CAPITOLO 1
Ippocampo e memoria. Aspetti fisiologici e funzionali
In questo capitolo si vuole cercare di fornire un quadro esauriente di tutte le unità che hanno un ruolo importante nella nostra simulazione del funzionamento dell’ippocampo, a partire dal neurone, elemento base nella trasmissione e nell’elaborazione dei segnali cerebrali, proseguendo con le strutture della corteccia, al cui vertice gerarchico sta proprio l’ippocampo, fino ad arrivare ai processi mentali più alti, quali l’apprendimento e la memoria. Questo compendio preliminare vuole essere di ausilio per la comprensione delle successive scelte nella modellizzazione, nella costruzione di un architettura neurale e nella sua implementazione software. La descrizione dei meccanismi biologici dell’apprendimento serve a rendere più immediato sia il parallelismo tra reale e simulato sia la loro netta distanza a causa delle inevitabili semplificazioni tendenti a ridurre la complessità del nostro cervello. L’anatomia altresì fornisce una sorta di giustificazione al nostro desiderio di assegnare nomi nobili ad oggetti che non sono altro che griglie di numeri.
1.1 Il neurone
I neuroni sono le cellule base elementari di cui è formato il cervello. Fra le specializzazioni più importanti del neurone vi sono la forma caratteristica della cellula, la membrana
esterna in grado di produrre impulsi nervosi, e una struttura peculiare, la sinapsi, per il trasferimento dell’informazione da un neurone al successivo.
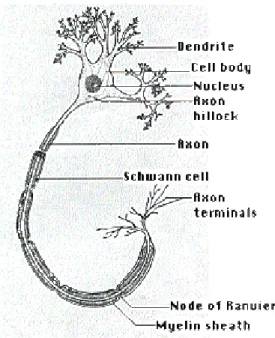
Figura 1.1: disegno schematico del neurone con le sue strutture principali.
Si calcola che il cervello umano sia formato da 11
10 neuroni, cifra confrontabile come ordine di grandezza con il numero di stelle della nostra galassia, e fra questi non se ne danno due che abbiano la stessa forma. Nonostante questo è possibile classificare i neuroni in un numero limitato di grosse categorie, e la maggior parte di essi ha in comune tratti strutturali peculiari che rendono possibile distinguere, nella cellula, tre regioni: il corpo cellulare, i dendriti e l’assone. Il corpo cellulare contiene il nucleo del neurone e il corredo biochimico necessario per la sintesi di enzimi e di altre molecole essenziali per la vita della cellula. I dendriti sono sottili arborizzazioni estese di forma tubolare che tendono a suddividersi più volte, formando così attorno al corpo cellulare una struttura ramificata che costituisce la principale struttura fisica per la ricezione di segnali in entrata. L’assone si
estende a notevole distanza dal corpo cellulare e rappresenta il percorso lungo il quale i segnali viaggiano dal corpo cellulare verso altre parti del cervello e del sistema nervoso. Mentre i rami dei dendriti tendono a raggrupparsi in prossimità del corpo cellulare, i rami degli assoni tendono a formarsi all’estremità della fibra, là dove l’assone entra in comunicazione con altri neuroni.
Il funzionamento del cervello dipende dal flusso di informazioni attraverso complessi circuiti di reti di neuroni. L’informazione viene trasferita da una cellula ad un’altra in punti di giunzione altamente specializzati: le sinapsi. Tipicamente un neurone può avere da 1000 a 10000 sinapsi e può ricevere informazioni da oltre un migliaio di neuroni. Nella maggior parte dei casi si ha la sinapsi tra l’assone di una cellula e un dendrite di un’altra, ma possono esistere anche sinapsi tra assone e assone, tra dendrite e dendrite e tra assone e corpo cellulare.
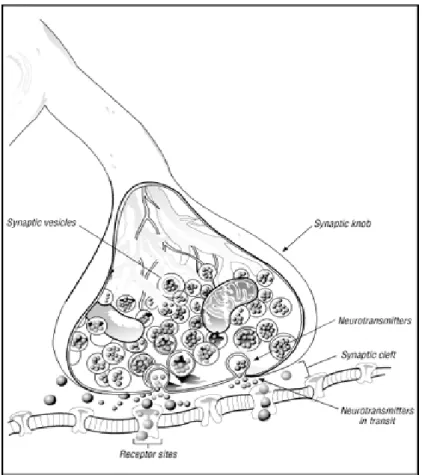
In prossimità della sinapsi l’assone si allarga a formare un bottone terminale, il bottone sinaptico, che è il luogo in cui viene fornita l’informazione. Il bottone sinaptico contiene minuscole strutture sferiche, chiamate vescicole sinaptiche, al cui interno sono contenute le molecole di neurotrasmettitore, una sorta di trasduttore di segnale da elettrico a chimico. Quando al bottone terminale arriva un impulso, alcune vescicole scaricano il loro contenuto nella cavità, denominata fessura sinaptica, che separa il neurone pre da quello post-sinaptico, a cui è destinato il messaggio chimico. L’informazione è quindi trasferita da un neurone ad un altro grazie ad un trasmettitore. La scarica, cioè la produzione di impulsi, riflette l’attivazione di centinaia di neuroni colpiti. Alcune sinapsi sono eccitatorie, in quanto favoriscono l’attivazione del neurone, mentre altre sono inibitorie, sono cioè capaci
di cancellare segnali che, se lasciati passare inalterati, solleciterebbero il neurone a produrre un nuovo impulso nervoso.
Figura 1.2 : disegno schematico della sinapsi. Si può notare la fusione delle vescicole con la membrana, il
rilascio di neurotrasmettitore da parte del neurone presinaptico e l’attivazione dei recettori nel neurone postsinaptico.
Tutti gli assoni sono ricoperti da un tipo di cellule, detto di Schwann, il cui compito è di formare strati densi e molteplici di isolante, noto come mielina. La guaina mielinica è interrotta circa ogni millimetro, lungo tutto l’assone, da strette discontinuità chiamate nodi di Ranvier (vedi fig. 1.1). Negli assoni rivestiti da questo strato di mielina l’impulso
viaggia saltando da nodo a nodo. In generale, le fibre mielinizzate conducono gli impulsi più velocemente delle fibre prive di rivestimento.
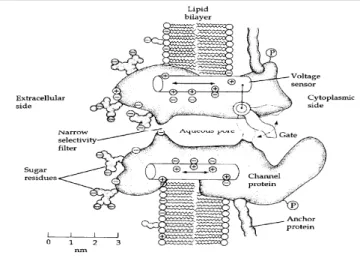
La trasmissione di segnali nervosi da parte dei neuroni è resa possibile dalle proprietà della loro membrana esterna, in quanto essa, lungo tutto l’assone, è specializzata nella propagazione di un impulso elettrico, inoltre, alla terminazione dell’assone, da essa fuoriescono dei neurotrasmettitori e sui dendriti risponde a tali neurotrasmettitori. La membrana ha uno spessore di qualche nanometro ed è formata da un doppio strato lipidico in cui le molecole sono disposte in modo che le loro estremità idrofile siano puntate verso l’acqua, sia dentro che fuori dalla cellula, e che le estremità idrofobe siano rivolte lontano dall’acqua, così da formare l’interno della membrana. Poiché il doppio strato lipidico non permette, da solo, il passaggio di molecole, la membrana ha elaborato un complesso sistema di proteine che forniscono una via preferenziale e selettiva attraverso cui possono diffondere specifici ioni. Le proteine della membrana possono essere classificate in cinque classi: pompe, canali, recettori, enzimi, proteine strutturali. Quelle che più ci interessano per il funzionamento del sistema neurone nel suo complesso sono le pompe, le quali spendono energia metabolica per spostare ioni e altre molecole in verso opposto ai loro gradienti di concentrazione, in modo tale da mantenere un dato valore di concentrazione di queste molecole all’interno della cellula. Le membrane cellulari debbono riconoscere e attirare vari tipi di molecole, per questo motivo esistono delle proteine recettrici in grado di fornire dei siti di legame con alta affinità.
Figura 1.3 : proteina canale inserita nel doppio strato lipidico della membrana
Il neurone è capace di mantenere, al proprio interno, un fluido che differisce notevolmente per composizione da quello esterno, specialmente per quanto riguarda la concentrazione degli ioni sodio e potassio, infatti il mezzo esterno ha una concentrazione 10 volte più grande di quello interno di ioni sodio e viceversa per gli ioni potassio. Sia il sodio che il potassio attraversano la membrana, quindi devono essere continuamente in funzione delle pompe che scambiano gli ioni sodio che tendono ad entrare nella cellula, secondo il loro gradiente di concentrazione, con gli ioni potassio presenti all’esterno. Questa funzione di scambio è svolta dalla pompa sodio-potassio. Ogni pompa può utilizzare l’energia di legame del fosfato nell’adenosintrifosfato (ATP) per scambiare tre ioni sodio intracellulari con due ioni potassio extracellulari. La velocità massima a cui può lavorare ciascuna pompa è di circa 200 ioni sodio e 100 ioni potassio al secondo, ma tali valori variano ovviamente in funzione delle necessità del neurone. Sono i gradienti degli ioni sodio e potassio, attraverso la membrana, che consentono al neurone di propagare gli impulsi nervosi. Poiché la concentrazione di Na+ e K+ su un lato della membrana cellulare è diversa da quella sull’altro, si instaura una differenza di potenziale, secondo la legge di
Nernst, tra i due lati, e se si prende l’esterno come riferimento, l’interno ha un potenziale di -70 mV.
Nei loro studi ormai classici sulla trasmissione del segnale nervoso nell’assone gigante del calamaro, nel 1953, Hodgkin e Huxley, hanno stabilito che la propagazione dell’impulso avviene grazie alle improvvise variazioni della permeabilità della membrana assonica all’Na+ e al K+. Quando un impulso, originato dal corpo cellulare in risposta a sinapsi dendritiche, si sviluppa lungo l’assone, localmente la differenza di potenziale attraverso la membrana diminuisce. Subito dopo la regione le cui caratteristiche di permeabilità si sono così modificate, nella direzione di propagazione dell’impulso, i canali si aprono e lasciano entrare Na+ nell’assone. Tale processo è autorinforzante: il flusso di Na+ attraverso la membrana apre nuovi canali e facilita il passaggio di altri ioni. Gli ioni Na+ entrati modificano la concentrazione interna e di conseguenza il potenziale, portandolo da negativo a positivo. Immediatamente dopo essersi aperti, i canali del sodio si chiudono e si apre un altro gruppo di canali che permettono l’ingresso degli ioni potassio, il cui risultato è di riportare il potenziale al valore di riposo di partenza di -70 mV.
Tale variazione di potenziale che si presenta come uno “spike” prende il nome di potenziale d’azione ed è la manifestazione elettrica di un impulso nervoso.
I canali risultano permeabili selettivamente e tale selettività ha ampi margini di variabilità. Ad esempio, un canale può lasciare passare gli ioni sodio mentre ferma quelli potassio, ma esistono canali che presentano comportamento inverso, anche se raramente la selettività è totale. Tipicamente un canale poco selettivo lascia passare all’incirca 85 ioni sodio su 100 potassio e uno più selettivo 7 su 100. La proprietà di “gate” che comanda l’apertura e la chiusura dei canali ha due forme principali: elettrica e chimica. Ci sono infatti canali che rispondono a differenze di potenziale attraverso la membrana ed altri affatto sensibili a variazioni elettriche che sono attivati quando una particolare molecola, trasmettitore, si lega ad una regione recettrice sulla superficie del canale. Si chiamano, rispettivamente, canali con porta a potenziale e chimica. Questi ultimi si trovano sulle membrane recettrici delle sinapsi e ad essi si deve la traduzione dei segnali chimici prodotti dalle terminazioni assoniche in variazione di permeabilità ionica nel corso della trasmissione sinaptica. I canali a porta chimica prendono il nome del trasmettitore a cui sono sensibili, così si parla di canali attivati dall’acetilcolina o dal GABA(acido gamma-amminobutirrico).
Quando i canali, con porta a potenziale o chimica, si aprono e lasciano entrare o uscire gli ioni, si può misurare la corrente elettrica connessa a tale flusso. In alcuni casi è possibile valutare la corrente che scorre in un singolo canale in modo da rilevare direttamente lo stato di tale canale. L’intervallo di tempo in cui un canale rimane attivo varia in modo casuale, dipendendo dalla modificazione nella conformazione della molecola proteica immersa nella membrana, che è a sua volta un processo casuale.
Visto che nella nostra modellizzazione del neurone gli elementi principali saranno le conduttanze della membrana ai vari ioni, quindi le proprietà intrinseche dei canali, e il modo in cui influenzano il potenziale che si propaga lungo l’assone, dedichiamo adesso la nostra attenzione ai processi molecolari che governano l’innesco e la propagazione di tale potenziale. Abbiamo visto che l’interno del neurone è a potenziale negativo rispetto all’esterno e la differenza è di -70 mV. Questo valore di riposo è dovuto allo squilibrio ionico generato dalla pompa del sodio e dalla presenza nella membrana cellulare di canali selettivi al potassio sempre aperti. La pompa fa uscire Na+ in cambio di K+ e porta la concentrazione interna di K+ ad un valore 10 volte maggiore di quella esterna. I canali del potassio permettono agli ioni K+ immediatamente a ridosso della membrana di fuoriuscire abbastanza liberamente. A riposo la permeabilità all’ Na+ è bassa e quindi non esiste un controflusso di Na+ dall’esterno all’interno, anche se, essendo la concentrazione esterna 10 volte maggiore di quella interna, dovrebbe essere il suo verso naturale. In questo modo, il flusso di potassio determina da un lato un deficit netto di carica positiva sulla parete interna della membrana e dall’altro un eccesso di carica positiva esternamente. Il risultato è la differenza di potenziale di 70 mV.
Passiamo ora ad esaminare il ruolo dei canali del sodio con porta a potenziale nella propagazione del potenziale d’azione. Questi canali hanno molti gruppi carichi in punti critici sulla loro superficie, che danno al canale un forte momento di dipolo elettrico variabile in modulo e verso a seconda che la conformazione molecolare passi da una condizione di apertura ad una di chiusura. Possiamo pensare alle due superfici della membrana cellulare come alle facce di un condensatore piano in cui il dielettrico intermedio è costituito dal doppio strato lipidico. Dato che lo spessore della membrana è
circa 10 nm, la differenza di potenziale di 70 mV in condizioni di riposo( ricordando che il campo è dato dall’ espressione E=V/d) dà luogo ad un campo elettrico molto intenso, dell’ordine dei 100 kV/cm, nella direzione del quale tendono ad allinearsi i dipoli elettrici presenti nella proteina canale del sodio. Le variazioni del modulo del campo della membrana pilotano il passaggio del canale dalla configurazione di chiusura a quella di apertura e quando il potenziale della superficie interna aumenta, in risposta ai primi Na+ che passano, i canali del sodio tendono a rimanere per la maggior parte nella conformazione aperta, ossia vengono attivati. Il processo termina con l’inattivazione dei canali del sodio da parte del potenziale transmembrana, che li porta in uno stato di chiusura diverso da quello caratteristico di riposo. Si procede verso la configurazione inattiva ad una velocità molto inferiore rispetto a quella attiva, con il risultato che i canali restano aperti per un periodo molto breve a fronte dei qualche millisecondi in cui restano chiusi, per poi tornare nello stato di riposo. Un ciclo completo di attivazione e inattivazione comporta il coinvolgimento di migliaia di canali di sodio e la descrizione dettagliata di questo processo viene effettuata in termini statistici, legando le fluttuazioni della permeabilità della membrana con le variazioni conformazionali delle proteine canale. Tramite stimolazione esterna con microelettrodi, si possono innescare ripetute aperture di canali e calcolare la permeabilità media istantanea e la permeabilità esatta associate ad ogni tentativo, con il risultato che la permeabilità esatta ha delle fluttuazioni del 10% intorno ad un valore medio. L’analisi di queste fluttuazioni mostra che i canali di sodio si comportano secondo il principio del tutto o niente.
Mentre gli assoni hanno anche canali del potassio con porta a potenziale che influiscono sul termine della trasmissione dell’impulso nervoso, lasciando uscire gli ioni K+ a
bilanciare il flusso entrante di Na+, i neuroni presentano una situazione molto più complessa, poiché la loro porzione di membrana è attraversata da cinque tipi di canali, ognuno dei quali ha velocità diversa, rimane attivo per un tempo diverso ed è permeabile a specie ioniche diverse( sodio, potassio o calcio). La presenza di questi cinque tipi di canale nel corpo cellulare rende, rispetto all’assone, la genesi e la trasmissione del potenziale d’azione estremamente più complessa. Ad esempio, se all’assone viene presentato uno stimolo di ampiezza costante, esso produce un unico impulso risposta in corrispondenza dell’inizio dello stimolo. Nella stessa situazione di eccitazione, i corpi cellulari producono un treno di impulsi la cui frequenza è proporzionale all’intensità dello stimolo. I neuroni possono produrre impulsi nel range di frequenza compreso tra 1 Hz e 100 Hz, tutti con la stessa ampiezza di modo che l’informazione ad essi associata è codificata dal numero di impulsi nell’unità di tempo, ossia è modulata in frequenza.
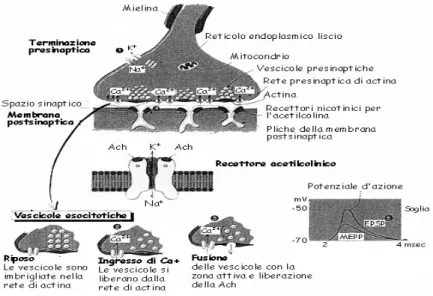
Abbiamo visto che il potenziale d’azione viene generato nel corpo cellulare e si propaga, come la scintilla lungo la miccia, attraverso l’assone. Una volta che l’impulso ha raggiunto il bottone presinaptico, la membrana libera per esocitosi nel vallo sinaptico delle vescicole contenenti neurotrasmettitore (acetilcolina), il quale diffonde fino alla membrana postsinaptica, dove induce l’apertura di canali con porta chimica. Gli ioni che entrano dai canali attivati dal neurotrasmettitore inducono un potenziale detto postsinaptico. La fusione delle vescicole con la membrana è innescata da un aumento transitorio della concentrazione di calcio nella terminazione presinaptica. Infatti l’arrivo dello spike apre i canali del calcio, che hanno gate a potenziale, permettendo agli ioni Ca2+di passare dal liquido extracellulare nel bottone presinaptico e facendo aumentare la concentrazione interna di calcio. Questo picco di concentrazione, di durata molto breve, in quanto esiste un
sistema che provvede a catturare il calcio in eccesso per riportarlo al livello d’equilibrio, porta all’esocitosi delle vescicole contenenti l’acetilcolina. In meno di 100 µsec l’acetilcolina rilasciata dalle vescicole diffonde nel setto sinaptico e va a legarsi al proprio recettore, che è una complessa proteina intrinseca immersa nella membrana postsinaptica. Una volta che la molecola di acetilcolina si è legata nel sito del recettore, si abbassa l’energia nella configurazione aperta del canale e in tal modo aumenta la probabilità che esso si apra.
Figura 1.5 : schema riassuntivo del funzionamento della sinapsi e del suo ruolo nella genesi dei PSP.
Durante l’intervallo di tempo, di circa 1 msec, in cui il canale è aperto, passano circa 20000 ioni Na+ e altrettanti K+ a generare un flusso di carica che tende ad annullare la differenza di potenziale tra le due facce della membrana. Il valore risultante dipende da quanti sono i canali attivi e per quanto tempo restano aperti. Normalmente, l’acetilcolina liberata da un impulso nella terminazione presinaptica produce dei potenziali postsinaptici, di durata circa 5 msec, e poiché l’innesco è dovuto più all’intervento di canali a porta chimica che non di quelli comandati da potenziale, tali potenziali hanno proprietà
abbastanza diverse dal potenziale d’azione. In generale possiamo rilevare che essi hanno ampiezza minore, durata maggiore e dimensioni dipendenti dalla quantità di trasmettitore liberato, quindi, in ultima analisi, dal numero di canali attivi. Anche i canali con porta chimica differiscono per la loro capacità di scelta, alcuni lasciando passare gli ioni Na+ e K+ con poca selettività, altri essendo altamente specializzati nel far passare una sola specie ionica. La variazione di potenziale in una data sinapsi dipende proprio dalla selettività dei canali aperti. Se i cationi vanno verso la cellula, la variazione di potenziale è positiva e tende ad aprire i canali con gate a potenziale generando l’impulso: questo è detto potenziale postsinaptico eccitatorio ( EPSP, Excitatory Post Synaptic Potential). Se i cationi, solitamente quelli sodio, migrano fuori dalla cellula, la variazione di potenziale è di segno opposto e quindi tende a chiudere i canali, generando dei potenziali che si oppongono alla nascita di nuovi potenziali: si parla in questo caso di potenziali postsinaptici inibitori ( IPSP, Inhibitory Post Synaptic Potential).
Prima abbiamo accennato al fatto che l’informazione venga codificata e trasmessa modulata in frequenza. Adesso vediamo come la sinapsi decodifichi tale informazione grazie a due processi concomitanti di integrazione temporale e spaziale. Nell’integrazione temporale ogni PSP si somma al totale accumulato dai precedenti, per dare una variazione di potenziale la cui ampiezza media riflette la frequenza degli impulsi in ingresso. Infatti, ad esempio, un neurone che sta trasmettendo impulsi ad alta frequenza libera dal bottone presinaptico una quantità di neurotrasmettitore molto maggiore di quella che produrrebbe se stesse trasmettendo a bassa frequenza. Più grande è il numero di molecole di neurotrasmettitore liberato in un determinato intervallo di tempo più canali si aprono nella membrana postsinaptica, quindi più ampio sarà il PSP. L’integrazione spaziale è un
processo equivalente a quello temporale da cui differisce per il fatto che somma gli impulsi in arrivo da tutti i possibili neuroni che formano sinapsi con il neurone in questione.
1.2 L’ippocampo. Circuiti neurali intrinseci e connessioni
Dopo aver visto il funzionamento del singolo neurone, mattone costitutivo di fondamentale importanza per il nostro cervello, esaminiamo la struttura ippocampale, fulcro primario del nostro lavoro.
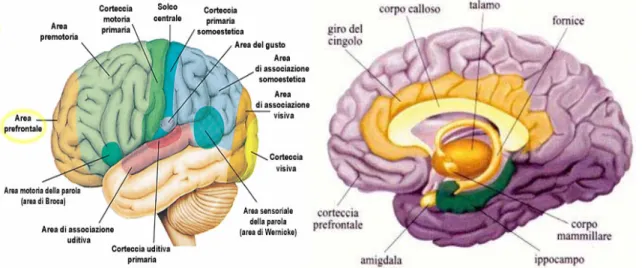
Figura 1.6 : rappresentazioni del cervello umano.
La corteccia cerebrale dell’uomo, e di tutti i mammiferi, può essere divisa in molti distretti. Alla base degli emisferi sporge in avanti una struttura composta esclusivamente da corteccia, sebbene abbia un’architettura cellulare primitiva. Il rigonfiamento anteriore è il bulbo olfattivo mentre il gambo pronunciato è il peduncolo olfattivo. Un secondo grande distretto si trova presso il margine libero della corteccia stessa, dove il mantello corticale si ripiega per dar luogo ad una circonvoluzione: questa strana formazione è l’ippocampo. La parte restante della corteccia, che ha un’estensione molto vasta e una complessità notevole,
è la neocorteccia, in cui vi sono non meno del 70% di tutti i nostri neuroni ed è l’ultima parte di corteccia comparsa nel corso dell’evoluzione. Alla fine dello stadio dei rettili un filone evolutivo si modellò sullo schema dei rettili e ne derivarono gli uccelli, mentre un’altro, che potremmo definire più rivoluzionario, sviluppò la neocorteccia, e prese vita la storia di mammiferi. In una prospettiva filogenetica, quindi, gli uccelli rappresentano il punto di arrivo evolutivamente logico dello sviluppo cerebrale, mentre i mammiferi sono dei devianti, visto che non annoverano gli uccelli tra i loro antenati. Nella profondità degli emisferi cerebrali, situata sotto la corteccia olfattiva, vi è l’amigdala, che insieme all’ippocampo forma il sistema limbico, che è l’attore principale nella regolazione delle emozioni e nell’immagazzinamento dei ricordi.
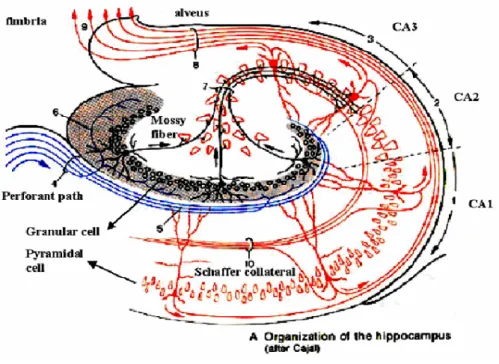
L’ippocampo è un’organizzazione nervosa relativamente semplice, costituita da due tipi principali di cellule stratificate, con una configurazione laminare di afferenze ed efferenze ad alto livello di specializzazione. Ha una struttura che si sviluppa in lunghezza dal setto al lobo temporale e all’interno ha un’organizzazione che si ripete similmente in ogni sua parte. Ci sono due classi maggioritarie di neuroni: le cellule piramidali e granulari. Le cellule piramidale costituiscono le principali vie efferenti, le più grandi delle quali, uscendo dall’ilo dentato attraverso la curvatura laterale dell’ippocampo, sono convogliate nella regione CA3, che costituisce la parte inferiore dell’ippocampo; le cellule piramidali più piccole, che partono dalla parte inferiore e arrivano alla zona mediana, sono nella regione CA1, o regione superiore. I neuroni piramidali delle zone CA1 e CA3 sono disposte in un unico strato che parte lateralmente dalla linea mediana e si incunea con un’ansa tra le lame dorsali e ventrali del giro dentato o regione DG( dentate gyrus). Il giro dentato contiene i neuroni granulari, con connessioni intrinseche, che sono cellule
unipolari con dendriti immersi nello strato molecolare della zona DG stessa e gli assoni che entrano nella regione CA3.
Figura 1.7 : disegno stilizzato dell’ippocampo.
L’ippocampo è in grado di comunicare con il resto del cervello grazie alla corteccia entorinale ( EC, entorhinal cortex), che è la primaria strada di interfaccia ingresso/uscita, e al subiculum, che ha un ruolo simile alla corteccia entorinale, privilegiando però le rappresentazioni subcorticali e motorie. Dalla EC ci sono proiezioni ampie e diffuse verso la regione CA3 e specialmente, attraverso un collegamento detto via perforante ( perforant path), in cui è presente il maggior numero di afferenze che vanno sulle cellule granulari, verso la regione DG. Alla regione CA3 arrivano anche le proiezioni sparse e focalizzate, quasi topologiche, dalla zona DG tramite la strada preferenziale costituita dalle fibre muscoidi (mossy fiber). Le cellule piramidali della CA3 a loro volta proiettano fuori
dall’ippocampo e mandano anche un assone collaterale, detto collaterale Schaffer, nella regione CA1, formando connessioni diffuse tra ampie porzioni delle due zone. Gli assoni della zona CA1 proiettano principalmente nella regione corticale soprastante, il subiculum appunto, e la loro interconnettività è quasi uno a uno.
Le afferenze ai dendriti delle cellule granulari del giro dentato sono organizzate in configurazione laminare. Le fibre della corteccia entorinale terminano sui due terzi esterni dei dendriti delle cellule granulari, mentre le fibre dell’ippocampo terminano sotto le fibre entorinali, vicino al corpo delle cellule granulari. Infine, le afferenze settali terminano quasi esclusivamente sulla parte più prossimale dei dendriti e l’ingresso proveniente da queste stesse fonti, ma non necessariamente dalle stesse cellule, raggiunge direttamente le cellule piramidali, dove presenta la stessa distribuzione spaziale di dendriti.
1.3 Proprietà intrinseche dei neuroni e delle sinapsi nell’ippocampo
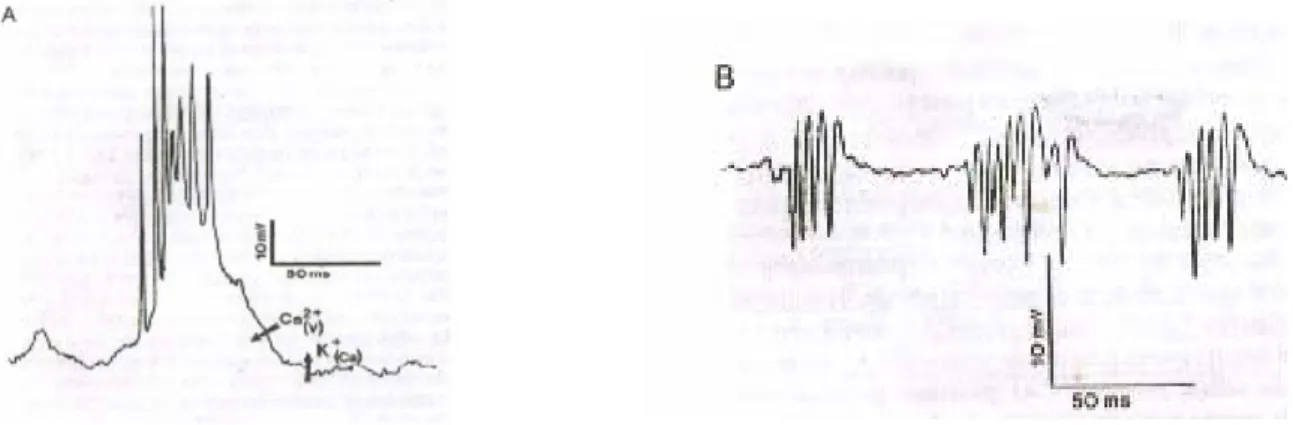
Le cellule piramidali della regione CA3 scaricano spontaneamente burst di potenziali d’azione dipendenti da sodio e calcio in ragione di ampie depolarizzazioni causate dalla conduttanza dei canali del calcio lenta e voltaggio-sensibile.
Figura 1.8 : burst nelle cellule piramidali CA3.( A) : burst spontaneo in cellule normali. (B) : tre burst in
Questi burst si interrompono quando la conduttanza al potassio in uscita, calcio-dipendente, viene attivata dall’aumento di Ca2+ intracellulare. La conduttanza al potassio è fondamentale perché il neurone possa ripolarizzarsi, poiché la conduttanza al Ca2+ si disattiva molto più lentamente dell’altra, tendendo a mantenere la cellula nel suo stato di depolarizzazione. Normalmente, i burst in diversi neuroni CA3 non sono sincronizzati e se in queste condizioni si va a misurare l’attività multineuronale di più cellule CA3, si vede che i potenziali asincroni non portano alla somma degli spike. Al contrario, quando le affferenze ippocampali stimolano elettricamente le cellule CA3 e le inducono a scaricare in modo sincrono, i potenziali d’azione delle cellule CA3 adiacenti si sommano con una sorta d’integrazione spaziale fino a produrre gruppi di spike chiari e distinti (vedi fig. 1.8). Gruppi di burst sincroni possono anche essere dovuti ad un blocco dell’inibizione prodotta dagli interneuroni al quale segue un attività epilettiforme in conseguenza proprio della predilezione da parte delle cellule CA3 normali per le scariche a gruppi. Questa attività a burst può essere generata dalla presenza nei neuroni piramidali dell’ippocampo di una conduttanza transiente al calcio con soglia di attivazione molto bassa, che viene attivata dall’iperpolarizzazione e disattivata in prossimità del valore di riposo del potenziale. Quando è attiva, anche le piccole depolarizzazioni successive, che hanno il compito di aprire i canali del calcio, possono generare burst sincroni, con il risultato quantomeno strano che l’inibizione iperpolarizzante può provocare in questi specifici neuroni un’attività di burst. Le altre conduttanze ioniche delle cellule piramidali dell’ippocampo hanno un ruolo regolatore per determinare gli intervalli temporali tra spike successivi o tra gruppi di spike e così controllano l’eccitabilità e la refrattarietà delle cellule.
Un’altra particolarità dell’ippocampo è, come suggeriscono le caratteristiche delle sinapsi afferenti, che i suoi ingressi sono molto potenti. Innanzitutto, il circuito di ritorno( feed-through circuit) dalla corteccia entorinale alle cellule granulari del giro dentato, alla regione CA3 e quindi CA1 è del tutto eccitatorio. In secondo luogo, quasi tutte le le sinapsi afferenti sono formate su assoni di collegamento, ossia un singolo assone forma sinapsi con molte cellule bersaglio( EPSPA). Infine, le cellule piramidali sono elettricamente compatte, con un lunghezza elettrotonica media pari a 1. Come risultato complessivo di queste caratteristiche si ha che pure le sinapsi molto distanti risultano efficienti nell’attivare i neuroni ed una percentuale di afferenze sopra soglia molto esigua, anche del 3-5%, può provocare la scarica di una cellula piramidale CA3. Nonostante l’efficacia del segnale d’ingresso eccitatorio e delle conduttanze depolarizzanti, la frequenza spontanea di scarica dei neuroni è bassa perché ogni evento eccitatorio che si presenta alla sinapsi è concomitante con un lungo e potente IPSP che lo riduce drasticamente e permette alla cellula piramidale di scaricare un solo potenziale d’azione. L’IPSP è il risultato di un’inibizione ricorrente che una cellula piramidale produce su un neurone inibitorio adiacente col suo passaggio allo stato eccitatorio (EPSPR). Il neurone inibitorio si collega sinapticamente alle cellule piramidali ( IPSP C) dove libera il GABA per produrre un consistente aumento della conduttanza al cloro, da cui scaturisce la componente d’innesco dell’IPSP e, essendo diminuita la resistenza di membrana agli altri ingressi, porta al cortocircuito per le altre correnti ioniche. Le terminazioni inibitorie e i rispettivi recettori sono posti opportunamente sul soma, sul segmento iniziale e sulle ramificazioni prossimali dei dendriti primari della cellula piramidale, dove il cortocircuito dovrebbe essere più efficace. Infine, il GABA produce separatamente un’apertura ritardata dei canali del
potassio contribuendo ad una componente di IPSP durevole nel tempo. Questi due fenomeni indotti dal neurotrasmettitore acido gamma-amminobutirrico, nel loro effetto complessivo, fanno si che l’inibizione ricorrente renda l’eccitazione autolimitante. Molti interneuroni non hanno bisogno di essere attivati dall’inizio dalle cellule piramidali, visto che ricevono segnali eccitatori direttamente dalle fibre efferenti. Questo circuito feed-forward inibitorio a connessioni in avanti viene attivato da stimoli con livello di soglia più basso e sembra molto più potente dell’inibizione in retroazione o feed-back. L’inibizione dell’ippocampo può essere di due tipi, feed-forward o feed-back, può essere mediata sia a livello somatico che dendritico, ha disposizione molti recettori postsinaptici e può essere mediata da diverse conduttanze ioniche.
1.4 Potenziali di campo e scarica sincrona
L’elettroencefalogramma di superficie (EEG) è una tecnica di indagine medica non invasiva per la valutazione delle funzioni cerebrali effettuata ponendo sulla cute della testa degli elettrodi che rilevano variazioni di potenziale elettrico dovute all’attività dei neuroni corticali. Normalmente, l’EEG registra, grazie ai numerosi elettrodi posti bilateralmente sui quattro lobi cerebrali, il potenziale dopo che ha attraversato le meningi, il cranio e il cuoio capelluto. L’EEG riflette per lo più l’attività sincrona integrata delle cellule piramidali corticali sottostanti l’elettrodo attivo e di conseguenza il potenziale ha generalmente bassa frequenza (fino a qualche decina di Hz) e bassa ampiezza (10-100
µV). I potenziali EEG possono essere rilevati oltre che superficialmente anche da strutture corticali profonde con un elettrodo relativamente grande inserito nel cervello e i segnali
filtrati per eliminare le componenti di rumore costituite dai potenziali d’azione dei singoli neuroni. In questo modo si riesce a registrare un EEG ippocampale per lo studio delle funzioni limbiche. Tale tracciato è caratterizzato da una configurazione irregolare o da un andamento sinusoidale, lento e regolare, noto come ritmo theta. Come il ritmo theta superficiale, il ritmo theta limbico ha una frequenza da 4 a 10 Hz , ma un’ampiezza molto più grande, ed è prodotto da burst sincronizzati di attività neurale, che si verificano nei momenti in cui l’EEG superficiale viene traslata in alta frequenza. Il ritmo theta limbico è correlato con comportamenti in cui l’individuo che li compie è attivo e motivato, come ad esempio alzarsi, nuotare, saltare, seguire segnali luminosi con il movimento della testa. I potenziali ippocampali, essendo insolitamente grandi, forniscono un modello molto utile e chiaro per comprendere il modo in cui vengono generati i potenziali stessi. Infatti, i corpi cellulari sono allineati, con l’asse somato-dendritico di ogni cellula disposto parallelamente a quello delle cellule adiacenti; per come sono disposte le fibre afferenti con sinapsi en
passant con ogni cellula piramidale, ogni ingresso eccita inevitabilmente un numero molto
grande di neuroni; lo spazio extracellulare attorno alle cellule ippocampali è piccolo e ciò aumenta la resistenza extracellulare, determinando un aumento della caduta di potenziale in tale spazio. Quando un EPSP è prodotto su un dendrite, la corrente passa dallo spazio extracellulare a quello intracellulare, con la convezione per la direzione del flusso di corrente concorde con la carica positiva, instaurando un circuito ionico fino al momento in cui si genera il potenziale stesso. Il neurone diventa un dipolo con una carica positiva principalmente all’estremità dendritica, dove si genera l’EPSP, e una carica negativa sul soma. Il flusso della corrente ionica attraverso la resistenza equivalente che modellizza lo spazio extracellulare produce una caduta di tensione che può essere rilevata con
microelettrodi e rispecchia l’andamento di carica del dipolo neuronale. Poiché la resistenza extracellulare è molto piccola, a confronto con quella di membrana, la differenza di potenziale causata da queste correnti è dell’ordine dei µV. Si pensa che i potenziali come il ritmo theta limbico siano generati da un’attivazione sincronizzata delle afferenze verso un gruppo di cellule, tali che tutti i PSP abbiano luogo nello stesso tempo. L’attività sincronizzata può essere generata da stimoli naturali brevi come flash di luce o click sonori. Si vede che i neuroni della regione CA3 rispondono ugualmente bene alla presentazione ripetuta di stimoli uditivi, visivi, tattili e olfattivi, senza che la loro risposta ad un tipo rispetto agli altri sia alterata in modo significativo. Da questo tipo di indagine, si è concluso che i neuroni CA3 rispondono alle novità piuttosto che agli aspetti qualitativi di uno stimolo e che i neuroni CA1 rispondono spesso ad una sola modalità sensoriale e alle caratteristiche complesse di questo stimolo, e quindi la loro scarica non è determinata solo dal loro ingresso CA3 ma anche da quello corticale.
1.5 Apprendimento e memoria
L’apprendimento è il processo grazie al quale l’uomo e gli esseri appartenenti alle altre specie animali acquisiscono la conoscenza dell’ambiente in cui sono immersi, mentre la memoria è la capacità essenziale di serbare queste conoscenze. Fino agli anni ’50 la maggior parte degli studiosi che si occupava di apprendimento pensava che la memoria non potesse essere localizzata in specifiche regioni del cervello; di contro la convinzione che l’immagazzinamento di tracce di passato fosse un processo diffuso a tutto il cervello collideva con l’idea, allora agli albori, della localizzazione delle funzioni cerebrali. Fino ad allora si credeva che la memoria fosse una proprietà generale della corteccia, mentre studi
recenti dimostrano che le regioni cerebrali in gioco sono molteplici, che esistono diversi tipi di memoria, ognuno dei quali ha bisogno di specifiche regioni, e che tipi diversi di memoria sono immagazzinati in sistemi neurali diversi. Come tutte le scoperte riguardanti le funzionalità cerebrali associate a facoltà superiori, anche quelle sul modo di apprendere sono dovute ad indagini condotte su pazienti con lesioni, nello specifico ai lobi parietali, da cui i neuropsicologi cognitivi hanno potuto dedurre l’esistenza di due tipi di memoria. L’uomo impara che cosa significa una parola, impara a conoscere persone, luoghi ed oggetti che hanno accesso alla nostra coscienza, e per far questo usa una forma di memoria che generalmente viene indicata memoria esplicita. D’altro canto impariamo anche come fare le cose, cioè acquisiamo abilità motorie o percettive che non hanno accesso alla coscienza usando un altro tipo di memoria detta implicita.
1.5.1 La memoria esplicita
La memoria esplicita codifica l’informazione che è associata ad eventi autobiografici e a conoscenze relative ad avvenimenti passati; la sua formazione dipende da processi cognitivi come valutazione, paragone, inferenza. Le tracce di memoria esplicita possono essere attivate mediante un atto volontario di richiamo alla mente, talvolta si stabiliscono nel corso di un’unica esperienza e possono essere espresse con frasi coincise di tipo dichiarativo. Da osservazioni su soggetti affetti da amnesia, si è arrivati ad ipotizzare che le conoscenze autobiografiche e quelle inerenti semplicemente i fatti sono mediate da meccanismi diversi che risiedono nel lobo temporale. L’ippocampo, invece, sembra essere un deposito temporaneo per la memoria a lungo termine, trasferendo le informazioni apprese ad altre aree, presumibilmente alla corteccia cerebrale, dove vengono trattenute permanentemente. Ad esempio, le informazioni sensoriali necessarie per il riconoscimento
di un volto subiscono una prima elaborazione nelle aree visive della corteccia implicate nel processo di estrazione delle caratteristiche rilevanti di un volto e contemporaneamente nella corteccia entorinale, che le invia, come abbiamo visto in precedenza, all’ippocampo tramite la via perforante. Si ritiene che l’ippocampo e la porzione del lobo temporale con questo in relazione elaborino le informazioni appena apprese, le tengano per un lasso di tempo che può andare da qualche settimana ad alcuni mesi e poi le trasferiscano alla corteccia cerebrale. Esiste anche un’altra ipotesi, alternativa alla precedente, secondo cui l’ippocampo non partecipa all’immagazzinamento a lungo termine, ma facilita l’immagazzinamento delle informazioni precedentemente elaborate dalla corteccia inferotemporale. Secondo queste due visioni, l’ippocampo potrebbe essere o una via di transito per la memoria a lungo termine o un sistema atto a facilitare l’ immagazzinamento in altre aree cerebrali.
1.5.2 La memoria implicita
La memoria implicita ha alla sua base delle proprietà automatiche o riflessive e la sua formazione e il modo con cui richiama ciò che ha immagazzinato non dipendono da un’attenzione cosciente da parte dell’individuo. Questo tipo di memoria si forma lentamente per ripetute prove successive, si palesa soprattutto con l’affinamento delle prestazioni e di solito non è esprimibile a parole da parte dell’individuo. Esempi di memoria implicita si hanno nell’apprendere abilità percettive e motorie, nella familiarità che si acquisisce verso alcune tecniche e regole, come quelle grammaticali. Un altro esempio di apprendimento riflessivo è quello verbale, fondato sulla ripetizione, come la memorizzazione della declinazione dei sostantivi nella lingua latina. Il richiamo delle
informazioni apprese grazie a questo tipo di memoria è automatico ed avviene senza nessuno sforzo intenzionale.
Attualmente si pensa che la memoria implicita relativa a particolari compiti sia collegata con l’attività dei sistemi sensoriali e motori coinvolti con l’apprendimento del compito in questione e venga conservata tramite meccanismi inerenti ciascuno dei sistemi in questione.
1.5.3 Relazioni tra memoria esplicita ed implicita nell’apprendimento
Per capire come possono essere collegate tra loro le due forme di memoria è opportuno ricorrere all’esempio di un esperimento. Un individuo deve mettere la mano con il palmo rivolto verso il basso sulla resistenza di un fornello elettrico. La persona riceve uno shock elettrico su un dito poco dopo che si è accesa una luce (stimolo condizionato). Il dito si ritrae immediatamente (riflesso incondizionato) e dopo qualche prova di condizionamento luce-shock l’individuo ritrae il dito non appena si accende la luce. Sembra che la presentazione dello stimolo luminoso sia capace di far innescare una specifica sequenza di contrazioni muscolari che hanno come risultato di far ritrarre il dito. Il passo successivo è chiedersi cosa succederebbe se il soggetto mettesse sulla resistenza la mano con il palmo rivolto verso l’alto, cioè al contrario di prima, e venisse, in questa nuova situazione, presentata la luce di avvertimento. Se fosse stata condizionata una specifica successione di atti muscolari, la luce dovrebbe ingenerare una risposta tendente a far avvicinare il dito alla resistenza. Se il soggetto avesse acquisito il significato del nesso tra luce e shock elettrico tenderebbe a ritrarre la mano. E nella realtà, facendo questo tipo di esperimento, il soggetto muove la mano allontanandola dalla fonte di potenziale dolore, cioè la risposta diventa adattativa nonostante comporti una serie di sequenze motorie contrarie a quelle di partenza.
L’individuo non impara solo un tipo di risposta fissa e rigida ad un dato stimolo, ma riesce a reperire tutta una serie di informazioni che il sistema nervoso potrà usare per ricostruire la risposta corretta anche in un contesto comportamentale nuovo. Dal precedente esempio, è chiaro che alcune esperienze hanno componenti di apprendimento sia implicito che esplicito. Tutto sfuma gradualmente e con ripetizioni successive la memoria esplicita può trasformarsi in implicita.
1.6 Basi neurali della memoria
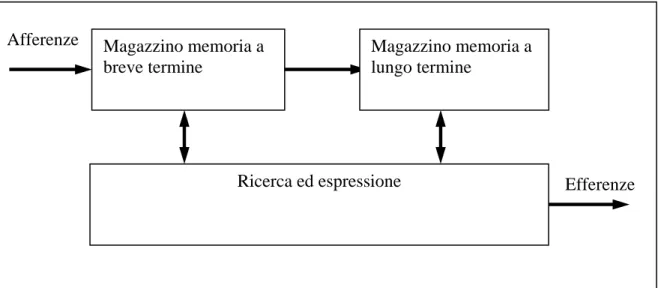
Gli studi sulla memoria, soprattutto quelli clinici sulle amnesie, hanno condotto ad un modello di memoria organizzato a stadi nel quale le informazioni in entrata vengono dapprima elaborate in un magazzino di memoria a breve termine.
Figura 1.9 : modello semplificato dei processi in un task di apprendimento derivato dall’osservazione del
decadimento temporale delle tracce di memoria.
Tale magazzino ha una capienza limita, al massimo una dozzina di tracce, e se l’informazione non viene rinfrescata, dopo qualche minuto decade. La traccia mnemonica
Afferenze Efferenze Magazzino memoria a breve termine Magazzino memoria a lungo termine Ricerca ed espressione
presente in questo primo contenitore viene portata, attraverso qualche altro processo, in un magazzino di memoria a lungo termine, dove diventa persistente e consistente. In una prospettiva coerente con questo modello, le tracce di memoria possono venir perse o a causa della distruzione di una parte del contenuto informativo del magazzino o per l’interferenza con il meccanismo antagonista della ricerca e del recupero, visto che a seguito di traumi, a volte, si può verificare perdita temporanea di memoria che, comunque, può essere quasi del tutto ripristinata. Se le tracce fossero andate completamente perdute non avrebbero potuto essere recuperate in alcun modo. Si è visto anche che la memoria a breve termine è suscettibile di alterazione fino a quando non è consolidata in memoria a lungo termine, e da questo momento in poi è relativamente stabile, anche se col tempo, pur in assenza di eventi traumatici, si ha una perdita graduale sia delle tracce di memoria sia della capacità di recuperarle. In definitiva, i processi che sottendono la memoria, nella loro completezza e precisione, sono soggetti a continue alterazioni in funzione del tempo.
1.7 Memoria esplicita e potenziamento a lungo termine nell’ippocampo
Come visto in precedenza, l’ippocampo ha un ruolo fondamentale nell’immagazzinamento della memoria esplicita e affinché tale proprietà possa stabilirsi devono intervenire delle modificazioni plastiche sui neuroni delle regioni ippocampali. Se si applicano stimoli di breve durata e ad alta frequenza alle tre vie afferenti che dalla corteccia entorinale portano alla zona CA1, cioè il fascio perforante, le fibre muscoidi e i collaterali di Schaffer, si manifesta un aumento, che può persistere da alcune ore a qualche giorno ed è specifico per ogni canale afferente, dell’ampiezza degli EPSP dell’ippocampo. Tale facilitazione è nota come potenziamento a lungo termine (LTP).
L’LTP può essere determinato nei collaterali di Schaffer che collegano i neuroni piramidali della regione CA3 con quelli della CA1 applicando stimoli intensi capaci di attivare un discreto numero di fibre afferenti, dando origine ad un’attività cooperativa. Quando in un’area dendritica arrivano molte afferenze eccitatorie, alcune delle quali portano stimoli forti e altre deboli, quelle deboli vengono potenziate solo se il loro arrivo è contemporaneo a quelle forti, svolgendo queste ultime un ruolo di trigger. L’LTP, inoltre, è strettamente specifico, ossia coinvolge solo quelle sinapsi attivate dallo stimolo e, per uno stesso neurone, uno stimolo a livello apicale non ha influenza su sinapsi a livello basale e viceversa. Le caratteristiche di cooperazione, associatività e specificità dell’LTP nella regione CA1 sono subordinate al fatto che la terminazione postsinaptica sia adeguatamente depolarizzata unendo o un treno di impulsi di piccola ampiezza o un solo stimolo, che da solo non sarebbe in grado di generare il potenziamento, con un treno di impulsi di corrente depolarizzante iniettati nel bottone postsinaptico.
Figura 1.10 : schematizzazione dell’LTP nella zona CA1. Nella figura si ha un neurone che riceve afferenze
deboli e forti dal collaterale di Schaffer. (A): stimolazione tetanica delle sole afferenze deboli non comporta LTP. (B): stimolazione contemporanea di entrambe le vie afferenze genera LTP su entrambe. (C): stimolazione delle sole esclusive vie forti comporta LTP su queste ma non su quelle deboli.
Dopo
A Cooperatività B Associatività C Specifità
Prima deboli
Quindi, perché si abbia LTP, il neurone presinaptico e postsinaptico devono scaricare insieme e ciò è la conferma sperimentale della teoria dell’apprendimento di Hebb secondo la quale quando il neurone A eccita il neurone B e contribuisce, continuativamente, a produrne la scarica, in uno o in entrambi i neuroni in questione si ha una crescita o una modificazione metaboliche di modo che aumenti l’efficienza con cui A eccita B. Il fatto che il potenziamento a lungo termine si sviluppi anche nell’ippocampo e sapendo che questi svolge un ruolo essenziale nell’immagazzinamento delle tracce di memoria, ha fatto propendere gli studiosi a pensare che l’LTP sia collegato ai processi mnemonici. In questa direzione conduce un interessante esperimento sui ratti, in cui l’animale deve nuotare in una vasca riempita di un liquido bianco e opaco e riuscire a trovare una struttura di approdo posta appena sotto il pelo dell’acqua. Il topo viene fatto entrare nella vasca in vari punti a caso e per orientarsi nello spazio ha a disposizione come riferimenti solo dei segni sulle paratie che circondano la vasca. All’inizio si parte con una versione solo visiva e non spaziale dell’esperimento sollevando l’approdo sopra il livello del liquido o segnalandolo con una asta: il topo nuota direttamente verso la struttura usando solo il senso della vista e non altre informazioni più complesse. Se poi, tramite iniezione di farmaci specifici, si inibiscono i recettori dell’ippocampo il ratto riesce a svolgere il compito a lui richiesto nella versione visiva dell’esperimento ma non in quella spaziale, portando a ritenere che nella memoria spaziale abbia un ruolo importante l’LTP.
Da queste brevi argomentazioni risulta evidente che l’apprendimento produce modificazioni funzionali e strutturali all’architettura cerebrale, come ad esempio nella mappa delle connessioni, provocandone l’espansione o l’involuzione, dei sistemi sensorimotori coinvolti in un determinato task di apprendimento. Si può quindi affermare
che le mappe corticali sono dinamiche e non statiche, poiché il loro stato dipende dall’uso. La conclusione estrema a cui si giunge percorrendo questa strada di analisi è che ogni uomo, crescendo in ambienti fisici e sociali inevitabilmente diversi, essendo esposto a stimoli diversi che lo inducono ad un uso specifico delle proprie capacità motorie e sensoriali, possiede un’architettura cerebrale che viene modificata dall’esperienza in modo pressoché unico. Queste modificazioni neurali, insieme al nostro patrimonio genetico, costituiscono le basi biologiche fondanti dell’individualità.