66
DISCUSSIONE
4.1 Associazione tra la premutazione al locus FMR1 e la POF
L’analisi del numero di ripetizioni al locus FMR1 nelle pazienti che manifestano POF ha un’importanza notevole dal punto di vista clinico perché consente di individuare le pazienti e le famiglie “a rischio”, in cui sono presenti alleli con zona grigia o premutazione in grado di generare prole affetta da sindrome di X fragile. Le donne ancora fertili analizzate per “familiarità per POF” hanno permesso di studiare la trasmissione dell’allele premutato e la penetranza del fenotipo POF consentendo di fare prevenzione.
Abbiamo preso in considerazione anche i casi di “sospetta POF”, cioè i soggetti che mostravano irregolarità nel ciclo mestruale e/o valori elevati di FSH, per verificare l’ipotesi che nelle donne premutate possano esistere condizioni diverse di disfunzioni ovariche. Infatti, in alcuni studi riportati in letteratura, nelle donne con premutazione che non presentavano POF conclamata si è riscontrato un aumento dei livelli di FSH. (Sullivan et al, 2005).
I portatori di premutazione al locus FMR1 in passato erano considerati soggetti fenotipicamente normali che potevano trasmettere alleli a rischio di espansione, oggi sappiamo invece che i maschi con la premutazione sono predisposti verso la manifestazione di FXTAS e che le donne premutate potrebbero avere un rischio di sviluppare POF maggiore (20%) rispetto alla popolazione generale (1%) (Sherman et al, 2000).
La presenza di un’associazione significativa tra POF e premutazione al locus FMR1 è stata dimostrata nel 1995 in un primo studio collaborativo internazionale
67
(Allingam-Hawkins et al, 1995) in cui il 16% delle portatrici di premutazione aveva POF, tale associazione è stata confermata da studi successivi (Cronister et al, 1998; Bennet et al, 2010, Gleicher et al, 2011).
Nella maggior parte dei lavori scientifici gli alleli con premutazione sono stati individuati, in media, nel 7% delle donne con POF sporadica e nel 21% dei casi di familiarità, rispetto a una prevalenza dello 0,4% nelle donne di controllo (Sherman et al, 2000).
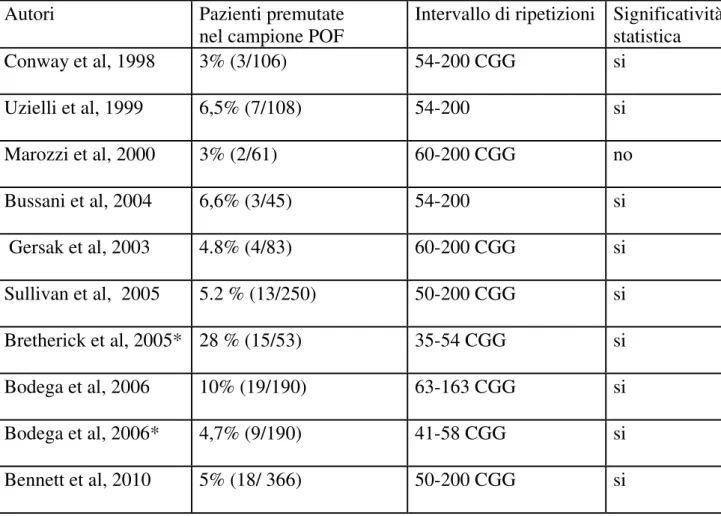
Tabella 4.1: Risultati ottenuti su popolazioni di donne con menopausa precoce. L’asterisco indica le ricerche che riguardano l’associazione tra la sola zona grigia e la POF.
Autori Pazienti premutate
nel campione POF
Intervallo di ripetizioni Significatività statistica Conway et al, 1998 3% (3/106) 54-200 CGG si Uzielli et al, 1999 6,5% (7/108) 54-200 si Marozzi et al, 2000 3% (2/61) 60-200 CGG no Bussani et al, 2004 6,6% (3/45) 54-200 si Gersak et al, 2003 4.8% (4/83) 60-200 CGG si Sullivan et al, 2005 5.2 % (13/250) 50-200 CGG si Bretherick et al, 2005* 28 % (15/53) 35-54 CGG si Bodega et al, 2006 10% (19/190) 63-163 CGG si Bodega et al, 2006* 4,7% (9/190) 41-58 CGG si Bennett et al, 2010 5% (18/ 366) 50-200 CGG si
68
I nostri risultati (Tabella 3.2 in Risultati) hanno confermato l’esistenza di un’associazione tra premutazione al locus FMR1 e POF (13,5% di pazienti con premutazione nei casi POF; p value= 0,001) concordando con i dati riportati precedentemente in letteratura; la percentuale da noi osservata supera quella riportata da altri autori, probabilmente per il fatto che abbiamo analizzato un campione limitato di pazienti con POF.
Nella categoria delle pazienti con sospetta POF non abbiamo osservato alcuna differenza statisticamente significativa tra la percentuale di casi premutati e i controlli.
I casi di familiarità per POF, pervenuti al laboratorio per una valutazione in base al rischio di espansione delle pazienti in età ancora fertile, presentano una percentuale di donne premutate maggiore rispetto a quella dei controlli, ma non statisticamente significativa (p=0,052; Tabella 3.4 in Risultati). Tuttavia le differenze osservate suggeriscono che nelle famiglie in cui sono presenti soggetti con POF è più alta la probabilità che ci siano alleli con numero di ripetizioni nell’intervallo della premutazione. E’ quindi importante che le pazienti ancora fertili vengano studiate per il rischio di espansione nell’eventuale prole e per la probabilità di avere un figlio affetto da sindrome di X fragile. Non è da escludere, inoltre, che due pazienti appartenenti al gruppo delle familiarità per POF (caso 11 con 22-45 CGG e caso 14 con 31-58 CGG) essendo ancora in giovane età (rispettivamente, 34 e 38 anni), possano manifestare menopausa prima dei 40 anni e dunque appartenere al gruppo delle POF
Nel confronto tra il totale dei casi analizzati (POF, Sospetta POF e Familiarità per POF) ed i controlli il valore basso di p value right tailed (p=0,016) relativo
69
all’intervallo della premutazione ci permette di confermare l’ipotesi che la premutazione al locus FMR1 sia un fattore genetico associato significativamente alla POF (Tabella 3.5 in Risultati).
Poiché alcuni studi riportati in letteratura hanno indagato anche l’associazione tra le ripetizioni intermedie e la POF (Bretherick et al, 2005; Bodega et al, 2006; Bennett et al, 2010), abbiamo preso in considerazione intervalli di alleli intermedi (40-54 CGG) e l’intervallo relativo alla zona grigia (45-54 CGG, come definita dall’ACMG). Questi alleli non hanno il rischio di espansione a mutazione completa, ma, essendo più instabili rispetto agli alleli normali, possono dare luogo a premutazione. Nelle pazienti pervenute con POF è stata rilevata una differenza statisticamente significativa solo nell’intervallo più ampio 40-54 CGG (p=0,03) e non nell’intervallo 45-54 CGG della zona grigia propriamente detta (Tabella 3.2 in Risultati).
In letteratura non sempre è stata dimostrata un’associazione tra alleli intermedi e POF. In una ricerca condotta nel 2005 (Bretherick et al, 2005) è stato rilevato un aumento significativo di alleli nell’intervallo 35-54 CGG nei casi con POF sporadica (15/106, p=0,02) rispetto alla popolazione di controllo (21/322). Tale associazione è stata rilevata anche in uno studio su pazienti italiane (Bodega et al, 2006) in cui è stata riscontrata una percentuale significativamente maggiore di pazienti con alleli nell’intervallo 41-58 CGG (9/190; p=0,021) tra le donne con POF.
Invece uno studio condotto su un numero elevato di campioni (Bennett et al, 2010) non ha rilevato associazione significativa tra ripetizioni intermedie
70
nell’intervallo 35-54 CGG e POF (p=0,48) e nell’intervallo 41-58 CGG e POF (p=0,23).
Il fatto che solo una percentuale variabile di soggetti con alleli intermedi sviluppi POF può essere spiegato, a livello biologico, considerando che, se alla base dell’effetto deleterio degli alleli premutati c’è l’aumento dell’mRNA, il leggero aumento dell’mRNA relativo agli alleli della zona grigia (dimostrato da Loesch et al, 2007) determini una bassa penetranza del fenotipo POF nei portatori di tali alleli.
Un’altra ipotesi che spiega la divergenza nelle conclusioni raggiunte dalle indagini sugli alleli intermedi potrebbe essere il fatto che non tutti i ricercatori hanno valutato la presenza e la localizzazione delle interruzioni AGG, le quali contribuiscono alla comparsa del fenotipo, in quanto influiscono sulla struttura secondaria dell’mRNA (Bodega et al, 2006; , Yrigollen et al, 2011). La bassa penetranza del fenotipo POF osservata tra i portatori di alleli della zona grigia potrebbe, quindi, dipendere dal fatto che buona parte dei nostri campioni presentava un numero di interruzioni AGG tale da impedire la formazione di un mRNA con struttura secondaria anomala. Non è stato possibile verificare questa ipotesi sia per la difficoltà di separare prima del sequenziamento gli alleli presenti in duplice copia nei soggetti di sesso femminile e diversi tra loro per poche ripetizioni, sia per la difficoltà di sequenziare la regione ripetuta CGG al locus FMR1.
In letteratura è’ stato dimostrato che il rischio di sviluppare POF aumentava con l’aumentare del numero di ripetizioni (Sullivan et al, 2005). Per questo abbiamo valutato le differenze tra le frequenze alleliche di casi POF e controlli in sei
71
classi alleliche, riscontrando una differenza statisticamente significativa nella classe 71-80 CGG (p value = 0,020; Tabella 3.6 in Risultati). E’inoltre interessante notare che, nell’intervallo 21-30, si osserva una maggiore frequenza allelica nel gruppo dei controlli rispetto a quello dei casi POF (Grafico 3.8 in Risultati). La differenza osservata è statisticamente significativa, il valore di p
value left tailed molto basso (p=0,007) indica un’associazione negativa tra questo
genotipo e la POF. La significatività del p-value right tailed cresce (poiché il suo valore decresce) con il crescere del numero di ripetizioni ed il valore di O.R. cresce fino al valore di infinito quando nei controlli il valore delle osservazioni è pari a zero.
Nel confronto tra il totale dei casi analizzati ed i controlli (Tabella 3.5 in Risultati) si osserva un valore basso di p-value left tailed (p= 0,012) relativo all’intervallo di normalità e percentuali maggiori di casi rispetto ai controlli nella classe allelica 40-54 e nella zona grigia. I nostri dati suggeriscono che gli alleli nell’intervallo di ripetizioni 40-54 non siano fattori di rischio per la POF, anche se sicuramente hanno una frequenza maggiore tra le donne con POF, sospetta POF e familiarità per POF.
In conclusione possiamo affermare che, come ipotizzato da Sullivan, esiste una correlazione tra il numero di ripetizioni al locus FMR1 ed il rischio di manifestare POF; tale rischio cresce con l’aumentare del numero di ripetizioni fino ed assume una significatività statistica nel range della premutazione, soprattutto nell’intervallo 71-80 CGG.
Il fatto che non siano state riscontrate pazienti con mutazione completa nel campione di donne analizzate è in accordo con gli studi riportati in letteratura
(Schartz et al, 1994; Allingham
tossico sulla funzione ovarica non è determinato dalla perdita di funzione del gene FMR1 come è dimostrato dall’osservazione che donne portatrici di mutazione completa hanno una funzione ovarica normale (Uzielli et al, 1999).
4.2 La trasmissione della POF
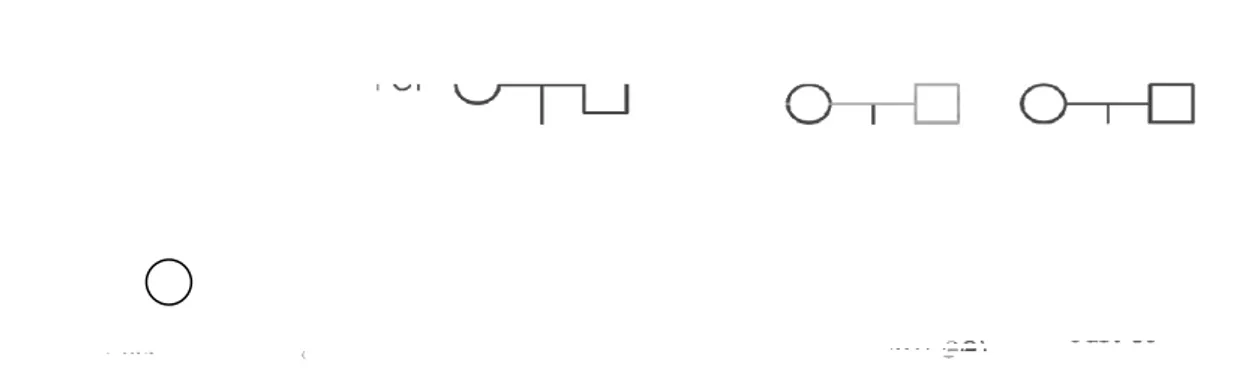
Non è stato possibile studiare l’origine parentale di tutte le pazienti con alleli premutati, tuttavia l’anamnesi familiare suggerisce un modello di ereditarietà del fenotipo POF paterna o materna, con penetranza incompleta ed espressività variabile (Figura 4.2).
Figura 4.2: Pedigree dei casi 14, 2, 3, 12, 11,15
La paziente 14 studiata per familiarità per POF (sorella con menopausa a 44 anni e nonna paterna con POF) avendo 38 anni non si può escludere che possa manifestare menopausa prima dei 40 anni.
L’analisi al locus FMR
amenorrea secondaria prima dei 40 anni, ha permesso di capire che ella ha trasmesso l’allele di 48 ripetizioni ad entrambe le due figlie (caso 2 e caso 12), (Schartz et al, 1994; Allingham-Hawkins et al, 1995;) ed indica che l’effetto tossico sulla funzione ovarica non è determinato dalla perdita di funzione del come è dimostrato dall’osservazione che donne portatrici di mutazione completa hanno una funzione ovarica normale (Uzielli et al, 1999).
4.2 La trasmissione della POF
Non è stato possibile studiare l’origine parentale di tutte le pazienti con alleli premutati, tuttavia l’anamnesi familiare suggerisce un modello di ereditarietà del fenotipo POF paterna o materna, con penetranza incompleta ed espressività
Pedigree dei casi 14, 2, 3, 12, 11,15
La paziente 14 studiata per familiarità per POF (sorella con menopausa a 44 anni e nonna paterna con POF) avendo 38 anni non si può escludere che possa manifestare menopausa prima dei 40 anni.
L’analisi al locus FMR1 estesa alle figlie della paziente 3, che aveva presentato amenorrea secondaria prima dei 40 anni, ha permesso di capire che ella ha trasmesso l’allele di 48 ripetizioni ad entrambe le due figlie (caso 2 e caso 12),
72
Hawkins et al, 1995;) ed indica che l’effetto tossico sulla funzione ovarica non è determinato dalla perdita di funzione del come è dimostrato dall’osservazione che donne portatrici di mutazione completa hanno una funzione ovarica normale (Uzielli et al, 1999).
Non è stato possibile studiare l’origine parentale di tutte le pazienti con alleli premutati, tuttavia l’anamnesi familiare suggerisce un modello di ereditarietà del fenotipo POF paterna o materna, con penetranza incompleta ed espressività
La paziente 14 studiata per familiarità per POF (sorella con menopausa a 44 anni e nonna paterna con POF) avendo 38 anni non si può escludere che possa
1 estesa alle figlie della paziente 3, che aveva presentato amenorrea secondaria prima dei 40 anni, ha permesso di capire che ella ha trasmesso l’allele di 48 ripetizioni ad entrambe le due figlie (caso 2 e caso 12),
73
ma solo una di loro ha presentato POF. L’eterogeneità del fenotipo all’interno di una famiglia è un fenomeno rilevato da vari autori. Nel 2011 è stato condotto uno studio su due gemelle monozigoti premutate delle quali solo una presentava POF (Johnston-MacAnanny et al, 2011); gli autori avevano ipotizzato inizialmente che alla base di questa differenza ci fosse un diverso pattern di inattivazione del cromosoma X; tuttavia gli studi sull’inactivation ratio su linfociti di sangue periferico non avevano confermato tale ipotesi, ragion per cui è stato ipotizzato che il pattern di inattivazione potrebbe variare da tessuto a tessuto nello stesso individuo, e quello osservato nelle cellule linfocitarie sia diverso da quello presente a livello dell’ovaio.
Il diverso fenotipo dei casi 2 e 12 potrebbe essere spiegato anche dalla scarsa penetranza della POF che si verifica quando la trasmissione dell’allele è materna; infatti secondo alcune ipotesi (Hundscheid et al; 2000) gli alleli premutati trasmessi per linea paterna hanno un rischio di sviluppare POF nella progenie femminile dieci volte maggiore rispetto a quello che si osserva nella trasmissione da madre a figlia, in cui la probabilità di presentare POF è paragonabile a quella della popolazione generale.
Possiamo ipotizzare che la probanda 15 (la cui nonna materna presentava POF) abbia ricevuto l’allele premutato di 130 ripetizioni dalla madre, la quale tuttavia non aveva POF; la mancanza di espressione del fenotipo nella probanda 15 potrebbe essere dovuta all’inattivazione preferenziale dell’allele premutato, come osservato dal pattern di inattivazione linfocitario (Figura 3.10 nei Risultati) Il caso 11, una donna di 34 anni, presenta un allele di 45 ripetizioni. Non essendo stato possibile effettuare l’analisi al locus FMR1 nella madre, che presentava
74
POF, non si può stabilire se la trasmissione dell’allele sia materna o paterna, tuttavia per la paziente è consigliata la consulenza genetica perché essendo in età ancora fertile, potrebbe trasmettere un allele a rischio di espansione.
4.3 Caratteristiche cliniche delle pazienti POF e possibili meccanismi molecolari di patogenesi
I casi da noi esaminati rientrano nel quadro clinico della POF secondaria.
Le forme di POF primaria si manifestano con assenza dello sviluppo puberale e amenorrea primaria (50% con disgenesia ovarica), mentre le forme ad insorgenza tardiva, proprie dei casi da noi esaminati, sono caratterizzate da un arresto dei cicli mestruali (amenorrea secondaria), manifestazione che testimonia esaurimento del patrimonio follicolare prima dei 40 anni. Gli elevati valori di FSH che si riscontrano nelle pazienti sono indice del fatto che le ovaie non rispondono più ai valori di ormone in circolo e non producono estrogeni. Infatti, nella donna l’FSH stimola la progressione verso la maturazione dei follicoli; mentre il follicolo cresce, esso rilascia inibinaA che per feedback negativo ostacola il rilascio di FSH nell’adenoipofisi. Alti valori di FSH dunque indicano situazioni dove il normale feedback negativo che origina dalle gonadi è assente, ciò porta ad un rilascio incontrollato di FSH da parte dell’adenoipofisi.
Ci sono diversi possibili meccanismi molecolari alla base dell’influenza della premutazione al locus FMR1 sul corretto sviluppo dei follicoli ovarici in fase embrionale o nell’adulto.
In passato si riteneva che la causa dell’atresia accelerata fosse l’assenza di proteina FMRP, che avrebbe determinato la mancata regolazione di alcuni geni
75
indispensabili per il corretto sviluppo dell’ovaio; infatti l’espressione di FMR1, oltre che a livello cerebrale, è particolarmente intensa nei testicoli e nell’ovaio (Bachner et al, 1993); tuttavia, se così fosse, tra i casi POF ci sarebbe una considerevole percentuale di soggetti con mutazione completa e gli esperimenti condotti su animali modello avrebbero dovuto dimostrare che i topi privi di proteina FMRP non sono fertili.
Oggi si ritiene che gli elevati livelli di mRNA oppure una sua alterata struttura secondaria possano determinare un effetto tossico nella cellula tale da causare un’accelerazione nell’invecchiamento dei follicoli ovarici. E’ stato dimostrato che FMR1 è altamente espresso nelle cellule germinali dei follicoli in particolar modo durante la maturazione degli stessi, e poiché mRNA con numero elevato di ripetizioni CGG vengono tradotti con un’efficienza minore, l’accumulo del trascritto potrebbe avere un effetto tossico a lungo termine favorendo l’atresia follicolare (Yrigollen et al, 2011) con un meccanismo simile a quello che si verifica nel tessuto cerebrale di un soggetto affetto da FXTAS (figura 4.3). Dal momento che quest’ultima è una patologia a esordio tardivo, anche nella POF si potrebbe parlare di conseguenze tardive di una aumentata espressione genica (Gleicher et al, 2008).
76 Figura 4.3:Possibili meccanismi di tossicità dell’mRNA di FMR1 (modificata da Hagerman
labs).
1)Il trascritto di FMR1 contenente la sequenza espansa viene normalmente trasportato fuori dal nucleo sottoforma di particella mRNP. La regione espansa impedisce l’assemblaggio della subunità ribosomiale 40s bloccando la traduzione del trascritto. Questo determina una bassa produzione di FMRP.
2)In risposta ai bassi livelli di FMRP si verifica un meccanismo di feedback che determina l’aumento della trascrizione di FMR1 e conseguente accumulo.
3)Il lungo tratto CGG nel trascritto potrebbe sequestrare una gran quantità di proteine importanti per il metabolismo cellulare.
Altri ricercatori invece ritengono che la struttura secondaria dell’mRNA premutato e privo di interruzioni AGG sia differente dal normale e determini legami “aberranti” con determinate proteine che riconoscono specifiche strutture
Follicular degeneration
77
a forcina. Questo porta alla formazione di complessi che interferiscono con il metabolismo cellulare (Bodega et al, 2006)
Secondo studi recenti, l’aumento del processo di trascrizione degli alleli premutati tra le 55 e le 79 ripetizioni porterebbe ad una maggiore produzione di FMRP (Loesch et al, 2007; Persani et al, 2010); poiché la proteina FMRP è altamente espressa nelle cellule germinali dell’ovaio fetale, una sua maggiore produzione potrebbe determinare la repressione di geni necessari per lo sviluppo ovarico (Persani et al, 2010).
Alcune ricerche hanno dimostrato che l’espansione di triplette CGG potrebbe determinare la formazione di strutture a forcina che vengono processate dalla RNAsi Dicer per dare luogo a molecole di miRNA con effetto tossico (Chang et al, 2008). Non è ancora noto quale sia il meccanismo di patogenesi, i miRNA originatisi, tuttavia sappiamo che i miRNA hanno dei siti di legame a livello dell’estremità 3’ UTR del gene FMR1 e potrebbero in qualche modo alterarne l’espressione.(Yong et al, 2010).
Sul cromosoma X ci sono numerosi altri geni che potrebbero essere coinvolti nella maturazione dei follicoli e quindi influire sulla manifestazione di POF, quando presentano un’espressione alterata, in seguito a riarrangiamenti cromosomici. Si potrebbe ipotizzare un parallelismo tra lo stato di POF ed alcuni casi di infertilità maschile che si manifesta dopo i 30 anni in soggetti con microdelezioni del cromosoma Y. A questo proposito, infatti, nel nostro laboratorio è stato riscontrato il caso di un soggetto di 35 anni con microdelezioni nella regione AZF del cromosoma Y; l’analisi estesa al padre ha evidenziato la
78
presenza della stessa delezione, tuttavia il padre, avendo procreato in età più giovane, non aveva manifestato segni di infertilità.
Bisogna prendere in considerazione, quindi, che la presenza o meno di POF potrebbe essere influenzata da numerosi altri fattori genetici che agiscono in concomitanza con la premutazione al locus FMR1. .
La regione Xq27 è considerata una delle regioni critiche del braccio lungo del cromosoma X associate a disfunzioni ovariche quando delete (Davison et al, 2000), la premutazione al locus FMR1 potrebbe essere essa stessa la causa di un’alterazione dell’espressione dei geni situati in loci contigui, quale ad esempio il locus POF1.