ALMA MATER STUDIORUM - UNIVERSITA` DI BOLOGNA
CAMPUS DI CESENA
SCUOLA DI INGEGNERIA E ARCHITETTURA
CORSO DI LAUREA IN INGEGNERIA BIOMEDICA
DISPOSITIVI DI SUPPORTO ALLA
INSUFFICIENZA EPATICA
Elaborato in
INGEGNERIA CLINICA
Relatore Presentata da
Prof. Ing. Claudio Lamberti Giulia Ortolani
Correlatore
Prof. Ing. Emanuela Marcelli
II Sessione
3
Alla mia famiglia, che mi ha sostenuto psicologicamente ed economicamente
nel raggiungimento del traguardo.
5
Indice
Introduzione………...7
1 Il fegato………9
1.1
L’insufficienza epatica…………...16
1.2
La rigenerazione epatica………18
2 I dispositivi di supporto al fegato………19
2.1 Sviluppo dei sistemi di purificazione del sangue…………...20
3
I dispositivi artificiali………27
3.1 Emodialisi………..27
3.2 Emofiltrazione………...28
3.3 Emoperfusione………...28
3.4 Reattori con enzimi immobilizzati……….29
3.5 Scambio del plasma………30
3.6 Emodiafiltrazione………...30
3.7 Scambio del plasma ed emodiafiltrazione continua………...30
3.8 Criofiltrazione………31
3.9 Terapia molecolare del sistema di ricircolo assorbente…………..33
6
4 Sistemi che sostituiscono completamente le funzioni del fegato ...43
5 I dispositivi bioartificiali………...45
5.1 Sorgenti cellulari………46
5.2 Tipi di sistemi di coltura degli epatociti……….47
5.3 Tipi di bioreattori………48
5.4 Il dispositivo Hepatassist………...52
5.5 Il dispositivo extracorporeo di assistenza epatica…………...54
5.6 Il dispositivo di supporto modulare epatico extracorporeo…... 57
Conclusioni……… ....63
Ringraziamenti………...67
7
Introduzione
L’organizzazione mondiale della sanità stima che il 10% della popolazione nel
mondo presenta una malattia epatica cronica. L’insufficienza epatica fulminante
porta alla morte entro novantasei ore in assenza di trapianto. Questa patologia
colpisce circa 2500 persone l’anno e il trapianto di fegato è l’unico trattamento
efficiente, ma la mancanza di donatori ha causato un elevato tasso di mortalità in
pazienti in lista di attesa per l’organo compatibile. Negli ultimi anni è cresciuta
sempre più la lista d’attesa per il trapianto, mentre il numero degli innesti
disponibili rimane ridotto. Non tutti i pazienti sono candidati al trapianto. Questo
tipo di intervento è rischioso e richiede un trattamento d’immunosoppressione per
tutta la vita. Si cercano quindi soluzioni sostitutive, ma lo sviluppo di dispositivi
efficaci di assistenza epatica rimane uno dei più alti sforzi dell’ingegneria
biomedica. Il fegato, infatti, svolge più di 500 funzioni diverse che sono difficili da
riprodurre artificialmente. Un dispositivo di assistenza epatica deve sostituire o
integrare la funzione epatica quando scende al di sotto della soglia critica del 30%
del normale funzionamento. Per garantire il normale funzionamento
dell’organismo, la massa di epatociti disponibile in un paziente adulto deve essere
approssimativamente di circa 400g. Se questa massa è disponibile si può avere
rigenerazione epatica spontanea. Questo spiega la necessita di raggiungere e
garantire, comunque, un livello minimo di funzionalità epatica, al di sotto del quale
non si ha né rigenerazione di epatociti (impossibilità di ripristinare l’attività
metabolica del fegato), né funzionamento di altri organi del corpo, che dipendono
8
dall’attività epatica. La ricerca e lo sviluppo di dispositivi di assistenza epatica è
tesa al raggiungimento e al mantenimento della soglia minima di funzionalità; in
questo modo si permette al paziente di sopravvivere fino al trapianto, quando
questo è l’unica terapia possibile, oppure di poter raggiungere le condizioni di
autorigenerazione spontanea nelle patologie meno gravi. La ricerca sui dispositivi
di assistenza epatica risale agli anni 50, e sin da allora sono state sviluppate diverse
soluzioni , che possiamo distinguere in sistemi meccanici (sistemi non biologici) e
sistemi biochimici o biomeccanici (sistemi biologici). I sistemi non biologici
possono avere un ruolo nel trattamento di forme specifiche d’insufficienza epatica.
L’obiettivo è di fornire purificazione del sangue, ossia rimuovere tutte le sostanze
che si accumulano nel sangue durante la disfunzione epatica, causando anomalie
neurologiche, lesioni del fegato e di altri organi e inibizione della rigenerazione
epatica. I sistemi biologici possono essere utili nel trattamento d’insufficienza
epatica, in cui l’obiettivo primario è quello di fornire tutte le funzioni del fegato
che sono state compromesse o perse.
9
Capitolo 1
Il fegato
10
Figura 1.2: Il fegato e gli organi connessi ad esso.
Figura 1.3: Le principali funzioni di biotrasformazione e detossificazione del fegato che, in coordinazione con reni e intestino, gioca un ruolo centrale nell’eliminazione delle tossine endogene ed esogene.
11
Il fegato è il più grande degli organi interni; infatti, pesa 1,5 kg in un soggetto adulto. E’
situato subito sotto il diaframma, verso il lato destro del corpo.
Il sangue che va al fegato ha due origini: il sangue ossigenato raggiunge il fegato con l’arteria epatica, mentre il sangue che raggiunge il fegato con la vena porta è ricco di nutrienti assorbiti dal tratto gastrointestinale e contiene i prodotti del catabolismo dell’emoglobina di origine splenica. Il sangue lascia il fegato con la vena epatica. La bile, sintetizzata dal fegato, è secreta nel dotto epatico per essere accumulata nella colecisti, e da qui è secreta nel lume intestinale tramite il coledoco.
Le quattro tipologie cellulari principali che si riscontrano nel fegato sono gli epatociti, le cellule stellate, le cellule endoteliali sinusoidali e le cellule di Kupffer.
Gli epatociti sono le cellule più numerose del fegato, ne costituiscono l'80% del volume e circa il 60% del numero; la loro forma è poliedrica e il loro diametro varia da 20 a 30 µm. Sono spesso polinucleate e tetraploidi, con un numero di nuclei che può arrivare anche a quattro. Gli epatociti sono disposti in unità esagonali irregolari definite lobuli. Ogni lobulo è disposto attorno ad una vena centrale che drena il sangue nella vena epatica. Alla periferia del lobulo si trovano rami della vena portale epatica e dell’arteria epatica. Questi vasi si ramificano ulteriormente tra gli epatociti formando sinusoidi in cui scorre il sangue. Circa il 70% della superficie di ogni epatocita è in contatto con le sinusoidi, il che permette di massimizzare lo scambio tra il sangue e le cellule. Circa il 15% della membrana dell’epatocita è in contatto con i canalicoli biliari, piccoli canali in cui è secreta la bile. I canalicoli si uniscono nei dotti biliari che attraversano il fegato accanto alle vene portali.
12 Figura 1.5: sezione di un lobulo epatico.
Le cellule stellate o di Ito, di origine mesenchimale e molto meno numerose degli epatociti, sono poste tra le lamine, alla base degli epatociti, ed hanno una forma stellata o irregolare. Il loro citoplasma è ricco di vescicole lipidiche contenenti vitamina A, ed il loro compito è quello di secernere le principali sostanze costituenti della matrice, tra cui collagene e reticolina. Sono fondamentali nella rigenerazione del fegato a seguito di lesioni o interventi chirurgici poiché secernono fattori di crescita responsabili della buona capacità di rigenerazione del fegato. In caso di lesione possono sostituire gli epatociti danneggiati e mediante la secrezione di collagene e altre proteine strutturali, formare del tessuto cicatriziale. Altre sostanze da loro secrete concorrono all'omeostasi dell'organo.
Le cellule endoteliali sinusoidali costituiscono l'endotelio dei sinusoidi venosi fenestrati del fegato. Hanno forma appiattita, con un nucleo ovalare in posizione centrale e scarso citoplasma contenente numerose vescicole transcitotiche.
13
Le cellule di Kupffer, i macrofagi del fegato, sono dei derivati dei monociti e si collocano nel lume dei sinusoidi venosi. La loro forma è variabile ed irregolare e la loro funzione è quella di rimuovere, per fagocitosi, eventuali detriti presenti nel sangue in afflusso agli epatociti, ma possono anche stimolare il sistema immunitario mediante la secrezione di numerosi fattori e di citochine. Rimuovono gli eritrociti invecchiati o danneggiati agendo in modo complementare alla milza (che possono sostituire in caso di splenectomia).
Il fegato è un organo metabolico molto complesso che partecipa all’assorbimento dei nutrienti, deposito e rilascio delle sostanze secondo le richieste del corpo. Svolge inoltre un ruolo chiave nella biotrasformazione, detossificazione ed eliminazione dei rifiuti endogeni, medicinali e tossine esogene. Inoltre contribuisce al controllo del flusso sanguigno e alla difesa immunitaria antibatterica.
Il metabolismo dell’ammoniaca, il principale prodotto di rifiuto risultante dal catabolismo delle proteine, avviene principalmente nel fegato. L’ammoniaca viene catturata e
trasformata in urea dagli epatociti periportali prima di essere eliminata dal rene. Gli epatociti peripatici (o centrolobulari), localizzati vicino alle venule epatiche, sono in
grado di trasformare l’ammoniaca in glutammina.
Gli acidi biliari sintetizzati dal fegato a partire dal colesterolo, sono liberati nell’intestino attraverso la bile. Questo è il modo principale per eliminare il colesterolo dal corpo. La bilirubina è il prodotto di degradazione dell’eme, gruppo prostetico incluso all’interno di emoglobina e di emoproteine, come la mioglobina e citocromi. L’eme viene trasformato in biliverdina e poi in bilirubina dall’ eme ossigenasi, la cui attività avviene prevalentemente nella milza, nelle cellule di Kupffer e, in misura minore, negli epatociti. Le molecole di bilirubina sono insolubili e quindi sono legate all’albumina nel plasma. Nel fegato la bilirubina viene catturata, coniugata con acido glucuronico per renderla solubile ed eliminata nella bile. All’interno dell’intestino, le molecole di bilirubina sono deconiugate e idrogenate in urobilinogeno dai batteri del colon. Una piccola quantità viene riassorbita dall’intestino per essere eliminata nuovamente dalla bile e, in misura minore, nelle urine. La maggior parte viene eliminata attraverso le feci.
14
Gli xenobiotici, quali esotossine e farmaci, devono essere eliminati. Gli xenobiotici più idrosolubili vengono eliminati dai reni. Al contrario, tossine liposolubili devono essere solubilizzate prima di essere eliminate. Queste modifiche sono realizzate principalmente dal fegato e, in misura minore, dai polmoni, reni e intestino attraverso due tipi di reazione: reazioni di I fase o ossidazione e reazioni di fase II o coniugazione. La prima aumenta la solubilità della molecola attraverso l’aggiunta di gruppi polari, mentre le ultime permettono il collegamento delle molecole endogene idrosolubili, quali acidi glucuronico, glutatione, solfati e amminoacidi, alle molecole ossidate (riducendo simultaneamente la loro attività farmacologica e incrementando la loro idrosolubilità). Tal molecole possono essere successivamente eliminate nella bile o dai reni.
Riassumendo, le funzioni del fegato sono espletate dalle cellule del fegato e possono essere sintetizzate nei vari punti:
Il fegato produce e secerne la bile, usata per emulsionare i grassi. Parte della bile viene riversata direttamente nel duodeno, parte viene accumulata nella cistifellea.
Il fegato svolge numerose funzioni nel metabolismo dei carboidrati e delle proteine:
la gluconeogenesi, ovvero la sintesi del glucosio a partire da alcuni amminoacidi, dall'acido lattico o dal glicerolo;
la glicogenolisi, ovvero la formazione del glucosio dal glicogeno (avviene anche all'interno dei muscoli);
la glicogenosintesi, ovvero la sintesi del glicogeno a partire dal glucosio;
la demolizione dell'insulina e di altri ormoni;
Il fegato interviene nel metabolismo dei lipidi, attraverso:
la sintesi del colesterolo;
la sintesi dei trigliceridi.
Il fegato produce i fattori di coagulazione come fibrinogeno e trombina, nonché la proteina C, la proteina S, l'epcidina e l'antitrombina.
Il fegato demolisce l'emoglobina, creando metaboliti che vengono aggiunti alla bile come pigmenti.
15
Il fegato demolisce numerose sostanze tossiche e numerosi farmaci nel processo noto come metabolismo dei farmaci.
Il fegato converte l'ammoniaca in urea.
Il fegato funge da deposito per numerose sostanze, tra cui il glucosio (come glicogeno), la vitamina B12, il ferro e il rame.
Nel feto fino al terzo mese, il fegato è la sede principale della produzione di globuli rossi; viene rimpiazzato in questo compito dal midollo osseo alla 32ª settimana di gestazione.
Il sistema reticoloendoteliale del fegato contiene numerose cellule specializzate del sistema immunitario che agiscono da "filtro" nei confronti degli antigeni trasportati dal sistema della vena porta.
Una delle principali attività del fegato è la disintossicazione dell'organismo da tossine, scorie ed altri elementi nocivi. La più importante di tali azioni disintossicanti è la trasformazione dell'ammoniaca presente nel sangue (sostanza tossica derivata dalle proteine) in una sostanza tollerabile a concentrazioni più alte, l'urea. L'urea viene poi rimessa nel sangue.
Le caratteristiche citologiche degli epatociti rispecchiano la funzione detossificante della ghiandola. Essi infatti presentano un reticolo endoplasmatico liscio molto abbondante. Quest'organulo infatti, oltre a presiedere alla sintesi di alcuni steroidi è intensamente implicato proprio nell'attività di detossificazione di molecole potenzialmente nocive o estranee (alcool, farmaci, etc.).
Molte malattie del fegato sono accompagnate dall'itterizia causata dall'incremento dei livelli di bilirubina nell'organismo. La bilirubina è il risultato della decomposizione dell'emoglobina dei globuli rossi morti; normalmente viene rimossa dal fegato ed escreta attraverso la bile.
Attualmente non esiste un organo artificiale capace di emulare tutte le funzioni del fegato. Senza il supporto delle funzioni svolte dal fegato, il corpo umano non è in grado di sopperire ad alcune importanti funzioni metaboliche, quali ad esempio il supporto
16
energetico, l’equilibrio acido-base e la termoregolazione. Le patologie più importanti che si presentano sono:
Insufficienza epatica acuta e cronica;
Varie forme di epatite, l’infiammazione del fegato causata da virus, sostanze
tossiche, malattie autoimmuni e condizioni ereditarie;
Cirrosi, la formazione di tessuto fibroso all'interno del fegato in sostituzione degli epatociti morti. La morte delle cellule epatiche può essere causata da epatite virale,
alcolismo o intossicazione da altre sostanze tossiche;
Emocromatosi, un disturbo ereditario che causa l'accumulo di ferro nel corpo,
portando nel lungo periodo ad un danno per il fegato;
Steatosi, un accumulo di lipidi nel fegato;
Echinococcosi epatica;
Epatomi;
Metastasi secondarie di tumori in altri organi o distretti corporei;
Malattia di Wilson, un disturbo ereditario che causa l'accumulo di rame nel corpo;
Sindrome di Budd-Chiari, ovvero l'ostruzione delle vene epatiche;
Sindrome di Gilbert, una malattia genetica del metabolismo della bilirubina.
Le corrette funzionalità del fegato possono essere verificate attraverso numerosi test clinici dedicati, che misurano la presenza o l'assenza di enzimi tipici, metaboliti o sostanze legati ad una regolare attività del fegato.
1.1 L’insufficienza epatica
L’ insufficienza epatica si distingue in acuta senza precedenti di epatopatia (acute liver failure, ALF), acuta su patologia cronica ( acute on chronic liver failure, AoCLF ), cronica terminale.
L’insufficienza epatica acuta ha eziologia complessa: può essere legata a patologia virale (epatite B), a ingestione di farmaci (paracetamolo), anche per usi impropri o al di fuori
17
delle indicazioni previste, o tossici (ecstasy); può associarsi a patologia metabolica (malattia di Wilson) e condizioni di ipercoagulità (sindrome di Budd-Chiari).
L’andamento cosiddetto fulminante o subfulminante si caratterizza per la presenza di encefalopatia che segue con variabile intervallo di tempo al danno epatico: fulminante se l’encefalopatia si sviluppa entro due settimane dalla comparsa dell’ittero, subfulminante se l’encefalopatia si sviluppa tra due settimane e tre mesi dalla comparsa dell’ittero. L’ittero è presente quasi sempre e inoltre si hanno alterazioni della coagulazione, il profilo emodinamico tendenzialmente iperdinamico, il deterioramento della funzione renale, la modificazione degli scambi respiratori, le modificazioni metaboliche (acidosi, ipoglicemia), la tendenza alle infezioni. La mortalità in era precedente il trapianto epatico era assai elevata e spesso vicina al 70-90%. Il trapianto di fegato ha sostanzialmente modificato la storia di questa patologia portando al 68% la probabilità di sopravvivenza dei soggetti sottoposti a trapianto.
Criteri prognostici in caso di ALF sono il pH, il profilo coagulativo, il valore di creatinina e il grado di encefalopatia. L’encefalopatia, associata a generazione di glutammina e produzione di ammonio a livello di astrociti, è caratterizzata dalla riduzione del livello di
coscienza, dall’aumento della pressione endocranica, dallo sviluppo di edema cerebrale. Il profilo cardiocircolatorio del paziente con insufficienza epatica acuta è caratterizzato
da sindrome ipercinetica, con elevato indice cardiaco (> 5L min-1 m-2), pressione arteriosa media vicina ai limiti inferiori, basse resistenze vascolari sistemiche e polmonari, pressioni di riempimento medio-basse. L’aumento della portata cardiaca è sostenuto sia
da un aumento del volume sistolico che da un aumento della frequenza cardiaca. Nel caso di insufficienza epatica, nel 40-50% dei casi è presente anche insufficienza
renale e inoltre il paziente è particolarmente predisposto alle infezioni. Questo perché è ridotta la funzione fagocitica dei macrofagi.
Il trattamento intensivo del paziente con ALF comincia oggi a disporre di supporti artificiali da utilizzare come:
Ponte per il trapianto (Bridge to transplant);
Ponte per il recupero (Bridge to recovery) dallo scompenso epatico;
18
Supporto fisiologico dopo chirurgia al fegato per trauma o rimozione di tumore. Il trapianto di fegato è attualmente l’unica terapia efficace per il trattamento dell’insufficienza epatica fulminante. In ogni caso il 10%-30% dei pazienti con insufficienza epatica fulminante possono rigenerare il loro fegato grazie ad una adeguata terapia farmacologica. Infatti gli epatociti mantengono la capacità di dividersi in vivo; quindi il recupero da un’epatite è in ogni caso possibile anche se è raro che il fegato riesca a rigenerarsi prima che il paziente soccomba alla malattia. Se compare in soggetti che non presentavano precedenti patologie del fegato, si hanno ottime possibilità di invertire il processo degenerativo e di raggiungere il completo recupero del fegato. Questo spiega l’importanza di individuare delle tecniche che permettano non tanto di creare un organo artificiale da sostituire permanentemente, quanto degli apparati in grado di fornire un adeguato supporto al fegato malato.
1.2 La rigenerazione epatica
Già nell’antica Grecia si erano resi conto che il fegato è l’unico organo umano capace di rigenerarsi. Infatti, nella mitologia greca, quando Prometeo fu punito dagli dei per aver rivelato agli esseri umani il segreto del fuoco, per punizione fu incatenato ad una roccia e ogni giorno un avvoltoio gli mangiava il fegato, che si rigenerava ogni notte.
Il fegato è in grado di raddoppiare la sua massa di epatociti in circa un giorno e su questa capacità rigenerativa si fonda il trattamento delle malattie degenerative dell’organo. Se il processo rigenerativo spontaneo non è possibile, l’unica alternativa è rappresentata dal trapianto.
19
Capitolo 2
I dispositivi di supporto al fegato
Può essere fatto molto poco per aumentare il numero di donatori di fegato mentre è ragionevole cercare mezzi artificiali di sostituzione e/o assistenza con lo scopo di sostenere i pazienti con massa delle cellule del fegato funzionale borderline fino a quando un organo diventa disponibile per il trapianto o fino a quando il fegato recupera da un infortunio. Un fegato artificiale potrebbe anche sostenere i pazienti durante i periodi di recupero funzionale dopo trapianto di fegato marginale e dopo chirurgia per trauma o rimozione di tumore.
Le terapie di supporto epatico prevedono due diversi approcci: uno di tipo biologico e uno di tipo non biologico. Mentre quelli di tipo biologico utilizzano epatociti o l’organo intero (sia di origine animale che umana), quelli non biologici utilizzano tecniche dialitiche di filtrazione e adsorbimento. I metaboliti associati al danno epatico si differenziano tra loro per peso molecolare e caratteristiche chimico-fisiche e gran parte delle tossine è legata all’albumina (bilirubina, bile, aminoacidi e acidi grassi). Un’altra porzione di tossine è invece rappresentata da quelle idrosolubili di basso o medio peso molecolare derivanti o dal danno epatico (ammonio) o dal danno renale, efficacemente rimosse con l’emodialisi o l’emofiltrazione. I metodi convenzionali non sono comunque efficaci nella rimozione delle tossine legate all’albumina. Sono proprio queste sostanze a rivestire un ruolo principale nella fisiopatologia delle complicanze del danno epatico quali l’encefalopatia epatica. L’ipotesi dell’intossicazione da tossine endogene è considerata la spiegazione più accreditata per giustificare gli eventi che si verificano in corso di insufficienza epatica e che determinano un rischio per la vita. Tossine di varia
20
natura, di diverso peso molecolare, libere o veicolate dalle proteine, sono responsabili delle diverse manifestazioni cliniche che caratterizzano questa sindrome. Le tossine accumulate danneggiano il fegato ed innescano un meccanismo vizioso per cui la malattia stessa si autoalimenta, si aggrava e si perpetua. L’aumentata concentrazione sierica di bilirubina, acidi biliari, ossido nitrico, ammonio, lattati, fenoli, aminoacidi aromatici, benzodiazepine endogene, correla con la gravità della epatopatia. L’albumina è
il principale trasportatore di proteine. Il concetto di dialisi con albumina è stato sviluppato proprio per rimuovere le sostanze legate all’albumina; è un nuovo metodo che combina l’efficacia di sorbenti per la rimozione di sostanze legate all’albumina, con la biocompatibilità delle moderne membrane di dialisi.
I sistemi di supporto artificiale non biologico, gravati da costi inferiori e caratterizzati da una gestione più semplice sotto il profilo logistico, risultano maggiormente sperimentati in termini di valutazione e applicazione clinica rispetto ai sistemi bioartificiali.
2.1 Sviluppo dei sistemi di purificazione del sangue
1958 Killey Treatment of a hepatic coma patient using hemodialysis
1958 Schechter Treatment of a hyperammonemia patient using an ion-exchange column
1958 Lee, Tink Exchange transfusion
1958 Hori Cross-hemodialysis using living dogs 1965 Yatzidis Bilirubin adsorbent using activated charcoal
1965 Eisemann Initial clinical use of ECLP using a resected porcine liver
1967 Burnell Cross-hemodialysis between a patient in hepatic coma and a healthy donor
1968 Sabin Plasma exchange (Plasmapheresis)
1970 Abouna Clinical use of ECLP using a xenogeneic liver
1976 Opolon Treatment of a patient with fulminant hepatitis using a dialyzer made of a polyacrilonitril membrane
1976 Knell, Dukes
Control of amino acid imbalance using BCAA solution
1978 Yamazaki Incorporated system of plasmapheresis and hemodialysis 1980 Brunner Bioreactor immobilized with hepatic enzymes
21
1982 Ozawa Cross-hemodialysis using porcine and baboon livers 1985 Teraoka XDHP and CPP using porcine liver
1987 Matsumura Perfusion system of suspended rabbit hepatocytes 1988 Marguilis Perfusion system of suspended porcine hepatocytes
1992 Yoshiba Incorporated system of plasmapheresis and hemodiafiltration 1993 Demetriou Bioreactor system of immobilized porcine hepatocytes 1994 Gerlach Bioreactor system of immobilized hepatocytes
2000 Stange Molecular adsorbent recirculating system (MARS)
Tabella 2.1: Lo sviluppo delle terapie di purificazione del sangue nel trattamento dell’insufficienza epatica.
La tabella mostra lo sviluppo della terapia di purificazione del sangue per insufficienza epatica. Nel corso del 1950, l’emodialisi è stata introdotta come trattamento ottimale per insufficienza renale. Questa rimuoveva sostanze uremiche basandosi sulla teoria della diffusione, in cui il soluto si muove secondo un gradiente di concentrazione. L’emodialisi, utilizzata in medicina clinica quotidiana come un’affidabile terapia per i pazienti con insufficienza renale, nel 1958, è stata effettuata su pazienti con insufficienza epatica, nel tentativo di eliminare le tossine responsabili di encefalopatia epatica. Killey ha svolto uno studio su 5 pazienti con insufficienza epatica cronica di cui 4 dei quali hanno mostrato un miglioramento nella loro encefalopatia metabolica, anche se la sopravvivenza a lungo termine non è stata raggiunta.
Per la rimozione più aggressiva di molecole proteiche sono state sviluppate due forme di sostegno del fegato: l’emoperfusione e la plasmaperfusione. Nel 1958, Schechter introdusse l’emoperfusione extracorporea diretta su matrici di resina di scambio ionico, che ha permesso la rimozione dell’ammoniaca nel sangue e l’inversione del coma nel 20% dei pazienti. Sempre nel 1958, Lee e Tink ebbero successo con il trattamento di un paziente in coma epatico attraverso la trasfusione di sangue fresco. Questo trattamento sarà poi sostituito dall’efficace metodo di scambio del plasma. Un considerevole vantaggio è stato acquisito utilizzando carbone attivo come adsorbente di possibili tossine, nel range compreso tra 500 e 5000 dalton, nel sangue intero e nel plasma di pazienti con insufficienza epatica. Nel 1965, Yatzidis ed altri svilupparono una colonna
22
di carbone attivo per la rimozione di bilirubina sierica, che viene ancora usata per i pazienti affetti da iperbilirubinemia. I suoi primi effetti collaterali principali sono stati la perdita di piastrine e shock anafilattico. Uno degli approcci più semplici a sostegno del fegato biologico è la cross-circolazione, scoperta nel 1967 da Burnell. In questa tecnica, che viene eseguita in anestesia generale, la circolazione dei pazienti con insufficienza epatica è collegata direttamente a quella di donatori umani sani, che soffrivano di gravi reazioni avverse durante la procedura.
Lo scambio del plasma, o plasmaferesi, è stato introdotto da Sabin nel 1968. Questa tecnica separava il plasma utilizzando una centrifuga o una membrana, e veniva poi scartato e sostituito con un volume equivalente di plasma fresco. Yamazaki ha sviluppato una tecnica di combinazione di plasmaferesi ed emodialisi che si è rivelato efficace per invertire il coma epatico e migliorare la coagulazione. Un problema per questo metodo era la necessità di un grande volume di plasma fresco come sostituto.
Durante gli ultimi anni ‘60, Henderson creò un nuovo approccio al metodo di emofiltrazione utilizzando una membrana di polisolfone. Considerando membrane cellulosiche permeabili a piccole molecole idrosolubili, nel 1976, Opolon utilizzò membrane poliacrilonitriliche per migliorare il trasferimento di sostanze, diffusive fino a 15000 dalton, rimuovendo così soluti di peso medio e piccoli peptidi. In uno studio clinico di 24 pazienti con epatite virale acuta fulminante, l'emodialisi con questa membrana ha raggiunto un tasso di inversione del coma del 54%, ma i tempi di sopravvivenza non sono migliorati. Una conclusione importante da questi esperimenti è che le sostanze inferiori a 15000 dalton di peso molecolare sono state associate ad encefalopatia metabolica.
Anche nel 1976, Knell e Duchi introdussero la dialisi reciproca in cui è stato utilizzato un fluido di dialisi con una concentrazione amminoacidica identica a quella del plasma normale per correggere l’aumento di amminoacidi aromatici e la diminuzione di amminoacidi a catena ramificata. L'emodialisi è efficace nella rimozione di molecole di piccole dimensioni, con peso molecolare inferiore a 5000 Dalton mentre l’emofiltrazione è particolarmente efficace nella rimozione di molecole di dimensioni più grandi, aventi un peso molecolare compreso tra 5000 e 10000 Dalton. Quindi, una terapia di
23
combinazione di emodialisi ed emofiltrazione ha il potenziale di essere una terapia ideale per insufficienza renale ed epatica. Nel 1977, Ota sviluppò il metodo di emodiafiltrazione (HDF), in cui viene rimossa una grande quantità di acqua ma viene fornita soluzione fisiologica per regolare la quantità di rimozione dell'acqua. In questo metodo, un dializzatore costituito da una membrana a fibra cava con dimensione dei pori più grandi rispetto a quelli presenti nell’emodialisi ordinaria, consente la rimozione di molecole più grandi. Nel tentativo di fornire una terapia più specifica di disintossicazione, nel corso del 1980 sono stati sviluppati sistemi enzimatici immobilizzati. In questi sistemi, il sangue è perfuso sopra enzimi epatici che sono o legati ad un substrato insolubile o incapsulati in cellule artificiali. Durante i primi anni ‘90, Yoshiba trattò 27 pazienti che avevano epatite fulminante, utilizzando lo scambio del plasma in combinazione con emodiafiltrazione continua, utilizzando una membrana ad alte prestazioni (polimetilmetacrilato). Il trattamento è stato considerato di successo per 15 dei 27 pazienti trattati.
Stange e Mitzner hanno introdotto un nuovo metodo di dialisi utilizzando il loro sistema di ricircolo assorbente molecolare, originariamente sviluppato, e applicato su 26 pazienti con sindrome epato-renale. Essi hanno riportato una diminuzione significativa dei livelli di creatinina sierica di bilirubina nei gruppi trattati, che ha permesso a questa procedura di essere una delle opzioni più importanti per il trattamento di insufficienza epatica. Lo scopo del trattamento di depurazione del sangue, nel caso di insufficienza epatica, è la rimozione delle tossine, causa di coma ed edema cerebrale. Come detto precedentemente, le prime applicazioni cliniche di purificazione del sangue includevano l'emodialisi, l’emoperfusione con carboni, lo scambio del plasma, l’emodiafiltrazione continua e la criofiltrazione. Anche se questi trattamenti migliorano l’encefalopatia, la sopravvivenza del paziente non è stata ancora raggiunta.
Il fegato ha più di 500 diverse funzioni, che sono difficili da sostituire con uno o alcuni metodi sostitutivi, e questo ha provocato molta ricerca nell’ambito del tessuto epatico. Nel 1958, Hori et al hanno condotto uno studio sul trattamento di perfusione utilizzando fegati xenogenici e un metodo di cross-emodialisi costituito da circuiti di sangue di un paziente con cirrosi e quattro cani in vita. I circuiti erano separati da una membrana semipermeabile, attraverso la quale i prodotti di scarto di basso e medio peso molecolare
24
passavano dal circuito del paziente al circuito degli animali per essere metabolizzato dal fegato canino e assorbito in una matrice di resina a scambio ionico. Questo trattamento è stato applicato su quattro pazienti con cirrosi, uno dei quali ha recuperato temporaneamente dal coma epatico, dopo una notevole diminuzione dei livelli sierici di ammoniaca.
Figura 2.1: Trattamento di Cross-emodialisi con l’utilizzo di quattro cani vivi (Hori et al 1958).
Dopo uno studio clinico iniziale di Eisemann et al nel 1965, in cui utilizzarono un fegato intero di suino per emoperfusione diretta, molti gruppi di ricerca hanno condotto studi clinici di perfusione extracorporea del fegato (ECLP). Abouna et al hanno chiarito che gli esseri umani hanno risposte immunitarie alle proteine di maiale e che si sono verificate reazioni anafilattiche al fegato di un'altra specie.
25
Nel 1974 in Giappone, sono stati condotti anche studi clinici di ECLP. Kawamura et al hanno clinicamente applicato ECLP usando fegato suino su un paziente in coma epatico da intossicazione acuta da fosforo. Durante i primi anni ‘80, Ozawa et al hanno sviluppato un metodo di cross- emodialisi usando un fegato asportato di suino o di babbuino, raggiungendo un tasso di sopravvivenza globale del 27% in 13 pazienti con insufficienza epatica grave. Nel 1985, Teraoka et al utilizzarono un fegato intero asportato di suino per trattare l'insufficienza epatica, con emoperfusione diretta per un paziente e perfusione del plasma incrociata per due pazienti.
Nel 1990, un rinnovato interesse, sulla base di studi sperimentali, ha portato Fox et al ad utilizzare ECLP nella gestione di tre pazienti con insufficienza epatica fulminante. Hanno usato fegati di cadaveri umani, che hanno migliorato il tempo di perfusione a 72 h, permettendo così il trapianto di fegato a due pazienti. Nuove prove di ECLP vengono effettuate utilizzando fegati suini transgenici. Un altro supporto bioartificiale è il sistema ibrido bioartificiale per il fegato in cui epatociti isolati con soluzione chelante e soluzione di collagenasi sono coltivati in dispositivi artificiali. Nel 1987, Matsumura et al hanno segnalato il primo uso clinico di un sistema di coltura di epatociti utilizzando una camera di emodialisi, in cui sono stati posti circa 100 g di epatociti di coniglio crioconservati. Gli epatociti sono cellule ancoraggio-dipendenti che devono aderire per sopravvivere. Demetriou et al svilupparono un sistema di bioreattori a fibre cave entro cui epatociti suini sono seminati nello spazio extrafibra. Gerlach et al introdussero un altro interessante disegno di bioreattore, che è un tessuto tridimensionale costituito da una rete capillare contenente epatociti immobilizzati negli spazi extrafibra. In Italia, Flendrig e Van de Kerkhove et al svilupparono un bioreattore utilizzando poliestere. Patzer et al esaminarono l'efficacia dell’emoperfusione rispetto alla perfusione di plasma utilizzando un bioreattore a fibre cave, che è attualmente utilizzata per l’uso clinico con epatociti suini.
27
CAPITOLO 3
I dispositivi artificiali
Di seguito è riportata una descrizione dei vari trattamenti artificiali di purificazione del sangue.
3.1 Emodialisi
Nel 1958, Kiley utilizzò l’emodialisi per trattare l’insufficienza epatica causata da cirrosi epatica. Aveva trattato 5 pazienti che soffrivano di intossicazione da ammoniaca. Anche se 4 pazienti ebbero un miglioramento sintomatico del loro stato neurologico, nessuno sopravvisse a lungo. Nel 1976 Opolon utilizzò una membrana di poliacrilonitrile nel trattamento di epatite acuta fulminante. Questa membrana rimosse la maggior parte delle molecole ad alto peso molecolare, associate ad encefalopatia. Il recupero da encefalopatia fu significativo, tuttavia non ci furono variazioni del tasso di sopravvivenza.
L’emodialisi con membrane convenzionali in cellulosa (punto di cut-off di 2000 Dalton), membrane permeabili in polisulfoni o poliacrilonitrile (punto di cut-off di 1500-5000 Dalton) aiutano a ristabilire l’equilibrio elettrolitico e acido-base e ridurre la concentrazione di ammonio nel sangue ma non sono in grado di eliminare le grandi molecole di tossine legate alle proteine plasmatiche. Il miglioramento delle condizioni del paziente è modesto e temporaneo e non vi è alcun effetto dimostrato sulla sopravvivenza del paziente.
28
Si possono distinguere tre tipi di emodialisi:
Emodialisi convenzionale, che utilizza una membrana a basso flusso (piccoli pori) e la rimozione del soluto avviene principalmente per diffusione.
Emodialisi “high-efficiency”, che utilizza una membrana a basso flusso con alta efficienza per la rimozione del soluto; tipicamente l’alta efficienza è raggiunta utilizzando una membrana con una superficie grande.
Emodialisi ad “high-flux”, che utilizza una membrana ad alto flusso (pori più grandi), rendendola più efficiente nella rimozione di soluti più grandi rispetto a quella convenzionale (a basso flusso).
3.2 Emofiltrazione
L’Emofiltrazione è realizzata con membrane filtranti ad alto punto di cut-off (circa 50000 Dalton) in cellulose modificate o polisulfoni. Queste membrane riescono a separare sostanze naturali e tossiche, entro i limiti imposti da fenomeni di trasporto convettivo, attraverso la membrana di scambio. I risultati ottenuti, anche in questo caso, sono scarsi. Queste procedure hanno un effetto favorevole temporaneo sull’encefalopatia epatica (forse a causa della correzione dei livelli tossici di certi aminoacidi) con ritorno del coma, ma non aumentano il tasso di sopravvivenza.
3.3 Emoperfusione
L’Emoperfusione è un processo di circolazione extracorporea del sangue attraverso elementi assorbenti (es. carboni attivi) o attraverso reattori biochimici di elevata complessità, che sono in grado di trattare specifici prodotti biologici, come ad esempio l’ammonio. Il problema più grande che affligge l’emoperfusione è l’emocompatibilità degli elementi filtranti o assorbenti, in particolare verso le componenti corpuscolari del sangue. I problemi di emocompatibilità sono legati in parte al deposito di polveri associate al materiale stesso ed in parte all’attivazione delle piastrine in pazienti con uno stato di coagulazione già compromesso. Per questo motivo, sottili film protettivi di materiale polimerico, emocompatibile, come nitrato di cellulosa, albumina o similari,
29
sono impiegati per rivestire gli elementi filtranti, in modo da eliminare il contatto filtro-sangue.
L’emoperfusione diretta è quindi un metodo di adsorbimento delle tossine nel sangue per mezzo dell’utilizzo di materiali adsorbenti. L’adsorbimento è un processo per cui il soluto si diffonde in un solido poroso ed aderisce alle superfici interne.
Il primo utilizzo fu riportato per il trattamento di overdose da barbiturici. Da allora è stato ampiamente utilizzato per il trattamento di insufficienza epatica. L’emoperfusione, realizzata mediante circolazione extracorporea di sangue su materiali adsorbenti non specifici (es. carboni attivi), non ha avuto importanti successi clinici sulla sopravvivenza nel lungo termine.
L’emoperfusione con carbone può rimuovere grandi molecole associate ad encefalopatia, che non passerebbero attraverso membrane per dialisi o emofiltrazione, ma materiali adsorbenti non specifici possono impoverire il plasma di sostanze biologicamente importanti.
3.4 Reattori con enzimi immobilizzati
Per dare una risposta al problema della specificità nella detossificazione, particolari enzimi sono stati:
• o attaccati a fibre cave
• o fatti circolare nel compartimento chiuso del dialisato di un rene artificiale • o incorporati in microcapsule esposte al sangue
Risultati in vitro hanno dimostrato evidenze sull’efficacia di questo approccio, ma nessuno studio clinico ha dimostrato risultati superiori dei reattori con enzimi rispetto ad altre modalità di dialisi: miglioramenti dello stato mentale dei pazienti in coma epatico, ma nessuna dimostrazione di aumento del tasso di sopravvivenza. Non è chiaro se l’insuccesso di questa tecnica sia dovuto all’inabilità degli specifici enzimi di rimuovere tutte le tossine dannose o se è evidente la necessità di qualcosa in più della detossificazione per un trattamento efficace.
30
3.5 Scambio del plasma
Lo scambio del plasma, o plasmaferesi, è un metodo per separare il plasma dagli elementi corpuscolati del sangue utilizzando filtri a fibra cava fatti con membrane di diacetato di cellulosa e polietilene. La plasmaferesi fu utilizzata per la prima volta per l’insufficienza epatica da Lepore e Martel nel 1970.
La logica dello scambio del plasma per il trattamento di insufficienza epatica è quella di rimuovere le tossine e fornire i componenti in difetto, come l’albumina e i fattori della coagulazione. Sembrava che la plasmaferesi fosse associata ad un recupero dal coma epatico e ad un miglioramento statisticamente significativo degli indici della coagulazione per i pazienti con insufficienza epatica acuta. Tuttavia, sia il rischio di infezione, sia la necessità di grandi quantitativi di costoso plasma fresco congelato, hanno reso difficile continuare la terapia di plasmaferesi per insufficienza epatica negli ultimi anni. Studi controllati sono necessari per stabilire gli effetti benefici di scambio del plasma sulla sopravvivenza del paziente.
3.6 Emodiafiltrazione
L’emodiafiltrazione (HDF) è basata sul presupposto che le molecole di medie dimensioni sono responsabili del coma epatico in pazienti con insufficienza epatica fulminante (FHF). Questo metodo utilizza una membrana ad alte prestazioni, come la membrana con pori larghi in polimetilmetacrilato (PMMA), sviluppata nel 1986. In studi retrospettivi, i pazienti hanno mostrato un recupero completo dal coma profondo e la sopravvivenza nei casi di grave insufficienza epatica fulminante.
3.7 Scambio del plasma ed emodiafiltrazione continua
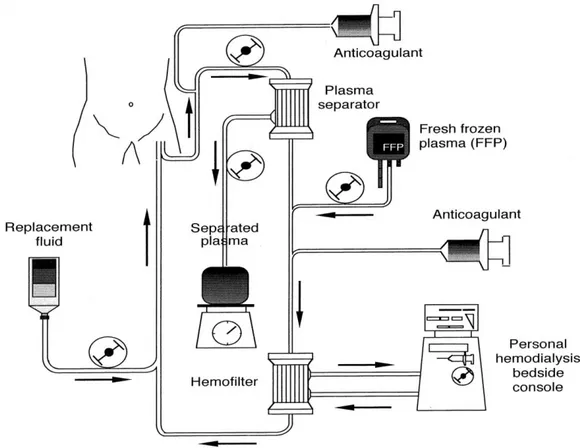
Per rimuovere efficacemente le sostanze di medio peso molecolare, come le tossine epatiche, e minimizzare gli effetti negativi associati alla plasmaferesi, Nitta sviluppò un trattamento di plasmaferesi lento in combinazione con un alto flusso continuo di emodiafiltrazione. Con uno studio svolto su cinque pazienti con insufficienza epatica, hanno concluso, quindi, che gli effetti negativi associati allo scambio del plasma (come
31
ipernatriemia, alcalosi metabolica, forte diminuzione della pressione osmotica dei colloidi) potevano essere minimizzati utilizzando la plasmaferesi in combinazione con la continua emodiafiltrazione. In Giappone, questa è la terapia usata maggiormente per trattare l’insufficienza epatica acuta. Il 35% -40% dei pazienti riescono a recuperare attraverso questo trattamento, mentre i restanti rimangono in attesa di trapianto.
Figura 3.1: Il diagramma del flusso e le condizioni operative dello scambio del plasma unito ad emodiafiltrazione continua.
3.8 Criofiltrazione
La criofiltrazione è una tecnica di immunomodulazione extracorporea, originariamente introdotta da Malchesky nel 1980. La criofiltrazione per il trattamento del plasma utilizza due filtri, un separatore di plasma e un criofiltro. Il sangue del paziente è portato al primo filtro in cui il sangue viene separato e il plasma è raffreddato, in presenza di eparina, in uno scambiatore di calore. Il plasma è poi filtrato attraverso un secondo filtro costituito da diacetato di cellulosa. Le indicazioni principali per l’utilizzo di questo trattamento
32
sono malattie complesse immunitario tra cui artrite reumatoide, lupus eritematoso sistemico (SLE), polimiosite, cirrosi biliare primitiva e il rigetto cronico di un innesto. Il vantaggio di questa modalità è che non vi è alcuna necessità di grandi volumi di plasma, che può essere causa di infezione. Questa procedura può essere applicata su pazienti con FHF perché il disordine immunologico può svolgere un ruolo importante nella patogenesi dell’insufficienza epatica fulminante. La criofiltrazione in combinazione con la plasmaferesi ha migliorato la persistente colestasi, iperbilirubinemia e coma epatico. Tuttavia, il tasso di sopravvivenza non è variato.
Figura 3.2: Il sistema di criofiltrazione.
Tutti questi trattamenti, basati sulla rimozione delle tossine nel sangue, non hanno modificato il tasso di sopravvivenza dei pazienti. Questo perché la maggior parte delle tecniche descritte rimuove in modo predominante le sostanze solubili in acqua mentre quelle legate alle proteine si accumulano nello scompenso epatico. Inoltre, la rimozione involontaria di vari fattori di crescita ha ritardato il processo di rigenerazione epatica.
Plas
m
a sep
arato
r
Cooling
chamber
Cr
yofi
lt
er
Cryogel
33
La dialisi con albumina utilizzata nel sistema MARS e nel Prometheus (PROM) rappresenta il nuovi sistema di supporto epatico non biologico specificamente progettata per rimuovere le sostanze legate all’albumina.
3.9 Terapia molecolare del sistema di ricircolo assorbente (MARS)
Il sistema di ricircolo assorbente molecolare si è mostrato utile nella rimozione altamente selettiva delle tossine solubili in acqua e delle sostanze di basso e medio peso molecolare associate all’albumina, attraverso una membrana ad alto flusso, come ad esempio la membrana in polisolfone. Il MARS è il supporto di fegato artificiale più utilizzato nonché il sistema di detossicazione meglio studiato in caso di insufficienza epatica. E’ stato introdotto clinicamente nel 1993 ed è basato sul principio della dialisi con albumina. Il MARS consiste di una macchina standard per la dialisi, che guida il circuito ematico extracorporeo, e di un dispositivo supplementare per eseguire e monitorare il circuito chiuso con albumina. E’ costituito da due circuiti: il circuito del sangue (circuito primario) e il circuito dell’albumina (circuito secondario).
34
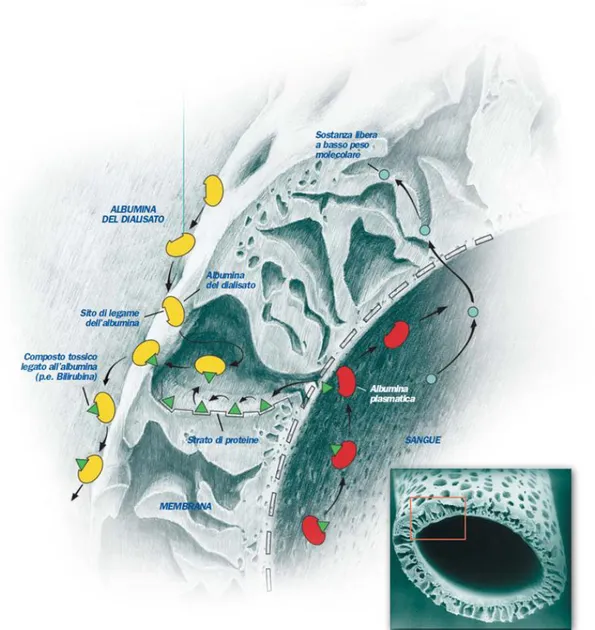
E’ stato utilizzato un dializzatore altamente permeabile, impregnato di albumina; il circuito chiuso del dializzato è stato innescato con 600 ml, di cui il 20% costituito di albumina sierica umana, ed è rigenerato attraverso un dializzatore a basso flusso, una colonna di carbone e uno scambiatore anionico. Il sangue esce dal paziente attraverso un catetere da dialisi venoso centrale. Nel circuito primario, il sangue del paziente passa attraverso un emofiltro con una dimensione di soglia di selezione (cut-off) inferiore ai 60 kDa, in modo da mantenere così l’albumina sul lato sangue. In un circuito secondario viene fatta circolare una soluzione di albumina al 20%, che passa attraverso l’emofiltro in controcorrente rispetto al sangue del paziente e agisce come dializzato. Le tossine nel sangue del paziente che dissociano dal legame con l’albumina possono attraversare la membrana seguendo il gradiente di concentrazione per legarsi all’albumina del circuito secondario. Questo accade secondo la teoria del gradiente di disponibilità del legame. Infatti, l’albumina presente nel dialisato ha tutti i siti disponibili, al contrario di quella presente nel sangue.
35
Figura 3.4: l’eliminazione delle tossine a livello della membrana MARS
La membrana è impermeabile all’albumina e solo la frazione libera di tossine può attraversarla e questo è il fattore limitante per l’eliminazione di composti con forte legame con l’albumina, come la bilirubina. L’ albumina, nel lato del dialisato, che lascia il primo dializzatore è saturata sia con le tossine epatiche legate all’albumina sia con i soluti solubili in acqua non legati alle proteine. Nel circuito secondario la soluzione di albumina subisce prima una dialisi, utilizzando un filtro ad alto flusso per eliminare le tossine solubili in acqua attraverso il movimento in controcorrente di un dialisato fresco ricco di bicarbonato. Quindi l’albumina che lascia il secondo dializzatore ha una bassa concentrazione di tossine uremiche ma ha ancora un’alta concentrazione di tossine
36
epatiche. Successivamente la soluzione è rigenerata passando attraverso due adsorbenti: una resina a scambio anionico e una colonna di carbone attivo. La resina a scambio ionico assorbe gli acidi biliari mentre la colonna di carbone non rivestita la bilirubina. Solitamente il trattamento adsorbente tramite cartucce di carbone richiede il rivestimento delle colonne con strato sintetico per evitare reazioni immunologiche; in questo caso il carbone non entra in contatto con il sangue del paziente. Il passaggio di albumina attraverso queste due colonne adsorbenti permette la rigenerazione e la pulizia dalle tossine epatiche. Nel momento in cui l’albumina esce dalla colonna di resina e rientra nel comparto del dialisato del primo dializzatore dovrebbe avere una più bassa concentrazione sia di tossine epatiche legate alla proteina sia dei soluti uremici. Mentre il dialisato ricco di bicarbonato è un circuito aperto e quindi con una capacità potenzialmente illimitata per la dialisi delle tossine uremiche, il comparto del dialisato ricco di albumina è chiuso e ha teoricamente un intrinseco limite assorbente. Una sessione MARS dura 6-8 ore, e dopo quel tempo la capacità di rigenerazione dell’albumina degli adsorbitori diminuisce significativamente.
Riduzioni significative della bilirubina sierica, acidi biliari, livelli di ammoniaca, urea, lattato e creatinina sono ripetutamente state documentate con una terapia MARS. La bilirubina totale e la bilirubina coniugata sono ridotte, mentre non si osserva nessun cambiamento nei livelli di bilirubina non coniugata. MARS non interferisce con molecole preziose come l’albumina, fattori di coagulazione ed elettroliti, non altera il numero delle cellule del sangue e i gas del sangue arterioso e non genera instabilità emodinamica. Il miglioramento della pressione arteriosa media, la resistenza vascolare sistemica, la gittata cardiaca e il flusso sanguigno cerebrale (dovuto alla riduzione dell’edema cerebrale) sono stati più volte dimostrati.
Il risultato clinico dipende molto dalla eziologia della insufficienza epatica. I tassi di sopravvivenza al momento della scoperta variavano tra il 60% e il 70% in pazienti sia con ALF o A-on-C LF di varie eziologie. In uno studio, in cui la terapia MARS era usato per trattare 56 pazienti con ALF di varie eziologie, il tasso di sopravvivenza era dell’88% a 6 mesi e dell’84% a 1 anno. La più alta incidenza di recupero del fegato è stata osservata in pazienti con ALF causata da intossicazione.
37
Il vantaggio di MARS è che è facile da usare e poco costoso rispetto ai dispositivi bioartificiali. La maggior parte degli studi clinici condotti con MARS sono stati effettuati
su pazienti con insufficienza epatica acuta cronica (ACLF), non su quelli con insufficienza epatica acuta (ALF). In uno studio, pazienti con ACLF con sindrome epatorenale a rapida insorgenza di tipo I sono stati trattati con MARS e terapia medica standard, tra cui emodiafiltrazione. Il trattamento MARS ha migliorato significativamente la sopravvivenza; infatti, i tassi di mortalità nei pazienti trattati con la terapia medica standard erano 100% al settimo giorno rispetto al 63% per i pazienti trattati con MARS. Il metodo è anche risultato sicuro, senza effetti collaterali indesiderati. Così, si è concluso che MARS sembrava essere utile come un ponte al trapianto di fegato. Il più recente studio controllato randomizzato è stato eseguito su 24 pazienti con ACLF con progressiva iperbilirubinemia. MARS è stato associato ad un miglioramento della sopravvivenza a 30 giorni; inoltre, la disfunzione renale e l’encefalopatia epatica sono migliorate nel gruppo MARS. Si era giunti alla conclusione che MARS sembrava essere efficace e sicuro per il trattamento a breve termine dei pazienti con cirrosi epatica e
sovrapposta a lesione acuta, associata a progressiva iperbilirubinemia.
Gli unici rilevanti svantaggi derivati dall'uso di MARS sono l’eparizzazione, il collasso, per il semplice fatto che il paziente è connesso ad un circuito extracorporeo e la trombocitopenia, che è la retrodiffusione del carbone fino al sangue del paziente.
38
Figura 3.7: Il funzionamento del sistema MARS. Figura 3.5: Catetere venoso centrale.
39
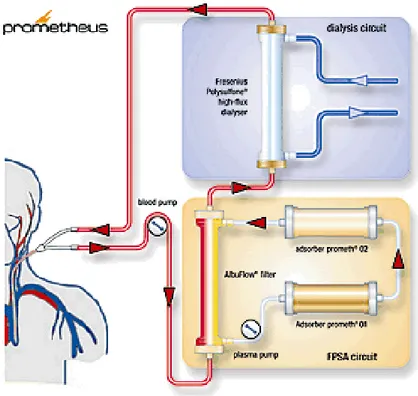
3.10 Prometheus
Il sistema Prometheus è costituito da un circuito primario (plasmafiltro e dializzatore) ed uno secondario (filtri adsorbenti per la rimozione della bilirubina) e realizza una rimozione combinata di molecole tossiche legate all’albumina e di molecole tossiche idrosolubili mediante l’utilizzo di un sistema di adsorbimento e separazione frazionata del plasma (Fractionated Plasma Separation and Adsorption FPSA) che è stato sviluppato nel 1999 da Falkenhagen et al. Diversamente da MARS, la frazione composta dall’albumina passa attraverso una membrana di polisulfone, un plasmafiltro AlbuFlow (Fresenius) con cut-off di circa 250 kDalton. Questa membrana permette il passaggio della frazione contenente l’albumina, delle sostanze ad essa legate e di tutte le componenti del plasma di peso inferiore a 250 kDalton, nel circuito secondario, in cui il plasma viene purificato dalle tossine legate all’albumina mediante adsorbimento diretto su speciali supporti adsorbenti. Quindi, in una prima fase, la frazione albumina del sangue viene selettivamente filtrata attraverso uno specifico polisulfone ed entra in un circuito secondario in cui questa frazione plasmatica viene filtrata attraverso due colonne adsorbenti: il primo è un adsorbente a resina stirenica neutra, che assorbe principalmente le citochine ( bilirubina e acidi biliari) e il secondo adsorbitore è un scambiatore anionico per la rimozione di tossine a carica negativa. E’ possibile aumentare la quantità di plasma trattato indipendentemente dalla quota di sangue fornita al circuito. Il sangue, poi, si va a ricomporre alla frazione non trattata e successivamente viene effettuata una dialisi convenzionale ad alto flusso, allo scopo di rimuovere le sostanze idrosolubili. Infatti l’emofiltro è impermeabile all’albumina ma permeabile alle tossine idrosolubili. Per integrare i due circuiti è utilizzato un monitor di emodialisi modificato. Un catetere di dialisi standard a doppio lume viene connesso al circuito ematico extracorporeo (circuito primario) e come nel trattamento MARS si utilizza un catetere venoso centrale; la membrana AlbuFlow separa il circuito primario dal secondario, che contiene il plasma filtrato. Dal momento che i circuiti hanno un funzionamento indipendente dall’unità, l’operatore può decidere se effettuare una emodialisi convenzionale o se associarla alla detossificazione albuminica. Il fatto che questi strumenti di purificazione extracorporea del sangue abbiano capacità di rimuovere selettivamente determinate sostanze è fondamentale per valutare la loro specificità ed efficacia.
40
Prometheus migliora significativamente i livelli sierici di bilirubina coniugata, acidi biliari, ammoniaca, colinesterasi, creatinina, urea, e pH del sangue. Con il sistema Prometheus sia le sostanze legate all’albumina che quelle idrosolubili, che si accumulano in caso di danno epatico, vengono rimosse tutte mediante un singolo passaggio del
sangue attraverso il circuito extracorporeo. Il più recente studio randomizzato e controllato condotto sull’efficacia clinica di tale
sistema è lo studio HELIOS. In tale studio sono stati arruolati 179 pazienti con insufficienza epatica acuta cronica (AoCLF) di cui 68 trattati con terapia medica standard (SMT) e 77 con FPSA (sessioni di 6/8 ore per un massimo di 8/11 trattamenti per paziente) con l’endpoint primario rappresentato dalla sopravvivenza dei pazienti a 28 giorni e a 90 giorni, indipendentemente dal trapianto. I risultati di tale studio mostrano una sopravvivenza del 66% vs 63% a 28 gg e 47% vs 38% a 90 gg (FPSA vs SMT) che non è statisticamente significativa. Analizzando però il sottogruppo dei pazienti con sindrome epatorenale (HRS) tipo I si notava una maggior sopravvivenza statisticamente significativa nel gruppo di pazienti trattati con FPSA. Pochi sono gli studi in letteratura che riportano gli effetti della terapia con Prometheus.
Krisper et al hanno confrontato gli effetti di MARS e Prometheus sulla rimozione delle tossine e hanno osservato una maggiore efficienza di Prometheus rispetto a MARS. La diminuzione della pressione arteriosa, la coagulazione del circuito secondario e un leggero aumento del numero dei leucociti sono stati gli unici effetti collaterali e complicazioni riportati per la terapia Prometheus.
Una riduzione della pressione arteriosa può essere spiegata dalla riduzione del volume ematico intravascolare dovuto al riempimento del circuito extracorporeo. Questo fenomeno può essere più evidenti in FPSA confrontato con MARS a causa della filtrazione della frazione di plasma ricco di albumina che riempie il circuito secondario. Inoltre, nella terapia Prometheus, un aumento reversibile del numero di globuli bianchi si verifica probabilmente come conseguenza dell’interazione sangue-membrana. Mentre non è stato osservato nessun calo della conta piastrinica, problemi di coagulazione sono stati occasionalmente segnalati, nonostante l’anticoagulante eparina.
41
43
Capitolo 4
Sistemi che sostituiscono completamente le
funzioni del fegato
La Cross-circolazione o circolazione incrociata è applicabile in pazienti in coma epatico e con la disponibilità di donatori in vita. Questa procedura consiste in uno scambio simile alla trasfusione, dove il sistema epatico di un donatore filtra il sangue del paziente. Questo metodo è molto lento e presenta rischi per il donatore.
È una variante dell’emodialisi diffusasi tra gli anni 50 e 60 nella quale il comparto del dialisato è perfuso continuamente con sangue proveniente da un donatore vivente (animale o umano).
La presenza di una membrana di separazione tra i due flussi di sangue consente di eseguire la procedura anche tra soggetti che hanno gruppo sanguigno differente o che appartengono a specie animale differenti.
Il rischio della procedura per il donatore umano (il controllo del volume di sangue, il trasferimento di sostanze tossiche, il miscelamento dei due flussi di sangue in caso di perdita del dializzatore) e la difficoltà di introdurre il donatore (nel caso di animale vivente) in ambiente ospedaliero hanno relegato questo approccio alla classe delle curiosità terapeutiche.
La perfusione ex-vivo utilizza un fegato isolato (espiantato) di un animale (mammiferi tipo suini, babbuini) che viene connesso al sistema cardiovascolare del paziente. Questo sistema è sicuramente più efficace e pratico dell’emoperfusione o della cross-circolazione. I limiti di questa tecnica risiedono nella necessità di avere fegati privi di virus, dato che il sangue del paziente attraversa direttamente il fegato, e nel numero dei
44
fegati necessari al trattamento, dato che occorre sostituire il fegato animale ogni 24 ore circa. Sono scarsissime le applicazioni cliniche avvenute con questo metodo.
Il trapianto eterotopico di epatociti si fonda sull’ingegneria dei tessuti biologici e consiste nel trapianto di epatociti in distretti corporei che normalmente non ne prevedono l’esistenza.
In sostanza, viene realizzata una cultura di epatociti su una matrice polimerica che viene successivamente impiantata nel paziente, in zone che presentano un’elevata vascolarizzazione, come ad esempio: peritoneo, capsule renali, pancreas e polmoni. Questa scelta è necessaria per garantire un’elevata ossigenazione delle cellule e ridurre la percentuale di epatociti morti dopo l’impianto. Le matrici polimeriche studiate possono essere biodegradabili e non biodegradabili.
Polimeri biodegradabili sono usati nell’ingegneria dei tessuti, mentre quelli non biodegradabili come, ad esempio, l’alcol polivinilico (PVA), sono usati sia per sistemi in vivo sia in vitro. Studi condotti in vitro ed in vivo, hanno dimostrato l’elevata sopravvivenza degli epatociti in impalcature polimeriche di Alcol Polivinilico. Per contro, l’alcol polivinilico non degrada nell’organismo e quindi può essere sede di infezioni e fonte di infiammazioni croniche. I polimeri biodegradabili, rappresentano una soluzione ottima per essere da supporto a popolazioni di epatociti, finché non vengono sostituiti da tessuto vivente. L’acido poliglicolico (PGA), l’acido polilattico (PLA) e altri copolimeri ibridi sono stati studiati in diversi casi, con risultati analoghi a quelli ottenuti con l’alcol polivinilico. L’elevata area superficiale che l’impalcatura di polimero presenta permette ad un numero elevatissimo di epatociti di poter aderire e sopravvivere. La struttura polimerica deve essere microscopicamente ad alta porosità, in modo da permettere il flusso di nutrienti e di ossigeno, nella prima fase dell’impianto, e di consentire lo sviluppo di una rete di vasi, che vascolarizzino l’impianto in modo permanente. Gli epatociti aderiscono alla matrice polimerica, negli spazi interstiziali, riuscendo a crescere ed a differenziarsi (funzionalmente). L’interfaccia polimero-epatociti, può essere manipolata attraverso l’immobilizzazione sulla superficie stessa di proteine, enzimi o altri fattori di crescita, in modo da migliorare la biocompatibilità del materiale, l’adesione e la sopravvivenza degli epatociti.
45
Capitolo 5
I dispositivi bioartificiali
La complessità metabolica del fegato è tale che è molto improbabile riuscire ad eliminare ogni singola tossina dall’organismo con la stessa efficacia di un fegato sano e questo è un grave limite per il successo di ogni terapia chimica artificiale. Dagli anni 60 in poi, quindi, l’approccio prevalente è quello biochimico. Infatti, solamente un altro fegato sano può sostituire adeguatamente un fegato malato. Il fegato bioartificiale (BAL) permette al paziente di beneficiare della combinazione della disintossicazione attiva, del metabolismo intermedio, della capacità di sintesi ed escrezione di macromolecole, che possono essere ottenute soltanto attraverso cellule epatiche (epatociti). Lo sviluppo di un BAL è una formidabile scoperta. Diversamente dal cuore, polmone o rene, che hanno un compito primario, il fegato controlla quasi ogni aspetto del metabolismo, coagulazione del sangue, sistema immunitario, risposte endocrine, rimozione dei rifiuti e la maggior parte dei processi fisiologici.
Il fegato bioartificiale è un sistema di supporto delle funzioni epatiche, costituito da una componente biologica (epatociti) e da una struttura artificiale che garantisce una continua perfusione di sangue o plasma dal paziente verso il bioreattore. Il sistema è collegato alla circolazione venosa del paziente e consiste generalmente in un apparato per la separazione del plasma, che viene poi convogliato attraverso il bioreattore contenente le cellule epatiche, ove avvengono gli scambi metabolici. Il plasma così trattato viene successivamente restituito al paziente. Qualora vengano usate cellule animali, la procedura viene considerata come xenotrapianto.
46
Figura 5.1: Funzionamento generale di un dispositivo bioartificiale
1- Sangue pompato dal paziente verso il fegato bioartificiale 2- Separatore del plasma
3- Fegato bioartificiale 4- Pompa ausiliaria 5- Globuli rossi
I fegati bioartificiali sono classificati in base a:
Sorgente cellulare
Tipo di sistema di coltura degli epatociti
Tipo di bioreattore
5.1 Sorgenti cellulari
Per utilizzare clinicamente un BAL è richiesta un’elevata quantità di cellule epatiche. Infatti, per supportare un paziente con insufficienza acuta, in un reattore di un BAL sono necessari circa 1010. Molti BAL sono stati sviluppati per ospitare epatociti suini, che possono essere ottenuti in grande quantità, ma sono state riportate, in vitro, infezioni di cellule umane da retrovirus endogeno suino (PERV). Un approccio alternativo è quello di utilizzare linee cellulari di epatociti umani immortalizzati, che hanno le necessarie caratteristiche funzionali e di sopravvivenza. Sono cellule epatiche tumorali modificate geneticamente (epatoblastomi), che consentono di ottenere una buona differenziazione funzionale e sono capaci di replicarsi indefinitamente. Queste cellule, frutto