1
UNIVERSITA’ DEGLI STUDI DI PISA
Facoltà di Medicina e Chirurgia
Scuola di Specializzazione in Anestesia e
Rianimazione
Tesi di laurea
VALUTAZIONE ECOGRAFICA DEL NERVO OTTICO
COME PARAMETRO INDIRETTO DI MISURAZIONE
DI IPERTENSIONE ENDOCRANICA IN RIANIMAZIONE
Relatore:
Dott. F. FORFORI
Prof. F. GIUNTA
Candidato: Toma Lucia
2
Indice Analitico
INTRODUZIONE 3
IPERTENSIONE ENDOCRANICA 3
Segni e sintomi di ipertensione endocranica 6
Monitoraggio della pressione intracranica 8
ANATOMIA ED ECOGRAFIA DEL NERVO OTTICO 9
STUDIO CLINICO 13
Scopo della tesi 13
Materiali e metodi 13
Risultati 14
DISCUSSIONE 20
CONCLUSIONI 23
3
INTRODUZIONE
Studi recenti hanno descritto un aumento del diametro della guaina del nervo ottico (ONSD) in pazienti con ipertensione endocranica. L’ecografia del nervo ottico offre la possibilità di valutare e misurare rapidamente questo diametro; può essere quindi considerata una metodica indiretta e non invasiva di misurazione di ipertensione endocranica, in particolare nei pazienti critici (1) (2).
IPERTENSIONE ENDOCRANICA
Il cranio è una struttura inestensibile. La sua pressione interna è determinata dalla somma di tre compartimenti: ematico, parenchimale e liquorale . Lievi variazioni pressorie vengono controbilanciate da un complesso meccanismo di compensazione conosciuto come omeostasi di Monro-Kellie: se il cranio è intatto, la somma del volume cerebrale, del fluido cerebro spinale e del volume di flusso sanguigno intracranico rimane costante ; un incremento volumetrico in uno dei tre compartimenti può essere compensato da un decremento volumetrico nei restanti. Diversamente, la pressione intracranica aumenta (3) (4).
Nell’uomo adulto normale la pressione intracranica (PIC) è di 5-13 mm Hg. Un incremento della PIC superiore a 15 mm Hg è definito ipertensione endocranica.
Data la scarsa elasticità del tessuto cerebrale, i primi e più efficaci sistemi tampone sono: variazioni del volume ematico: sangue venoso verso i seni venosi e le vene
giugulari;
variazione del volume liquorale: liquor verso gli spazi sub aracnoidei spinali; la riduzione del flusso ematico arterioso per compressione dei vasi;
Quando i meccanismi di compenso sono esauriti si assiste ad un incremento esponenziale della PIC.(Figura 1)
Considerata quindi la piccola differenza che intercorre tra valori normali e patologici di PIC, risulta chiaro come questa costituisca un parametro rilevante nella pratica clinica poiché indice indiretto della perfusione cerebrale, della sua integrità e della funzionalità.
4
FIGURA 1 CURVA PRESSIONE-VOLUME DEL COMPARTIMENTO CEREBRALE: LA PRESSIONE
INTRACRANICA RESTA NORMALE NONOSTANTE PICCOLE AGGIUNTE IN VOLUME ( PUNTO A, “FASE DI COMPENSO”) FINO AD UN PUNTO IN CUI SI PERDE IL COMPENSO ( PUNTO B ), DOPO IL
QUALE SUCCESSIVI AUMENTI D
Un aumento della PIC si può verificare per il realizzarsi di una serie di meccanismi diversi:
aumento della produzione del liquido cerebrospinale, o per ostacolo al suo deflusso e riassorbimento (idrocefalo);
a causa di modificazioni della pressione arteriosa o per aumento della pressione venosa;
aumento del volume dell’encefalo.
Quest’ultimo è la causa più frequente e deriva da lesioni occupanti spazio, come ematomi, tumori, ascessi, cisti o per edema cerebrale.(5)(6) .
In linea generale l’aumento della PIC che si realizza in queste condizioni può essere sostenuto da diversi meccanismi, il cui ruolo dipende dalla sede, dalle dimensioni e dalla velocità di crescita del processo patologico.
I processi occupanti spazio possono essere a crescita rapidissima, come ematomi epidurali, subdurali o intracerebrali, che determinano ipertensione endocranica essenzialmente per effetto della massa della lesione che si espande; a crescita rapida come metastasi, glioblastomi, medulloblastomi; a crescita lenta come meningiomi o astrocitomi ben differenziati. Questi ultimi permettono spesso un graduale assestamento e ridistribuzione del contenuto intracranico e possono raggiungere anche notevoli dimensioni senza provocare IE. (7).
5 L’edema cerebrale può essere classificato in base ad uno dei diversi meccanismi patogenetici coinvolti:
• Edema vasogenico per aumento di acqua nello spazio extracellulare a causa di un’alterazione della barriera ematoencefalica. Clinicamente si associa a tumori, traumi cranici, ascessi, malattie vascolari (infarti ed emorragie), encefalopatia ipertensiva (brain swellig).
• Edema citotossico che non è dovuto ad un danno primitivo della BEE, ma è la conseguenza del danno prodotto da agenti nocivi sulle cellule del parenchima nervoso (neuroni, cellule gliali), le quali si rigonfiano con concomitante riduzione dello spazio extracellulare. Alla base vi è un disturbo della pompa del Na+. L'edema citotossico si verifica nell'ipossia che consegue ad esempio ad arresto cardiaco o nell'asfissia.
• Edema osmotico con aumento di acqua nello spazio extra-cellulare e nel liquor (osmolarità liquor e spazio extracellulare superiore al plasma). Ciò si verifica tipicamente in condizioni di ipo-osmolarità plasmatica, come nella intossicazione da acqua, nella "sindrome da disequilibrium" che si verifica un caso di emodialisi eccessivamente rapida, o ancora in caso di un'insufficiente secrezione di ADH. • Edema interstiziale o idrocefalico. Si tratta di una condizione che si accompagna
alla presenza di un idrocefalo ostruttivo ed è dovuto ad un'abnorme passaggio trans-ependimale di liquor attraverso le pareti ventricolari con conseguente accumulo di fluido nella sostanza bianca periventricolare. In tale condizione la BEE risulta integra. Caratteristica è la rapida risoluzione dell'edema interstiziale dopo derivazione liquorale.
L’ipertensione endocranica si instaura in circa il 40% dei traumi cranici severi a causa dell’ aumento della massa emorragica, per aumento di produzione del liquor, per perdita dell’autoregolazione vascolare ed a causa dell’edema tissutale (8).
Gli effetti patologici dell’IE sul SNC sono determinati dalla diminuzione della pressione di perfusione cerebrale e dagli spostamenti di massa cerebrale (ernie). Si definisce pressione di perfusione cerebrale la pressione arteriosa sistemica meno la pressione intracranica ( CPP = PAM – PIC).
6 Un aumento di PAM o una diminuzione di PIC provocano un aumento della pressione di perfusione, all’inverso una caduta della PAM o un aumento della PIC provocano una diminuzione della CPP.
In condizioni normali la pressione di perfusione deve scendere al di sotto dei 40 mmHg prima che il flusso ematico cerebrale diminuisca, poiché l'autoregolazione dei vasi cerebrali provoca una vasodilatazione compensatoria a livello arteriolare che consente di mantenere il flusso cerebrale costante. D'altra parte, quando la PIC sale sino ad eguagliare la pressione arteriosa sistemica, il flusso ematico cerebrale cessa completamente (9).
I rapporti tra pressione intracranica e volume ematico intracerebrale rivestono una notevole importanza, sono molto complessi e non ancora completamente chiariti.
Importante da ricordare che l’ipossia cerebrale è una conseguenza indiretta dell’ipertensione endocranica e conduce ad un’ischemia ipossica, con conseguenti lesioni cerebrali ed edema. In caso di patologie cerebrali, in cui i fini meccanismi di regolazione sono alterati, aumenti anche minimi di pressione intracranica possono provocare ipossia ed ischemia cerebrale. Più sono integri i meccanismi di regolazione cerebro-vascolare maggiore è l’aumento di PIC che può essere tollerato. Variazioni acute ed improvvise della PIC provocano effetti più gravi di variazioni instauratesi lentamente (10).
Il più temibile e dannoso effetto dell’ipertensione endocranica è la formazione di ernie cerebrali, in cui parti dell’encefalo si dislocano attraverso le normali aperture della dura madre e dell’osso, causando patologiche compartimentazioni intracraniche. L’instaurarsi di ipertensione endocranica è chiaramente associata ad una prognosi sfavorevole (11) .
SEGNI E SINTOMI DI IPERTENSIONE ENDOCRANICA
Tra i segni e sintomi clinicamente rilevanti in corso di ipertensione endocranica ricordiamo(12) :
Cefalea (85 %): è il sintomo cardine dell’ipertensione endocranica, è dovuta a
compressione e stiramento delle fibre nervose dei vasi del poligono di Willis e della dura madre, alla distorsione dei seni venosi e dell’arteria meningea media, dei nervi cranici e delle radici cervicali. Ha connotazioni peculiari, che consentono di formulare diagnosi differenziale con altre sindromi algiche cranio facciali. Parossistica, con esacerbazioni e remissioni, soprattutto nelle fasi iniziali, tende poi a diventare continua. Esacerbata da tutte le manovre
7 che innalzano la PIC come tosse, starnuti, postura. Aumenta al mattino e durante il sonno secondariamente alla ritenzione di CO2(13).
Edema papillare, da stasi ( 75%): alterazione oftalmologica tipica, caratterizzata da un
edema imponente della testa del nervo ottico, con campo visivo normale. La struttura cellulare lassa e la copiosità di nevroglia, permettono una notevole imbibizione acquosa del II° nervo cranico. La patogenesi del papilledema è da correlare alla compressione creata dall’innalzamento della pressione del LCS, al rigonfiamento degli assoni ed alla trasudazione del loro contenuto negli spazi extracellulari del disco. Inoltre, l’edema cerebrale passivo si propaga al nervo ottico, disturbando il suo deflusso venoso e realizzando un circolo vizioso. La stasi papillare, più evidente nei giovani, lo è meno oltre i 60 anni, a causa di un’atrofia ottica, con connettivo sclerotico e vasi obliterati.
L’edema papillare è il segno obiettivo fondamentale dell’ipertensione endocranica. Inizialmente difficile da identificare, (esordisce con una fievole dilatazione venosa e una sfumatura del bordo nasale della papilla), evolve poi verso la stasi, con prominenza del disco papillare. L’edema non comporta una diminuzione del visus. Si possono presentare episodi di amaurosis fugax, che perdurano nelle forme croniche ed evolvono in atrofia post-papillitica e cecità(14).
Vomito ( 65%): espressione di sofferenza bulbare, di irritazione del centro riflesso nella
sostanza reticolare, è un sintomo comune ma meno frequente della cefalea. Mattutino, a getto, incoercibile, non preceduto da nausea.
Altri sintomi, ma di minor frequenza sono vertigini, di tipo soggettivo ed in alcuni casi associati a disturbi della marcia ( atassia), disturbi della sfera psichica e crisi comiziali.
Se i valori della PIC si avvicinano a quelli della pressione arteriosa sistemica si verifica un brusco aumento di quest’ultima, accompagnata da bradicardia e bradipnea. Questo fenomeno è conosciuto come “triade di Cushing”, meccanismo neurogeno rappresentante un riflesso bulbare, scatenato dall’ischemia di questo segmento del nevrasse ed indicativo dell’instaurarsi di un’ipertensione endocranica rapidamente progressiva.
8
MONITORAGGIO DELLA PRESSIONE INTRACRANICA
Le metodiche non invasive in grado di identificare l’IE sono varie anche se nessuna, presa singolarmente, offre un’accuratezza tale da misurare in maniera precisa il grado di ipertensione endocranica.
Clinicamente vengono valutati l’eventuale peggioramento della sintomatologia, l’instaurarsi di bradicardia e la dilatazione pupillare del paziente.
TC e RM sono indagini essenziali, che ritraggono possibili alterazioni morfologiche delle strutture endocraniche, ma non quantificano il grado di un’eventuale ICP. Da ricordare inoltre che, se la TC è eseguita precocemente, i segni di Ipertensione Endocranica possono essere assenti o non ancora visualizzabili (15).
Il doppler transcranico (16). (17)., la determinazione del diametro del III ventricolo e l’oftalmodinamometria sono metodiche strumentali, le ultime due poco utilizzate.
Le metodiche invasive sono più accurate ed in grado di individuare anche forme lievi ed asintomatiche di ipertensione endocranica, ma sono gravate da un tasso variabile di complicazioni.
La puntura lombare con manometria ( introdotta nel 1891 da Quinke che standardizzò la tecnica) misura la pressione liquorale lombare. Non è considerata una metodica sicura né accurata perché può causare una sindrome da impegno (ernia tonsillare o uncale) e poiché lo spazio sub aracnoideo spinale può essere isolato da quello sopratentoriale se le vie liquorali sono bloccate vicino all’incisura tentoriale (18).. La pressione liquorale lombare è di 80-180 mm H2O e risente, oltre che di fattori di ordine gravitario, delle escursioni respiratorie, del battito cardiaco. della contrazione dei muscoli addominali , della compressione giugulare.
Attualmente la metodica di misurazione della pressione endocranica più precisa ed affidabile, introdotta da Lundberg nel 1960, è il posizionamento di un catetere intracranico, intraventricolare o parenchimale (19)..
Il catetere intraventricolare è quello che misura più accuratamente la PIC ed ha la possibilità di rilevare l’onda pressoria, di drenare il liquor e di ricalibrare. Sono maggiori le difficoltà di inserzione in caso di ventricoli piccoli, compressi o dislocati, si ha un rischio più elevato di infezione (5% in più), emorragie (1,4 % di cui solo lo 0,5% richiede trattamento), e di ostruzioni. E’controindicato in presenza di falde ematiche extracerebrali instabili. Nel 3% dei casi può verificarsi un mal posizionamento(20)..
9 Il catetere intraparenchimale è accurato, ha posizionamento più facile e minor rischio di infezione. Contrariamente all’intraventricolare può dare un’inesatta lettura nel tempo e non è possibile drenare il liquor. Sarebbe sempre da preferire la sede intraventricolare in quanto permette l’evacuazione del liquor e non risente della compartimentalizzazione del cervello ma il suo inserimento può essere più difficoltoso(21).
Recentemente sono stati messi a punto sistemi di misurazione che non richiedono necessariamente la penetrazione del tessuto nervoso, e che, parallelamente, tengono conto dell’esigenza di misurare sia la PI sistematicamente, ad esempio nell'idrocefalo infantile, sia rapidamente ed una tantum, ad esempio nei traumi cranici.
Questi metodi si fondano sulla quantificazione della PIC dallo spazio extradurale, a mezzo di sensori che riflettono variazioni di forze applicate dallo spazio intradurale.
La tecnica oggi maggiormente in voga è quella della vite sub aracnoidea che, attraverso un tubo, comunica con un trasduttore esterno.
Nondimeno, è stato assodato che i metodi di registrazione della PIC dallo spazio subaracnoideo ed epidurale tendono a sottostimare i livelli di PI molto elevata rispetto ai valori misurati con catetere intraventricolare(22)..
In conclusione, l'informazione più accurata sul valore della PIC rimane la quantificazione con catetere intraventricolare, con un incidenza di complicanze dell’1%.
ANATOMIA ED ECOGRAFIA DEL NERVO OTTICO
Il nervo ottico è un fascio di fibre ( circa 800 mila) che si forma in corrispondenza della papilla del nervo ottico, dove i prolungamenti nervosi delle cellule gangliari della retina si accollano a costituire un unico fascio che, abbandonando il bulbo oculare, attraversa il foro ottico e penetra nella cavità cranica.
In base ai rapporti che contrae nel suo decorso, il nervo ottico può essere suddiviso in quattro parti: intrabulbare, orbitaria, canalicolare ed intracranica.
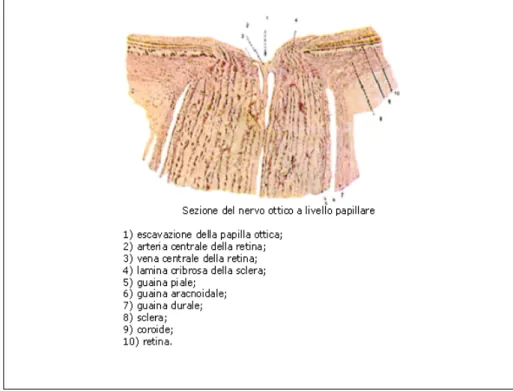
La porzione intrabulbare è costituita dalle fibre che seguono immediatamente la papilla ottica, ancora amieliche, che si raccolgono in piccoli fasci, passano per un orifizio della corioidea e si insinuano attraverso le maglie della lamina cribrosa della sclera.
10 Nell’attraversare la sclera, le fibre acquistano la guaina mielica ed il nervo raddoppia il suo diametro. Emergendo dal bulbo oculare, il nervo ottico viene avvolto da tre guaine (durale, aracnoidea e piale) che, a livello del foro ottico, continuano con le corrispondenti meningi (23).
La guaina piale è sottilissima, fascia l’insieme di tutte le fibre nervose, ed è costituita da tessuto connettivo molto compatto; sulla piale si trova l’aracnoide, la quale è molto delicata. La più esterna, più spessa e resistente, è la guaina durale, che come le altre due, rappresenta anch’essa la proliferazione delle guaine cerebrali.
Subito al di sotto della retina, la guaina perineurale è particolarmente porosa ed un aumento della PIC provocherà edema e conseguente aumento del diametro misurabile del nervo ottico (figura 2).
FIGURA 2 SEZIONE DEL NERVO OTICO A LIVELLO PAPILLARE
Come ogni struttura macroscopica che non è circondata da aria o osso, il nervo ottico è quindi accessibile agli ultrasuoni. Il suo aspetto sonografico, dal centro alla periferia, è caratterizzato dalla zona ipoecogena costituita dalle fibre nervose, circondata dalla pia madre(24).
Lo spazio sub aracnoideo appare anecogeno o ipoecogeno ed è circondato da una zona iperecogena corrispondente alla dura madre e al grasso periorbitale.
11 Il diametro del nervo è in pratica costituito dalla distanza interna alla pia madre, mentre il diametro della guaina del nervo ottico ( ONSD) è costituito dalla distanza interna alla dura madre(25).
Le misurazioni di tali diametri vengono effettuate 3 mm al di sotto del globo oculare. Per eseguire l’esame la sonda ecografica viene posizionata sulla porzione temporale della palpebra superiore. E’consigliabile proteggere gli occhi da contaminazioni prima di applicare il gel usando, ad esempio, del cerotto di carta o del tegaderm sulle palpebre chiuse (figura 3).
FIGURA 3 POSIZIONAMENTO DELLA SONDA ECOGRAFICA.
Affinché venga ben visualizzata la struttura, il raggio di ultrasuoni deve attraversare il nervo entrando attraverso l’orbita con un angolo piccolo. Leggeri movimenti laterali o di rotazione della sonda vanno poi effettuati nella ricerca della migliore immagine possibile.
Spesso a seguito delle variazioni anatomiche da paziente a paziente della curva orbitale, è necessario usare una maggiore quantità di gel allo scopo di aumentare l’interfaccia tra la sonda e la superficie oculare.
Data la superficialità delle strutture che si devono esaminare la sonda da utilizzare deve essere una lineare ad alta frequenza (7,5 MHz).
12 Per ogni nervo ottico andrebbero effettuate 2 misurazioni, una sul piano sagittale e una su quello trasverso, ruotando la sonda di 90°. La media dei valori ottenuti viene ritenuta un valore attendibile del diametro(26-32)..(figura 4)
FIGURA 4 SCHEMA ANATOMICO DELLE STRUTTURE ESAMINATE ECOGRAFICAMENTE
Oltre all’aumento del diametro del nervo ottico e della sua guaina, con l’ecografia oculare possiamo evidenziare altre patologie oculari come il distacco di retina (normalmente non ben visualizzabile; in caso di distacco appare come una sottile linea iperecogena nella parte posteriore del globo oculare) o la dislocazione del cristallino(31).
13
STUDIO CLINICO
SCOPO DELLA TESI
Studio ecografico del diametro della guaina del nervo ottico come parametro indiretto di misurazione di Ipertensione Endocranica in Rianimazione.
MATERIALI E METODI
Lo studio, ancora in fase preliminare, è stato condotto presso la Terapia Intensiva del Pronto Soccorso e la Terapia Intensiva Polivalente IV dell’ Ospedale di Cisanello, Pisa.
Sono stati arruolati i pazienti che rispettavano i seguenti criteri di inclusione:
1. TC encefalo positiva per patologia cranica 2. GCS < = 8 al ricovero
3. Presenza di catetere per il monitoraggio invasivo della PIC
Sono stati esclusi tutti i pazienti con lesioni oculari e del nervo ottico, acute o pregresse. E’stata considerata normale una PIC < 20 mmHg; la PIC è stata considerata elevata per valori superiori a 20 mmHg, mantenutasi tale per più di 30 minuti e/o con tendenza alla refrattarietà al trattamento farmacologico.
Considerato che non sono ben noti, ad eccezione di dati recenti (33)(34), i valori normali delle dimensioni della guaina del nervo ottico in pazienti ricoverati in rianimazione sedati e ventilati meccanicamente, sono stati inclusi 10 pazienti di controllo, degenti in TI per patologie non di natura cranica (shock settico, insufficienza respiratoria, monitoraggio post-operatorio).
I pazienti arruolati, dopo completamento diagnostico e valutazione neurochirurgica, sono stati sottoposti a posizionamento di catetere per il monitoraggio della PIC, intraparenchimale o intraventricolare.
Se sottoposti ad intervento neurochirurgico, i pazienti sono stati ricoverati in TI per il proseguimento della sedazione e monitoraggio post-operatorio. Il trattamento è stato condotto secondo protocolli internazionali e non ha subito modifiche in seguito allo studio.
Le misurazioni ecografiche sono state eseguite dopo stabilizzazione emodinamica. Le immagini sono state acquisite con un ecografo portatile, utilizzando una sonda lineare da 7,5
14 MHz. Applicato un sottile strato di gel sulla palpebra, la sonda è stata posizionata sulla porzione temporale della palpebra superiore, la sua inclinazione è stata corretta in maniera da ottenere un’angolazione adatta a visualizzare in maniera ottimale l’ingresso del nervo ottico nel globo oculare. Il campo è stato ridotto ad una profondità di 4 cm per strutture superficiali, ed il nevo ottico non è stato zoomato(35).
L’ONSD è stato misurato con un calibro elettronico, da un asse perpendicolare al nervo stesso, in modalità bidimensionale 3mm dietro al globo. Sono state eseguite diverse misurazioni per ogni nervo ottico, sul piano sagittale e sul piano trasversale, ruotando la sonda in senso orario.
La pressione arteriosa è stata monitorizzata in continuo. La pressione di perfusione cerebrale è stata calcolata come differenza tra pressione arteriosa media e PIC.
Oltre ad i parametri emodinamici sono stati valutati anche età, sesso, parametri ventilatori ed emogasanalitici, mortalità.
RISULTATI
Nell’arco dei primi 4 mesi di ricerca, 20 pazienti hanno soddisfatto i criteri di inclusione. Sono stati suddivisi in due gruppi in base ai valori di PIC riscontrati durante l’esame ecografico: un gruppo di pazienti con PIC > 20 mmHg e uno con PIC < 20 mmHg. Tra i pazienti arruolati 10 sono rientrati nel primo gruppo e 10 nel secondo gruppo.
Per valutare l’eventuale significatività statistica tra i dati ottenuti sui tre gruppi in esame è stato utilizzato il test di Mann Whitney per campioni indipendenti.
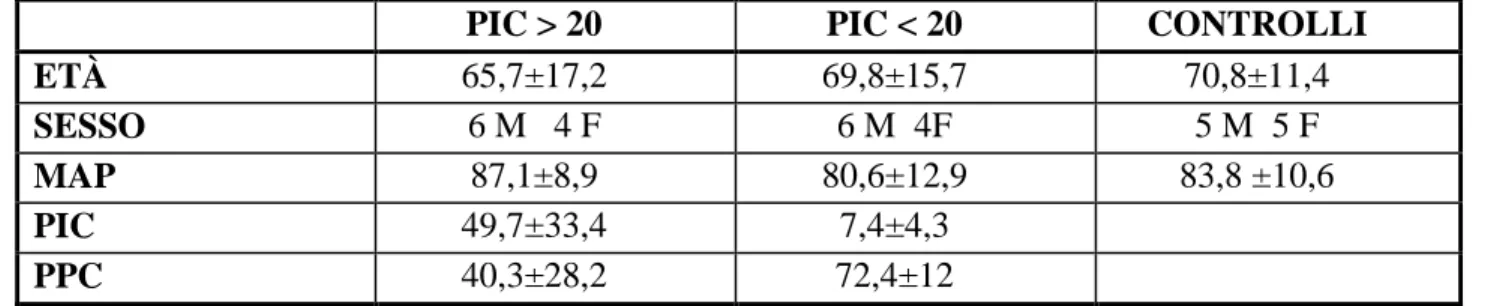
Non è stata evidenziata alcuna differenza significativa nei tre gruppi in relazione ad età, sesso e valori emodinamici ( tabella 1). La mortalità è risultata essere molto elevata nel gruppo dei pazienti con PIC >20 mm Hg, più bassa nel gruppo con PIC normale ed in quello di controllo.
PIC > 20 PIC < 20 CONTROLLI
ETÀ 65,7±17,2 69,8±15,7 70,8±11,4
SESSO 6 M 4 F 6 M 4F 5 M 5 F
MAP 87,1±8,9 80,6±12,9 83,8 ±10,6
PIC 49,7±33,4 7,4±4,3
PPC 40,3±28,2 72,4±12
15
FIGURA 5 MODIFICAZIONI DELL’ONSD NEI TRE GRUPPI IN ESAME
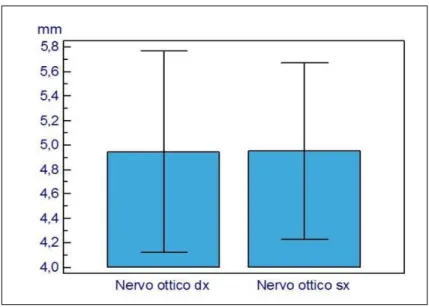
In tutti e tre i gruppi non si rilevano differenze statisticamente significative tra i diametri del nervo ottico di destra e quello di sinistra (vedi figura 6).
Il valore medio di ONSD destro nei pazienti di controllo è stato pari a 3,8 ± 0,8 mm; 3,8 ± 0,7mm è risultato il valore di ONSD sinistro. Nei pazienti con PIC < 20 mmHg si è riscontrato rispettivamente un valore pari a 3,7 ± 0,4mm a destra e 3,8 ±0,4mm a sinistra. In conclusione non vi sono differenze significative tra i valori di ONSD destro e sinistro tra questi primi due gruppi.
I pazienti con Ipertensione Endocranica mostrano un diametro del nervo ottico maggiore rispetto sia a quello riscontrato nei pazienti con PIC monitorizzata ed inferiore a 20 mmHg che in quelli di controllo, con valori di ONSD destro pari a 6,2 ±1,7mm e ONSD sinistro pari a 6,0 ± 1,7mm ( vedi tabella 2).
16
PIC MONITORIZZATA CONTROLLI
PIC > 20 PIC< 20 P P VS PIC>20 P VS PIC<20
ONSD DX 6,2 ±1,7 3,7 ±0,4 0,0005 3,8 ± 0,8 0,003 NS
ONSD SX 6,0 ±1,7 3,8 ±0,4 0,0009 3,8 ± 0,7 0,001 NS
TABELLA 2 TEST DI MANN WHITNEY NEI GRUPPI IN ESAME
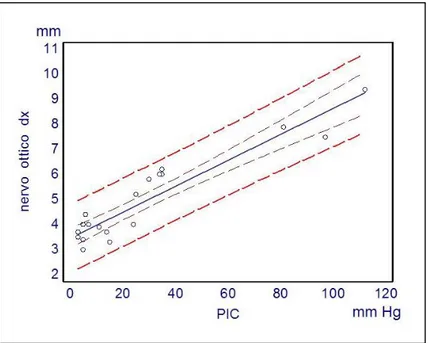
Applicando la funzione di regressione lineare, considerato il diametro del nervo ottico come variabile dipendente e la PIC come variabile indipendente, si è riscontrata una stretta correlazione tra ONSD ed il grado di ipertensione endocranica. (ONSD destro r= 0,93 r2=0,87 P<0,001;
ONSD sinistro r=0,85 r2=0,72 P<0,001, vedi figure 9 e 10).
Dai dati ottenuti si è costruita inoltre la Roc-Curve (Area Under Roc Curve = 0,94 ;
95% IC 74% -100% , P<0,0001), dalla cui interpretazione potremmo considerare un ONSD
di 4,5 mm come valore di cut-off nell’individuare valori di PIC elevata, con una sensibilità dell’80% ed una specificità del 100%. Quanto da noi rilevato dimostra che dimensioni del nervo inferiori al valore di 4,5 mm sono correlate ad una pressione intracranica < 20 mmHg (negative predictive value 83%), mentre un diametro che supera il valore di 4,5 mm può essere considerato indicativo di PIC > 20 mmHg (positive predictive value 100%). (vedi figure 11 e 12).
I nostri risultati risultano essere in accordo con la più recente letteratura(36)(37)(38). Infatti, lo studio di Qayyum e Ramlakhan, pubblicato nel febbraio 2012 , riconosce come valore ottimale di cut off un ONSD = 5mm, confermato anche dagli studi di Geeraerts del 2008 e 2007.
17
FIGURA 6 DIFFERENZE NON SIGNIFICATIVE TRA ONSD DESTRO E SINISTRO NEI TRE GRUPPI
FIGURA 7 ONSD DESTRO NEI GRUPPI CON PIC MONITORIZZATA P=0,0005
18
FIGURA 9 CORRELAZIONE TRA ONSD DX E PIC. R= 0,93; R2=0,87; P<0,001
19
FIGURA 11 ROC CURVE PER ONSD DX
20
DISCUSSIONE
I risultati ottenuti suggeriscono che la misurazione ecografica dell’ONDS nel paziente con patologia cranica o trauma cranico severo è una metodica potenzialmente utile nel rilevare un aumento della PIC.
Dimensioni di ONSD < 4,5 mm (mediana dei valori ottenuti) sono correlabili ad una PIC<20 mmHg. Dimensioni di ONDS > 4,5 mm sono indicative di ipertensione endocranica.
Più di 40 anni fa Hayreh dimostrò a livello sperimentale e clinico che la pressione del liquor cefalorachidiano si trasmette lungo la guaina del nervo ottico(39) e che lo studio del fondo oculare non è utilizzabile per una determinazione precoce di ipertensione endocranica poiché l’edema della papilla si rende visibile con una latenza di alcuni giorni(40).
Nell’uomo, l’infusione intratecale lombare di Ringer Lattato produce una dilatazione della ONSD proporzionale all’incremento della pressione prodotta all’interno dello spazio sub-aracnoideo (41),confermando l’ipotesi della comunicazione anatomica tra lo spazio sub-aracnoideo stesso e quello perineurale orbitale(42) (43).
Sulla base di questi principi l’ecografia oculare è stata introdotta come metodica strumentale utile nella valutazione dei pazienti con Ipertensione Endocranica.
Nel 2007 Geeraerts ha pubblicato uno studio che mette in relazione le dimensioni dell’ONSD ed i valori della PIC nel paziente traumatizzato: pazienti con PIC < 20 mmHg presentavano valori di ONSD inferiori a 5,8 mm, considerato come valore di cut-off. Tali dati sono confermati da uno studio successivo del 2008.
Risultati analoghi per Blaivas e coll., che hanno condotto uno studio su 35 pazienti con trauma cranico e con segni di IE al doppler trans-cranico (2002): l’ONSD medio era di 6,3 mm in pazienti con segni radiologici di ipertensione endocranica, al confronto con 4,4 mm nei pazienti che non presentavano suddetti segni. Gli autori hanno considerato 5mm come il limite di normalità, con una specificità di questo valore di cut off nell’individuare IE evidente alla TC del 93% e valore predittivo negativo del 100%. Lo stesso gruppo nel 2007 ha prodotto ulteriori dati a supporto di quanto precedentemente dimostrato.
Nel 2008 Soldatos e coll., ha pubblicato uno studio su 76 pazienti con trauma cranico, suddivisi in gruppi a seconda del GCS e della classificazione di Marshall, in cui mette in evidenza una stretta correlazione tra il diametro del nervo ottico e la PIC monitorizzata con catetere intracranico: il diametro assunto come miglior valore di cut off è pari a 5,7 mm, con una sensibilità del 74% e una specificità del 100%.
21 Ultimo lavoro pubblicato quello di Qayyum e Ramlakhan, del Febbraio 2012, che riconosce come valore ottimale di cut off un ONSD = 5mm.
L’ecografia del nervo ottico non è ancora una metodica validata ed ha come principale limitazione quella di non poter essere eseguita in pazienti con trauma oculare ( presente in circa il 10% dei traumi cranici(44)) o in pazienti con patologie oculari, acute o pregresse. Il numero limitato di pazienti reclutati è inoltre una delle principali limitazioni del nostro studio.
L’ecografia del nervo ottico è una metodica rapida, semplice, economica e non invasiva in grado di discriminare i pazienti con valori patologici di pressione intracranica. Tra i principali vantaggi la possibilità di essere eseguita direttamente al letto del paziente.
La TC ad esempio, non dà una misurazione continua della PIC e richiede manovre di spostamento che possono essere difficoltose, potenzialmente pericolose, non eseguibili se il è paziente instabile. Inoltre, se la TC viene eseguita precocemente i segni dell’Ipertensione Endocranica possono non essere ancora evidenti.
Risulta ancor più utile negli ospedali periferici laddove non sussista la possibilità di eseguire rapidamente una TC, costituendo una tecnica utile nel diagnosticare e trattare in tempi rapidi pazienti con Ipertensione Endocranica, in attesa di trasferimento presso centri specializzati.
È altresì utile nei casi di astensione del neurochirurgo al posizionamento del catetere parenchimale o intraventricolare, tutt’oggi considerato il gold standard per il monitoraggio pressorio intracranico, unico dispositivo che permette ad oggi un monitoraggio continuo interfacciabile con il monitor del paziente, ottenendo in tempo reale anche la pressione di perfusione cerebrale .
Il posizionamento e la gestione del catetere intracranico non sono prive di complicanze: in un paziente scoagulato o trombocitopenico l’indicazione al posizionamento di tale catetere, sebbene sia un intervento chirurgico minimamente invasivo, è una soluzione controversa. (46) (47).
Da valutare inoltre quella percentuale di casi, circa il 6% per il catetere intraventricolare, in cui, a causa di un mal posizionamento, la lettura del dispositivo non è attendibile.
22 Un ecografo portatile offre la possibilità di poter porre diagnosi velocemente anche in presenza di più pazienti, evenienza che potrebbe mettere in crisi le risorse sia umane che strumentali anche di ospedali specializzati ritardando l’inizio dei trattamenti.
Le attuali linee guida del trauma cranico severo raccomandano la misurazione ed il monitoraggio continuo della pressione intracranica e non l’utilizzo di metodiche non invasive. All’ammissione in ospedale comunque, l’identificazione precoce dell’ Ipertensione Endocranica in pazienti con trauma cranico utilizzando il Doppler Transcranico o l’Ultrasonografia, in attesa del posizionamento di un monitoraggio invasivo, è risultata essere molto importante sia per il triage che per un inizio tempestivo della terapia. (48)
In pazienti con insufficienza epatica acuta, stroke ischemico, trombosi venosa centrale, meningite ed encefalitel’Ipertensione Endocranica non è una complicanza rara. (49) (50).
Il trapianto di fegato è una delle possibili opzioni di trattamento in caso di Insufficienza Epatica Acuta (ALF) e necessita di un’ adeguata gestione dell’Encefalopatia Epatica ad essa associata. In questi casi la diagnosi ed il monitoraggio dell’Ipertensione Endocranica contribuiscono alle cure del paziente candidato al trapianto, sia prima sia durante l’intervento chirurgico. In caso di pazienti con ALF è importante considerare lo svantaggio correlato all’utilizzo della metodica invasiva di monitoraggio della pressione intracranica, non solo a causa dei gravi disordini coagulativi di questa tipologia di pazienti ma anche a causa dell’ immunosoppressione associata a questa patologia(51).
Questi pazienti sono solitamente trattati senza il monitoraggio invasivo della PIC e l’atteggiamento peggiore potrebbe essere quello di ignorare e sottovalutare il pericolo di un aumento della pressione endocranica, correndo il rischio inaccettabile di ischemia cerebrale. Anche in questo caso utilizzare l’ecografia del nervo ottico nella diagnosi precoce risulta un vantaggio.
Due recenti studi (2012) hanno utilizzato efficacemente la sonografia oculare, in una categoria molto particolare di pazienti: le donne gravide affette da preeclampsia.(52). (53)
La preeclampsia/eclampsia è una sindrome potenzialmente grave associata ad edema cerebrale materno di natura prevalentemente vasogenica, con perdita dell’autoregolazione cerebrale e conseguente ipoperfusione, perdita dell’integrità della barriera ematoencefalica e disfunzione endoteliale. In questi casi le immagini TC e RMN mostrano segni compatibili con un significativo aumento della PIC, anche se la metodica di riconoscimento e di monitoraggio considerata gold-standard rimane sempre quella invasiva. Anche in questi
23 studi l’ecografia della guaina del nervo ottico si è dimostrata un valido supporto diagnostico.
CONCLUSIONI
L’ultrasonografia del nervo ottico potrà essere in futuro un valido supporto diagnostico, teso ad abbreviare notevolmente i tempi di intervento farmacologico e chirurgico in pazienti con ipertensione endocranica.
Sono comunque necessari studi ulteriori su un numero elevato di pazienti, in grado di stabilire definitivamente la validità della metodica ecografica come parametro indiretto di misurazione di ipertensione endocranica.
24 BIBLIOGRAFIA
1 QAVYUM H, RAMLAKHAN S:Can ultrasound predict intracranial hypertension? A pilot
diagnostic accuracy evaluation in a UK emergency department. 2012. Eur. J Emerg Med
2 GEERAERTS T, MERCERON S, BENHAMOU D, VIGUE B, DURANTEAU J:
Noninvasive assessment of intracranial pressure using ocular sonography in neurocritical care patients. 2008.Intensive Care Med 34:2062–2067.
3 MONRO: Observation on the structure and function of the nervous system,1823. Creech
&Johnson, Edinburgh, p 5.
4 KELLIE G: An account of the appearances observed in the dissection of two of the three
individuals presumed to have perished in the storm of the 3rd, and whose bodies were discovered in the vicinity of Leith on the morning of the 4th November 1821 with some reflections on the pathology of the brain, 1824. Trans Med Chir Sci, Edinburgh 1:84.
5 BRUCE DA, ASBURY A.K, MC KHANN G,MC DONALD WI: Pathophysiology of
intracranial pressure. Disease of Nervous System. Clinical Neurobiology”. Heinemann, London,
pp. 1044-1063, 1986.
6 BECKER DP,MILLER JD, WARD JD, GREENBERG RP, YOUNG HF, SAKALAS R :The
outcome from severe head injury with early diagnosis and intensive management. 1977. Neurosurg.
47:491-502.
7 MARSHALL LF,SMITH RW,SHAPIRO HM :The outcome with aggressive treatment in
severe head injuries. II Acute and chronic barbiturate administration in the management of head injury.1979. Neurosurg. 50:26-30.
8 FARAHVAR A, GERBER L.M., CHIU Y.L., HARTL R, FROELICH M, CARNEY N, GHAJAR J: Response to intracranial hypertension treatment as a predictor of death in patients
with severe traumatic brain injury.2011.Journal of Neurosurgery, Vol. 114 / No. 5 : Pages
1471-1478
9 ANDREWS P.J.D, CITERIO G:Pressione intracranica Parte I: revisione storica e concetti di
base.2005. Intensive Care Med 1:62-65 Ed. Italiana.
10- 12 HARRISON : Principi di medicina interna.2002.
13 ADAMS R.D., VICTOR M.: Disturbances of cerebrospinal fluid circulation, including
hydrocephalus and meningeal reaction. In Adams R.D., Victor M. (eds.), “Principles of
Neurology”, fourth edition. McGraw Hill, New York, 1989, pp. 501-515
14 ROPPER A.H.: Acute increased intracranial pressure. In Asbury A.K., Mc Khann G.M., Mc
Donald W.I. (eds.), “Diseases of the Nervous System. Clinical Neruobiology”. Heinemann, London, pp. 1064-1073, 1986.
25
15 O’SULLIVAN MG, STATHMAN PF, JONES PA,LIMMER JD, DEARDEN NM, PIPER IR, et all: Role of intracranial pressure monitoring in severely head-injured patients without signs
of intracranial hypertension on initial computerized tomography. 1994. J. Neurosurg. 80 (1), 46-50
16 HASSLER W, STEINMETZ H, GAWLOWSKI J: Transcranial Doppler ultrasonography in
raised intracranial pressure and in intracranial circulatory arrest. 1988.J Neurosurg , 68:745-751.
17 AASLID R, HUBER P, NORNES H: A transcranial Doppler method in the evaluation of
cerebrovascular spasm. Neuroradiology 1986, 28:11-16.
18 QUINCKE HI: Ueber Hydrocephalus verhondlungen des congress 1892 Innere Medizin
Wiesbaden 10;321-339
19 BRAIN TRAUMA FOUNDATION GUIDELINES FOR THE MANAGEMENT OF SEVERE TRAUMATIC BRAIN INJURY. J. Neurotrauma 2007, 24 (Suppl 1): S37-S44.
20 BARLOW P, MENDELOW AD, LAWRENCE AE, BARLOW M, ROAN JO: Clinical
evaluation of two methods of subdural pressure monitoring. 1985.J Neurosurg 63:578–582.
21 LEE LA,SHARAR SR, LAM AM: Perioperative head injury management in the multiply
injured trauma patient. Int Anesthesiol Clin 2002, 40:31-52.
22 SCHIFFER D, MORTARA M, ORSI L:La sindrome da ipertensione endocranica:
fisiopatologia e clinica
23 BALBONI: Anatomia Umana vol III 2004 terza edizione .
24 LICHTENSTEIN D: Lichtenstein D (eds) L’echographie générale en réanimation.1992.
Springer, Berlin. Heidelberg New York
25- 31- 35 BLAIVAS M, THEODORO D, SIERZENSKI PR: A study of bedside ocular
ultrasonography in the emergency department.2002. Acad Emerg Med 9:791–799.
26 BLAIVAS M, THEODORO D, SIERZENSKI PR: Elevated intracranial pressure detected by
bedside emergency ultrasonography of the optic nerve sheath. 2007. Acad Emerg Med 10:376–381.
27 SOLDATOS T, KARAKITSOS D, CHATZIMICHAIL K, PAPATHANASIOU M, GOULIAMOS A, KARABANIS A :Optic nerve sonography in the diagnosis evaluation of adult
brain injury.2008.Crit. Care 12:R67.
28 NEWMAN WD, HOLLMAN AS, DUTTON GN, CARACHI R:Measurement of optic nerve
sheath diameter by ultrasound: a means of detecting acute raised intracranial pressure in hydrocephalus. 2002.Br J Ophthalmol.
29 GEERAERTS T, LAUNEY Y, MARTINI L, POTTECHER J, VIGUE B, DURANTEAU J, BENHAMOU D: Ultrasonography of the optic nerve sheath may be useful for detecting raised
26
30 HELMKE K, HANSEN HC: Fundamentals of transorbital sonographic evaluation of optic
nerve sheath expansion under intracranial hypertension I. Experimental study. 1996. Pediatr Radiol
26:701–705.
32 HELMKE K, HANSEN HC: Fundamentals of transorbital sonographic evaluation of optic
nerve sheath expansion under intracranial hypertension, II. Patient study.1996. Pediatr Radiol
26:706–710.
33 BALLANTYNES SA, O’NEILL G, HAMILTON R, HOLLMANN AS: Observed variation
in the sonographic measurement of optic nerve sheath diameter in normal adults. 2002.Eur J
Ultrasound 15:145–149.
34 STOCCHETTI N:Could intracranial pressure in traumatic brain injury be measured or
predicted noninvasively? 2007.Almost. Intensive Care Med 33:1682–1683.
35 MORETTI R, PIZZI B: optic nerve ultrasound for detection of intracranial hemorrahage
patients: confirmation of previus findings in a different patient population.2008. J Neuro surg
Anesthesiol 21: 16-20
36GEERAERTS T, DURANTEAU J, BENHAMOU D, :Ocular sonography in patients ith
raised intracranial pressure: the papilloedema revisited.2008.Crit Care 12:150
37 ROLLINS M, FLOOD P: Imaging intracranial pressure, An Introduction to Ultrasonography
of the Optic Nerve Sheath. 2012 Anesthesiology 116:1-1
38 VILLAIN MA, CANDON E, ARNAUD B, HAMARD H, ADENIS JP: Optic nerve sheath
decompression in optic neuropathy complicating idiopathic intracranial hypertension: a new focus.2003. J Fr Ophtalmol 26:191–197.
39 HAYREH SS: Pathogenesis of oedema of the optic disk. 1968. Doc Ophthalmol 24:289–411. 40 HAYREH SS: Pathogenesis of oedema of the optic disk (papilloedema), a preliminary
report.1964. Br J Ophthal 1964,
48:522-543.
41 HANSEN HC, HELMKE K: The subarachnoid space surrounding the optic nerves. An
ultrasound study of the optic nerve sheath.1996. Surg Radiol Anat 18:323–328.
42 HANSEN HC, HELMKE K: Validation of the optic nerve sheath response to changing
cerebrospinal fluid pressure: ultrasound findings during intrathecal infusion tests.1997. J
Neurosurg 87:34–40.
43 LIU D, KAHN M: Measurement and relationship of subarachnoid pressure of the optic nerve
27
44 TAYAL VS, NEULANDER M, NORTON HJ, FOSTER T, SAUNDERS T, BLAIVAS M:
Emergency department sonographic measurement of optic nerve sheath diameter to detect findings of increased intracranial pressure in adult head injury patients.2007. Ann Emerg Med 49:508–514.
45 MORETTI R, PIZZI B: optic nerve ultrasound for detection of intracranial hemorrahage
patients: confirmation of previus findings in a different patient population.2008. J Neuro surg
Anesthesiol 21: 16-20
46 SEESTED RC, FRANKEL MR: Intracerebral hemorrhage. Curr Treat Options Neurol 1999, 1:127-137.
47 LEE LA,SHARAR SR, LAM AM: Perioperative head injury management in the multiply
injured trauma patient. Int Anesthesiol Clin 2002, 40:31-52.
48 RACT C, LE MOIGNO S, BRUDER N, VIGUE B: Transcranial Doppler ultrasound
goal-directed therapy for the early management of severe traumatic brain injury. Intensive Care Med
2007, 33:645-651.
49 WARE AJ,D’AGOSTINO AN,COMBES B: Cerebral edema: a major complication of
massive hepatic necrosis. Gastroenterology 1971, 61:877-884.
50 HELMKE K, BURDELSKI M, HANSEN HC: Detection and monitoring of intracranial
pressure dysregulation in liver failure by ultrasound. 2000.Transplantation 70:392–395.
51 RABADAN A, SPAHO N, HERNANDEZ D, GADANO A, DE SANTIBANES E:
Intraparenchymal intracranial pressure monitoring in patients with acute liver failure.
52 ROLLINS M, PH.D, FLOOD P: An Introduction to Ultrasonography of the Optic Nerve
Sheath in preeclampsia.2012 Anesthesiology, V 116 • No 5.
53 DUBOST C, LE GOUEZ A, JOUFFROY V et all: Optic Nerve Sheath Diameter Used as
Ultrasonographic Assessment of the Incidence of Raised Intracranial Pressure in Preeclampsia.