Capitolo 3
Miscele di polimeri naturali per applicazioni nella
tecnica di soft lithography (SL)
3.1 Introduzione
Un aspetto desiderabile della chimica di uno “scaffold” consiste nella possibilità dell’instaurarsi di interazioni specifiche tra lo “scaffold” e la matrice extra-cellulare (ECM), i fattori di crescita e/o i recettori cellulari [Minuth et al., 1998]. I polimeri naturali, come proteine e polisaccaridi, sono stati ampiamente adoperati nel settore dell’ingegneria tessutale, in virtù della loro biocompatibilità e biodegradabilità. La biocompatibilità dei polimeri naturali è dovuta al fatto che essi sono componenti della matrice extra-cellulare o strutturalmente molto simili ai glicosamminoglicani della ECM. Il chitosano è un polisaccaride ottenuto per N-deacetilazione della chitina ed è un copolimero della D-glucosammina e della N-acetil-D-glucosammina. Recentemente, il chitosano ha riscosso ampio interesse in vari settori, come la medicina, la biochimica, la chimica analitica e la chimica industriale, grazie alle sue proprietà anti-tumorali, all’attività antibatterica, alla biocompatibilità e alla biodegradabilità [Pangburn et al., 1982; Liu et al., 2001]. Il chitosano è stato anche adoperato come materiale per il bendaggio, agente emostatico, membrana per emodialisi e mezzo per il rilascio di farmaci [Vasudev et al., 1996; Van der Lubben et al., 2003]. Un’altra possibile applicazione riguarda la rigenerazione del tessuto connettivo, per la quale l’efficacia del chitosano è dovuta alla somiglianza chimica delle macromolecole di chitosano con quelle dei glicosamminoglicani della ECM del tessuto connettivo. [Muzzarelli et al., 1998]. Il grado di deacetilazione del chitosano, vale a dire il rapporto tra le unità D-glucosamminiche e quelle N-acetil-D-glucosamminiche, influenza molte proprietà, quali la biodegradabilità [Tomihata et al., 1997], il peso molecolare [Blair et al., 1997], la velocità di degradazione [Kurita et al., 2000], l’adesione e la proliferazione cellulare [Chatelet et al., 2001]. Un elevato grado di deacetilazione, ad esempio, favorisce l’adesione dei fibroblasti, grazie all’interazione elettrostatica tra la carica negativa della membrana cellulare e la carica positiva del substrato. L’elevata attrazione tra cellule e superficie di adesione, tuttavia, ostacola la loro proliferazione, in quanto inibisce il processo di divisione cellulare [Mao et al., 2004].
Ulteriori studi hanno mostrato che films di chitosano impediscono la crescita di cellule fibrose e la formazione di cicatrici, mentre facilitano la crescita di cellule endoteliali, vasi capillari e cellule del muscolo cardiaco [Barnes et al., 1985]. Il chitosano, inoltre, è noto per favorire la rigenerazione del sistema nervoso. Le membrane e le fibre di chitosano sono state applicate con successo come supporto per l’adesione, la proliferazione e la migrazione delle cellule di Schwann, che sono cellule neurogliali del sistema nervoso periferico, coinvolte nella produzione di fattori di crescita e membrana extracellulare [Bunge et al., 1994]. Le fibre di chitosano sono in grado di facilitare la migrazione delle cellule di Schwann e hanno pertanto un ruolo simile alle Bande di Büngner nella guida della crescita assonale. Fibre di chitosano, ricavate da tendini di granchio, sono state modificate chimicamente
la rigenerazione nervosa [Itoh et al., 2003]. Protesi di chitosano in grado di rilasciare progesterone sono state adoperate per la rigenerazione di un difetto di 10 mm di lunghezza nel nervo facciale di coniglio [Chavez-Delgado et al., 2003].
La miscelazione del chitosano con una proteina o con un peptide è stata proposta come un metodo efficace per la produzione di materiali dalle migliorate proprietà meccaniche e biologiche, per quanto concerne l’adesione e la proliferazione cellulare [Cheng et al., 2003].
Miscele chitosano/proteine (albumina, collagene) e chitosano/peptide (poli-L-lisina) sono state studiate come possibili substrati per la rigenerazione nervosa, effettuando prove in vitro con cellule fetali della corteccia cerebrale di topo (dette cellule PC12) [Cheng et al., 2003]. La miscela chitosano/poli-L-lisina è risultata particolarmente efficace nel favorire l’adesione delle cellule PC12, in virtù dell’elevata carica superficiale positiva. La miscela chitosano/collagene ha dato risultati superiori alla miscela chitosano/albumina, grazie alla chimica del collagene che possiede domini funzionali che possono essere legati direttamente dai recettori cellulari integrinici. Il livello di differenziazione delle cellule PC12 è stato più elevato per le miscele rispetto che per il chitosano puro, e la più alta percentuale di differenziazione si è avuta per la miscela chitosano/collagene.
In questo lavoro sono state prodotte miscele tra chitosano e gelatina, che è un derivato del collagene, con l’obiettivo di adoperarle, in particolare, nel settore della rigenerazione nervosa.
La gelatina è una proteina ottenuta dal collagene tramite denaturazione termica, o degradazione fisica e/o chimica. Essa è un materiale adatto per essere miscelata con il chitosano, in quanto possiede gruppi carbossilici laterali che possono formare legami idrogeno con i gruppi idrossilici e/o amminici del chitosano [Taravel et al., 1993]. La gelatina è biodegradabile, riassorbibile in vivo, non è antigenica in condizioni fisiologiche, le sue proprietà fisiche e chimiche possono essere facilmente modulate, ed è più economica del collagene [Yao et al., 2002; Kuijpers et al., 1999]. Nel settore biomedico, la gelatina trova soprattutto applicazione nella produzione di capsule, come sigillante per protesi vascolari e come materiale per il rilascio di farmaci [Cascone et al., 2002; Ofner III et al., 2001]. Esistono due tipologie di gelatina: la gelatina di tipo A e la gelatina di tipo B, che differiscono nella procedura con cui sono state estratte dal collagene e poi processate, rispettivamente tramite trattamento in ambiente acido o alcalino [Rose et al., 1987]. Il pre-trattamento alcalino converte i residui di glutammina e asparagina in acido aspartico e glutammico, con il risultato che la gelatina B contiene un numero maggiore di gruppi carbossilici rispetto alla gelatina A [Zao et al., 1999]. In letteratura, le miscele chitosano/gelatina sono state ampiamente adoperate per applicazioni nell’ingegneria tissutale. Le miscele chitosano/gelatina sono state utilizzate, ad esempio, per la produzione di membrane per il rilascio di cheratinociti, nel trattamento di ustioni di terzo grado [Mao et al., 2003]. Il vantaggio delle membrane a base di chitosano e gelatina, rispetto alle membrane di solo chitosano, consiste nella loro capacità di favorire l’adesione e la proliferazione dei cheratinociti, in virtù della loro composizione chimica e delle proprietà meccaniche.
Uno dei principali svantaggi della gelatina consiste nella sua solubilità in ambiente acquoso: le strutture a base di gelatina adoperate nel settore biomedico necessitano quindi di una reticolazione. I limiti delle reticolazioni mediante trattamento chimico riguardano la possibilità che all’interno dello
scaffold rimanga una certa quantità di reticolante che non ha reagito e anche il rischio che si formino
prodotti tossici per reazione tra gelatina e/o chitosano con l’agente reticolante. Esistono oggi reticolanti di derivazione naturale, come destrani ossidati e genipina [Cortesi et al., 1999; Bigi et al., 2002], o agenti reticolanti non-tossici come la gliceraldeide [Vandelli et al., 1995], che sono privi dei rischi dei tradizionali agenti chimici usati per reticolare le miscele chitosano/gelatina. Un altro metodo per reticolare le miscele chitosano/gelatina consiste nella modificazione enzimatica: ad esempio l’enzima transglutaminasi (TGase) catalizza la formazione di ponti di reticolazione tra i gruppi γ-ammidici della glutammina e i gruppi ε-amminici della lisina [Kolodziejska et al., 2004].
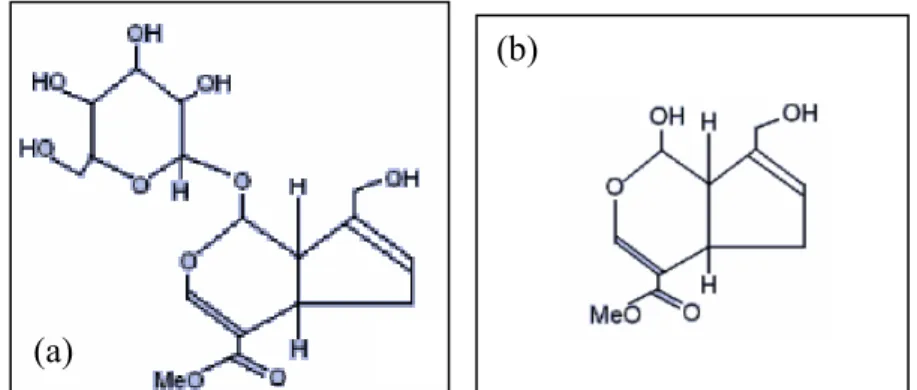
In questo lavoro, è stata impiegata la genipina come reticolante chimico delle miscele chitosano/gelatina. La genipina è un reagente reticolante naturale, che è stato adoperato recentemente per la reticolazione del chitosano e delle proteine contenenti residui con gruppi amminici primari, in particolare la gelatina [Bigi et al., 2002; Mi et al., 2003; Mi et al., 2002; Jin et al., 2004]. La genipina è ottenuta dal geniposite, un glucoside iridoide isolato dai frutti delle Genipa Americana e dalla
Figura 3-1. Formule chimiche del geniposite (a) e della genipina da esso estratta (b).
La genipina è stata comunemente adoperata nella medicina erboristica [Akao et al., 1994], mentre i pigmenti blu scuro ottenuti per reazione della genipina con i gruppi amminici primari sono stati usati nella fabbricazione di coloranti alimentari, resistenti al calore, al pH a alla luce [Paik et al., 2001]. Alcuni studi hanno dimostrato la maggiore biocompatibilità e minore citotossicità della genipina, rispetto ad altri comuni agenti reticolanti chimici, come la glutaraldeide, la formaldeide e i composti epossidici [Sung et al., 1999; Tsai et al., 2000].
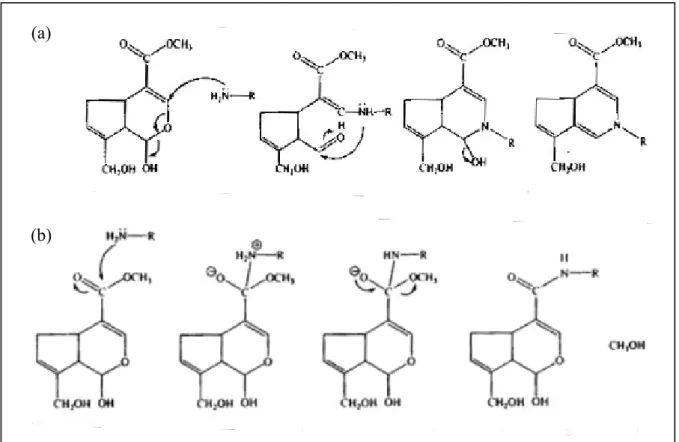
Il meccanismo di reticolazione consiste di due reazioni che coinvolgono diversi siti sulla molecola di genipina [Michael et al., 2003]. Il primo stadio della reazione (Figura 3-2a) consiste nell’attacco nucleofilo dell’atomo di carbonio C3 della genipina, da parte di un gruppo primario amminico, per formare un gruppo aldeidico intermedio. L’ammina secondaria appena formata reagisce con il gruppo aldeidico per formare un composto eterociclico. Il secondo stadio della reazione (Figura 3-2b) è una reazione di sostituzione nucleofila, che consiste nella sostituzione del gruppo estereo sulla molecola di genipina con un legame ammidico secondario. La reazione, in generale, è complicata dalla polimerizzazione della genipina, indotta dai radicali ossigeno, che avviene dopo la formazione del composto eterociclico, ed è responsabile del colore blu del gel reticolato.
I metodi fisici di reticolazione della gelatina includono l’uso delle microonde [Vandelli et al., 2004], il trattamento deidrotermico DHT [Yannas et al., 1967; Welz et al., 1992; Ueda et al., 2000; Wess et al., 2000] e l’irraggiamento UV [Welz et al., 1992; Ma et al., 2003]. Il trattamento deidrotermico, in particolare, è stato spesso adoperato per reticolare materiali proteici ed è un metodo la cui efficacia dipende dal tempo e dalla temperatura di lavoro. Il trattamento della gelatina ad alta temperatura e sotto vuoto promuove la reazione di condensazione tra i gruppi carbossilici e amminici di molecole adiacenti. I principali inconvenienti del trattamento deidrotermico sono la necessità di adoperare tempi di reazione lunghi, in modo da reticolare sufficientemente la gelatina, e la difficoltà tipica dei metodi fisici di reticolazione di controllare il grado di reticolazione del materiale. Come soluzione, Berr et al. [Ber et al., 2005] hanno adoperato una combinazione di due tecniche di reticolazione in sequenza per il collagene: il trattamento DHT e la successiva reticolazione con carbodiimmide. In questo lavoro, la gelatina è stata miscelata con il chitosano, che contiene un’elevata densità di gruppi amminici e/o idrossilici reattivi verso i gruppi carbossilici della gelatina: la miscelazione dovrebbe favorire la cinetica e l’equilibrio delle reazioni coinvolte nel trattamento DHT. Sono state prodotte miscele chitosano/gelatina con diverso rapporto in peso tra i componenti e ne sono state investigate le caratteristiche chimico-fisiche prima e dopo la reticolazione tramite trattamento fisico e per reazione con genipina. Sono state anche investigate le caratteristiche funzionali dei materiali per applicazioni nell’ingegneria tissutale come la bagnabilità superficiale e i test di adesione e proliferazione cellulari. Infine, sono state valutate le proprietà meccaniche dei campioni reticolati allo stato bagnato e asciutto, mediante un’apparecchiatura messa a punto presso il Centro Piaggio e basata sull’uso di un trasduttore isotonico di posizione. La stabilità delle strutture è stata valutata tramite test di dissoluzione e rigonfiamento in mezzi con caratteristiche tali da simulare le tipiche condizioni fisiologiche. Le miscele chitosano/gelatina si sono adoperate per la produzione di scaffolds con risoluzione micrometrica mediante la tecnica di soft lithography, che è una tecnica di prototipazione rapida, basata sull’uso di uno stampo sagomato in polidimetilsilossano (PDMS) [Vozzi et al. 2002-2003]. I test di adesione cellulare, in particolare, sono stati condotti su film ottenuti per casting e su microstrutture ottenute tramite soft lithography, adoperando fibroblasti murini. I test di adesione e proliferazione
(b)
cellulare, adoperando neuroblasti, invece, che sono stati effettuati su campioni in forma di film per
casting, hanno permesso di valutare la composizione più adatta al settore della rigenerazione nervosa.
Figura 3-2. Schema della reazione della genipina con catene macromolecolari contenenti ammine primarie: (a) primo stadio della reazione (attacco nucleofilo); (b) secondo stadio di reazione (sostituzione nucleofila).
3.2 Parte sperimentale
3.2.1 Materiali
Il chitosano (CS) adoperato, derivato da gusci di granchio, è stato fornito dalla Aldrich. Il grado di deacetilazione (DD) del chitosano, che è risultato pari all’85%, è stato determinato sperimentalmente mediante spettroscopia a infrarossi, usando la relazione seguente [Dhiman et al., 2004]:
% DD = [1-(A1665/A3340)×(1/1.33)]×100 (3.1) dove A è il rapporto tra i logaritmi delle assorbanze a 1665 cm-1 e a 3340 cm-1.
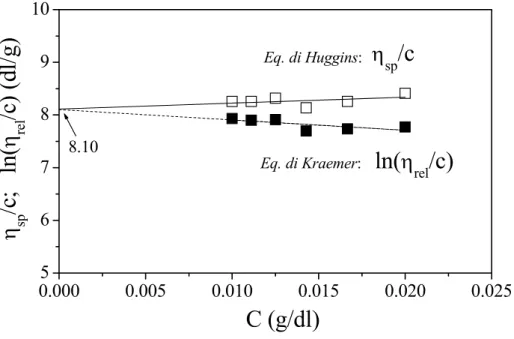
Il peso molecolare viscosimetrico (Mη) del chitosano adoperato è stato determinato tramite metodo viscosimetrico in una soluzione 0.1 M di acido acetico (Aldrich) e 0.2 M di cloruro di sodio (Fluka) a 25°C, usando come valori per le costanti α e K dell’equazione di Mark-Houwink quelli riportati in letteratura (K=1.81×10-3, α=0.93) [Dhiman et al., 2004].
La Figura 3-3 riporta le curve sperimentali utilizzate per il calcolo della viscosità intrinseca, da cui è stato calcolato il peso molecolare Mη del CS che è risultato pari a 8425.
(a)
0.000
5
0.005
0.010
0.015
0.020
0.025
6
7
8
9
10
Eq. di Kraemer: Eq. di Huggins:ln(
η
rel/c)
η
sp/c
8.10η
sp/c
; ln(
η
rel/c
) (
dl/g)
C (g/dl)
Figura 3-3. Andamento della viscosità ridotta (equazione di Huggins) ( ) e della viscosità inerente (equazione di Kramer) (■) in funzione della concentrazione delle soluzioni di chitosano adoperate. Nelle formule delle due equazioni adoperate, la concentrazione (c) delle soluzioni è espressa in g/dl.
La gelatina di tipo B da pelle bovina (G; forza del gel 75 Bloom; Mη=62,260 g/mol [Abrusci et al., 2004] è stata fornita dalla Aldrich.
La genipina (GP) è stata fornita dalla Wako Chemicals.
Tutti i solventi e reagenti adoperati sono di grado analitico e sono stati usati senza ulteriori purificazioni.
3.2.1.1 Preparazione delle miscele tra chitosano e gelatina per reticolazione termica
(DHT)
Una quantità di chitosano pari ad 1 g è stata sciolta in una soluzione all’1% (v/v) di acido acetico (Aldrich) in acqua demineralizzata e la sua frazione insolubile è stata rimossa tramite filtrazione. La gelatina è stata sciolta in acqua demineralizzata a 50°C ottenendo una soluzione al 10% (w/v). Opportuni volumi delle due soluzioni sono stati miscelati per 2 h a 50°C, in modo da ottenere miscele contenenti il 20 , 40 % e 60 % in peso di chitosano, rispettivamente indicate con i codici CS/G 20/80, CS/G 40/60 e CS/G 60/40.
Le soluzioni delle miscele sono state versate in capsule Petri di plastica e il solvente è stato fatto evaporare a 37°C per 48 h in stufa ventilata, ottenendo film per casting.
I film di miscele e dei puri sono stati successivamente sottoposti ad un trattamento termico in stufa da vuoto, detto dehydrothermal treatment (DHT), basato su due stadi: il primo stadio è stato un semplice essiccamento a 50°C sotto vuoto per 90 min, il secondo stadio, invece, è consistito nel trattamento dei campioni a 130°C sotto vuoto per 5 h e ha promosso le reazioni di reticolazione. I campioni reticolati tramite il trattamento DHT sono stati indicati con i codici: CS-t, G-t, (CS/G 20/80)-t, (CS/G 40/60)-t e (CS/G 60/40)-t.
3.2.1.2 Preparazione delle miscele chitosano/gelatina per reticolazione chimica con
genipina.
3.2.1.2.1 Reticolazione della gelatina
Sono state effettuate prove preliminari di reticolazione sui campioni di gelatina, al fine di valutare la quantità ottimale di reticolante per la gelatina pura, che, nelle miscele chitosano/gelatina, è il componente con la minore resistenza alla dissoluzione in ambiente acquoso.
La gelatina (G) è stata disciolta in acqua demineralizzata a 50°C, ottenendo una soluzione al 10 % (w/v). La genipina (GP) è stata aggiunta alle soluzioni di G in differenti percentuali: 0.5; 1.0; 1.5; 2.0; 2.5; 3.0; 3.5 % (w/w). Ogni soluzione è stata mantenuta a 50 °C, sotto agitazione magnetica moderata, fino al tempo di inizio della gelificazione. A questo punto, la soluzione è stato versata su un piattino Petri, per permettere l’evaporazione lenta del solvente e la continuazione del processo di gelificazione. Dopo 48 h di essiccamento, i campioni sono stati sottoposti a diversi lavaggi in acqua demineralizzata, per rimuovere le tracce residue di GP. I campioni reticolati di gelatina sono stati identificati con le sigle: G-0.5 GP; G-1.0 GP; G-1.5 GP; G-2.0 GP; G-2.5 GP; G-3.0 GP; G-3.5 GP.
3.2.1.2.2 Reticolazione delle miscele chitosano/gelatina e del chitosano
Sono state preparate soluzioni di miscele CS/G e di CS, come indicato al paragrafo 3.2.1.1. La GP è stata aggiunta ad ogni soluzione a due diverse concentrazioni: 0.5 % (w/w) e 2.5 % (w/w). Ogni soluzione è stata mantenuta in agitazione a 50 °C, fino al tempo di inizio gelificazione. A questo punto, le soluzioni sono state versate all’interno di piatti Petri e lasciate essiccare per 48 h, a temperatura ambiente, sotto cappa. I films per casting essiccati sono stati lavati con una soluzione 0.1 M di NaOH (Merck), poi sciacquati ripetutamente in acqua demineralizzata fino ad ottenere un pH neutro e, quindi, lasciati essiccare in una stufa ventilata a 37 °C per 48 h. I campioni reticolati, adoperando una quantità di GP pari allo 0.5 % (w/w) e al 2.5 % (w/w), sono stati identificati con la seguente rispettiva nomenclatura: CS/G 20/80-0.5 GP; CS/G 40/60-0.5 GP; CS/G 60/40-0.5 GP; CS-0.5 GP; CS/G 20/80-2.5 GP; CS/G 40/60-2.5 GP; CS/G 60/40-2.5 GP; CS-2.5 GP.
3.2.2 Metodi
3.2.3.1 Analisi termogravimetrica
La degradazione termica dei campioni in forma di film è stata misurata, adoperando l’apparecchiatura Perkin Elmer TGA 6 Thermogravimetric Analyzer sotto flusso di azoto. Gli esperimenti sono stati condotti riscaldando i campioni a 10°C/min nell’intervallo di temperatura 30-700°C.
3.2.2.2 Analisi all’infrarosso in modalità ATR (FTIR-ATR)
Gli spettri FTIR-ATR sono stati ottenuti da campioni in forma di film, a temperatura ambiente attraverso lo strumento Perkin Elmer Spectrum One Spectrometer nell’intervallo di frequenza 4000-600 cm-1.
3.2.2.3 Microscopia elettronica a scansione (SEM)
L’analisi in microscopia elettronica a scansione è stata condotta attraverso l’apparecchiatura Jeol JSM-5600 LV su campioni di film fratturati in azoto liquido e rivestiti con Au mediante lo strumento Edwads Sputter Coater.
3.2.2.4 Misura dell’angolo di contatto
Gli angoli di contatto statici dei campioni reticolati e non reticolati in forma di film sono stati misurati a temperatura ambiente tramite l’apparecchiatura CAM 200 KSV, adoperando gocce da 5 µl di acqua
doppiamente distillata. Ogni angolo riportato è la media di almeno cinque misure effettuate su differenti zone della superficie del campione.
3.2.2.5 Prove di rigonfiamento
Campioni dei film di forma quadrata (1×1 cm2) sono stati pesati e poi immersi in pozzetti contenenti 2 ml di tampone fosfato (PBS; Sigma) a pH 7.4 a 37°C. I campioni rigonfiati sono stati prelevati dai pozzetti a tempi diversi (1, 3, 6, 24, 48 h), poi sono stati asciugati in superficie mediante contatto con carta da filtro e pesati nuovamente.
La percentuale di rigonfiamento è stata calcolata come:
% Sw = [(Ws-Wi)/Wi]×100 (3.2)
dove Ws e Wi sono rispettivamente i pesi dei campioni rigonfiati e di quelli iniziali. Ogni valore di rigonfiamento è stato espresso come la media di tre misure. Le prove sono state effettuate su tutti i campioni reticolati e non reticolati.
3.2.2.6 Prove di solubilità
I campioni in forma di films (1×1 cm2) sono stati essiccati a 37°C per 48 h in una stufa ventilata, poi sono stati pesati e immersi in tampone fosfato (PBS) a pH 7.4 alla temperatura di 37 °C.
I campioni sono stati prelevati a vari tempi (1, 3, 6, 24, 48 h), sono stati nuovamente essiccati in stufa ventilata a 37 °C per 48 h, poi sono stati pesati nuovamente.
La percentuale di solubilità è stata calcolata come:
% S = [(Wd-Wo)/Wo]×100 (3.3)
dove Wd e Wo sono i pesi dei campioni essiccati prima e dopo il trattamento. I risultati sono stati calcolati come media delle misure effettuate su tre campioni adoperati ad ogni tempo di prova. Le prove sono state effettuate sui campioni reticolati e non reticolati.
3.2.2.7 Proprietà meccaniche
Le proprietà meccaniche dei campioni in forma di films per casting dei campioni reticolati termicamente e con GP sono state misurate usando un trasduttore isotonico di posizione (modello 7006, UGO Basile Biological Research Apparatus, Italy), nel quale la forza applicata ha una risoluzione di 1 mN. Sono stati analizzati campioni con dimensione 2 × 0.5 cm2 e spessore 100 µm. Le immagini degli scaffolds sono state registrate tramite microscopio ottico (Olympus AX 70), equipaggiato con una macchina fotografica digitale (ccD Camera HIRES, DTA; Italy), per avere informazioni circa le dimensioni iniziali dei campioni e la loro geometria. La forza di trazione è stata applicata nel senso della lunghezza. Sono stati sottoposti alla prova tre campioni per tipo di materiale. Il modulo di Young è stato calcolato dalla pendenza della porzione lineare iniziale delle curve di sforzo (σ)- deformazione (ε).
Le prove a trazione delle miscele (CS/G)-t sono state effettuate anche allo stato umido, su campioni che sono stati immersi in mezzo di coltura completo (DMEM, Biowhittaker, Italy), a 37 °C per 1 h. Lo scopo di tali prove è stato quello di valutare le proprietà meccaniche dei campioni a contatto con un mezzo in grado di simulare le caratteristiche fisiologiche. Dopo 1 h di immersione nel mezzo, i campioni sono stati prelevati, tamponati con carta da filtro e immediatamente sottoposti alle prove, usando la stessa procedura e apparecchiatura usata per le prove meccaniche sui campioni asciutti.
3.2.2.8 Soft lithography (SL)
La tecnica di soft lithography è stata già descritta nella sezione introduttiva (cfr 1.3.1.3.1.2.). La tecnica utilizza uno stampo in polidimetilsilossano (PDMS), con una specifica geometria, che viene
silicio sono stati riportati da Bathia et al. [Bathia et al., 1999]. Inizialmente, su alcuni wafers di silicio è depositato, per spin-coating, un materiale fotosensibile (EPSON-SU8, Microchem Co., Newton MA). Dopo l’essiccamento, il sistema è esposto ai raggi UV, attraverso una maschera Bottom Side Mask Aligner (Karl Suss, Waterbury Center, VT). La maschera è disegnata tramite il programma Coreldraw 9.0 e stampata su una trasparenza, usando una stampante commerciale Linotronic-Hercules con 3300 dpi di risoluzione. La parte esposta del materiale fotosensibile è sviluppata (SU8 developer, Microchem Co.) e, successivamente, i wafers sono essiccati. Il prepolimero del PDMS è preparato per miscelazione di un prepolimero commerciale con un catalizzatore (Sylgard 184 kit, Dow Corning) nel rapporto in peso 10:1. Viene effettuato un casting della miscela sul master, dopo che questa è stata essiccata sotto vuoto. Il sistema viene mantenuto nuovamente sotto vuoto per rimuovere le bolle che si sono formate a seguito dell’inglobamento di aria in fase di casting e poi è sistemato in forno a 65 °C per 2 h. Dopo il raffreddamento, lo stampo di PDMS è staccato dal master di silicio, lavato con una soluzione di etanolo al 70 % (v/v) e sottoposto a trattamento in un sonicatore per 5 min.
Lo stampo di PDMS è pronto per essere utilizzato per la microfabbricazione di scaffolds, secondo la procedura seguente. Una piccola quantità di soluzione è depositata per casting sullo stampo in PDMS. Poi, il sistema è posto in forno ventilato a 37 °C per 48 h. Dopo l’essiccamento, la struttura polimerica è rimossa dallo stampo mediante un paio di pinze e sottoposta agli stessi trattamenti adoperati per i film per casting (neutralizzazione con soluzione di NaOH, lavaggio, essiccamento ed eventuale reticolazione per trattamento termico sotto vuoto).
Si sono prodotti scaffolds con geometrie diverse: griglie con maglie quadrate, strisce parallele e films con superficie sagomata a griglia a maglie quadrate.
3.2.2.8.1 Microscopia ottica (OM)
Le microstrutture ottenute per soft lithography sono state analizzate tramite un microscopio ottico (Olympus AX 70).
3.2.2.9 Coltura cellulare
Le prove cellulari sono state effettuate adoperando fibroblasti di topo NIH-3T3 e neuroblastomi S5Y5. Entrambi i tipi di cellule sono state coltivate in fiasche da 25 cm2 contenenti il mezzo Dubecco's modified Eagle's medium (DMEM; Cambrex, Italia) con un’alta percentuale di glucosio, il 10 % di siero fetale bovino (Cambrex, Italia), l’1 % di glutammina (Cambrex, Italia), penicillina (200 U/ml) (Cambrex, Italia) e streptomicina (200 µg/ml) (Cambrex, Italia). La coltura cellulare è stata effettuata seguendo la stessa procedura indicata nel Capitolo 2 al paragrafo 2.2.2.11.
3.2.2.9.1 Prove in vitro con fibroblasti
Le prove di adesione cellulare dei fibroblasti sono state effettuate sui films per casting e sugli scaffolds ottenuti per soft lithography in forma di films con superficie sagomata a griglia a maglie quadrate. La procedura di sterilizzazione, rivestimento dei campioni con gelatina di tipo A, semina delle cellule,fissaggio cellulare e colorazione sono identiche a quelle descritte al paragrafo 2.2.2.11 del Capitolo 2. La misura dell’adesione cellulare è stata effettuata su tre campioni per ogni tempo (2, 4, 24 h). Dopo la prova, i campioni sono stati analizzati al microscopio ottico (Olympus AX70) e il rapporto tra il numero di cellule sulle strutture polimeriche e l’area totale del substrato polimerico è stata calcolata come indice della densità cellulare [Vozzi et al., 2002]. Sono state esaminate e poi confrontate sia le cellule di un campione di riferimento (uno strato di gelatina), sia quelle seminate sugli scaffolds a diversa geometria, per valutare l’effetto della topografia dello scaffold sull’adesione cellulare.
3.2.2.9.2 Prove in vitro con neuroblasti
L’adesione e la proliferazione dei neuroblasti S5Y5 è stata valutata sui films per casting di (CS/G)-t. I campioni sterilizzati e rivestiti con gelatina di tipo A sono stati seminati con una sospensione di neuroblasti in piastre di coltura da 24 celle. Come controllo positivo si è adoperato uno strato di polilisina (Sigma, Italia). La valutazione dell’adesione e proliferazione cellulare è stata effettuata dopo
1, 2, 3 giorni su tre campioni per ogni tempo. Dopo ogni tempo di prova, il mezzo di coltura è stato rimosso e i substrati (con le cellule ad essi aderite) sono stati lavati con una soluzione di PBS. Le cellule aderite sono state fissate e poi colorate come descritto nel paragrafo 2.2.2.11 del Capitolo 2. I campioni sono stati poi esaminati al microscopio ottico (Olympus AX70, Italia). La conta cellulare è stata effettuata mediante un software per l’acquisizione e l’elaborazione delle immagini, che è stato sviluppato in ambiente Matlab.
3.3 Risultati
In questo paragrafo, sono riportati i risultati relativi alla caratterizzazione chimico-fisica e funzionale delle miscele chitosano/gelatina reticolate e non reticolate. Inizialmente, sono esposte alcune considerazioni riguardo alla scelta della quantità di reticolante per le miscele CS/G. Successivamente, sono riportati i risultati dell’analisi termogravimetrica, che sono fondamentali per determinare la stabilità termica delle miscele CS/G, dalla quale dipende la scelta dei parametri di temperatura del trattamento termico di reticolazione. La stabilità termica dei campioni reticolati e non reticolati, inoltre, può essere messa in relazione con le interazioni esistenti tra le macromolecole. Sono poi riportati i risultati dell’analisi FTIR-ATR, che, generalmente, è una tecnica efficace per valutare eventuali variazioni nella composizione chimica dei materiali, a seguito di trattamenti fisici e/o chimici. L’analisi SEM delle sezioni di films per casting è stata effettuata allo scopo di avere informazioni sulla compatibilità delle miscele. Sono state poi effettuate alcune caratterizzazioni maggiormente specifiche all’utilizzo delle miscele chitosano/gelatina nel settore dell’Ingegneria Tissutale. Per prima cosa, sono state riportate le misure di angolo di contatto, importanti per la determinazione del grado di idrofilia dei campioni. Sono stati anche misurati i gradi di rigonfiamento e di dissoluzione allo scopo di indagare la stabilità dei campioni in un ambiente che simula le condizioni di quello fisiologico e valutare, indirettamente, l’efficacia dei trattamenti di reticolazione. La caratterizzazione meccanica ha permesso di confrontare l’effetto del tipo di reticolazione e, per la reticolazione tramite trattamento chimico, della percentuale di reticolante sulla proprietà meccaniche dei materiali. Infine, sono riportati i risultati delle prove cellulari in vitro, che hanno consentito di valutare la variazione del grado di biocompatibilità delle miscele CS/G con la composizione ed il tipo di reticolazione, e di stabilire l’eventuale specificità delle miscele CS/G come substrato per la rigenerazione assonale.
3.3.1 Valutazione della concentrazione ottimale di genipina nella reticolazione delle
miscele chitosano/gelatina
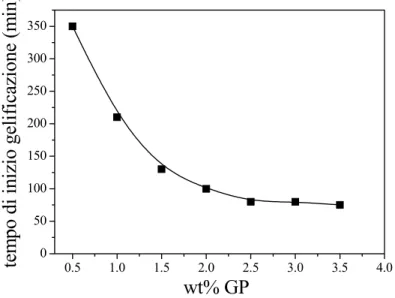
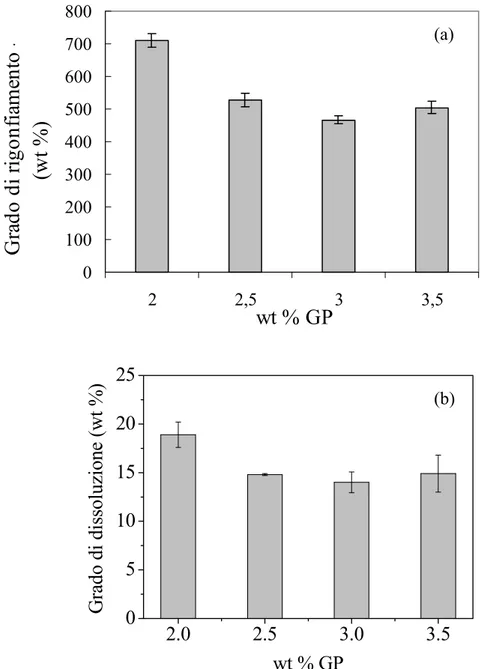
La concentrazione ottimale di genipina è stata selezionata sulla base dei dati sperimentali relativi al tempo di gelificazione delle soluzioni di gelatina pura, in funzione della percentuale di GP. La Figura 3-4 mostra l’andamento del tempo di gelificazione delle soluzioni di G in funzione del contenuto di reticolante. Il tempo di gelificazione ha evidenziato un rapido calo per contenuti di GP crescenti tra lo 0.5 % (w/w) e il 2.5 % (w/w), assestandosi ad un valore pressoché costante, per contenuti maggiori di reticolante. Questi risultati hanno mostrato che contenuti di GP maggiori del 2.5 % (w/w) non modificano il tempo di gelificazione delle soluzioni di GP e, quindi, il grado di reticolazione. La concentrazione di GP del 2.5 % (w/w) è stata ritenuta quella ottimale per la reticolazione della gelatina pura. Le miscele chitosano/gelatina sono state reticolare, adoperando tale concentrazione e la concentrazione del 0.5 % (w/w) per confronto.
0.5 1.0 1.5 2.0 2.5 3.0 3.5 4.0 0 50 100 150 200 250 300 350
te
m
po di
in
iz
io
geli
fi
cazi
one (m
in
)
wt% GP
Figura 3-4. Andamento del tempo di inizio gelificazione delle soluzioni di gelatina in funzione della percentuale di reticolante (GP) addizionata.
I dati relativi ai gradi di rigonfiamento e di dissoluzione dei campioni di gelatina pura reticolata, in funzione della percentuale di reticolante hanno confermato che il 2.5 % (w/w) di genipina è la concentrazione limite oltre la quale i gradi di rigonfiamento e di dissoluzione non subiscono nessuna variazione (Figura 3-5 a-b).
Figura 3-5. Andamento del grado di rigonfiamento (a) e di dissoluzione (b) dei campioni reticolati di gelatina, in funzione della quantità di reticolante, dopo 24 h di permanenza dei campioni in tampone fosfato a pH 7.4, a 37 °C. Le colonne indicano il valore medio di tre misurazioni, mentre le barre indicano la deviazione standard (n=3).
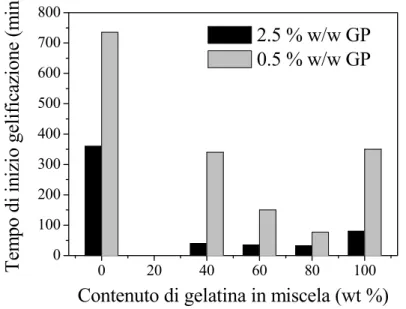
In Figura 3-6 vengono anche riportati gli andamenti del tempo di inizio gelificazione delle miscele CS/G, reticolate con lo 0.5 % (w/w) e il 2.5 % (w/w) di GP. In questo caso, il tempo di inizio gelificazione diminuisce al crescere della percentuale di reticolante adoperata e varia con la composizione della miscela, in un modo dipendente dalla concentrazione di gruppi amminici reattivi e dal pH della soluzione. Precisamente, un’elevata concentrazione di gruppi amminici primari favorisce la reazione (quindi riduce il tempo di gelificazione), mentre un pH acido sfavorisce la cinetica della reazione (quindi causa un aumento del tempo di gelificazione) [Mi et al., 2003]. Nonostante le miscele a maggiore contenuto di CS abbiano una maggiore concentrazione di gruppi reattivi, l’acidità del pH (crescente al crescere del contenuto di CS) ha determinato un rallentamento della cinetica di
0
100
200
300
400
500
600
700
800
2
2,5
3
3,5
wt % GP
G
ra
do di
r
igonf
ia
m
ent
o
-(w
t %
)
2.0
2.5
3.0
3.5
0
5
10
15
20
25
G
rado di
di
ssol
uzione (w
t %
)
wt % GP
(a)
(b)
gelificazione al crescere della percentuale di CS in miscela, particolarmente evidente per concentrazioni basse di reticolante (0.5 % (w/w)).
0 20 40 60 80 100 0 100 200 300 400 500 600 700 800
Tem
po di
in
iz
io
gel
if
icazione (m
in
)
Contenuto di gelatina in miscela (wt %)
2.5 % w/w GP
0.5 % w/w GP
Figura 3-6. Andamento dei tempi di inizio gelificazione per le soluzioni di miscele CS/G, in funzione del contenuto di gelatina in miscela e della quantità di reticolante addizionata. I dati sono stati mediati su tre misure.
Lo schema della reazione della genipina con molecole contenenti gruppi amminici (Figura 3-2 a-b) illustra come la reazione di reticolazione, promossa dalla genipina, porti alla formazione di un gruppo amminico terziario e di un gruppo ammidico secondario, a partire da due ammine primarie. Nel caso delle miscele CS/G, le macromolecole coinvolte nella reazione sono le catene macromolecolari del chitosano (che contengono una quantità di gruppi amminici primari, dipendente dal grado di deacetilazione) e i residui di lisina e idrossilisina della gelatina, che contengono gruppi laterali amminici [Butler et al., 2003]. Come già accennato nella parte introduttiva, il meccanismo di reticolazione delle miscele CS/G è complicato dalle possibili reazioni di polimerizzazione della genipina.
3.3.2 Analisi termogravimetrica (TGA)
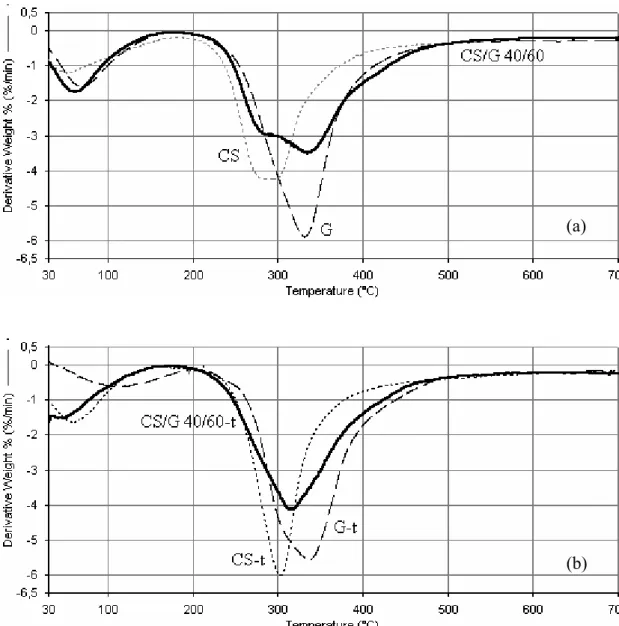
Le curve relative all’analisi TGA dei campioni delle miscele CS/G hanno evidenziato due fenomeni degradativi: il primo nell’intervallo di temperatura 50-150 °C, legato all’evaporazione dell’acqua, e il secondo nell’intervallo di temperatura 200-500 °C, legato alla pirolisi dei polimeri. La Tabella 3-1 raccoglie le temperature di massima velocità di degradazione (Td) per tutti i campioni studiati, derivate dalle curve DTG e relative ai fenomeni di pirolisi dei polimeri. I dati termogravimetrici di Tabella 3-1 hanno mostrato la maggiore stabilità termica della gelatina (di circa 32-40°C) rispetto al chitosano, sia per i campioni non reticolati, sia per quelli reticolati termicamente o con genipina. La reticolazione ha determinato modeste variazioni nei valori delle temperature di massima velocità di degradazione dei campioni di gelatina e di chitosano (2-8°C).
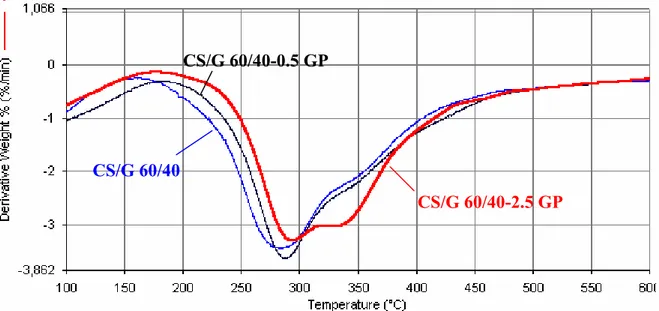
Per le miscele non reticolate e per quelle reticolate con GP, la Tabella 3-1 riporta due temperature di massima velocità di degradazione che sono legate alla pirolisi dei singoli componenti. Al contrario, per i campioni reticolati tramite trattamento DHT, è stato rilevato un singolo picco di degradazione nelle curve DTG, con temperatura intermedia, rispetto a quella registrata per i due componenti puri reticolati, e crescente all’aumentare del contenuto di gelatina. Le Figure 3-7a e 3-7b mostrano, rispettivamente, le curve termogravimetriche derivative (DTG) per la miscela CS/G 40/60, per il CS e per la G, e per le loro controparti sottoposte a processo DHT. La Figura 3-8 riporta le curve derivative termogravimetriche delle miscele CS/G 60/40 non reticolate e reticolate con diverse percentuali di GP.
Le Figure 3-7 e 3-8 mostrano chiaramente il diverso comportamento delle miscele non reticolate e di quelle reticolate termicamente e con GP.
I risultati dell’analisi termogravimetrica, quindi, hanno mostrato che il processo DHT ha modificato le proprietà di degradazione termica delle miscele chitosano/gelatina. Le variazioni delle proprietà termiche potrebbero essere un indizio delle maggiori interazioni tra i due componenti chitosano e gelatina nelle miscele sottoposte al processo DHT, rispetto alle miscele non sottoposte a tale trattamento, a seguito della formazione di legami esterei e/o ammidici tra le catene macromolecolari della gelatina e/o tra le macromolecole della gelatina e quelle del chitosano.
Tuttavia, per le miscele chitosano/gelatina reticolate con GP, gli eventi di pirolisi dei due componenti sono risultati distinti: il differente comportamento delle miscele reticolate con GP, rispetto alle miscele reticolate termicamente, potrebbe essere legato alla diversa natura dei ponti di reticolazione. La reticolazione con GP può comportare la formazione di ponti di reticolazione a base di oligomeri di GP. Probabilmente la stabilità termica dei “ponti” di reticolazione a base di GP è inferiore a quella del chitosano e della gelatina e ciò comporta la formazione di due picchi di pirolisi separati per i due componenti. Questi ipotesi, tuttavia, dovrebbe essere supportata da dati sperimentali relativi all’analisi termogravimetrica di oligomeri a base di GP.
Tabella 3-1. Temperature di massima velocità di degradazione termica per le miscele CS/G non reticolate, reticolate termicamente e reticolate con reticolante chimico.
Td (°C)
Contenuto di G in miscela
(wt %) Miscele non reticolate
Reticolate termicamente Reticolate con GP: 0.5 % (w/w) Reticolate con GP: 2.5 % (w/w) 0 280-300 304 298 292 40 288 (347)a 294 286.5; (345)a 291; 337 60 (287)a 336 316 290; 338 290; 336 80 (287)a 326 332 (280)a; 328 (280)a; 326 100 332 336 338 (308)a; 333
Figura 3-7. Curve derivative termogravimetriche relative al chitosano, alla gelatina e alla miscela chitosano/gelatina 40/60, prima (a) e dopo (b) il processo di reticolazione termica.
(a)
Figura 3-8. Curve derivative termogravimetriche relative alla miscela chitosano/gelatina 60/40: non reticolata (curva blu); reticolata con lo 0.5 % (w/w) di GP (curva nera); reticolata con il 2.5 % (w/w) di GP (curva rossa).
3.3.3 Analisi all’infrarosso (FTIR-ATR)
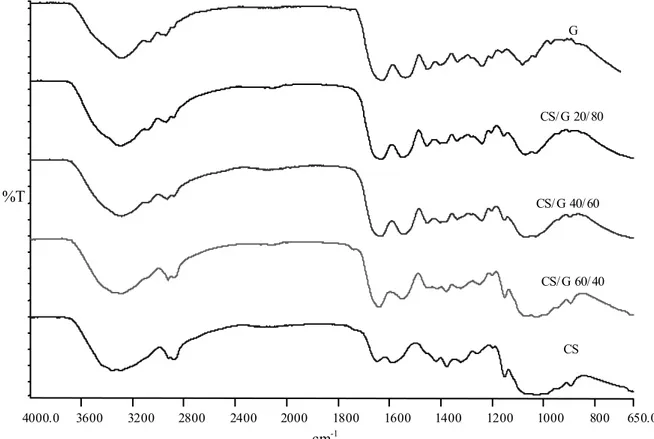
La Figura 3-9 mostra gli spettri FTIR-ATR dei campioni in forma di film per casting di chitosano, gelatina e delle miscele chitosano/gelatina non reticolate.
Lo spettro FTIR-ATR del CS ha evidenziato le bande tipiche ti questo polimero: nell’intervallo di frequenze 3400-3500 cm-1 si sovrappongono le bande dovute alle vibrazioni di stretching dei gruppi amminici e alcolici; a 1587 cm-1 e a 1414 cm-1 si localizzano rispettivamente le bande caratteristiche delle vibrazioni di bending dei gruppi ammidici e amminici e quelle di bending dei gruppi primari alcolici O-H.; la banda a 1647 cm-1 è dovuta alle vibrazioni di stretching del legame C=O del gruppo ammidico e suggerisce che il CS è un prodotto parzialmente deacetilato. Le bande di assorbimento a 1151 cm-1 (stretching asimmetrico del ponte C-O-C) e a 1027 cm-1 (vibrazioni di stretching del C-O) sono tipiche della struttura saccaride del chitosano [Peniche et al., 1998].
Lo spettro della gelatina ha mostrato le caratteristiche bande dell’ammide I e dell’ammide II, rispettivamente a 1629 cm-1 e a 1538 cm-1. L’assorbimento dell’ammide I deriva principalmente dalle vibrazioni di stretching del C=O ammidico proteico. L’assorbimento dell’ammide II è legato alle vibrazioni di bending dell’N-H amminico e ammidico [Jackson et al., 1995].
CS/G 60/40-2.5 GP
CS/G 60/40-0.5 GP
3600 4000.0 3200 2800 2400 2000 1800 1600 1400 1200 1000 800 650.0 cm-1 %T CS G CS/ G 40/ 60 CS/ G 20/ 80 CS/G 60/40
Figura 3-9. Spettri FTIR-ATR relativi alle miscele CS/G non reticolate.
La Figura 3-10 riporta gli spettri FTIR-ATR delle miscele sottoposte a trattamento termico sotto vuoto. Lo spettro FTIR-ATR del CS-t non ha evidenziato significative variazioni, rispetto allo spettro del chitosano non reticolato. Alcuni ricercatori, studiando la degradazione termica del chitosano, hanno mostrato come un trattamento termico fino a 160°C abbassi la solubilità del chitosano, senza determinare cambiamenti significativi nello spettro infrarosso del chitosano [Bengisu et al., 2002]. Al contrario, la gelatina e le miscele chitosano/gelatina hanno subito delle variazione nelle loro caratteristiche chimiche a seguito del trattamento DHT, che ha causato la formazione di legami ammidici tra i gruppi amminici del chitosano e/o della gelatina con i gruppi carbossilici della gelatina, e anche la formazione di legami esterei tra i gruppi idrossilici del chitosano e/o della gelatina con quelli carbossilici delle macromolecole di gelatina.
Tuttavia, gli spettri FTIR-ATR dei campioni di G-t e delle miscele (CS/G)-t sono risultati simili a quelli dei rispettivi campioni non trattati, per via della sovrapposizione delle bande di assorbimento caratteristiche dei legami esterei e ammidici con quelle tipiche del chitosano e della gelatina.
Figura 3-10. Spettri FTIR-ATR relativi alle miscele (CS/G)-t (reticolate termicamente).
Le Figure 3-11 e 3-12 mostrano gli spettri FTIR-ATR delle miscele chitosano/gelatina reticolate rispettivamente con lo 0.5 % e il 2.5 % di genipina.
Gli spettri FTIR-ATR delle miscele CS/G reticolate con genipina hanno mostrato lievi variazioni rispetto a quelli degli stessi campioni non reticolati. In particolare, lo spettro FTIR-ATR delle miscele reticolate ha evidenziato una leggera crescita del rapporto tra le intensità della banda di stretching del C=O ammidico (1630-1640 cm-1) e quella di bending del legame N-H amminico e ammidico (1540-1550 cm-1). Tali variazioni sono riportate nella Tabella 3-2 e sono in linea con la tipologia delle reazioni di reticolazione, che hanno comportato la formazione di un’ammina terziaria e di un’ammide a partire da due funzionalità amminiche. In particolare, le miscele reticolate con la più alta percentuale di reticolante (2.5% in peso) hanno registrato le variazioni più significative del rapporto di banda analizzato. Non si sono registrate variazioni significative del rapporto di banda A1630-1640/A1540-1550 per i campioni di chitosano, probabilmente a causa della formazione di un numero ridotto (rispetto agli altri campioni) di ponti di reticolazione piuttosto lunghi, in forma di oligomeri di genipina, a seguito dei tempi piuttosto lunghi delle reazioni di reticolazione (Figura 3-6).
4000.0
3600 3200 2800 2400 2000 1800 1600 1400 1200 1000 800 650.0
cm
-1%T
G-t
CS-t
(CS/G 80/20)-t
(CS/G 60/40)-t
(CS/G 40/60)-t
Figura 3-11. Spettri FTIR-ATR relativi alle miscele (CS/G)-0.5GP.
Figura 3-12. Spettri FTIR-ATR relativi alle miscele (CS/G)-2.5 GP.
4000
.03600 3200 2800 2400 2000 1800 1600 1400 1200 1000 800 650.0
cm
-1%T
CS-0.5 GP
G-0.5 GP
(CS/G 20/80)-0.5 GP
(CS/G 40/60)-0.5 GP
(CS/G 60/40)-0.5 GP
4000.0
3600 3200 2800 2400 2000 1800 1600 1400 1200 1000 800 650.0
cm
-1%T
G-2.5 GP
CS-2.5 GP
(CS/G 40/60)-2.5 GP
(CS/G 60/40)-2.5 GP
(CS/G 20/80)-2.5 GP
Tabella 3-2. Valore del rapporto tra le intensità delle bande di assorbimento a 1630-1640 cm-1 e a
1540-1550 cm-1, in funzione della composizione delle miscele CS/G e della quantità di reticolante
adoperata (genipina). Rapporto di banda: A1630-1640/A1540-1550 Campioni 0 % GP 0.5 % GP 2.5 % GP CS 1.0 1.0 1.0 CS/G 60/40 1.5 1.6 2.4 CS/G 40/60 1.6 1.6 2.2 CS/G 20/80 1.4 1.6 1.6 G 1.5 1.6 1.7
3.3.4 Analisi al microscopio elettronico a scansione (SEM)
Le Figure 3-13 a-b riportano, a titolo esemplificativo, le immagini SEM delle superfici delle sezioni fratturate dei campioni di CS/G 40/60 e (CS/G)-t 40/60 in forma di films per casting.
Per le miscele chitosano/gelatina, l’analisi SEM delle sezioni non ha mostrato segni di separazione di fase tra i due componenti: le superfici di frattura sono risultate omogenee, caratteristica che può essere attribuita ad una buona compatibilità delle miscele chitosano/gelatina.
Figura 3-13. Immagini SEM di sezioni di films fratturati in azoto liquido di: (a) CS/G 40/60 e (b) (CS/G)-t 40/60.
3.3.5 Risultati della misura dell’angolo di contatto
La Figura 3-14 riporta gli angoli di contatto delle miscele chitosano/gelatina trattate termicamente e non trattate termicamente. Tutti i campioni hanno mostrato un comportamento idrofilo con angoli di contatto di 78-90°. Tali valori rientrano nell’intervallo indicato in letteratura come ottimale per l’adesione cellulare [Vogler et al., 1998; Van Wachem et al., 1985]. Il trattamento DHT ha determinato una certa diminuzione dell’idrofilia dei campioni di gelatina e di chitosano/gelatina, attribuibile alla formazione di legami ammidici ed esterei a partire da funzionalità idrossiliche, amminiche e carbossiliche, maggiormente idrofile. Al contrario, l’idrofilia del chitosano è aumentata a seguito del trattamento termico: probabilmente tale trattamento ha causato un riarrangiamento delle macromolecole con la preferenziale distribuzione delle funzionalità idrofile sulla superficie del campione.
Gli angoli di contatto dei campioni di chitosano/gelatina e di gelatina reticolati con GP sono risultati maggiori di quelli dei rispettivi campioni reticolati termicamente. Inoltre, per ogni composizione, gli angoli di contatto sono risultati crescenti al crescere della quantità di GP impiegata: questo comportamento può essere attribuito alla riduzione del numero di funzionalità idrofile dei campioni, a seguito delle reazioni di reticolazione. Precisamente, alcune composizioni reticolate con genipina sono risultate idrofobe (CS/G 60/40-0.5 GP, CS/G 60/40-2.5 GP; CS/G 20/80-2.5 GP; CS/G 20/80-0.5 GP)
In generale, le caratteristiche di idrofobicità non sono ottimali per l’adesione cellulare, che comunque risulta influenzata da molte altre caratteristiche superficiali del substrato: natura chimica, densità di carica elettrica, rugosità, etc. Al contrario, i campioni di chitosano reticolati con GP hanno mostrato angoli di contatto inferiori a quello del film di chitosano sottoposto a trattamento termico e un’idrofilia crescente al crescere della percentuale di reticolante. L’idrofilia dei campioni CS-0.5 GP e CS-2.5 GP può essere attribuita alla formazione, per reticolazione, di un network poroso che ha aumentato l’affinità dei materiali verso i mezzi acquosi (come mostrato dalle prove di rigonfiamento riportate nel paragrafo successivo 3.3.6)
Figura 3-14. Angolo di contatto per i campioni di miscele chitosano/gelatina non reticolati, reticolati termicamente, reticolati con lo 0.5 % (w/w) e il 2.5 % (w/w) di GP. Le colonne indicano il valore medio mentre le barre indicano la deviazione standard (n = 5). La linea tratteggiata è stata tracciata in corrispondenza di un angolo di contatto di 90°.
3.3.6 Risultati delle prove di rigonfiamento e di dissoluzione.
Le Figure 3-15 a-d riportano gli andamenti dei gradi di rigonfiamento e di dissoluzione dei campioni di CS/G e di (CS/G)-t in funzione del tempo di prova. In particolare, i films ad alto contenuto di gelatina (100 wt.% e 80 wt.%) si sono sciolti nella soluzione di tampone fosfato a pH 7.4 in un tempo inferiore ad 1 h. Per le miscele CS/G 40/60, 60/40 e per il CS puro, a parità di tempo di prova, i gradi di rigonfiamento e di dissoluzione si sono mostrati crescenti al crescere del contenuto di gelatina in miscela. Ad alti tempi di prova, inoltre, si è registrata una riduzione nel grado di rigonfiamento e un incremento del grado di dissoluzione, per i campioni di CS, CS/G 40/60 e di CS/G 60/40. Precisamente, il grado di rigonfiamento del CS ha mostrato un incremento da un valore pari all’84 % in peso dopo 1 h a un valore del 104 % in peso dopo 3 h, per poi decrescere al 14 % dopo 48 h. Corrispondentemente, il grado di dissoluzione del CS si è mantenuto basso e costante (3-5 % in peso) nelle prime 3 h, per poi aumentare fino al 53 % in peso dopo 48 h. Il grado di rigonfiamento dei campioni di CS/G 60/40 e 40/60 ha mostrato un massimo, rispettivamente dopo 3 h (con valore del rigonfiamento pari al 225 % in peso) e dopo 1 h (con valore del rigonfiamento pari al 260 % in peso) di prova. Il tempo corrispondente al massimo grado di rigonfiamento, quindi, ha evidenziato un decremento al crescere del contenuto di gelatina, a causa della minore stabilità in ambiente acquoso dei campioni ad alto contenuto di gelatina. Il grado di dissoluzione dei campioni di CS/G 60/40 e 40/60 ha mostrato una crescita al crescere del tempo di prova, raggiungendo, rispettivamente, i valori del 80 % in peso e dell’85 % in peso dopo 24 h di prova.
Per quanto riguarda i campioni trattati termicamente, i films di G-t hanno mostrato un andamento crescente del grado di rigonfiamento in funzione del tempo, per tempi di prova inferiori a 3 h.
0 20 40 60 80 100 120 140 0 40 60 80 100 wt % Gelatina A ngol o di cont at to ( °) CS/G CS/G-T CS/G-0.5GP CS/G-2.5 GP
Tuttavia, il processo di dissoluzione dei campioni di G-t si è svolto in un tempo relativamente breve, con un incremento del processo di dissoluzione per tempi superiori a 3 h, causando un decremento del grado di rigonfiamento per tempi superiori a 3 h. La dissoluzione dei campioni di G-t si è completata nell’arco delle 24 h.
I campioni di CS-t hanno evidenziato un grado di rigonfiamento approssimativamente costante (56-61 % in peso) per un tempo di prova inferiore alle 24 h; un incremento del grado di rigonfiamento del CS-t si è avuto nelle ore successive con un valore del 100 % in peso dopo 48 h. Il grado di dissoluzione del CS-t si è mantenuto prossimo allo 0 % in peso durante le prime 6 h, ed ha raggiunto un valore pari al 5-8 % in peso dopo 24-48 h.
I gradi di rigonfiamento e di dissoluzione delle miscele (CS/G)-t sono risultati inferiori a quelli dei rispettivi campioni non trattati termicamente: precisamente, il grado di dissoluzione delle miscele (CS/G)-t si è mostrato crescente durante le prime 6 h e poi ha mostrato una decrescita causata dalla parziale dissoluzione dei campioni. Il grado di dissoluzione dei campioni, al contrario, ha mostrato una crescita al crescere del tempo di prova. Precisamente, i campioni di miscela (CS/G 20/80)-t hanno perso una quantità considerevole del loro peso (circa il 55 %) nelle prime 6 h. Le miscele (CS/G 40/60)-t e (CS/G 60/40)-t hanno mostrato una maggiore stabilità legata al maggiore contenuto in chitosano: i massimi gradi di dissoluzione per le due miscele si sono registrati dopo 48 h con valori rispettivi dei gradi di dissoluzione pari al 48 % in peso e al 7.6 % in peso.
Riassumendo, le prove di dissoluzione e di rigonfiamento hanno evidenziato che, per le miscele CS/G, la stabilità in ambiente acquoso cresce al crescere del contenuto di CS: questo risultato è attribuibile all’insolubilità del CS in mezzi aventi un pH>6.5. Il trattamento DHT, inoltre, ha determinato una riduzione dei gradi di rigonfiamento e di dissoluzione delle miscele, a parità di tempo di prova. Il comportamento delle miscele sottoposte a trattamento termico è attribuibile alla presenza di un
network tra le macromolecole di chitosano e di gelatina e tra quelle di sola gelatina, dovuto alla
formazione di legami ammidici ed esterei durante il trattamento DHT.
Al contrario, il trattamento DHT effettuato non può avere modificato le caratteristiche chimiche del chitosano, sia alla luce della sua natura chimica sia considerando i dati di letteratura [Pawlak et al., 2003]. Le macromolecole di chitosano, infatti, non posseggono funzionalità in grado di reagire tra loro attraverso il semplice trattamento fisico DHT. Tuttavia, l’evaporazione dell’umidità dai campioni di chitosano durante il trattamento DHT ha probabilmente determinato cambiamenti conformazionali, con una crescita della densità di impacchettamento delle macromolecole di chitosano e la formazione di legami idrogeno diretti tra le catene di chitosano [Ogawa et al., 2004].
La Figura 3-16 a-b riporta i gradi di rigonfiamento e di dissoluzione delle miscele reticolate con genipina, dopo 24 h di prova. Il grado di rigonfiamento delle miscele ha mostrato una decrescita al crescere del contenuto di GP dallo 0.5 % (w/w) al 2.5 % (w/w). Al contrario, un contenuto crescente di reticolante ha determinato una crescita del grado di rigonfiamento per il chitosano. Il diverso comportamento del chitosano rispetto alle miscele può essere attribuito al fatto che la reticolazione del chitosano è avvenuta in un ambiente con un pH maggiormente acido. La cinetica del secondo stadio della reazione di reticolazione (c.f.r. 3.1, Figura 3-2) è rallentata da un pH acido [Mi et al., 2003], quindi è lecito aspettarsi che le molecole di genipina, aggraffate al chitosano, abbiano subito un processo di oligomerizzazione, prima di riuscire a completare il processo di reticolazione. Le reazioni di oligomerizzazione hanno determinato la formazione di “ponti di reticolazione” più lunghi, con l’ottenimento di un network poroso con caratteristiche di rigonfiamento maggiori di quelle dei campioni reticolati di gelatina e a base delle miscele chitosano/gelatina.
I gradi di dissoluzione dei campioni di CS-0.5 GP e CS-2.5 GP sono risultati vicini allo 0% dopo 24 h di prova. Per le miscele CS/G-0.5 GP, i gradi di dissoluzione sono risultati crescenti con il contenuto di gelatina e maggiori di quelli misurati per le corrispondenti miscele CS/G-2.5 GP. I gradi di dissoluzione delle miscele CS/G-2.5 GP hanno mostrato una dipendenza meno marcata dal contenuto di gelatina, rispetto alle miscele reticolate con lo 0.5 % (w/w) di GP.
Il confronto tra i dati relativi al grado di dissoluzione dopo 24 h di tutti i campioni reticolati ha mostrato che la reticolazione tramite trattamento termico e quella con lo 0.5 % (w/w) di GP hanno un’analoga efficacia. I campioni reticolati con il 2.5 % (w/w) di GP, al contrario, hanno mostrato una maggiore stabilità in ambiente acquoso. Il trattamento di reticolazione con il 2.5 % (w/w) di GP, inoltre, ha permesso di ottenere campioni di gelatina che dopo 24 h di permanenza in ambiente acquoso hanno perso, all’incirca, solo il 12 % del loro peso iniziale. La gelatina reticolata
Il confronto tra i gradi di rigonfiamento dei campioni reticolati, dopo 24 h di prova, ha mostrato che il grado di rigonfiamento dei campioni reticolati con il 2.5 % (w/w) di GP è stato inferiore, a parità di composizione, a quello degli altri campioni reticolati. I campioni reticolati con lo 0.5 % (w/w) di GP hanno mostrato gradi di rigonfiamento leggermente maggiore di quelli dei campioni reticolati termicamente, a parità di composizione, pure avendo analoghi gradi di dissoluzione: tale comportamento è stato probabilmente causato dalla natura dei “ponti” di reticolazione che sono risultati più “lunghi” nel caso dei campioni reticolati con GP.
0 50 100 150 200 250 300 48 24 6 3 1
G
ra
do di rig
onf
iam
ento (wt %
)
tempo (h)
CS CS/G 60/40 CS/G 40/60(a)
0 100 200 300 400 500 600 700 800 900 CS-t CS/G 60/40-t CS/G 40/60-t CS/G 20/80-t G-t 48 24 6 3 1G
rado di r
ig
onf
ia
m
ento (
w
t %
)
tempo (h)
(b)
Figura 3-15. Comportamento a rigonfiamento e dissoluzione delle miscele CS/G (a, c) e (CS/G)-t (b, d) in funzione del tempo. I dati sono mediati su tre misure. Le barre indicano la deviazione standard (n=3). 0 10 20 30 40 50 60 70 80 90 100 110 120 130 CS CS/G 20/80 CS/G 60/40 G CS/G 40/60 48 24 6 3 1
tempo (h)
G
ra
do di di
ssoluz
ione (wt %
)
0 10 20 30 40 50 60 70 80 90 48 24 6 3 1Gra
do di dissol
uz
ione
(
w
t %
)
tempo (h)
CS-t CS/G 60/40-t CS/G 40/60-t CS/G 20/80-t G-t(c)
(d)
Figura 3-16. Andamento dei gradi di rigonfiamento (a) e di dissoluzione (b) delle miscele chitosano/gelatina reticolate con lo 0.5 % (w/w) e il 2.5 % (w/w), dopo 24 h di permanenza in soluzione di tampone fosfato a pH 7.4 e alla temperatura di 37°C. Le colonne indicano il valore medio, mentre le barre indicano la deviazione standard (n=3).
3.3.7 Caratteristiche meccaniche
Il modulo elastico dei campioni di (CS/G)-t, valutato sia allo stato umido sia allo stato asciutto, è stato riportato in Figura 3-17, in funzione del contenuto di gelatina in miscela. I moduli elastici dei campioni allo stato asciutto sono stati confrontati con quelli ricavati dal modello in serie, dopo avere calcolato la composizione volumetrica delle miscele chitosano/gelatina, sulla base dei dati di densità del chitosano e della gelatina, riportati in letteratura (ρCS = 1.5 g/cm3 [Dufresne et al., 1999]; ρG = 1.369 g/cm3 [Mwangi et al., 2004]).
Il modulo di Young dei campioni di (CS/G)-t allo stato asciutto è risultato crescente al crescere del contenuto di CS. La deviazione del comportamento sperimentale dei moduli elastici dalla legge additiva in funzione della composizione può essere attribuito alla formazione di legami chimici tra i
0 20 40 60 80 100 0 50 100 150 200 250 300 350 400 450 500 550 wt % G G rad o di r igonf iam en to (wt % ) 0.5 wt% GP 2.5 wt% GP
(a)
0 20 40 60 80 100 0 10 20 30 40 50 60 70 80 90 100G
rado
di
di
ssoluzione (wt %
)
wt % G
(b)
Il modulo elastico dei campioni allo stato umido è risultato molto inferiore a quello dei corrispondenti campioni asciutti e decrescente al crescere del contenuto di gelatina. Questo comportamento può essere attribuito alle proprietà di rigonfiamento dei campioni, che sono risultate crescenti all’aumentare del contenuto di gelatina. La soluzione acquosa incorporata dai campioni rigonfiati ha esercitato un’azione plasticizzante, con conseguente diminuzione del modulo elastico. Le misure di modulo elastico a umido hanno fornito indicazioni circa i possibili campi di applicazione delle miscele (CS/G)-t, come scaffolds per l’ingegneria tissutale. Gli sforzi all’interfaccia tra il biomateriale ed il tessuto, infatti, a causa del movimento naturale del tessuto, influenzano la reazione dell’organismo: se lo scaffolds presenta un modulo elastico più elevato di quello del tessuto, gli sforzi si concentrano all’interfaccia, con la conseguente formazione di una capsula fibrotica [Hilborn et al., 2004]. La somiglianza tra il modulo elastico dello scaffold e quello del tessuto evita l’innescarsi di una reazione dell’organismo, con la formazione di una capsula fibrotica, pertanto le proprietà meccaniche a umido rappresentano un valido criterio per stabilire la possibilità di utilizzo di un certo materiale per una determinata applicazione biomedica. La Tabella 3-3 riporta i moduli elastici di alcuni tessuti umani, derivati dalla letteratura: il confronto tra il modulo elastico delle miscele (CS/G)-t allo stato umido e i dati riportati in Tabella 3-3 ha permesso di stabilire la possibilità di utilizzare le miscele (CS/G)-t per la rigenerazione di tessuti soft, come pelle e nervi.
Tabella 3-3. Modulo elastico di vari tessuti soft (ricavato da [Wong et al., 2004])
Tessuto Tipo Modulo elastico
(Mpa)
Vena a Safena 0.027
Arteria b Aorta toracica Aorta addominale Arteria carotide Arteria iliaca
Arteria anteriore cerebrale
1.0 1.0 1.0-3.0 3.0 5.5 Nervo Sciatico c
Spina dorsale bovina Materia grigia umana
7.0
(a taglio): 50 Pa (a taglio): 200 Pa Tendine Patellare
Flessore profondo delle dita Estensore lungo delle dita
300-350 1000 1600 Cartilagine d Cartilagine articolare 10.5
Pelle d - 0.1-0.2
a Misurata a 1 kPa b Misurata a 13.3 kPa c Tessuto murino
Figura 3-17. Moduli elastici dei campioni di miscele chitosano/gelatina: (a) campioni allo stato asciutto e confronto tra i dati sperimentali e la curva ottenuta applicando la legge additiva delle miscele; (b) campioni allo stato umido. I dati riportati sono stati mediati su tre misure (n=3).
0 20 40 60 80 100 100 150 200 250 300 350 400 450 500 550 600 650
M
odulo di Y
oung (M
Pa
)
G (vol %)
Experimental data In-series model(a)
0 100 200 300 400 500 600 0 40 60 80 100 G (wt. %) M odul o di Y oung (M Pa ) . . wet samples(b)
La Figura 3-18 riporta i moduli di Young allo stato secco per i campioni a base delle miscele chitosano/gelatina reticolate con genipina e termicamente. Il modulo elastico delle miscele chitosano/gelatina reticolate con genipina è risultato crescente al crescere del contenuto di reticolante impiegato, per ogni composizione. Per le miscele chitosano/gelatina, contenenti una percentuale di gelatina maggiore o uguale al 60%, il modulo elastico dei campioni reticolati con genipina è risultato, generalmente, maggiore di quello dei campioni reticolati termicamente. Questo risultato può essere legato alla maggiore efficienza di reticolazione, ottenuta per queste composizioni, adoperando genipina. Al contrario, nel caso del chitosano puro e della miscela chitosano/gelatina 60/40, i campioni reticolati termicamente hanno mostrato una maggiore rigidità. Questo comportamento può essere attribuito al fatto che, nel caso delle composizioni a maggiore contenuto in chitosano, in fase di reticolazione, il pH delle soluzioni è risultato minore rispetto a quello delle altre composizioni. La maggiore acidità del mezzo di reazione ha comportato tempi di reticolazione della genipina maggiori, con la formazione di ponti di reticolazione lunghi costituiti da oligomeri di genipina. I campioni reticolati termicamente, al contrario, presentano ponti di reticolazione più corti tra le macromolecole. La diversa rigidità dei campioni può essere attribuita alla diversa natura e lunghezza dei ponti reticolazione.
0
100
200
300
400
500
600
700
800
0
40
60
80
100
Contenuto di gelatina (wt %)
M
odul
o di
Y
oung (
M
Pa
)
CS/G-0.5 GP
CS/G-2.5GP
CS/G-T
Figura 3-18. Moduli elastici dei campioni di miscele chitosano/gelatina allo stato asciutto, reticolati con lo 0.5 % e il 2.5 % in peso di genipina. I dati riportati sono stati mediati su tre misure. Le barre indicano la deviazione standard (n=3).
3.3.8 Caratteristiche morfologiche degli scaffolds prodotti attraverso la tecnica di soft
lithography
La Figura 3-19 a-c riporta alcuni esempi di scaffolds bidimensionali ottenuti tramite soft lithography. La tecnica di soft lithography si è rivelata piuttosto versatile, permettendo la produzione di scaffolds con differenti geometrie ed una risoluzione micrometrica, entrambe dipendenti dal tipo di stampo adoperato. La Figura 3-19 a mostra uno scaffold costituito da una serie di linee in rilievo, larghe 20 µm e tra loro parallele, poste a 150 µm l’una dall’altra.
La Figura 3-19 b mostra uno scaffold in forma di film sagomato con scanalature quadrate di 200 × 200 µm2; i bordi in rilievo tra le scanalature sono larghi 65 µm o 150 µm, a seconda della zona dello
scaffold. Infine, la Figura 3-19 c mostra uno scaffold in forma di griglia con maglie quadrate di 65 × 65 µm2; le linee della griglia sono larghe 65 µm.
Figura 3-19. Immagini ricavate tramite microscopio ottico di scaffolds di (CS/G)-t ottenuti tramite soft lithography.
3.3.9 Risultati delle prove cellulari in vitro.
La Figura 3-20 mostra l’andamento dell’area percentuale occupata dalle cellule sugli scaffolds di (CS/G)-t e su uno strato di gelatina in funzione del tempo. Il rapporto tra la densità cellulare sulle strutture e quella sullo strato di gelatina è un indice dell’efficienza di adesione cellulare [Vozzi et al., 2002]. 0 10 20 30 40 50 60 70 80 90 100 2 4 24 tempo (h) A rea occ u p at a d al le ce llu le ( % ) CS/G 20/80-t (F) CS/G 20/80-t (S) CS/G 40/60-t (F) CS/G 40/60-t (S) CS/G 60/40-t (F) CS/G 60/40-t (S) Gelatin
Figura 3-20. Area percentuale occupata dalle cellule misurata sugli scaffolds (sia ottenuti per soft lithography sia in forma di films per casting) di (CS/G)-t e su uno strato di controllo di proteina di adesione (gelatina) a diversi tempi (2, 4, 24 h). Le colonne indicano i valori medi, mentre le barre rappresentano le deviazioni standard (n=9).
Alla luce dei risultati dei tests di dissoluzione nelle soluzioni di tampone fosfato (che hanno mostrato che i campioni sono soggetti ad una perdita di peso crescente al crescere del contenuto di gelatina e del tempo di prova), è ragionevole supporre che i campioni sottoposti alle prove cellulari si siano inizialmente rigonfiati e poi parzialmente disciolti, rilasciando principalmente gelatina. Questo comportamento ha sicuramente causato una variazione della composizione dei campioni rispetto allo stato iniziale, con una crescita del contenuto in chitosano delle miscele.
La densità dei fibroblasti ha registrato un incremento al crescere del tempo di prova. L’adesione è risultata influenzata dalla composizione: dopo 2-4 h, i fibroblasti hanno aderito maggiormente sui campioni ad alto contenuto di chitosano. Probabilmente questo comportamento è legato alla maggiore
200 µm 200 µm 200 µm
l’adesione cellulare. Dopo 24 h, invece, è stato rilevato un andamento opposto: i campioni a maggiore contenuto in gelatina hanno mostrato la più alta densità cellulare. Questo risultato può essere legato sempre alla maggiore densità di carica superficiale positiva dei campioni ad alto contenuto di chitosano, che causa una forte adesione delle cellule allo scaffold e, di conseguenza, altera o modifica la crescita cellulare. Le interazioni elettrostatiche tra chitosano e gelatina, che coinvolgono i siti cationici del chitosano, crescono al crescere del contenuto di gelatina in miscela, causando una diminuzione della carica superficiale positiva dei campioni e favorendo così la proliferazione cellulare. Dopo un tempo di prova pari a 24 h, la proliferazione cellulare esercita un maggiore contributo sulla densità cellulare rispetto all’adesione cellulare. Di conseguenza, dopo 24 h, la densità cellulare è maggiore sui campioni che supportano meglio la proliferazione cellulare, cioè sui campioni ricchi in gelatina. L’effetto della densità di carica superficiale positiva del chitosano sulla densità cellulare è in linea con quanto riportato da altri autori [Mao et al., 2004; Chatelet et al., 2001].
L’adesione e proliferazione dei fibroblasti è anche risultata dipendente dalla topografia superficiale del substrato: per ogni composizione, la densità cellulare è risultata maggiore sugli scaffolds ottenuti per
soft lithography rispetto che sui films per casting. L’unica eccezione rispetto a questo andamento è
stata la miscela (CS/G 20/80)-t dopo un tempo di coltura pari a 24 h. La ragione di questo comportamento anomalo può essere attribuita al maggiore grado di dissoluzione dello scaffold rispetto al film per casting avente la stessa composizione, a causa della sua più elevata area superficiale. La parziale dissoluzione dello scaffold di (CS/G 20/80)-t ha determinato una parziale perdita di gelatina, con conseguente aumento della densità di carica superficiale positiva e riduzione della densità cellulare.
La Figura 3-21 a-b mostra l’andamento della densità cellulare su campioni in forma di films per
casting delle miscele chitosano/gelatina reticolate con lo 0.5 % (w/w) e con il 2.5 % (w/w) di GP, in
funzione del tempo.
Per le miscele CS/G-2.5 GP, la densità cellulare è risultata crescente con il contenuto di chitosano, mentre, nel caso delle miscele CS/G-0.5 GP, è stato registrato un valore elevato della densità cellulare per la miscela più ricca in gelatina (CS/G 20/80-2.5 GP). La ragione del diverso comportamento delle due tipologie di miscele può essere legata sia ad una diversa chimica superficiale (dipendente dal grado di reticolazione) sia al processo di dissoluzione parziale, cui sono soggetti i campioni debolmente reticolati e ricchi in gelatina, che ne influenza la composizione superficiale e interferisce con l’adesione cellulare attraverso il rilascio di gelatina.
Figura 3-21. Andamento della densità cellulare (fibroblasti di topo NIH 3T3): (a) per i campioni delle miscele (CS/G)-0.5GP e (b) per quelli delle miscele (CS/G)-2.5. Le colonne indicano il valore medio. Le barre indicano la deviazione standard (n=9).
E’ stata poi valutata l’adesione e la proliferazione dei neuroblasti che è risultata scarsa per le miscele contenenti il 40 % ed il 60 % in peso di gelatina ed elevata per le miscele contenenti l’80 % in peso di gelatina. La Figura 3-22 riporta la densità cellulare sui campioni di (CS/G 20/80)-t, CS/G 20/80-2.5 GP e su uno strato di poli-L-lisina, adoperata come bianco. I differenti risultati di adesione e proliferazione cellulare adoperando neuroblasti o fibroblasti hanno mostrato come i meccanismi di adesione e proliferazione cellulari siano specifici per il tipo di cellula.
0 200000 400000 600000 800000 1000000 1200000 4 24 48