P
P
P
r
r
r
e
e
e
d
d
d
i
i
i
s
s
s
p
p
p
o
o
o
s
s
s
i
i
i
z
z
z
i
i
i
o
o
o
n
n
n
e
e
e
G
G
G
e
e
e
n
n
n
e
e
e
t
t
t
i
i
i
c
c
c
a
a
a
a
a
a
l
l
l
l
l
l
e
e
e
C
C
C
o
o
o
m
m
m
p
p
p
l
l
l
i
i
i
c
c
c
a
a
a
n
n
n
z
z
z
e
e
e
d
d
d
e
e
e
l
l
l
D
D
D
i
i
i
a
a
a
b
b
b
e
e
e
t
t
t
e
e
e
Nei soggetti con diabete la distribuzione delle complicanze sia in termini di prevalenza che in termini di momento della comparsa in funzione della durata e dell’intensità dell'esposizione alla malattia, suggerisce fortemente che la suscettibilità allo sviluppo delle complicanze è controllata, almeno in parte, da fattori genetici (203,204). I pazienti con diabete tipo 2 presentano un rischio tre volte superiore rispetto alla popolazione generale di sviluppare malattie cardiovascolari, cosicchè circa il 75% di tali pazienti muore per eventi cardiovascolari. L’aumentato rischio non è completamente spiegato dai fattori tradizionali quali fumo, ipercolesterolemia, ipertensione né da fattori “specifici” quali il controllo glicemico, ne da fattori emergenti quali attivazione infiammatoria, insulino-resistenza, stato trombofilico o disfunzione endoteliale. Inoltre, il fatto che, indipendentemente dal grado del controllo glicemico (205) non tutti i diabetici sviluppano queste complicanze, insieme all’evidenza di una forte aggregazione familiare, suggeriscono che una parte della suscettibilità alla patologia cardiovascolare presenta una base genetica (203,204). Analogamente, nel diabete tipo 1 e nel diabete tipo 2, le complicanze microvascolari sono espressione dell'interazione tra il disordine metabolico (206) ed un substrato predisponente, di natura verosimilmente genetica. Tale ipotesi è indispensabile per spiegare le osservazioni epidemiologiche, per spiegare, per esempio, il peculiare andamento della incidenza della nefropatia in funzione della durata del diabete (155).
Se si confrontano l'andamento dell'incidenza di nefropatia e di retinopatia in relazione alla durata del diabete, la peculiarità della nefropatia è subito evidente. L'incidenza della retinopatia cresce in modo proporzionale alla durata della malattia durante i primi 20 anni di diabete e rimane poi costante negli anni seguenti. Nel caso della nefropatia si osserva un picco di incidenza tra i 10 e i 15 anni di durata del diabete, seguito però da un calo progressivo. L’andamento peculiare dell'incidenza della complicanza renale, incremento e poi decremento, può essere spiegato solo ipotizzando l’esistenza di un sottogruppo di pazienti selettivamente predisposto a questa complicanza. Una volta esaurito questo sottogruppo (durante i primi 15-20 anni di diabete), i pazienti rimasti sono più resistenti alla complicanza renale e l'incidenza della nefropatia si riduce.
La ricerca di una predisposizione genetica, non necessariamente comune a tutte le complicanze microangiopatiche e macrovascolari del diabete, deve essere inserita in un contesto dove numerosi fattori di rischio giocano un ruolo importante (97,147,148,207). Iperglicemia ed ipertensione (97,207), devono probabilmente coesistere per indurre l’insorgenza e modulare la progressione della nefropatia (154). Diabetici tipo 1 di lunga durata esenti da lesioni microvascolari rilevanti presentano
Inoltre, la variabilità tra etnie nella prevalenza della nefropatia potrebbe essere almeno in parte spiegata dalle differenze nell’incidenza dell’ipertensione. D’altra parte, non è possibile escludere che la presenza di ipertensione possa agire solo come fattore di progressione di un danno renale altrimenti indotto.
L'ipotesi di una predisposizione genetica allo sviluppo della nefropatia è sostenuta fortemente da alcuni studi familiari in cui è stato valutato il rischio di nefropatia in soggetti con diabete tipo 1 aventi un fratello anch'egli affetto da diabete tipo 1 "portatore" di nefropatia diabetica o da essa esente nonostante una lunga durata di malattia. Nello studio di Seaquist e coll. (177), albuminuria ed ESRD secondari a nefropatia diabetica sono più frequenti in fratelli diabetici di soggetti tipo 1 con nefropatia (83%) che in fratelli diabetici di soggetti tipo 1 senza complicanze renali (17%).
In uno studio successivo il rischio di nefropatia dopo 15-20 anni di diabete è risultato significativamente più alto (33% vs 10%) nei pazienti con un fratello diabetico a sua volta affetto da nefropatia (32). Nello studio di Quinn e coll. (178) dopo 25 anni di durata del diabete di tipo 1, il rischio cumulativo di nefropatia era del 71.5% se il probando presentava proteinuria, ma solo del 25.4% se il probando non aveva patologia renale (p<0.001). Secondo gli autori la differenza di circa il 50% nel rischio di nefropatia nei fratelli di diabetici tipo 1 in funzione della presenza o meno di complicanza renale in questi ultimi, sostiene l'ipotesi dell'esistenza di un gene maggiore autosomico dominante capace di predisporre i pazienti con diabete di tipo 1 allo sviluppo della nefropatia conclamata . I dati più recenti sono quelli del Diabetes Control and Complication Trial Research Group (179): l'aggregazione familiare della nefropatia e della retinopatia è stata studiata in 241 familiari con diabete di tipo 1 o tipo 2 di 217 soggetti arruolati nel DCCT: 53% appartenevano al gruppo in terapia intensiva, 47% al gruppo in terapia convenzionale, 44% appartenevano alla coorte in prevenzione primaria (senza retinopatia né albuminuria), 56% alla coorte in prevenzione secondaria.
Nella coorte in prevenzione secondaria, il rischio di retinopatia severa era maggiore nei familiari dei probandi positivi per retinopatia rispetto ai familiari dei probandi senza retinopatia (odds ratio (OR): 3.1; p<0.05), allo stesso modo, il rischio di nefropatia (AER >40 mg/24h) era maggiore nei familiari dei probandi positivi per nefropatia (OR: 5.4; p<0.001). Questo studio suggerisce che sia la severità della retinopatia che l’incidenza della nefropatia, sono influenzate da fattori familiari possibilmente genetici (179).
Anche nel diabete tipo 2 il rischio di sviluppare proteinuria è significativamente correlato con la storia familiare di nefropatia (209): avere entrambi i genitori diabetici e proteinurici aumenta di circa 3 volte (46%) la prevalenza della nefropatia nei discendenti; tale prevalenza è del 14% nei figli di genitori entrambi non proteinurici e del 25% nei figli di cui un solo genitore è proteinurico. L'aggregazione familiare di proteinuria e nefropatia osservata tra gli Indiani Pima con diabete tipo 2 (209) è stata descritta anche nelle popolazioni di origine caucasica. Nello studio di Faronato e coll. (210) il rischio (OR) di presentare elevati valori di AER nei soggetti con diabete tipo 2 fratelli di diabetici tipo 2 con albuminuria è risultato 3.94 (CI=1.93-9.01) quando confrontato al rischio di soggetti con diabete tipo 2 fratelli di diabetici tipo 2 con normoalbuminuria. Anche la retinopatia proliferante è risultata più frequente nelle famiglie che mostrano una aggregazione di diabete tipo 2 ed albuminuria (210). Nello studio di Canani e coll. (180), macroalbuminuria o ESRD erano presenti nel 5.2% dei gemelli di probandi normoalbuminurici, ma nel 24.1% (p=0.024) dei gemelli dei probandi macroalbuminurici.
Inoltre, cluster familiare di ipertensione e patologie cardiovascolari è stato osservato in famiglie in cui il probando presentava diabete tipo 2 e nefropatia (211,212). Il 73% dei soggetti microalbuminurici al momento della diagnosi di diabete tipo 2 presentavano una storia familiare positiva per ipertensione o malattia cardiovascolare; tale familiarità era presente solo nel 20% dei normoalbuminurici. Nel diabete tipo 2 sono state quindi descritte l’aggregazione familiare della nefropatia diabetica, una elevata prevalenza di ipertensione e malattie cardiovascolari nei genitori di diabetici tipo 2 con nefropatia, ma anche un aumento della pressione arteriosa ed un’elevata prevalenza di albuminuria tra i discendenti dei diabetici tipo 2 con nefropatia (213).
La frequente associazione tra nefropatia, ipertensione arteriosa e patologia cardiovascolare ha guidato l'attenzione sul possibile ruolo della predisposizione familiare all'ipertensione essenziale ed al processo aterosclerotico (e delle alterazioni dei meccanismi cellulari implicati nella regolazione del tono vascolare e della pressione sistemica) nel modulare la suscettibilità alla nefropatia ed alle altre complicanze del diabete. Nei genitori di diabetici tipo 1 con nefropatia sono stati rilevati sia aumentati livelli di pressione sistolica e diastolica (214) che maggior prevalenza di ipertensione arteriosa (215,216).
Nello studio di Fagerudd a coll. (175) la prevalenza di ipertensione è stata valutata in 109 genitori di 73 diabetici tipo 1 con nefropatia (DN+, AER>300 mg/24h) e in 112 genitori di 73 diabetici tipo 1 senza nefropatia (DN-, AER<30 mg/24h) ma con lunga durata del diabete.
L'ipertensione, definita come terapia con antipertensivi o pressione arteriosa media nelle 24 ore >135/85 mmHg, era presente nel 57% dei genitori dei DN+ e nel 41% dei genitori dei DN-(p=0.034). La predisposizione familiare all’ipertensione essenziale sebbene abbia un significato ancora incerto nell'individuare il sottogruppo di diabetici tipo 1 a rischio di sviluppare la nefropatia diabetica, sembra quindi aumentare il rischio di progressione della nefropatia diabetica e contribuire alla comparsa di ipertensione sistemica nei diabetici tipo 1 con nefropatia.
Un’altra serie di osservazioni interessanti deriva dagli studi che hanno dimostrato nei familiari dei diabetici con nefropatia una maggior frequenza di patologia cardiovascolare (173,176), una più elevata mortalità per malattie cardiovascolari (173) e una maggior incidenza di fattori di rischio per patologia aterosclerotica quali iperlipemia ed insulino-resistenza (174). Nello studio di Earle e coll. (173) la patologia cardiovascolare risultò più frequente causa di morte nei genitori di diabetici tipo 1 proteinurici rispetto ai genitori dei normoalbuminurici (40% vs 22%) o, in altri termini, il rischio di nefropatia è risultato maggiore in presenza di familiarità per patologia cardiovascolare. Fattori di rischio cardiovascolare (ipertensione, iperlipidemia, aumentati livelli di Lp(a), insulino-resistenza), morbilità cardiovascolare e mortalità precoce sono particolarmente frequenti tra i genitori di diabetici tipo 1 proteinurici (217,218). Nello studio di Rudberg e coll. (176), familiarità per ipertensione (OR: 4.21) e per malattia cardiovascolare (OR: 1.26) influenzano in maniera indipendente il rischio di nefropatia nei nati a termine che avrebbero successivamente sviluppato diabete tipo 1. Tra gli Indiani Pima, popolazione ad elevata incidenza di nefropatia diabetica, la presenza di ipertensione prima della comparsa di diabete conferisce un aumentato rischio di nefropatia diabetica (219). Allo stesso modo, l’ipertensione presente al momento della diagnosi del diabete è associata più frequentemente con anormali livelli di albuminuria dopo la diagnosi del diabete tipo 2 anche in popolazioni caucasiche (220a). I figli di diabetici tipo 2 con nefropatia presentano valori di pressione arteriosa sistolica superiori (+8 mmHg) dei figli di diabetici tipo 2 senza nefropatia (213). Inoltre, i diabetici tipo 2 destinati a sviluppare nefropatia presentano in fase pre-proteinurica livelli pressori più elevati (164/87 vs 149/84 mmHg) e prevalenza di ipertensione maggiore (70 vs 43%) rispetto ai pazienti che non svilupperanno la nefropatia (140). L’ereditabilità di AER e di pressione arteriosa è stata recentemente valutata da Fogarty e coll. (181) in 96 ampie famiglie di cui facevano parte 630 diabetici tipo 2 e 639 soggetti normoglicemici. Lo studio ha confermato che in famiglie con diabete tipo 2, l’albuminuria è un tratto ereditario con ereditabilità simile a quella della pressione arteriosa e ad essa associata. Una significativa correlazione genetica (rg 0.26-0.27, p<0.001) tra AER e pressione sistolica e diastolica, più evidente in presenza di
G
G
G
e
e
e
n
n
n
i
i
i
e
e
e
C
C
C
o
o
o
m
m
m
p
p
p
l
l
l
i
i
i
c
c
c
a
a
a
n
n
n
z
z
z
e
e
e
d
d
d
e
e
e
l
l
l
D
D
D
i
i
i
a
a
a
b
b
b
e
e
e
t
t
t
e
e
e
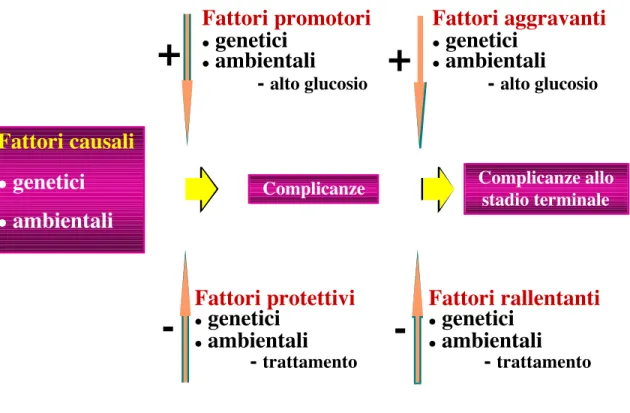
Poiché le complicanze del diabete riconoscono nell’esposizione all’iperglicemia il principale fattore patogenetico, la ricerca di una base genetica per le complicanze del diabete rappresenta un tipico esempio di ricerca di una interazione tra determinanti genetici e fattori ambientali (figura 13).
Figura 13 – Interazione tra fattori di rischio genetici ed ambientali e complicanze del diabete.
La forte associazione tra ipertensione arteriosa e complicanze del diabete in genere e nefropatia in particolare rende plausibile l'ipotesi che la predisposizione alle complicanze ed alla nefropatia diabetica coincida, almeno in parte, con la predisposizione all'ipertensione essenziale. D’altra parte, la stretta associazione tra microalbuminuria e nefropatia da una parte e la patologia cardiovascolare dall’altra, nonché le evidenze di analogie nei processi patogenetici che inducono glomerulosclerosi ed aterosclerosi, rendono verosimile l’ipotesi che la suscettibilità alla nefropatia diabetica condivida determinanti genetici con i processi che modulano il rischio macrovascolare e regolano la suscettibilità agli eventi cardiovascolari (220b).
Complicanze
Fattori causali
genetici
ambientali
Complicanze allo stadio terminaleInsorgenza
Progressione
Fattori promotori
genetici
ambientali
-
alto glucosio+
Fattori protettivi
genetici
ambientali
-
trattamento-Fattori aggravanti
genetici
ambientali
-
alto glucosio+
Fattori rallentanti
genetici
ambientali
-
trattamento-La predisposizione alle suddette patologie condivide le caratteristiche tipiche dei disordini multifattoriali. La suscettibilità è probabilmente poligenica (è cioè necessaria l'interazione di più geni); è geneticamente eterogenea (geni diversi potrebbero essere responsabili dei singoli casi); è verosimile l'esistenza di fenocopie (cioè di pazienti suscettibili al danno d’organo per fattori non genetici) ed è possibile che vi sia penetranza variabile, per cui solo alcuni dei pazienti con background genetico predisponente sono effettivamente predisposti alla complicanza o alla patologia (tabella 6).
Tabella 6 - Modelli genetici per la nefropatia diabetica. Tutti i modelli rispettano la seguente ipotesi: la nefropatia diabetica è una condizione acquisita, espressione delle conseguenze a livello glomerulare della microangiopatia diabetica che, a sua volta, è secondaria all'"esposizione" al diabete. L'"esposizione" al diabete (durata della malattia, qualità del controllo glicemico) è fattore necessario e sufficiente per lo sviluppo della retinopatia diabetica. Gli stessi fattori sono necessari, ma non sufficienti, per lo sviluppo della nefropatia diabetica. L'identificazione dei fattori che proteggono dalla comparsa delle complicanze renali, nonostante l'iperglicemia, assume importanza cruciale.
MODELLO "ADDITIVO"
- l'iperglicemia da inizio al danno microvascolare - l'influenza genetica contribuisce alla sua progressione MODELLO "INTERATTIVO"
- l'iperglicemia interagisce con la suscettibilità genetica sia per dare inizio al danno microangiopatico che per favorirne la progressione
MODELLO "MISTO"
- l'iperglicemia interagisce con certi geni per dare inizio al danno microvascolare - altri geni contribuiscono all'evoluzione e alla progressione del danno
microvascolare
Due strategie sono possibili per identificare i determinanti genetici in malattie multifattoriali: la strategia del gene candidato e l'individuazione dei loci associati con la patologia in studio attraverso l'esame dell'intero genoma (whole-genome scanning). Lo scanning dell’intero genoma, basato sull’impiego dei microsatelliti o SNPs (Single Nucleotide Polymorphisms), è una strategia promettente già utilizzata per lo studio dei determinanti genici della pressione arteriosa. Questa strategia non richiede la proposizione dei geni candidati, né assunzioni sulle modalità di trasmissione genetica. Sequenze ripetute di di-, tri, e tetra-nucleotidi, altamente polimorfe, denominate microsatelliti, o mutazioni puntiformi frequenti sul genoma (SNPs) vengono usate quali
La disponibilità di centinaia di questi markers già mappati in ciascun cromosoma umano in associazione ai recenti progressi nelle tecniche automatiche di analisi del genotipo, tra le quali i microarrays, rendono possibile lo studio dell’intero genoma umano alla ricerca di associazioni con una patologia poligenica o un tratto complesso quali sono le complicanze del diabete. Associazioni diverse da quelle proposte dalla casualità, suggeriscono che un gene contenuto in una certa regione cromosomica conferisce suscettibilità (o protezione) rispetto alla nefropatia diabetica. Questa strategia potrebbe essere particolarmente efficace se applicata a nuclei familiari in cui vi siano coppie di diabetici concordanti per nefropatia diabetica (concordant sib-pairs). Questo richiede lo studio di un ampio numero di famiglie (almeno 300) con due o più fratelli entrambi con diabete complicato da nefropatia diabetica e, possibilmente, con la partecipazione dei loro genitori per determinare in maniera più precisa la condivisione allelica. E’ stata altresì proposto l’analisi di coppie di fratelli con diabete discordanti per nefropatia diabetica (discordant sib-pairs). Questa strategia sembra richiedere un numero inferiore di famiglie (circa 100) per raggiungere la stessa potenza statistica; in questo caso le famiglie dovranno ospitare coppie di diabetici uno con nefropatia, l’altro con normoalbuminuria nonostante la lunga durata di diabete. L’analisi sistematica dell’intero genoma consente di verificare se certe regioni cromosomiche sono condivise dai fratelli con diabete concordanti per nefropatia più frequentemente e dai fratelli discordanti per nefropatia meno frequentemente di quanto atteso in base alla casualità. Enormi difficoltà esistono nel reclutamento dei sib-pairs. La concordanza di diabete tipo 1 tra fratelli non è superiore al 10%. La concordanza di nefropatia tra fratelli con diabete tipo 1 è stimata al 40%, la discordanza corretta per la necessità di lunga durata del diabete nel fratello non affetto è stimata al 15%. Una base di partenza di 1000 diabetici tipo 1 potrà quindi consentire al massimo di individuare 40 coppie di fratelli concordanti per nefropatia e 15 coppie di discordanti per nefropatia.
E’ perciò comprensibile che a tutt'oggi, l'approccio pressochè esclusivamente utilizzato per identificare i geni coinvolti nella predisposizione alla nefropatia diabetica è stato quello dello studio caso-controllo mediante il quale si valuta l’eventuale esistenza di associazione tra nefropatia diabetica e alleli di "geni candidati" in gruppi di individui non consanguinei. In questo disegno sperimentale pazienti senza segni di nefropatia con diabete mellito di lunga durata e quindi con bassa probabilità di sviluppare danno renale (normoalbuminuria + durata del diabete >20 anni) vengono utilizzati come "controlli" di diabetici con nefropatia (proteinuria persistente o microalbuminuria) per valutare il ruolo di alleli di geni "noti, clonati e mappati". Il numero di “casi” e di “controlli” richiesti in questo tipo di studio è empirico, ma, generalmente coorti superiori a 200 soggetti per gruppo sono verosimilmente necessarie per garantire un’adeguata potenza statistica. Gli
La commistione di popolazioni può causare associazioni artificiose se vengono coinvolte popolazioni geneticamente distinte. Anche la stratificazione della popolazione (founder effect) può generare risultati positivi. Un eventuale bias di pubblicazione (predilezione per i risultati positivi) può sovrastimare il significato di eventuali associazioni positive. Numerosità inadeguate tra i casi e i controlli nonché difetti nella stratificazione fenotipica possono dare origine a risultati falsamente positivi o negativi.
Un secondo approccio agli studi di associazione è quello di valutare il significato di un gene candidato in studi su famiglie attraverso il “trasmission disequilibrium (o “distortion”) test (TDT). Il disegno sperimentale richiede il DNA di un probando affetto da nefropatia e dei suoi genitori ed esamina la trasmissione di determinati alleli da un genitore eterozigote al figlio affetto. Deviazioni significative del rapporto atteso (50:50) suggeriscono un ruolo dell’allele in studio nella suscettibilità alla nefropatia. Questo metodo rimuove il rischio di stratificazione della popolazione, ma non esclude la possibilità di risultati falsamente positivi o negativi se le numerosità incluse non sono adeguate.
Con lo scopo di individuare markers genetici clinicamente utili in quanto sufficientemente predittivi di futuro sviluppo o di protezione nei confronti della nefropatia diabetica, sono stati proposti e studiati, tramite il disegno caso controllo, numerosi geni "candidati" (tabella 7). I geni esaminati sono stati selezionati in virtù di funzioni biologiche verosimilmente coinvolte nella patogenesi delle complicanze del diabete o in relazione al loro ruolo in patologie (ipertensione, aterosclerosi) strettamente associate alle complicanze del diabete (221,222a).
Negli organi/tessuti suscettibili alle complicanze del diabete le alterazioni del metabolismo del glucosio sono mediate da vie metaboliche quali la via dei polioli e la glicazione non enzimatica delle proteine. D’altra parte, fattori emodinamici sono importanti nella patogenesi delle complicanze del diabete (222b, 222c).
La vasodilatazione arteriolare indotta dall’iperglicemia aumenta la pressione idrostatica capillare contribuendo ad aterosclerosi e glomerulosclerosi. La ricerca dei geni candidati a modulare il rischio delle complicanze dovute alla esposizione al diabete può essere rivolta in due direzioni: 1. polimorfismi di enzimi che regolano il metabolismo del glucosio negli organi bersaglio delle complicanze; 2. polimorfismi che influenzano il rischio cardiovascolare nella popolazione generale.
Quest’ultima ipotesi si basa sulla assunzione che la vasodilatazione capillare indotta dall’iperglicemia e/o dalla carenza insulinica alteri la funzione del microcircolo inducendo ipertensione capillare quale conseguenza, per esempio a livello renale, di vasodilatazione afferente (iperglicemia-indotta) e vasocostrizione efferente relativa. Numerosi sistemi sono in grado di regolare l’emodinamica glomerulare modificando la pressione idrostatica capillare. Perturbazioni farmacologiche di questi sistemi inducono alterazioni nell’emodinamica glomerulare lette attraverso modificazioni della permeabilità all’albumina. Gli ACE-inibitori bloccano i sistemi renina-angiotensina e kallicreina-chinine riducendo micro- e macroalbuminuria.
Tabella 7 - Geni “candidati” studiati o ipotizzati in rapporto alle complicanze del diabete. Ipertensione/malattie
cardiovascolari - ACE, enzima di conversione dell’angiotensina II- Angiotensinogeno (AGT) - Recettore tipo 1 angiotensina II (AT1)
- Renina
- Kallicreina (KLK1)
- Recettore per la bradichinina - ∂-adducina
- Peptide natriuretico atriale (ANP)
- Sintetasi endoteliale dell’ossido nitrico (eNOS) - Inibitore dell’attivatore del plasminogeno (PAI-1) - Glicoproteina piastrinica IIIa
- Paraoxonase
- Fattore di vonWillebrand (vWF) - Fattore VII (FVII)
- Fibrinogeno
- Antitrombina III (ATIII) - Na+/H Scambiatore + (NHE-1)
Lipidi - Lipoproteinlipasi
- Lipoproteina (a) (Lp(a) - Apolipoproteina A1 (ApoA1) - Apolipoproteina E (ApoE) - Apolipoproteina B (ApoB) - Apolipoproteina C3 (ApoC3)
- CEPT - cholesterol ester transfer protein Matrice extracellulare - Collagene tipo VI
- Heparan sulfate protein - Interleuchina-1 (IL-1)
Altre - Metilentetraidrofolato reduttasi
- HLA human leucocyte antigen - Insulina
- Glicogeno sintetasi (GYS) - Glucochinasi (GCK)
- TGF-ß trasforming growth factor- ß - Recettore adrenergico-ß3
- TNF-∂ tumor necrosis factor-∂ - Aldoso-reduttasi
- RAGE advanced glycation end-protucts receptors - Sorbitolo deidrogenasi
Riduzioni dell’albumina possono essere ottenute attraverso il blocco dei prostanoidi (indometacina) o le modificazioni dei meccanismi dell’emostasi e l’attivazione dei proteoglicani (eparina). Così polimorfismi a livello di ciascun componente di questi sistemi possono essere studiati in relazione al rischio di sviluppare le complicanze del diabete e specialmente la nefropatia. D’altra parte, in funzione della prima ipotesi, è giustificato valutare polimorfismi negli enzimi che regolano il metabolismo del glucosio attraverso la via dei polioli (aldoso-reduttasi) o che modulano le attività dei trasportatori ionici di membrana (un polimorfismo della Na/K ATPasi che ne modifica l’attività è stato associato al rischio di neuropatia nel diabete tipo 1).
Numerosi sono quindi i geni valutati in relazione al rischio di complicanze del diabete. Tra questi, i geni che codificano per l'enzima di conversione dell'angiotensina (ACE), l'angiotensinogeno, l'apolipoproteina E, l'N-acetiltransferasi, la proteina che codifica per lo scambiatore sodio-idrogeno (NHE-1), la catena alfa del collagene tipo IV, l’interleuchina-1 (IL-1) e l’enzima aldoso-reduttasi sono stati oggetto di studi più o meno numerosi. La categoria che più ha attratto l'attenzione è quella che include i geni codificanti per le varie componenti del sistema renina-angiotensina (RAS). Oltre che nella regolazione della pressione arteriosa sistemica, questo sistema interviene anche nel modulare l’emodinamica renale la cui alterazione sembra avere un ruolo di primo piano nella patogenesi della nefropatia diabetica e nel promuovere la proliferazione delle cellule glomerulari. L'enzima chiave di questo sistema è l'enzima di conversione dell'angiotensina II (ACE). Tale enzima regola l'attività dell'angiotensina II a livello del circolo e a livello dei tessuti. L'ACE è anche il principale inattivatore della bradichinina, un peptide con azione vasodilatatrice che espleta la sua attività soprattutto a livello renale.
G
GGeeennniiicccoooiiinnnvvvooollltttiiinnneeellllllaaarrreeegggooolllaaazzziiiooonnneeedddeeelllsssiiisssttteeemmmaaarrreeennniiinnnaaa---aaannngggiiiooottteeennnsssiiinnnaaa...
G
GGeeennneeedddeeellllll’’’eeennnzzziiimmmaaadddiiicccooonnnvvveeerrrsssiiiooonnneeedddeeellllll’’’aaannngggiiiooottteeennnsssiiinnnaaaIIIIII...
Il gene più studiato di questo sistema è quello dell'enzima di conversione dell'angiotensina II (ACE). Una variante di questo gene, una inserzione/delezione (I/D) di una sequenza di circa 300 paia di basi, sita nell'introne 16, largamente "responsabile" della variabilità dei livelli plasmatici e tissutali dell'ACE, fa ipotizzare l'esistenza di un "linkage disequilibrium" con un vicino locus deputato a regolare l'espressione dell'ACE (223a). L'aumentata attività circolante e/o tissutale dell'ACE osservata nei portatori dell'allele D, potrebbe favorire la comparsa di cardiopatia ischemica e di infarto miocardico attraverso diversi meccanismi quali la vasocostrizione coronarica, il rimodellamento cardiovascolare ed effetti proaritmici. Inoltre, poiché l’angiotensina II é coinvolta nella induzione e nella progressione della nefropatia diabetica, è ragionevole includere il polimorfismo I/D dell’ACE tra i potenziali determinanti delle complicanze micro- e macrovascolari del diabete (223b).
Uno studio caso-controllo, pubblicato da Cambien e coll. (224) ha aperto un controverso capitolo della epidemiologia genetica (225). Lo studio ha rilevato una maggior frequenza di omozigoti per l'allele D (delezione) in pazienti con recente infarto miocardico rispetto ai controlli senza evidenza di cardiopatia ischemica. Al primo studio hanno fatto seguito numerosi altri che hanno in parte confermato ed in parte negato l'esistenza di una associazione tra polimorfismo ACE I/D ed infarto miocardico (226-238). Tale associazione è stata estesa al diabete tipo 2 (227).
Una meta-analisi comprendente 3394 soggetti con infarto miocardico e 5479 soggetti di controllo è giunta alla conclusione che i dati pubblicati sono compatibili con una debole associazione tra allele D ed infarto miocardico. Infatti, il rischio relativo di infarto miocardico per i soggetti omozigoti DD nell'insieme dei 15 studi considerati è risultato pari a 1.26 (limiti di confidenza (CI) al 95%: 1.15-1.39, p<0.001) (239).
L'aumento del rischio di infarto miocardico attribuito al genotipo ACE DD sarebbe dunque di modesta entità. Appare evidente l'eterogeneità tra i diversi studi, sia per quanto riguarda la frequenza dei diversi genotipi ACE I/D nei controlli che per l'entità del rischio relativo osservato nelle diverse popolazioni. Così, ad esempio, il rischio relativo è solo 1.18 nelle popolazioni caucasiche, ma sale a 2.55 nelle popolazioni giapponesi.
Un'altra importante considerazione riguarda il rapporto tra valore stimato del rischio relativo e dimensione dello studio. I valori più elevati di rischio relativo sono stati osservati negli studi di più modeste dimensioni, mentre gli studi comprendenti un elevato numero di casi e di controlli sono risultati pressochè invariabilmente negativi (239-242). Alcuni nuovi studi hanno rivalutato la rilevanza del tratto ACE I/D in relazione alla cardiopatia ischemica (243-247), ma solo uno di questi studi ha riportato una associazione positiva tra allele D ed eventi coronarici (244).
Altre meta-analisi mettono a fuoco aspetti diversi del rapporto tra polimorfismo I/D del gene dell'ACE e patologia cardiovascolare. Bauters e coll. (248) suggeriscono l'esistenza di associazioni del genotipo dell'ACE con 1'iperplasia intimale in risposta all'insulto vascolare (restenosi dopo "stenting" coronarico, ma non dopo angioplastica coronarica), con lo spasmo delle arterie coronariche e con la trombosi coronarica. Mentre vi è assenza di ogni associazione tra polimorfismo dell'ACE ed ipertensione essenziale nella popolazione caucasica, una relazione positiva tra allele D ed elevati valori di pressione arteriosa è stata osservata nella razza nera; risultati discordanti sono disponibili nella popolazione giapponese.
Dati interessanti emergono dalla meta-analisi di Staessen e coll. (249); il database utilizzato da questa meta analisi include 145 studi e un campione complessivo di 49959 soggetti. La presenza dell'allele D risulta associata ad un aumentato rischio di aterosclerosi e di complicanze microvascolari a livello renale. A confronto con il genotipo II, l'eccesso di rischio associato alla omozigosi DD (p<0.001) risulta del 32% per l'arteriopatia coronarica (30 studi), del 45% per l'infarto miocardico (20 studi), del 94% per lo "stroke" (5 studi) e del 56% per la nefropatia diabetica (11 studi). Il corrispondente rischio associato alla eterozigosi ID risulta rispettivamente dell'11% (p=0.02), 13% (p=0.02), 22% (p=0.10) per l'arteriopatia coronarica, l'infarto del miocardio e lo "stroke" e del 40% (p<0.001) per la nefropatia diabetica (249). L'ipertensione arteriosa (23 studi), l'ipertrofia ventricolare sinistra (5 studi), la cardiomiopatia ipertrofica o quella dilatativa (8 studi) e la retinopatia diabetica (2 studi) non sono risultate associate al polimorfismo I/D.
Negli studi in cui l'amplificazione del DNA è stata ottenuta grazie ad un primer inserzione-specifico, il rischio associato al genotipo DD aumenta al 150% (intervallo di confidenza al 95%: 76-256; 4 studi) per la nefropatia diabetica, ma si riduce al 12% (95% CI: -3,+28; 7 studi) per l'arteropatia coronarica e al 14% (95% CI: -6,+37; 4 studi) per l'infarto del miocardio. Infine, definito "controllo" il gruppo II, i livelli circolanti dell'ACE (29 studi) aumentano rispettivamente del 58% e del 31% (p<0.001) nei gruppi DD e ID (249).
Una meta-analisi più recente è stata dedicata a 46 studi, comprendenti 32715 individui di razza bianca (250). L’attività plasmatica dell’ACE è risultata aumentata del 40% e del 71% in ID e DD rispetto a II negli studi di piccole dimensioni e del 21% e 48% negli studi di più ampie dimensioni (p<0.001). La pressione arteriosa non è stata influenzata dal genotipo I/D. Il rischio di infarto miocardico e quello di cardiopatia ischemica erano aumentati rispettivamente del 47% e del 29% per DD verso ID e II negli studi di minor dimensione, ma non negli studi più ampi (p<0.001). Il rischio di eventi cerebrovascolari non veniva influenzato nei piccoli come nei grandi studi. La meta-analisi di Larsen e coll. (81) dimostra quindi che il polimorfismi I/D dell’ACE modula l’attività plasmatica dell’ACE ma non la pressione arteriosa e non è associato con aumentate frequenze di infarto del miocardio, cardiopatia ischemica o eventi cerebro-vascolari negli studi di più ampie dimensioni. Il ruolo del polimorfismo I/D del gene dell'ACE nella suscettibilità alla nefropatia diabetica è stato oggetto di almeno tre meta-analisi relativamente recenti (251-253). In un totale di 4773 pazienti diabetici (18 studi) (254-271), 2495 con nefropatia diabetica e 2278 senza nefropatia, l'allele D è risultato associato in maniera statisticamente significativa (p<0.0001) con la nefropatia diabetica in un modello dominante (DD+ID vs II) (253). L'odds ratio medio è risultato 1.32 (95% CI=1.15-1.51). Questo indica che il rapporto tra pazienti con e senza nefropatia è 1.32 volte maggiore nei portatori dell’allele D. L’associazione tra genotipo ACE e nefropatia risultava significativa sia nei diabetici di tipo 1 (p<0.05; OR=1.28, 95% CI=1.05-1.57), che nei diabetici di tipo 2 (p<0.005; OR=1.36, 95% CI=1.22-1.64). Inoltre, l'associazione tra genotipo I/D dell'ACE e nefropatia risultava significativa anche quando il gruppo con nefropatia era limitato ai pazienti con macroalbuminuria o con più severa compromissione della funzione renale (p<0.005; OR=1.33, 95%CI=1.10-1.62) (256-258, 262, 266, 268-271). Infine, l'associazione rimaneva significativa quando i differenti gruppi etnici sono stati studiati separatamente: popolazioni asiatiche (p<0.00005; OR=1.79, 95%CI=1.37-2.33; 7 studi) (256, 257, 264, 266-268, 270); popolazioni caucasiche (p<0.05; OR=1.18, 95%CI=1.00-1.39; 11 studi) (254, 255, 258-263, 269, 271). In un totale di 2010 diabetici, 1008 con retinopatia e 1002 senza retinopatia (7 studi: 254, 257, 260, 262, 267, 268, 272), l'allele D non è risultato associato in un modello dominante (DD+ID vs II) con la retinopatia diabetica (OR=0.91; 95%CI=0.73-1.13).
Un'altra meta-analisi (252), pressochè contemporanea a quella appena descritta (253) ha analizzato diabetici di tipo 1 e di tipo 2 separatamente. Una ulteriore stratificazione è stata fatta in rapporto al background etnico (la distribuzione del polimorfismo I/D dell'ACE varia considerevolmente nelle varie razze).
Undici studi realizzati su diabetici di tipo 1 sono stati inclusi (1371 casi con micro- o macroalbuminuria, 1317 controlli) (254, 255, 259-262, 269, 271, 273, 274). L'odds ratio medio di II vs ID+DD è 0.72 (0.51-1.01), p=0.06 (allele D "dominante"). L'odds ratio medio di DD vs ID+II (allele D "recessivo) è 1.12 (0.95-1.32). Risultati simili fornisce il confronto DD vs II. Dieci studi sono stati valutati per quanto riguarda il diabete tipo 2: 5 in popolazioni caucasiche (730 casi e 836 controlli) (258, 260, 261, 265, 275), 5 in popolazioni giapponesi (478 casi e 284 controlli) (256, 257, 264, 266, 269). L'odds ratio medio di II vs ID+DD è 0.86 [(0.68-1.10), p=0.23] nelle popolazioni caucasiche; 0.50 [(0.37-0.69), p<0.0001] nelle popolazioni giapponesi. I corrispondenti odds ratio per DD vs ID+II sono 1.41 (0.93-2.12) e 1.18 (0.95-1.45).
La meta-analisi di Fujisawa e coll. (253) fornisce importanti informazioni. Il polimorfismo I/D del gene dell'ACE è associato alla nefropatia diabetica (odds ratio=1.32; 95%CI=1.15-1.51), ma non con la retinopatia diabetica. Tale polimorfismo sembra quindi modulare il rischio della nefropatia, ma non quello della retinopatia diabetica. Poichè il polimorfismo dell'ACE è associato con la progressione di altre patologie renali e, in particolare, alla progressione della nefropatia ad IgA (276-282), il locus I/D potrebbe determinare una più generale suscettibilità al danno renale e, quindi, in presenza di diabete, una maggiore suscettibilità alla nefropatia diabetica. Tale meccanismo sembra estrinsecarsi sia nel diabete tipo 1 che nel diabete tipo 2. In base ad un rischio relativo di 1.32 nei portatori dell'allele D (odds ratio) e ad un grado di aggregazione familiare della nefropatia diabetica pari a 2.17 (nelle popolazioni caucasiche), è possibile stimare che il locus I/D dell'ACE contribuisce per circa il 28% (14-43%) al clustering familiare della nefropatia diabetica. Inoltre, poichè l'allele D è presente nel 50-85% di ciascun gruppo etnico ed è universalmente associato alla complicanza renale, la riduzione (ACE-inibitori?) del rapporto tra pazienti con e senza nefropatia nei portatori dell'allele D da 1.32 volte rispetto ai non portatori, a quello dei non portatori stessi potrebbe determinare una riduzione del 14-21% del rischio di insufficienza renale dovuta alla nefropatia diabetica. Incerto rimane il meccanismo genetico che regola la suscettibilità alla nefropatia: recessivo, codominante o dominante. I livelli di ACE plasmatico, intermedi nel genotipo ID, minori nel genotipo II e maggiori nel DD, suggeriscono un effetto codominante. La meta-analisi di Samani e coll. (239) dedicata all'associazione tra polimorfismo I/D e arteriopatia coronarica, suggerisce un effetto recessivo (DD vs ID+II). Al contrario, la meta-analisi di Fujisawa e coll. (253) dedicata alla nefropatia diabetica propone un effetto dominante; infatti l'odds ratio calcolato postulando un modello recessivo (1.20; 95%CI=1.06-1.37) non risulta maggiore dell'odds ratio calcolato per il modello dominante (1.32). E' possibile che i gruppi classificati come "nefropatia" siano eterogenei.
D'altra parte, la associazione tra genotipo dell'ACE e complicanza renale permane significativa (p<0.005) anche quando l'analisi viene limitata ai diabetici con macroalbuminuria e/o nefropatia più avanzata.
A conclusioni almeno in parte diverse conduce la meta analisi di Tarnow e coll. (251). Nel diabete tipo 1, solo 3 su 11 studi riportano una associazione significativa tra polimorfismo I/D e nefropatia. Nel diabete tipo 2, nessuno dei 9 studi su popolazioni caucasiche, ma 3 dei 5 studi su pazienti giapponesi dimostrano una associazione positiva. La maggior parte degli studi include tra i nefropatici i pazienti con microalbuminuria anche se, sia nel diabete tipo 1 che nel tipo 2, la microalbuminuria non sempre progredisce verso la nefropatia conclamata e può anche regredire verso la normoalbuminuria. Solo 4 studi nel diabete tipo 1 (262, 269, 273, 274) e 3 studi nel diabete tipo 2 (257, 264, 275) includono esclusivamente pazienti con macroalbuminuria. Solo in 3 di questi studi (264, 274, 275), tra l'altro numericamente piccoli, è stata rilevata una associazione tra nefropatia e ACE I/D. Nello studio di Marre e coll. (271) la nefropatia conclamata (macroalbuminuria persistente) è relativamente più rara nel genotipo II.
L'eterogeneità dei risultati tra i vari studi può essere spiegata, almeno in parte, da numerosi fattori quali differenze nella modalità di raccolta dei campioni urinari e nella determinazione dell'albuminuria o differenze nelle soglie impiegate per la definizione della micro- e della macroalbuminuria. Inoltre, l'inclusione in alcuni studi, soprattutto in quelli realizzati in soggetti con diabete tipo 2, di pazienti con AER elevata in assenza di retinopatia diabetica può determinare la presenza tra i "casi" di un certo numero di individui con nefropatie di origine non-diabetica. La selezione dei "controlli" è un altro importante fattore di variabilità. In alcuni studi sono stati inclusi tra i "controlli" i soggetti con microalbuminuria o, ancora, i diabetici con breve durata di malattia e quindi a rischio pieno di futuro sviluppo di nefropatia. In altri studi sono stati esclusi tra i "controlli" i pazienti normotesi o i soggetti trattati con ACE-inibitori. Infine, i pazienti con genotipo DD sembrano avere anche un maggior rischio non solo di nefropatia, ma anche di malattia coronarica (283, 284); questo può determinare un bias naturale di selezione e cioè la perdita selettiva dei nefropatici omozigoti per l'allele D.
In conclusione, la meta-analisi di Tarnow e coll. (251) a differenza di altre [Fujisawa e coll. (253) e Staessen e coll. (249)], suggerisce che la associazione tra polimorfismo I/D dell'ACE e aumento dell'AER è confinata, nel diabete tipo 2, alle popolazioni giapponesi (n=762), mentre nei diabetici
Poichè il polimorfismo I/D dell'ACE è probabilmente solo un marker del polimorfismo funzionale che influenza i livelli circolanti (e tissutali) dell'ACE (281), il grado di disequilibrio tra i due polimorfismi (il marker ed il funzionale) può variare di popolazione in popolazione e così contribuire alle differenze osservate tra le diverse popolazioni.
Altri studi, più recenti, hanno valutato il ruolo di altri polimorfismi del gene ACE. In uno studio che ha reclutato 127 diabetici tipo 2 con proteinuria clinica o insufficienza renale, 335 soggetti con microalbuminuria e 254 normoalbuminurici con durata di diabete di almeno 10 anni, nessuna associazione con la nefropatia è stata osservata sia per il polimorfismo I/D (introne 16) che per il polimorfismo PstI (sostituzione A/G nell’introne 7; alleli P/M) (285). Freire e coll. (286) hanno osservato una associazione tra il polimorfismo dell’ACE rilevato con l’enzima di restrizione PstI (introne 7) e la nefropatia nel diabete tipo 1 (casi/controlli = 77/89). I pazienti PstI omozigoti presentavano un rischio di nefropatia 2,3 volte superiore (95% CI: 1,2-4,5) rispetto agli altri genotipi, in assenza di aumento dell’attività sierica dell’ACE. Il rischio di nefropatia sembra quindi influenzato da polimorfismi del locus per l’ACE, ma la variante responsabile non è il polimorfismo I/D dell’introne 16. D’altra parte, Tarnow e coll. (287) hanno osservato che l’allele D dell’ACE rappresenta un fattore di rischio per la cardiopatia ischemica in diabetici tipo 1 con nefropatia diabetica clinica. Questa analisi di sottogruppo non aveva una ipotesi a priori e ha coinvolto un modesto numero di pazienti così che il risultato potrebbe essere dovuto ad un errore di tipo 2. Tale possibilità è indirettamente confermata dallo studio di Frost e coll. (288) in cui nessuna associazione è stata rilevata tra polimorfismo I/D dell’ACE e spessore dell’intima media a livello della carotide comune in 148 diabetici tipo 1.
Più recentemente, alcuni studi hanno suggerito che il polimorfismo I/D dell'ACE possa giocare un ruolo importante sia quale promotore della progressione della nefropatia (268, 289) che quale modulatore della terapia con ACE-inibitori (290) piuttosto che come fattore di suscettibilità alla nefropatia (291, 292b). L’allele D del polimorfismo I/D sembra essere associato ad un più rapido declino della funzione renale (276, 280, 282) ed a una minor efficacia del trattamento con ACE-inibitori o con altri anti-ipertensivi anche in nefropatie non-diabetiche quali la nefropatia IgA (276, 278) e altre nefropatie (279, 293). Particolarmente interessante è lo studio di Parving e coll. (290). Gli autori dimostrano che il genotipo DD riduce gli effetti favorevoli a lungo termine della terapia con ACE-inibitori sulla progressione della nefropatia diabetica (velocità di declino del GFR) in un piccolo gruppo (n=35) di pazienti con diabete tipo 1.
Un’analisi successiva dello stesso gruppo di pazienti, suggerisce che il trattamento con ACE-inibitori sia particolarmente efficace nei diabetici tipo 1 contemporaneamente portatori dell'allele I del gene dell'ACE e dell'allele C del gene che codifica per il recettore tipo 1 dell'angiotensina II (A1166➞ C).
L'ipotesi che il polimorfismo I/D del gene dell'ACE sia in grado di modulare gli effetti terapeutici dell'ACE-inibizione sulla progressione dell'escrezione urinaria dell'albumina nel diabete tipo 1 è stata recentemente rivalutata in un ampio studio multicentrico randomizzato (EUCLID), dedicato a studiare gli effetti del lisinopril verso il placebo sulla progressione dell'AER e della retinopatia in 530 pazienti con diabete tipo 1 (294). Dopo 2 anni di trattamento, l'AER era di 2.2 µg/min inferiore nel gruppo in trattamento con lisinopril rispetto al gruppo placebo. La differenza relativa tra i due trattamenti nel valore dell'AER era del 24% (95%CI=4.1-39.8%, p=0.02). Nel gruppo placebo, i pazienti con il genotipo II presentano la più rapida progressione dell'AER, mentre i soggetti con il genotipo DD mostrano il più contenuto aumento dei livelli dell'AER (p=0.03). Questa osservazione è in accordo con i risultati di un recente studio di Miller e coll. (295): diabetici tipo 1 con genotipo II presentano valori di GFR e di ERPF (portata renale plasmatica) significativamente più elevati degli omozigoti DD. L'iperfiltrazione glomerulare viene considerata un fattore di rischio per lo sviluppo della nefropatia diabetica. Al contrario, nel gruppo in trattamento con il lisinopril, i pazienti con il genotipo II presentano la miglior risposta all'ACE-inibitore, cioè un aumento dell'AER minore rispetto a quello osservato nei gruppi ID e DD (p=0.3).
L'analisi dei dati in funzione del genotipo fornisce i seguenti risultati: la differenza percentuale dell'AER placebo vs lisinopril era 51.3% nei pazienti II (95%CI da 15.7 a 71.8, p=0.01), 14.8% nel gruppo ID (p=0.2) e 7.7% nel gruppo DD (p=0.7). In termini assoluti la differenza in AER placebo vs lisinopril era 8.11, 1.70, 0.78 µg/min rispettivamente nei gruppi II, ID, DD (figura 11). Nell'EUCLID, i pazienti con genotipo II presentano quindi la più rapida progressione dell'AER in assenza di trattamento con ACE-inibitori, ma anche la migliore risposta al lisinopril in termini di rallentamento della progressione dell'AER (294).
Altri studi dimostrano che l’allele D è un fattore di rischio per un decorso accelerato della nefropatia diabetica nel diabete tipo 1 (296, 297), sebbene in uno di questi studi (296) la tendenza verso un più rapido declinare della funzione renale nel genotipo DD non era significativa. Yoshida e coll. (268) hanno osservato una frequenza significativamente più alta del genotipo DD in pazienti con diabete tipo 2 e funzione renale in declino. I diabetici tipo 2 con genotipo DD presentano un rischio quattro volte più elevato di progressione verso l’ESRD.
Il genotipo DD era assente nei pazienti con proteinuria clinica ma funzione renale stabile, mentre la maggior parte (95%) dei pazienti con genotipo DD progrediva verso l’ESRD entro 10 anni (268). Altri due studi confermano che l’allele D ha effetti deleteri sulla funzione renale (298,299). Una maggior prevalenza del genotipo DD è stata osservata in diabetici tipo 2 in trattamento emodialitico (298); in questi stessi pazienti, il genotipo DD sembra aumentare la mortalità dopo l’inizio del trattamento dialitico.
A
AAllltttrrriiigggeeennniiicccooodddiiifffiiicccaaannntttiiipppeeerrrcccooommmpppooonnneeennntttiiidddeeelllsssiiisssttteeemmmaaarrreeennniiinnnaaa---aaannngggiiiooottteeennnsssiiinnnaaa...
Il gene dell'angiotensinogeno (AGT) è localizzato nel braccio lungo del cromosoma 1. Diversi polimorfismi sono stati descritti in questo locus. Tra questi, il più interessante è l'M235T, localizzato nell'esone 2. Un'allele corrisponde alla presenza di una timina che codifica una metionina (ATG) in posizione 235, l'altro allele, meno frequente, corrisponde ad una citosina e codifica una treonina (ACG). Un'altra variante ampiamente studiata è la T174M.
Numerose evidenze suggeriscono un’associazione tra pressione arteriosa e livelli circolanti di AGT: i livelli di AGT correlano con i valori della pressione arteriosa; i livelli plasmatici di AGT sono più elevati negli ipertesi rispetto ai controlli. Alcuni studi ipotizzano una associazione tra ipertensione arteriosa essenziale e polimorfismi comuni del gene codificante per l'AGT quali l'M235T ed il T174M (300,301). Nello Skaraborg Hypertension and Diabetes Project (302) nessuna associazione è stata rilevata tra variante M235T del gene dell’AGT e l’ipertensione arteriosa sia in soggetti con ipertensione essenziale (osservazione confermata recentemente in una coorte spagnola) (303) che in diabetici tipo 2 ipertesi. D’altra parte, il genotipo DD dell’ACE risultava associato con l’ipertensione (OR: 1.54) anche quando i diabetici tipo 2 erano esclusi dall’analisi (OR: 1.45) e anche se la più forte associazione era presente nei soggetti in cui coesistevano diabete tipo 2 ed ipertensione (OR: 2.19; 95% CI=1.09-4.38) (302).
Gli studi dedicati alla nefropatia diabetica presentano risultati contrastanti. In uno studio realizzato presso la Joslin Clinic, il genotipo TT risultò più comune nei diabetici tipo 1 con nefropatia rispetto ai normoalbuminurici (18% vs 12%); il rischio di nefropatia associato al genotipo TT fu 1.6 volte superiore (95%CI=0.8-3.5) rispetto al rischio associato a MM o MT, ma la differenza non risultava statisticamente significativa (304). In uno studio caso-controllo realizzato in Irlanda (305), il genotipo TT è risultato significativamente più frequente nei diabetici tipo 1 con nefropatia che nei controlli con normale AER (19% vs 8%) con un odds ratio associato al genotipo TT pari a 2.7.
Nello studio di Marre e coll. (271), polimorfismo I/D dell'ACE e polimorfismo M235T dell'angiotensinogeno interagiscono in maniera significativa (p=0.0166) per modulare il rischio di nefropatia; nei soggetti con genotipo ACE ID e DD, la prevalenza della nefropatia diabetica conclamata aumenta progressivamente da MM a MT e TT (p=0.0282); nei soggetti con genotipo ACE II, la frequenza di assenza di nefropatia aumenta da MM a MT e TT.
Altri autori non hanno osservato alcuna relazione fra il polimorfismo M235T e il rischio di nefropatia sia nel diabete tipo 1 che nel diabete tipo 2 (260, 265, 269, 306-308), sebbene almeno uno studio abbia suggerito una associazione del genotipo TT con aumentati livelli di pressione arteriosa nei diabetici tipo 1 con nefropatia (269). Associazioni significative tra genotipo TT e nefropatia sono state invece descritte in diabetici tipo 2 di origine cinese (309). Nello studio di Gutierrez e coll. (310), entrambe le varianti del gene che codifica per l'angiotensinogeno (M235T e T174M) non sembrano contribuire alla suscettibilità genetica né della nefropatia né della retinopatia diabetica nel diabete tipo 2, in una popolazione caucasica di origine mediterranea.
In accordo a quanto suggerito da Marre e coll. nel diabete tipo 1 (271), l'omozigosi TT, associata all'ipertensione essenziale, è risultata più frequente in pazienti con diabete tipo 2 di sesso maschile con nefropatia (odds ratio=4.8, 95%CI=1.5-14.9) ma non in quelli di sesso femminile (odds ratio=1.1) (311). L'osservazione è stata confermata nel diabete tipo 1 presso il Joslin Diabetes Center (312) in uno studio "family-based" tramite il "trasmission disequilibrium test". Il "trasmission disequilibrium test" valuta se una particolare variante o allele è trasmesso preferenzialmente al probando da un genitore che presenta una singola copia di quell'allele. Rogus e coll. (312), dimostrano che nei soggetti di sesso maschile (ma non nelle femmine) l'allele T del polimorfismo M235T è trasmesso preferenzialmente ai pazienti con nefropatia (p=0.05) e specificamente ai pazienti con le più severe manifestazioni della nefropatia (p=0.04).
In un altro studio, l'assenza dell'allele T dell’angiotensinogeno sembra essere associata ad un ridotto rischio di nefropatia nel diabete tipo 1 (313). Infine, in uno studio su “sibpairs” con diabete tipo 2 (160 famiglie), nessuna associazione è stata osservata tra escrezione urinaria di albumina e genotipo I/D dell’ACE o genotipi M235T e T174M dell’angiotensinogeno, mentre, in accordo con altri studi nella popolazione non diabetica (300,301), il polimorfismo M235T è stato associato con l’ipertensione arteriosa (314).
Il sistema renina-angiotensina media la maggior parte dei suoi effetti tramite l'azione dell'angiotensina II su un recettore di tipo 1 (AT1) presente a livello delle cellule muscolari liscie vascolari, del miocardio e del rene. Almeno due polimorfismi sono stati identificati a livello del gene che codifica per il recettore AT1 (AT1R): il polimorfismo A1166C e il polimorfismo C573T
Il polimorfismo A1166C, corrispondente alla sostituzione di un'adenina con una citosina nella posizione nucleotidica 1166, è stato associato con l'ipertensione essenziale nella popolazione non-diabetica (316). Il polimorfismo A1166C del recettore AT1 dell'angiotensina II non sembra invece contribuire alla suscettibilità genetica alla nefropatia o alla retinopatia proliferante in diabetici tipo 1 di origine caucasica (271,315). L'osservazione è stata confermata da un ampio studio inglese: 264 diabetici tipo 1 con nefropatia conclamata presentavano frequenza genotipica simile a 136 soggetti senza nefropatia nonostante una lunga durata di malattia, 200 diabetici tipo 1 di diagnosi recente e 212 soggetti non diabetici di controllo (317). Infine, nello studio di Marre e coll. (271), nessuna associazione è stata individuata tra polimorfismo C573T del recettore AT1 e nefropatia diabetica. D'altra parte uno studio di Doria e coll. (318), purtroppo di modeste dimensioni, ha rilevato un interessante effetto sinergico tra polimorfismo A1166C del gene AGT1R e controllo glicemico. Tra i pazienti con frequenti gravi iperglicemie nei primi 10 anni dopo la diagnosi del diabete tipo 1, il rischio relativo di nefropatia tra i portatori dell'allele C1166 risultò 12.1 (95%CI=3.7-39.8), mentre fu solo 1.4 negli omozigoti A1166 (p=0.004). Immancabilmente, in uno studio più recente (95 casi/97 controlli) Savage e coll (319), non hanno confermato l’osservazione di una associazione tra rischio di nefropatia nel diabete tipo 1 e sinergismo tra controllo glicemico e allele C1166 (ipertensione associato) del gene per il recettore AT1 dell’angiotensina II.
Nel CORGENE Study, nè il polimorfismo M235T dell’angiotensinogeno, né quello A1166C del recettore AT1 dell’angiotensina sono risultati associati alla presenza di aterosclerosi coronarica valutata mediante esame coronarografico (320); d’altra parte il genotipo TT del polimorfismo M174T dell’angiotensinogeno (321) è risultato fattore di rischio coronarico in soggetti di origine giapponese con basso BMI, basso rischio cardiovascolare complessivo, o genotipo ACE II. Recentemente, la coesistenza di omozigosi TT per AGT M235T e dello stato di portatore dell’allele ε4 dell’apolipoproteina E (associato ad alte concentrazioni di colesterolo plasmatico) è risultata particolarmente frequente in soggetti con precoce comparsa di infarto del miocardio (età <55 anni) (322a).
Infine, un recente lavoro (322b), dimostra un ruolo significativo di tre polimorfismi del RAS (ACE, AGT, AGTR1) nella suscettibilità alla nefropatia in pazienti con diabete tipo 2.
G
GGeeennniiiiiimmmpppllliiicccaaatttiiinnneeellllllaaacccooommmpppooosssiiizzziiiooonnneeeooonnneeellltttuuurrrnnn---ooovvveeerrrdddeeellllllaaammmaaatttrrriiiccceeemmmeeesssaaannngggiiiaaallleee
Una ipotesi nata presso lo Steno Memorial Hospital (Copenhagen), propone che la suscettibilità alla nefropatia sia modulata da polimorfismi di geni coinvolti nella regolazione della composizione e del turn-over della membrana basale glomerulare e della matrice extracellulare (323a, 323b).
La perdita dei proteoglicani eparansolfati a livello della membrana basale glomerulare può essere di importanza fondamentale nella patogenesi della nefropatia diabetica. Difetti geneticamente determinati della sintesi e della solfatazione dei proteoglicani eparansolfati (glicosaminoglicani) potrebbero esporre al rischio di sviluppare alterazioni strutturali e funzionali (difetti di permeabilità alle proteine) capaci di indurre la glomerulopatia diabetica. Una associazione significativa è stata rilevata tra il polimorfismo del "perlecan gene" (polimorfismo BamHI) codificante per il proteoglicano eparansolfato (heparan sulphate core protein, HSPG2) e la nefropatia diabetica, in uno studio che ha combinato due coorti (una danese ed una inglese) di diabetici tipo 1 (324).
Anche i geni del collagene tipo IV (catena α1) e della N-deacetilasi, un enzima chiave nella biosintesi dei proteoglicani eparansolfati, sono stati studiati come "geni candidati" per la nefropatia diabetica (325).
Il gene che codifica per la catena α1 del collageno tipo IV (Hind III restriction polymorphism) è l'unico per il quale è stata suggerita (326), sebbene in maniera non univoca (327), una relazione con la nefropatia diabetica nel diabete tipo 1, mentre nessuna associazione è stata osservata con la retinopatia proliferante (327). Il polimorfismo della N-acetyltranserase (NAT2) è stato proposto quale possibile marker genetico di nefropatia diabetica. Benché le frequenze alleliche di NAT2 fossero ugualmente distribuite tra normo-, micro e macroalbuminurici, risultati diversi sono stati ottenuti quando i pazienti sono stati stratificati in base al fumo di sigaretta, un fattore di rischio noto per la nefropatia diabetica. Tra i non fumatori, l’odds ratio per microalbuminuria e nefropatia era di 3.1 (95% CI: 1.36-7.05; p=0.007) tra i “fast acetylators”. Gli autori suggeriscono che i diabetici tipo 1 non fumatori con genotipo NAT2 “fast” presentavano un più elevato rischio di nefropatia diabetica (328).
Alterazioni nell'espressione di geni che codificano per fattori di crescita e citochine potrebbero contribuire all’aumentata proliferazione della componente cellulare e all’aumentata produzione di matrice mesangiale che caratterizzano la glomerulosclerosi diabetica.
L'interleuchina 1 (IL-1) è un potente fattore di stimolo alla proliferazione delle cellule mesangiali e alla produzione della matrice extracellulare.
L'IL-1Ra è un inibitore naturale endogeno che compete con il recettore (IL-1RI
) per l'interleuchina 1 senza determinarne l'attivazione. Ciascuna delle componenti del sistema dell'interleuchina 1 riconosce polimorfismi genetici (biallelici per IL-1β e IL-1RI
, pentaallelici per IL-1Ra), ma nessuno di essi sembra contribuire alla suscettibilità genetica alla nefropatia diabetica in pazienti diabetici tipo 1 di origine caucasica (329). In uno studio più recente, tuttavia, l’allele 1B*2 dell’interleuchina 1B è risultato più rappresentato tra i diabetici tipo 1 con nefropatia rispetto ai controlli (p=0.007) in una popolazione nord-irlandese (330). Blakemore e coll. (331a) avevano in precedenza riportato, sia nel diabete tipo 1 che nel tipo 2, una significativa associazione tra nefropatia diabetica e l’essere portatore dell’allele IL1RN*2 dell’interleuchina-1. Di recente è stata osservata una forte associazione tra il polimorfismo VNTR sull’antagonista al recettore di Il-1 (Il1Ra) e una rapida progressione verso ESRD (331b, 331c)
Infine, l’interazione tra piastrine e collagene potrebbe essere coinvolta nella patogenesi della microangiopatia e, in particolare, della retinopatia diabetica. In un recente studio realizzato su 227 diabetici tipo 2 (119 con retinopatia) è stata rilevata una associazione tra retinopatia diabetica e un polimorfismo Bg/II localizzato nell’introne 7 del gene che codifica per la subunità alfa del recettore piastrinico per il collagene (integrina α2ß1 o glicoproteina Ia/IIa) (332).
A
AAllltttrrriiigggeeennniiiaaassssssoooccciiiaaatttiiiaaallllll’’’iiipppeeerrrttteeennnsssiiiooonnneeeaaarrrttteeerrriiiooosssaaa
Oltre ai geni che codificano per componenti del sistema renina-angiotensina (enzima di conversione dell'angiotensina II, angiotensinogeno, recettore AT1 dell'angiotensina II) e i geni che codificano per componenti strutturali (costitutive) o funzionali dell'architettura mesangiale (collagene tipo IV, proteoglicani, sistema dell'interleuchina-1), numerosi altri geni sono stati "candidati" ad un putativo ruolo nella suscettibilità alla nefropatia diabetica e alle altre complicanze del diabete.
Data l'importanza dell'ipertensione arteriosa quale fattore indipendente di progressione della nefropatia diabetica, altri sistemi capaci di modulare in vario modo i livelli della pressione sistemica ed intraglomerulare sono stati oggetto di ricerche (333). Tra i geni per l'ipertensione un gruppo importante è rappresentato dai geni che codificano per i trasportatori dei cationi di membrana. Tra questi ampiamente studiato è il controtrasporto Na+/Li+, un surrogato dello scambiatore
sodio-protoni. E' stato proposto che la proteina responsabile di questo controtrasporto sia il trasportatore Na+/H+ amiloride-sensibile (NHE-1), ma non vi sono dati sul ruolo di questo gene nel predisporre
Altro gene dello stesso gruppo che è attualmente in via di studio è il trasportatore Na+/H+
amiloride-insensibile localizzato nel tubulo renale (NHE-3). Alcuni dati preliminari suggeriscono però che questo gene non svolge un ruolo importante nella patogenesi della nefropatia diabetica (334).
Più recentemente è stato osservato che linfoblasti di pazienti con ipertensione arteriosa essenziale presentano alterazioni nella cinetica proteina G dipendente del controtrasporto Na+/H+ (335). In
questo contesto, l'osservazione di un'aumentata attivazione della proteina G in linee cellulari di β−linfoblasti di pazienti con diabete tipo 1 e nefropatia diabetica apre una nuova pagina di ricerca con risultati promettenti anche nel diabete non-insulino-dipendente (333). L'aumentata attivazione della proteina G è stata associata con una variante genetica nella subunità β3 della proteina G, GNß3 (polimorfismo C825T a livello dell'esone 10). L'allele T è associato ad aumentata attività della proteina G ed è più frequente nell'ipertensione essenziale (336). Nessuna associazione è stata tuttavia trovata tra allele T e nefropatia diabetica. Portatori dell'allele T (CT o TT) sono risultati il 49% dei controlli ed il 53% dei diabetici tipo 1 con nefropatia (proteinuria o ESRD). Inoltre, non è stato osservato alcun eccesso di trasmissione dell'allele T dai genitori eterozigoti ai probandi con nefropatia (337). Successivamente, Bluthner e coll (338) esaminando la frequenza dell’allele T del polimorfismo C825T della subunità ß3 della proteina-G in soggetti in emodialisi, hanno ricavato informazioni compatibili con un ruolo specifico dell’allele T nello sviluppo e nella progressione della nefropatia diabetica. Nessuna associazione è stata riportata tra 825T e nefropatia, retinopatia e neuropatia da Shcherbak e coll. in una coorte di soggetti con diabete tipo 1 (339), da Beige e coll. (340), sia nel diabete tipo 1 che nel diabete tipo 2, e da Zychma e coll. (341) nel diabete tipo 2. Altro gene potenzialmente utile e non ancora esplorato in rapporto alla nefropatia diabetica è quello della α-adducina. Una variante di questo gene è associata all'ipertensione essenziale (342) e, tra i pazienti con ipertensione, alla sensibilità al sodio (343). In relazione alla frequente associazione tra nefropatia ed ipertensione, alla frequente preesistenza dell'ipertensione al diabete tipo 2, alla frequente "salt-sensitivity" dell'ipertensione arteriosa nel diabetico con microalbuminuria (344), il gene dell'adducina appare come un plausibile "gene candidato" (345).
G
GGeeennniiiccchhheeecccooonnntttrrrooollllllaaannnoooiiilllmmmeeetttaaabbbooollliiisssmmmooollliiipppiiidddiiicccooo
Se la frequente associazione tra nefropatia ed ipertensione arteriosa ha indirizzato l'attenzione sul significato della predisposizione familiare all'ipertensione essenziale e sul possibile ruolo di geni implicati nei meccanismi di regolazione del tono vascolare (in particolare i geni che codificano per componenti del sistema renina-angiotensina), la relazione tra nefropatia e familiarità per malattie cardiovascolari nonchè l'associazione stretta ed irrisolta tra complicanze microangiopatiche e patologie cardiovascolari rende razionale l'analisi dei fattori coinvolti nei processi aterosclerotico e trombotico. Alterazioni lipidiche possono giocare un ruolo nella patogenesi della nefropatia diabetica, mentre la terapia ipolipemizzante sembra attenuare la progressione della nefropatia (346). Particolare attenzione è stata recentemente dedicata all’apolipoproteina E. L'apoE media l'uptake epatico delle lipoproteine e il trasporto inverso del colesterolo. L'apoE presenta tre isoforme: E3 con funzione "normale", E2 con ridotta affinità per il recettore per le apoE, E4 con aumentata affinità. Le tre isoforme sono codificate da tre alleli codominanti ε1, ε2 e ε3. La isoforma E2 è associata con più bassi livelli di colesterolo (totale e LDL), ma più elevati livelli di trigliceridi rispetto a E3; E4 è associata a più elevati livelli di colesterolo rispetto a E3, ma più bassi livelli di trigliceridi. Una associazione tra polimorfismo dell'apoE e patologia cardiovascolare è stata descritta in popolazioni sia diabetiche che non diabetiche. Vi è evidenza che la presenza di apoE2 protegge, mentre quella di apoE4 espone alla malattia coronarica, anche se il valore predittivo nei confronti degli eventi cardiovascolari è modesto (347). Dopo che risultati preliminari hanno suggerito una associazione tra il polimorfismo triallelico dell'apoE e la nefropatia diabetica nel diabete tipo 2 (348), numerosi studi hanno confermato tale osservazione sia nel diabete tipo 2 (349-351) che nel tipo 1 (352). Nel complesso, gli studi, con le dovute eccezioni (350), suggeriscono che l'allele ε2 della apoE espone al rischio di nefropatia, mentre l'allele ε4 riduce il rischio di progressione del danno renale. In particolare, nello studio di Chowdhury e coll. (352), l'allele ε2 era presente nel 23.4% dei soggetti con nefropatia, nel 13.7% dei soggetti con diabete tipo 1 di breve durata (p=0.004) e nel 6.6% dei pazienti tipo 1 di lunga durata e senza segni di compromissione della funzione renale (p<0.001). Sebbene l'osservazione sia altamente significativa, è importante rilevare che solo circa il 23% dei diabetici tipo 1 con nefropatia presenta almeno un allele ε2; questo suggerisce che tale loco non è certamente il solo né il principale gene capace di contribuire alla suscettibilità alla nefropatia diabetica. Nello studio di Werle e coll. (351), i diabetici tipo 1, ma non i diabetici tipo 2, portatori dell’allele ε2 presentavano ridotti valori di clearance della creatinina e aumentata escrezione urinaria di albumina. L’esame di questo polimorfismo delle apoE tramite il “trasmission disequilibrium