52
Capitolo 4
Risultati e discussione
4.1 Effetti concentrazione e tempo dipendenti delle nanoparticelle
QTAM-02 e QTAM-03 sulla morfologia di cellule A549
I dati ottenuti dalle osservazioni delle cellule A549 al microscopio ottico, dopo trattamento con le soluzioni di nanoparticelle di PMMA a concentrazioni scalari e ad intervalli di tempo differenti, indicati nella sezione “Materiali e Metodi”, hanno permesso una prima analisi degli effetti delle nanoparticelle. In particolare, le cellule trattate con le soluzioni di QTAM-02 e QTAM-03 alle concentrazioni più alte, 25 e 50µg/mL, hanno mostrato, dopo soli 10’ di esposizione, un cambiamento della morfologia cellulare, indice di sofferenza. Inoltre, alle medesime concentrazioni, è stata rilevata la presenza di una sorta di “patina” nel pozzetto di coltura, che ha portato ad escludere queste due concentrazioni dagli studi successivi. Dopo un’esposizione di 3 ore alle nanoparticelle, si è potuto osservare un quadro di sofferenza cellulare generalizzato, probabilmente dovuto anche all’utilizzo di mezzo di coltura non ricostituito, richiesto dalle condizioni sperimentali.
Le osservazioni, dopo un tempo di esposizione di 1 ora, hanno mostrato lievi variazioni morfologiche delle cellule trattate con alte concentrazioni di NP (maggiori di 10µg/mL), mentre, le cellule trattate con NP alle concentrazioni comprese tra 0.5 e 10µg/mL, mostravano il loro profilo tipico, senza significative variazioni della morfologia e della vitalità.
53
4.2 Valutazione della vitalità cellulare dopo trattamento con nanoparticelle
QTAM-02 e QTAM-03 (0,5-50µg/mL)
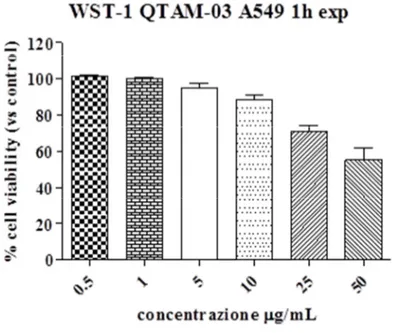
L’analisi della vitalità cellulare dopo trattamento con concentrazioni scalari di nanoparticelle QTAM-02 e QTAM-03 per 60’ e 180’, è stata effettuata mediante saggio colorimetrico WST-1. Questo tipo di valutazione preliminare è fondamentale per la determinazione della concentrazione massima di nanoparticelle in grado di non alterare in maniera significativa la vitalità cellulare. I risultati ottenuti evidenziano l’assenza di citotossicità delle nanoparticelle somministrate a basse concentrazioni, 0.5-1µg/mL e una inibizione della vitalità cellulare alle concentrazioni di 25 e 50µg/mL (≈ 25 e 90% rispettivamente). Nonostante la concentrazione 10µg/mL ha indotto una riduzione della vitalità cellulare di circa il 10%, è stata comunque selezionata per gli esperimenti successivi, poiché, concentrazioni inferiori non avrebbero assicurato il rilevamento di un segnale fluorescente apprezzabile. Tali risultati hanno portato alla scelta delle migliori condizioni sperimentali in termini di concentrazione di NP e tempo di trattamento, ovvero 10µg/mL e 1 ora, in accordo con quanto visto al microscopio ottico. E’ emerso inoltre che non vi sono differenze significative, in termini di vitalità cellulare, tra un tipo di NP e l’altro. Esposizioni per un tempo superiore a 3 ore (dati non mostrati) portano ad una riduzione della vitalità cellulare più marcata, effetto probabilmente imputabile anche all’utilizzo di mezzo di coltura senza siero.
54
Figura 25 Vitalità cellulare di cellule A549 dopo 60’ di trattamento con nanoparticelle QTAM-02
55
4.3 Analisi al microscopio a fluorescenza delle nanoparticelle QTAM-02 e
QTAM-03
Data la differente quantità di Fluoresceina immobilizzata sulla superficie delle nanoparticelle di PMMA, un’opportuna valutazione del segnale fluorescente emesso dalle QTAM-02 e QTAM-03 ha permesso di selezionare la tipologia di nanoparticelle più idonea alle successive analisi al microscopio confocale.
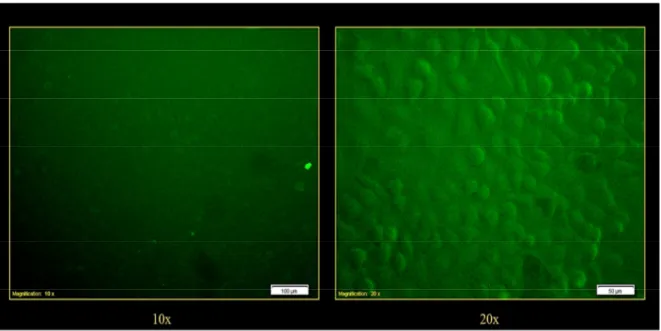
I risultati ottenuti con microscopio a fluorescenza hanno evidenziato una maggiore intensità del segnale fluorescente emesso dalle nanoparticelle QTAM-03 (Fig. 29) rispetto alle QTAM-02 (Fig. 28), pertanto sono state scelte le QTAM-03 per le successive analisi al microscopio confocale.
Figura 27 Cellule A549 non trattate (controllo). Le immagini sono ottenute con obiettivo 10X (a sinistra) e 20X (a destra)
56
Figura 28 Cellule A549 trattate con QTAM-02 (10µg/mL) per 60’. Le immagini sono ottenute con obiettivo 10X (a sinistra) e 20X (a destra)
Figura 29 Cellule A549 trattate con QTAM-03 (10µg/mL) per 60’. Le immagini sono ottenute con obiettivo 10X (a sinistra) e 20X (a destra)
57
4.4 Valutazione della localizzazione delle nanoparticelle QTAM-03 tramite
microscopia confocale
L’analisi al microscopio confocale ha permesso una valutazione tridimensionale del sistema biologico in studio. Attraverso il sezionamento in piani paralleli e successiva raccolta in serie delle sezioni ottiche acquisite, è stato possibile “ricostruire” un'immagine complessiva dell'intero volume scansionato.
L’indagine è stata effettuata, inizialmente, sulle cellule A549 trattate solo con la soluzione di nanoparticelle QTAM-03 alla concentrazione 10µg/mL (Fig. 30).
Figura 30 Cellule A549 trattate con QTAM-03 10µg/mL. Dettagli di cellule A549 trattate con QTAM-03 (a destra)
58
presentava sotto forma di spot di varie dimensioni e intensità, e la quasi totale assenza di rumore di fondo; tuttavia questi risultati non hanno fornito informazioni chiare sulla reale localizzazione delle nanoparticelle. Per tali motivi, le indagini successive hanno previsto, oltre al trattamento delle A549 con QTAM-03-FITC, anche la marcatura della membrana plasmatica e del nucleo cellulare, in modo da cercare di ottenere informazioni più precise circa la localizzazione delle NP nel sistema biologico in studio.
4.4.1 Cellule A549 trattate con colorante di membrana plasmatica Vybrant DiI e QTAM-03-FITC
La marcatura della membrana plasmatica delle cellule A549 effettuata con il colorante Vybrant DiI, è stata realizzata dopo il trattamento con la soluzione di nanoparticelle QTAM-03.
I dati ottenuti, eccitando alla lunghezza d’onda di 549nm, specifica per la visualizzazione del colorante Vybrant DiI, hanno evidenziato una marcatura delle membrane cellulari piuttosto omogenea e una lieve ma diffusa marcatura anche della regione citoplasmatica (dati non mostrati).
Quanto ottenuto eccitando alla lunghezza d’onda specifica per la fluoresceina, 488nm, ha evidenziato, come atteso, gli spot corrispondenti alle nanoparticelle-FITC, ma contemporaneamente anche un segnale dovuto a una coda di emissione nel verde del colorante Vybrant DiI (dati non mostrati). Quest’ultimo dato ha indicato una localizzazione degli spot corrispondenti alle NP, per la maggior parte, in prossimità della membrana cellulare, anche se non è stato possibile determinare se si tratti di localizzazione intracellulare o extracellulare.
59
4.4.2 Cellule A549 trattate con colorante dei nuclei Hoechst e nanoparticelle QTAM-03-FITC
Oltre al colorante di membrana plasmatica, per approfondire l’indagine della localizzazione delle NP, è stato anche utilizzato il colorante dei nuclei Hoechst. A differenza di quanto descritto per il colorante Vybrant DiI, la marcatura dei nuclei è stata effettuata prima del trattamento delle cellule con le nanoparticelle QTAM-03.
Figura 31 Marcatura dei nuclei di cellule A549 trattate con nanoparticelle QTAM-03
Le immagini ottenute hanno mostrato un’efficiente e specifica marcatura dei nuclei (in blu) e la presenza di spot fluorescenti verdi, corrispondenti alle NP. Questi ultimi sono stati ritrovati, per la maggior parte, in corrispondenza della periferia cellulare, supportando quanto emerso con l’uso del marcatore di membrana, ovvero l’ipotesi di una localizzazione delle nanoparticelle prevalentemente in prossimità
60
scansionando la cellula in corrispondenza del piano equatoriale, potrebbero essere interpretati come nanoparticelle presenti in corrispondenza di invaginazioni della membrana cellulare e individuati anche mediante tecnica di elettroporazione (dati non mostrati).
4.5. Profili di espressione della survivina ottenuti con RT-PCR
L’estrazione dell’RNA totale dalle cellule è stata eseguita secondo la procedura descritta nella sezione “Materiali e Metodi”. I campioni di RNA ottenuti sono stati analizzati mediante spettrofotometro NanoQuant. I risultati dell’analisi hanno mostrato un rapporto A260/A280 compreso tra 1.8 e 2.0 per tutti i campioni, indice di un buon grado di purezza dell’RNA estratto. Successivamente, l’RNA è stato valutato tramite elettroforesi in gel d’agarosio, per verificare l’integrità del campione. L’RNA totale è stato poi retrotrascritto, al fine di ottenere cDNA da utilizzare nelle reazioni di PCR.
Per verificare l’efficacia dell’esecuzione del protocollo di retrotrascrizione, è stata inizialmente eseguita una PCR con primer specifici per la GAPDH, codificata da un gene costitutivo, definito anche housekeeping, sempre presente ed espresso in misura simile nei diversi organi e tessuti di un organismo. Nei diversi campioni, le bande relative alla GAPDH hanno esibito una stessa intensità, come è ragionevole aspettarsi dallo studio di espressione di un gene costitutivo, fig. 32. Una volta verificata la corretta esecuzione del protocollo di retrotrascrizione, si è proceduto con l’indagine dell’espressione del gene per la survivina. L’espressione della survivina è stata indagata attraverso il protocollo di amplificazione descritto nel paragrafo 3.6.3, utilizzando come temperatura di annealing 59°C. Dal tracciato elettroforetico ottenuto è possibile osservare che la survivina è ben espressa nelle cellule A375, confermando i dati presenti in letteratura (fig. 32).
La retrotrascrizione e la successiva amplificazione del cDNA tramite PCR, sono state effettuate, in maniera analoga, anche su RNA estratto da monociti umani, al
61
fine di valutare una linea cellulare che potesse essere utilizzata come controllo negativo, in termini di mancata espressione della survivina, per i saggi di attività intracellulare del MB. I dati ottenuti dall’elettroforesi, osservabili in fig. 32, mostrano l’assenza della banda relativa alla survivina nei monociti, portando quindi alla scelta di queste cellule come controllo negativo nei successivi esperimenti.
Figura 32 Elettroforesi su gel d’agarosio per il prodotto di PCR ottenuto con primer per GAPDH e survivina su cellule A375 e monociti
4.6 Valutazione della localizzazione e della specificità del molecular beacon
dopo trasfezione con lipofectamina
Dopo aver verificato l’espressione del target survivina nelle cellule A375, è stata valutata la funzione come sensore del molecular beacon all’interno delle cellule, attraverso la tecnica di dinamica in vivo. Le cellule A375, trasfettate con MB 100nM, sono state visualizzate al microscopio confocale a 1, 3 e 6 ore. Successivamente all’acquisizione delle immagini, è stata eseguita la sovrapposizione delle immagini a fluorescenza con la corrispondente immagine DIC, effettuando così il merge e permettendo la valutazione della localizzazione del MB nelle cellule.
62
comparsa di fluorescenza prevalentemente concentrata vicino la membrana plasmatica.
Figura 33 Cellule A375 trasfettate con MB 100nM dopo 1 ora di esposizione
L’osservazione a tempi successivi, 3 e 6 ore di trasfezione, mostra un aumento progressivo del segnale fluorescente localizzato all’interno delle cellule (fig. 34, 35).
63
Figura 35 Cellule A375 trasfettate con MB 100nM a 6 ore di esposizione
Inoltre, è stata verificata la specificità del MB anti-survivina effettuando il medesimo studio di dinamica in vivo sui monociti. A conferma dei dati di espressione dell’mRNA per survivina, l’osservazione al microscopio confocale dei monociti trattati con MB 100nM non evidenzia alcun segnale fluorescente, fig. 36. Questa analisi conferma l’alta specificità del MB poiché, in assenza di espressione del target survivina, il MB non emette fluorescenza.
64
specificità del MB nei confronti dell’mRNA codificante per la survivina, è stata effettuata un’ulteriore analisi. I monociti sono stati trasfettati, con la stessa metodica indicata nel capitolo “Materiali e metodi”, con una sonda fluorescente (sondaMB) avente la medesima sequenza oligodeossinucleotidica del MB ma mancante del
quencher, quindi di per sé sempre fluorescente. I monociti osservati al microscopio
confocale, durante la trasfezione, hanno mostrato un intenso segnale fluorescente, fig. 37, confermando quindi la loro trasfettabilità e ulteriormente la specificità del MB.
Figura 37 Monociti trasfettati con sondaMB 100nM dopo 6 ore di esposizione
4.7 Valutazione degli effetti del molecular beacon sulla vitalità cellulare
La valutazione degli effetti sulla vitalità cellulare del trattamento con MB è stata effettuata mediante saggio WST-1. Dopo trasfezione per 6 ore con MB 100nM, è stata valutata la vitalità cellulare a 24 e 48 ore dall’ esposizione. L’analisi è stata eseguita rispetto ad un campione di controllo costituito da cellule A375 trasfettate con revMB 100nM. I dati mostrati in fig. 38 indicano una riduzione statisticamente significativa della vitalità cellulare di circa il 50% (p≤ 0,0001) indotta dal MB rispetto al revMB, sia a 24 che a 48 ore, quindi tempo-indipendente.
65
Figura 38 Vitalità cellulare di cellule A375 trasfettate con MB e revMB 100nM a 24 e 48 ore
4.8 Valutazione dell’attività farmacologica del MB in associazione al
Cisplatino
La valutazione degli effetti sulla vitalità cellulare in seguito a trattamento con MB in associazione a Cis-Pt è stata effettuata mediante saggio WST-1. Le cellule A375 sono state trasfettate per 6 ore con MB 100nM e trattate per 48 ore con Cis-Pt 3µM. L’analisi della vitalità cellulare è stata eseguita rispetto ad un campione di controllo costituito da cellule A375 trasfettate per 6 ore con revMB 100nM e trattate per 48 ore con Cis-Pt 3µM. . I dati mostrati in fig. 39 evidenziano un leggero effetto di sinergismo tra il MB e il Cis-Pt, essendo l’abbattimento della vitalità cellulare dell’associazione maggiore rispetto alla somma dei singoli trattamenti.
66
Figura 39 Vitalità cellulare di cellule A375 trasfettate con MB 100nM e trattate con Cis-Pt 3µM per 48 ore