Capitolo 2
Il trattamento della malattia metastatica
Come già accennato nel paragrafo 1.1 Epidemiologia, la percentuale di pazienti che al momento della diagnosi si presenta con malattia metastatica costituisce circa il 50% dei casi; a questo si deve aggiungere l’insorgenza di metastatizzazione in circa il 25% dei pazienti radicalmente operati.
La principale sede di secondarietà è rappresentata dal fegato (20-70% dei pazienti), seguita dal polmone (10-20% dei pazienti)6. La localizzazione epatica è la sola
presente in circa un terzo degli affetti. La presenza di metastasi costituisce sicuramente un fattore prognostico negativo, ma oggi, grazie ai miglioramenti delle varie strategie terapeutiche e alla loro reciproca combinazione, è possibile ottenere una buona percentuale di sopravvivenza a 5 anni, variabile dal 27 al 41%9.
Le strategie terapeutiche a disposizione sono infatti molteplici e comprendono la chemioterapia, la chirurgia, le terapie a target molecolare e le tecniche di trattamento loco-regionale (ad esempio, l’ablazione per radiofrequenza). L’obiettivo di questi trattamenti rimane strettamente legato alle caratteristiche della malattia e può variare dall’ottenimento della guarigione del paziente, all’allungamento della sua sopravvivenza o semplicemente alla palliazione con miglioramento della qualità di vita.
I fattori che influenzano la scelta del trattamento di prima linea comprendono tanto le caratteristiche cliniche del paziente (età, performance status, funzione epatica, comorbidità), quanto le caratteristiche biologiche del tumore (resecabilità, aggressività, chemioresistenza), tenendo ovviamente in debita considerazione la volontà del paziente e le sue aspettative.
2.1 Il ruolo integrato della chirurgia e della chemioterapia
I pazienti con malattia metastatica possono essere distinti in tre categorie, differenti per quanto riguarda la possibilità di un approccio chirurgico:
• pazienti con metastasi immediatamente resecabili
• pazienti con metastasi marginalmente o potenzialmente resecabili • pazienti con metastasi mai resecabili
2.
1aPazienti con metastasi immediatamente resecabili
A questo gruppo appartiene circa il 10-20%74 dei pazienti con CRC. Si tratta di
soggetti che presentano adeguati margini di resezione delle lesioni, assenza di coinvolgimento dei linfonodi portali e metastasi anche multiple ma distribuite in un unico lobo epatico. In questi pazienti la chirurgia permette di ottenere un alto tasso di resezioni complete, ma nonostante questo la frequenza di ricorrenza è molto elevata, fino al 75% dei casi. È questo il motivo per cui viene quasi sempre programmato un trattamento chemioterapico adiuvante o neoadiuvante. La chemioterapia preoperatoria permette di ridurre il volume delle lesioni al fine di aumentare il tasso delle risposte R0, testare la chemioresponsività tumorale e trattare anche eventuali micrometastasi. Il rischio di progressione di malattia durante tale fase di trattamento è estremamente basso e ad ogni modo, anche se si verificasse, permetterebbe semplicemente di anticipare il giudizio di malattia a cattiva prognosi.
Lo studio dell’European Organisation for Research and Treatment of Cancer (EORTC), Intergroup 4098375 ha confrontato l’efficacia della chemioterapia periooperatoria rispetto alla sola chirurgia, in termini di PFS, in pazienti con metastasi immediatamente resecabili. I 364 pazienti arruolati nello studio sono stati randomizzati in due bracci di trattamento, chemioterapia perioperatoria con FOLFOX4 o chirurgia da sola. I tassi di resezione completa ottenuti dai due trattamenti sono risultati del tutto sovrapponibili (83% vs 83.5%), mentre le differenze in termini di PFS hanno mostrato un trend in favore del braccio con chemioterapia (HR=0.79 95% CI 0.62-1.02; p=0.058).
Pertanto in considerazione dei risultati presentati da questo studio sembra ragionevole proporre un regime di chemioterapia neoadiuvante a base di oxaliplatino nei pazienti immediatamente resecabili, soprattutto in presenza di fattori prognostici negativi, quali presentazione sincrona delle metastasi, metastasi multiple o di dimensioni superiori ai 5 cm.
2.
1bPazienti con metastasi marginalmente o potenzialmente resecabili
La differenza tra metastasi “marginalmente” e “potenzialmente” resecabili risiede nel fatto che, mentre le prime rappresentano secondarietà operabili, quelle “potenzialmente resecabili” non lo sono ancora ma lo possono diventare.In entrambi i casi un trattamento chemioterapico di conversione viene preso in considerazione con lo scopo principale di ottenere una riduzione del volume delle lesioni visibili e la rimozione di eventuali micrometastasi non valutabili. Questo al fine di rendere l’intervento chirurgico fattibile e più efficace in termini di risposte R0, nel primo caso, e di consentire la chirurgia, altrimenti non attuabile, per eccessivo coinvolgimento epatico, nel secondo.
La scelta del trattamento chemioterapico tiene in considerazione le più importanti evidenze cliniche che emergono dalla recente letteratura:
• Equi-efficacia di FOLFIRI FOLFOX vs FOLFOX FOLFIRI
Tournigand e coll., secondo il disegno dello studio GERCOR76, hanno randomizzato 220 pazienti con prima diagnosi di CRC, in due bracci di trattamento: FOLFIRI fino a progressione seguito da FOLFOX (braccio A) e FOLFOX fino a progressione seguito da FOLFIRI (braccio B). Nessuna differenza statisticamente significativa è emersa tra i due gruppi di trattamento. Infatti, in prima linea, FOLFIRI ha permesso di ottenere il 56% di risposte, con una PFS mediana di 8.5 mesi, mentre FOLFOX6 ha ottenuto il 54% di risposte con una PFS mediana di 8.0 mesi (p=0.26). L’OS mediana dei 109 pazienti del braccio A è risultata di 21.5 mesi vs 20.6 dei 111 pazienti del braccio B (p=0.99). Lo studio ha sottolineato anche come fosse la chemioterapia del braccio B a portare più frequentemente il paziente alla resezione delle metastasi epatiche (9% vs 13%) pur non ottenendo un vantaggio statisticamente significativo in termini di risposte R0.
Alle medesime conclusioni è giunto anche lo studio italiano di Colucci e coll.77 che
ha confrontato la linea di trattamento FOLFIRI seguita da FOLFOX con quella FOLFOX seguita da FOLFIRI. Nessuna differenza in termini di RR e di chirurgia secondaria sulle metastasi è emersa tra i due bracci di trattamento (5.1% vs 4.4%). Ad oggi si ritiene pertanto equivalente l’utilizzo di queste doppiette nel trattamento neoadiuvante della malattia metastatica.
• Superiorità di FOLFOXIRI vs FOLFIRI
Uno studio di fase III, condotto dal Gruppo Oncologico Nord-Ovest (GONO)78, ha confrontato l’efficacia del regime di trattamento FOLFOXIRI con quella del regime FOLFIRI, in 244 pazienti con mCRC. Lo schema di trattamento FOLFOXIRI, in confronto a quello FOLFIRI, ha ottenuto un migliore RR e più lunghe PFS ed OS (RR: 66% vs 41%, p=0.0002; PFS mediana: 9.8 mesi vs 6.9 mesi, HR=0.63, p=0.0006; OS mediana: 22.6 mesi vs 16.7 mesi, HR=0.70, p=0.032), a fronte di un gestibile incremento della tossicità soprattutto in termini di neurotossicità periferica di grado 2/3 (19% vs 0%, p<0.001) e di neutropenia di grado 4 (50% vs 28%, p<0.001). Inoltre, il tasso di resezione completa delle metastasi è risultato maggiore tra i pazienti trattati con FOLFOXIRI rispetto al braccio di trattamento con FOLFIRI (tra tutti i 244 pazienti: 15% vs 6%, p=0.033; tra i pazienti con sola metastasi epatica: 36% vs 12%, p=0.017). In un’analisi multivariata, solo il trattamento con FOLFOXIRI è risultato essere collegato a risposta R0 alla chirurgia delle metastasi (HR=3.1; 95%CI: 1.2-7.9; p=0.018).
La maggiore efficacia del trattamento che combina i tre agenti citotossici, è emersa anche in un’analisi retrospettiva condotta su 196 pazienti con metastasi epatiche inizialmente non resecabili e trattati con la tripletta. FOLFOXIRI ha infatti consentito l’intervento chirurgico in 37 pazienti (19%). I pazienti sottoposti a chirurgia R0 hanno mostrato ad un follow-up mediano di 61 mesi, una PFS mediana di 17.8 mesi ed una OS mediana di 40.8 mesi, con una sopravvivenza a 5 anni nel 45% dei casi79.
Pertanto alla luce di quanto evidenziato potrebbe essere la combinazione FOLFOXIRI quella da preferire per il trattamento neoadiuvante di pazienti con malattia potenzialmente resecabile, mentre l’impiego di una doppietta (FOLFOX o FOLFIRI) potrebbe essere sufficiente nel paziente con malattia marginalmente resecabile.
2.1c Pazienti con metastasi mai resecabili
Esistono alcune condizioni che rappresentano delle controindicazioni assolute all’intervento chirurgico di resezione delle metastasi. Queste comprendono: la presenza di malattia extraepatica non resecabile (carcinomatosi peritoneale, metastasi polmonari multiple, metastasi ossee o cerebrali ed il coinvolgimento dei linfonodi dell’asse preaortico o celiaco) ed il massivo coinvolgimento del parenchima epatico (più di 6 segmenti interessati, invasione di oltre il 70% della superficie epatica o interessamento di tutte e tre le vene sovraepatiche)80.
Il trattamento di pazienti con malattia mai resecabile deve mirare all’ottenimento di due obiettivi principali: il prolungamento della sopravvivenza complessiva ed il miglioramento o almeno, il non peggioramento, della qualità di vita del paziente. Al fine di comprendere quale sia il più vantaggioso approccio terapeutico per il paziente con mCRC, Grothey e coll.81 in una metanalisi condotta su 7 studi di fase III
realizzati nel setting della malattia metastatica, hanno ricercato la presenza di correlazione tra la sopravvivenza mediana e le percentuali di pazienti riceventi una qualsiasi seconda linea di chemioterapia o una associazione dei tre agenti citotossici 5-FU/LV, irinotecano ed oxaliplatino durante il trattamento. I risultati hanno evidenziato l’esistenza di un’associazione statisticamente significativa tra l’OS mediana e la percentuale di pazienti trattati con i tre agenti chemioterapici (p=0.0008), mentre la significatività statistica non è stata raggiunta per i pazienti riceventi una qualsiasi seconda linea di chemioterapia (p=0.19). La sopravvivenza mediana è risultata, inoltre, significativamente superiore nei pazienti trattati in prima linea con una doppietta di farmaci (p=0.0083), rispetto a quelli riceventi il solo 5-FU/AF.
Partendo anche da queste osservazioni sono state proposte e studiate due differenti strategie di trattamento: schemi sequenziali, in cui i vari chemioterapici vengono somministrati in tempi successivi e schemi di associazione comprendenti la tripletta di farmaci, quest’ultimi giustificati soprattutto dalla possibile difficoltà di trattare in seconda linea pazienti progrediti e dalla necessità di sviluppare regimi con maggiore attività in termini di risposte obiettive.
Due recenti studi hanno riportato risultati analoghi tra schemi sequenziali, in cui i pazienti ricevevano esclusivamente fluoropirimidine in prima linea e gli altri chemioterapici erano introdotti successivamente, e schemi in cui l’irinotecano o l’oxaliplatino erano compresi già in prima linea.
Lo studio FOCUS82 ha confrontato, con obiettivo primario stabilito in OS, le differenti strategie terapeutiche di chemioterapia sequenziale vs chemioterapia
combinata, in 2135 pazienti con mCRC trattati con intento non curativo. I pazienti sono stati randomizzati in tre bracci di trattamento: un gruppo di controllo (strategia A), trattato con 5-FU in monoterapia, poi sostituito alla progressione dal solo irinotecano; un braccio di strategia B ricevente 5-FU in monoterapia fino a progressione e poi una chemioterapia combinata a base di oxaliplatino od irinotecano ed un gruppo di strategia C trattato fin da principio con chemioterapia combinata a base di oxaliplatino od irinotecano.
I pazienti riceventi la strategia terapeutica B o C hanno presentato una OS mediana più lunga, rispetto ai pazienti del braccio di controllo (A: OS mediana: 13.9 mesi; B, irinotecano: OS mediana: 15 mesi; B, oxaliplatino: OS mediana: 15.2 mesi; C irinotecano: OS mediana: 16.7 mesi; C oxaliplatino: OS mediana: 15.4 mesi). Ad ogni modo, solo la strategia C con irinotecano ha raggiunto la significatività statistica, nel test di superiorità rispetto al braccio A (p=0.01). Il confronto tra le strategie B e C ha soddisfatto invece, il test di non inferiorità (HR=1.06, 90%CI: 0.97-1.17).
Anche lo studio CAIRO83 è stato condotto allo scopo di valutare se pazienti con mCRC beneficiassero maggiormente di un trattamento sequenziale o di uno in combinazione. L’end-point primario dello studio è stato fissato in OS. Gli 820 pazienti arruolati sono stati randomizzati a ricevere un trattamento sequenziale con capecitabina (prima linea), irinotecano (seconda linea) e capecitabina + oxaliplatino (terza linea) o un trattamento di combinazione con capecitabina + irinotecano (prima linea) e capecitabina + oxaliplatino (seconda linea). I pazienti che hanno ricevuto un trattamento di combinazione hanno mostarto piccoli ma non significativi vantaggi in termini di OS, (OS: 17.4 mesi vs 16.3 mesi; HR=0.92; 95%CI: 0.79-1.08; p=0.3281), ed una più lunga PFS (HR=0.77; 95%CI: 0.67-0.89; p=0.0002), rispetto ai pazienti che hanno ricevuto la terapia sequenziale. Non vi sono state inoltre, differenze statisticamente rilevanti tra le PFS2 dei due gruppi (p=0.15) e tra la PFS2 del gruppo di combinazione e la PFS3 del gruppo in sequenza (p=0.19). In aggiunta, lo studio ha sottolineato come i due modelli di trattamento non differiscano molto in termini di tossicità, si è registrata, infatti, solamente una maggiore frequenza di hand-foot syndrome di grado 3 nei pazienti trattati con il regime di combinazione (13% vs 7%; p=0.004).
Alla luce di quanto esposto si può concludere che, il regime di trattamento in combinazione, in confronto a quello in sequenza, non aumenta significativamente la sopravvivenza complessiva del paziente con mCRC. Pertanto, se in passato al
paziente metastatico veniva proposto un trattamento fin da subito più aggresivo, oggi il trattamento sequenziale rappresenta una valida opzione terapeutica per pazienti con malattia metastatica mai operabile, ma per le cui condizioni generali si prevede la possibilità di arrivare a somministrare seconde linee di chemioterapia.
2.2 Il ruolo degli agenti biologici
Lo sviluppo di farmaci con meccanismo d’azione selettivo per le cellule tumorali, rappresenta da sempre una delle sfide più impegnative ed importanti per la terapia del cancro. Mentre con le diverse categorie di farmaci citotossici usualmente impiegati non è possibile evitare il danno alla cellula tissutale sana, ciò viene consentito dalla terapia a “bersaglio molecolare”, che in aggiunta si rivela essere terapia efficace, non per una neoplasia specifica ma per la malattia tumorale in quanto tale, essendo sempre le stesse le molecole necessarie per la crescita e la vitalità della cellula trasformata.
2.2a Gli inibitori dell’angiogenesi nella terapia a bersaglio molecolare
“Un tumore per crescere oltre un diametro di 2 mm e per metastatizzare ha bisogno di una rete vascolare propria” (teoria formulata da Folkman negli anni ’70), ne consegue che impedire la formazione di nuovi vasi sanguigni previene la crescita e la metastatizzazione tumorale. È questo il concetto su cui si fonda la terapia antiangiogenica.
I principi su cui si basa la terapia antiangiogenica e le ragioni di un suo potenziale successo nella cura dei tumori sono i seguenti:
• le cellule endoteliali rappresentano un bersaglio facilmente raggiungibile in seguito alla somministrazione del farmaco
• le cellule endoteliali sono cellule geneticamente stabili per cui non dovrebbero sviluppare resistenze
• il danno provocato a poche cellule endoteliali dovrebbe tradursi nella morte di molte cellule tumorali, la cui vitalità dipende dal continuo apporto di nutrimenti ed ossigeno e pertanto dal regolare flusso sanguigno
Durante il processo di angiogenesi le cellule endoteliali che in condizioni fisiologiche si trovano in uno stato di quiescenza, vengono attivate da fattori
angiogenici, sintetizzano enzimi proteolitici, invadono la matrice extracellulare, migrano in risposta ad un gradiente di fattori chemotattici e chemochine, proliferano e da ultimo si organizzano in strutture tubulari anastomotiche. L’intero processo è finemente regolato da fattori endogeni che stimolano o inibiscono l’angiogenesi. Nei tumori l’equilibrio fisiologico tra tali fattori è spostato a favore dei primi, auto-alimentanto, in maniera continua la creazione di una rete vascolare. Si viene pertanto ad innescare un processo di angiogenesi incontrollata.
L’angiogenesi tumorale è stimolata da numerosi fattori, tra cui Vascular Endothelial Growth Factor (VEGF) e basic Fibroblast Growth Factor (bFGF o FGF-2) sono quelli ritenuti più importanti. Numerose sono le molecole che sono state sviluppate negli ultimi anni allo scopo di interferire con la produzione dei fattori angiogenetici ed interferire con il legame di questi ai loro recettori. Oggetto di un’ampia sperimentazione clinica, avviata già da alcuni anni, risulta essere bevacizumab, anticorpo monoclonale diretto contro VEGF, il cui utilizzo nella pratica clinica sta ottenendo numerosi consensi.
Associato alla chemioterapia, bevacizumab ha infatti permesso di ottenere un importante beneficio in termini di risposte e di sopravvivenza.
In particolare la combinazione dell’anticorpo con 5-FU, somministrato in bolo, leucovorin e irinotecano (IFL) ha dimostrato un significativo incremento, rispetto al solo IFL, del tasso di risposte (44.8% vs 34.8%; p=0.004), della sopravvivenza libera da progressione (PFS mediana: 10.6 vs 6.2 mesi; p≤0.001) e della sopravvivenza globale (OS mediana: 20.3 vs 15.6 mesi; p≤0.001). Anche in termini di tollerabilità, l’associazione del bevacizumab con la chemioterapia si è rivelata sicura: nel braccio contenente IFL + bevacizumab, rispetto al solo IFL, si è registrata infatti, una significativa maggiore incidenza di episodi ipertensivi (22.4% vs 8.3%, p<0.01; ipertensione di grado 3: 11% vs 2.3%; p<0.01), che comunque non hanno determinato variazioni importanti nello schema di trattamento. Va detto però che, nel braccio sperimentale si è osservato un maggior numero di episodi di sanguinamento (3.1% vs 2.5% di grado 3-4), di perforazioni del tratto gastrointestinale (1.5% vs 0%) e di fenomeni tromboembolici (19.4% vs 16.2%), sebbene senza il raggiungimento della significatività statistica84. E’ stato grazie a questo studio randomizzato di fase III, condotto da Hurwitz, che nel 2004 la Food and Drug Administration (FDA) ha approvato l’utilizzo di bevacizumab in associazione a regimi contenenti 5-FU nel trattamento di prima linea di pazienti con mCRC.
Nel 2005 uno studio randomizzato di fase II85 ha confrontato l’associazione bevacizumab più 5-FU/LV rispetto a placebo più 5-FU/LV per il trattamento di
prima linea di pazienti con mCRC non candidabili a ricevere una terapia a base di irinotecano. L’OS ha rappresentato l’obiettivo primario dello studio, mentre PFS e RR sono stati fissati come obiettivi secondari. L’aggiunta di bevacizumab ha apportato un significativo incremento della sopravvivenza mediana dei pazienti (OS mediana: 16.6 mesi nel gruppo trattato con bevacizumab/5-FU/LV vs 12.9 mesi nel gruppo trattato con placebo/5-FU/LV; HR=0.79; p=0.16), nonché aumenti in PFS (PFS mediana: 9.2 mesi vs 5.5 mesi; HR=0.50; p=0.0002) ed in RR (26% vs 15.2%; p=0.055). I pazienti trattati con bevacizumab hanno presentato una maggiore incidenza di ipertensione di grado 3 (16% vs 3%). Ad ogni modo, questa è risultata ben gestibile con la terapia antiipertensiva e non ha richiesto la sospensione del biologico.
Precedentemente lo stesso gruppo, aveva condotto un altro studio di fase II86, che
randomizzava 104 pazienti in tre bracci di trattamento: un braccio di controllo ricevente 5-FU/AF in bolo e due bracci sperimentali, riceventi 5-FU/AF + bevacizumab rispettivamente a basse (5 mg/kg q14) e ad alte dosi (10 mg/kg q14). I risultati evidenziavano che l’aggiunta del bevacizumab apportava un vantaggio significativo sia in RR che in tempo alla progressione (RR: 40% vs 17%, p=0.029 e TTP: 9 vs 5.2 mesi, p=0.005) ed un trend positivo in termini di OS (21.5 vs 13.8 mesi, p=0.137), mentre la somministrazione del biologico ad alte dosi non si rivelava capace di incrementare l’efficacia del trattamento (RR: 24% vs 17% del braccio di controllo, p=0.434; TTP mediano: 7.2 vs 5.2 mesi, p=0.217; OS: 16.1 vs 13.8 mesi, p=0.582).
L’analisi combinata dei tre studi randomizzati sopra citati, ha dimostrato la superiorità del braccio di trattamento contenente bevacizumab rispetto agli schemi di chemioterapia convenzionale sia per quanto riguarda il tasso di risposte obiettive (RR: 34.1% vs 24.5%, p=0.019) che la PFS (PFS mediana: 8.8 mesi vs 5.6 mesi, p<0.0001) e la sopravvivenza globale (OS mediana: 17.9 mesi vs 14.6 mesi, p=0.008), portando gli autori a concludere che l’aggiunta in prima linea di bevacizumab al 5-FU/LV determina un beneficio clinico statisticamente significativo87.
L’associazione di bevacizumab a regimi contenenti oxaliplatino in prima linea è stata valutata in uno studio randomizzato a doppio cieco (NO16966)88 condotto su 1400 pazienti. Questi potevano ricevere capecitabina e oxaliplatino (XELOX) o 5FU/LV e oxaliplatino (FOLFOX 4) +/- bevacizumab.
La PFS mediana, obiettivo primario dello studio, tra i pazienti che hanno ricevuto bevacizumab è risultata di 9,4 vs 8,0 mesi nei pazienti che hanno ricevuto il placebo
(HR=0.83, 95% CI:0.72-0.95; p=0.0023), mentre la differenza in termini di sopravvivenza (21,3 vs 19,9 mesi; HR=0.89; 95%CI: 0.76-1.03; p=0,077) non ha raggiunto la significatività statistica. I tassi di risposta sono risultati sovrapponibili nei due bracci di trattamento (47% vs 49%, p=0,31). È da sottolineare, però, che più della metà dei pazienti, diversamente da quanto prevedeva il protocollo dello studio, ha interrotto il trattamento prima della progressione di malattia, spesso per cause diverse da tossicità legata a bevacizumab. Questo permette di ipotizzare che per ottenere il massimo beneficio dal trattamento sia necessario proseguire il farmaco fino alla progressione.
Gruenberger ha valutato, in uno studio monocentrico di fase II89, l’impatto di
bevacizumab associato a capecitabina ed oxaliplatino sulle complicanze chirurgiche e sulla capacità rigenerativa del fegato residuo in seguito a resezione delle metastasi. Cinquantasei pazienti con CRC e metastasi epatiche resecabili hanno ricevuto 12 cicli di trattamento con XELOX e bevacizumab (6 preoperatori e 6 postoperatori); l’anticorpo è stato sospeso cinque settimane prima della chirurgia e ripreso dopo un ulteriore intervallo post-chirurgico di 5 settimane.
Cinquantadue (93%) pazienti sono stati sottoposti a resezione radicale delle metastasi epatiche, nessuno di questi pazienti ha presentato un incremento di sanguinamenti intraoperatori o di complicanze durante il processo di riparazione della ferita.
Ad un follow-up di tre mesi è stato registrato un unico caso di prolungata disfunzione epatica accompagnato da alterazione della rigenerazione del fegato residuo legata però ad un quadro basale di steatoepatite.
I risultati pertanto suggeriscono che bevacizumab, nel setting perioperatorio, rispettando un intervallo di cinque settimane tra l’ultima somministrazione e la chirurgia, è sicuro e allo stesso tempo attivo, con un tasso di risposte del 73%.
2.2b Il recettore per l’Epidermal Growth Factor (EGFR)
Qualsiasi coltura cellulare per crescere in vitro necessita di siero il quale contiene, non tanto generici fattori nutritivi, ma soprattutto fattori di crescita. Uno di questi è l’Epidermal Growth Factor (EGF), identificato nel 1962 dal premio Nobel Stanley Coen90, che, 18 anni più tardi ne caratterizzò anche il recettore: l’Epidermal Growth Factor Receptor (EGFR)91. EGFR è il capostipite di una famiglia di recettori (ErbB) comprendente in tutto 4 membri: EGFR (Erb1 o HER1: Human Epidermal Growth Factor related Receptor 1), Erb2 (HER2 o neu), Erb3 (HER3) e Erb4 (HER4).
La sua struttura è schematizzabile in tre distinte regioni:
• un dominio extracellulare, sito di legame per i diversi fattori di crescita • un dominio transmembrana, di ancoraggio alla membrana cellulare
• un dominio intracellulare, responsabile dell’attivazione del recettore e della cascata di reazioni intracellulari che ne conseguono
Ciò che contraddistingue tali recettori è la loro attività tirosin-chinasica (TK), ossia la loro capacità di fosforilare i residui di tirosina situati nella porzione intracellulare del recettore stesso, attivando in tal modo una serie di eventi che da ultimo conducono all’attivazione intranucleare di specifici geni implicati nella regolazione e proliferazione cellulare. Questa attività, in condizioni normali, è soggetta a rigidi controlli, che vengono a mancare qualora si instauri un processo di trasformazione maligna, con conseguenze quali l’aumento dell’attività proliferativa, l’inibizione dell’apoptosi, l’innesco di processi di neoangiogenesi, l’invasione dei tessuti circostanti e la metastatizzazione a distanza.
Si sono identificate, sino ad oggi, 11 molecole dotate di capacità legante tali recettori: EGF, TGF-α (Trasforming Growth Factor-α), amphiregulin, HB-EGF (Heparin Binding EGF), betacellulin, epiregulin, epigen, neuregulins 1,2,3 e 492.
Alcuni di questi ligandi sono specifici per un unico recettore (es. TGF-α solo con EGFR), altri invece hanno la capacità di interagire con più di un recettore. Il ligando per HER2 non è stato ancora identificato ma si ritiene, con buona probabilità, che Erb2 abbia prevalentemente funzione di co-recettore, essendo in grado di aumentare l’affinità del complesso recettoriale dimerico con il corrispondente ligando93,94. Nelle cellule normali, dall’interazione tra ligando e recettore, origina un processo a molti stadi, che favorisce la trasmissione del segnale dall’ambiente extracellulare al nucleo. La prima fase è sempre rappresentata dall’accoppiamento di due molecole recettoriali uguali, chiamate omodimeri, o tra loro differenti, denominate eterodimeri. Verosimilmente è la relativa presenza di un recettore rispetto agli altri ad influenzare la modalità di dimerizzazione95.Per la sua funzione di co-recettore, già illustrata, HER2 può legare, indifferentemente, tutti gli altri recettori96.
A seguito della dimerizzazione, la conformazione recettoriale subisce importanti modificazioni, a loro volta responsabili dell’attivazione della tirosin-chinasi intracellulare e della conseguente fosforilazione dei residui tirosinici della stessa molecola e/o della molecola accoppiata (autofosforilazione e/o fosforilazione incrociata all’interno del dimero).
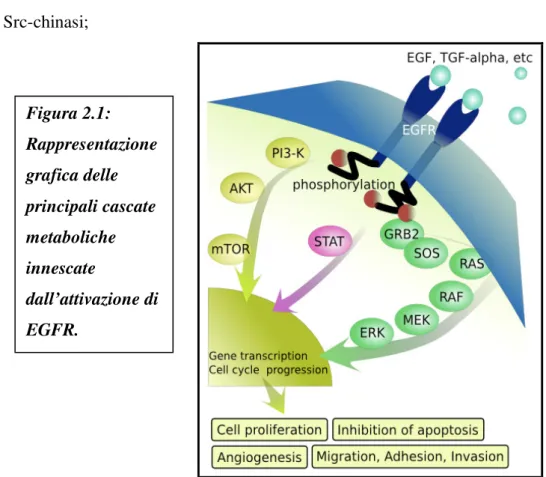
Tra le principali cascate metaboliche che prendono origine dalla fosforilazione di EGFR (FIGURA 2.1): • Ras/Raf/MAPK; • PI3K/Akt ; • fosfolipasi C (PLC-γ)/protein-chinasi C (PKC); • STAT; • Src-chinasi;
Tutte queste vie del segnale, assieme esercitano un ruolo di controllo cruciale su alcuni dei più importanti meccanismi coinvolti nello sviluppo e nella progressione delle neoplasie: crescita, proliferazione, invasione, migrazione cellulare ed angiogenesi.
Nelle cellule cancerose meccanismi diversi possono portare ad una iperstimolazione della via di segnale di EGFR tra cui:
• iperespressione di EGFR, conseguente ad anomalie di trascrizione o ad aumento del numero di copie del gene (per amplificazione o polisomia); • mutazioni del gene EGFR, che possono portare a forme della proteina
costitutivamente attivate (es. la forma tronca EGFRvIII); • iperproduzione autocrina di ligandi
Figura 2.1: Rappresentazione grafica delle principali cascate metaboliche innescate dall’attivazione di EGFR.
EGFR si ritrova sulla superficie delle cellule normali, particolarmente su quelle di natura epiteliale, in numero variabile dalle 40.000 alle 100.000 copie97,98, mentre risulta iperespresso in un terzo, almeno, di tutti i tumori epiteliali (TABELLA 2.1), associandosi in questi casi ad una prognosi tendenzialmente più sfavorevole. L’iperespressione è infatti indicativa di una malattia particolarmente aggressiva, caratterizzata da scarsa differenziazione, elevata frazione di crescita ed alto potenziale metastatico, che correlano con aumento del rischio di recidiva, metastasi e ridotta sopravvivenza.
Tabella 2.1 Iperespressione di EGFR nei diversi tumori epiteliali
TUMORI CON IPERESPRESSIONE DI EGFR %
Carcinoma del colon 25-77
Carcinoma del capo e collo 80-100 Carcinoma del pancreas 30-50 Carcinoma del polmone NSCLC 40-80 Carcinama della mammella 14-91
Carcinoma del rene 50-90
Carcinoma dell’ovaio 35-70 Carcinoma della vescica 31-48
Glioma 40-63
Muovendo dalle considerazioni fatte fino a questo punto negli ultimi anni sono stati sviluppati farmaci mirati ad interferire con EGFR ed i suoi effettori.
Diverse sono le possibilità, sino ad ora sviluppate, per poter bloccare o inibire l’attività di EGFR. Tra queste:
• anticorpi monoclonali (MoAb) diretti contro la porzione extracellulare del recettore;
• piccole molecole inibitrici dell’attività tirosin-chinasica; • oligonucleotidi antisenso;
• complessi ligando-tossine ed immunotossine;
di cui, le prime due elencate, risultano essere quelle di esclusivo impiego nella pratica clinica quotidiana.
2.2c Anticorpi monoclonali anti-EGFR: il cetuximab
Nel trattamento del tumore del colon-retto sono registrati due anticorpi monoclonali diretti verso EGFR, il panitumumab ed il cetuximab. Il primo è un MoAb completamente umanizzato di 147 Kda, appartenente alla classe IgG2, mentre il cetuximab è un MoAb chimerico, murino umano di 152 Kda appartenente alla classe IgG1. Entrambi riconoscono il dominio extracellulare di EGFR, creando un ingombro sterico che impedisce l’ancoraggio dei ligandi naturali del recettore. L’utilizzo del cetuximab in monoterapia o in combinazione con gli altri chemioterapici standard, è stato approvato, per la prima volta, nel febbraio 2004, dalla US Food and Drug Administration, per il trattamento di pazienti con mCRC, EGFR+, irinotecano refrattario99. La condizione di irinotecano-refrattarietà viene
soddisfatta quando la malattia mostra segni di progressione durante o entro un mese dalla sospensione di un regime chemioterapico contenente irinotecano. Ancora oggi l’impiego di cetuximab viene considerato nei pazienti che presentano tali caratteristiche tumorali, ma numerose evidenze cliniche hanno portato a restringerne l’impiego solo ai pazienti con tumore K-RAS wild-type. Studi analoghi a quelli condotti in pazienti trattati con cetuximab hanno confermato il potere predittivo negativo delle mutazioni di K-RAS anche in relazione alla risposta a panitumumab.100,101 Sulla base di questi dati l’EMEA ha registrato tale farmaco limitandone l’utilizzo ai soli pazienti con mCRC chemiorefrattario, K-RAS WT. I primi risultati incoraggianti, riguardanti l’impiego di cetuximab, provengono da uno studio di fase II non randomizzato, del 2004, condotto con lo scopo di valutare l’efficacia antitumorale ed il grado di tossicità del cetuximab su 57 pazienti con mCRC, irinotecano-refrattario, a cui il farmaco è stato somministrato in monoterapia (una dose iniziale di 400 mg/m2 in 2 ore, successivamente infusioni settimanali di 250 mg/m2 in un’ora). Sei dei 57 (10.5%) pazienti arruolati hanno mostrato una risposta parziale al trattamento e 20 pazienti (35%) hanno presentato, invece, una risposta minore (riduzione tumorale tra il 25 e il 49%) o una stabilizzazione di malattia, con una mediana di OS di 6.4 mesi. I principali eventi avversi riconducibili al trattamento hanno compreso un rash cutaneo, prevalentemente al volto ed al tronco (di ogni grado nell’86% dei pazienti, di grado 3 nel 18%) ed una variabile associazione di astenia, fatigue, malessere o letargia (di ogni grado nel 56% dei pazienti, di grado 3 nel 9%)102.
Nei mesi successivi sono stati confermati i risultati ottenuti da Saltz, ma anche sottolineata la maggiore attività del cetuximab in schemi di associazione, grazie allo
studio di fase II randomizzato BOND (Bowel Oncology with Cetuximab Antibody), condotto su 329 pazienti con mCRC, EGFR+, provenienti da 56 centri di 11 paesi europei. Questo ha confrontato l’efficacia di uno schema terapeutico con solo cetuximab vs uno con cetuximab + irinotecano. Il tasso di risposta nel regime di combinazione è risultato significativamente più alto rispetto a quello in monoterapia (22.9% vs 10.8%; p=0.007), così come la sopravvivenza mediana (OS mediana: 8.6 vs 6.9 mesi; p=0.48) ed il tempo a progressione tumorale (TTP: 4.1 vs 1.5 mesi; p<0.001)103. Dallo studio è emersa anche:
1. la relazione di proporzionalità diretta tra l’efficacia del farmaco e l’entità delle manifestazioni tossiche cutanee. Infatti sono stati i pazienti che hanno presentato un grado maggiore di tossicità cutanea a mostrare le migliori risposte obiettive;
2. la mancanza di correlazione tra il grado di espressione di EGFR e la risposta clinica alla terapia.
Il vantaggio ottenibile dall’aggiunta di cetuximab a schemi chemioterapici a base di irinotecano è stato confermato anche dal trial CRYSTAL. Il presente studio è stato condotto con lo scopo di valutare l’efficacia del cetuximab in combinazione con lo schema standard FOLFIRI, in confronto al solo FOLFIRI, per il trattamento in prima linea di pazienti con mCRC, EGFR+. I 1217 pazienti risultati eleggibili sono stati randomizzati a ricevere cetuximab più FOLFIRI (Gruppo A) o solo FOLFIRI (Gruppo B). La PFS ha costituito l’obiettivo primario dello studio, mentre l’OS, il tasso di risposte (RR) e di controllo di malattia e la tollerabilità del trattamento hanno rappresentato gli obiettivi secondari. I pazienti del gruppo A hanno mostrato una PFS significativamente più lunga (PFS mediana: 8.9 mesi vs 8 mesi, p=0.036) ed un miglior RR (46.9% vs 38.7%, p=0.005) rispetto ai pazienti del gruppo B. I pazienti del gruppo A hanno presentato, inoltre, una buona tolleranza al trattamento. La frequenza di neutropenia (26.7% Gruppo A, 23.3% Gruppo B) e diarrea (15.2% e 10.5% rispettivamente) è risultata sostanzialmente sovrapponibile tra i due gruppi. La tossicità cutanea è rimasta il più comune evento avverso di grado 3-4 tra i pazienti in trattamento con cetuximab (18.7% e 0.2% rispettivamente)104.
Un miglior tasso di risposta e una più lunga PFS (RR: 16.4% vs 4.2%; p=0.0001 e PFS mediana: 4 mesi vs 2.6 mesi; HR=0.692; 95%CI: 0.617-0.776; p=0.0001), associate alla somministrazione di cetuximab, si sono ottenute anche nello studio EPIC (Cetuximab plus Irinotecan for Metastatic Colorectal Cancer)105, il cui intento primario è stato però, quello di dimostrare il vantaggio in termini di sopravvivenza globale, ottenibile dall’aggiunta di cetuximab ad irinotecano per il trattamento di pazienti con tumore EGFR +, progredito al trattamento in prima linea con schemi
contenenti oxalilplatino. Il fallimento dell’obiettivo primario (OS mediana cetuximab/irinotecano: 10.7 mesi vs OS mediana irinotecano: 10 mesi; HR=0.975; 95%CI: 0.854-1.114; p=0.71) è, verosimilmente, da attribuire al cross-over dei bracci dello studio, ossia al fatto di aver somministrato cetuximab ai pazienti randomizzati a ricevere il solo irinotecano dopo progressione di malattia.
Infine, negli ultimi anni, si è cercato di valutare la possibilità di una strategia terapeutica che combinasse gli effetti dell’anti-EGFR (cetuximab o panitumumab) a quelli dell’antiangiogenetico (anti-VEGF) bevacizumab. Dati incoraggianti sono inizialmente emersi dallo studio randomizzato di fase II, BOND2 di Saltz e coll., in cui 83 pazienti, irinotecano refrattari, sono stati randomizzati a ricevere l’associazione di cetuximab e bevacizumab con o senza l’aggiunta di irinotecano. Nel braccio di pazienti trattati con la combinazione dei tre farmaci (CBI) è emerso, infatti, un TTP (obiettivo primario dello studio) di 7.3 mesi versus i 4.9 mesi dei pazienti appartenenti al braccio CB (cetuximab + bevacizumab); il gruppo CBI ha ottenuto risultati migliori anche in termini di tasso di risposte (37% vs 20%) e di OS a 28 mesi di follow-up (14.5 vs 11.4 mesi), entrambi obiettivi secondari dello studio106. Tuttavia gli stessi autori hanno sottolineato la necessità di analizzare i
risultati con una certa cautela, soprattutto in ragione dei dati preliminari del Panitumumab Advanced Colon Cancer Evaluation Trial, che hanno condotto alla sospensione anticipata dello studio. In tale trial, infatti 800 pazienti trattati con lo schema FOLFOX e 200 con quello FOLFIRI + bevacizumab sono stati randomizzati a ricevere o meno l’anti-EGFR panitumumab, con risultati in termini di OS e PFS nettamente inferiori nel braccio di pazienti trattati con l’inibitore dell’EGFR.
Ed infatti, a distanza di pochi mesi, lo studio CAIRO2 ha confermato l’effetto peggiorativo dell’aggiunta del cetuximab ad uno schema contenente bevacizumab, mostrando risultati di PFS significativamente superiori nel braccio di pazienti (dei 736 arruolati) trattati con la combinazione capecitabina + oxaliplatino + bevacizumab rispetto a quelli riceventi anche cetuximab (10.7 vs 9.6 mesi; p=0.018)107. Inoltre, come prevedibile, l’aggiunta del cetuximab ha determinato un incremento degli effetti collaterali, sia a livello cutaneo che gastroenterologico.
• Effetti avversi
Gli inibitori dell’EGFR vengono generalmente ben tollerati e non determinano gli effetti collaterali caratteristici dei farmaci citotossici.
Tra gli effetti avversi conseguenti l’utilizzo del cetuximab, è la tossicità cutanea quella ad avere il maggior risalto. Già nello studio BOND102, è stata sottolineata la
comparsa di rash acneiforme nell’80% dei pazienti appartenenti ad entrambi i gruppi di trattamento, con un’incidenza di tossicità di grado 3-4 del 9.4% e del 5.2% (p=0.20), rispettivamente nel braccio cetuximab + irinotecano ed in quello cetuximab in monoterapia. Lo stesso studio ha riscontrato una correlazione statisticamente significativa tra gravità della reazione cutanea e attività del trattamento.
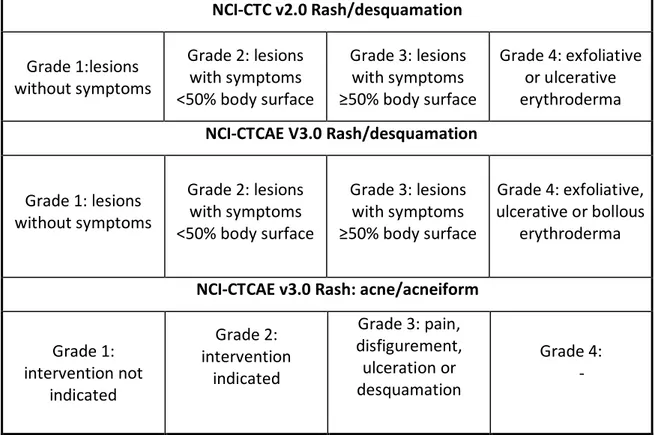
Negli studi clinici l’eruzione acneiforme cutanea viene classificata in accordo ai criteri NCI-CTC.2 (National Cancer Institute Common Toxicity Criteria version 2.0) o a quelli più recenti del National Cancer Institute Common Terminology Criteria for Adverse Events version 3.0 (NCI CTCAE v3.0). (TABELLA 2.2)
Tabella 2.2 Classificazione semplificata dell’eruzione acneiforme causata dagli inibitori di EGFR, secondo le versioni 2.0 e 3.0 del National Cancer Institute – Common Toxicity Criteria
NCI-CTC v2.0 Rash/desquamation Grade 1:lesions without symptoms Grade 2: lesions with symptoms <50% body surface Grade 3: lesions with symptoms ≥50% body surface Grade 4: exfoliative or ulcerative erythroderma NCI-CTCAE V3.0 Rash/desquamation Grade 1: lesions without symptoms Grade 2: lesions with symptoms <50% body surface Grade 3: lesions with symptoms ≥50% body surface Grade 4: exfoliative, ulcerative or bollous erythroderma
NCI-CTCAE v3.0 Rash: acne/acneiform
Grade 1: intervention not indicated Grade 2: intervention indicated Grade 3: pain, disfigurement, ulceration or desquamation Grade 4: -
L’eruzione rimane solitamente confinata alle aree seborroiche quali il viso, il collo, le regioni retroauricolari, le spalle, la parte superiore del tronco e la nuca, interessa meno comunemente la schiena, l’addome, le braccia e le gambe, mentre risparmia sempre il palmo delle mani e la pianta dei piedi. Le lesioni possono evolvere da papule follicolari eritematose a pustole, che tendono a loro volta a confluire, con formazione di lacune purulente che si essiccano evolvendo in croste giallastre. (FIGURA 2.2)
Talvolta si associano teleangectasie simili alle lesioni tipiche della rosacea. Raramente, l’infiammazione è tanto accentuata da provocare necrosi cutanea con formazione di escare necrotiche ed ulcerazioni. L’eruzione si manifesta in genere da 2 giorni a 3 settimane dopo l’inizio del trattamento e può talvolta andare incontro a miglioramento spontaneo, nonostante la prosecuzione della terapia con cetuximab. Se, invece, la somministrazione dell’inibitore di EGFR viene sospesa, le lesioni scompaiono in poche settimane, residuando talvolta iperpigmentazione e xerosi cutanea108.
Manifestazioni meno comuni di tossicità cutanea sono rappresentate da alterazioni ungueali (solitamente paronichia, estremamente dolorosa se complicata da granuloma piogeno), modificazioni dei capelli, teleangectasie ed iperpigmentazione. L’eruzione acneiforme risponde alla terapia antibiotica a base di tetracicline, mentre per la xerosi cutanea è necessario un trattamento con creme emollienti.
Nonostante i meccanismi fisiopatologici alla base della tossicità cutanea non siano ancora totalmente compresi, vi sono alcune osservazioni cliniche che consentono di supporre un meccanismo determinato direttamente dall’inibizione di EGFR:
• manifestazioni cutanee simili, si sviluppano conseguentemente alla somministrazione di farmaci anti-EGFR, indipendentemente dalla loro categoria di appartenenza (sia anticorpi monoclonali, come cetuximab, panitumumab e matuzumab, che inibitori dell’attività tirosina-kinasi, come gefitinib ed erlotinib). La stessa tossicità cutanea od ungueale non si manifesta, invece, dopo somministrazione di farmaci inibitori di altri membri recettoriali della famiglia EGFR, come trastuzumab, anticorpo monoclonale diretto contro HER2109;
• la tossicità cutanea appare essere dose dipendente, come evidenziato per gefitinib110 e panitumumab (ABX-EGF)111;
• la presenza, in topi transgenici EGFR-null, di alterazioni dell’epidermide, in parte simili a quelle indotte dall’utilizzo dei farmaci inibitori di EGFR112;
• evidenze sempre maggiori, sia per cetuximab101,102 e panitumumab111 che per gefitinib113 ed erlotinib114, mostrano una significativa correlazione tra l’entità delle manifestazione cutanee e la risposta tumorale/sopravvivenza globale del paziente.
Nonostante EGFR abbia un’espressione quasi ubiquitaria nei tessuti epiteliali normali, la tossicità dei farmaci inibitori dello stesso è scarsamente rappresentata e limitata, appunto, alle manifestazioni cutanee. Questo, probabilmente, in relazione alla maggiore suscettibilità all’apoptosi delle cellule tumorali rispetto a quelle normali, a parità di inibizione della via dell’EGFR. Infatti, così come emerso dagli studi recenti115, segnali provenienti dalla matrice extracellulare e dall’interazione con
le cellule contigue, renderebbero le cellule normali meno dipendenti dal pattern di EGFR.
Figura 2.2 Tre possibili quadri clinici di tossicità cutanea da anti-EGFR
Infine, in pazienti che assumono inibitori di EGFR, rispetto a quelli trattati con la sola chemioterapia standard, si riscontra in corso di trattamento, una riduzione più marcata dei valori di magnesio plasmatico. A sostegno della presunta relazione tra assunzione di anti-EGFR ed ipomagnesiemia vi sono analisi retrospettive sia per cetuximab116 che per panitumumab117 e lo studio prospettico di Tejpar e coll118.
Quest’ultimo dimostra infatti, un calo della magnesiemia circa 10 volte maggiore nei pazienti riceventi cetuximab rispetto a quelli del gruppo di controllo trattati con sola terapia convenzionale (-0.00157 mmol/l/die vs -0.00014 mmol/l/die) e permette di ipotizzare, in relazione agli elevati valori della magnesiuria delle 24h, un alterato riassorbimento renale quale meccanismo eziopatogenetico. Tale supposizione trova favorevole riscontro negli esperimenti elettrofisiologici di Groenestage e coll.119, dove viene riconosciuto all’EGF un ruolo chiave per il mantenimento dell’omeostasi del magnesio. L’inibizione di EGFR, così come l’insufficiente espressione di EGF geneticamente determinata, provoca una debole attivazione del canale epiteliale del magnesio (TRP M6) con conseguente eccessiva perdita dell’elettrolita stesso nelle urine.
Da ultimo, come recentemente osservato da Vincenzi e coll su una serie di 68 pazienti con mCRC sottoposti a trattamento con cetuximab + irinotecano e pesantemente pretrattati, una più evidente e precoce riduzione dei livelli circolanti di magnesio risulta predittiva di maggiore attività (RR: 64% vs 25.6%, p=0.004) ed efficacia (TTP: 6.0 vs 3.6 mesi, p<0.0001; OS: 10.7 vs 8.9, p=0.021) della terapia120.
• Lo studio dei fattori predittivi di beneficio: generalità
I farmaci inibitori di EGFR, attualmente registrati per il trattamento del paziente con mCRC, hanno permesso di migliorarne significativamente la prognosi. Analisi trasversali, condotte su alcuni dei più importanti trial che hanno valutato l’efficacia degli anti-EGFR, dimostrano però, come solo alcuni dei pazienti trattati, ricevano un reale beneficio dalla somministrazione del farmaco. Pertanto diventa necessario comprendere quali siano le caratteristiche dei pazienti “responders”, al fine di evitare la somministrazione di una terapia, costosa e non priva di effetti collaterali, a quei pazienti che sicuramente non ne trarrebbero alcun vantaggio.
In prima analisi l’attenzione va posta sull’osservazione che, anche se sembrerebbe ragionevole aspettarsi una maggiore efficacia del farmaco nei pazienti con tumore esprimente EGFR all’immunoistochimica, i dati emergenti dai vari trials clinici non confermano tale supposizione, dimostrando piuttosto l’esistenza di un’attività farmacologica sovrapponibile tra i pazienti EGFR + e quelli EGFR – 121,122.
Questa strana incoerenza, come in un primo momento si era ipotizzato, non sembra essere dovuta alla bassa sensibilità del kit anticorpale approvato dalla FDA per l’allestimento dell’IHC. Emerge infatti, da un confronto con altri kit esistenti in commercio ed utilizzati allo stesso scopo, una sostanziale sovrapponibilità di
risultati123. Ad ogni modo va sottolineato, come una discrepanza tra positività immunoistochimica ed efficacia del farmaco possa esistere in virtù del fatto che i kit anticorpali utilizzati riconoscono porzioni del dominio recettoriale extracellulare differenti da quelle riconosciute dal farmaco.
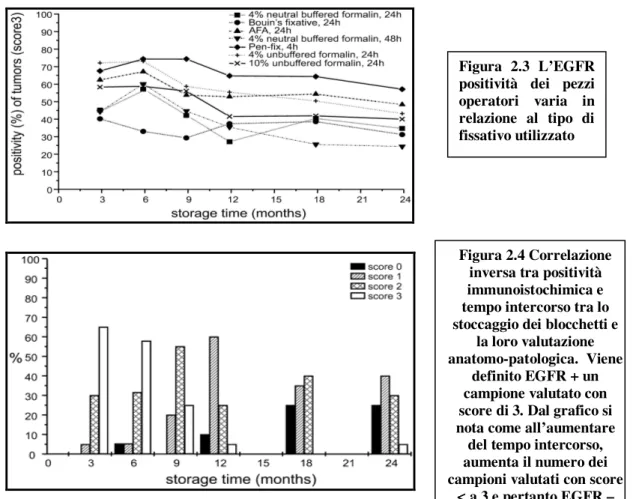
Altra possibile spiegazione emerge focalizzando l’attenzione sulle modalità di esecuzione del test immunoistochimico. In modo particolare, come dimostrato dallo studio prospettico elaborato da Atkins e coll.124, la percentuale di positività immunoistochimica di EGFR sembra variare in relazione al tipo di fissativo utilizzato (FIGURA 2.3) ed essere inversamente correlata al tempo trascorso tra lo stoccaggio del blocchetto e la valutazione anatomo-patologica (FIGURA 2.4).
Nel definire inadeguata la metodica di valutazione immunoistochimica concorrono anche la soggettività dell’interpretazione, la soglia di positività convenzionalmente fissata all’1% e da ultimo, ma non per questo meno importante, la possibile mancanza di concordanza tra positività di EGFR nel tessuto tumorale primitivo e
Figura 2.3 L’EGFR positività dei pezzi operatori varia in relazione al tipo di fissativo utilizzato
Figura 2.4 Correlazione inversa tra positività immunoistochimica e tempo intercorso tra lo stoccaggio dei blocchetti e
la loro valutazione anatomo-patologica. Viene
definito EGFR + un campione valutato con score di 3. Dal grafico si nota come all’aumentare
del tempo intercorso, aumenta il numero dei campioni valutati con score
nelle rispettive metastasi. In merito a questo hanno indagato alcuni gruppi di studio, le cui analisi statistiche hanno però portato a risultati diametralmente opposti. Infatti, mentre Scartozzi e coll.125, a conclusione di uno studio condotto su 99 campioni di CRC primitivo e sulle corrispettive 103 metastasi (84 epatiche, 13 polmonari, 5 cerebrali, 1 ossea), hanno riscontrato una assenza di concordanza nel 36% dei 53 tumori primitivi EGFR + e nel 15% dei 46 tumori primitivi EGFR - , Italiano e coll.126, su un totale di 80 campioni di tumore del colon-retto assieme alle corrispettive metastasi (79 epatiche, 1 polmonare) hanno evidenziato solo 5 casi di mancata concordanza primitivo-metastasi ed una percentuale decisamente più elevata di primitivi EGFR + (80% vs 53.3%).
Ad ogni modo le ragioni biologiche della possibile discordanza di espressione di EGFR tra il tumore primitivo e le sue metastasi sono ancora da comprendersi a fondo.
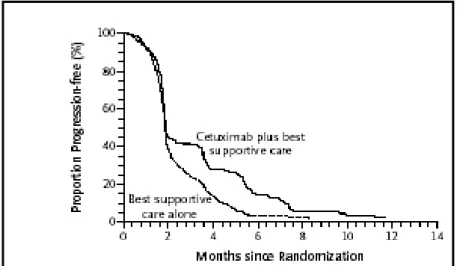
Altro interessante riscontro emerge dagli studi che valutano cetuximab e panitumumab in monoterapia, da cui risulta che entrambi gli anticorpi monoclonali, indipendentemente dal numero di linee di chemioterapia ricevute dal paziente in precedenza, producono un tasso di risposta che costantemente si attesta attorno al 10%. Inoltre, indipendentemente dallo studio clinico randomizzato considerato103,104,105, non esiste una grande differenza tra la mediana di PFS dei pazienti trattati con l’inibitore dell’EGFR e quella di pazienti riceventi la chemioterapia convenzionale (braccio di controllo). Dal punto di vista grafico anche l’evidenza delle curve di progressione di Kaplan Meier permette di sottolineare come il 50% dei pazienti trattati con il farmaco a bersaglio molecolare non ne tragga un effettivo beneficio (FIGURA 2.5).
Figura 2.5 Curve di progressione di Kaplan Meier di uno studio che confronta cetuximab in monoterapia con la sola BSC. Solo la metà dei pazienti ottiene beneficio dalla somministrazione del farmaco.
Data la scarsa capacità dimostrata dall’immunoistochimica nel predire, sulla base della positività EGFR, la risposta al trattamento, alcuni gruppi di studio hanno provato ad utilizzare la FISH (Fluorescent In Situ Hybridization) o la CISH (Chromogenic In Situ Hybridization) per la determinazione quantitativa del numero di copie del gene di EGFR e la sua valutazione restrospettiva quale parametro predittivo di risposta alla terapia con gli anticorpi monoclonali. Una forte correlazione tra risposta al trattamento ed aumento del numero di copie di EGFR è stata descritta dal gruppo di lavoro guidato da Moroni127, che prendendo in considerazione 31 pazienti con tumore del colon-retto metastatico ed EGFR positivo, ha riscontrato l’aumento di copie del gene in 8 dei 9 pazienti “responders” ed in uno solo dei 20 “non responders” (p<0,0001 al test Fisher), essendo la metodica di valutazione FISH non conclusiva in 2 pazienti. Più recentemente, il medesimo gruppo di studio ha ottenuto analoghi risultati positivi, su una coorte di pazienti più ampia ed omogenea e soprattutto utilizzando un più accurato sistema di valutazione dei risultati FISH128.
La mancanza di un sistema di scoring affidabile ed universalmente accettato rappresenta tutt’oggi una delle grosse limitazioni all’utilizzo routinario della FISH.
• EGFR intron 1 CA tandem repeats
In corrispondenza dell’introne 1 del gene EGFR è stata identificata una sequenza ripetuta dinucleotidica altamente polimorfica129. Una variazione del numero delle sequenze ripetute è stata associata in vitro a modificazioni dell’attività trascrizionale di EGFR ed in vivo con variazioni del livello di espressione dello stesso recettore. La trascrizione risulta, infatti, ridotta di circa 5 volte in presenza di 16-21 ripetizioni, mentre aumentata di altrettante volte quando le ripetizioni sono in numero inferiore a 12.
Graziano e coll. hanno studiato tale polimorfismo in 110 pazienti con diagnosi di CRC in trattamento con cetuximab ed irinotecano. Gli autori hanno definito EGFR intron 1 short (S) gli alleli con un numero di sequenze di nucleotidiche inferiori a 17 ed EGFR intron 1 long (L) quelli con un numero superiore o uguale a 17, risultando pertanto 3 possibili genotipi: S/S, S/L o L/L. I pazienti con genotipo S/S o S/L sono risultati quelli maggiormente responsivi al trattamento (RR=40% nei pazienti S/S; RR=19% nei pazienti S/L; RR=5% nei pazienti L/L; p=0.008) e anche quelli, come atteso, più suscettibili a sviluppare tossicità cutanea.
• NF-kB e risposta al trattamento con cetuximab
Il fattore nucleare kB (NF-kB) appartiene ad una famiglia di fattori di trascrizione coinvolta nella regolazione di una ampia varietà di risposte biologiche. Largamente conosciuto è il suo ruolo nel controllo della risposta immune ed infiammatoria, mentre il coinvolgimento in processi di oncogenesi risulta sempre più supportato da crescenti evidenze cliniche. NF-kB regola, infatti, l’espressione di geni coinvolti in processi alla base dello sviluppo e della progressione tumorale, come proliferazione, migrazione ed apoptosi cellulare130.
In condizioni fisiologiche i dimeri di NF-kB sono presenti prevalentemente in forma inattiva in relazione alla interazione degli stessi con i loro inibitori citoplasmatici. Attivazioni aberranti o costitutive di NF-kB sono state descritte negli ultimi anni in alcuni tumori maligni umani, tra cui il CRC. Alcune evidenze cliniche dimostrano che l’alterata espressione di NF-kB nei tumori solidi umani è associata a resistenza al trattamento antitumorale standard (chemioterapia e/o radioterapia) probabilmente in virtù dell’inibizione della risposta apoptotica che tali terapie dovrebbero indurre131,132. Pertanto l’inibizione di tale fattore di trascrizione potrebbe rappresentare un importante potenziamento terapeutico nel trattamento del cancro. Partendo dalla considerazione che NF-kB rappresenta un effettore della cascata del segnale posta a valle di EGFR e che lo stesso EGFR risulta iperespresso in molti tumori umani, Scartozzi133 e coll. hanno valutato l’espressione di NF-kB in 76 mCRC trattati con cetuximab ed irinotecano dopo fallimento del trattamento chemioterapico standard. Lo scopo dell’analisi è stato quello di verificare il ruolo di NF-kB quale fattore predittivo, in termini di tasso di risposte e di TTP. I risultati ottenuti dallo studio hanno mostrato un tasso di risposta del 10% e del 48% rispettivamente nei tumori NF-kB positivi e negativi (p=0.0007) ed un TTP di 3.0 e di 6.4 mesi rispettivamente nei tumori esprimenti e non il fattore di trascrizione (p=0.021). Tali dati suggeriscono un potenziale ruolo predittivo di resistenza a terapia con cetuximab. Ulteriori studi saranno pertanto necessari per comprendere a fondo le potenzialità di NF-kB quale parametro di aiuto nella scelta del migliore approccio terapeutico al paziente.
•
La via di trasduzione del segnale Ras/Raf/MAPK
Al fine di giustificare la mancata risposta al trattamento con farmaci inibitori di EGFR, numerosi studi clinici hanno soffermato la loro attenzione sulle vie di trasduzione del segnale a valle del recettore.
La cascata Ras/Raf/MAPK riveste un ruolo di estrema importanza nel controllo della proliferazione e sopravvivenza cellulare.
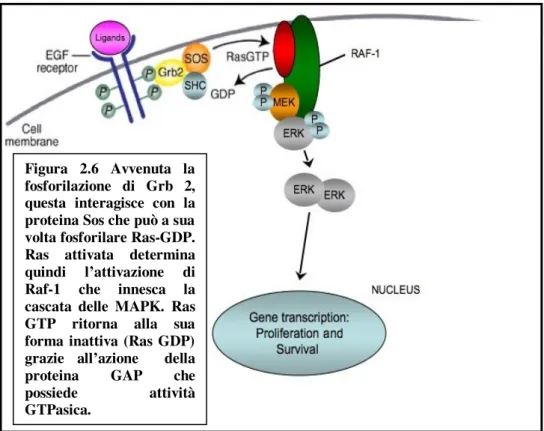
In seguito all’attivazione di EGFR, si verifica anche quella della proteina adattatrice Grb 2 e della proteina Sos. Quest’ultima ha il compito di fosforilare Ras-GDP, trasformandola nella forma attiva Ras-GTP. (FIGURA 2.6). Questo processo è reversibile in condizioni di normalità ad opera dell’attività GTPasica della proteina GAP. Le mutazioni di Ras cosiddette “attivanti” rendono la proteina costitutivamente attiva, interrompendo questo delicato meccanismo di attivazione/inattivazione. In queste condizioni si realizza una stimolazione continua delle tappe molecolari a valle di Ras, in modo particolare l’attivazione delle MAPK (Mytogen Activated Protein Kinases). In tal modo la spinta proliferativa cellulare promossa diviene indipendente dall’attivazione di EGFR, essendo la cascata del segnale ugualmente avviata dall’anomala attività di Ras. Le mutazioni di K-RAS sono state individuate in molte neoplasie solide umane, tra le quali anche il tumore del colon-retto, dove l’alterazione interessa circa il 40% dei tumori primitivi134,135.
Figura 2.6 Avvenuta la fosforilazione di Grb 2, questa interagisce con la proteina Sos che può a sua volta fosforilare Ras-GDP. Ras attivata determina quindi l’attivazione di Raf-1 che innesca la cascata delle MAPK. Ras GTP ritorna alla sua forma inattiva (Ras GDP) grazie all’azione della proteina GAP che possiede attività GTPasica.
Tra i primi, lo studio RASCAL134 ha cercato di capire il significato prognostico delle mutazioni di K-RAS, arrivando a riconoscere un aumentato rischio di recidiva (p<0.001) e di morte (p=0.004) nei CRC K-RAS mutati. Attraverso l’analisi di ogni singola mutazione lo studio è giunto alla conclusione che solo quella del codone 12, che determina la sostituzione del residuo amminoacidico glicina in uno di valina, rappresenta un fattore indipendente di aumento del rischio di recidiva (p=0.007) e di morte (p=0.004), correlandosi pertanto ad un comportamento più aggressivo di malattia. Gli stessi risultati sono stati confermati dallo studio RASCAL II, condotto su un campione di pazienti ancora più consistente (3439 vs 2721 pazienti)135.
Sono oramai numerosi gli studi che, con esito positivo, hanno valutato la correlazione tra stato mutazionale di K-RAS nel tumore primitivo e assenza di risposta al trattamento con farmaci inibitori di EGFR.
La prima evidenza del ruolo predittivo di K-RAS è emersa da uno studio francese136, che ha valutato la presenza di correlazione tra la risposta del paziente metastatico trattato con cetuximab in monoterapia e lo stato mutazionale del gene. Mutazioni di K-RAS si sono riscontrate in 13 pazienti sul totale di 30 arruolati nello studio. Le mutazioni sono risultate strettamente associate alla risposta al trattamento, infatti, nessuno dei tumori mutati ha risposto al cetuximab. Tra i responders nessuno (0/11) ha presentato mutazioni di K-RAS, mentre le stesse sono state riscontrate nel 68.4% (13/19) dei pazienti non responders (p=0.0003). La sopravvivenza complessiva dei pazienti con tumore K-RAS WT è risultata significativamente più alta se confrontata con quella di pazienti K-RAS MUT (OS mediana: 16.3 vs 6.9mesi; p=0.016).
Amado e coll. attraverso l’analisi post-hoc137 di uno studio di fase III che ha confrontato l’efficacia del panitumumab in monoterapia rispetto alla sola BSC, per il trattamento del paziente con mCRC, hanno valutato se tra i pazienti trattati con l’inibitore di EGFR vi sia una differenza in PFS, in relazione allo stato mutazionale di K-RAS. La PFS mediana è risultata di 8.0 settimane nel braccio di trattamento con cetuximab rispetto alle 7.3 settimane nel braccio con sole BSC. Il relativo vantaggio determinato dalla somministrazione del panitumumab è diventato più importante tra i pazienti K-RAS WT (HR=0.45; 95%CI: 0.34-0.59; PFS mediana: 12.3 settimane per panitumumab vs 7.3 settimane per BSC) mentre tra i pazienti K-RAS MUT il panitumumab non ha apportato alcun vantaggio (HR=0.99; 95%CI: 0.73-1.36; PFS mediana: 7.4 settimane per panitumumab vs 7.3 settimane per BSC). Gli autori hanno pertanto concluso il loro studio sostenendo che l’efficacia del panitumumab nel trattamento del paziente metastatico sia ristretta ai soli pazienti K-RAS WT.
Anche Karapetis e coll.138 hanno valutato se le mutazioni di K-RAS, specificamente quelle dell’esone 2 del gene, possano predire la risposta al trattamento con cetuximab, mediante l’analisi post-hoc di uno studio che ha randomizzato 572 pazienti con mCRC progredito a precedenti linee di chemioterapia, in due bracci di trattamento: cetuximab in monoterapia vs BSC. Tra i pazienti con tumore K-RAS WT, il trattamento con cetuximab, confrontato con quello con sola BSC, ha determinato un incremento significativo dell’OS (OS mediana: 9.5 vs 4.8 mesi; HR=0.55; 95%CI: 0.41-0.74; p<0.001) e della PFS (PFS mediana: 3.7 vs 1.9 mesi; HR=0.40; 95%CI: 0.30-0.54; p<0.001) mentre tra i pazienti K-RAS MUT le differenze non sono risultate significative sia in PFS che in OS (p=0.96 e p=0.89, rispettivamente).
Stabilito che le mutazioni somatiche di K-RAS costituiscono un meccanismo di resistenza ai farmaci anti EGFR, un’ampia metanalisi di studi condotti su pazienti con tumore del polmone non a piccole cellule in stadio avanzato e con mCRC, ha cercato di stabilire se le stesse mutazioni rappresentino un effettivo marcatore predittivo di resistenza al trattamento. Specificità e sensibilità hanno costituito gli obiettivi primari dell’analisi. Mutazioni di K-RAS si sono riscontrate in 306 di 817 pazienti con mCRC. La presenza di mutazioni si è associata strettamente all’assenza di risposta al trattamento con moAb nei pazienti con mCRC (sensibilità: 0.47; 95%CI: 0.43-0.52, specificità: 0.93; 95%CI: 0.83-0.97). L’analisi pertanto ha evidenziato come le mutazioni di K-RAS costituiscano un marcatore negativo altamente specifico di risposta al trattamento, ma, in ragione della bassa sensibilità riscontrata, ha anche sottolineato come altri fattori possano essere coinvolti nel meccanismo di resistenza ai farmaci anti-EGFR139.
Tutti questi studi hanno valutato il ruolo predittivo di K-RAS nel paziente già sottoposto a più linee di chemioterapia convenzionale, ma la predittività della mutazione genica rimane anche per il paziente trattato in prima linea con cetuximab da solo o in associazione a regimi standard a base di irinotecano od oxaliplatino. I dati forniti all’ASCO 2008 e provenienti dagli studi CRYSTAL e OPUS evidenziano infatti, che l’aggiunta del cetuximab al regime chemioterapico convenzionale non apporta alcun beneficio nei pazieni K-RAS MUT, potendo talora avere un effetto peggiorativo.
In ragione dell’emergente ruolo predittivo di K-RAS, i risultati preliminari dello studio CRYSTAL, che ha valutato l’efficacia della combinazione cetuximab + FOLFIRI vs solo FOLFIRI nel trattamento di prima linea del paziente con mCRC,
sono stati rivalutati, e presentati all’ASCO 2008140. L’analisi dello stato mutazionale di RAS è risultata eseguibile in 540 tumori su un totale di 1198. Mutazioni di K-RAS sono state riscontrate nel 35.6% dei casi (192/540). In termini di PFS (obiettivo primario dello studio), una differenza statisticamente significativa in favore del cetuximab è stata evidenziata solo tra i pazienti K-RAS WT (PFS mediana: 9.9 mesi (cetuximab + FOLFIRI) vs 8.7 mesi (solo FOLFIRI); HR=0.68; 95%CI: 0.051-0.934 p=0.0167;). Anche in termini di RR (obiettivo secondario) la differenza è risultata statisticamente significativa solo tra i pazienti non mutati (RR: 59.3% (cetuximab + FOLFIRI) vs 43.2%(FOLFIRI); p=0.0025).
Il trial OPUS141 ha presentato risultati del tutto analoghi. Dei pazienti con tumore metastatico randomizzati a ricevere in prima linea FOLFOX o FOLFOX più cetuximab, solo quelli K-RAS WT hanno ottenuto un beneficio dall’associazione del biologico alla terapia convenzionale (PFS mediana: 7.7 mesi nei pazienti K-RAS WT vs 5.5 mesi nei pazienti K-RAS MUT; p=0.0009). Inoltre il trattamento con cetuximab ha determinato un netto peggioramento della PFS nei pazienti K-RAS MUT (PFS mediana: 5.5 mesi (FOLFOX + cetuximab) vs 8.6 mesi (solo FOLFOX); HR=1.83; p=0.02).
Mutazioni di B-RAF, chinasi posta a valle di K-RAS, nella via di trasduzione del segnale di EGFR, vengono riscontrate nei tumori del colon retto con una frequenza relativamente bassa (circa 10%). Anche tali alterazioni sono state studiate negli ultimi tempi per comprenderne l’eventuale ruolo predittivo di risposta ai farmaci anti-EGFR.
Le mutazioni di B-RAF e quelle di K-RAS sono tra loro mutualmente esclusive. Di Nicolantonio e coll.142, ipotizzando che le mutazioni di B-RAF possano avere, in tumori K-RAS WT, un ruolo predittivo/prognostico, hanno retrospettivamente analizzato RR, TTP, OS e stato mutazionale di K-RAS e B-RAF in 113 pazienti con mCRC trattati con cetuximab o panitumumab. Per le mutazioni di K-RAS si è confermato il ruolo predittivo di scarsa risposta al trattamento con MoAb, essendo le stesse presenti in 2 (8%) dei 24 pazienti responders ed in 32 (35%) degli 89 non-responders (p=0.011). La mutazione V600E di B-RAF è risultata l’unica presente nella coorte di pazienti analizzata. La sua presenza è apparsa inversamente correlata all’attività del trattamento, in modo particolare nessuno dei pazienti mutati (11 su 79 K-RAS WT) ha risposto alla somministrazione del biologico e viceversa nessuno dei responders ha presentato la mutazione in esame (p=0.029). Inoltre i pazienti B-RAF MUT, rispetto ai WT hanno ottenuto una PFS (p=0.011) ed un OS (p<0.0001)
significativamente più brevi. Gli autori hanno concluso sostenendo la necessità di B-RAF WT per ottenere risposta dalla terapia con inibitori di EGFR.
Appurato che le mutazioni di K-RAS nei codoni 12 e 13 rappresentano un fattore predittivo di resistenza al trattamento con cetuximab e che le stesse sono mutualmente esclusive con quelle di B-RAF, al fine di ottimizzare la selezione dei pazienti candidati a ricevere un trattamento con farmaci inibitori di EGFR, uno studio del nostro gruppo ha retrospettivamente valutato se la presenza di mutazioni rare di K-RAS e di B-RAF possa influenzare la risposta al trattamento143. Lo studio è stato condotto su una coorte di 87 pazienti con mCRC, irinotecano refrattario, K-RAS WT (nei codoni 12 e 13), trattati con cetuximab ed irinotecano. In tali pazienti è stata ricercata la presenza di rare mutazioni attivanti di K-RAS, coinvolgenti i codoni 61 o 146 del gene o l’esistenza della mutazione V600E di B-RAF. Le mutazioni di K-RAS nei codoni 61 o 146 si sono riscontrate, complessivamente in 8 pazienti. Tra i mutati nessuno ha risposto al trattamento, mentre 22 risposte si sono registrate tra i 68 pazienti K-RAS WT (p=0.096). Nel sottogruppo di pazienti B-RAF WT, i soggetti che hanno presentato mutazioni di K-RAS nei codoni 61 o 146 hanno manifestato un peggior outcome rispetto ai pazienti K-RAS WT, sia in termini di RR che di PFS ed OS (RR: 0% vs 37%; p=0.0005; PFS mediana: 3.8 vs 5.3 mesi; HR=0.45; p=0.023; OS mediana: 9.7 vs 14.8; HR=0.32; p=0.320). Pertanto al pari delle mutazioni di K-RAS nei codoni 12 e 13, le mutazioni rare possono essere considerate predittive di assente risposta al trattamento.
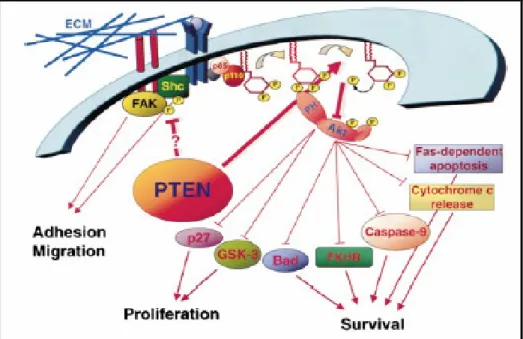
• La via PTEN/PI3K/pAkt
Un’altra importante via di trasduzione del segnale di EGFR è PTEN/PI3K/pAkt. Tale via è coinvolta in meccanismi che presiedono alla crescita, invasione e migrazione cellulare e che conferiscono resistenza ai processi di apoptosi. PI3K è un enzima composto da due subunità, di cui una con funzione regolatoria, capace di legare EGFR in particolari siti di ancoraggio, ed una con funzione catalitica, responsabile della fosforilazione del PIP2 a PIP3. Il secondo messaggero PIP3 avvia
una cascata di reazioni biochimiche intracellulari, tra cui la fosforilazione attivante di Akt. L’attivazione di PI3K viene in condizioni normali regolata da PTEN, la cui attività enzimatica comporta la defosforilazione di PIP3 a PIP2, l’arresto della spinta