Cap. 2
I parassiti della lepre
2.1 I protozoi
Fra le malattie della lepre sostenute da protozoi le più frequenti e studiate sono la coccidiosi, quasi costantemente presente nelle lepri allo stato libero. Altre malattie protozoarie riportate nella lepre sporadicamente o eccezionalmente sono la
toxoplasmosi (Olliaro et al. 1990; Gustafsson e Uggla, 1993;Haerer et al.1997;
Sedlak et al. 1997), la neosporosi (Ferroglio et al., 2000), la sarcosporidiosi (Odening et al.,1996) e la theileriosi (Vaccari et al., 1958).
I protozoi sono organismi microscopici e formati da una sola cellula, differenziata da una serie di cosiddetti organelli od organoidi; essi contengono uno o più nuclei e sono avvolti da una netta membrana cellulare (Casarosa , 1985). Soltanto una parte delle circa 20.000 specie descritte conduce vita parassitaria (Boch e Supperer, 1980). In molte specie la riproduzione avviene soltanto per via asessuata, mediante semplice divisione cellulare. La suddivisione multipla asessuata è chiamata schizogonia
(Urquhart et al ., 1998). Nei ciliati e negli apicomplexa si aggiunge inoltre una generazione sessuata (Urquhart et al ., 1998).
Negli apicomplexa si ha la produzione di forme particolari, sessualmente
differenziate: sono in un primo tempo i gamonti che poi si trasformano in gameti femminili (macrogameti) e maschili (microgameti). Dalla fecondazione dei macrogameti ad opera dei microgameti origina lo zigote, mobile in alcune specie (oocinete) (Casarosa , 1985). Se lo zigote è circondato da una membrana fissa e duratura si parla di oocisti (Casarosa , 1985). Il processo di suddivisione all'interno dell'oociste è denominato sporogonia. Si formano delle sporocisti contenenti ciascuna alcuni sporozoiti (Urquhart et al ., 1998).
Molti protozoi parassiti presentano un ciclo diretto (ad un solo ospite), ma altri hanno bisogno di più di un ospite per il loro sviluppo (oltre il vertebrato può servire un
artropode vettore) (Boch e Supperer, 1980).
Toxoplasma, Neospora e Sarcocystis sono tre generi di Protozoi inseriti nel Phylum
Apicomplexa (con complesso apicale consistente in anello polare, conoide,
micronemi, ed altre formazioni; tubuli sottocutanei con micropori) e nella Famiglia
Sarcocystidae (Boch e Supperer, 1980).
Non si conoscono nelle lepri casi di infezioni da Giardia e Cryptosporidium.
La toxoplasmosi
La toxoplasmosi della lepre è stata riscontrata in diverse Nazioni europee, Haerer e collaboratori l’hanno diagnosticata in alcune lepri svizzere nel 1997, Frolich e
collaboratori hanno diagnosticato la presenza di anticorpi anti Toxoplasma gondii in diverse lepri in Germania nel 2003, Christiansen e Siim l’hanno riscontrata in
Danimarca nell’Agosto 2006. In Italia Olliaro e collaboratori hanno registrato un caso di toxoplasmosi letale in una lepre nel 1990. Gustaffson e Uggla (1993) riferiscono un’alta incidenza di toxoplasmosi acuta fatale nelle lepri in Scandinavia, ma non hanno riscontrato nei loro studi anticorpi anti- toxoplasma nel siero di lepri uccise in Svezia.
Englert (1956) riferisce di una infezione endemica di toxoplasmosi verificatasi nelle lepri europee della Foresta Nera. Lo stesso Englert (1956) aveva isolato in Germania per la prima volta questo agente patogeno dalla lepre. La toxoplasmosi causa un ingrossamento della milza e dei linfonodi meseraici con focolai di necrosi biancastri e talvolta un’infiammazione della mucosa nasale e polmoniti essudativo necrotizzanti (Marcato e Rosmini, 1986).
In Italia, la toxoplasmosi della lepre è riportata nelle lepri dell’Italia settentrionale da Vaccari e collaboratori (1960) e da Gallazzi e collaboratori (1990) con rari casi riscontrati presso gli Istituti Zooprofilattici Sperimentali (IZS) delle Venezie e della Lombardia ed Emilia. I dati anamnestici comuni erano rappresentati da mortalità elevata in gruppi liberati da due o tre anni in aree recintate in prossimità di centri abitati (presenza di gatti randagi) e con densità superiore alle tre – quattro lepri per
ettaro. Attualmente, però, questa grave zoonosi va perdendo importanza nelle lepri nelle regioni dell’Italia settentrionale, dove sono in forte aumento le lepri allevate e sottoposte a controlli sanitari più accurati.
La neosporosi
Ferroglio nel 2000 riscontra mediante test di agglutinazione diretta anticorpi contro
Neospora caninum nel siero di una lepre europea importata in Italia dall’Ungheria.
La sarcosporidiosi
Odening e collaboratori (1996) affermano che nella Lepus europaeus una specie di
Sarcocystis è stata trovata in Germania da Witzmann, ed altre cinque specie in
Polonia. Una tra queste specie risulta essere specie-specifica per questo ospite intermedio ed è stata rinominata Sarcocystis cuniculorum nom. Nov. Per differenziarla da S. cuniculi Brumpt, 1913nom. nud.
La theileriosi
Il genere Theileria comprende Protozoi inseriti nel phylum Apicomplexa, e nella Famiglia Theileriidae. Nei vertebrati essi si riproducono nei linfociti, quindi si localizzano negli eritrociti; il loro ciclo prevede la presenza di artropodi vettori (zecche) in cui avviene la gametogonia e la sporogonia (Boch e Supperer, 1980). In Italia la theileriosi della lepre è stata riscontrata da Vaccari e collaboratori (1958) identificato con Theileria leporis la specie in causa.
La coccidiosi
I ) Il genere Eimeria
I coccidi sono dei Protozoi inseriti nel phylum Apicomplexa (con complesso apicale consistente in anello polare, conoide, micronemi, ed altre formazioni; tubuli
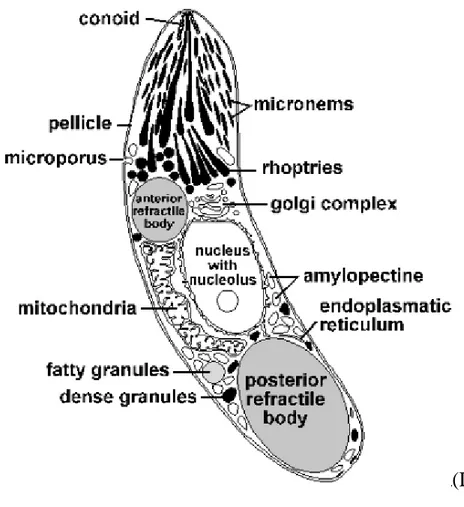
La caratteristica degli organismi appartenenti al Phylum Apicomplexa è quella di possedere un "complesso apicale" che ha la funzione di favorire la penetrazione del protozoo all'interno della cellula dell’ospite (Casarosa, 1985).
Il complesso apicale è composto da:
- un "conoide" : struttura a tronco di cono formata da filamenti avvolti a spirale - delle rhoptrie: organuli osmiofili a forma di clava che hanno una funzione di
raccolta degli enzimi litici mentre non è chiaro se siano esse stesse capaci di produrre sostanze litiche,
- dei "micronemi": strutture ghiandolari che secernono enzimi litici - dei microtubuli o fibrille sottopellicolari
- un anello polare.
I coccidi sono parassiti endocellulari ma non obbligati continui, svolgendo alcune fasi del loro ciclo all'interno delle cellule dell'ospite e altre nell’ambiente esterno, senza intermediazioni biologiche (ciclo diretto), con le forme di resistenza (oocisti)
(Urquhart et al.,1998). I coccidi dei mammiferi sono generalmente monoxeni,
parassitando nel loro ciclo biologico una singola specie animale. La schizogonia e la gametogonia avvengono all’interno dell’ospite, mentre la sporulazione (maturazione dello zigote fertile) avviene nell’ambiente esterno. La fase del ciclo vitale dei coccidi nell'ambiente esterno si svolge sotto forma di oocisti le quali non hanno solo funzione di resistenza, ma subiscono una maturazione moltiplicativa (sporulazione) che porta alla formazione delle fasi infettanti, gli sporozoiti (Casarosa, 1985). I coccidi della famiglia Eimeriidae colonizzano prevalentemente le cellule epiteliali della mucosa dell'apparato digerente, ma nel coniglio e nella lepre anche le cellule epatiche e dei dotti biliari. Infatti nei Lagomorfi si possono distinguere due forme di coccidiosi, una epatica e l’altra intestinale, e non sono rare forme miste di eimeriosi (Levine
e Ivens, 1972).
La coccidiosi è una malattia protozoaria che interessa qualsiasi specie animale selvatica o allevata e ogni specie animale può essere colonizzata da più specie di coccidi.
I coccidi della lepre appartengono al genere Eimeria che ha la caratteristica di avere oocisti mature con quattro sporocisti, ognuna contenente 2 sporozoiti (Casarosa, 1985).
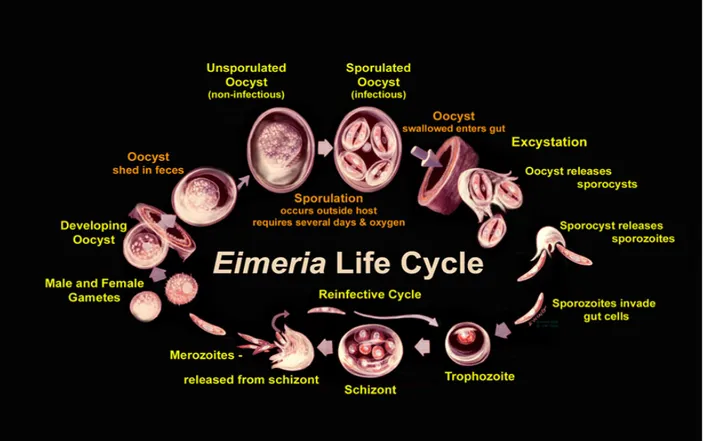
II) Il ciclo biologico di Eimeria
Nel ciclo evolutivo dei coccidi del genere Eimeria (Urquhart et al.,1998) si possono riconoscere 3 fasi: schizogonia, gametogonia e sporogonia (Fig. 8). Quando le oocisti vengono ingerite dalla lepre, attraverso il cibo contaminato da materiale fecale,
raggiungono il tubo digerente e qui avviene la disgregazione della parete delle oocisti in seguito all'azione dei succhi gastrici. La rottura della parete oocistica provoca la liberazione delle sporocisti da cui, dopo la rottura della parete sporocistica,
fuoriescono gli sporozoiti che penetrano nelle cellule epiteliali della parete intestinale (Ambrosi, 1995).
(http://www.anri.barc.usda.gov/pbel/images/eimeria%20life%20cycle%20med.jpg)
Il riconoscimento del target e la conseguente localizzazione avviene grazie a fattori biochimici. All’interno del citoplasma delle cellule ospiti gli sporozoiti sono racchiusi in un vacuolo chiamato "vacuolo parassitoforo". Nelle cellule gli sporozoiti si
trasformano in trofozoiti perdendo il citoscheletro e arrotondandosi; in questa fase vengono inglobate le sostanze nutritive necessarie alla loro successiva replicazione. Infatti, i trofozoiti vanno rapidamente incontro a ad una prima riproduzione asessuata per schizogonia. Quando il trofozoita comincia a replicarsi viene chiamato
"schizonte" di prima generazione. La moltiplicazione degli schizonti provoca la rottura della membrana della cellula colonizzata e della parete degli schizonti con liberazione di numerosissimi merozoiti di prima generazione. I merozoiti a loro volta infettano nuove cellule epiteliali e seguono lo stesso ciclo (ovvero si trasformano in trofozoiti che danno origine a nuovi merozoiti (Casarosa, 1985). Dopo un numero di divisioni schizogoniche proprio di ciascuna specie, al termine del ciclo evolvono in microgameti mobili biflagellati (cellule maschili) e macrogameti (cellule femminili), ed avviene la gametogonia. La fase gametogonica, una delle più patogene del ciclo dei coccidi, comprende la riproduzione sessuata (il macrogamete viene fecondato dal microgamete) con formazione dello zigote; gli zigoti si rivestono della parete
trasformandosi in oocisti, fuoriescono nel lume intestinale e sono eliminate
nell'ambiente esterno tramite le feci dell'animale infettato. Nell'ambiente esterno, se presenti le giuste condizioni di temperatura (20-30° C) ed umidità (ambiente molto umido) e se al riparo dalla luce, si compie la fase sporogonica del ciclo vitale ed in ciascuna oocisti si assiste alla formazione di quattro sporocisti ciascuna contenente 2 sporozoiti. Le oocisti sporulate, ovvero mature, sono infettanti, possono sopravvivere per mesi e costituire una nuova fonte di contagio. La schizogonia porta ad
un'altissima invasione dei tessuti target anche se i coccidi non si riproducono
indefinitamente nell' ospite ma presentano un "ciclo a termine”finalizzato al ritorno nell’ambiente. Le oocisti anche dopo la sporulazione hanno una notevole longevità e
possono sopravvivere per diversi anni (Urquhart, 1998).
La grande resistenza delle oocisti, l'infezione che avviene per via orale e
l'eliminazione di nuove oocisti con le feci fanno sì che la coccidiosi sia molto diffusa e che la si trovi soprattutto negli ambienti caratterizzati da un elevato il carico medio di animali per unità di superficie. Infatti tanto più è elevata la densità di animali per unità di superficie tanto più alto è il rischio di contaminazione (Ambrosi, 1995).
III) La patogenicità di Eimeria
La patogenicità di Eimeria spp.è condizionata da cinque fattori (Marcato e Rosmini, 1986):
1) specie dei parassiti (infatti, a seconda della specie a cui appartengono, i coccidi possono localizzarsi in profondità, ed in questo caso sarà maggiore il danno da loro causato, o più in superficie, ed in questo caso il danno sarà minore; inoltre la
patogenicità dei parassiti varia in funzione della frequenza di duplicazione, ed anche tale parametro cambia a seconda della specie del parassita);
2) carica infettante nell'intestino; 3) resistenza dell' ospite;
4) habitat dell’animale o tipo di allevamento; 5) eventuale presenza di agenti microbici.
Nell'animale colpito da eimeriosi (Marcato e Rosmini, 1986) si può osservare diarrea con escrementi siero-mucosi, a volte alternata a stipsi, gonfiore del ventre
(timpanismo) e dimagrimento. Nella forma intestinale, inoltre, le feci appaiono acquose con presenza di muco e sangue. Si possono inoltre osservare inappetenza, sete intensa e disidratazione. Quest'ultima può portare alla morte dell'animale se sono presenti anche infezioni batteriche secondarie.
Esaminando i soggetti malati o morti si possono trovare nell' intestino tipiche
macchie bianche, grandi come lenticchie, dovute alle lesioni prodotte dagli ammassi di parassiti nell'epitelio intestinale. Il contenuto dell’intestino è in parte caseoso ed in parte fluido, i linfonodi meseraici appaiono aumentati di volume e la mucosa risulta
ispessita. Si possono osservare sia lesioni produttive che derivano dalla esuberante proliferazione dell'epitelio parassitato, sia lesioni acute emorragiche. Le lesioni
produttive sono causate prevalentemente dalla fase gametogonica del ciclo, mentre le emorragie sono causate dai coccidi nei vari stadi di schizogonia.
Nelle forme acute la coccidiosi intestinale esordisce con un'infiammazione catarrale del tenue la cui mucosa appare edematosa, diffusamente arrossata o con
punteggiature emorragiche. A ciò si associa un timpanismo del grosso intestino, la morte avviene dopo qualche giorno. Nella forma intestinale cronica invece si osserva solo un lento e progressivo dimagrimento.
IV) La diagnosi di eimeriosi
La diagnosi (Marcato e Rosmini, 1986) di questa malattia si basa, negli animali vivi, sull'esame coprologico ovvero sulla dimostrazione delle tipiche oocisti nelle feci; questa dimostrazione può però mancare nelle forme iperacute ed acute perché l'emissione delle oocisti avviene solo dopo un determinato periodo dall'inizio
dell'infezione, cioè dopo il periodo prepatente. Il periodo di prepatenza è il periodo che passa dal momento in cui l'animale ingerisce le oocisti mature ed il momento in cui comincia ad espellere oocisti con le feci. Nella fase prepatente si ha necrosi
cellulare, infatti le cellule parassitate muoiono e ciò nelle forme acute e iperacute può provocare la morte dell’animale per shock. Nell'animale morto la diagnosi si basa su un attento esame dell'intestino per riscontrare le tipiche lesioni e sulla dimostrazione dei parassiti nelle sedi elettive. Il riconoscimento dei coccidi (Levine e Ivens, 1972) viene fatto in base alla loro forma, grandezza, colore, parete cistica, presenza od assenza della capsula polare e del micropilo (la capsula polare è una zona di minor resistenza sulla parete dell'oocisti, il micropilo è una parte di questa zona in cui la parete si assottiglia). Per effettuare un' ulteriore differenziazione delle oocisti dopo sporulazione, una parte di feci contenenti i coccidi, viene messa in coltura con
soluzione di bicromato di potassio al 2,5% per determinare il tempo di sporulazione a 15°,25° e 32° C, la forma e la grandezza delle sporocisti e degli sporozoiti e la
comparsa dei residui oocistico e sporocistico. Nella diagnosi della coccidiosi (bibliografia)è molto importante il conteggio delle oocisti per grammo di feci. In seguito alla diversa patogenicità delle diverse specie, si possono verificare le seguenti situazioni:
1) molti coccidi ma assenza di malattia; 2) pochi coccidi e presenza di malattia;
3) assenza di coccidi e presenza di malattia (questo caso è conseguenza di lesioni a seguito di numerose schizogonie, mentre la gametogonia non è ancora completata). La creazione di uno stato immunitario (bibliografia) dipende dal numero, dall' intensità e dalla successione temporale delle infezioni precedenti; la vecchia ipotesi secondo la quale gli animali acquisirebbero una certa resistenza con l' avanzare dell' età è ormai considerata errata, infatti anche gli animali più vecchi si possono
ammalare in seguito ad un primo e massiccio contagio.
Nella lepre (Marcato e Rosmini, 1986), la coccidiosi colpisce soprattutto animali giovani. Si manifesta soprattutto nei soggetti tra il primo e il quarto mese di età. Essa può presentarsi in forma subclinica con crescita ritardata, e peggioramento degli indici di conversione dell' alimento, o in forme clinicamente manifeste che possono essere acute (più frequenti), subacute e croniche (Marcato e Rosmini, 1986).
V) Il controllo della eimeriosi
Il controllo si basa sull’igiene dell’alimento, delle conigliere con l’uso di gabbie con grigliato o rete che consentano la caduta delle feci , sulla netta separazione tra giovani e adulti , sulla severa attenzione ai capi da riproduzione di nuova introduzione e
sull’utilizzo di coccidiostatici come amprolium e robenidina (Casarosa, 1985).
I sulfamidici, come la sulfochinossalina e la sulfadimetossina, sono somministrati con l’acqua d’abbeverata e sono utilizzate per la terapia (Ambrosi, 1995).
In lepri allevate e alimentate con mangimi contenenti anticoccidici persiste la
presenza delle coccidiosi subcliniche, questo perché è difficile ottenere una completa disinfezione anticoccidica anche in ambienti vuoti ed è ancora più difficile ottenere
tale disinfezione nell'allevamento della lepre, che è un allevamento a ciclo chiuso dove gli animali di varie età vengono tenuti negli stessi ambienti o recinti esterni (Spagnesi e Trocchi, 1992 ). Infatti quando i cicli d'allevamento sono brevi e continui (come nell'allevamento della lepre) l'accumulo nell'ambiente di agenti patogeni di vario tipo, coccidi compresi, è maggiore (Spagnesi e Trocchi, 1992).
VI) L’ identificazione delle specie del genere Eimeria
L’ identificazione delle specie del genere Eimeria si basa forma, grandezza, colore, parete cistica, presenza od assenza della capsula polare e del micropilo, forma e grandezza delle sporocisti e degli sporozoiti e comparsa dei residui oocistico e sporocistico , per cui per effettuarla si ricorre alla misurazione dei vari elementi con l’uso dell’obiettivo micrometrico.
Il tempo di sporulazione può aiutare l'identificazione.
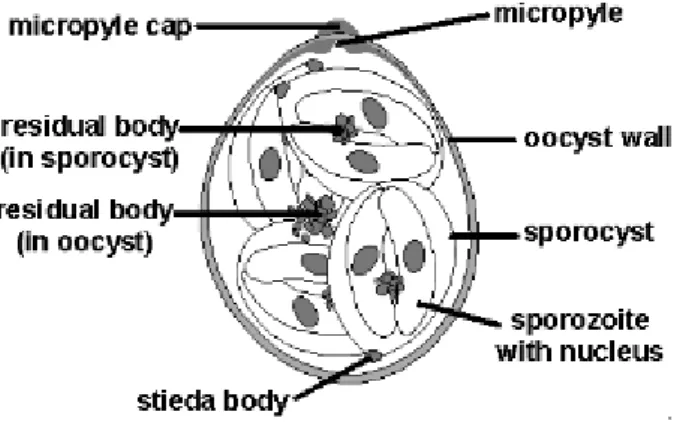
Figura 9. Morfologia di una tipica oocisti (Eimeria spp.).
Figura 10. Sporozoite di Eimeria spp.
(Dr. Gisela Greif, 1993) (www.saxonet.de/coccidia/eim-oocy.gif)
VII) I coccidi dei leporidi
Nel 1972 Levine pubblica un articolo dal titolo “I coccidi dei leporidi” in cui descrive 36 specie di coccidi, tutti appartenenti al genere Eimeria che sono stati descritti in 3 dei 9 generi ed in 11 delle oltre 48 specie di lagomorfi della famiglia
Leporidae. I coccidi riportati da Levine sono stati descritti nella singola specie del
genere Oryctolagus, in 4 delle 13 specie di Sylvilagus ed in 6 delle 26 specie di
Lepus. Questi generi presentano rispettivamente 12,12 e 14 specie di Eimeria di cui
solo due sono comuni ai generi Oryctolagus e Sylvilagus. Il genere Lepus, invece, non presenta alcuna specie coccidica in comune con gli altri due generi. Una specie è riconosciuta come presente nei dotti biliari del fegato, tredici nell’intestino e la
lepre non è conosciuto.
I coccidi sono stati riportati in 3 generi della famiglia Leporidae ed in undici specie (ovvero nel 33% dei generi e nel 20% delle specie ). Sicuramente questa statistica dovrebbe essere soggetta attualmente ad una revisione. Ancora oggi, infatti, la tassonomia della lepre e dei coccidi specifici del genere Lepus rimane confusa ed in continua evoluzione. E’ del 1999 l’elezione a rango di specie di Lepus corsicanus (Pierpaoli et al., 1999) e nel 2005 Aoutil e collaboratori riportano 13 specie e due sottospecie di Eimeria mai precedentemente descritte nel genere Lepus.
VIII) La specie-specificità di Eimeria del genere Lepus
Nel corso dei primi studi era stato ipotizzato che tutti i leporidi fossero parassitari da una singola specie di coccidio, E. stiedai a localizzazione epatica. Successivamente si è giunti alla conclusione che alcuni coccidi si riscontravano nel fegato e altri
nell’intestino. Leuckart (1929) denominò la specie intestinale Eimeria perforans. Pellerdy (1956) afferma che dagli anni 30 del 1900 era opinione comune che i coccidi del coniglio domestico (Oryctolagus cuniculus) e delle lepri selvatiche (Lepus)
appartenessero alle stesse specie. Il motivo di questa convinzione era la stretta somiglianza delle caratteristiche morfologiche delle oocisti dei coccidi dei generi
Oryctolagus e Lepus. Quindi, per molto tempo la confusione riguardo alla
nomenclatura era causata dalla convinzione che tutti i conigli e le lepri fossero equiparabili e che una specie parassita riscontrata nell’uno potesse esser presente anche nell’altra. Abbastanza stranamente, prove per ottenere una evidenza
sperimentale riguardo l’identità dei coccidi presenti nelle lepri e nei conigli sono stati condotti solo molti anni dopo. Madsen, nel 1938, affermava che in genere i coccidi sono strettamente associati ad alcune specie, e che solo se gli ospiti sono molto strettamente correlati una cross infezione va a termine. In seguito sono stati effettuati numerosi tentativi di cross infezione quasi tutti falliti (Becker 1933) eccetto un caso in cui Becker (1933) ha infettato Sylvilagus con Eimeria magna di Oryctolagus. Carvalho (1943) fu il primo a dimostrare, con infezioni sperimentali e sulla base delle
caratteristiche morfologiche e biometriche delle oocisti dei coccidi parassiti dei generi Sylvilagus, Oryctolagus e Lepus, che le specie del genere Eimeria che
parassitano questi ospiti sono strettamente specie specifiche. Più recenti studi, basati su infezioni crociate, hanno verificato che ogni genere di lagomorfo possiede i propri coccidi anche se alcuni di essi possono trasmettersi da un genere all’altro (Pèllerdy 1965). I coccidi intestinali del coniglio domestico non sono trasferibili alla lepre e viceversa (Pèllerdy 1965; Ballarini, 1966; Francalanci e Manfredini, 1970;
Pastuszco, 1995). Dai dati della letteratura relativi ai coccidi delle lepri, la prima specie riconosciuta come propria della lepre è stata descritta da Nieschulz (1923) e denominata Eimeria leporis. L’ospite-specificità dei coccidi di Lepus europaeus è stata dimostrata da Pellèrdy nel 1956 mediante esperimenti di infezione crociata. Sulla base degli esperimenti suddetti Pellèrdy (1965) ha rivalutato le descrizioni dei coccidi della lepre europea ed ha in parte modificato la classificazione di questi parassiti. Studi effettuati anche in Italia da Ballarini (1966) e Francalanci e
Manfredini (1970) hanno dimostrato che la maggior parte delle specie coccidiche sono strettamente legate al proprio ospite. Ballarini (1966) ha infatti eseguito uno studio in cui ha mantenuto la lepre comune (Lepus europaeus) in unità collettive con
Oryctolagus cuniculus in permanenza per valutare la trasmissione tra un ospite e
l’altro di Eimeria. Dallo studio è emerso che la trasmissione crociata non avviene. Francalanci e Manfredini (1970) sono giunti alla stessa conclusione effettuando una indagine sulle Eimeriosi delle lepri e dei conigli selvatici della provincia di Venezia, hanno dimostrato che le specie di Eimeria della lepre che si riscontravano nella zona erano nettamente distinte da quelle del coniglio.
Secondo Pellerdy (1956), però, le specie di Eimeria che si trovano nel fegato di
Lepus europaeus hanno una somiglianza morfologica con Eimeria stiedai, ma la loro
identificazione in quel momento era sempre incerta in assenza di una prova convincente.
Levine, nel 1972, afferma che non ci sono valide segnalazioni sulla presenza di
“Sull’esistenza di una coccidiosi del fegato (Eimeria stiedai) nella lepre” affermano Spagnesi e collaboratori (1992) “ha regnato incertezza per lungo tempo, nonostante alcune segnalazioni in questo senso (Braunschweig , 1965). Con l’aiuto del
microscopio ottico ed elettronico, Scholtiseck ed i suoi collaboratori (1979) hanno potuto dimostrare gli stadi di sviluppo di questa specie di Eimeria nelle vie epato-biliari di lepri sperimentalmente infettate; tali prove sembrano dimostrare che
Eimeria stiedai è presente nei conigli e nelle lepri e forse è possibile la trasmissione
reciproca anche in natura. Aoutil e collaboratori (2005) riferiscono che la specie
Eimeria stiedai che descrivono nella lepre è quasi identica a quella che loro stessi
hanno osservato in Francia in Oryctolagus cuniculus (Grès et al, 2003). Comunque, una lieve differenza si può osservare tra i parassiti della lepre e quelli del coniglio. Sia per Aoutil e collaboratori (2005) in Francia, che per Bouvier, in Svizzera, (1967) il micropilo di Eimeria stiedai della lepre è abbastanza distinto, mentre è appena visibile nel parassita del coniglio.
Eimeria stiedai è stata anche segnalata in infezioni spontanee di alcuni Sylvilagus
(Levine e Ivens, 1972) ma l’uguaglianza tra Eimeria stiedai di Oryctolagus
cuniculus, di Sylvilagus e della lepre non è ancora stata stabilita con certezza (Aoutil
et al., 2005).
I coccidi intestinali della lepre si sono invece dimostrati strettamente specifici per cui non è possibile la trasmissione reciproca tra lepre e coniglio; dal punto di vista
morfologico le differenze esistenti tra i coccidi della lepre e del coniglio sono così evidenti da rendere relativamente facile il reciproco riconoscimento (Francalanci e Manfredini, 1970).
IX) Le specie di Eimeria di Lepus europaeus
Delle 13 specie di Eimeria riscontrabili nel genere Lepus (Eimeria stiedai esclusa) soltanto sette (Eimeria leporis, Eimeria towsendi, Eimeria semisculpta, Eimeria
robertsoni, Eimeria stefanskii, Eimeria europea, Eimeria hungarica) sono specifiche
(1970) mentre secondo Terracciano (1986) e Spagnesi (1992) le specie riscontrabili in Lepus europaeus sono otto, Eimeria septentrionalis (Yakimoff, Matschoulsky e Spartansky, 1936) compresa.
I coccidi sono molto diffusi nella lepre comune, dove la percentuale di infezione va dal 62 al 99% (Spagnesi e Trocchi, 1992). Attraverso indagini sistematiche su animali abbattuti o morti spontaneamente e seguendo la classificazione riportata da Pellerdy (1965) sono state riscontrate in Italia (Francalanci e Manfredini, 1970; Poli et al. , 1988; Gallazzi et al.,1990; Guberti et al. 2001) sette specie di Eimeria a localizzazione intestinale (Eimeria leporis, E.hungarica, E.townsendi, E.robertsoni,
E.semisculpta, E.septentrionalis, E.europaea) ed una a localizzazione epatica
(E.stiedae/stiedai).
X) Eimeriosi intestinale di Lepus europaeus
La localizzazione di Eimeria spp. va dall'intestino tenue al cieco, con decorso diverso a seconda della gravità.
Si può osservare diarrea con escrementi siero-mucosi, a volte alternata a stipsi,
gonfiori del ventre (timpanismo) e dimagramento. La mortalità spesso è elevata entro non molti giorni: dato che il periodo sintomatico va dai quattro agli otto giorni per le specie più patogene e arriva a 10 giorni per le meno patogene, la comparsa delle oocisti è costante (Marcato e Rosmini, 1986).
XI) Eimeriosi epatica di Lepus europaeus
Anche se la coccidiosi intestinale è la più frequente, esiste anche quella epatica, dovuta ad Emeria stiedai.
Questa infezione colpisce soprattutto i giovani soggetti nei quali si ha ipertrofia epatica e lesione delle cellule epiteliali dei dotti biliari (Marcato e Rosmini, 1986).
XII) Classificazione di Pèllerdy e di Levine ed Ivens delle specie di Eimeria di
Lepus
Secondo Pellerdy (1965, 1974) le specie di Eimeria riscontrabili nei Lagomorfi del genere Lepus sono tredici:
Eimeria semisculpta (Madsen, 1938) è stata descritta nell’Europa centrale, ma è stata
riscontrata anche in Nord America (Pellerdy, 1956). Sia Carvalho (1943) che Pellerdy (1956) hanno fallito la cross-infezione di questa specie da lepre a coniglio. E’ stata ritrovata spesso nel duodeno di lepre groenlandiche (Lepus arcticus
groenlandicus) ma si può trovare anche in lepri europee (Lepus europaeus).
Questa specie è stata isolata anche da Nickel e Gottwald in Lepus europaeus in Germania (1978).
Eimeria robertsoni (Madsen, 1938) è stata riscontrata abbastanza spesso in Lepus arcticus groenlandicus, nella lepre coda bianca (Lepus towsendi-campanius) e nella
lepre comune (Lepus europaeus), nonché nella lepre indiana (Lepus ruficaudatus), diffusa in tutto il mondo (Carvalho, 1943). Carvalho (1943) non è stato in grado di trasferire questa specie al coniglio domestico ed al Sylvilagus floridanus mearnsii. Anche Pèllerdy ha fallito la cross-infezione sul coniglio domestico.
Questo coccidio secondo Bouvier (1967) si trova in grande quantità nelle giovani lepri in periodi molto umidi, si localizza più frequentemente nel cieco dove può provocare delle gravi lesioni infatti il contenuto ciecale può anche essere interamente emorragico. Anche nell’adulto è possibile riscontrare E. robertsoni ma generalmente in numero più ristretto e con delle lesioni più limitate.
Questa specie è stata isolata anche da Nickel e Gottwald in Lepus europaeus in Germania (1978).
Eimeria stefanskii (Pastuszko,1961) è stata descritta in Polonia sulla base delle
comune e la sua patogenicità nonché gli stadi endogeni sono ignoti (Levine e Ivens, 1972).
Eimeria towsendi (Carvalho 1943) è stata isolata nella lepre coda bianca (Lepus towsendi–campanius) e nella lepre comune (Lepus europaeus), in vari esemplari di
Lepus timidus e nella lepre californiana (Lepus californicus) in Nord America e in Europa (Pellerdy, 1956).
Questa specie è stata isolata inoltre da Nickel e Gottwald in Lepus europaeus in Germania (1978).
Eimeria leporis (Nieschulz ,1923) localizzata frequentemente nel piccolo intestino di Lepus europaeus, della lepre tulai (Lepus tolai) e della lepre indiana (Lepus
ruficaudatus), sia in India che in Europa (Levine e Ivens, 1972).
Questo coccidio è stato riconosciuto da Bouvier nel 1958 e secondo l’Autore si riscontrava da relativamente poco tempo in Svizzera poichè le sue caratteristiche lo rendono facile da identificare e prima del riscontro di Bouvier non era mai stato segnalato.
E. leporis può dare delle gravi enteriti , talvolta anche emorragiche , specialmente
nelle giovani lepri (Mc Culloch et al. 2003). Essa si trova più raramente nelle lepri viventi allo stato libero e si riscontra soprattutto nell’intestino crasso, e come l’E.
hungarica provoca nel colon delle gravi lesioni (Bouvier, 1967).
Questa specie è stata isolata anche da Nickel e Gottwald in Lepus europaeus in Germania (1978).
Eimeria europea (Pellerdy 1956) riscontrata nel piccolo intestino di Lepus europaeus
in varie nazioni europee (Nickel e Gottwald, 1978; Pakandl, 1979; Guberti et al. 2001; Aoutil et al. 2005). E’ abbastanza comune e Pellerdy (1965) ha sperimentato la capacità di trasmissione al coniglio che è fallita.
Eimeria belorussica Litvenkova, 1969, riscontrata in Europa occidentale ed in
Russia. E’ stata trovata in Lepus europaeus in Italia da Terracciano nel 1986.
Eimeria hungarica (Pellerdy 1956) riscontrata nel piccolo intestino di Lepus
ruficaudatus e di Lepus europaeus in India ed in Europa (Levine e Ivens, 1972). E’
relativamente comune ed i tentativi di cross infezione con il coniglio tentati da Pellerdy (1956) sono falliti.
La sporulazione di questa specie, secondo Bouvier (1967) non è facile da ottenere perché sembra che questo coccidio sia sensibile al bicromato di potassio. Inoltre Bouvier (1967) afferma che anche questa specie coccidica (come E. leporis) è stata importata in Svizzera all’inizio degli anni ’60 poiché il primo caso riconosciuto in Svizzera è stato nel 1964 in lepri allo stato libero, in un’infezione mista di E. leporis,
E. robertsoni e soprattutto E. hungarica Bouvier (1967) .
Può essere molto pericolosa per le giovani lepri perché può provocare un’enterite emorragica di tutto l’intestino crasso.
Le lesioni della mucosa intestinale causate da questo coccidio sono estremamente gravi e la parete quasi completamente distrutta e ricoperta di parassiti Bouvier (1967). Questa specie è stata isolata da Lepus europaeus in Germania da Nickel e Gottwald, nel 1978.
Eimeria septentrionalis (Yakimoff, Matschoulsky and Spartansky), 1936; si trova
comunemente nel duodeno della lepre variabile (Lepus timidus), in Lepus arcticus
groenlandicus e nalla lepre coda bianca (Lepus towsendi –campanius) in Russia,
Groenlandia e Nord America (Levine e Ivens, 1972). Negli studi di Carvalho (1943) la cross infezione tra coniglio domestico e Sylvilagus floridanus mearnsii non è risultata possibile.
Eimeria sculpta Madsen, 1938; si trova spesso nell’intestino di Lepus arcticus
ed in Nord America (Levine e Ivens, 1972). Negli studi di Carvalho (1943) la cross infezione tra coniglio domestico e Sylvilagus floridanus mearnsii non è risultata possibile.
Eimeria americana Carvalho, 1943; riscontrata nella lepre coda bianca (Lepus towsendi –campanius) in Nord America (Iowa) (Levine e Ivens, 1972). La sua
localizzazione nell’ospite è sconosciuta ma probabilmente si ritrova nell’intestino. Negli studi di Carvalho (1943) la cross infezione tra coniglio domestico e Sylvilagus
floridanus mearnsii non è risultata possibile.
Eimeria punjabensis Gill and Ray 1960; scoperta nella lepre indiana (Lepus
ruficaudatus). La sua localizzazione nell’ospite è sconosciuta, le oocisti sono state
ritrovate nelle feci. La sua patogenicità nonché gli stadi endogeni sono ignoti (Levine e Ivens, 1972).
Eimeria ruficaudati Gill e Ray 1960; isolata nella lepre indiana (Lepus ruficaudatus)
in India; le oocisti sono state ritrovate nelle feci. La sua patogenicità nonché gli stadi endogeni sono ignoti (Levine e Ivens, 1972).
Levine e Ivens (1972) non riportano E. belorussica e segnalano altre due specie del genere Lepus (E. campania ed E. groenlandica), classificando 14 specie.
Eimeria campania Carvalho 1943
Riscontrata in Lepus towsendi – campanius in Iowa , in Europa in Lepus europaeus ed in India in Lepus ruficaudatus.
Eimeria groenlandica Madsen 1938
Questa specie è stata successivamente isolata da Lepus europaeus in Italia da Guberti e collaboratori (2001).
XIII) Descrizione di Pèllerdy e di Levine ed Ivens delle specie di Eimeria di
Lepus
Eimeria belorussica Litvenkova, 1969
Dimensione: 26-28 x 14-16 µm.
Forma e colore:ovoidali o ellissoidali,marrone chiaro.
Parete: marrone chiara e bistratificata contiene un Micropilo cospicuo al polo appiattito dell’ oocisti.
Micropilo:presente di notevole larghezza. Sporocisti:ovali.
Eimeria europea Pellerdy 1956
Dimensione:26 -34 x 15 -20 µm.
Forma e colore:ellissoide allungata o fusiforme ,ristretta intorno ad entrambi i poli. Parete: uniformemente spessa ma si ispessisce intorno al micropilo,formando una struttura simile ad un colletto leggermente più scura di colore rispetto al resto della parete.
Micropilo: largo 6-9 µm, i suoi margini liberi appaiono a volte diritti,a volte ondulati, fochettando col microscopio.
Sporocisti:lunghe ,ovoidali,misurano 9 x 6 µm,i granuli occasionalmente rilevati tra di esse probabilmente rappresentano parte del residuo oocistico. Gli sporozoiti ,di forma a virgola, presentano un corpo refrattile tondo alla loro estremità più larga. Residui: residuo oocistico largo ,granulare ,sferico o angolare con contorni definiti. Residuo sporocistico posto centralmente alle sporocisti.
Dimensione: 14 x 13 µm (13-15 x 12 -14) . Forma e colore:sferica o subsferica incolore. Parete: sottile, incolore, liscia .
Micropilo:assente.
Sporocisti:corte ,occupanti quasi l’intero volume dell’oocisti.
Residui: residuo oocistico consistente in 1-2 granuli al centro tra le sporocisti; residuo sporocistico assente.
Eimeria leporis Nieschulz ,1923
Dimensione:32 x 16 µm (26-38 x 13-20).
Forma e colore:lunga cilindrica oocisti con i lati pressoché paralleli,sono frequenti forme ricurve e reniformi.
Parete:incolore ,liscia. Micropilo:assente.
Sporocisti: fusiformi con sporozoiti a forma di virgola contenenti due corpi refrattili, uno grande ed uno piccolo tondeggianti.
Residui: residuo oocisticogrossolanamente granulare di 4-5 µm di diametro. Residuo sporocistico con granuli grossolani piccolo al centro della sporocisti tra i due
sporozoiti.
Eimeria robertsoni (Madsen, 1938) Carvalho, 1943
Dimensione:42.1 x 25.8 µm (34-52 x 23-32)
Forma e colore:ovoidale o ellissoidale larga,giallastra- marrone.
Parete:liscia giallastra-marrone ,forma un ispessimento simile ad un colletto attorno al micropilo ,ma altrimenti è uniformemente spessa .
Micropilo:largo 8-9 µm, piatto.
Residui: residuo oocistico misura 12-15 µm di diametro al massimo. Residuo sporocistico indistinto composto da pochi granuli.
Eimeria semisculpta (Madsen, 1938) Pellerdy 1956
Dimensione:38 x 25 µm (35-45 x 22 -27)
Forma e colore: ellissoide leggermente appiattita ad un polo,marroncina-gialla . Parete:marroncina gialla bistratificata ,uniformemente spessa. La superficie esterna dello strato esterno della parete è granulare nella metà anteriore,mentre è liscia nella metà posteriore. Le due metà sono nettamente definite l’una dall’altra.
Micropilo:largo 6-8 µm.
Sporocisti:fusiformi misurano 19 x 9 µm .Gli sporozoiti a forma di virgola giacciono posizionati incastrandosi testa-coda attorno al residuo sporocistico centrale.
Residui: residuo oocistico assente, residuo sporocistico centrale alla sporocisti.
Eimeria stefanskii Pastuszko,1961
Dimensione:59-68 x 32-37 µm, è la più grande specie segnalata.
Forma e colore:ellissoidale o ovoidale appuntita alle due estremità,leggermente appiattita al polo micropilare.
Parete:si ispessisce distintamente attorno al micropilo. Micropilo:largo 7-9 µm.
Sporocisti: sottili,fusiformi lunghe 15 µm.
Residui: residuo oocistico largo,16 µm di diametro, residuo sporocistico assente.
Eimeria towsendi (Carvalho 1943) Pellerdy, 1956
Dimensione: 40 x 28 µm (37-44 x 25-31 ) Forma e colore:simile a E. Magna.
Parete:giallastra-marrone ,formata da due strati ,il più esterno dei quali è più scuro e si distacca facilmente in bicromato di potassio ;ed uno sottile più interno e liscio.
Micropilo:presente solo nello strato più esterno della parete bistratificata. Sporocisti: fusiformi ,misurano 17 x10 µm,gli sporozoiti contengono due corpi refrattili tondeggianti,uno largo ed uno piccolo.
Residui: residuo oocistico assente , residuo sporocistico copiosamente granulare disseminato dentro le sporocisti.
E. towsendi ha un tempo di sporulazione molto lento (più di 7-9 giorni). Questo
parassita è stato riscontrato da Bouvier (1967) sempre in piccolo numero, si localizza nel cieco, probabilmente la patogenicità è nulla.
I coccidi riconosciuti in Svizzera da Bouvier (1967) sono gli stessi segnalati da Pellerdy (1965) in Ungheria infatti corrispondono alla descrizione fatta da quest’ultimo.
Eimeria campania Carvalho 1943
Dimensione: 35-45 x 22-27
Forma e colore: Oocisti ellittiche – cilindriche con un collo allungato Micropilo:6-8 senza una cresta intorno ad esso.
Parete : composta da 2 strati di cui l’esterno è molto sottile e marroncino e l’interno è più spesso e apparentemente incolore
Residui: residuo oocistico assente e anche granuli polari, residuo sporocistico presente e ben visibile.
Sporocisti : oblunghe , fusiformi 18 x 9 µm con un corpo di Stieda. Gli sporozoiti sono allungati con una estremità più larga dell’altra , giacciono per lungo testa coda nella sporocisti ed hanno un distinto corpo refrattile all’estremità più larga. Il tempo di sporulazione è 3-4 giorni.
Specie di Eimeria non riscontrate in Lepus europaeus ma in altre sottospecie: E.
Eimeria septentrionalis Yakimoff,Matschoulsky and Spartansky, 1936
Dimensione:26.7 x 21.6 (24-32 x 20-22) Forma e colore:tonda o ovoidale.
Parete:liscia ,trasparente, uniformemente spessa, si ispessisce notevolmente in prossimità del micropilo a formare un orlatura di colore scuro.
Micropilo:largo 12 µm.
Sporocisti:ovoidali-ellissoidali ,misurano 12-14 µm x 6-7 µm.
Eimeria sculpta Madsen, 1938
Dimensione:36.8 x 28.7 µm (32-42 x 23-32) Forma e colore:ovoidali o piriformi
Parete:marrone scura, l’intera superficie della parete è notevolmente granulare. Micropilo: Secondo Madsen(1938) e Pellerdy (1956)è stretto mentre per Carvalho è largo 7.5 µm.
Sporocisti:ovoidali di 15-17 µm per 9-10 µm.
Residui: residuo oocistico assente, residuo sporocistico largo con contorni netti e forma indefinita.
Eimeria americana Carvalho, 1943;
Dimensione:38.1 x 21 µm(34.3 - 42.8 x 18.3- 25)
Forma e colore:ovoidali o ellissoidali allungate rastremanti verso entrambe le estremità.
Parete:uniformemente sottile ,attorno al micropilo è presente un evidente “collare” scuro .
Micropilo: largo circa 6 µm.
Sporocisti:ovoidali relativamente larghe ,7-8 µm di diametro e 17 µm di lunghezza. Gli sporozoiti a forma di virgola un nucleo centrale ad un cospicuo corpo retrattile di 5.5 µm.
Residui: residuo oocistico è granulare e appare diffuso tra le sporocisti; residuo sporocistico assente.
Eimeria punjabensis Gill and Ray 1960
Dimensione:22.5 x 22 µm (20-23.8 x 19.5 -22.5) Forma e colore: pressoché tonde, giallo chiaro. Parete:liscia
Micropilo:assente.
Sporocisti:ovoidali ,misurano 12.5 x 8.5 µm,con nucleo centrale ed un corpo retrattile con un diametro medio di 5 µm presente all’estremità smussata.
Residui: residuo oocistico di 5 µm di diametro, residuo sporocistico assente.
Eimeria ruficaudati Gill and Ray 1960
Dimensione:28-35 x 12-15 µm
Forma e colore:cilindriche chiare giallastre-rosa.
Micropilo:presenta un apice appuntito al centro che lo fa apparire di forma a triangolo aperto in alcune oocisti.
Residui: residuo oocistico tondo di 4-6 µm di diametro con la tendenza di diminuire di dimensione; residuo sporocistico di 4 µm di diametro.
Eimeria groenlandica Madsen 1938
Dimensione: 23-33 x 17- 26 µm.
Forma e colore: grossolanamente ellissoidi, incolori , lisce. Micropilo: può essere presente e stretto o assente.
Sporocisti: fusiformi, di 13-19 x 7-8 µm con un corpo di Sieda. Gli sporozoiti sono allungati e con una estremità più larga dell’altra, giacciono testa coda nelle sporocisti e presentano un evidente corpo refrattile all’estremità più larga.
Residui: presente un residuo oocistico e assenti granuli polari. Residuo sporocistico può essere presente e composto da pochi granuli o assente.
XIV) Classificazione delle specie di Eimeria di Lepus secondo Aoutil & Landau La classificazione di Aoutil & Landau del 2005 individua le seguenti specie di
Eimeria presenti in Lepus europaeus e Lepus granatensis in Francia.
Eimeria Leporis Brevis N.SUBSP Aoutil & Landau Eimeria Leporis Leporis Nieschulz 1923
Eimeria orbiculata Lucas ,Laroche & Durand 1959 Eimeria europea Pellerdy 1956
Eimeria audubonii Duszynski & Marquardt 1969. Eimeria nicoloegerae N.SP Aoutil & Landau Eimeria gantieri N.SP. Aoutil & Landau
Eimeria deharoi deharoi N.SP. Aoutil & Landau Eimeria deharoi rotonda N.SUBSP. Aoutil & Landau Eimeria bainae N.SP. Aoutil & Landau
Eimeria coquelina N.SP. Aoutil & Landau Eimeria grease N.SP. Aoutil & Landau Eimeria mazierae N.SP. Aoutil & Landau Eimeria rienai N.SP. Aoutil & Landau
Eimeria pierrecouderti N.SP. Aoutil & Landau Eimeria cabareti N.SP. Aoutil & Landau
Eimeria stiedai (Lindemann 1865)
Eimeria lapierrei N.SP. Aoutil & Landau Eimeria macrosculpta Sugar ,1979
Eimeria tailliezi N.SP. Aoutil & Landau Eimeria babatica Sugar 1978
Si tratta di 21 specie di cui 13 specie e due sottospecie non erano state prima descritte. Aoutil e collaboratori (2005) hanno riscontrato le oocisti delle suddette specie di Eimeria nel contenuto ciecale di 46 Lepus granatensis e di 18 Lepus
europaeus catturate in Francia. La carica parassitaria di questi animali era
prevalentemente molto bassa, nonostante la differenza delle specie fosse
considerevole. Secondo gli Autori tre taxa della classificazione di Pellerdy (Eimeria
towsendi, Eimeria robertsoni ed Eimeria semisculpta ), precedentemente identificate
in numerose occasioni in Europa occidentale e corrispondenti a forme e varianti create prima del 1960 e che sono state successivamente elevate a rango di specie, appaiono non essere valide. Infatti le descrizioni dei parassiti dal materiale usato per effettuare l’indagine non corrispondeva alle descrizioni originali. Il motivo di questa differenza potrebbe anche essere dovuto dal fatto che si sono usati campioni
appartenenti ad un ospite di una diversa specie raccolti in una regione differente e ad una inadeguata descrizione della morfologia rispetto a quelle fornite dalle prime descrizioni. Per questo motivo Aoutil e collaboratori (2005) hanno considerato le tre specie non valide. In particolare, Eimeria towsendi (Carvalho 1943) Pellerdy, 1956 è stata riportata sotto il nome di Eimeria tailliezi N.SP.; Eimeria robertsoni (Madsen, 1938) Carvalho, 1943 come Eimeria coquelina N.SP. ed Eimeria semisculpta (Madsen, 1938) Pellerdy 1956 come Eimeria pierrecouderti N.SP. ed Eimeria
tailliezi N.SP.
Un equilibrio stabile, come generalmente si osserva nel caso di molte co-infezioni di specie congeneriche dello stesso ospite, non è stato osservato nella lepre. Questo è stato attribuito alle abitudini solitarie dell’ospite e della natura probabilmente
polifiletica del genere Eimeria. Dati relativi alla paleontologia dei Leporidi indicano che i parassiti del coniglio derivano da quelli della lepre.
In questo studio (Aoutil e Landau, 2005), indipendentemente dalla regione geografica, dalla stagione, dall’età dell’ospite , alcune specie sono risultate costantemente dominanti mentre altre sono invariabilmente rare. Tutte le specie hanno delle sporocisti che possiedono un corpo di Stieda, apparentemente simile in tutte le specie, per esso cui non viene considerato nella descrizione di ogni singola specie.
XV) Descrizione delle specie di Eimeria della lepre secondo Aoutil & Landau (2005)
Eimeria Leporis Leporis Nieschulz:1923
Dimensione 33 x 15 µm (28-41 x 15-19 con shape index (rapporto lunghezza spessore) = 2.2
Forma e colore: ellissoide allungata o leggermente reniforme di colore giallo molto pallido o bianco.
Parete sottile e liscia con un polo appiattito. Micropilo assente.
Sporocisti occupano i 2/3 dell’oocisti e sono tozze ,misurano 15 x 8 µm, gli sporozoiti contengono un largo allungato corpo refrattile .
Residui : un residuo oocistico rotondo piccolo di 6 µm di diametro ed un ben delimitato residuo sporocistico di 5 grani.
Eimeria Leporis Brevis N.SUBSP Aoutil & Landau
Dimensione 27 x 14 µm (23-31 x 13-15) con shape index =1.93.
Colore e forma allungata o leggermente reniforme di colore giallo molto pallido. Parete: sottile e liscia con un polo appiattito.
Micropilo assente .
Sporocisti occupanio quasi la totalità del volume dell’oocisti e sono tozze ,misurano 15 x 8 µm e gli sporozoiti contengono un corpo refrattile piccolo ed uno largo e allungato.
Residui:un residuo oocistico piccolo tondo di 4 µm di diametro ed un ben delimitato residuo sporocistico con 5 grani.
Eimeria orbiculata Lucas ,Laroche & Durand 1959
Dimensione:13 x 13 (12-16 x 12-15 ) con shape index =1. Forma e colore: subsferica e bianca.
Parete: liscia e più frequentemente con uno spazio semilunare tra le pareti interna ed esterna.
Micropilo: assente.
Sporocisti : occupano l’intero spazio all’interno dell’oocisti e misurano 9 x 5 µm e gli sporozoiti possiedono due corpi refrattili tondi.
Residui: un ben definito residuo oocistico irregolare che misura 2 µm. Residuo sporocistico non è stato rilevato.
Differisce da E. hungarica solo per il residuo oocistico arrotondato dal momento che Pellerdy non segnala che qualche granulazione di residuo oocistico visibile solo con obiettivo ad immersione in E. hungarica.
Bouvier (1967) sottolinea che Lucas e collaboratori (1959) non hanno riscontrato E. orbiculata che una sola volta in una lepre francese , ma E. hungarica è più frequente e causa gravi lesioni della mucosa intestinale.
Eimeria audubonii Duszynski & Marquardt 1969.
Dimensione:21 x 17 µm (19-24 x 14-18 ) con shape index =1.24. Forma e colore: ellissoide e bianca.
Parete:guscio esterno sottile e liscio.
Micropilo:assente ma con un polo molto appiattito e assottigliato.
Sporocisti: 12 x 7 µm ovali e tozze con una estremità arrotondata , riempiono quasi l’ oocisti e gli sporozoiti contengono due corpi retrattili, uno piccolo e uno largo.
Residui sia il residuo sporocistico che il residuo oocistico sono assenti.
Eimeria europea Pellerdy 1956
Dimensione: 31 x 19 µm (30-35 x 17-21 ) con shape index = 1.63.
Forma e colore: ovale e allungata ,la parte anteriore è più stretta,marroncina. Parete:liscia spessa attorno al micropilo.
Micropilo: presente e formato da una cupola di 3-5 µm.
Sporocisti:il volume disponibile è quasi riempito dalla sporocisti di 19x 9 µm; gli sporozoiti posseggono un corpo retrattile allungato.
Residui: è presente un residuo oocistico di 9 µm di diametro e il residuo sporocistico è formato da un aggregato di piccoli granuli poco definito.
Eimeria nicoloegerae N.SP Aoutil & Landau
Dimensione: 34 x 18 µm (28- 40 x 15-20 ) con shape index= 1.89.
Forma e colore: allungata ellissoide con bordi paralleli ,anche se in alcuni casi un bordo è più concavo dell’altro ,marroncina.
Parete:liscia e spessa.
Micropilo: piatto e spesso di 5-6 µm di diametro,con un anello che sporge molto leggermente.
Sporocisti: queste occupano 2/3 del volume oocistico, misurando 15 x 8 µm ,e gli sporozoiti posseggono un singolo corpo refrattile tondo.
Residui: un molto piccolo residuo oocistico è presente (4 µm di diametro), il residuo sporocistico è allungato con granuli regolari e larghi.
Eimeria gantieri N.SP. Aoutil & Landau
Dimensione: 30 x 22 (29-33 x 20-24 ) con shape index =1.36. Forma e colore: da ellissoide a leggermente ovale ,marrone chiaro.
Parete: 2/3 della parete esterna dal lato del micropilo sono finemente granulari. Micropilo: misura 4 µm con una parte superiore sottile diritta e una base concava. Sporocisti: occupano lo spazio disponibile ,misurano 16 x 9 µm e gli sporozoiti possiedono un singolo corpo refrattile.
Residui: un residuo oocistico è composto da pochi piccoli grani, ed è presente un residuo sporocistico compatto ovale.
Eimeria deharoi deharoi N.SP. Aoutil & Landau
Dimensione : 28 x 16 µm (26 -33 x 14-18) con shape index = 1.75.
Forma e colore: ovoidale e bianca con un anello del micropilo giallastro. Parete:liscia.
Micropilo:4,5 µm di diametro,anello del micropilo alto 3 µm formato da un ispessimento della parete esterna e che dà l’impressione di essere che dà l’impressione di essere aggiunto (incollato)alla parete oocistica.
Sporocisti:queste hanno un citoplasma molto granulare ,misurano 13x 7 µm e gli sporozoiti contengono due corpi refrattili uno dei quali è largo e allungato.
Residui: un residuo oocistico di 7 µm di diametro è presente estendendosi tra le sporocisti.Il residuo sporocistico è piccolo e contiene grani larghi e dispersi.
Eimeria deharoi rotonda N.SUBSP. Aoutil & Landau.
Dimensione:23 x 16 µm (22-29 x 13-18 ) con shape index=1,44. Forma e colore: corta ellissoide,giallo pallido.
Eimeria bainae N.SP. Aoutil & Landau
Dimensione: 29 x 18 µm (26-33 x 15-21 ) con shape index = 1.61. Forma e colore: ellissoide e leggermente allungata ,bianca –giallastra.
Parete: liscia con un polo appiattito all’estremità in cui è presente il micropilo. Micropilo: largo 6 µm leggermente convesso.anello di un colore giallo più intenso. Sporocisti: occupano l’intero volume dell’oocisti ,misurano 15 x 8 µm e gli sporozoiti hanno un singolo corpo refrattile leggermente ovale.
Residui:tondo residuo oocistico di 8 µm di diametro con grani di media grandezza. Assente il residuo sporocistico.
Eimeria coquelina N.SP. Aoutil & Landau
Dimensione: 35 x 23 µm (32- 39 x 20 -26) con shape index = 1.52. Forma e colore:corta ellissoide marrone chiaro.
Parete: spessa parete esterna che è finemente granulare ,anche se questo si può vedere solo dopo che l’oocisti si è rotta (è scoppiata).
Micropilo:presente sottile e un poco incurvata,circondata da un ispessimento
semplice della superficie senza un vero anello del micropilo e misura da 7 a 8 µm. Sporocisti: misurano 19 x 9 µm,riempiono i 2/3 dell’ oocisti e gli sporozoiti
possiedono un singolo corpo refrattile largo e allungato.
Residui: un ben definito ma dai contorni irregolari di 11 µm di diametro con grani medi . Assente il residuo sporocistico.
Eimeria grease N.SP. Aoutil & Landau
Forma e colore: leggermente ovale ,appiattita all’estremità del micropilo ,giallo chiaro.
Parete:liscia. Ispessimento della parete attorno al micropilo formante l’anello del micropilo.
Micropilo: 8 µm di diametro con una base diritta ed una cupola leggermente protuberante.
Sporocisti: allungate 19 x 8,5 µm assemblate al centro in modo da lasciare dello spazio libero da entrambi i lati. Due corpi refrattili uno piccolo ed uno largo sono presenti negli sporozoiti.
Residui: un residuo oocistico tono di 9 µm di diametro formato da granuli grossolani, ben delimitato e trasmettendo qualche espansione tra le sporocisti. Assente il residuo sporocistico.
Eimeria mazierae N.SP. Aoutil & Landau
Dimensione:40 x 29 (39-41 x 29-31) con shape index = 1.38. Forma e colore:ovale e molto larga ,giallo chiara.
Parete: liscia e sottile.
Micropilo: 8 µm di diametro di forma piramidale e circondato da un leggero ispessimento della parete.
Sporocisti: misurano 18 x 10 µm. Gli sporozoiti possiedono un corpo refrattile tondo e occupano i ¾ del volume disponibile dell’oocisti.
Residui: il residuo oocistico è largo ,irregolare e con dei diverticoli a cui si ancorano grani medi molto diffusi e non compatti . Assente il residuo sporocistico.
Eimeria rienai N.SP. Aoutil & Landau
Dimensione 37 x 22 µm 35-40 x 19-24) con shape index =1.68.
Parete: liscia.
Micropilo:da 4 a 5 µm di diametro con una cupola sporgente,ed un anello del micropilo ben definito.
Sporocisti: misurano 19 x 9 µm e gli sporozoiti contengono due corpi refrattili , uno allungato e l’altro piccolo e tondo. Nell’ oocisti sono circondate da un largo spazio vuoto da tutti i lati.
Residui: un residuo oocistico è presente e misura 10 µm di diametro. Assente il residuo sporocistico.
Eimeria pierrecouderti N.SP. Aoutil & Landau
Dimensione:35 x 24 µm (33 – 37 x 23-26 ) con shape index =1.46. Forma e colore: leggermente ovoidale , marrone-giallastra.
Parete: la metà anteriore della parete esterna è talvolta coperta da granuli sporgenti ed è oiù spessa della metà posteriore.
Micropilo:8 µm di diametro,formante una leggera cupola.
Sporocisti:occupano i 2/3 dell’ oocisti e misurano 21x 9.5 µm e gli sporozoiti possiedono un corpo refrattile tondo.
Residui:è presente un residuo oocistico che misura 11 µm di diametro,esso ha bordi parzialmente definiti e qualche estensione è proiettata tra le sporocisti. Assente il residuo sporocistico.
Eimeria cabareti N.SP. Aoutil & Landau
Dimensione: 33x26 µm (31-35 x 24-28) con shape index =1.27. Forma e colore: ovale tondeggiante marrone scuro.
Parete: la parete esterna è liscia con uno spazio frequentemente osservato tra le pareti interna ed esterna.
Micropilo: misura 5 µm di diametro ed è spessa lievemente convessa e leggermente concava alla base .E’ presente un anello del micropilo.
Sporocisti:misurano 17 x 9 µm e occupano i 2/3 dell’ oocisti e gli sporozoiti possiedono due corpi refrattili tondi uno largo ed uno piccolo.
Residui: residuo oocistico formato da 3 o 5 grani.Un largo e ben definito residuo sporocistico di forma ovale con larghi grani è presente.
Eimeria stiedai (Lindemann 1865)
Dimensione:37 x 22 µm (33-40 x 19-24) con shape index =1.68.
Forma e colore:ellissoide ed in alcuni casi con un lato più convesso dell’altro ,marroncina.
Parete:spessa paree esterna con un ispessimento più pronunciato e fini granulazioni nella metà anteriore. Uno spazio può talvolta essere osservato tra pareti interna ed esterna dell’ oocisti.
Micropilo: piccolom piatto e misura 4,5 µm,e in alcuni casi con una depressione visibile nell’ispessimento della parete esterna adiacente.
Sporocisti: tozze ,18 x 10 µm di dimensione,e occupano i 2/3 dell’ oocisti; sporozoiti con un corpo refrattile piccolo ed uno più largo.
Residui: residuo oocistico assente o rappresentato da un singolo grano. Un residuo sporocistico di forma ovale è presente e misura 9 µm ed ha larghi grani.
Eimeria lapierrei N.SP. Aoutil & Landau
Dimensione: 33 x 26 (31-35 x 24-28) con shape index =1.27. Forma e colore:ovale arrotondata,marrone scuro.
Parete:la parete esterna è spessa e grossolanamente granulare ,separata sotto il micropilo dallo strato sottostante da un consistente spazio di 2 µm
Micropilo: diritto e spesso ,apparentemente in contiunuità con la aprete esterna e che misura 6 µm.
Sporocisti:sono tozze e misurano 17 x 9 µm e gli sporozoiti posseggono 2 corpi refrattili tondi.
Residui: residuo oocistico assente.Un residuo sporocistico di 7 x 4 µm è presente ed è formato da larghi granuli raggruppati che non sono tuttavia racchiusi da una
membrana.
Eimeria macrosculpta Sugar ,1979
Dimensione:42 x 21 (40-45 x 18-22) con shape index =2.
Forma e colore: allungata ed ellissoide con i lati paralleli. Una estremità è arrotondata mentre l’altra, l’estremità del micropilo ,è leggermente appiattita. Il colore è
marroncino.
Parete: la metà anteriore è più spessa e più scura . Micropilo:appiattito,largo 6,5 µm senza anello definito.
Sporocisti: occupano approssimativamente il 60 % del volume dell’ oocisti, lunghe (22 x 8,5 µm) con estremità arrotondate. Ogni sporozoite presenta un corpo refrattile largo allungato.
Residui: residuo oocistico assente. Residuo sporocistico ellissoide e ben definito con granuli di medie dimensioni.
Eimeria tailliezi N.SP. Aoutil & Landau
Dimensione: 42 x 23 µm (40-43 .5 x 22 -24.3 ) con shape index =1.81. Forma e colore: allungata ed ovoide, spesso asimmetrica,con un’estremità leggermente concava e l’altra più convessa , marrone-beige.
Parete: la metà anteriore è più spessa e più scura di quella posteriore e mostra una granulazione grossolana.
Micropilo: piatto e largo 6 µm.
Sporocisti: occupano i 2/3 dell’oocisti,misurano 19 x9 µm, e gli sporozoiti possiedono un corpo refrattile di forma ovale .
Residui: residuo oocistico ridotto a due – tre grani ed il residuo sporocistico di 6 µm, allungato e compatto mostra grani abbastanza fini.
Eimeria babatica Sugar 1978
Dimensione: 26 x 17,5 µm (23-29 x 15 -18) con shape index =1.49.
Forma e colore: ovoidale ,biancastra e colorata leggermente di giallo- bruno intorno al micropilo. Parete: liscia e sottile.
Micropilo:diritto ,misura 4,5 µm di diametro circondato da un anello che appare attaccato alla oocisti.
Sporocisti: sono tozze e misurano 15 x 8 µm,riempiono l’intero volume dell’oocisti e gli sporozoiti possiedono un corpo refrattile tondo.