1.1 La neurulazione e lo sviluppo del SNC nei Vertebrati
Alla fine della gastrulazione il neuroectoderma acquisisce un aspetto colonnare, tanto da diventare anatomicamente distinguibile dal restante ectoderma. Si forma così la piastra neurale che ben presto darà origine al tubo neurale, l'abbozzo del sistema nervoso centrale (SNC), attraverso un processo chiamato neurulazione (Fig. 1.1). Inizialmente i margini della piastra neurale si ispessiscono formando le pliche neurali, mentre la zona mediana forma un avvallamento che prende il nome di solco neurale. Contemporaneamente le pliche si sollevano e convergono verso la linea mediana andando a chiudere dorsalmente il tubo neurale. Questi movimenti sono accompagnati dalla formazione di regioni di cerniera, nelle quali le cellule del tubo neurale assumono un aspetto cuneiforme che facilita la rotazione del tessuto intorno all'asse longitudinale della piastra.
Successivamente avvengono una serie di modificazioni anatomiche, istologiche e cellulari che porteranno al differenziamento del cervello e del midollo spinale. La chiusura del tubo neurale procede con modalità diverse lungo l'asse antero-posteriore nelle diverse classi di Vertebrati. Prendendo in considerazione lo sviluppo dei Vertebrati, il primo segno di regionalizzazione rostro-caudale consiste nella formazione anteriore di tre vescicole primarie denominate prosencefalo,
mesencefalo e romboencefalo, prima che la chiusura del tubo neurale sia avvenuta nella regione
caudale (Fig 1.2). Con il procedere dello sviluppo il prosencefalo si suddivide in un telencefalo anteriore, che formerà gli emisferi cerebrali, e in un diencefalo posteriore che darà luogo all'epitalamo, al talamo, alla retina e all'ipotalamo. Il mesencefalo rimane indiviso, mentre il romboencefalo si suddivide in un metencefalo anteriore, dal quale svilupperanno il cervelletto e il ponte, e in un mielencefalo posteriore che darà luogo al midollo allungato (Fig 1.2).
1.2 Lo sviluppo dell'occhio
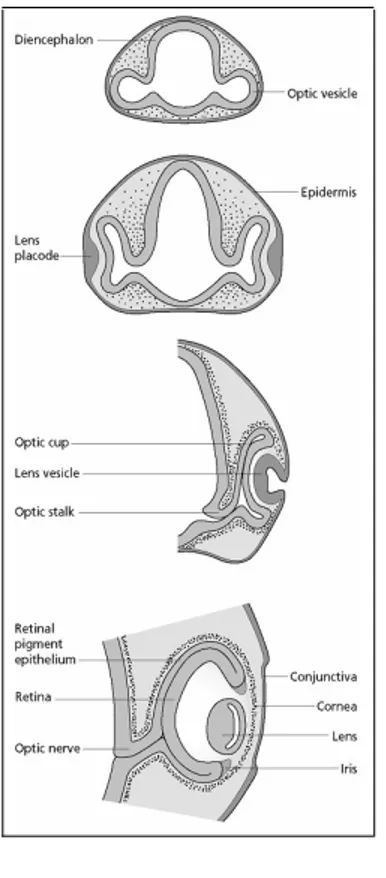
Lo sviluppo dell'occhio dei Vertebrati inizia con la formazione di due evaginazioni simmetriche del prosencefalo denominate vescicole ottiche (Fig 1.3). Queste si spingono
Fig. 1.2 – Differenziamento anteriore del sistema nervoso centrale (Gilbert, Developmental Biology
lateralmente fino a contattare l'ectoderma della testa dove, mediante una serie di segnali induttivi, provocano la formazione di due ispessimenti ectodermici pseudostratificati chiamati placodi
lentigeni. La parte prossimale delle vescicole ottiche si restringe formando il peduncolo ottico che
diventerà in seguito il nervo ottico. Successivamente i placodi si invaginano e si separano definitivamente dall'ectoderma circostante formando le vescicole lentigene, che daranno luogo alle cellule delle fibre della lente. Contemporaneamente le estremità distali delle vescicole ottiche si ripiegano su sé stesse avvolgendo le vescicole lentigene e formando delle strutture bilaminari chiamate coppe ottiche. La lamina esterna della coppa darà luogo all'epitelio pigmentato, uno strato cellulare deputato al mantenimento funzionale e trofico dei fotorecettori; mentre quella interna si differenzierà nella retina. L'iride e il corpo ciliare derivano dalla porzione più periferica della retina. La sclera e la cornea derivano dalle cellule mesenchimatiche provenienti dalle creste neurali.
Fig. 1.3 – Fasi successive dello sviluppo dell'occhio (Slack, Essential Developmental
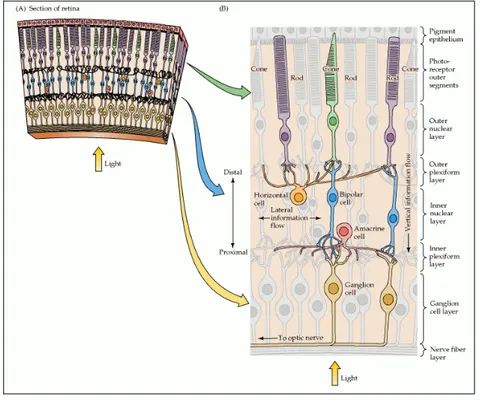
La retina dei Vertebrati è l'organo di senso deputato alla trasduzione del segnale luminoso. Istologicamente presenta una tipica organizzazione trilaminare: lo strato nucleare esterno (ONL), contenente i fotorecettori (coni e bastoncelli), lo strato nucleare interno (INL), contenente cellule
bipolari, orizzontali, amacrine e cellule della glia di Müller, e lo strato di cellule gangliari
(GCL) (Fig 1.4). La retina è un centro nervoso dotato di vie di trasmissione centripete dei messaggi (fotorecettori, cellule bipolari e gangliari) e di vie associative che permettono un'elaborazione periferica dell'informazione (cellule amacrine e orizzontali). I fotorecettori convertono opportunamente lo stimolo luminoso in messaggi chimici ed elettrici. Tali messaggi sono trasportati dalle cellule bipolari nella porzione interna della retina, ma essi sono modulati in uscita dall'ONL attraverso la presenza delle cellule orizzontali e in entrata nel GCL mediante le cellule amacrine. Le connessioni tra i diversi strati sono anch'esse organizzate in uno strato plessiforme esterno ed uno interno. Infine i prolungamenti assonici delle cellule gangliari, che costituiscono il nervo ottico, provvedono a inviare i segnali verso i distretti centrali del cervello.
1.3 Le “tappe fondamentali” dell'induzione neurale
Una delle sfide più importanti, nell'ambito dell'embriologia, è rappresentata dalla ricerca dei meccanismi molecolari responsabili dell'induzione dei campi morfogenetici embrionali. Questi territori sono responsabili della formazione di organi e strutture corporee mediante un meccanismo fine di regolazione dell'espressione genica. Tale attività ha un duplice scopo: il mantenimento omeostatico della propria identità all'interno dell'embrione (autoregolazione) e il cambiamento del destino delle cellule situate al di fuori del campo morfogenetico. L'induzione neurale è forse l'aspetto più affascinante di questi studi e per questo motivo, nel corso degli anni, si è assistito alla contrapposizione di visioni diametralmente opposte.
Nel 1924 gli esperimenti di trapianto del labbro dorsale del blastoporo di tritoni, effettuati da Hans Spemann e Hilde Mangold, dimostrarono che un gruppo di cellule provenienti dalla futura regione dorsale di un embrione allo stadio di gastrula precoce era in grado di organizzare la formazione di un embrione secondario una volta trapiantato nella futura regione ventrale vegetativa di un embrione ricevente allo stesso stadio di sviluppo. Per distinguere l'origine dei tessuti dell'embrione gemello, i due ricercatori utilizzarono come donatore un embrione di una specie non pigmentata e come ricevente uno appartenente ad una specie pigmentata. Mediante questo semplice accorgimento fu possibile individuare nella notocorda e nelle strutture mesodermiche della testa i derivati del labbro dorsale trapiantato (cordo-mesoderma e mesoderma pre-cordale); nel sistema nervoso centrale (neuro-ectoderma), nei somiti (mesoderma parassiale) nei reni (mesoderma intermedio) e in un intestino (endoderma) i derivati dei tessuti dell'ospite indotti a cambiare il proprio destino [Spemann e Mangold, 1924]. Per la capacità di organizzare un asse corporeo secondario con una corretta polarità antero-posteriore e dorso-ventrale, Spemann si riferì alle cellule trapiantate come all'Organizzatore, oggi conosciute come Organizzatore di Spemann o Organizzatore Primario, a causa della credenza erronea che l'induzione neurale, operata dal labbro dorsale del blastoporo sul sovrastante ectoderma, fosse il primo evento di induzione embrionale.
Una prima serie di evidenze sperimentali, come il mantenimento dell'attività induttiva da parte del labbro dorsale del blastoporo trapiantato all'interno del blastocele di un embrione ricevente, o da parte di tessuti morti ([Bautzmann et al., 1932] citato in [Gilbert S.F., 2001]), depose a favore della natura diffusibile dei segnali rilasciati dall'Organizzatore. La conferma definitiva provenne dagli esperimenti di frapposizione di membrane micro porose attraverso cui si impediscono i contatti intercellulari ([Saxén, 1961]; [Toivonen et al., 1975]; [Toivonen e Wartiovaara, 1976] citati in Gilbert S.F., 2001). Tali esperimenti dimostravano la presenza di una
via di segnalazione verticale che origina dal mesoderma involuto, nella sua componente più
dorsale, e raggiunge l'ectoderma prospettico sovrastante inducendolo a differenziarsi in tessuto nervoso (recensito in Gilbert S.F., 2001). Questa ipotesi venne corroborata anche da esperimenti di esogastrulazione realizzati da Holtfreter trattando gli embrioni con soluzioni saline ipertoniche allo stadio di gastrula precoce ([Holtfreter, 1933a]; [Holtrfreter, 1933b] citati in Gilbert S.F., 2001). In questo modo il mesoderma non subiva involuzione e i movimenti di gastrulazione procedevano normalmente all'esterno dell'embrione: nelle esogastrule l'ectoderma veniva a trovarsi completamente separato dal mesoderma e non si differenziava alcun tessuto nervoso.
Successivamente Otto Mangold evidenziò la capacità dell'Organizzatore di regionalizzare il tessuto nervoso ripetendo gli esperimenti di trapianto di Spemann-Mangold, ma utilizzando il labbro dorsale del blastoporo proveniente da stadi diversi di gastrulazione o porzioni successive del tetto dell'archenteron. In questo modo ottenne delle parziali duplicazioni dimostrando che le prime cellule dell'Organizzatore a passare attraverso il labbro dorsale del blastoporo inducono strutture anteriori come cervello e parti della testa, mentre quelle successive inducono midollo spinale e coda ([Mangold, 1933]; [Sala, 1955]; citati in [Saxén L., 2001]).
I primi tentativi di frazionamento ed individuazione delle molecole attive nell'induzione neurale non ebbero molto successo a causa dell'estrema eterogeneità dei composti, naturali ed artificiali, che si dimostrarono avere attività neuralizzante sull'ectoderma di salamandra. Nel 1941
ogni speranza fu infranta di fronte all'evidenza che anche in soluzione salina gli espianti ectodermici di salamandra erano capaci di differenziarsi in tessuti neurali ([Barth, 1941]; [Holtfreter, 1944]; citati in [De Robertis E.M., 2006]).
Durante gli anni '80 fu dimostrata la conservazione del meccanismo di induzione neurale da parte del labbro dorsale del blastoporo e dei suoi derivati nell'Anfibio Xenopus laevis, utilizzato prevalentemente per studi molecolari ([Gimlich e Cooke, 1983]; [Smith e Slack, 1983]; [Recanzone e Harris, 1985]; citati in Gilbert S.F., 2001). A differenza della salamandra, l'ectoderma di X. laevis non presentava l'inconveniente di rispondere a induttori neurali non specifici ([Kintner e Melton, 1987], [Ruiz i Altaba, 1992]; citati in Gilbert S.F., 2001) anche se la dissociazione degli espianti ectodermici in soluzione salina provoca una parziale neuralizzazione in risposta all'attivazione della via delle “mitogen-activated protein kinase” o Mapk (e non come conseguenza della diluizione dei BMP, differentemente da quanto in precedenza creduto [Kuroda et al., 2005]).
Nell'ectoderma delle esogastrule di X. laevis fu dimostrata l'espressione di marcatori neurali, fra cui N-CAM. Oltre agli esperimenti di esogastrulazione anche un'altra metodica permetteva di osservare gli effetti dell'abolizione della via di induzione verticale: gli espianti a “sandwich” (o di Keller). In questa metodica due espianti contenenti il neuroectoderma presuntivo e il labbro dorsale venivano sovrapposti specularmente per impedire l'involuzione del mesoderma. In tali esperimenti sia l'ectoderma indotto che il mesoderma non involuto dell'Organizzatore mostravano una corretta regionalizzazione antero-posteriore ([Doniach et al., 1992]; Ruiz i Altaba, 1992; citati in Gilbert S.F., 2001). Tuttavia, l'importanza della componente verticale di induzione venne nuovamente sottolineata dall'inibizione dell'involuzione del mesoderma durante i diversi stadi di gastrulazione. Se l'involuzione veniva bloccata precocemente non si formava alcuna struttura dorsale, ma se il blocco avveniva allo stadio di medio-gastrula era la parte più anteriore del sistema nervoso a mancare ([Gerhart et al., 1989]; [Sharpe e Gurdon, 1990]; [Hemmati-Brivanlou et al., 1990]; citati in Gilbert S.F., 2001). Ciò indica la presenza di una via di segnalazione orizzontale che, in registro
con quella di natura verticale, era responsabile della regionalizzazione della parte posteriore del sistema nervoso (Doniach et al. 1992; recensito in Gilbert S.F., 2001).
1.4 Le molecole dell'induzione neurale
Gli esperimenti eseguiti da Niewkoop tra il 1969 e il 1985, per l'induzione mesodermica hanno mostrato la capacità degli espianti ectodermici (o calotte animali o “animal cap”) di essere riprogrammati verso un diverso destino differenziativo (recensito in [Gerhart J., 2001]). Quando gli “animal cap”, provenienti da embrioni allo stadio di blastula, venivano separati dal resto dell'embrione e tenuti in coltura, essi si sviluppavano in una epidermide atipica cioè prova di strutture morfologicamente distinguibili. Al contrario quando questi venivano posti in contatto con gli emisferi vegetativi, Nieuwkoop otteneva differenziamento di derivati mesodermici a partire dalle cellule della calotta animale. La regionalizzazione del mesoderma ottenuto dipendeva dalla polarità dorso-ventrale del frammento vegetativo utilizzato per l'induzione. Frammenti ventrali inducevano derivati come sangue e mesenchima, frammenti laterali provocavano la formazione di muscolo e reni, mentre quelli più dorsali inducevano la componente mesodermica dell'Organizzatore dalla quale deriveranno la notocorda e i somiti. Per questo motivo, le cellule vegetative-dorsali dell'embrione vennero chiamate centro di Nieuwkoop per la proprietà di induzione dell'Organizzatore di Spemann (recensito in Gerhart J., 2001).
Allo stesso modo, le calotte animali isolate potevano essere utilizzate come modello per lo studio delle molecole capaci di indurre un destino differenziativo neurale.
Nel 1992 Smith e Harland isolarono da una libreria plasmidica ottenuta da embrioni dorsalizzati, cioè privi delle strutture ventrali, il cDNA di noggin [Smith e Harland, 1992]. Essi videro che l'iniezione precoce dell'mRNA purificato da embrioni dorsalizzati, ottenuti mediante
trattamento con LiCl, era capace di dirigere la formazione di un nuovo asse dorsale in embrioni ventralizzati, privi delle strutture dorsali, ottenuti mediante trattamento con UV. Lo “screening” della libreria venne eseguito trascrivendo in vitro gli mRNA, provenienti da frazioni contenenti un numero sempre minore di plasmidi, che mantenevano la capacità di recuperare l'asse dorsale in embrioni ventralizzati. L'effetto di noggin è dose-dipendente ed elevate concentrazioni determinano negli embrioni ventralizzati soprattutto lo sviluppo delle regioni anteriori. L'espressione spazio-temporale del suo trascritto è del tutto coerente con i dati riguardanti l'Organizzatore. L'espressione zigotica inizia a livello del labbro dorsale del blastoporo per poi proseguire a livello della notocorda e della piastra precordale. La sua espressione si espande mediante trattamento con LiCl e e viene abolita mediante trattamento con UV. L'analisi del suo cDNA dimostra la presenza di una cornice di lettura aperta contenente una sequenza amino-terminale idrofobica con funzione di peptide segnale per la secrezione extracellulare (Smith e Harland, 1992). Nel 1993 Lamb, un'altra collaboratrice di Harland, dimostrò la capacità di noggin d'indurre tessuto neurale anteriore dalle calotte animali in assenza di marcatori mesodermici [Lamb et al., 1993].
Contemporaneamente, ma utilizzando un'altra metodica, il gruppo di De Robertis isolò il cDNA di chordin [Sasai et al., 1994]. Una libreria plasmidica di cDNA proveniente dal labbro dorsale del blastoporo venne replicata su filtro e vagliata mediante ibridazione con sonde radioattive prodotte da embrioni dorsalizzati e ventralizzati. I cloni positivi alle sonde provenienti dai primi e negativi a quelle dei secondi vennero ulteriormente saggiati per la capacità di indurre assi corporei ssecondari tramite l'iniezione dei corrispondenti mRNA nella regione ventrale di embrioni normali. La sua espressione è localizzata a livello del labbro dorsale del blastoporo e successivamente nel mesoderma della notocorda (Sasai et al., 1994).
Un terzo possibile induttore, la Follistatina, fu scoperto nel corso di uno studio rivolto a chiarire il ruolo della molecola secreta attivina nell'induzione mesodermica. Iniettando negli embrioni l'mRNA per una forma mutante, dominante negativa del recettore per l'attivina, si osservò
l'espressione di marcatori proteici neurali nell'ectoderma. Questo risultato metteva in luce la capacità del recettore per l'attivina di legare inibitori della neurulazione [Hemmati-Brivanlou et al., 1994]. Nel 1994 Hemmati-Brivanlou e Melton proposero il modello di “default” dell'induzione
neurale: “l'Organizzatore produce inibitori contro fattori anti-neuralizzanti”. Secondo questo
modello l'Organizzatore avrebbe un ruolo protettivo sull'ectoderma il cui futuro prospettico di base sarebbe quello di tessuto neurale e non di produrre epidermide (recensito in Gilbert S.F., 2001). A sostegno di questa teoria era l'osservazione che cellule ectodermiche dissociate differenziavano in senso neurale. La Follistatina è una proteina secreta dal labbro dorsale del blastoporo e successivamente dalla notocorda; la sua funzione è quella di legare l'attivina e altre molecole ad essa correlate, come le proteine morfogenetiche ossee (“bone morphogenetic protein” o BMP), impedendone il legame al loro recettore (Hemmati-Brivanlou et al., 1994).
Noggin, Chordin e Follistatina sono molecole secrete dall'Organizzatore di Spemann nello spazio intercellulare dove legano le molecole BMP, impedendone l'attivazione della via di segnale ([Piccolo et al., 1996]; [Zimmermann et al., 1996]; e recensito in [De Robertis et al., 2000]). I fattori di crescita BMP hanno il compito di regionalizzare e imprimere una connotazione ventrale ai tessuti circostanti [Reversade et al., 2005]. Nel caso dell'ectoderma l'effetto è quello di inibire il differenziamento in senso neurale.
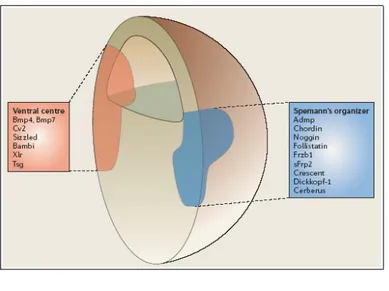
Nel corso degli anni sono state identificate altre molecole prodotte dall'Organizzatore, quali Cerberus, Frzb-1, Crescent e Dickkopf (recensito in De Robertis et al., 2000), ciascuna con funzione antagonista rispetto alle molecole BMP e Wnt (Fig 1.5). Parallelamente alla scoperta di questi nuovi fattori si è affermata l'idea che allo stadio di gastrula precoce esistesse un altro centro segnalatore, situato nella parte ventrale, che produce i fattori di crescita contro i quali l'Organizzatore produce i suoi antagonisti. Nel centro ventrale della gastrula, questo il nome dato al centro segnalatore, vengono prodotte molecole come Bmp4 e Bmp7, la proteasi Xolloid, in grado di degradare Chordin, e un cofattore che facilita il legame delle BMP ai propri recettori denominato
twisted-gastrulation (Tgs) (recensito in De Robertis, 2006). Un aspetto ancora più interessante è stato la scoperta che ciascuno dei centri segnalatori della gastrula mostra un meccanismo di controllo a “feedback” negativo rivolto al mantenimento entro livelli fisiologici dei segnali prodotti. L'Organizzatore di Spemann produce un fattore di crescita appartenente alla famiglia BMP in risposta ai bassi livelli delle molecole Bmp4 e Bmp7, mentre il centro ventrale della gastrula produce Bambi, un recettore che funziona come un dominante negativo nei confronti delle molecole BMP, e crossveinless-2 (Cv2), una molecola che contiene motivi di legame alle BMP simili a quelli di Chordin, in risposta a elevati livelli delle molecole BMP (recensito in De Robertis, 2006).
1.5 Noggin nei Vertebrati superiori
La forma umana di Noggin è composta da 205 aminoacidi (residui 28-232) dopo la rimozione del peptide segnale (residui 1-27), e viene secreta come proteina omodimerica covalentemente legata e glicosilata. La sua struttura primaria consiste di una metà aminoterminale acida e una carbossiterminale ricca in cisteine, che non mostrano alcuna apparente omologia strutturale con
Fig. 1.5 – Localizzazione del centro ventrale e dell'Organizzatore di Spemann allo stadio di gastrula e elencazione dei relativi fattori prodotti (De Robertis, 2006).
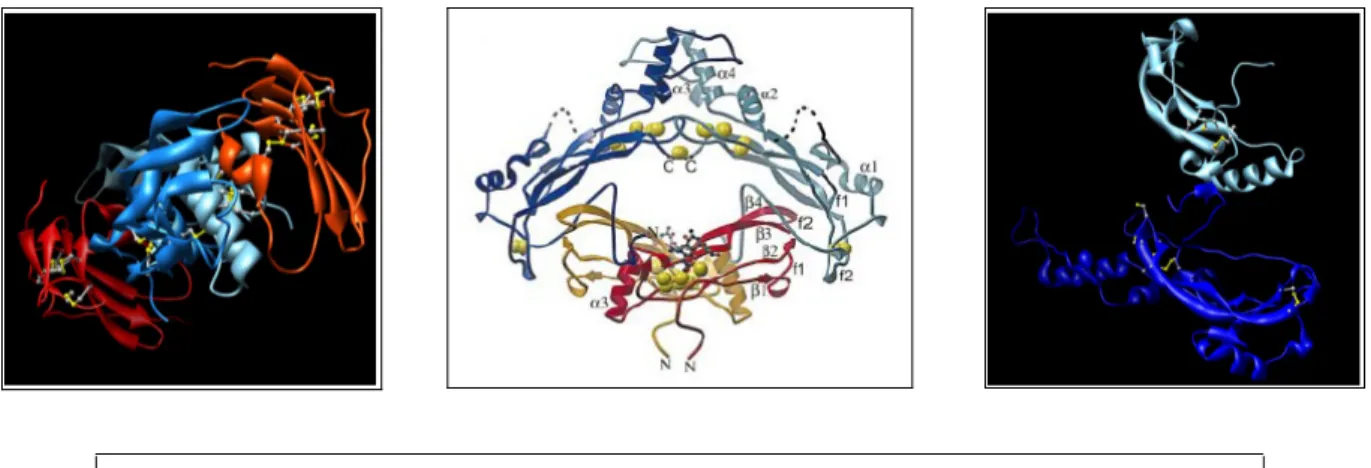
altre proteine. La parte centrale della proteina contiene un segmento fortemente basico di legame all'eparina che ha la funzione di mantenere Noggin adeso alla superficie cellulare, impedendone la diffusione. Noggin è un antagonista specifico dei fattori secreti BMP e mostra un'elevata affinità per BMP4 ed una minore affinità per BMP7. La risoluzione del complesso proteico non covalente Noggin-BMP7 ha evidenziato che la capacità di bloccare la via di segnale dei BMP deriva dalla capacità di Noggin di mimare la modalità di legame dei due tipi di recettore ai loro ligandi [Groppe et al., 2002] (Fig 1.6).
Nel topo, Noggin viene prodotto dal nodo, una struttura omologa all'Organizzatore di Spemann. Il nodo e l'endoderma viscerale anteriore, un altro centro segnalatore importante per lo sviluppo del topo, svolgono una funzione sovrapponibile a quella esercitata dal mesendoderma di
Xenopus. Questa regione profonda della zona dorsale della gastrula contiene le cellule
dell'Organizzatore di Spemann e l'endoderma anteriore prospettico, entrambi importanti per la formazione della testa dell'embrione. Nei due sistemi questi centri segnalatori esprimono geni omologhi come Hesx-1, Lim-1 e Otx2. La condizione di omozigosi per la mutazione di ciascuno di
Fig. 1.6 – Visione tridimensionale dei complessi BMP7-BMPR o BMP7-Noggin. A sinistra:
Complesso BMP7 (celeste-azzurro) con il segmento esterno del suo recettore (rosso-arancione); al centro: complesso BMP7 (arancione-rosso) con Noggin (celeste-azzurro; Groppe et al., 2002); a destra: legame tra noggin (blu) e BMP7 (celeste).
Molecular graphics images were produced using the UCSF Chimera package from the Resource for Biocomputing, Visualization, and Informatics at the University of California, San Francisco (supported by NIH P41 RR-01081).([Pettersen et al., 2004]; http://www.cgl.ucsf.edu/chimera)
questi geni comporta l'assenza del SNC anteriore nel topo ([Acampora et al., 1995]; [Shawlot e Behringer, 1995] ; [Dattani et al., 1998]).
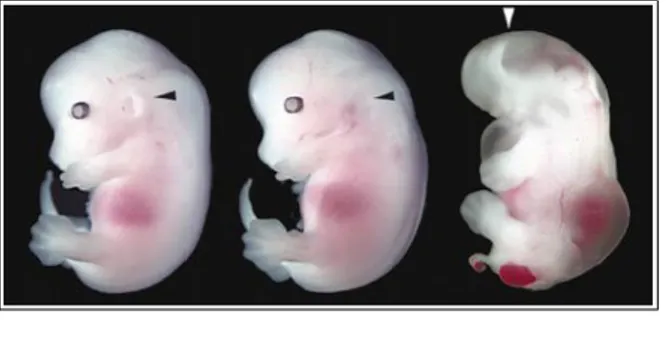
Tuttavia l'inattivazione di chordin non influisce sullo sviluppo precoce e sull'induzione neurale, ma causa delle anormalità di sviluppo successive, a livello dell'orecchio interno ed esterno, dell'organizzazione cardiovascolare e faringea [Bachiller et al., 2000]. In maniera simile l'inattivazione di noggin non altera la gastrulazione e la regionalizzazione del sistema nervoso centrale anteriore, ma causa una serie di anomalie successive che coinvolgono i somiti e la spina dorsale posteriore (Bachiller et al., 2000). Questi risultati, apparentemente in contraddizione con l'effetto d'induzione neurale anteriore indotta nelle cellule di “animal cap” di Xenopus, sono spiegabili alla luce di una ridondanza di questi due prodotti genici nello sviluppo del sistema nervoso. Solo la condizione di doppia mutazione produce topi privi del prosencefalo, occhi, naso e strutture facciali (agnatia). In questi topi il telencefalo e il diencefalo sono ridotti a una piccola vescicola composta da un sottile strato di neuroepitelio, mentre la maggior parte delle strutture nervose posteriori sono pressoché normali (Bachiller et al., 2000) (Fig 1.7).
Noggin, BMP e i loro recettori, continuano ad essere espressi anche nel cervello adulto dei Mammiferi, a livello della zona subventricolare (SVZ) della parete dei ventricoli laterali. È stato dimostrato che il loro antagonismo è importante anche all'interno di particolari microambienti
Fig. 1.7 – Effetti fenotipici degli embrioni Chd-/-;Nog+/+ e Chd-/-;Nog-/-.A sinistra: Embrione normale a
(nicchie) ai fini del mantenimento delle cellule staminali neurali e per il loro differenziamento neurogenico. Noggin è infatti espresso a livello delle cellule ependimali mentre i BMP e i loro recettori sono espressi a livello della SVZ adiacente. Noggin potenzia la formazione di nuovi neuroni dai precursori della SVZ, mentre i BMP contrastano questo processo e inducono il differenziamento in senso gliale [Lim et al., 2000].
Altre informazioni derivano dall'uso di Noggin nel differenziamento delle cellule staminali embrionali umane (hESC). Recentemente è stato dimostrato che quando le hESC vengono coltivate come aggregati galleggianti in mezzi definiti e in presenza di Noggin, il differenziamento in senso non-neurale viene soppresso ed inoltre gli aggregati si sviluppano in sfere altamente arricchite in precursori neurali proliferanti [Itsykson et al., 2005]. Tali precursori hanno la capacità di differenziarsi in neuroni maturi, astrociti e oligodendrociti. Le diverse popolazioni appaiono con una frequenza dipendente dai tempi di coltura, infatti tempi prolungati inducono un passaggio dal destino neuronale ad uno gliale. Tuttavia questi risultati sono in accordo con il modello citogenetico proposto durante lo sviluppo neurale precoce: (i) formazione e proliferazione dei precursori neurali, (ii) neurogenesi e (iii) gliogenesi (Itsykson et al., 2005).
L'insieme di questi dati dimostra l'elevato grado di conservazione dell'attività biologica esercitata da Noggin all'interno delle specie.
1.6 Competenza, specificazione e differenziamento del tessuto
retinico
Xenopus laevis costituisce un buon modello per lo studio, in vivo, dei meccanismi preposti al
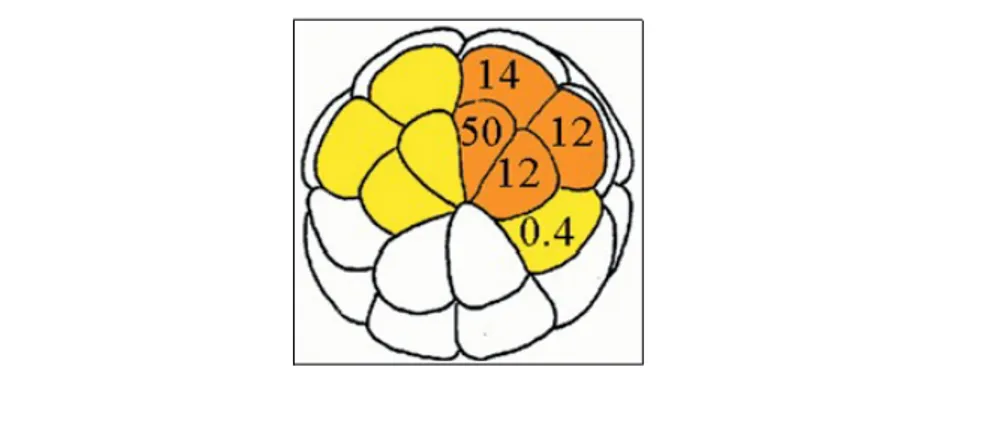
differenziamento retinico. Tutti i tipi cellulari presenti nella retina matura derivano da nove blastomeri situati nella regione dorso-animale dell'embrione allo stadio di trentadue cellule (recensito in [Moore e Moody, 1999]; [Kenyon et al., 2001] e [Zaghloul et al., 2005]) (Fig 1.8).
Esperimenti di “cell lineage”, ottenuti mediante l'iniezione precoce di traccianti, mettono in evidenza il diverso contributo quantitativo di ciascuno di questi blastomeri alla formazione del tessuto retinico [Huang e Moody, 1993]. Il trapianto in posizioni diverse da quella di origine dimostra che a questo stadio di sviluppo tali cellule non sono determinate nel loro differenziamento in senso retinico, bensì risentono dei segnali provenienti dalle regioni circostanti dell'embrione (recensito in Moore e Moody, 1999; e in Kenyon et al., 2001). Se i blastomeri a più alto contributo retinogenico vengono trapiantati nella regione ventro-vegetativa dell'embrione, deputata alla formazione dell'intestino e della coda, questi non si sviluppano in retina [Gallagher et al., 1991]. Se, al contrario, dei blastomeri provenienti dalla regione ventro-animale o equatoriale, incapaci di formare tessuto retinico, vengono trapiantati nella regione dorsale essi contribuiscono alla formazione della retina (Huang e Moody, 1993). Se ne deduce che l'informazione posizionale all'interno degli emisferi animali contribuisce a individuare i blastomeri che daranno luogo ad una discendenza retinogenica.
Un ruolo chiave in questo contesto, come abbiano visto, è svolto dalla via delle proteine morfogenetiche ossee (BMP), appartenenti alla famiglia del fattore di crescita trasformante β (TGFβ), e in particolare dal fattore Bmp4. Durante la gastrulazione di Xenopus, Bmp4 è espresso in un dominio ventrale situato in posizione diametralmente opposta rispetto all'Organizzatore di
Fig. 1.8 – Embrione di Xenopus allo stadio di trentadue cellule. Il numero presente in ciascun
blastomero indica la percentuale di contributo alla formazione del tessuto retinico. In giallo sono indicate le cellule che contribuiscono con una percentuale inferiore all'1%. In arancione quelle a maggiore contributo retinogenico (Zaghloul et al., 2005).
Spemann denominato centro ventrale della gastrula (Reversade et al., 2005).
Se il trascritto di Bmp4 viene iniettato nei blastomeri a maggiore contributo retinogenico questi perdono la capacità di formare retina, al contrario l'iniezione del trascritto di noggin, un inibitore di Bmp4 espresso dall'Organizzatore, nei blastomeri animali non retinogenici determina un'acquisizione di competenza verso il destino retinico (Moore e Moody, 1999).
Questi dati indicano che il primo evento necessario per acquisire la competenza retinica coincide con l'individuazione del tessuto neurogenico.
1.6.1 Geni di specificazione delle cellule staminali retiniche
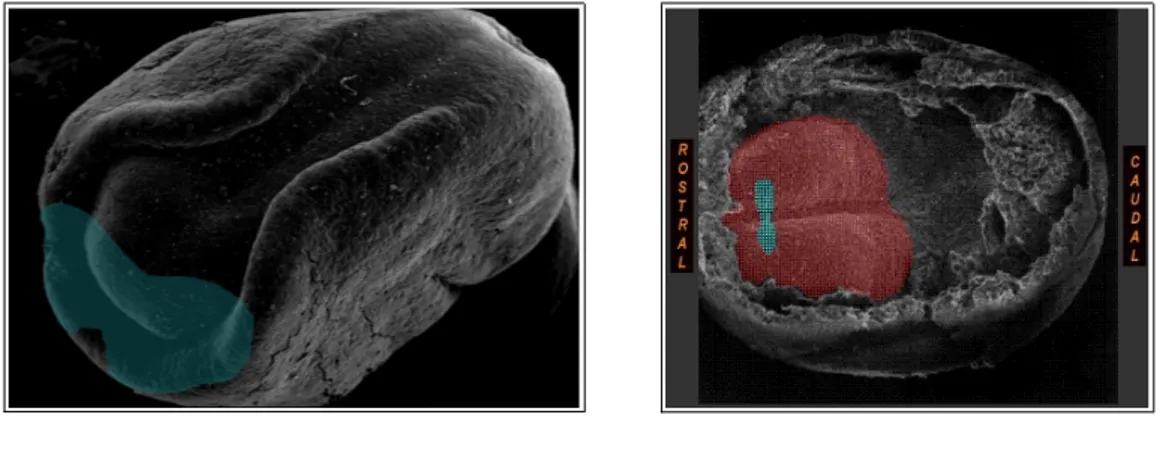
Esperimenti di trapianto dimostrano che l'intero territorio presuntivo della piastra neurale allo stadio di mediogastrula ha la capacità di formare retina (Kenyon et al., 2001), ma la specificazione del territorio neurale deputato allo sviluppo dell'occhio inizia verso il termine della gastrulazione tramite l'individuazione di un campo morfogenetico dell'occhio (“eye field”) nella parte anteriore della piastra neurale [Perron e Harris, 1998] (Fig. 1.9). Tale capacità di differenziarsi in tessuto retinico in un ambiente esterno all'embrione, coincide con l'espressione localizzata di alcuni geni estremamente conservati durante l'evoluzione (Kenyon et al., 2001).
Fig. 1.9 – A sinistra: campo morfogenetico dell'occhio in un embrione di Xenopus a stadio 15 (immagine
modificata da www.muhlenberg.edu ); A destra: campo morfogenetico dell'occhio (celeste) all'interno della regione anteriore della piastra neurale (rosso) nell'embrione di topo (www.med.unc.edu).
Pax6 è stato il primo gene, appartenente alla classe di geni contenenti “homeobox”, di cui si
sia dimostrata un'espressione spazio-temporale concorde con il processo di sviluppo dell'occhio nel topo (recensito in [Wawersik e Maas, 2000]). Le patologie causate dalle mutazioni di questo gene si trasmettono con una modalità semidominante: l'aploinsufficienza, ossia la presenza di una singola copia mutata, causa aniridia nell'uomo, e la condizione Small eye (Sey) nel topo. L'omozigosi causa anoftalmia e altri difetti a carico del sistema nervoso centrale (recensito in Wawersik e Maas, 2000; [Hanson, 2001]). Esperimenti di sovraespressione in Xenopus causano la formazione di lenti e tessuto retinico ectopici [Chow et al., 1999]. La ricerca degli omologhi di Pax6 in Drosophila ha portato all'identificazione di ey (eyeless) [Quiring et al., 1994] e toy (twin of eyeless) [Czerny et al., 1999], espressi a livello del disco immaginale dell'occhio. La perdita di funzione di ey impedisce la formazione dell'occhio, mentre la sovraespressione a livello dei dischi immaginali di zampe, antenne o ali causa la formazione di occhi ectopici. Toy è espresso più precocemente rispetto a ey e la sovraespressione comporta la formazione dell'occhio mediante l'attivazione di ey (Czerny et al., 1999). L'espressione di ey e toy non è però confinata all'occhio (recensito in Wawersik e Maas, 2000).
In Drosophila sono stati identificati anche altri geni coinvolti nello sviluppo dell'occhio, quali
sine oculis (so) [Cheyette et al., 1994], eyes absent (eya) [Bonini et al., 1993] e dachshund (dac)
[Mardon et al., 1994]. Ciascuno di essi mostra una modesta capacità di indurre occhi ectopici, ma la loro coespressione potenzia notevolmente l'effetto a causa di interazioni proteina-proteina (Hanson, 2001) (Fig 1.10).
Altre evidenze mostrano che toy, ey, so, eya e dac appartengono ad una stessa rete genica non rappresentabile semplicemente come una gerarchia lineare di interazioni (recensito in Wawersik e Maas, 2000; e in Hanson, 2001).
Molti degli omologhi di questi geni nei Vertebrati conservano il loro ruolo nello sviluppo dell'occhio. In particolare alcuni geni della famiglia Six (omologhi di so) sono espressi durante lo sviluppo della retina. Six3 e Optx2, altri due geni “homeobox”, risultano condividere un grado di omologia maggiore con Optix di Drosophila, un paralogo di so [Ghanbari et al., 2001]. La perdita di funzione di Six3 nell'uomo causa microftalmia e oloprosencefalia (recensito in Wawersik e Maas, 2000), mentre il guadagno di funzione nel teleosteo Medaka comporta la formazione di retine e lenti ectopiche [Loosli et al., 1999]. La perdita di funzione di Optx2 nell'uomo causa anoftalmia (recensito in Wawersik e Maas, 2000), mentre il guadagno di funzione in Xenopus comporta proliferazione delle cellule retiniche ([Zuber et al., 1999]; [Bernier et al., 2000]).
Otx1, Otx2 e Crx sono omologhi a orthodenticle di Drosophila, un gene “homeobox”
importante per lo sviluppo della testa e dei fotorecettori (recensito in Wawersik e Maas, 2000).
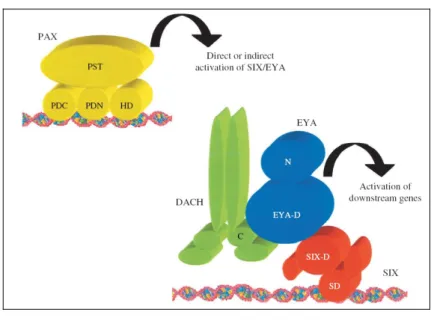
Fig. 1.10 – Interazioni molecolari nell'occhio di Drosophila. Ey (PAX) induce l'espressione di eya e so
che a loro volta sono necessari per l'espressione di dac. Le proteine so (SIX), eya e dac interagiscono per formare un fattore di trascrizione (Hanson, 2001).
Mutazioni di Otx2 nel topo portano ad anormalità di sviluppo dell'occhio, dell'orecchio e del cervello (Acampora et al., 1995; [Martinez-Morales et al., 2001]; [Nishida et al., 2003]). Il gene omeobox Rx/Rax è espresso a livello delle vescicole ottiche e contribuisce alla regionalizzazione neurale durante lo sviluppo del topo [Mathers et al., 1997]. Anche il suo omologo in Drosophila,
DRx, è espresso durante lo sviluppo della testa [Eggert et al., 1998]. TBX3, omologo a omb di Drosophila e ET di Xenopus, appartiene alla famiglia genica T-box ed è espresso a livello dello
strato nucleare interno della retina e nella lente durante lo sviluppo del topo [Sowden et al., 2001].
mtll, omologo a tailless (tll) di Drosophila e Xtll di Xenopus [Hollemann et al., 1998], è un recettore
nucleare orfano che funziona come attivatore trascrizionale monomerico ed è espresso nel prosencefalo e in particolare nelle vescicole ottiche durante lo sviluppo del topo [Yu et al., 2000]. L'omozigosi per la mutazione di questo gene porta a difetti di sviluppo dell'occhio e del cervello, e determina una condizione patologica definita “topo aggressivo” [Monaghan et al., 1997].
In Xenopus la sovraespressione di Xrx1 [Casarosa et al., 1997], XPax6 ([Hirsch e Harris, 1997]; [Altmann et al., 1997]), Xsix3 [Zhou et al., 2000], XOptx2 (Zuber et al., 1999) e ET [Li et al., 1997] nei progenitori del CNS causa la formazione di tessuto retinico ectopico o l'espansione del campo morfogenetico dell'occhio ([Andreazzoli et al., 1999]; Chow et al., 1999; Zuber et al., 1999; [Zuber et al., 2003]; [Gestri et al., 2005]). Ciò deriva dalla loro capacità di iniziare il programma retinogenico mediante l'induzione dell'espressione degli altri fattori di trascrizione del campo dell'occhio.
Tuttavia questa azione non risulta essere sufficiente ad indurre la formazione di tessuto retinico in territori soggetti all'azione anti-neuralizzante esercitata da Bmp4 (Kenyon et al., 2001). Si è visto comunque che Rx1, Pax6 e Otx2 hanno la capacità di influire sui movimenti cellulari durante la gastrulazione inducendo, con un'elevata frequenza, il posizionamento della progenie dei blastomeri iniettati all'interno della piastra neurale contribuendo così a partecipare alla formazione della retina (Kenyon et al., 2001). In modo complementare, la coespressione di Pax6 e noggin determina la
formazione di tessuto retinico ectopico (Kenyon et al., 2001).
Recentemente è stato dimostrato che in Xenopus la microiniezione contemporanea dell'RNA messaggero codificante per Rx1, Pax6, Six3, Optx2, ET, tll e Otx2 ad uno stadio molto precoce di sviluppo (stadio di due cellule) comporta la formazione di tessuto retinico ectopico con un'elevata frequenza ed anche in sedi molto distanti dal SNC (Zuber et al., 2003). Questi esperimenti dimostrano che la rete genica di cui fanno parte questi fattori è sufficiente a dirigere la formazione di un campo dell'occhio secondario.
Coerentemente con quanto osservato precedentemente riguardo all'effetto degli induttori neurali sull'induzione del destino retinico nelle cellule dell'emisfero animale, noggin ha la capacità di attivare l'espressione di tutti i fattori di trascrizione del campo dell'occhio, negli espianti ectodermici, con l'eccezione di ET (Zuber et al., 2003).
La repressione mostrata nei confronti di ET viene rimossa con un effetto dose-dipendente mediante l'azione di Otx2 (Zuber et al., 2003) (Fig. 1.11). Questo effetto è in accordo con il ruolo svolto da Otx2 durante le prime fasi della neurulazione, quando inizialmente la sua espressione
Fig. 1.11 – Effetto sugli “animal cap” non iniettati (U), iniettati con noggin o con Otx2 sull'espressione
dei fattori di trascrizione del campo dell'occhio (in A). Effetto della co-iniezione di noggin e dosi crescenti di Otx2 sull'espressione di ET (in B). Modello proposto di interazione tra noggin, Otx2 e ET (in C)(Zuber et al., 2003).
marca il confine tra futuro cervello anteriore e posteriore, mentre successivamente Otx2 viene represso dall'azione di Rx1 per individuare il confine retina-diencefalo (Andreazzoli et al., 1999) (Fig. 1.12).
Nel modello proposto di normale sviluppo quindi, inizialmente l'ectoderma sarebbe indotto a diventare piastra neurale grazie all'azione di induttori neurali (Moore e Moody, 1999; Kenyon et al., 2001; Zuber et al., 2003). Successivamente, l'azione transiente di Otx2 delimiterebbe la parte rostrale della piastra neurale acquisendo l'identità anteriore che serve per indurre l'espressione dei fattori di trascrizione del campo dell'occhio (Zuber et al., 2003) (Fig. 1.13).
Fig. 1.12 – Espressione precoce di Otx2 nel territorio del prosencefalo-mesencefalo presuntivo durante le
fasi precoci della neurulazione (A). Espressione transiente e complementare con Rx1 nella definizione del margine tra campo dell'occhio-diencefalo (B e C; Zuber et al., 2003).
Fig. 1.13 – Modello proposto di individuazione successiva della piastra neurale, della parte anteriore
presuntiva del cervello e del campo dell'occhio (sopra). Rete genica responsabile del meccanismo (sotto; Zuber et al., 2003).
1.6.2 Geni coinvolti nella specificazione dei Progenitori retinici e dei tipi
cellulari differenziati
Con il procedere dei processi morfogenetici che portano alla formazione dell'occhio altri geni iniziano ad essere espressi a livello delle vescicole ottiche. I geni Pax2 e Vax2 sono marcatori per il peduncolo ottico e la retina ventrale rispettivamente, mentre l'epitelio pigmentato e la retina dorsale esprimono inizialmente Pax6 e Rx1 (recensito in Zaghloul et al., 2005). Successivamente l'epitelio pigmentato esprime Otx2 e Mitf a spese di Pax6 e Rx1 (recensito in Zaghloul et al., 2005).
Per comprendere meglio le successive fasi che le cellule staminali retiniche intraprendono per formare cellule completamente differenziate è utile analizzare i processi che avvengono a livello della zona del margine ciliare (CMZ) degli Anfibi e dei Pesci (Fig 1.14). Questa regione ricapitola temporalmente e spazialmente gli eventi di regolazione genica embrionale che avvengono durante la retinogenesi [Perron et al., 1998]. Essa è responsabile del continuo accrescimento della retina in questi organismi mediante il progressivo differenziamento delle cellule staminali retiniche, situate nella regione più distale della CMZ e che esprimono Pax6, Six3, Rx1, Optx2 (Perron et al., 1998; Zuber et al., 1999) e situate nella regione più distale della CMZ, in progenitori altamente proliferanti, situati nella regione mediana della CMZ, e in progenitori post-mitotici indirizzati verso singoli destini cellulari, nella regione più prossimale alla retina matura (Perron et al., 1998; [Ohnuma et al., 2002]). Perciò lo studio della CMZ costituisce un ottimo modello del differenziamento retinico (Perron et al., 1998).
In base alle evidenze raccolte la CMZ può essere suddivisa in quattro zone (Fig 1.14). La zona
1 si trova nella parte più periferica della retina, accoglie le cellule staminali che, rispetto ai
retinoblasti ai quali danno origine, si dividono più lentamente ed esprimono geni del campo morfogenetico dell'occhio come Rx1, Six3 e Pax6. Queste cellule rinnovano continuamente sia l'epitelio pigmentato che la retina neurale (Perron et al., 1998; Ohnuma et al., 2002). La zona 2 contiene i retinoblasti in attiva proliferazione che esprimono i maggiori attivatori del ciclo cellulare come la ciclina D1, ciclina A2 e cdk2. In essi i geni del campo dell'occhio continuano ad essere attivi, ma iniziano anche ad essere espressi geni proneurali omologhi al complesso genico
achaete-scute di Drosophila, come Xash1 e Xash3, e geni neurogenici come X-Notch-1 e X-Delta-1,
implicati in fenomeni di inibizione laterale (Perron et al., 1998; Ohnuma et al., 2002). Nella zona 3 gli attivatori del ciclo cellulare iniziano ad essere repressi, in concomitanza con l'espressione di geni proneurali omologhi ad atonal di Drosophila, quali Xath5, Xath3 e XneuroD, che codificano per
fattori di trascizione bHLH (“basic Helix Loop Helix”); sono inoltre attivati inibitori del ciclo cellulare come p27Xic1. In particolare XneuroD è espresso a livello dei neuroblasti e dei neuroni in differenziamento. Durante questa fase inizia ad essere espresso anche Otx2 (Perron et al., 1998; Ohnuma et al., 2002). Nella zona 4 i precursori retinici appaiono come cellule che smettono di dividersi ed iniziano a differenziarsi. Ciò è permesso dallo spegnimento dei geni neurogenici ed dal mantenimento dell'espressione di alcuni geni proneurali (Perron et al., 1998; Ohnuma et al., 2002).
Una volta usciti dalla CMZ, i precursori postmitotici raggiungono la loro localizzazione finale, iniziano ad esprimere neurotrasmettitori o pigmenti visivi e sviluppano le loro corrette connessioni sinaptiche. Questo processo è regolato mediante un codice combinatorio di fattori di trascrizione appartenenti alla classe omeodominio e alla classe bHLH (Fig. 1.15). Tra i primi sono compresi fattori espressi precocemente durante la retinogenesi come Pax6, Rx1 e Six3, e fattori tardivi come
Otx2, Chx10 e Vsx1 (recensito in Zaghloul et al., 2005). Ai secondi appartengono geni neurogenici
precoci come Xash e Ngn e geni neurogenici tardivi come Xath e neuroD (recensito in [Vetter e Brown, 2001]).
Fig. 1.15 – Codice combinatorio dei fattori di trascrizione omeodominio e bHLH responsabili dell'indirizzamento dei progenitori verso destini cellulari specifici [Hatakeyama e Kageyama, 2004].
Otx2 e Chx10 risultano essere necessari per lo sviluppo delle cellule bipolari in Xenopus. Gli
esperimenti di lipofezione di Otx2 nei precursori retinici di Xenopus promuovono i differenzamento delle cellule bipolari a spese dei fotorecettori [Viczian et al., 2003]. Nel topo la sovraespressione mediante retrovirus di Otx2 promuove l'attivazione di Crx e differenziamento dei fotorecettori; mentre il mutante condizionale per questo gene promuove il differenziamento in cellule amacrine a spese dei fotorecettori (Nishida et al., 2003). Chx10 è espresso a livello dei progenitori retinici e delle cellule bipolari mature nel topo, la sua mutazione comporta l'insorgenza di microftalmia e l'assenza di cellule bipolari differenziate [Burmeister et al., 1996]. Esso coopera con Xash1 e Xath3 (Hatakeyama e Kageyama, 2004). Anche Vsx1 è espresso a livello dei neuroblasti in differenziamento e delle cellule bipolari ([Chow et al., 2001]; [D'Autilia et al., 2006] in press).
Altri fattori sono coinvolti nel differenziamento dei singoli tipi cellulari.
NeuroD, Xash1 e Otx5b, omologo a Crx di topo, sono importanti per il differenziamento dei
fotorecettori (Viczian et al., 2003; Hatakeyama e Kageyama, 2004). La lipofezione di Otx5 nei precursori retinici di Xenopus comporta un aumento dei fotorecettori, e una leggera diminuzione delle cellule gangliari, amacrine, orizzontali e cellule di Müller (Viczian et al., 2003). Mutazioni legate a Crx comportano l'insorgenza di malattie come la retinite pigmentosa, l'amaurosi congenita di Leber e la distrofia dei coni e dei bastoncelli ([Freund et al., 1997]; [Furukawa et al., 2002]). Insieme al fattore di trascrizione NRL, implicato nell'attivazione di geni specifici dei bastoncelli, Crx è responsabile dell'espressione del gene dell'opsina, un marcatore terminale di differenziamento dei fotorecettori [Whitaker e Knox, 2004].
Xath5, Xath3, Brn3d e Xbh1 sono coinvolti nella formazione delle cellule gangliari ([Poggi et
al., 2004]; [Liu et al., 2001]). Il mutante lakritz di Zebrafish, un ortologo di ath5, esibisce una riduzione delle cellule gangliari e un aumento di cellule amacrine, bipolari e glia di Müller [Kay et al., 2001]; similmente il topo mutante per Math5 è privo di cellule gangliari e di nervo ottico, ma mostra inoltre un aumento dei coni [Brown et al., 2001]. Al contrario la sovraespressione di Xath5
nei progenitori retinici di Xenopus causa un aumento delle cellule gangliari a spese di altri tipi cellulari quali amacrine, bipolari e glia di Müller [Kanekar et al., 1997]. Gli esperimenti di lipofezione di Xbh1 nei progenitori retinici in Xenopus comportano un aumento differenziativo verso il destino gangliare a spese di quello dei fotorecettori (Poggi et al., 2004). Prox1 regola l'uscita dei progenitori retinici dal ciclo cellulare ed è responsabile dello sviluppo delle cellule orizzontali [Dyer et al., 2003].
1.7 Cellule staminali embrionali: parallelismi tra cellule ES di
Mammifero e cellule di “animal cap” di Xenopus laevis
Lo studio delle cellule staminali embrionali di Mammifero (cellule ES) costituisce uno degli aspetti più interessanti della moderna biologia cellulare e dello sviluppo. Uno dei motivi principali riguarda il loro possibile utilizzo quale fonte di materiale di “ricambio” o veicolo di fattori trofici/protettivi, nei confronti di malattie degenerative che causano nei pazienti affetti la progressiva morte di specifiche popolazioni cellulari. Questo approccio viene identificato con il nome di “Terapia di trapianto basata sulle cellule staminali” e richiede che le cellule ES siano opportunamente trattate e fatte differenziare in vitro prima di essere somministrate (Fig. 1.16). Sono attualmente al centro dell'attenzione scientifica i protocolli sperimentali basati su queste strategie per la cura di malattie neurologiche come il Parkinson, l'Alzheimer, la corea di Huntington, la Sclerosi multipla e la Sclerosi laterale amiotrofica [Lindvall e Kokaia, 2006].
1.7.1 Sviluppo precoce del topo e caratteristiche delle cellule ES
Vediamo brevemente quali sono gli eventi iniziali nello sviluppo del topo che portano alla formazione delle cellule ES.
La fecondazione avviene all'interno dell'ovidotto e provoca il rapido completamento della meiosi nell'uovo che espelle il secondo globulo polare. Dopo circa 24 ore avviene la prima divisione di segmentazione e ciascuna delle seguenti impiega circa 12 ore per completarsi. Queste divisioni formano una sfera di cellule detta morula che ben presto subisce il fenomeno della
compattazione, che si realizza attraverso l'aumento dell'area di contatto tra cellule. In seguito alla
compattazione le cellule divengono polarizzate mediante la presenza di microvilli presenti solo sulla superficie esterna. Le divisioni successive hanno un orientamento sia radiale che tangenziale
Fig. 1.16 – Strategia di sostituzione cellulare basata sulle cellule staminali embrionali (Stem Cells:
comportando un posizionamento esterno di alcune cellule, che allo stadio di trentadue blastomeri sono in numero di circa venti. Successivamente l'embrione si sviluppa in una blastocisti (tre giorni e mezzo dopo la fecondazione) composta da una massa cellulare interna, derivata appunto dalle cellule interne alla morula, e da un trofoectoderma derivato dalle cellule superficiali della morula. Dal trofoectoderma deriveranno le strutture extraembrionali come la placenta che provvede al nutrimento dell'embrione. A questo punto il trofoectoderma inizia a pompare del fluido all'interno della blastocisti costringendo la massa cellulare interna su di un lato della superficie interna della blastocisti stessa. Tra il giorno 3,5 e il 4,5 di gestazione si distinguono due popolazioni diverse della massa cellulare interna. Le cellule più superficiali e in contatto con il liquido interno alla blastocisti divengono l'endoderma primitivo che contribuirà alla formazione delle membrane extraembrionali; mentre la restante parte costituisce l'epiblasto (o ectoderma primitivo) da cui deriverà l'embrione vero e proprio. Durante questo stadio l'embrione, che ormai ha raggiunto l'utero materno, si libera della zona pellucida, un rivestimento esterno composto da mucopolisaccaridi e glicoproteine, e si impianta nella parete uterina continuando nel suo regolare sviluppo.
Dalle cellule della massa cellulare interna della blastocisti vengono ricavate le cellule ES. Secondo quanto elencato nel “report” preparato dal “National Institutes of Health (NIH)” nel giugno 2001 (http://stemcells.nih.gov/info/screport/2001report.htm) i caratteri distintivi delle cellule ES di topo sono i seguenti:
• Derivano dalla massa cellulare interna (ICM)/epiblasto di una blastocisti;
• Hanno la capacità d'intraprendere un numero illimitato di divisioni simmetriche senza
differenziarsi (capacità definita come “self-renewal”);
• Esibiscono e mantengono un assetto cromosomico (cariotipo) stabile, completo e normale; • Le cellule ES sono pluripotenti e possono differenziarsi in tipi cellulari derivanti da tutti e tre i
foglietti germinativi embrionali (endoderma, mesoderma e ectoderma);
• Possono colonizzare la linea germinale dando luogo a spermatozoi e cellule uovo;
• Mostrano capacità clonogenica, cioè una singola cellula ES può dare luogo ad una colonia di
cellule geneticamente identiche, o cloni, che mostrano le stesse proprietà della cellula fondatrice;
• Esprimono il fattore di trascrizione Oct-4, che attiva o inibisce un cospicuo numero di geni
bersaglio mantenendo le cellule ES in uno stato proliferativo e non differenziato;
• Possono essere indotte a continuare a proliferare o a differenziarsi;
• Mancano del “checkpoint” della fase G1 del ciclo cellulare. Le cellule ES si trovano per la
maggior parte del loro tempo nella fase S del ciclo cellulare, durante il quale sintetizzano il DNA. A differenza delle cellule somatiche differenziate, esse non richiedono alcuno stimolo esterno per iniziare la replicazione del DNA;
• Non mostrano inattivazione del cromosoma X.
1.7.2 Sviluppo precoce di Xenopus e caratteristiche delle “Xenopus animal
cap embryonic stem cells” (ACES)
L'uovo non fecondato di X. laevis presenta una polarità basata sulla diversa distribuzione del vitello, che influenza l'orientamento delle prime divisioni di segmentazione. Il polo animale ne è privo, accoglie il nucleo e presenta una pigmentazione superficiale. Il polo vegetativo, opposto al primo, non è pigmentato, è ricco di vitello e per questo motivo è più pesante. La fecondazione avviene in un punto qualsiasi del polo animale e provoca il sollevamento della membrana vitellina. Nel giro di poco tempo (15 minuti) l'uovo si dispone secondo gravità all'interno della membrana vitellina rivolgendosi con la regione vegetativa verso il basso e la regione animale verso l'alto. Entro un'ora dalla fecondazione il citoplasma corticale ruota rispetto al citoplasma profondo e approssimativamente 90 minuti dopo la fecondazione lo zigote inizia a dividersi a intervalli di circa
20 minuti. Il ritmo sostenuto delle prime divisioni di segmentazione porta rapidamente alla formazione di una blastula sferica contenente una cavità ripiena di liquido, detta blastocele, e situata nel polo animale. Le cellule ectodermiche che delimitano superiormente e lateralmente la cavità blastocelica, regione denominata calotta animale, sono destinate a svilupparsi in epidermide e tessuto neurale (Fig 1.17). Le cellule vegetative sono più grandi, a causa del loro contenuto di deutoplasma, e delimitano inferiormente il blastocele.
Xenopus laevis costituisce un organismo d'elezione per lo studio della funzione genica e dei
meccanismi d'induzione embrionale. Le dimensioni dei suoi embrioni e la resistenza nei confronti delle infezioni ne consentono l'uso in esperimenti di chirurgia, inoltre l'assenza di reazioni di rigetto permette l'esecuzione di saggi di trapianto e ricombinazione tissutale. Infine i tessuti prelevati possono essere coltivati e analizzati alla luce dei meccanismi comuni presenti nelle altre classi di Vertebrati [Ariizumi e Asashima, 2001].
Il saggio sulle calotte animali (o “animal cap assay”) è un semplice metodo utilizzato per testare, a livello istologico e molecolare, l'attività induttiva di alcuni fattori solubili [Okabayashi e Asashima, 2003]. Se coltivate in una soluzione salina per alcuni giorni, le calotte animali prelevate dalla blastula si sviluppano in epidermide atipica, ossia priva di evidenti strutture differenziate. Se alla soluzione salina vengono aggiunti degli induttori mesodermici o neurali si possono osservare corrispondenti strutture differenziate, che possono essere identificate mediante successive analisi
Fig. 1.17 – Embrione di Xenopus allo stadio di blastula e territori presuntivi di sviluppo [Delaune et
istologiche e molecolari . L'uso di singoli induttori, o combinazioni di essi, ha consentito di ottenere derivati di tutti e tre i foglietti germinativi embrionali a partire da cellule delle calotte animali (Okabayashi e Asashima, 2003). Un esempio è dato dall'effetto dose-dipendente dell'attivina, un potente induttore mesodermico (Fig 1.18). A basse concentrazioni essa induce la formazione di derivati mesodermici di natura ventrale (come il sangue), mentre ad alte concentrazioni provoca la formazione di derivati mesodermici di natura dorsale (come muscoli, reni, cuore e notocorda) e endodermici (come il fegato) (Ariizumi e Asashima, 2001). Per quanto riguarda l'effetto degli induttori neurali (come Noggin, Chordin e Follistatina) sulle cellule delle calotte animali, essi hanno la capacità di indurre il differenziamento in senso neurale, ma non di organizzare istologicamente i tessuti indotti in strutture di ordine superiore come cervello e organi di senso (Okabayashi e Asashima, 2003). Per ottenere un differenziamento istologico, vengono utilizzate combinazioni di induttori neurali e mesodermici, o alternativamente saggi di ricombinazione tra calotte animali normali e trattate con soli induttori mesodermici (Okabayashi e Asashima, 2003).
I dati sopra elencati indicano la natura pluripotente delle cellule delle calotte animali.
Ulteriori evidenze mettono in risalto altri aspetti in comune con le cellule ES di topo. Le
Fig. 1.18 – Azione dose-dipendente dell'induttore mesodermico attivina sugli espianti ectodermici
cellule delle calotte animali possono essere indotte a proliferare mediante la coltura in mezzi nutrienti e supplementati [Fukui et al., 2003]. Recentemente anche in Xenopus è stato dimostrato il ruolo dell'omologo di Oct-4, nel mantenimento dello stato pluripotente delle cellule durante le prime fasi di sviluppo [Morrison e Brickmann, 2006].
1.7.3 Terapie cellulari contro le malattie degenerative della retina
Sotto il nome di Retinite Pigmentosa (RP) rientrano un gruppo di malattie ereditarie, presenti nella popolazione con una frequenza di 1 persona su 3.500-4.000 nati vivi, con caratteristiche variabili che possono portare alla totale cecità (fonte Telethon). In generale, le malattie degenerative della retina comportano la perdita della percezione visiva attraverso l'attuazione di un processo multifasico che inizia con la morte dei fotorecettori e prosegue con il rimodellamento delle connessioni sinaptiche e con la perdita degli altri tipi cellulari della retina neurale (Fig. 1.19; [Marc et al., 2003]). L'eterogeneità delle mutazioni che possono comportare l'insorgenza della RP incoraggia l'uso di terapie cellulari volte alla cura di queste malattie, purchè queste siano indirizzate verso la sostituzione di tutti i tipi cellulari affetti dalla degenerazione.
Per le loro caratteristiche pluripotenti le cellule ES sembrano essere un ottimo candidato per l'allestimento di protocolli di differenziamento in vitro di cellule retiniche.
1.8 Scopo della tesi
Esperimenti emergenti dimostrano come l'inibizione della via di segnalazione di BMP4 giochi un ruolo importante nel processo di acquisizione del destino retinico da parte delle cellule di “animal cap” di Xenopus laevis. Inoltre, la produzione di tessuto retinico ectopico ad opera dell'iniezione precoce degli mRNA sintetici dei fattori di trascrizione del campo dell'occhio, apre nuove prospettive nella possibilità di indurre il differenziamento in vitro di cellule retiniche.
Scopo di questa tesi è indurre un destino retinico multipotente nelle cellule di “animal cap” di
X. laevis mediante la sovraespressione di geni coinvolti nello sviluppo e nel differenziamento Fig. 1.19 – Degenerazione e rimodellamento retinico nei Mammiferi (Marc et al., 2003).
dell'occhio.
L'acquisizione della competenza retinica è stata misurata in vitro, mediante un'analisi per RT-PCR dell'espressione di marcatori specifici per l'occhio. Inoltre gli “animal cap” sono stati utilizzati
in vivo per saggi di recupero. In questi esperimenti metà del campo morfogenetico dell'occhio di