Caratteristiche dei pazienti
Sono risultati valutabili ai fini dello studio 17 pazienti arruolati dal novembre 2009 al dicembre 2010, che hanno quindi terminato il trattamento a fine dicembre 2011.
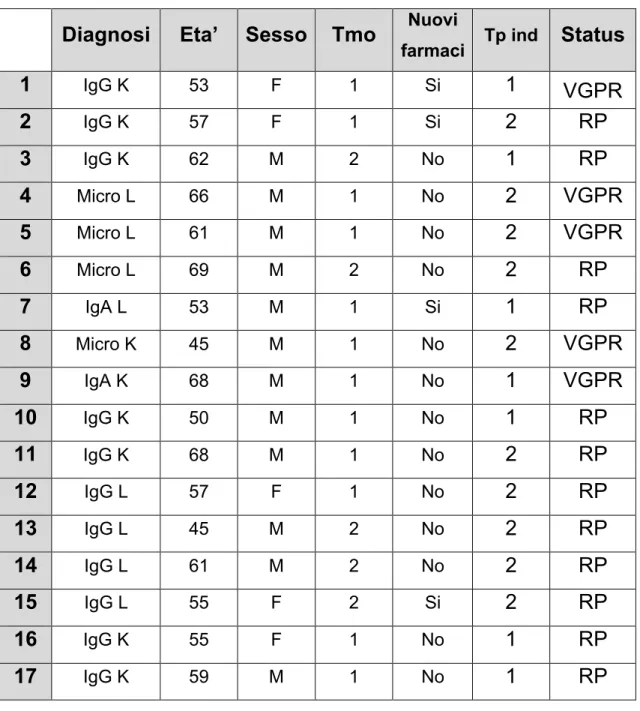
Le caratteristiche dei pazienti sono riassunte nelle tabelle 2 e 3. I parametri che sono stati considerati sono sesso, età, tipo di malattia mielomatosa, numero di trapianto effettuato, numero di terapie di induzione eseguite prima della procedura trapiantologia, status malattia al momento dell’inizio del trattamento. Le terapie sono state raggruppate in due macro categorie denominate in base al ricorso a “ nuovi farmaci”, ovvero, in caso contrario “no nuovi farmaci”. Nel primo gruppo quindi sono comprese le terapie contenenti bortezomib e farmaci immomodulatori quali talidomide e lenalidomide.
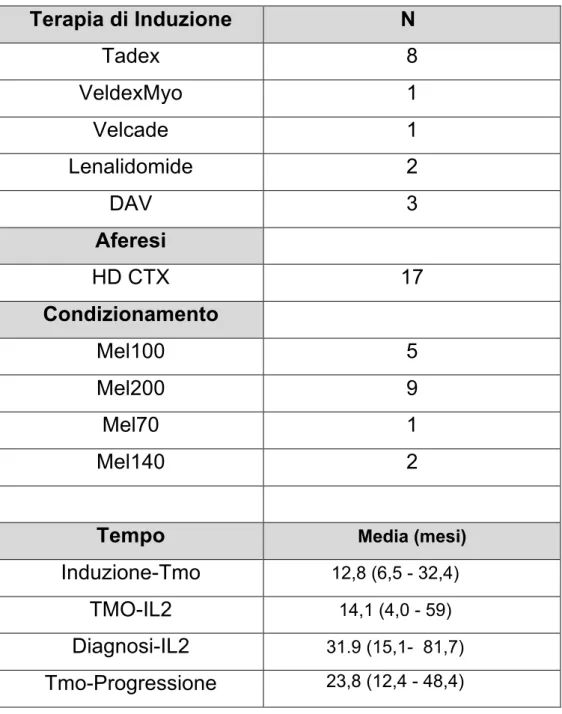
Le terapie effettuate dai pazienti sono riassunte in dettaglio in
tabella 4, sia per quanto riguarda il tipo di terapia d’induzione, la
modalità di recupero di cellule staminali periferiche e il tipo di condizionamento pre-trapiantologico
Per quanto riguarda le analisi relative ai parametri cronologici sono stati considerati: tempo diagnosi-inizio terapia con IL2, tempo tra trapianto ed inizio terapia con IL2, tempo passato tra la fine della terapia di induzione e la procedura trapiantologica e, infine il tempo alla progressione dalla procedura trapiantologica. Per quanto riguarda i dati relativi al trattamento effettuati abbiamo considerato il numero di cicli effettuati, la dose massima di IL2
tollerata, la presenza di tossicita’, la possibilità che la terapia fosse stata ridotta per tossicita’ oppure interrotta.
Valutazione clinica
La valutazione clinica (prima, durante ed al termine dello studio) e’ stata effettuata in accordo con i criteri dell’International Myeloma Working Group73. Una valutazione clinica e’ stata effettuata ogni 3 mesi con esami di laboratorio ed una valutazione clinica completa di esame midollare e’ stata effettuata ogni sei mesi. All’inizio dello studio ed alla fine dello studio veniva effettuata anche una valutazione delle eventuali localizzazioni ossee di malattia a meno che i pazienti non lamentassero dolore potenzialmente riferibile a tale evento.
Valutazione tollerabilita’
Le valutazioni di sicurezza si sono basate sulla registrazione di tutti gli eventi avversi ed eventi avversi seri, sulle condizioni fisiche generali. La gravità degli eventi avversi e’stata stabilita secondo i criteri NCI CTC (National Cancer Institute – Common Toxicity Criteria).
Analisi citofluorimetrica
L’analisi citofluorimetrica e’ stata effettuata tramite citofluorimetro BD FACScanto II. Sono stati utilizzati i seguenti gate rispettivamente per le analisi su sangue periferico e midollare:
Periferico Gate specificità
Linfociti CD3 CD3 TCR gammadelta TCR gammadelta CD27+CD45RO+ CD27-CD45RO+ CD27+CD45RA+ CD27-CD45RA+ CD57+ Vdelta2/Vgamma9+ CD69+ CD27+ Linfociti CD4+ CD8+ CD4+CD25+ CD127+ CD8+CD25+ NK (16/56+CD3-)
Midollo Gate specificità
Linfociti CD3+ CD3 TCR gammadelta NO Gate CD38+CD138+ CD38+CD138+ CD56+ CD19+ CD45+
Sono stati utilizzati i seguenti anticorpi monoclonali: Ac Anti CD3 Am Cyan; Ac anti CD8 APC-Cy7; Ac Anti CD45 Am Cyan; Ac anti CD138 PerCP-Cy 5,5’; Ac anti CD19 APC-Cy7 ; Ac anti CD38 PE’ (HB-7); Ac anti TCR gd PE* ; AC anti CD25 PE* (2A3); Ac anti CD4 FITC (SK3); Ac anti CD57 FITC; Ac anti CD45RA PE-Cy7 ; Ac anti CD45RO APC ; Ac anti CD56 APC (NCAM 16.2) ; Ac anti CD16 FITC (Leu 11a) ; Ac anti δ9 FITC Mouse anti Humat Vd9 Tcr ; Ac anti g2 PE Mouse anti Humat Tcr; Ac anti CD27 APC ; Ac anti CD127 PE Tcr . Tutti gli anticorpi sono prodotti da BD Bioscience, San Jose, California, USA). L’analisi citofluorimetrica e’ stata effettuata tramite software il Facs DIVA software. Per le analisi su sangue periferico sono state acquisiti 100000 eventi, su sangue midollare 500000 eventi.
Analisi statistica
L’analisi statistica è stata effettuata con software Prism for Mac Os, versione 5.0. Le differenze statistiche tra gruppi di variabili sono state effettuate secondo test t di student. Le analisi di PFS e OS sono state effettuate attraverso analisi Kaplan-Meier.
RISULTATI
Risposte cliniche
Dopo sei mesi di trattamento in 13 pazienti (76,4%) la malattia
rimaneva stabile (SD). In quattro pazienti (23,6%) con precedente VGPR (very good partial remission) è stata notata una ricomparsa della componente monoclonale all’elettroforesi sierica e sono stati considerati in PR (partial remission). All’interno dei pazienti considerabili con in malattia stabile è stata notata un aumento della componente monoclonale almeno del 25% in 6 casi (35,2%); in un paziente la componente monoclonale si è ridotta. Per quanto riguarda l’infiltrazione midollare in cinque pazienti è aumentata (29,4%), in uno è diminuita (5,9%), nel resto dei casi non è cambiata.
Alla fine del trattamento la valutazione dei paziente era la seguente: SD 10 (58,9%) , CR (complete remission) 1 (5,8%), PD (progressive disease) 6 (35,3%). All’interno dei pazienti in SD la componente monoclonale risultava aumentata in 7 (41,1%). Per quanto riguarda l’infiltrazione midollare in 5 pazienti (29,4%) è aumentata, in uno e’ diminuita (5,9%), nel resto dei casi non e’ cambiata. Le risposte cliniche sono riassunte in tabella 5.
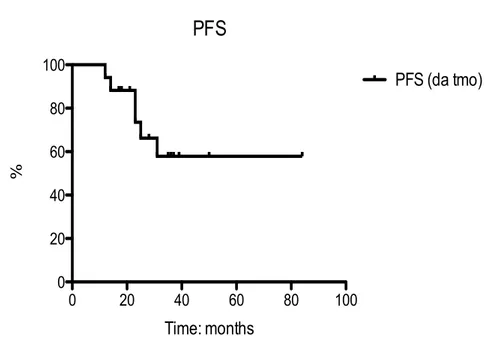
La Progression free survival calcolata dal tempo del trapianto e’ stata del 57,9 % (Fig 1). La sopravvivenza mediana non e’ stata raggiunta. Sono state eseguite analisi delle seguenti variabili per verificarne l’impatto sulla PFS: tipo di diagnosi I (macro vs micromolecolare), tipo di diagnosi II II (Kappa vs lambda), tempo TMO – IL 2 (< 6 mesi ; 6 < x < 12 mesi ; > 12 mesi), numero ti terapie pre TMO ( < = 1 vs > 1), Numero di trapianti (1 vs 2) Tipo
di terapia pre trapianto (nuovi farmaci vs terapie tradizionali) , Status pre trattamento (VGPR vs PR). Nessuna di queste variabili e’ risultata statisticamente significativa. Per quanto riguarda i pazienti progrediti la progressione, secondo i criteri CRAB e’ stata caratterizzata da insufficienza renale in un caso, anemia isolata in un altro caso, soltanto ossea in due casi e, nei rimanenti due pazienti, interessamento osseo ed anemia. In tutti i pazienti (100%) la progressione clinica e’ stata accompagnata da aumento della componente monoclonale.
Fig. 1 Progression Free survival 57,9%
PFS 0 20 40 60 80 100 0 20 40 60 80 100 PFS (da tmo) Time: months %
Tossicita’
Durante il trattamento tutti i pazienti (100%) hanno manifestato sintomi sistemici riferibili al trattamento con IL2. Tali sintomi erano attesi in seguito al trattamento. Tra i sintomi riferibili a questa categoria abbiamo considerato, astenia, iperpiressia, mialgie, dolori articolari , cefalea e sensazione di confusione, Quest’ultima sintomatologia talora e’ scomparsa con l’interruzione dell’assunzione di antistaminico, potendo quindi risultare potenzialmente iatrogena. In totale si sono verificati 48 eventi classificabili come ”sintomi sistemici” con massimo grado pari a III, con necessità di riduzione di dose. In conseguenza di tali sintomi la dose massima tollerata dai pazienti e’ stata di 4,5 x 106
UI. In base a tale osservazione la dose massima successivamente considerata target e’ stata di 4,0x106 UI.
In 4 pazienti (23,5%, per un totale di 12 eventi) si sono verificati sintomatologia a livello dell’apparato gastroenterico con nausea, vomito diarrea e mucosite. Rispetto ad altre tossicità e’ stata notata una correlazione tra dose di interleuchina 2 e comparsa dei sintomi. Grado massimo della tossicità II.
In 4 pazienti (23,5%, per un totale di 4 eventi) si sono verificate complicanze infettive. In un caso si e’ trattato di lieve faringodinia senza necessità di terapia antibiotica, in tre casi si e’ verificata febbre al di fuori del trattamento, con necessità di terapia antibiotica empirica. In un caso e’ stato necessario ricovero con terapia sistemica con pronta risoluzione del quadro clinico. Grado
massimo della tossicità III.
In otto pazienti (47,3%, totale 13 eventi), si e’ verificata tossicità a carico di cute/tegumenti, in cui abbiamo considerato rash diffuso e/o localizzato e dolore e rossore a livello della sede di inoculo (regione deltoidea). In un caso la tossicità cutanea e’ risultata dose indipendente con impossibilità all’esecuzione della terapia stessa ed interruzione dello studio. Grado massimo della tossicità III.
In due pazienti (11,7%, totale due eventi) si sono verificati, in forma lieve (CTC I), sintomi/segni riferibili all’apparato circolatorio come ipotensione e tachicardia. In quest’ultimo caso l’esecuzione di un ECG ha mostrato presenza di extrasistolia atriale saltuaria. Nessuna terapia e’ stata necessaria.
In un paziente (5,9%) si e’ verificato un aumento della glicemia con necessità di aumento delle terapia insulinica. Il paziente aveva diagnosi di diabete con necessità già di terapia insulinica. In tre pazienti (17,6%) il trattamento ha determinato un aumento ponderale, con, in un caso, necessità di iniziare terapia diuretica. Tale segno potrebbe sempre riferibile alle categoria di sintomi sistemici come alterazione della funzione endoteliale.
In un paziente (5,9%) si e’ verificato un noto evento avverso riferibile a terapia con zoledronico, come alterazioni odontoiatrica. Il paziente e’ uscito dallo studio, non si e’ verificata frattura della mandibola ma e’ stato necessario intervento di stabilizzazione odontoiatrico. Infine, sebbene non possa essere riferibile a tossicità, l’analisi degli esami ematochimici e dell’esame
con l’eccezione del riscontro di eosinofilia in tutti i pazienti, di grado variabile. Le tossicità sono riassunte in tabella 6.
Variazioni linfociti T γδ e sottopopolazioni γδ
L’'analisi dei linfociti T γδ è stata effettuata sia su sangue midollare che periferico. La prima ha riguardato soltanto i linfociti T γδ mentre su sangue periferico sono state analizzate le sottopopolazioni γ2δ9 ed i sottotipi linfocitarie CD45RO+/CD27+, CD45RA+/CD27+, CD45RO+/CD27-, CD45RA+/CD27-, CD27+, CD57+.
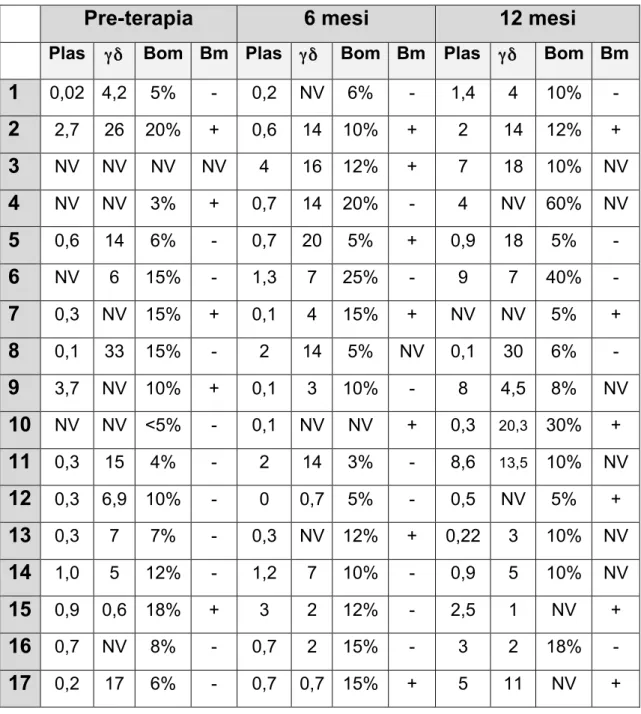
Per quanto riguarda la popolazione basale midollare γδ abbiamo notato una notevole variabilità con percentuali midollari tra 0,6 % e 33 %. Per sei pazienti (35,6%) non erano disponibili valori basali di linfociti T γδ. Per quanto riguarda le variazioni midollari di pazienti dopo sei mesi di trattamento in tre pazienti (17,6%) si e’ verificato un aumento della popolazione midollare, in quattro pazienti (23,5%) una diminuzione, in due (11,7%) e’ considerabile come stabile, in otto (47,0%) non erano valutabili.
Al termine del trattamento cinque pazienti (29,4%) si e’ verificato un aumento della popolazione midollare, in un pazienti (5,8%) una diminuzione, in otto (47,0%) e’ considerabile come stabile, in otto (27,7%) non erano valutabili.
pazienti le biopsie osteomidollare sono state riviste utilizzando un anticorpale per γδ in immunoistochimica. Le analisi con questa metodica non hanno consentito un adeguato riconoscimento dell’infiltrazione di linfociti γδ.
L’analisi midollare e le variazioni delle popolazioni linfocitarie sono riassunte in tabella 7.
Per quanto riguarda le analisi su sangue periferico i valori basali di linfociti γδ hanno mostrato un range tra 0,4 e 28 %. Di tutti i pazienti si sono calcolati i valori assoluti prima e dopo lo stimolo con interleuchina 2 e delle eventuali variazioni e’ stata calcolata l’eventuale significatività’ statistica.
Sono state notate le seguenti significatività.
In due pazienti (11,7%) si e’ notata una riduzione significativa del numero dei linfociti T γδ (pz 5 e pz 9, p=0,02 e p=0,0136) . Per quanto riguarda le sottopopolazioni aumento dei linfociti T γ2δ9 si
e’ notato in un paziente (pz 14, 5,8%, p<0,048), una riduzione dei CD45RA+/CD27+, in un pz (pz 9, 5,8% p=0,01), una riduzione dei CD45RA+/CD27-, in un pz (pz 5, 5,8% p<0,01), un aumento dei CD45RO+/CD27- si e’ notato in un pz (pz 4, p<0,05) , in uno una loro diminuzione dei CDRO+/CD27+ (pz 3, p=0,01). I CD27+ sono diminuiti in un paziente (pz 8, p=0,02), i linfociti T γδ CD57 sono diminuiti in un caso (pz 17,p<0,01).
Nei due pazienti in cui si e’ verificato un aumento significativo dei linfociti T γδ c’è stato in un caso una riduzione dei CD45+/CD27- parallelamente ad un aumento dei CD4/CD25. Nell’altro paziente si e’ assistito ad una riduzione di CD45RA+/CD27+, una riduzione
dei CD27+ ed una riduzione dei CD8+. Nel caso in cui si e’ verificato un aumento dei linfociti T γ2δ9 si e’ assistito ad un
aumento dei CD4/CD25 ed una riduzione dei CD8.
Per quanto riguarda l’andamento dei linfociti T γδ non si è verificato un loro aumento inter ciclo nei pazienti considerati, tranne nel paziente in cui sono statisticamente aumentati i linfociti T γ2δ9 . Sebbene non vi fossero alterazioni significative dei linfociti
T γδ in un paziente (pz 4) si è verificato un progressivo calo dei loro valori assoluti, sia nei valori pre che post stimolo con IL2 e zoledronato.
Variazioni linfociti T
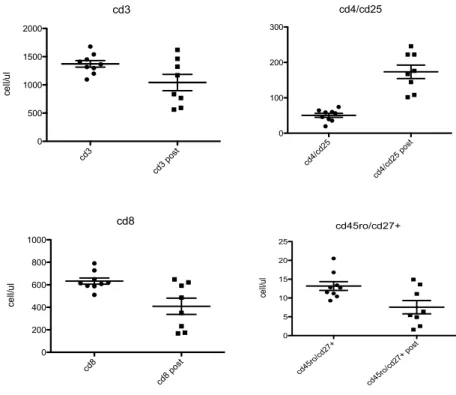
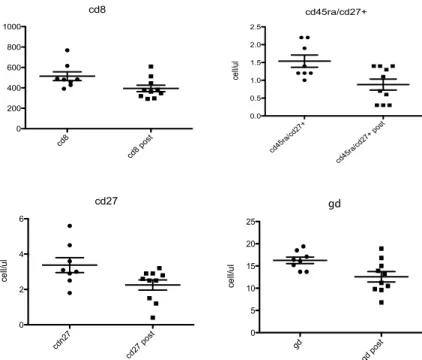
Si sono verificati le seguenti variazioni (pre e post terapia) statisticamente significative. I CD3 si sono ridotti in tre casi (17,6%, pz3,pz4,pz11, p=0,04, p=0,03 e p<0,01). I CD4 sono aumentati in un paziente (pz8, p=0,05) e ridotti in un altro (pz11, p=0,01). I CD8 si sono ridotti in due casi (pz 3 e pz 14, p<0,01 e p<0,01). I CD8/CD25+ sono aumentati in un caso (pz 16,p=0,036), le cellule NK CD16/CD56+/CD3- sono aumentate in un caso (pz12, p=0,045) e diminuite in un altro caso (pz16, p=0,00145). Le cellule CD4/CD25+ sono aumentate in dodici pazienti (70,6%).
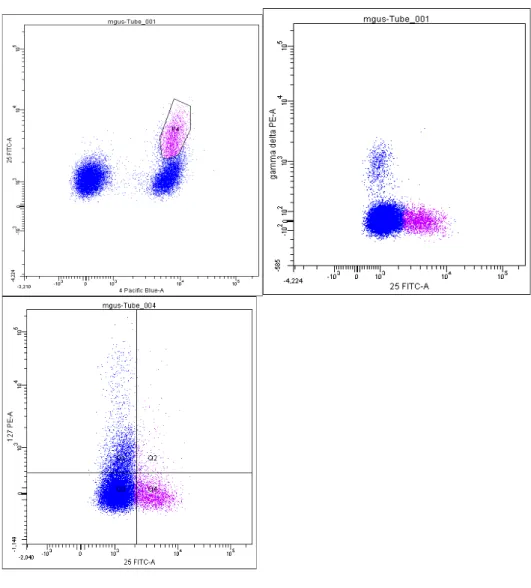
L’analisi citofluorimetrica effettuata sulla popolazione T CD4/CD25 con, rispettivamente Ac anti CD127 ed Ac anti Tcr γδ ha mostrano come tale popolazione mostrasse fenotipo:
CD4+/CD25+/CD127-/γδ -, compatibile con quello noto dei T regolatori.
Le variazioni delle popolazioni linfocitarie sono riassunte in tabella 8 ed il dettaglio di alcuni pazienti e dell’analisi citofluorimetrica T reg nelle Figure da 2 a 6.
Discussione
Il nostro lavoro ha mostrato come la somministrazione in vivo di Interleuchina 2 e zoledronato determini un aumento della popolazione T reg e, solo in alcune casi, variazioni nelle popolazioni γδ midollari e periferiche. Dal punto di vista clinico si sono osservate nei pazienti in studio risposte cliniche nell’ 11,7 %. L’associazione in vivo di interleuchina 2 e zoledronato come terapia mantenimento proposta è la prima esperienza in letteratura in pazienti con diagnosi di mieloma multiplo. Precedenti esperienze in questo setting di pazienti sono state effettuate in pazienti non responsivi ai trattamenti precedenti oppure recidivati. La nostra casistica comprende pazienti con caratteristiche eterogenee sia dal punto di vista delle terapie effettuate che come tempistica di arruolamento rispetto alla precedente terapia. Tutti i pazienti risultavano però nello stesso momento della storia clinica di malattia, in quando tutti quanti avevano effettuato una procedura di chemioterapia ad alte dose (autotrapianto).
Anche per quanto riguarda la tempistica dell’arruolamento i dati sono variabili con pazienti arruolati dopo poco più di tre mesi dal trapianto mentre in altri casi da più di un anno. La ricostituzione immunologica post trapianto in questi pazienti avrebbe potuto determinare una responsività diversa allo stimolo con IL2.
Dal punto di vista delle risposte cliniche la nostra esperienza si è dimostrata sostanzialmente in linea con quelle delle analoghe esperienze in vivo con IL2 e bifosfonati con una percentuale sovrapponibili se non migliori68,72. Wilhelm68, con
somministrazione in vivo di pamidronato e IL2 e.v. ha notato come non tutti i pazienti cui venivano somministrato il farmaco in una prima fase aumentassero i gamma delta con scarse risposte; in una seconda fase dello studio in cui soltanto i pazienti responsivi allo stimolo in vitro venivano sottoposti alla terapia, si assisteva ad una risposta del 33%. Una recente esperienza dello stesso gruppo, stavolta con somministrazione di IL s.c., in associazione con zoledronato, non ha mostrato alcuna risposta al trattamento in pazienti con mieloma.
Dei nostri pazienti 2 sono considerabili responsivi, con in un caso una negativizzazione dell’immunofissazione sierica con pertanto ottenimento di una remissione completa. Nell’altro paziente abbiamo assistito ad un calo della componente monoclonale e parallelamente ad un dimezzamento della quota midollare di malattia. Questi pazienti non avevano caratteristiche di malattia o di storia clinica peculiari rispetto agli altri pazienti. Il dato che è emerso, precedentemente non descritto, e’ come rispetto agli altri pazienti considerati avessero una quota maggiore di linfociti T γδ a livello midollare e periferico.
Per quanto riguarda le progressioni di malattia e la progression free survival osservate (57,9%) il dato ottenuto è sovrapponibile con quello che i dati della letteratura di PFS dopo trapianto (senza terapia di mantenimento)74, sebbene è necessario estendere il periodo del follow up ed il numero dei pazienti considerabili. Le variabili considerate per la stratificazione della PFS (tipo di terapia, risposta post trapianto, tempo dal trapianto ecc.) non hanno determinato variazioni statisticamente significative
verosimilmente a causa del numero di pazienti.
I pazienti progrediti avevano un quadro di progressione anch’esso variabile con interessamento midollare e conseguente anemia, insufficienza renale e lesioni osteolitiche. In tutti i pazienti la progressione clinica (considerata applicando i criteri CRAB) era sempre preceduta da un aumento della componente monoclonale, che rimane analoga a quella della diagnosi.
I risultati clinici in termine di progressione devono essere valutati alla luce della estrema variabilità della popolazione in studio sia come terapia effettuata che come periodo di tempo passato dalla procedura trapiantologica. Sebbene il primo criterio sia comune a molti studi relativi al trapianto autologo od a strategie di mantenimento, i nostri pazienti avevano in alcuni casi un follow up post trapiantologico di lunga durata. Pertanto alcune delle progressioni osservate possono rientrare nella storia clinica della malattia. Tra l’altro, relativamente ai pazienti trattati con farmaci di nuova generazioni (lenalidomide e bortezomib) recenti studi retrospettivi hanno messo in evidenza come in questi pazienti il periodo libero da malattia post trapiantologico sia minore.74
Il nostro studio e’ stato il primo ad analizzare parallelamente al sangue periferico anche il sangue midollare: purtroppo non tutti i pazienti avevano prelievi basali o, in ogni caso, una completezza dei dati midollari. Per ovviare a questo abbiamo provato ad effettuare una analogia istologica per individuare con Ac anti γδ , ma anche questa metodica non ha consentito di ottenere dati più completi .. Come abbiamo visto nei due casi responsivi si aveva una quota basale dei γδ maggiore e nel 29,4% si sia
verificato un aumento percentuale (di entità variabile), maggiore rispetto a quello osservato in periferia: sarebbe interessante approfondirne la natura con analisi dei γ2δ9 anche a tale livello. L’analisi delle tipizzazioni citofluorimetriche su sangue periferico prima e dopo lo stimolo di IL 2 non ha mostrato un aumento significativo della popolazione γδ , tranne in un caso. In quest’ultimo paziente l’aumento della popolazione γ2δ9 avveniva durante la settimana di trattamento per poi tornare a livelli basali sostanzialmente invariati durante i dodici mesi di terapia.
In due pazienti abbiamo notato un calo dei γδ anche con variabilità delle sottopopolazione γδ (presenti anche in altri casi senza alterazioni dei γδ totali), che risultavano però disomogenee. In particolare non si osserva una correlazione tra variazioni di γδ e relative sottopopolazioni. Inoltre le caratteristiche immunofenotipiche basali in questi casi non erano correlate con la variazione osservata. Parallelamente a tali cambiamenti post terapia sia in questi pazienti che in altri sono state osservate variazioni delle popolazioni T CD4,CD8, NK. Anche in questo caso non emergevano relazioni con caratteristiche pre terapia ed i dati non erano omogenei.
Alcuni lavori, eseguiti anche in pazienti ematologici, indicano come l‘ espansione dei linfociti T γδ appaia deficitaria in pazienti neoplastici52. Anche dopo stimolo con IL2 e zoledronato, da soli od in associazione, e’ stato osservato un fenomeno analogo ma più marcato in alcuni pazienti, tanto che alcuni possono essere definiti come “responder”, altri “no responder”68. Alcune
sottopopolazioni γδ sembra essere predittiva di tale status, in particolare la preponderanza della popolazione CD45RA+/CD27- TEMRA. Nei nostri pazienti la maggior parte (13/17 76,4%) aveva
tali caratteristiche di superficie e pertanto una possibile spiegazione della scarsa espansione dei T γδ potrebbe risiedere proprio nelle caratteristiche di “ no responders” nei nostri casi. Kunzmann68 ha difatti anche dimostrato come in color che mostrano in vitro una responsività all’espansione in γδ conservavano tale caratteristica in vivo che si rifletteva in risposte cliniche oggettivabili.
Recentemente Santos75 ha mostrato come e’ possibile definire in base alla distribuzione sulla superficie cellulare di alcuni proteine di superficie lo status di responders o meno: e’ interessante notare come le molecole implicate nel sistema recettoriale Kir, il cui ruolo nel riconoscimento delle cellule neoplastico e’ noto, assumano un ruolo centrale76.
Il dato che emerge in modo omogeneo nella maggior parte dei pazienti (70.5%), e’ l’aumento della popolazione CD4+/CD25+. L’analisi citofluorimetrica ha chiarito come si trattasse di Tαβ (una quota di γδ può essere CD4+), e attraverso l’utilizzo del CD127 (recettore IL7), per distinguere tra T attivati
(CD4+/CD25+/CD127+) e T regolatori (T reg
CD4+/CD25+/CD127-) , abbiamo messo in evidenza come si tratti di linfociti T regolatori (T reg)7. I T reg sono una popolazione
cellulare con ruolo di omeostasi del sistema immunitario79,80. L’interleuchina 2 è fondamentale per la loro omeostasi 81,82,83,84 e vari autori hanno messo in evidenza come somministrazione in
vivo di IL 2 possa determinare un aumento della popolazione T reg sia in pazienti affetti da neoplasie che in altri modelli sperimentali85. I nostri dati sono i primi a dimostrare in vivo come questo possa avvenire in una piattaforma sperimentale con IL 2 e zoledronato. In vitro è già stato notato come l’espansione in vitro di γδ stimolati con IL2 e zometa possa essere inibita da cellule T reg, verosimilmente con un mediatore solubile non identificato.86 In tale studio sia l’ipotesi di un meccanismo inibitorio diretto per via cellulare veniva escluso, sia di una competizione con IL 2 venivano esclusi.
L’aumento dei linfociti T reg si e’ verificato parallelamente ad un calo di alcune popolazioni T ed in un caso anche dei T γδ; d’altro canto nell’altro paziente in cui i γδ si sono ridotti i T reg non variavano e nel paziente con aumento dei γ2δ9 si assisteva parallelamente ad un aumento della popolazione dei T reg. Pertanto una diretta correlazione tra comportamento dei Treg ed inibizione dell’espansione dei γδ puo’ essere ipotizzato solo in parte osservando le variazioni delle sottopopolazioni in studio. L’aumento dei linfociti T reg potrebbe teoricamente influenzare il comportamento clinico dei pazienti poiché variazioni di tali popolazioni e il rapporto Treg/γδ sono stati messi in relazione con un’alterazione del controllo immunologico in senso antineoplastico87,88. Un aumento quindi della popolazione Treg quindi potrebbe rendere meno efficace tale controllo riflettendosi in un rischio di recidiva di malattia89. Nei nostri pazienti non e’ possibile affermare tale concetto: l’aumento dei livelli di Treg
si riduce con l’interruzione del ciclo stesso. Inoltre non abbiamo dati di natura funzionale per i quali sarà necessario un analisi in coltura delle sottopopolazioni evidenziate. Alcuni dati in letteratura indicano inoltre come i Treg, analogamente ad altre popolazioni linfocitarie appaiono malfunzionanti in pazienti con mieloma multiplo. Infine i dati relativi alla progression free survival appaiono in linea con quelli che sono descritti dalla letteratura. Per rendere più efficace lo stimolo in vivo di linfociti T γδ, oltre ad una migliore selezione dei pazienti potenzialmente più “responsivi” al trattamento, un nuovo approccio potrebbe essere quello di aggiungere farmaci che agiscono in modo diretto od indiretto sull’azione di killing dei T γδ: recenti reports90 indicano come l’azione sui recettori dell’istamina, già utilizzata in passato in combinazione con IL2 in malattie ematologiche91, aumenti le capacità di migrazione e citotossicità dei linfociti T γδ; anche l’utilizzo di anticorpi monoclonali di nuova generazione e’ stato descritto aumentare l’azione di citotossicità cellulo-mediata
anticorpo-dipendente (antibody- dependent cellular cytotoxicity,
ADCC)92.
Conclusioni
La terapia di mantenimento con interleuchina 2 e zometa e’ risultata essere discretamente tollera con ottenimento di risultati clinici significativi nei pazienti con quota di γδ basale maggiore, che potrebbe indicare un subset di pazienti “responders”.
Tale dato e la diminuzione dei γδ durante il trattamento confermano il ruolo antineoplastico di tale sottopopolazione.
Lo stimolo interleuchina 2 e zometa non ha determinato un aumento significativo dei T γδ e delle relative sottopopolazioni quanto un’espansione della popolazione Treg, di cui sarà necessario analizzare il ruolo funzionale per capire se possa essere responsabile dell’inibizione dell’espansione dei T γδ.
Bibliografia
1) Bladé J, Cibeira MT, Fernández de Larrea C, Rosiñol L. Multiple myeloma. Ann Oncol. 2010 Oct;21 Suppl 7:vii313-9. Review.
2) Bird JM, Owen RG, D'Sa S, Snowden JA, Pratt G, Ashcroft J, Yong K, Cook G, Feyler S, Davies F, Morgan G, Cavenagh J, Low E, Behrens J; Haemato-oncology Task Force of British Committee for Standards in Haematology (BCSH) and UK Myeloma Forum. Guidelines for the diagnosis and management of multiple myeloma 2011. Br J Haematol. 2011 Jul;154(1):32-75.. Review.
3) Criteria for the classification of monoclonal gammopathies, multiple myeloma and related disorders: a report of the International Myeloma Working Group. International Myeloma Working Group. Br J Haematol. 2003 Jun;121(5):749-57.
4) Sawyer JR. The prognostic significance of cytogenetics and molecular profiling in multiple myeloma. Cancer Genet. 2011 Jan;204(1):3-12. Review.
5) Greipp PR, San Miguel J, Durie BG, Crowley JJ, Barlogie B, Bladé J, Boccadoro M, Child JA, Avet-Loiseau H, Kyle RA, Lahuerta JJ, Ludwig H, Morgan G, Powles R, Shimizu K, Shustik C, Sonneveld P, Tosi P, Turesson I, Westin J. International staging system for multiple myeloma. J Clin Oncol. 2005 May 20;23(15):3412-20. Epub 2005 Apr 4
6) Attal M et AL Intergroupe Francais di Myelome Autologous bone marrow transplantation and chemotherapy in multiple myeloma. N Engl J Med 335, 91-7; 1996
7) Anderson KC. New insights into therapeutic targets in myeloma. Hematology Am Soc Hematol Educ Program. 2011;2011:184-90.
8) Alexanian R, Barlogie B, Tucker S.VAD-based regimens as primary treatment for multiple myeloma. Am J Hematol. 1990 Feb;33(2):86-9.
9) Barlogie B, Anaissie E, van Rhee F, Haessler J, Hollmig K, Pineda-Roman M, Cottler-Fox M, Mohiuddin A, Alsayed Y, Tricot G, Bolejack V, Zangari M, Epstein J, Petty N, Steward D, Jenkins B, Gurley J, Sullivan E, Crowley J, Shaughnessy JD Jr. Incorporating bortezomib into upfront treatment for multiple myeloma: early results of total therapy 3. Br J Haematol. 2007 Jul;138(2):176-85.
10) Buda G, Orciuolo E, Galimberti S, Pelosini M, Petrini M.
Pegylated liposomal doxorubicin in combination with dexamethasone and bortezomib (VMD) or lenalidomide (RMD) in multiple myeloma pretreated patients. Ann Hematol. 2011 Sep;90(9):1115-6. Epub 2010 Dec 22.
11) Morgan GJ, Davies FE, Gregory WM, Bell SE, Szubert AJ, Navarro Coy N, Cook G, Feyler S, Johnson PR, Rudin C, Drayson MT, Owen RG, Ross FM, Russell NH, Jackson GH, Child JA. Cyclophosphamide, thalidomide, and dexamethasone as induction therapy for newly diagnosed multiple myeloma patients destined for autologous stem-cell transplantation: MRC Myeloma IX randomized trial results. Haematologica. 2011 Nov 4.
12) Reece DE Posttransplantation maintenance therapy and optimal frontline therapy in myeloma. Hematology Am Soc Hematol Educ Program. 2011;2011:197-204.
13) Attal M et AL Intergroupe Francais di Myelome Single versus double transplantation in myeloma. N Engl J Med 350, 2628; 2004
14) Moreau P, Hullin C, Garban F, Yakoub-Agha I, Benboubker L, Attal M, Marit G, Fuzibet JG, Doyen C, Voillat L, Berthou C, Ketterer N, Casassus P, Monconduit M, Michallet M, Najman A, Sotto JJ, Bataille R, Harousseau JL; Intergroupe Francophone du Myélome group.Tandem autologous stem cell transplantation in high-risk de novo multiple myeloma: final results of the prospective and randomized IFM 99-04 protocol. Blood. 107:397-403; 2006
15) Tosi P, Zamagni E, Cellini C, Ronconi S, Patriarca F, Ballerini F, Musto P, Di Raimondo F, Ledda A, Lauria F, Masini L, Gobbi M, Vacca A, Ria R, Cangini D, Tura S, Baccarani M, Cavo M. Salvage therapy with thalidomide in patients with advanced relapsed/refractory multiple myeloma. Haematologica. 87:408-14; 2002
16) Sirohi B, Powles R, Harousseau JL, Anderson KC. The evolving background for high-dose treatment for myeloma. Bone Marrow Transplant. 40:1097-100; 2007
17) Scott E, Reece D. What is the benefit of maintenance therapy with lenalidomide or bortezomib after autologous stem cell transplantation in multiple myeloma and what is the risk of developing a secondary primary malignancy? Hematology Am Soc Hematol Educ Program. 2011;2011:205-7.
18) Ludwig H, Durie BG, McCarthy P, Palumbo A, San Miguel J, Barlogie B, Morgan G, Sonneveld P, Spencer A, Andersen KC, Facon T, Stewart KA, Einsele H, Mateos MV, Wijermans P, Waage A, Beksac M, Richardson PG, Hulin C, Niesvizky R, Lokhorst H, Landgren O, Bergsagel PL, Orlowski R, Hinke A, Cavo M, Attal M. IMWG
consensus on maintenance therapy in multiple myeloma. Blood. 2012 Jan 23.
19) Attal M, Harousseau JL, Leyvraz S, Doyen C, Hulin C, Benboubker L, Yakoub Agha I, Bourhis JH, Garderet L, Pegourie B, Dumontet C, Renaud M, Voillat L, Berthou C, Marit G, Monconduit M, Caillot D, Grobois B, Avet-Loiseau H, Moreau P, Facon T; Inter-Groupe Francophone du Myélome (IFM). Maintenance therapy with thalidomide improves survival in patients with multiple myeloma. Blood. 108:3289-94; 2006
20) Abdelkefi A, Ladeb S, Torjman L, Othman TB, Lakhal A, Romdhane NB, Omri HE, Elloumi M, Belaaj H, Jeddi R, Aissaouï L, Ksouri H, Hassen AB, Msadek F, Saad A, Hsaïri M, Boukef K, Amouri A, Louzir H, Dellagi K, Abdeladhim AB; Tunisian Multiple Myeloma Study Group. Single autologous stem-cell transplantation followed by maintenance therapy with thalidomide is superior to double autologous transplantation in multiple myeloma: results of a multicenter randomized clinical trial. Blood. 111:1805-10; 2008
21) Palumbo A, Gay F, Falco P, Crippa C, Montefusco V, Patriarca F, Rossini F, Caltagirone S, Benevolo G, Pescosta N, Guglielmelli T, Bringhen S, Offidani M, Giuliani N, Petrucci MT, Musto P, Liberati AM, Rossi G, Corradini P, Boccadoro MBortezomib as induction before autologous transplantation, followed by lenalidomide as consolidation-maintenance in untreated multiple myeloma patients. J Clin Oncol. 2010 Feb 10;28(5):800-7. Epub 2010 Jan 4.
22) Nishihori T, Kharfan-Dabaja MA, Ochoa-Bayona JL, Bazarbachi A, Pasquini M, Alsina M. Role of reduced intensity conditioning in allogeneic hematopoietic cell transplantation for patients with multiple myeloma. Hematol Oncol Stem Cell Ther. 2011;4(1):1-9. Review.
23) Lokhorst H, Einsele H, Vesole D, Bruno B, San Miguel J, Pérez-Simon JA, Kröger N, Moreau P, Gahrton G, Gasparetto C, Giralt S, Bensinger W; International Myeloma Working Group. International Myeloma Working Group consensus statement regarding the current status of allogeneic stem-cell transplantation for multiple myeloma. J Clin Oncol. 2010 Oct 10;28(29):4521-30. Epub 2010 Aug 9.
24) Terpos E, Sezer O, Croucher PI, García-Sanz R, Boccadoro M, San Miguel J, Ashcroft J, Bladé J, Cavo M, Delforge M, Dimopoulos MA, Facon T, Macro M, Waage A, Sonneveld P; European Myeloma Network. The use of bisphosphonates in multiple myeloma: recommendations of an expert panel on behalf of the European Myeloma Network. Ann Oncol. 2009 Aug;20(8):1303-17. Epub 2009 May 22. Review.
25) Cairo C, Armstrong CL, Cummings JS, Deetz CO, Tan M, Lu C, Davis CE, Pauza CD. Impact of age, gender, and race on circulating γδ T cells. Hum Immunol. 2010 Oct;71(10):968-75. Epub 2010 Jun 30.
26) Catros V, Toutirais O, Bouet F, Cabillic F, Desille M, Fournié JJ. Tgammadelta lymphocytes in oncology: unconventional killer lymphocytes. Med Sci (Paris). 2010 Feb;26(2):185-91. Review
27) LA, Herzenberg LA, Roederer M. Ontogeny of gamma delta T cells in humans. J Immunol. 2004 Feb 1;172(3):1637-45.
28) Urban EM, Chapoval AI, Pauza CD. Repertoire development and the control of cytotoxic/effector function in human gammadelta T cells. Clin Dev Immunol. 2010;2010:732893. Epub 2010 Apr 13. Review.
29) O'Brien RL, Born WK. Gammadelta T cell subsets: a link between TCR and function? Semin Immunol. 2010 Aug;22(4):193-8. Epub 2010 May 6. Review
30) Born WK, O'Brien RL. γδ T cells develop, respond and survive - with a little help from CD27. Eur J Immunol. 2011 Jan;41(1):26-8. doi: 10.1002/eji.201041270. Epub 2010 Dec 9
31) Jensen KD, Chien YH.Thymic maturation determines gammadelta T cell function, but not their antigen specificities. Curr Opin Immunol. 2009 Apr;21(2):140-5. Epub 2009 Mar 25. Review.
32) Meyer C, Zeng X, Chien YH.Ligand recognition during thymic development and gammadelta T cell function specification. Semin Immunol. 2010 Aug;22(4):207-13. Epub 2010 Apr 28. Review.
33) Ribot JC, Chaves-Ferreira M, d'Orey F, Wencker M, Gonçalves-Sousa N, Decalf J, Simas JP, Hayday AC, Silva-Santos B.Cutting edge: adaptive versus innate receptor signals selectively control the pool sizes of murine IFN-γ- or IL-17-producing γδ T cells upon infection. J Immunol. 2010 Dec 1;185(11):6421-5. Epub 2010 Oct 29.
34) Roark CL, Simonian PL, Fontenot AP, Born WK, O'Brien RL.gammadelta T cells: an important source of IL-17. Curr Opin Immunol. 2008 Jun;20(3):353-7. Epub 2008 Apr 23. Review
35) e Rosa SC, Andrus JP, Perfetto SP, Mantovani JJ, Herzenberg Shibata K, Yamada H, Nakamura R, Sun X, Itsumi M, Yoshikai Y.Identification of CD25+ gamma delta T cells as fetal thymus-derived naturally occurring IL-17 producers. J Immunol. 2008 Nov 1;181(9):5940-7.
36) Hao J, Dong S, Xia S, He W, Jia H, Zhang S, Wei J, O'Brien RL, Born WK, Wu Z, Wang P, Han J, Hong Z, Zhao L, Yin Z. Regulatory role of Vγ1 γδ T cells in tumor immunity through IL-4 production. J Immunol. 2011 Nov 15;187(10):4979-86. Epub 2011 Oct 10
37) De Rosa SC, Mitra DK, Watanabe N, Herzenberg LA, Herzenberg LA, Roederer M. Vdelta1 and Vdelta2 gammadelta T cells express distinct surface markers and might be developmentally distinct lineages. J Leukoc Biol. 2001 Oct;70(4):518-26.
38) Ismail AS, Severson KM, Vaishnava S, Behrendt CL, Yu X, Benjamin JL, Ruhn KA, Hou B, DeFranco AL, Yarovinsky F, Hooper LV. Gammadelta intraepithelial lymphocytes are essential mediators of host-microbial homeostasis at the intestinal mucosal surface. Proc Natl Acad Sci U S A. 2011 May 24;108(21):8743-8. Epub 2011 May 9.
39) Tanaka Y, Morita CT, Tanaka Y, Nieves E, Brenner MB, Bloom BR. Natural and synthetic nonpeptide antigens recognized by human g/d T cells. Nature 1995; 375: 155-8.
40) Gober HJ, Kistowska M, Angman L, Jeno P, Mori L, De Libero G. Human T cell receptor gamma delta cells recognize endogenous mevalonate metabolites in tumor cells. J Exp Med 197: 163 – 8; 2003
41) Rincon-Orozco B, Kunzmann V, Wrobel P, Kabelitz D, Steinle A, Herrmann T. Activation of V gamma 9V delta 2 T cells by NKG2D. J Immunol. 2005 Aug 15;175(4):2144-51.
42) Angelini DF, Zambello R, Galandrini R, Diamantini A, Placido R, Micucci F, Poccia F, Semenzato G, Borsellino G, Santoni A, Battistini L. NKG2A inhibits NKG2C effector functions of γδ T cells: implications
in health and disease. J Leukoc Biol. 2011 Jan;89(1):75-84. Epub 2010 Oct 15.
43) Maniar A, Zhang X, Lin W, Gastman BR, Pauza CD, Strome SE, Chapoval AI. Human gammadelta T lymphocytes induce robust NK cell-mediated antitumor cytotoxicity through CD137 engagement. Blood. 2010 Sep 9;116(10):1726-33. Epub 2010 Jun 2.
44) Caccamo N, Meraviglia S, Ferlazzo V, Angelini D, Borsellino G, Poccia F, Battistini L, Dieli F, Salerno A. Differential requirements for antigen or homeostatic cytokines for proliferation and differentiation of human Vgamma9Vdelta2 naive, memory and effector T cell subsets. Eur J Immunol. 2005 Jun;35(6):1764-72.
45) Caccamo N, La Mendola C, Orlando V, Meraviglia S, Todaro M, Stassi G, Sireci G, Fournié JJ, Dieli F. Differentiation, phenotype, and function of interleukin-17-producing human Vγ9Vδ2 T cells. Blood. 2011 Jul 7;118(1):129-38. Epub 2011 Apr 19.
46) Argentati K. Reduced number and impaired function of circulkating gd T cells in patients with cutaneous primary melanoma. , J Invest Dermatol. 2003 May;120(5):829-34.
47) Yuasa T, Intravescical administration of gd T cells successfully prevents the growth of bladder cancer in the murine modelCancer Immunol Immunother. 2009 Apr;5
48) Verbeek WH. The presence of small intestinal intraepithelial gd T lymphocytes is inversely correlated with lymphoma development in refractory celiac disease 2008 Dec;103(12):3152-8.
multiple myeloma patients after non-myeloablative transplantation. 2006 May;30(5):529-35
50) Godder KT, Long term disease free survival in acute leukemia patients recovering with increased gd T cells after partially mismatched related donor bone marrow transplantatio Bone marrow transplantation. 2007 Jun;29 (12):751-7
51) Gomes AQ, Martins DS, Silva-Santos B.Targeting γδ T lymphocytes for cancer immunotherapy: from novel mechanistic insight to clinical application. Cancer Res. 2010 Dec 15;70(24):10024-7. Review.
52) Caccamo N, Dieli F, Meraviglia S, Guggino G, Salerno A. Gammadelta T cell modulation in anticancer treatment. Curr Cancer Drug Targets. 2010 Feb;10(1):27-36. Review
53) Kunzmann V, Bauer E, Wilhelm M. g/d T-cell stimulation by pamidronate. N Engl J Med 340: 737-8; 1999
54) Kunzmann V, Bauer E, Feurle J, Weissinger F, Tony HP, Wilhelm M. Stimulation of gamma delta T cells by aminobisphosphonates and induction of antiplasma cell activity in multiple myeloma. Blood 96: 384-92; 2000
55) Mariani S, Muraro M, Pantaleoni F, Fiore F, Nuschak B, Peola S, Foglietta M, Palumbo A, Coscia M, Castella B, Bruno B, Bertieri R, Boano L, Boccadoro M, Massaia M. Effector gammadelta T cells and tumor cells as immune targets of zoledronic acid in multiple myeloma. Leukemia. 2005 Apr;19(4):664-70.
56) Cimini E Zoledronic acid enhances Vd2 T-lymphocyte antitumor response to human glioma cell lines P Int J Imm Pharm. 2011
Jan-Mar;24(1):139-48.
57) Naoe M Zoledronate stimulates gd T cells in prostate cancer patients.. Oncol Res. 2010;18(10):493-501.
58) Kondo M Zoledronate facilitates large-scale ex vivo expansion of functional gd T cells from cancer patients for use in adoptive immunotherapy. Cytotherapy. 2008;10(8):842-56.
59) Casetti R, Perretta G, Taglioni A, Mattei M, Colizzi V, Dieli F, D'Offizi G, Malkovsky M, Poccia F. Drug-induced expansion and differentiation of V gamma 9V delta 2 T cells in vivo: the role of exogenous IL-2. J Immunol. 2005 Aug 1;175(3):1593-8.
60) Petrini I., Pacini S.,. Petrini M, Fazzi R., Trombi L., Galimberti S. Mesenchymal cells inhibit expansion but not cytotoxicity exerted by gamma – delta T cells. Eur. J. Clin. Invest.
61) Amato RJ, Malya R, Rawat A. Phase II study of combination thalidomide/interleukin-2 therapy plus granulocyte macrophage-colony stimulating factor in patients with metastatic renal cell carcinoma. Am J Clin Oncol. 31:237-43; 2008
62) Alici E, Konstantinidis KV, Sutlu T, Aints A, Gahrton G, Ljunggren HG, Dilber MS. Anti-myeloma activity of endogenous and adoptively transferred activated natural killer cells in experimental multiple myeloma model. Exp Hematol. 35:1839-46; 2007 Interleukina-2 ricombinante nella terapia del Mieloma Multiplo in terza recidiva: risultati preliminari
63) Capochiani E., Petrini M., Caracciolo F., Papineschi F. Vanacore R., Grassi B. Atti Sezione Regionale Toscana Società Italiana di Ematologia,
Firenze 24 aprile 1993
64) Petrini M., Capochiani E., Caracciolo F., Vanacore R., Papineschi F., Grassi B Interleukina-2 in infusione continua nel trattamento del Mieloma Multiplo in terza recidiva. Dati Preliminari. 34° Congresso della Società Italiana di Ematologia, Napoli 5-8 Ottobre 1993
65) Robinson N, Benyunes MC, Thompson JA, York A, Petersdorf S, Press O, Lindgren C, Chauncey T, Buckner CD, Bensinger WI, Appelbaum FR, Fefer A. Interleukin-2 after autologous stem cell transplantation for hematologic malignancy: a phase I/II study. Bone Marrow Transplant. 19: 435-42; 1997
66) Bennouna J, Bompas E, Neidhardt EM, Rolland F, Philip I, Galéa C, Salot S, Saiagh S, Audrain M, Rimbert M, Lafaye-de Micheaux S, Tiollier J, Négrier S. Phase-I study of Innacell gammadelta, an autologous cell-therapy product highly enriched in gamma9delta2 T lymphocytes, in combination with IL-2, in patients with metastatic renal cell carcinoma. Cancer Immunol Immunother. 2008 Nov;57(11):1599-609. Epub 2008 Feb 27.
67) Nakajima J, Murakawa T, Fukami T, Goto S, Kaneko T, Yoshida Y, Takamoto S, Kakimi K. A phase I study of adoptive immunotherapy for recurrent non-small-cell lung cancer patients with autologous gammadelta T cells. Eur J Cardiothorac Surg. 2010 May;37(5):1191-7.
68) Wilhelm M, Kunzmann V, Eckstein S, Reimer P, Weissinger F, Ruediger T, Tony HP. Gammadelta T cells for immune therapy of patients with lymphoid malignancies. Blood. 2003 Jul 1;102(1):200-6. Epub 2003 Mar 6.
69) Meraviglia S, Eberl M, Vermijlen D, Todaro M, Buccheri S, CiceroG, La Mendola C, Guggino G, D'Asaro M, Orlando V, Scarpa F, Roberts A, Caccamo N, Stassi G, Dieli F, Hayday AC. In vivo manipulation of Vgamma9Vdelta2 T cells with zoledronate and low-dose interleukin-2 for immunotherapy of advanced breast cancer patients. Clin Exp Immunol. 2010 Aug;161(2):290-7. Epub 2010 May 10.
70) Dieli F, Vermijlen D, Fulfaro F, Caccamo N, Meraviglia S, Cicero G, Roberts A, Buccheri S, D'Asaro M, Gebbia N, Salerno A, Eberl M, Hayday AC Targeting human {gamma}delta} T cells with zoledronate and interleukin-2 for immunotherapy of hormone-refractory prostate cancer. Cancer Res. 2007 Aug 1;67(15):7450-7.
71) Lang JM, Kaikobad MR, Wallace M, Staab MJ, Horvath DL, Wilding G, Liu G, Eickhoff JC, McNeel DG, Malkovsky M. Pilot trial of interleukin-2 and zoledronic acid to augment γδ T cells as treatment for patients with refractory renal cell carcinoma. Cancer Immunol Immunother. 2011 Oct;60(10):1447-60. Epub 2011 Jun
72) Kunzmann V. Pro versus antitumor effects of biphosponate activated γδ T cells in cancer ummunotherapy. ASCO Annaul meetin 2011 Abstract n 2569
73) Durie BG, Harousseau JL, Miguel JS, Bladé J, Barlogie B, Anderson K, Gertz M, Dimopoulos M, Westin J, Sonneveld P, Ludwig H, Gahrton G, Beksac M, Crowley J, Belch A, Boccadaro M, Cavo M, Turesson I, Joshua D, Vesole D, Kyle R, Alexanian R, Tricot G, Attal M, Merlini G, Powles R, Richardson P, Shimizu K, Tosi P, Morgan G, Rajkumar SV; International Myeloma Working Group. International uniform response criteria for multiple myeloma.Leukemia. 2006 Sep;20(9):1467-73. Epub 2006 Jul 20.
74) Barlogie B, Attal M, Crowley J, van Rhee F, Szymonifka J, Moreau P, Durie BG, Harousseau JL. Long-term follow-up of autotransplantation trials for multiple myeloma: update of protocols conducted by the intergroupe francophone du myelome, southwest oncology group, and university of arkansas for medical sciences. J Clin Oncol. 2010 Mar 1;28(7):1209-14. Epub 2010 Jan 19.
75) Gomes AQ, Correia DV, Grosso AR, Lança T, Ferreira C, Lacerda JF, Barata JT, Silva MG, Silva-Santos B. Identification of a panel of ten cell surface protein antigens associated with immunotargeting of leukemias and lymphomas by peripheral blood gammadelta T cells. Haematologica. 2010 Aug;95(8):1397-404. Epub 2010 Mar 10.
76) Lança T, Correia DV, Moita CF, Raquel H, Neves-Costa A, Ferreira C, Ramalho JS, Barata JT, Moita LF, Gomes AQ, Silva-Santos B The MHC class Ib protein ULBP1 is a nonredundant determinant of leukemia/lymphoma susceptibility to gammadelta T-cell cytotoxicity. Blood. 2010 Mar 25;115(12):2407-11. Epub 2010 Jan 25.
77) eddiki N, Santner-Nanan B, Martinson J, Zaunders J, Sasson S, Landay A, Solomon M, Selby W, Alexander SI, Nanan R, Kelleher A, Fazekas de St Groth B. Expression of interleukin (IL)-2 and IL-7 receptors discriminates between human regulatory and activated T cells. J Exp Med. 2006 Jul 10;203(7):1693-700. Epub 2006 Jul 3.
78) Corthay A. How do regulatory T cells work? Scand J Immunol. 2009 Oct;70(4):326-36. Review
79) Kelley TW, Parker CJ. CD4 (+)CD25 (+)Foxp3 (+) regulatory T cells and hematologic malignancies. Front Biosci (Schol Ed). 2010 Jun 1;2:980-92. Review.
80) Vang KB, Yang J, Mahmud SA, Burchill MA, Vegoe AL, Farrar MA. IL-2, -7, and -15, but not thymic stromal lymphopoeitin, redundantly govern CD4+Foxp3+ regulatory T cell development.J Immunol. 2008 Sep 1;181(5):3285-90.
81) Barron L, Dooms H, Hoyer KK, Kuswanto W, Hofmann J, O'Gorman WE, Abbas AK. Cutting edge: mechanisms of IL-2-dependent maintenance of functional regulatory T cells.J Immunol. 2010 Dec 1;185(11):6426-30. Epub 2010 Oct 29.
82) Burchill MA, Yang J, Vang KB, Farrar MA. Interleukin-2 receptor signaling in regulatory T cell development and homeostasis. Immunol Lett. 2007 Nov 30;114(1):1-8. Epub 2007 Sep 14. Review.
83) Weiss L, Letimier FA, Carriere M, Maiella S, Donkova-Petrini V, Targat B, Benecke A, Rogge L, Levy Y. In vivo expansion of naive and activated CD4+CD25+FOXP3+ regulatory T cell populations in interleukin-2-treated HIV patients. Proc Natl Acad Sci U S A. 2010 Jun 8;107(23):10632-7. Epub 2010 May 24.
84) Kunzmann V, Kimmel B, Herrmann T, Einsele H, Wilhelm M.Inhibition of phosphoantigen-mediated gammadelta T-cell proliferation by CD4+ CD25+ FoxP3+ regulatory T cells. Immunology. 2009 Feb;126(2):256-67. Epub 2008 Sep 2.
85) Giannopoulos K, Kaminska W, Hus I, Dmoszynska A. The frequency of T regulatory cells modulates the survival of multiple myeloma patients: detailed characterisation of immune status in multiple myeloma. Br J Cancer. 2012 Jan 31;106(3):546-52.
Significantly reduced regulatory T cell population in patients with untreated multiple myeloma. Leuk Res. 2011 Jul;35(7):874-8. Epub 2010 Dec 10.
87) Feyler S, von Lilienfeld-Toal M, Jarmin S, Marles L, Rawstron A, Ashcroft AJ, Owen RG, Selby PJ, Cook G. CD4(+)CD25(+)FoxP3(+) regulatory T cells are increased whilst CD3(+)CD4(-)CD8(-)alphabetaTCR(+) Double Negative T cells are decreased in the peripheral blood of patients with multiple myeloma which correlates with disease burden. Br J Haematol. 2009 Mar;144(5):686-95. Epub 2008 Dec 26.
88) Prabhala RH, Neri P, Bae JE, Tassone P, Shammas MA, Allam CK, Daley JF, Chauhan D, Blanchard E, Thatte HS, Anderson KC, Munshi NC. Dysfunctional T regulatory cells in multiple myeloma. Blood. 2006 Jan 1;107(1):301-4. Epub 2005 Sep 8
89) Brune M, Castaigne S, Catalano J, Gehlsen K, Ho AD, Hofmann WK, Hogge DE, Nilsson B, Or R, Romero AI, Rowe JM, Simonsson B, Spearing R, Stadtmauer EA, Szer J, Wallhult E, Hellstrand K. Improved leukemia-free survival after postconsolidation immunotherapy with histamine dihydrochloride and interleukin-2 in acute myeloid leukemia: results of a randomized phase 3 trial. Blood. 2006 Jul 1;108(1):88-96. Epub 2006 Mar 23.
90) Truta-Feles K, Lagadari M, Lehmann K, Berod L, Cubillos S, Piehler S, Herouy Y, Barz D, Kamradt T, Maghazachi A, Norgauer J. Histamine modulates γδ-T lymphocyte migration and cytotoxicity, via Gi and Gs protein-coupled signalling pathways. Br J Pharmacol. 2010 Nov;161(6):1291-300.
91) Braza MS, Klein B, Fiol G, Rossi JF. γδ T-cell killing of primary follicular lymphoma cells is dramatically potentiated by GA101, a type II glycoengineered anti-CD20 monoclonal antibody. Haematologica. 2011 Mar;96(3):400-7. Epub 2010 Nov 25
Tabelle e Grafici
Diagnosi Eta’ Sesso Tmo Nuovi
farmaci Tp ind Status
1 IgG K 53 F 1 Si 1 VGPR 2 IgG K 57 F 1 Si 2 RP 3 IgG K 62 M 2 No 1 RP 4 Micro L 66 M 1 No 2 VGPR 5 Micro L 61 M 1 No 2 VGPR 6 Micro L 69 M 2 No 2 RP 7 IgA L 53 M 1 Si 1 RP 8 Micro K 45 M 1 No 2 VGPR 9 IgA K 68 M 1 No 1 VGPR 10 IgG K 50 M 1 No 1 RP 11 IgG K 68 M 1 No 2 RP 12 IgG L 57 F 1 No 2 RP 13 IgG L 45 M 2 No 2 RP 14 IgG L 61 M 2 No 2 RP 15 IgG L 55 F 2 Si 2 RP 16 IgG K 55 F 1 No 1 RP 17 IgG K 59 M 1 No 1 RP Tabella 2
N Cicli Dose max Rid Dose Tox Stop Studio Causa stop 1 12 4,0 SI SI NO 2 12 3,0 SI SI NO 3 8 4,0 NO SI SI TOX 4 11 2,5 SI SI SI PD 5 12 3,5 SI SI SI PD 6 12 4,5 SI SI NO 7 8 3,0 SI SI SI TOX 8 12 4,0 SI SI No 9 12 3,5 SI SI No 10 9 4,5 SI SI SI PD 11 12 4,0 NO NO SI PD 12 12 2,0 SI SI NO 13 12 4,0 SI SI NO 14 12 4,5 SI SI NO 15 9 4,5 NO NO SI PD 16 9 4,5 SI SI SI PD 17 12 3,5 M 1 NO Tabella 3
Tabella 4 Terapia di Induzione N Tadex 8 VeldexMyo 1 Velcade 1 Lenalidomide 2 DAV 3 Aferesi HD CTX 17 Condizionamento Mel100 5 Mel200 9 Mel70 1 Mel140 2
Tempo Media (mesi)
Induzione-Tmo 12,8 (6,5 - 32,4)
TMO-IL2 14,1 (4,0 - 59)
Diagnosi-IL2 31.9 (15,1- 81,7) Tmo-Progressione 23,8 (12,4 - 48,4)
Status 6 Mesi 12 Mesi CM 1 VGPR RP SD + 2 RP SD SD - 3 RP SD SD + 4 VGPR RP PD + 5 VGPR RP PD + 6 RP SD SD = 7 RP SD SD = 8 VGPR SD RC - 9 VGPR RP SD = 10 RP SD PD + 11 RP SD PD + 12 RP SD SD + 13 RP SD SD = 14 RP SD SD + 15 RP SD PD + 16 RP SD PD + 17 RP SD SD +
Tabella 5 Valutazione risposte cliniche CM = componente monoclonale
Pre-terapia 6 mesi 12 mesi Plas γδ Bom Bm Plas γδ Bom Bm Plas γδ Bom Bm 1 0,02 4,2 5% - 0,2 NV 6% - 1,4 4 10% - 2 2,7 26 20% + 0,6 14 10% + 2 14 12% + 3 NV NV NV NV 4 16 12% + 7 18 10% NV 4 NV NV 3% + 0,7 14 20% - 4 NV 60% NV 5 0,6 14 6% - 0,7 20 5% + 0,9 18 5% - 6 NV 6 15% - 1,3 7 25% - 9 7 40% - 7 0,3 NV 15% + 0,1 4 15% + NV NV 5% + 8 0,1 33 15% - 2 14 5% NV 0,1 30 6% - 9 3,7 NV 10% + 0,1 3 10% - 8 4,5 8% NV 10 NV NV <5% - 0,1 NV NV + 0,3 20,3 30% + 11 0,3 15 4% - 2 14 3% - 8,6 13,5 10% NV 12 0,3 6,9 10% - 0 0,7 5% - 0,5 NV 5% + 13 0,3 7 7% - 0,3 NV 12% + 0,22 3 10% NV 14 1,0 5 12% - 1,2 7 10% - 0,9 5 10% NV 15 0,9 0,6 18% + 3 2 12% - 2,5 1 NV + 16 0,7 NV 8% - 0,7 2 15% - 3 2 18% - 17 0,2 17 6% - 0,7 0,7 15% + 5 11 NV +
Apparato
coinvolto Sintomo/segno Pazienti/casi
Grado max CT Apparato respiratorio Tosse, asma, dispnea 5/8 II Apparato gastroenterico Nausea,vomito, diarrea,mucosite 4/12 II SIntomi sistemici Febbre, astenia, dolori articolari, mialgie,cefalea confusione 17/48 III Complicanze infettive Febbre, faringodinia, polmonite 4/4 III
Cute Rash, dolore
inoculo 8/13 III Apparato circolatorio Tachycardia, ipotensione 2/2 I Sistema endocrino Iperglicemia 1/1 I Altro Alterazioni odontoiatriche 1/1 III Eosinophilia 17/17 NV Alterazioni esami ematochimici 0/0 NV Aumento ponderale 3/3 III Tabella 7
Fig. 2 Variazioni T γδ e popolazioni T e T γδ pz 3
Fig. 3 Variazioni T γδ e popolazioni T e T γδ pz 4
cd3 cd3 cd3 post 0 500 1000 1500 2000 ce ll/ u l 1 2 3 4 5 6 7 8 9 10 0 100 200 300 num ciclo ce ll/ u l cd45ro/cd27cd45ro/cd27 -cd45ro/cd27- post 0 50 100 150 200 ce ll/ u l cd3 cd3 cd3 post 0 500 1000 1500 2000 ce ll/ ul cd4/cd25 cd4/cd25 cd4/cd25 post 0 100 200 300 cd8 cd8 cd8 post 0 200 400 600 800 1000 ce ll/ ul cd45ro/cd27+ cd45ro/cd27+ cd45ro/cd27+ post 0 5 10 15 20 25 ce ll/ ul
Fig. 4 Variazioni T γδ e popolazioni T e T γδ pz 9
Fig. 5 Variazioni T γδ e popolazioni T e T γδ pz 14
cd8 cd8 cd8 post 0 200 400 600 800 1000 cd27 cdn27 cd27 post 0 2 4 6 ce ll/ ul cd45ra/cd27+ cd45ra/cd27+ cd45ra/cd27+ post 0.0 0.5 1.0 1.5 2.0 2.5 ce ll/ ul gd gd gd post 0 5 10 15 20 25 ce ll/ u l g2d9 g2d9 g2d9 post 0 10 20 30 40 ce ll/ u l cd4/cd25 cd4/cd25 cd4/cd25 post 0 100 200 300 400 ce ll/ ul cd8 cd8 cd8 post 0 500 1000 1500 ce ll/ u l dose g2d9 2 2 3 3 3,5 3,5 4 43,5 3,5 4,0 44,5 4,5 4,5 4,5 4,5 4,5 2,5 2,5 3 3 0 1 2 3 4 dose IL 2 (UI x 106)
Fig. 6 Analisi citofluorimetrica CD4/CD25/CD127 per identificazione T regolatori