1.1 Introduzione
Con il termine electroplating (deposizione elettrochimica) è indicato un processo in cui un oggetto viene ricoperto con uno o più strati di altri materiali mediante l’utilizzo di una soluzione elettrolitica.
I metodi in cui può avvenire la deposizione sono essenzialmente due:
- un processo di elettrodeposizione, in cui gli elettroni necessari sono forniti da una fonte di energia esterna e c’è un passaggio di corrente tra due elettrodi, un anodo e il catodo, costituito dall’oggetto da placcare; entrambi gli elettrodi sono immersi all’interno di una soluzione elettrolitica;
- un processo di deposizione electroless, in cui l’oggetto da placcare viene immerso in una particolare soluzione elettrolitica che, grazie ad un agente riducente che costituisce la fonte di elettroni, riesce a depositare materiale senza l’ausilio di una fonte di energia esterna.
I materiali deposti sono generalmente metalli, ma ci sono casi in cui la sostanza deposta è costituita da un materiale isolante. Il materiale su cui avviene la deposizione è tipicamente un metallo o un semiconduttore, ma ci sono anche esempi di deposizioni su plastica, legno o pelle.
In questo lavoro di tesi sono state investigate entrambe le tecniche di deposizione con lo scopo di riempire strutture ad alto aspect ratio, cioè ad elevato rapporto altezza-larghezza, con rame, dopo aver depositato un seed layer dello stesso metallo con differenti tecniche.
1.2 Elettrodeposizione
1.2.1 Teoria di base
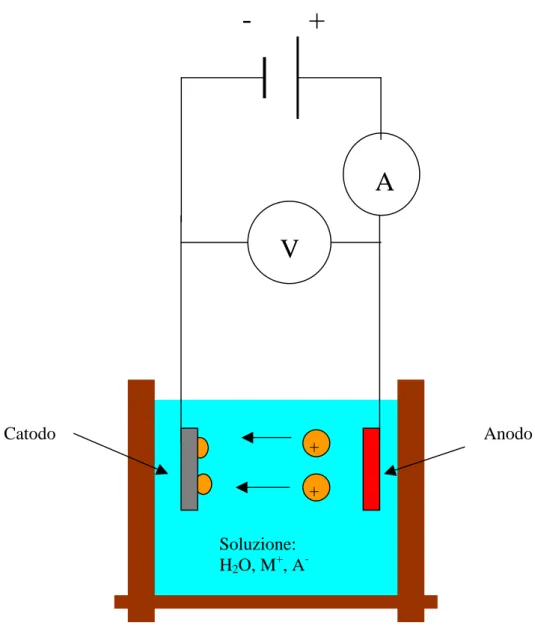
La deposizione avviene grazie al passaggio di corrente tra l’anodo e l’oggetto da ricoprire, che costituisce il catodo, entrambi posti all’interno di una soluzione contenente ioni del metallo che deve essere deposto. Tipicamente la soluzione è a base d’acqua, ma possono essere utilizzati altri elettroliti liquidi, cioè sostanze che in soluzione producono ioni. La corrente scorre tra i due elettrodi grazie agli ioni presenti nell’elettrolita, poiché questi possono muoversi liberamente nella soluzione. Gli ioni positivi presenti nella soluzione sono attratti dal catodo (elettrodo negativo) e si chiamano cationi, quelli negativi invece sono attratti dall’anodo (elettrodo positivo) e si chiamano anioni. Si ottiene così un flusso di ioni del metallo, che sono carichi positivamente, verso il catodo, con scarica di tali ioni sulla superficie e formazione su di essa di un film metallico (fig 1.1). La reazione di riduzione di ioni metallici Mz+ in soluzioni acquose è: M ze Msolutionz + → + (1.1) Contemporaneamente alla reazione di riduzione che avviene sul catodo, all’anodo avviene una reazione che dipende dal tipo di materiale utilizzato per realizzare l’elettrodo. Se l’anodo è solubile, si avrà un passaggio in soluzione degli atomi che lo
compongono, atomi ovviamente dello stesso metallo che si deve deporre sul catodo; se l’anodo è insolubile, all’interfaccia si avrà la scarica di un altro tipo di atomo, ad esempio l’evoluzione d’idrogeno.
+ + Catodo Soluzione: H2O, M+, A -Anodo
- +
V
A
Figura 1.1: Schematizzazione di una cella elettrolitica.
Le equazioni di reazioni agli elettrodi possono essere bilanciate come qualsiasi altra reazione chimica; la carica non viene però misurata in moli, ma in Coulomb; 96500 C
equivalgono ad una mole di elettroni: questa quantità è detta Faraday (F) ed è un’unità
conveniente per i calcoli elettrochimici. I principi che governano il comportamento delle reazioni elettrochimiche sono riassunti nelle leggi di Faraday:
• nel processo di scambio elettrolitico, uguali quantità di carica elettrica caricano o scaricano equivalenti quantità di ioni ad ogni elettrodo;
• il passaggio di un Faraday causa l’ossidazione o la riduzione di un grammo equivalente di materia (un grammo equivalente corrisponde al peso atomico diviso la valenza).
Oltre agli ioni del metallo che deve essere deposto, in soluzioni saranno presenti altri ioni positivi che si andranno a scaricare sul catodo; in particolare, ioni di altri metalli che andranno ad inquinare il film deposto, e gli ioni idrogeno dovuti alla dissociazione dell’acqua presente nella soluzione.
Questi ioni, insieme a quelli del metallo da deporre, si scaricheranno sul catodo, determinando quella che è definita efficienza di catodo, cioè la percentuale di corrente utile per la deposizione del metallo. Una variabile importante per valutare l’efficienza di catodo è in che misura la reazione di riduzione dell’idrogeno entra in gioco; ciò dipende da quanto valgono i potenziali di reazione del metallo e dell’idrogeno [1]. L’efficienza è definita come il rapporto tra la massa di metallo depositata MA e quella calcolata teoricamente con la legge di Faraday MT , espresso in percentuale:
CE= 100x T A M M (1.2)
L’efficienza di catodo è CE se applicata alla reazione del catodo mentre è l’efficienza di
anodo se applicata alla reazione dell’anodo. In altre parole, il rapporto tra peso del metallo effettivamente deposto e il peso che risulterebbe se tutta la corrente fosse usata
per la deposizione è chiamata efficienza di catodo. Nel caso del rame, che è quello di interesse in questa tesi, valori tipici di CE sono effettivamente vicini al 100%. Anche
per il Nichel valori vicini al 100% non sono inusuali, mentre per il cromo il valore tipico è intorno al 20%. In generale il valore dell’efficienza di catodo dipende, oltre che dal tipo di sale metallico utilizzato, da un numero di parametri chiave dell’elettrolita, come la concentrazione delle specie chimiche, il pH, dall’agitazione, dalla temperatura e dalla densità di corrente utilizzata.
1.2.2 Distribuzione di corrente
La quantità complessiva di materiale deposto sul catodo è una quantità di minor interesse rispetto alla sua distribuzione sul catodo e al suo spessore. Infatti, difficilmente ci sarà una deposizione continua da un capo all’altro del catodo; piuttosto gli ioni metallici si depositeranno in siti preferenziali. Il risultato è la possibile presenza di discontinuità in forma di pori, cracks o altre irregolarità. Nell’electroplating, la densità
di corrente e la sua distribuzione giocano un ruolo centrale nel determinare la qualità del deposito finale. Nei processi di elettrodeposizione, la densità di corrente è definita come la corrente totale diviso l’area dell’elettrodo. Questa definizione però è di scarso utilizzo nella maggior parte dei casi. Una definizione più accurata, utile e immediata è:
J = ds di
(1.3)
Dove J è la densità di corrente, è l’elemento di corrente che insiste su ds, che è
l’elemento infinitesimo della superficie del catodo. La densità di corrente è, infatti, variabile punto per punto sulla superficie del catodo. La corrente tende a concentrarsi sulle punte e sui punti prominenti e tende ad essere minore nei recessi e nelle cavità. In
conseguenza di questa disuniformità della corrente, lo spessore tenderà a variare sulla superficie del catodo e ad essere più spesso agli spigoli e sulle punte. Il deposito del metallo è inoltre pesantemente influenzato dalla variazione della CE con la densità di corrente: a volte questo può essere d’aiuto nella deposizione di film di spessore uniforme. In alcuni bagni di particolare composizione CE diminuisce all’aumentare della densità di corrente: lo spessore nelle regioni di alta densità di corrente quindi non eccede di molto la media delle altre zone. C’è anche il caso opposto, ad esempio nei bagni di cromo, in cui CE aumenta con l’aumentare della densità di corrente, con il risultato di avere disuniformità di spessore abbastanza marcato. In breve, la distribuzione del metallo deposto dipende dalla forma e dalle dimensioni dell’oggetto, dalla geometria della cella, dalla conduttività del bagno, dalla forma delle curve di polarizzazione, dalle curve CE-densità di corrente e dagli effetti dell’agitazione.
E’ quindi di fondamentale importanza poter prevedere la distribuzione di corrente all’interno della soluzione, in quanto dall’uniformità della distribuzione dipenderà l’uniformità e la qualità dello spessore deposto. La distribuzione della corrente varierà secondo la configurazione della cella, cioè dipenderà dalla forma e dalla dimensione della cella, oltre che dalla forma e dalla dimensione della parte immersa di catodo e anodo. Un possibile metodo di risoluzione del problema può essere quello di supporre che l’elettrolita si comporti come un materiale ohmico e applicare al sistema elettrodi-elettrolita la teoria del campo elettrico. Il problema resta in ogni caso complesso perché si tratta di risolvere l’equazione di Poisson in un dominio tridimensionale, non risolvibile direttamente. Nonostante la mancanza di una soluzione completa quest’approccio può essere utile per una progettazione di massima del sistema perché ci
permette ci conoscere almeno qualitativamente l’andamento della distribuzione di corrente. Come già detto in precedenza la corrente tende a concentrarsi sulle protuberanze dell’oggetto, mentre tende a fluire male dentro le cavità. La distanza minore rispetto all’elettrodo dove è generata la corrente provoca sulle protuberanze un campo elettrico maggiore e, quindi, un addentrarsi delle linee di corrente. Oltre a quest’effetto va ricordato anche come la geometria delle punte provochi un addensarsi delle linee di corrente. Se si parte dall’ipotesi che l’elettrolita si comporti come un materiale ohmico, la distribuzione di corrente non risulta essere quella effettiva, per questo motivo viene chiamata distribuzione primaria di corrente e rappresenta la corrente che si avrebbe in assenza degli effetti di disturbo causati dalla dissoluzione e dalla deposizione degli ioni agli elettrodi. Le reazioni che avvengono sulla superficie del catodo modificano pesantemente la deposizione e determinano la distribuzione secondaria di corrente, da cui dipende effettivamente la deposizione del materiale.
1.2.3 Polarizzazione di catodo
La zona che si estende 0.1-0.25 mm all’interno della soluzione intorno al catodo, viene chiamata strato di catodo [2]. Questa zona, caratterizzata dall’avere composizione e concentrazione alterate rispetto al resto del bagno di plating, riveste molta importanza perché la velocità di deposizione e la bontà del film deposto dipendono dal potenziale presente a cavallo dello strato di catodo, potenziale che varia da punto a punto con il fluire della corrente. Il potenziale di un elettrodo immerso in una cella in cui scorre corrente subisce delle variazioni rispetto al potenziale statico. La differenza tra questo
potenziale dinamico e quello statico è definita come polarizzazione di catodo. Il valore della polarizzazione è determinato principalmente da alcuni fattori:
• le reazioni che avvengono agli elettrodi;
• il processo di diffusione degli ioni nella soluzione;
• la riduzione della superficie effettiva dello strato di catodo, causata dall’evoluzione di idrogeno al catodo stesso.
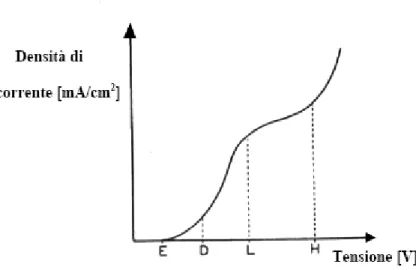
Il processo di elettrodeposizione è governato dalle reazioni che avvengono sull’elettrodo e dalla diffusione degli ioni in soluzione [1]. La velocità relativa di questi due processi determina la polarizzazione di catodo: la capacità dell’elettrolita di rifornire ioni resta costante mentre modificando la densità di corrente si modifica la velocità di reazione sulla superficie del catodo. Si viene così a creare una differenza di potenziale a cavallo della superficie del catodo, che costituisce la polarizzazione. Per spiegare la reazione che avviene al catodo è utilizzata la curva di polarizzazione: si ottiene misurando idealmente la tensione a cavallo dello strato di catodo, in funzione di una corrente imposta dall’esterno al sistema (fig.1.2).
Fino al punto E non è presente nessuna corrente e la tensione è quella di equilibrio dell’elettrodo. Con l’aumento della corrente, la tensione inizia a salire; tuttavia fino al punto D, chiamato potenziale di deposizione, non si sarà nessuna deposizione di materiale sull’elettrodo. Il punto D dipende dal materiale da depositare e dal tipo di substrato utilizzato. A partire da questo punto inizia la deposizione del metallo e ad un aumento della corrente corrisponde un aumento della tensione, dovuto al fenomeno della polarizzazione. Il punto rilevante successivo è L, chiamato densità di corrente limite. Oltre questo punto l’elettrolita non è più in grado di rifornire il catodo di ioni con la velocità richiesta: si avrà così la dissoluzione degli ioni depositati e la rideposizione degli stessi. Questo porta ad un grave peggioramento della qualità del film deposto [3]. Un ulteriore aumento della corrente porta ad una crescita rapida della tensione fino ad arrivare al punto H. Qui l’evoluzione di idrogeno aumenta notevolmente e gli ioni di idrogeno concorreranno alla scarica sul catodo portando ad un ulteriore peggioramento della qualità del film. Dopo il punto H la tensione crescerà meno velocemente perché la soluzione è in grado di fornire gli ioni idrogeno alla stessa velocità con cui essi reagiscono sul catodo.
1.2.4 Soluzione elettrolitica
Una delle scelte più importanti da fare in un processo di elettrodeposizione è la scelta dei componenti che andranno a comporre la soluzione elettrolitica utilizzata. I principali elementi di un bagno elettrolitico sono:
•
cationi: ioni derivanti dalla dissociazione del sale del metallo da deporre; di solito la concentrazione è abbastanza elevata in modo da poter usare elevate densità di corrente e avere quindi deposizioni veloci;•
anioni: vengono scelti in base ad una serie di proprietà quali la solubilità del tipo di sali, la corrosività dell’anione sull’anodo e la stabilità della soluzione. In tabella sono riportati i principali anioni utilizzati per nickel, rame e ferro [2].Anione Usato per deporre Stabilità della soluzione
Cianuro Cu Molto bassa
Pirofosfato Cu Alta
Cloruro Fe,Ni Alta
Fluoroborato Fe,Ni Molto alta
Solfato Cu,Fe,Ni Moderata
Solfammato Ni Moderata
Oltre ai componenti principali, la soluzione può contenerne altri, che conferiscono proprietà particolari alla soluzione:
• sali conduttivi: sono aggiunti per aumentare la conducibilità dalla soluzione; • agenti bagnanti: sono aggiunti alla soluzione per evitare la formazione di buchi
nel film deposto. L’aggiunta di questi elementi abbassa la tensione superficiale consentendo alle bolle d’idrogeno, che sono una delle cause della formazione dei buchi, di staccarsi più facilmente dalla superficie;
• additivi: composti speciali che servono ad ottenere caratteristiche particolari, ad esempio una maggior lucentezza, una minor rugosità o una elevata capacità di
filling.
Le caratteristiche del bagno elettrolitico devono essere tenute sotto controllo durante tutto il processo di elettrodeposizione per evitare che si modifichino, variando in modo incontrollabile la qualità del film. Le principali cause d’invecchiamento della soluzione sono:
• decomposizione chimica: alcune sostanze della soluzione si possono alterare con il tempo o a causa della presenza di particolari reazioni chimiche;
• reazioni incomplete agli elettrodi: nel caso in cui l’efficienza di anodo e catodo siano molto diverse, per ogni anione che si scarica sul catodo non ce n’è uno che si discioglie all’anodo (nel caso in cui sia solubile), per questo la concentrazione del sale metallico può variare molto durante il processo;
• filtraggio della soluzione: è possibile che durante l’operazione di pulizia, insieme alle impurità, vengano eliminate anche sostanze utili al processo.
Il controllo della soluzione è fondamentale per la riproducibilità e l’affidabilità del processo; le variabili più importanti da esaminare sono:
• le impurità presenti nella soluzione, che modificano la qualità del film deposto; • la concentrazione del sale metallico, che modifica il limite massimo delle densità
di corrente che è possibile utilizzare;
• l’agitazione della soluzione, che favorisce la diffusione degli ioni all’interno della soluzione e garantisce che non ci siano gradienti di concentrazione tra le varie zone del catodo.
1.2.5 Distribuzione del metallo
Come detto in precedenza, la distribuzione del metallo depositato dipende da molti fattori: forma e dimensioni del catodo, dalla geometria della cella, dal tipo di soluzione, dalla forma della curve di polarizzazione e quindi dalla densità di corrente utilizzata, dalla distribuzione secondaria di corrente e dall’efficienza catodica a quella densità di corrente. Per ottenere il risultato desiderato bisognerà tener conto di tutte queste variabili, agendo sui parametri e operando le scelte appropriate.
Uno dei casi più frequenti è quello in cui ci saranno zone di diverso spessore da placcare: nel caso si voglia ottenere uno spessore uniforme, indipendentemente dalla presenza di punte o recessi, è importante la scelta dell’elettrolita. Alcune composizioni di bagni elettrolitici, infatti, hanno la proprietà di diminuire la differenza tra le zone dove il deposito è più spesso e dove è più sottile. In altre parole danno un’uniforme copertura di catodo dispetto alle irregolarità eventualmente presenti. Queste soluzioni hanno quello che si chiama un elevato “throwing power”, cioè la capacità del bagno di produrre depositi più o meno uniformi a partire da superfici che hanno irregolarità macroscopiche. Nei bagni elettrolitici i potenziali di deposizione sono influenzati dall’evoluzione d’idrogeno durante la deposizione, così che la CE crolla all’aumentare della densità di corrente. Questo tipo di comportamento porta ad un deposito più uniforme, perché nelle zone in rilievo, dove la densità di corrente è maggiore a causa
dell’effetto punta, si otterrà un deposito di minor spessore rispetto a quanto predetto dalla distribuzione secondaria di corrente.
Anche la scelta dei contatti sugli elettrodi è importante, per due motivi: con la loro presenza impediranno la deposizione sulla zona contattata e, essendo fatti di un materiale conduttore, la loro immersione provocherà sia una deposizione di metallo su di essi, sia una distorsione della distribuzione di corrente. I contatti devono essere isolati elettricamente, se immersi nella soluzione, o, anche meglio, devono essere fatti in modo da contattare gli elettrodi al di fuori dal bagno elettrochimico.
Un efficace controllo della temperatura è molto importante per una buona deposizione. Deviazioni di meno di 5 °C dalla temperatura ottimale sono sufficienti per peggiorare la qualità del deposito, modificare la velocità di deposizione e le altre proprietà del bagno elettrolitico. I bagni di plating sono solitamente ridotti in formule che garantiscono un funzionamento soddisfacente per ogni temperatura all’interno di un range abbastanza ampio, di solito anche maggiore di 60 °C.
E’ fondamentale tener conto anche del fatto che il pezzo da placcare sia fatto in modo da non intrappolare al suo interno bolle di gas, sia durante l’immersione della cella, sia durante la deposizione. Solitamente sono aggiunti alla soluzione degli additivi che favoriscono l’uscita delle bolle abbassando la tensione superficiale del bagno.
1.2.6 Struttura e proprietà del metallo deposto
La struttura del deposito è influenzata da molti fattori, tra cui: la composizione della soluzione, la temperatura del bagno, il livello di agitazione, la densità di corrente utilizzata, la presenza di impurezze, la geometria del substrato [4]. A secondo della
struttura, i depositi di metallo possono essere suddivisi in varie tipologie; una possibile classificazione secondo la struttura cristallina è la seguente [5]:
•
columnar: questi tipi di grani sono molto comuni in film sottili e compatti. Sono il risultato di crescite secondo direzioni cristallografiche preferenziali. Grani orientati in maniera random sono solitamente piccoli in confronto allo spessore del film;•
equiaxed: sono caratterizzati da cristalli che presentano la stessa dimensione in tutte le direzioni e raggiungono solitamente dimensioni maggiori rispetto a quelli del caso precedente;•
dendritic: in film elettrodeposti con grani di tipo dendritico risultano da crescitecontrollate dal processo di diffusione, la forma dei singoli cristalli può essere molto varia;
•
nodular: a causa del loro aspetto strutture di questo tipo sono spesso chiamate a cavolfiore. Sebbene il fenomeno sia attribuito ad un certo numero di fattori (come le impurezze), l’origine del meccanismo di crescita non è ancora completamente chiara;•
fibrous: questo tipo di grani è il risultato di una crescita orientata che ricopre ilsubstrato solo in maniera parziale.
In letteratura sono presenti altre classificazioni, a seconda dell’aspetto preso in considerazione. Di seguito è riportata brevemente quella basata sulle proprietà fisiche macroscopiche del deposito:
• columnar: sono depositi di bassa resistenza e durezza ma possiedono un’elevata duttilità. Sono solitamente ottenuti operando in condizione di piccole densità di corrente;
• fine-grained: sono depositi caratterizzati dal fatto di essere costituiti da grani di dimensioni di 10-100 nm. Sono solitamente ottenuti operando in condizione di alte densità di corrente;
• fibrous: sono depositi con caratteristiche intermedie rispetto ai due tipi precedenti;
• banded: sono depositi costituiti da grani di dimensioni inferiori ai 10 nm. Tipicamente hanno elevata resistenza e durezza ma bassa duttilità.
Il tipo predominante di depositi, nel caso di metallo depositato su film evaporati o elettrodeposti, è quello a colonna. Questo tipo di struttura è dovuta all’anisotropia della velocità di crescita dei cristalli, in cui la crescita verticale eccede quella orizzontale. Il primo strato del film deposto generalmente è costituito da una grana più piccola rispetto a quella che verrà deposta in seguito: la tensione interna del film tenderà quindi a diminuire al crescere dello spessore.
1.2.7 Qualità del metallo deposto
La qualità del metallo deposto dipende dalla soluzione utilizzata e dalle condizioni operative in cui è stata fatta la deposizione. Un numero molto alto di variabili concorre all’ottenimento della struttura finale: gli additivi usati, la concentrazione di ioni metallici, la densità di corrente, la temperatura, l’agitazione. In tabella sono riassunti schematicamente gli effetti che questi parametri possono avere sulla grandezza dei
grani, migliorando la qualità del film mediante la riduzione delle dimensioni dei singoli cristalli. La freccia in tabella indica la tendenza che un incremento del parametro in questione ha sulla grandezza dei grani. Per esempio un aumento della concentrazione di ioni metallici comporta un aumento delle dimensioni dei singoli cristalli, al contrario un aumento di additivi porta ad una riduzione delle dimensioni dei grani.
Dimensione cristalli
Concentrazione ioni metallici
Additivi Densità di corrente
Temperatura Agitazione
Le caratteristiche generalmente desiderabili per un film metallico sono:
• adesione: dipende dalle condizioni fisiche e chimiche del substrato. Importante è quindi la pulizia del substrato, che è solitamente effettuata con passi standard di pulizia che prevedono eliminazione di residui organici, di tracce metalliche e eventualmente dell’ossido nativo;
• solidità: la mancanza di solidità del metallo deposto può essere dovuta alla presenza di buchi, crepe, bolle, ecc. Questi difetti possono essere causati da una non perfetta preparazione del substrato, dall’inquinamento della soluzione, dall’utilizzo di una densità di corrente troppo alta o da una cattiva fuoriuscita delle bolle di idrogeno durante il processo.
• stress interno: a causa della differenza dei materiali si crea una tensione all’interfaccia che può portare al distacco del film deposto. Questo stress può essere ridotto variando la composizione della soluzione, la temperatura e la densità di corrente utilizzata.
Le proprietà meccaniche dipendono principalmente dalla composizione della soluzione mentre quelle fisiche esclusivamente dal metallo deposto. Tra i metalli comuni, solo tredici possono essere deposti in maniera abbastanza semplice; sono riportati in tabella, oltre ai possibili sali contenuti nella soluzione e alle condizioni operative [2].
1.2.8 Preparazione del substrato
Per una buona deposizione è necessaria un’opportuna preparazione del substrato: solitamente con una serie di passi si rende pulita la superficie del campione e la si attiva chimicamente.
Il numero di passi da effettuare dipende anche dal tipo di processo che si vuole realizzare: nel caso delle strutture in rame di nostro interesse è necessario solo un passo di pulizia per la rimozione della sporcizia superficiale.
Nella tabella è riportata una lista di materiali suddivisi per difficoltà di placcaggio.
Facili da placcare Difficili Molto difficili
Ferro Acciaio inossidabile Tantalio
Rame Alluminio Tungsteno
Zinco Berillio Niobio
Cobalto Magnesio Torio
Nickel Cromo Uranio
Argento Piombo Silicio
Cadmio Titanio Molibdeno
Oro Zirconio Germanio
La pulizia è costituita da vari passi secondo il tipo d’impurità presenti sul substrato: solitamente sono presenti delle soluzioni per la rimozione di organici a base di H2SO4,
per la rimozione di residui metallici a base di HCl, per la rimozione di ossidi a base di HF, oltre ad una serie di risciacqui in acqua deionizzata che ripuliscono il campione dopo ogni passo, in modo da evitare la contaminazione tra le varie soluzioni. Sul
substrato ci sono particelle, solitamente di piccole dimensioni, che non sono attaccate da queste soluzioni. Per facilitare la loro rimozione si utilizzano gli ultrasuoni: questi creano delle bolle che facilitano la penetrazione della soluzione anche sotto le particelle, provocandone il distacco. Le soluzioni poi devono essere buttate o filtrate, per eliminare le particelle che si sono staccate dal substrato. Le frequenze utilizzate sono dell’ordine del MHz, in quanto più piccole sono le particelle, maggiore deve essere la frequenza. Di solito l’immersione in soluzioni fortemente acide permette anche la riattivazione chimica della superficie. Nel caso di metalli molto reattivi, come l’alluminio, non avrebbe senso rimuovere l’ossido in un bagno acido, poiché al contatto con l’aria questo si riformerebbe immediatamente; si usa quindi disciogliere l’ossido presente con un bagno alcalino contenente zinco. Inoltre quest’immersione deposita un sottile strato di zinco, meno reattivo e più facilmente placcabile. Per migliorare l’adesione del film si utilizzano soluzioni di tipo “strike”: queste depositano sul substrato un sottile strato di metallo su cui successivamente si va a deporre il film con l’elettrodeposizione. A causa della bassa velocità di deposizione e della bassa efficienza di catodo queste soluzioni non possono essere utilizzate per la deposizione vera e propria.
1.3 Electroless
1.3.1 Teoria di base
La deposizione mediante soluzione elettrochimica può avvenire tramite l’immersione del campione nella soluzione senza l’applicazione di corrente.
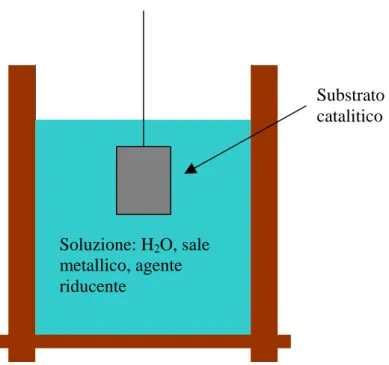
Contrariamente a quella utilizzata per l’elettrodeposizione questa cella non ha alimentazione e il sistema nel suo complesso ha solo un elettrodo. La soluzione è più complessa e contiene come elementi base un sale metallico MA (Mz+; Az-), un agente riducente Red e acqua deionizzata.
Soluzione: H2O, sale
metallico, agente riducente
Substrato catalitico
Figura 1.3: Una cella elettrolitica per deposizione electroless di metallo da una soluzione acquosa di sale metallico e agente riducente.
La reazione complessiva può essere riassunta come segue:
solution solution
z
solution d M Ox
M + +Re → + (1.4) dove Ox è il prodotto ossidato dell’agente riducente Red. La superficie catalitica può essere il substrato stesso o un nucleo catalitico di un metallo sparso sulla superficie del materiale non catalitico. Nel processo di deposizione electroless un agente riducente presente nella soluzione è la fonte di elettroni. La reazione (1.4) deve essere tale che la reazione tra Mz+ e Red sia soppressa nel bulk della soluzione. Una differenza tra
elettrodeposizione e deposizione electroless è la presenza in quest’ultima di un solo elettrodo invece del catodo e dell’anodo. Nell’elettrodeposizione avvengono due diverse reazioni con trasferimento di elettroni in due interfacce elettrodo-elettrolita spazialmente separate: al catodo avviene la reazione di riduzione, all’anodo procede la reazione di ossidazione. Nella deposizione electroless le due reazioni elettrochimiche, la riduzione di Mz+ e l’ossidazione di Red, avvengono allo stesso elettrodo, alla stessa interfaccia elettrodo-elettrolita. Abbiamo quindi una divisione statistica dei siti catalitici del substrato in siti anodici e catodici. Questi siti catalitici sono parte dello stesso substrato e c’è un flusso di elettroni tra questi siti.
1.3.2 Modello elettrochimico: mixed-potential theory
Un modello per il processo della deposizione electroless è stato suggerito da Paunovic [6] e Saito [7] sulla base della teoria mixed-potential dei processi di corrosione di Wagner-Traud [8].
In accordo con la teoria del mixed-potential della deposizione electroless, la reazione complessiva può essere scomposta in una riduzione, cioè la reazione parziale catodica:
Msolutionz+ +ze ⎯sup⎯erficie⎯⎯catalitica⎯⎯⎯→ M (1.5)
e una ossidazione, cioè la reazione anodica parziale:
me
Ox
dsolution ⎯sup⎯erficie⎯⎯catalitica⎯⎯⎯→ solution +
La reazione complessiva è il risultato della combinazione di queste due differenti reazioni parziali che avvengono su un unico elettrodo e, quindi, sulla stessa interfaccia metallo-soluzione. Il potenziale d’equilibrio dell’agente riducente, Eeq,red, deve essere più negativo di quello dell’elettrodo di metallo, Eeq,M, in modo che l’agente Red possa funzionare come donatore di elettroni e Mz+ come accettore di elettroni.
1.3.3 Wagner-Traud diagram
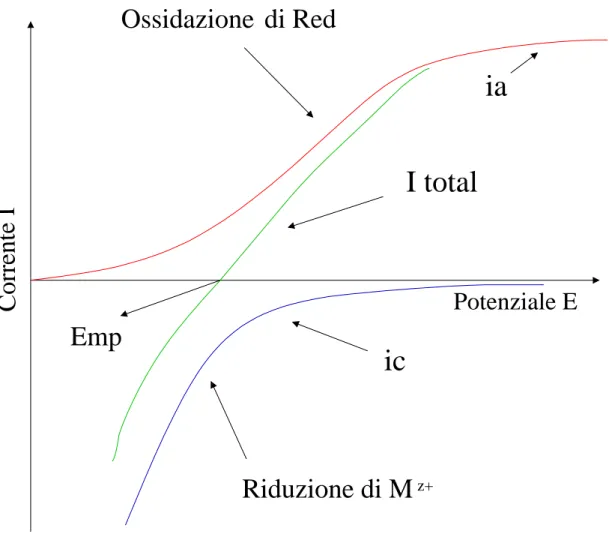
In accordo con la teoria mixed-potential, la reazione totale della deposizione electroless può essere descritta elettrochimicamente in termini di tre curve corrente-potenziale [3], come mostrato schematicamente in fig.1.4:
• ic = f(E), è la curva corrente-potenziale per la riduzione degli ioni Mz+, in assenza dell’agente riducente Red;
• ia = f(E), è la curva corrente-potenziale per l’ossidazione dell’agente riducente
Red, in assenza degli ioni Mz+.
• itotal = f(E), la linea verde in figura, è la curva corrente-potenziale per la reazione complessiva.
Le due principali caratteristiche del sistema di curve sono:
• la curva itotal = f(E) interseca l’asse del potenziale. In quest’intersezione la corrente è zero e
|ic| = |ia| (1.7)
per itotal = 0. Il potenziale per cui vale l’equazione (1.7) si chiama mixed-
ia
ic
Riduzione di M
z+I total
Ossidazione di Red
Emp
C
o
rr
en
te
I
Potenziale E
Figura 1.4: Diagramma Wagner-Traud delle reazioni parziali e della curva totale.
• In ogni punto della curva itotal = f(E)
itotal= ia + ic (1.8) Quindi, la densità totale di corrente itotalè il risultato dell’addizione delle densità di corrente dei due processi parziali.
1.3.4 Mixed potential, E
mpQuando una superficie catalitica S è introdotta in una soluzione acquosa contenente ioni
di ossidazione (1.6) avvengono contemporaneamente. Entrambe queste reazioni cercano di raggiungere il proprio potenziale di equilibrio, Eeq. Il risultato è il raggiungimento di uno stato di equilibrio stabile ad un valore di potenziale chiamato steady-state mixed
potential, Emp. Il risultato è che il potenziale della coppia Red/ox (1.6) è innalzato dal
valore Eeq,red, e il potenziale dell’elettrodo di metallo M/Mz+ (1.5) è abbassato dal suo valore Eeq,M fino al valore Emp.
Quindi, le quattro caratteristiche fondamentali dello steady-state mixed potential sono: • Entrambi i sistemi sono shiftati dai loro potenziali di equilibrio di un η
(overpotential):
ηM = Eeq,M - Emp (1.9) ηRed = Emp – Eeq,Red (1.10) • Una reazione elettrochimica netta avviene in ogni sistema redox quando
entrambe le reazioni (1.5) e (1.6) sono shiftate dal loro equilibrio.
• La condizione per lo stato di equilibrio è che il rate della riduzione di Mz+ , cioè la densità di corrente catodica iM, sia uguale al rate di ossidazione dell’agente di riduzione Red, cioè la densità di corrente anodica iRED:
iM,deposizione = (iM)Emp = (iRed)Emp (1.11) in modo che non scorra una corrente netta nel sistema isolato.
• Un sistema nello steady-state mixed potential non è in equilibrio poichè avviene una reazione totale netta, quindi, lo scambio dell’energia libera non è zero, come richiesto dall’equilibrio termodinamico.
Nel caso particolare della deposizione electroless di rame, la teoria del mixed-potential è essenzialmente verificata, come dimostrano vari lavori: vedi per esempio Donahue
[9], Molenaar [10]. Comparando i valori teorici e quelli sperimentali del rate di deposizione e del mixed potential, questi risultano essenzialmente identici.
1.3.5 Reazione catodica parziale
Ioni metallici in una soluzione per la deposizione electroless del metallo stesso devono essere, in generale, complessati con dei leganti. Uno ione complesso è costituito da uno ione positivo centrale e da leganti formati da molecole neutre, ma polari, o da ioni negativi. La formazione dello ione complessato è indispensabile per prevenire la formazione di idrossidi metallici, come per esempio il Cu(OH)2 nella deposizione del
rame. Per la deposizione elettrochimica di metalli è indispensabile la presenza di specie elettroattive. Queste specie, a seconda del metallo e della soluzione utilizzata, possono essere ioni metallici complessati o meno: nel primo caso, lo schema cinetico del processo di deposizione è un semplice trasferimento di carica; nel secondo, il trasferimento di carica è preceduto da una dissociazione dello ione metallico complesso. In quest’ultimo caso, dagli ioni metallici, mediante una reazione di dissociazione, si ottengono le specie elettroattive non complesse; poi avviene la deposizione con un semplice trasferimento di carica. Il meccanismo implica, quindi, una sequenza di almeno due passi elementari:
• formazione delle specie elettroattive
• trasferimento di carica dalla superficie catalitica alla specie elettroattiva.
Quindi, dal punto di vista cinetico, la reazione parziale catodica è una reazione elettrochimica che è preceduta da una reazione chimica.
I fattori che determinano il rate della reazione sono: la concentrazione degli ioni metallici e dei leganti, il pH della soluzione e il tipo e la concentrazione degli additivi. Gli additivi, in generale, hanno due effetti opposti: accelerazione e inibizione. Particolari tecniche permettono di valutare quantitativamente l’aumento del rate di deposizione in presenza dei vari additivi.
1.3.6 Reazione anodica parziale
Anche la reazione anodica solitamente procede in due passi elementari: la formazione delle specie elettroattive e il trasferimento di cariche. La formazione delle specie elettroattive avviene in due step, attraverso una specie intermedia (Redinterm):
Red →Redinterm Redinterm →R
Una delle reazioni più studiate è l’ossidazione della formaldeide (Red=H2CO), nel caso della deposizione di rame. La reazione complessiva dell’ossidazione elettrochimica della formaldeide, all’elettrodo di rame, in una soluzione alcalina avviene secondo l’equazione:
H CO+OH− → HCOO− +H O+2H2 +e
1 2
2 (1.12)
Tale reazione avviene in una serie di passi elementari:
• La formazione della specie elettroattiva R, che avviene in tre passi [11];
• Il trasferimento di carica: la specie elettroattiva si ossida dando il prodotto finale
I fattori che determinano il rate della reazione anodica parziale sono il pH e gli additivi. Poiché gli ioni OH- sono reagenti nello step del trasferimento di carica, l’effetto del pH è diretto e significativo.
Gli additivi possono avere un effetto di inibizione o di accelerazione.
1.3.6 Attivazione delle superfici non catalitiche
Superfici non catalitiche (materiali non conduttori, metalli non catalitici, semiconduttori non catalitici) devono essere attivate, rese catalitiche, prima della deposizione
electroless.
Quest’attivazione deve essere realizzata generando nuclei catalitici sulla superficie dei materiali non catalitici. I metodi principali per generare nuclei catalitici sono due: elettrochimico e fotochimico.
-Attivazione elettrochimica
Nuclei catalitici di metallo su una superficie non catalitica possono essere generati mediante una reazione di ossido-riduzione:
Mz+ +Red → M +Ox (1.13) dove Mz+ sono gli ioni metallici e M è il metallo catalizzatore.
Il catalizzatore più utilizzato è il Pd, e quindi l’agente di nucleazione preferito è Pd2+ (dal PdCl2). L’agente riducente Red in questo caso è lo ione Sn2+ (da SnCl2). La
reazione complessiva, usando un modello semplificato, è: + + + + 2 → + 4 2 Sn Pd Sn Pd (1.14)
Sn2+ può ridurre gli ioni Pd2+ poiché il potenziale standard ossidazione-riduzione di
Il flusso di elettroni è da una coppia più elettronegativa (Sn4+/ Sn2+) a una meno elettronegativa (Pd2+/Pd).
In questo caso l’attivazione elettrochimica può essere fatta in uno o due passi.
-Processo in due step
• Nel primo passo, detto di sensibilizzazione, gli ioni Sn2+
sono adsorbiti sul substrato S non conduttivo:
S+Snsolution2+ → S⋅Snads2+ (1.15) dove S⋅Sn2ads+ rappresenta gli ioni Sn2+ adsorbiti sulla superficie S.
Una tipica formula di una soluzione di sensibilizzazione è: SnCl2 10 g/L
HCl (37%) 40 mL/L
• Nel secondo passo, avviene la nucleazione. Una soluzione usata in industria è: PdCl2 0.1-1.0 g/L
HCl (37%) 5-10 mL/L
La fase di nucleazione è effettuata con l’immersione di un non conduttore sensibilizzato in una soluzione di nucleazione per 0.5-2 minuti. La reazione è:
S⋅Snads2+ +Pdsolution2+ → S⋅Pdads+Snsolution4+ (1.16) Il processo di nucleazione produce piccoli siti catalitici di Pd sparsi sulla superficie del substrato: il metallo catalitico Pd copre solo una piccola frazione della superficie.
-Processo in uno step
Le soluzioni che realizzano i due processi di sensibilizzazione e nucleazione, sono combinate in una sola soluzione. I componenti chimici sono gli stessi del metodo
precedente, con l’aggiunta di composti che servono per solubilizzare i reagenti complessi che si vengono a formare durante il processo.
-Attivazione fotochimica
Le reazioni coinvolte in questo metodo sono molto complesse, solitamente si tratta di una reazione fotochimica, cioè una reazione indotta da una sorgente luminosa, seguita da una reazione elettrochimica.
1.4 Il rame
Grazie ad alcune sue proprietà, che saranno illustrate in seguito, il rame sta accrescendo la sua importanza nell’industria microelettronica, in particolar modo come materiale per le interconnessioni.
1.4.1 Il rame nelle interconnessioni
La tecnologia dei circuiti integrati (IC) ha utilizzato da sempre l’alluminio come materiale per realizzare le interconnessioni tra i dispositivi integrati. Queste metallizzazioni vengono spesso disposte su più piani o livelli (layers); il numero di questi livelli aumenta man mano che il numero dei dispositivi circuitali integrati su silicio aumenta. Un esempio è l’elevata estensione e complessità delle interconnessioni presenti in un microprocessore, cuore di qualsiasi moderno calcolatore. Proprio l’evoluzione nel campo dei microprocessori, il loro crescente fattore di integrazione, ovvero riduzione di scala, la sempre maggiore frequenza di lavoro e le conseguenti più alte densità di corrente circolanti, hanno dato impulso alla ricerca di soluzioni
tecnologiche che consentano l’utilizzo del rame in alternativa alle ormai consolidate tecniche basate sull’alluminio. Per essere utilizzabile come elemento di interconnessione, un materiale deve possedere una resistenza di strato di valore più basso possibile, al fine di minimizzare le cadute di tensione lungo le linee di interconnessione, come pure i ritardi di propagazione dei segnali elettrici causati dalla resistenza e capacità della linea stessa. Inoltre sono necessarie basse resistenze di contatto nei punti di giunzione tra diversi materiali, oltre ad una buona affidabilità nel tempo delle linee di interconnessione. L'esigenza di materiali a bassa resistività porta immediatamente a considerare i metalli come elementi di interconnessione: oro, alluminio, etc. L'oro necessita, tuttavia, di una deposizione multistrato con l'uso di altri metalli intermedi, come titanio e tungsteno. Inoltre, l'oro può causare inaffidabilità in quanto diffonde facilmente nel silicio e può produrre centri di ricombinazione elettrone– lacuna che possono rendere inefficiente il dispositivo integrato. Finora la scelta è ricaduta sull'alluminio, che è compatibile con le tecnologie di integrazione del silicio ed è a tutt'oggi il materiale più comunemente usato. E' relativamente economico ed ha una buona adesione sull'ossido di silicio, tradizionalmente usato come dielettrico. Inoltre‚ l'alluminio e le sue leghe presentano una bassa resistività: ad esempio, 2.65 µΩ·cm per l'Al e fino a 3.5 µΩ·cm per le sue leghe. Bisogna, tuttavia, prestare attenzione ad alcuni problemi associati con la formazione di un buon contatto alluminio-silicio, quali:
• la deformazione dell'interfaccia, a causa della formazione di punte (spiking); • l’elettromigrazione.
Benché, grazie ad una serie di accorgimenti introdotti per superare questi problemi, la tecnologia basata sull’utilizzo dell’alluminio sia arrivata ad uno standard di qualità
elevatissimo, ci sono condizioni che non possono essere soddisfatte. La riduzione delle sezioni delle interconnessioni ha portato all’aumento della densità di corrente circolante, aumentando il problema dell’elettromigrazione; altra necessità, per evitare che le interconnessioni rallentino i processori, è quella di rendere le costanti di ritardo RC le più piccole possibili.
Tra le varie alternative possibili il rame presenta buoni requisiti: una resistività di 1.67 µΩ·cm, più bassa dei 2.65 µΩ·cm dell’Al e una grande resistenza all’elettromigrazione, di uno o due ordini di grandezza migliore rispetto a quella dell’Al. Grazie a queste proprietà l’utilizzo del rame ha subito una grossa spinta. L’ulteriore compatibilità con l’ossido di silicio, che ha proprietà meccaniche, termiche ed elettriche di cui difficilmente si potrebbe fare a meno, ha contribuito fortemente allo sviluppo della tecnologia del rame.
1.4.2 Problemi per l’utilizzo del rame
Per utilizzare il rame si sono dovuti risolvere essenzialmente tre problemi: come depositarlo, come imprimere la geometria desiderata e come attaccarlo. Per quanto riguarda l’alluminio, esso viene deposto per sputtering o evaporazione; si definisce la geometria tramite fotolitografia e si rimuove il metallo in eccesso tramite un attacco chimico. Segue quindi la deposizione uno strato isolante, tipicamente ossido di silicio deposto per CVD (Chemical Vapour Deposition), per riempire le cavità tra le linee metalliche, in modo da isolare le linee e planarizzazare la superficie. Una volta effettuata la planarizzazione meccanica della superficie (lappatura), il metallo e l’ossido
isolante diventano la base per il successivo livello di metallizzazione. L’alluminio, come noto, forma un ossido autopassivante e resistente alla corrosione.
Il rame differisce molto dall’alluminio. Per prima cosa, il rame non può essere attaccato chimicamente a basse temperature. Si corrode facilmente in quanto l’ossido è instabile e poco duro. Inoltre è difficile ottenere una buona adesione con gli altri materiali, in parte a causa di un ossido così poco compatto. Tali differenze hanno obbligato a sviluppare una tecnologia interamente nuova. IBM ha inventato e sviluppato il processo
Damascene, dove i passaggi per la definizione delle metallizzazioni sono praticamente
rovesciati: invece di imprimere la geometria della metallizzazione con le tecniche litografiche tradizionali, viene sagomato in negativo l’ossido di isolamento mediante la creazione di solchi. Questi ultimi vengono riempiti con il metallo e l’intera superficie viene poi lappata con i consueti metodi chimico-meccanici (CMP: Chemical -
Mechanical Polishing). Il primo problema è stato trovare un buon metodo per la
deposizione. Le tecniche di evaporazione e di sputtering adottate per l’alluminio non hanno dato buoni risultati con il rame ed il riempimento dei solchi praticati nell’ossido è stato tutt’altro che ottimale: il rame aderisce alle pareti, ma poi coalesce alla sommità del solco producendo così cavità che aggravano il fenomeno dell’elettromigrazione. L’elettrodeposizione si è quindi rivelata la soluzione migliore. Poiché l’elettrodeposizione implica l’immersione in una soluzione, piuttosto che la deposizione in una camera ad alto vuoto, ed è noto che la contaminazione è la causa predominate di difetti nella fabbricazione dei circuiti integrati, l'idea di utilizzare questa tecnica è sembrata a molti rivoluzionaria, forse anche perché risulta poco intuitivo che un bagno di placcatura possa essere più pulito del vuoto. In effetti, non vi è carica elettrostatica
che possa attrarre polvere ed è inoltre possibile controllare elettrochimicamente gli ioni che migrano sul wafer di silicio. Nel vuoto, invece, nel caso di deposizione o sputtering, il mezzo è un plasma di particelle cariche ed il wafer è polarizzato in modo da poter attrarre il metallo da depositare. Tuttavia il campo elettrico applicato attrae anche gli eventuali contaminanti. Il rame deposto mediante elettrodeposizione ha dimostrato di possedere una resistenza all’elettromigrazione eccezionalmente alta, così come una migliore compattezza; inoltre il processo è risultato molto veloce ed economico e si è imposto in sostituzione della più affermata tecnica CVD. Alcune misure effettuate nei laboratori IBM hanno messo in luce che nelle interconnessioni così realizzate non erano presenti difetti, come vuoti o interruzioni circuitali. Un altro punto importante per ottenere il successo della tecnologia del rame è stata l’eliminazione dei problemi di contaminazione. Il rame ha una mobilità superiore all’alluminio e diffonde più facilmente attraverso l’ossido di isolamento e il silicio stesso, più di qualsiasi altro metallo: sono sufficienti le più piccole contaminazioni di rame per degradare le proprietà dei transistor. La presenza di campi elettrici durante il normale funzionamento di un circuito integrato non può che accelerare i processi di diffusione nell’ossido di silicio. Di qui l’importanza che ha assunto la ricerca di materiali che costituiscano un’efficace barriera alla diffusione del rame. Nel processo Damascene, il materiale di barriera deve essere deposto prima del rame, sulle superfici che costituiscono i solchi delle interconnessioni. Tale barriera deve essere necessariamente un metallo, in quanto deve garantire il contatto elettrico con il circuito sottostante.
1.4.3 Processo Dual Damascene
Il processo Damascene prevede la realizzazione di linee di interconnessione mediante la creazione prima di solchi o canali in uno strato dielettrico planare ed il loro riempimento poi con un metallo. Rispetto alle tecniche tradizionali, nel processo Damascene i passaggi per la definizione delle metallizzazioni sono praticamente rovesciati: invece di imprimere la geometria della metallizzazione con le tecniche litografiche tradizionali, viene sagomato in negativo l’ossido di isolamento mediante la creazione di solchi. Questi ultimi vengono riempiti con il metallo e l’intera superficie viene poi lappata con i consueti metodi chimico - meccanici (CMP: Chemical - Mechanical Polishing).
Il vantaggio principale del processo Damascene è che elimina la necessità di rimuovere il metallo con attacco chimico per la definizione delle geometrie. E questo è un aspetto importante dal momento che i processi industriali si stanno evolvendo dall’alluminio al rame, e il rame è difficile da rimuovere chimicamente in maniera selettiva. Un secondo vantaggio è che non necessità della deposizione di un materiale isolante dopo la deposizione del metallo. Un altro vantaggio è che il metodo Damascene aggira alcuni problemi associati alle tolleranze litografiche, permettendo di raggiungere più alte densità di interconnessione. Nel processo Dual Damascene vi è la presenza di due strati di dielettrico: nel primo sono realizzate le metallizzazioni, nel secondo sono realizzati i contatti, mediante attacco chimico; tutte queste cavità sono poi riempite con il metallo. Dopo la deposizione, il metallo e l’isolante sono planarizzati con una lappatura chimico-meccanica (CMP).
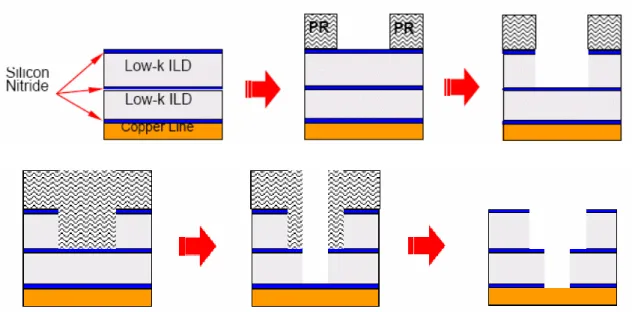
La prima versione del processo prevedeva la fabbricazione delle trenches e in un secondo momento quella delle vias. In figura 1.5 è rappresentato schematicamente il
processo. Inizialmente vengono realizzati due strati che alternano nitruro di silicio e dielettrico (in figura è indicato un dielettrico a bassa costante dielettrica). Con un passo litografico standard e un attacco dry anisotropo viene realizzato un solco, fino allo stop
layer costituito dallo strato intermedio di nitruro di silicio.
Figura 1.5: Processo Dual Damascene realizzato con l’approccio first-trench.
Il processo viene ripetuto: il fotoresist è nuovamente applicato e sagomato mediante processo litografico. Segue un ulteriore attacco dry che viene fermato dalla barriera di nitruro di silicio situata sul fondo della via. A questo punto viene rimossa la barriera sul fondo con un attacco particolare, effettuato a bassa energia, e viene rimosso il resist. Una sottile barriera di Ta/TaN è deposta per impedire la diffusione del rame all’interno del dielettrico e si procede con la deposizione del seed layer mediante CVD, PVD (Physical Vapour Deposition). La cavità è riempita con rame mediante elettrodeposizione e viene lappata a superficie con CMP. Per incapsulare il rame viene
infine deposto una barriera di nitruro di silicio. I problemi di questo processo sono essenzialmente due:
• la deposizione di resist in trenches crea zone di diverso spessore proprio nelle zone dove devono essere realizzate le vie;
• realizzare via di buona qualità in resist così spessi è molto difficile tecnologicamente.
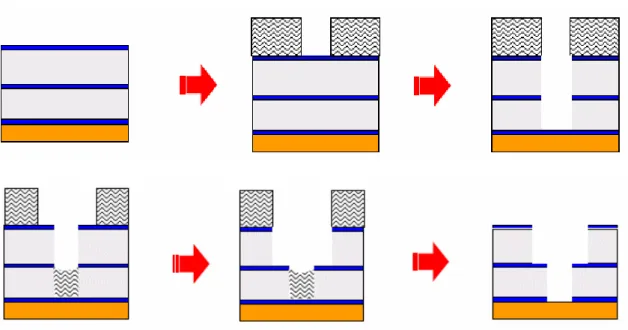
Per superare queste problematiche è stato sviluppato un processo alternativo che prevede prima la realizzazione delle vias (fig.1.6).
Figura 1.6: Processo Dual Damascene realizzato con l’approccio first-via.
La struttura di partenza è la solita: in questo caso, però, l’attacco anisotropo dry viene prolungato fino al raggiungimento della barriera di nitruro sul fondo della via. Questo è il passaggio critico perché se la barriera viene rotta il rame sottostante può diffondere nel dielettrico danneggiando il dispositivo in maniera irreparabile. Il resist viene applicato di nuovo e sagomato. Parte del resist rimarrà sul fondo della via e proteggerà la parte finale della via stessa dall’attacco per la realizzazione delle trenches. A questo
punto viene attaccato il dielettrico, per realizzare la trench, con un attacco anisotropo di tipo dry, che si deve arrestare sullo strato di nitruro di silicio intermedio. Dopo la rimozione del resist il processo prosegue come visto nel caso precedente, senza alcuna differenza. Questo approccio è utilizzato per dispositivi a geometrie molto piccole perché previene l’accumulo di resist in zone che devono essere litografate con estrema precisione.
1.5 Sistemi elettrochimici industriali per la deposizione di rame
[12]L’obiettivo pratico principale è di permettere che la reazione avvenga simultaneamente su tutta la superficie del wafer per ogni wafer processato. La capacità di riempire cavità dipende fortemente dalle condizioni elettrochimiche locali, tra cui l’overpotential e la concentrazione delle numerose specie presenti nella soluzione: gli additivi, i prodotti di reazione di questi additivi, gli ioni di cloro, l’acido solforico, e degli ioni di rame. Le tre condizioni più importanti che devono essere rispettate in una cella per il plating sono:
• la composizione della soluzione deve essere costante nel tempo;
• l’overpotential sulla superficie del wafer deve essere uniforme su tutti i punti del
wafer e consistente da wafer a wafer;
• le condizioni di trasferimento di massa devono essere uniformi così che la concentrazione locale delle specie nella soluzione adiacente alla superficie dell’elettrodo non vari lungo la superficie del wafer.
Questi fattori sono i punti fondamentali per il disegno e la progettazione delle moderne celle per il plating. Considerando il terzo punto, per esempio, il wafer solitamente è
tenuto a faccia in basso nell’elettrolita ed è ruotato durante l’elettrodeposizione. La rotazione dà il vantaggio di neutralizzare cause di disuniformità azimutali nella distribuzione di corrente. Le conseguenze di un non uniforme trasferimento di massa lungo il wafer comporta differenze tra il centro e la periferia per quel che riguarda:
• il comportamento del riempimento delle cavità (anche se questo può dipendere anche da una disuniformità della densità di corrente).
• il grado di overplating in zone con elevata densità di impacchettamento di
trenches sottili.
• la concentrazione di impurità (atomi di S, N, O, C, Cl) nel rame.
Ci sono poi altri importanti requisiti di importanza pratica. Per esempio, fare contatti elettrici sul wafer è una questione di importanza fondamentale perché coinvolge considerazioni di resistenza di contatto, ripetibilità, difetti, prevenzione dal danneggiamento di film di dielettrici a bassa costante dielettrica, il tempo di vita e il costo delle parti consumabili e il controllo dei residui. Un’altra questione importante è come il wafer viene immerso nella soluzione. E’ importante che non rimanga intrappolata aria o che non ci sia una diseguale bagnatura della superficie del wafer. Spesso si ricorre ad una prebagnatura e ad una sequenza di introduzione del wafer nella soluzione che prevenga questi problemi.
Per prevenire la corrosione del seed layer, durante l’immersione del wafer, ma prima di iniziare la deposizione, è norma tenere il catodo ad un potenziale fisso e poi passare alla modalità di corrente controllata utilizzata per il plating. E’ pratica comune usare basse densità di corrente nei primi stadi di deposizione, quando avvengono molti dei riempimenti critici, per incrementare poi la corrente nelle fasi successive.
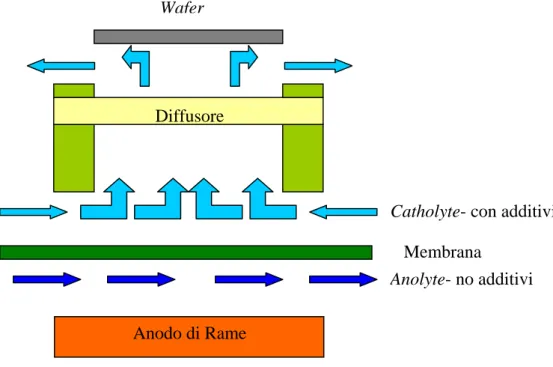
Le celle in produzione attualmente utilizzano degli anodi di rame. Gli anodi sono stati storicamente una fonte di residui e particelle di rame, che possono essere rilasciati nell’elettrolita e depositarsi su ogni superficie, incluso il wafer, creando dei difetti, per esempio i copper ball defect, che possono danneggiare l’integrità di tutta la struttura, specialmente se si tratta di metallizzazioni. Inizialmente si ricircolava il bagno attraverso un filtro, in modo da ridurre questi residui. L’ultima generazione di celle prevede la presenza di una membrana porosa che divide la parte anodica, contenente l’elettrodo di rame, con le sue impurità, da quella catodica, dove è presente il bagno elettrolitico, con tutti gli additivi utilizzati, ma senza le impurità anodiche (fig.1.7).
Wafer
Diffusore
Anodo di Rame
Catholyte- con additivi
Membrana
Anolyte- no additivi
Figura 1.7: Illustrazione di una cella che utilizza una membrana selettiva per separare anodo e catodo (wafer).
Mentre gli ioni di rame possono passare senza problemi, non c’è flusso di fluido attraverso la membrana di separazione. Non c’è modo per le impurezze originate
dall’anodo di creare difetti sul wafer. Tale struttura evita anche che gli additivi organici, che sono fondamentali per il processo di elettrodeposizione, reagiscano sulla superficie dell’anodo, comportando i seguenti problemi: la dose di additivi deve essere maggiorata, perché gli additivi, specialmente gli acceleratori, sono consumati; il consumo degli additivi dipende dalle condizioni della superficie dell’anodo, che però variano nel tempo, tendendo a far diventare il consumo instabile e impredicibile; i prodotti di reazione, molti dei quali sono elettrochimicamente attivi, si accumulano nel bagno e danneggiano l’elettrodeposizione nel wafer.
L’introduzione della membrana evita completamente questi problemi, inoltre la stabilità del processo e la durata dell’elettrolita ne traggono vantaggio. Il bagno viene periodicamente sostituito con varie metodologie: nelle prime celle venivano usati grossi quantitativi di elettolita, 150-200 L e, a intervalli regolari, frazioni del 15-20 % erano tolte e sostituite da una soluzione nuova; recentemente sono usati minori quantitativi di soluzione, 15 L, che vengono usati per un numero predefinito di wafer per poi essere buttati. Viene usato questo approccio perché, con la riduzione delle geometrie in gioco, il processo diventa sempre più critico e è sempre più indispensabile avere un limitato accumulo di prodotti di reazioni degli additivi. In questo modo si evita anche di dover costantemente monitorare e dosare gli additivi. In molti di questi sistemi per l’elettrodeposizione è presente un sistema per fare un annealing subito dopo la deposizione. E’ noto, infatti, che l’annealing è importante per controllare la grandezza dei grani, lo stress, i difetti e la resistenza all’elettromigrazione e allo stress. Non esiste una procedura standard perché gli effetti del processo di annealing sono complessi e dipendono da molti fattori come la composizione del bagno, le condizioni di plating, lo
spessore del film e altri ancora. C’è quindi un’ampia gamma nel modo in cui l’annealing è usato.