CAPITOLO 4 : RISULTATI
4.1 CONSIDERAZIONI FLORISTICHE
Nell’ habitat studiato sono state identificate un totale di 81 specie macroalgali, di cui 11 Chlorophyta, 6 Ochrophyta e 64 Rhodophyta (Tabella 4.1) .
I taxa più abbondanti che crescono sulle corallinacee sono risultati : Flabellia
petiolata, Meredithia microphylla, Peyssonnelia rubra, Phyllophora crispa, Tricleocarpa fragilis e Womersleyella setacea.
Specie come Pseudochlorodesmis furcellata, Acrothamnion preissi, Eupogodon
planus, Jania adhaerens, Womersleyella setacea, Halimeda tuna, Osmundea pelagosae,
sono presenti in tutti i campioni esaminati anche se con un basso ricoprimento.
Tabella 4.1 Lista delle specie macroalgali identificate nel coralligeno dell’area di studio:
S1 s1 s1 s2 s2 s2 d1 d1 d1 d2 d2 d2 FELTRO
Chlorophyta
Cladophora echinus (Biasoletto) Kutzing 0 0,3 0 0,6 0 0 0,5 0,5 0 0 0,5 0 Cladophora pellucida (Hudson) Kutzing 0 0 0,3 0 0 0 0 0 0 0 0 0 Cladophora prolifera (Roth) Kutzing 1 0,6 0 0 1 0 0,5 2 0 2 0 0,5
Cladophora sp 0 0 0 0 0 0 0 0 0,1 0 0 0,3
Derbesia tenuissima (De Notaris) P.L. et H.M. Crouan
0 0 0,5 0 0 0 0 0 0 0 0 0,3 Pseudochlorodesmis furcellata (Zanardini)
Borgesen
1 0,5 1,1 0,1 1 0,5 0,3 0,4 1,1 0,6 0,3 0,7
Ochrophyta
Dictyota linearis (C.Agardh) Greville 0,8 1,1 0,5 0,8 1,4 1 0,1 0,3 1,1 0,1 0,3 1,9 Sphacelaria cirrosa (Roth) C.Agard 1 0,3 0 0,1 0,2 0,1 0 0 0,1 0 0 0 Sphacelaria plumula Zanardini 0 0 0 0 0 0 0,2 0 0 0 0 0,1 Rhodophyta
Acrothamnion preissi (Sonder) Wollaston 0,4 0,1 0,3 3,5 0,9 0,4 2,2 1,5 0,5 0,7 0,8 2,2 Aglaothamnion tenuissimum (Bonnemaison)
G. Feldman
0,1 0,1 0 0,3 0,1 0,2 0,1 0,1 0 0,1 0,1 0,1 Aglaothamnion tripinnatum (Grateloup)
G.Feldmann
Antithamnion cruciatum (C.Agard) Nageli 0 0 0 0 0 0 0 0 0,5 0 0 0,3 Anthithamnion piliferum Cormaci & G.
Furnari
0 0 0 0 0 0,2 0,6 1,5 0,1 0,7 0,6 0 Antithamnion heterocladum Funk 0 0,1 0,1 0 0,2 0 0 0 0,1 0 0 0 Antithamnion tenuissimum (Bonnemaison)
G.Feldmann
0,1 0 0 0 0,5 0 0 0 0,1 0 0 0,1 Apoglossum ruscifolium (Turner) J. Agardh 0,1 0,1 0 0,3 0,7 0,2 0 0 0 0 0 0 Botryocladia boergesenii G. Feldmann 0 0 0,4 0 0 0 0 0 0,6 0 0 0,3 Botryocladia botryoides (Wulfen)
G.Feldmann
0,4 1,7 0,2 0,7 2 1 0,5 0,4 0 1 0,5 0,2
Ceramium bertoldi Funk 0 0,1 0 0 0 0 0 0 0 0 0 0
Ceramium bisporum D.L. Ballantine 0 0,1 0 0 0 0 0 0 0 0,1 0 0 Ceramium gracillimum (Kutzing) Zanardini 0 0,1 0 0 0,1 0 0 0 0 0 0 0,1 Ceramium codii (Richards) G.Feldman 0 0 0 0 0,1 0 0 0 0,1 0 0,1 0 Ceramium comptum Boergesen 0 0 0 0 0 0 0 0,1 0 0 0 0 Ceramium diaphanum (Lighfoot) Roth 0,1 0 0 0 0,1 0 0 0 0,1 0 0 0 Champia intricata J.Cremades 0,2 0,3 0,1 0,1 0,1 0,3 0 0,1 0 0,1 0,1 0,1 Chondria tenuissima (Witering) C.Agard 0 0 0 0 0 0 0,1 0 0 0 0 0 Crouania attenuata (Bonnemaison ex
C.Agarth) J.Agardh
0,2 0 0 0,4 0 0,1 0 0,1 0,1 0,1 0,1 0,3 Cryptonemia tuniformis (Bertolini) Zanardini 0 0 0 0 0,2 0 0,5 0,4 0 3 0 0 Dasya baillouviana (S.G.Gmelin)Montagne 0 0 0 0 0 0 0,2 0,5 0 2 0,5 0 Dasya ocellata (Grateloup) Harvey 0 0 0 0 0 0 0 0 0,2 0 0 1,5 Dasya rigidula (Kutzing) Ardissone 0,1 0 0 0 0,2 0 0 0 0 0 0 0 Eritroglossum sandrianum (Zanardini) Kilin 0 0 0 0 0 0 0 0 0 0 0 0,3 Eupogodon planus (C.Agardh) Kutzing 0,2 0,7 2,1 0,8 2,5 1,2 1,5 1 1,4 0,1 1,5 0,2 Falkenbergia rufolanosa (Harvey) Schmitz 0,2 0 0,2 0 0,1 0 0 0 0 0 0 0 Feldmannophycus rayssiae (J.et
G.Feldman) Augier et Boudouresque
0,4 0,7 0,6 0,8 1 0,7 1,2 0,1 1,1 1 0,8 0 Gelidium bipectinatumG.Furnari 0 0 0 0 0 0,4 0 0 0 0 0 0 Gelidiella lubrica (Kutzing) G.Feldman et
Hamel
0 0 0 0 0 0 0 0 0 0 0 0,3 Griffitsia shoesboei Montagne 0 0 0 0,1 0 0 0 0 0 0,1 0 0 Jania adhaerens J.V.Lamouroux 2,4 2,8 3,2 4,5 2,4 4,3 0,3 0,8 0,4 0,2 0,6 1 Halodictyon mirabile Zanardini 0,2 0 0 0 0,3 0 0 0 0 0 0 0 Heterosiphonia crispella (C.Agardh) Wynne 0,2 0,2 0,7 0,3 0,5 0 0,2 0,3 0,4 0,1 0,5 0,3 Hypoglossum hypoglossoides (Stackhouse)
Collins et Hervey
0 0,3 0,9 0,5 0 0,1 0,1 0 1,1 0,6 0,1 0 Lomentaria chylocladiella Funk 0 0,1 0 0 0 0,2 0,1 0,1 0 0 0,1 0 Monosporus pedicellatus (Smith) Solier 0 0,1 0 0,1 0 0 0,2 0,1 0 0 0,2 0 Nitophyllum micropunctatum (Stackhouse)
Greville
0 0,3 0 0,2 0 0 0 0 0 0 0 0,1 Plocamium cartilagineum (L.) Dixon 0 0,1 0 0 0 0 0,1 0,1 0,4 0,2 0,2 0 Polysiphonia furcellata (C.Agardh) Harvey 0,1 0,2 0 0,3 1,4 0,5 0 0 0 0 0 0 Polisiphonia perforans
Cormaci,Furnari,Pizzuto et Serio
0 0 0 0 0 0 0 0 0 0,1 0 0 Polysiphonia scopulorum Harvey 0 0 0 0 0,1 0 0 0 0 0 0 0 Pterothamnion plumula (J.Ellis) Nageli 0 0 0 0 0 0 0,1 0 0 0,1 0 0,1 Ptilothamnion pluma (Dillwyn) Turet 0 0 0 0 0,1 0 0 0,1 0 0 0 0 Radicilingua reptans (Kilin) Papenfuss 0 0 0 0 0 0,2 0 0 0 0 0 0 Rhodophyllis divaricata (Stackhouse)
Papenfuss
0,1 0,1 0 0,1 0,2 0 0,1 0 0 0,1 0,3 0 Rodriguezella strafforelii F.Scmitz ex
J.J.Rodriguez
0,3 0,2 0 0,8 1,8 0 1,5 0,5 0,2 1,6 1 0,8 Womersleyella setacea (Hollenberg)
R.E.Norris
14 12 15 21 12 13,3 3 7 13 2,2 4 4,3 Wrangelia penicillata (C.Agardh) C.Agardh 0,1 0,2 0,1 0 0 0 0 0 0 0 0 0
STRATO INCROSTANTE Chlorophyta
Codium bursa (L.) C.Agardh 0 0 0,2 0 0 0 0 0 0 0 0 0 Palmophyllum crassum (Naccari)
Rabenhorst
0 0 0 0 0 0 0 0,2 0 0 0 0 Valonia macrophysa Kutzing 0,1 0 0 0 0 0 0,1 0 0 0 0 0 Ochrophyta
Aglaozonia chilosa (Falkenberg) 0 0 0 0 0 0 0 0,1 0 0,1 0,1 0 Zanardinia typus (Nardo) P.C.Silva 0 0 0 0 0 0 0 0,5 0 0 0 0 Rhodophyta
Contarina peyssonneliaeformis Zanardini 0,4 0,3 0 0 1 0,8 0,1 0 0 0 0,2 0 Peyssonnelia bornetii Boudouresque et
Denizot
0 0 0 0 0 0 0 0 0,3 0 0 0 Peyssonnelia rubra (Greville) J.Agardh 27 12 9,3 3 8 3 8 8 36 12 16 21 Peyssonnelia squamaria (Gmelin) Decaisne 3 0 0 0 0 0 0 0 0 0 0 0 Peyssonnelia stoechas Boudouresque et
Denizot
0,7 0 0 0,7 0 0 0 0 0 0 0 0
STRATO ERETTO Chlorophyta
Flabellia petiolata (Turra) Nizamuddin 30 40 19 43 33 66,6 0 0,1 0,8 0,5 2 0 Halimeda tuna (Ellis et Solander)
Lamouroux
3,4 2,2 1,5 4 4,7 4 0 0,2 1,3 1 0,5 1
Ochrophyta
Halopteris filicina (Grateloup) Butters 1,2 0 0 0 0 0 6,5 2 1,1 3,2 0,8 3,3 Rhodophyta
Acrodiscus vidovichii (Meneghini) Zanardini 0,4 7,2 1,5 0,4 9 0,2 0 2 0 1,2 2,2 0,1 Acrosorium venulosum Zanardini (Kylin) 0 0,3 0,1 0 0 0 0,2 0 0,3 0 0,4 0 Amphiroa criptarthrodia Zanardini 0 1 0,8 0 0 0 0 0 0 0 0 0 Laurencia chondroides Boergesen 2 1,7 1 1,4 1,5 2 0,5 0,5 1,1 0 0 0,9 Meredithia microphylla (J.Agardh) J.Agardh 0,5 2 3,5 0,7 0 0 1 15 0 8 21 12 Osmundea pelagosae (Shiffner) Nam 6,2 1,7 0,8 2,5 3,5 2 8 6 4 2,2 2,5 0,3 Phyllophora crispa (Hudson) Lamouroux 0 0 0 0 0 0 40 20 0 7 5 3 Rhodymenia ardissonei (Stackhouse) 0,4 0 0 0 0 0 0 0 0 0 0 0 Rytiphloea tinctoria(Clemente) C.Agardh 0 0 0,1 0 0 0 2 0 1,1 3 0 1 Sphaerococcus coronopifolius (Stackouse) 0 0 0 11 0 0 0 0 0 0 0 2 Trichleocarpa fragilis (Linnaeus) Huisman et
R.A.Towsend
4.2 ANALISI MULTIVARIATA
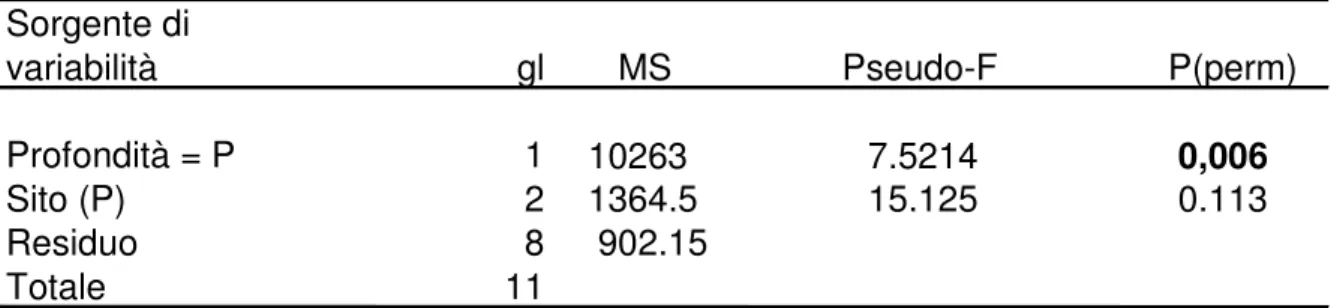
L’analisi PERMANOVA mostra differenze significative nella struttura del popolamento tra le due profondità, mentre non ci sono differenze tra siti (Tabella 4.2.1).
Il Simper test evidenzia che Flabellia petiolata, Meredithia microphylla,
Peyssonnelia rubra, Phyllophora crispa, Tricleocarpa fragilis e Womersleyella setacea
sono i taxa più abbondanti nel determinare le separazioni tra i popolamenti a 25 m. e quelli a 35 m. di profondità (Tabella 4.2.2).
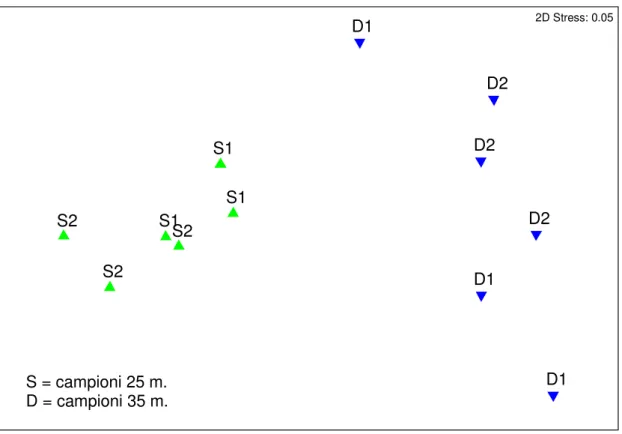
Questo risultato è confermato dal nMDS che dove si nota una netta separazione tra i campioni alle due profondità (Figura 4.2.1).
E’ inoltre possibile osservare che i campioni prelevati a 35 m sono più dispersi rispetto a quelli prelevati a 25 m (Figura 4.1.1).
Questa osservazione trova conferma nel dendrogramma basato sull’indice di similarità di Bray-Curtis, nel quale risulta evidente che il cluster che comprende i campioni più superficiali (25 m) ha un livello di similarità di circa il 60 %, mentre il cluster che raggruppa i campioni più profondi (35 m) ha un livello di similarità di circa il 40 % (Figura 4.2.2).
Tabella 4.2.1 Risultati della PERMANOVA sulla struttura dei popolamenti dell’area di studio.
( I valori in grassetto sono significativi) Sorgente di
variabilità gl MS Pseudo-F P(perm) Profondità = P 1 10263 7.5214 0,006 Sito (P) 2 1364.5 15.125 0.113
Residuo 8 902.15
Tabella 4.2.2 Risultati del Simper test sul contributo percentuale delle specie determinare le significative differenze tra profondità. (S= 25 m.; D= 35 m.)
S1 S1 S1 S2 S2 S2 D1 D1 D1 D2 D2 D2 2D Stress: 0.05
Figura 4.2.1 Modello di ordinamento (n MDS) dei dati non trasformati basato sull’indice di dissimilarità di Bray-Curtis dei campioni a 25 m. (S) e dei campioni a 35 m. (D).
S = campioni 25 m. D = campioni 35 m. Specie Abbondanza relativa (S) Abbondanza relativa (D) Contributo %
Flabellia petiolata (Turra) Nizamuddin 38,74 0,56 31,41
Phyllophora crispa (Hudson) Lamouroux 0 12,5 9,99
Peyssonnelia rubra (Greville) J.Agard 10,24 16,77 9,1
Tricheocarpa fragilis (Linnaeus) H.etT. 10,5 1,42 7,95
Womersleyella setacea (Hollenberg) R.E.Norris 14,56 5,53 7,67
Meredithia microphylla (J.Agard) 1,12 9,44 7,47
Acrodiscus vidovichii (Meneghini) Zanardini 3,11 0,92 2,44
Jania adhaerens Lamouroux 3,26 0,53 2,29
Halopteris filicina (Grateloup) Kutzing 0,2 2,8 2,18
Halimeda tuna (J.Elis et Solander)J.V.Lamouroux 3,3 0,65 2,16
Osmundaea pelagosae (Shiffner) F.W.Nam 2,78 3,83 2,14
Sphaerococcus coronopifolius Stackhouse 1,83 0,33 1,7
Rytiphloea (Clemente) C.Agardh 0,02 1,17 0,98
Acrothamniom preissi (Sonder) Wollaston 0,93 1,3 0,95
Laurencia chondroides Boergesen 1,59 0,5 0,9
Eupogodon planus (C.Agardh) Kutzing 1,24 0,95 0,74
Figura 4.2.2 Dendrogramma basato sull’indice di similarità di Bray-Curtis dei campioni.
4.3 ANALISI UNIVARIATA
Questa analisi non ha evidenziato significative differenze tra profondità e tra siti per tutte le variabili considerate, ad esclusione del ricoprimento totale per il quale risulta significativo il fattore profondità (Tabella 4.1.4).
campioni s im ila ri tà
4.3.1 Numero medio di specie e ricoprimento totale percentuale
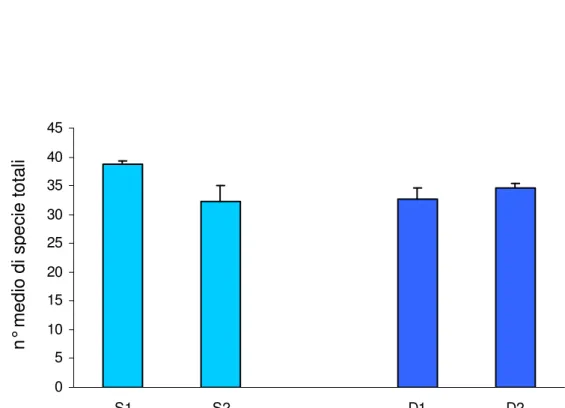
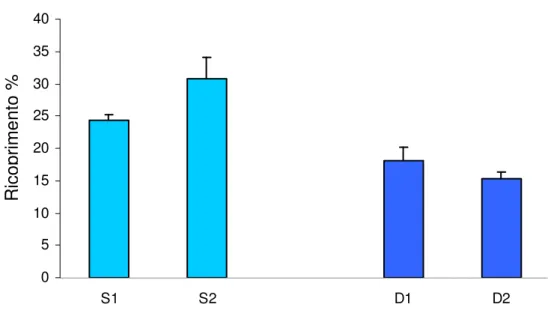
Il numero medio di specie per sito oscilla tra (32,33 +/- 2,6) e (38,67 +/- 0,67) (media +/- SE, n= 3) (Figura 4.3.1), mentre il ricoprimento totale percentuale per sito varia tra (60,67 +/- 2,26) e (104,48+/- 0,64) (Figura 4.3.2)
Tabella 4.3.1 Risultati dell’analisi della varianza sul numero medio di specie totali (n.s.= non significativo). 0 5 10 15 20 25 30 35 40 45 S1 S2 D1 D2
Figura 4.3.1 Numero di medio di specie totali nei due siti campionati (S= 25 m. , D= 35 m.). n ° m e d io d i s p e c ie t o ta li Numero di specie Sorgente di variabilità gl MS F P Profondità 1 10,0833 0,3 0,6364 Sito 2 33,0833 3,75 0,0711 Residui 8 8,833 Totale 11 Cochran's test C=0,57 n.s.
Tabella 4.3.2 Risultati dell’analisi della varianza sul ricoprimento medio totale percentuale. Ricoprimento Sorgente di gl MS F P Profondit 1 3613,773 21,8 0,042 8 Sito 2 165,28 1,26 0,334 Residu 8 131,218 Total 11 Cochran's C=0,88
(I valori in grassetto sono significativi) 0 20 40 60 80 100 120 S1 S2 D1 D2
Figura 4.3.2 Ricoprimento totale medio percentuale nei due siti campionati (S= 25 m. , D= 35 m.). R ic o p ri m e n to %
4.3.2 Strati vegetazionali
La percentuale di ricoprimento degli strati vegetazionali è mostrata nelle Tabelle 4.3.2.1, 4.3.2.2, 4.3.2.3.
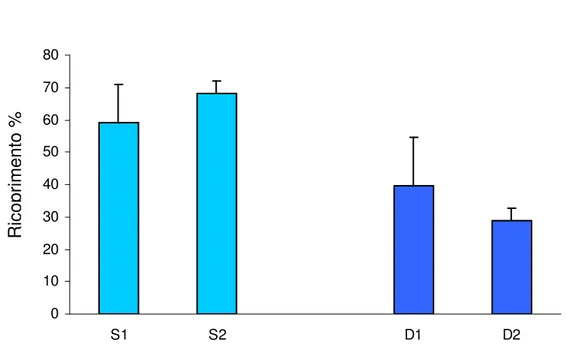
Le specie del feltro sono più abbondanti nei siti a 25 m di profondità con valori tra il 25% ed il 30% (Figura 4.3.2.1).
Le specie incrostanti non calcaree hanno in tutti i siti un ricoprimento al di sotto del 20% , ma i valori di abbondanza più elevati sono presenti nei siti a 35 m di profondità (Figura 4.2.2).
Tabella 4.3.2.1 Risultati dell’analisi della varianza sul ricoprimento medio percentuale del feltro algale (n.s.= non significativo).
0 5 10 15 20 25 30 35 40 S1 S2 D1 D2
Figura 4.3.2.1 Ricoprimento medio percentuale del feltro algale nei due siti campionati (S= 25 m. , D= 35 m.). R ic o p ri m e n to % Feltro Sorgente di variabilità gl MS F P Profondità 1 359,2696 9,83 0,0884 Sito 2 36,5439 2,74 0,124 Residuo 8 13,3369 Totale 11 Cochran's test C=0,62 n.s.
Tabella 4.3.2.2 Risultati dell’analisi della varianza sul ricoprimento medio percentuale dello strato incrostante (n.s= non significativo).
0 5 10 15 20 25 30 S1 S2 D1 D2
Figura 4.3.2.2 Ricoprimento medio percentuale dello strato incrostante nei due siti campionati (S= 25 m. , D= 35 m.). R ic o p ri m e n to % Incrostante Sorgente di variabilità gl MS F P Profondità 1 94,08 0,88 0,4474 Sito 2 107,0204 1,01 0,4056 Residuo 8 105,7192 Totale 11 Cochran's test C=0,59 n.s.
Tabella 4.3.2.3 Risultati dell’analisi della varianza sul ricoprimento medio percentuale dello strato eretto (n.s.= non significativo).
(I valori in grassetto sono significativi)
0 10 20 30 40 50 60 70 80 S1 S2 D1 D2
Figura 4.3.2.3 Ricoprimento medio percentuale dello strato eretto nei due siti campionati (S= 25 m., D= 35 m.). R ic o p ri m e n to % Eretto Sorgente di variabilità gl MS F P Profondità 1 2584,85 18,0 0,0513 Sito 2 143,454 0,48 0,6337 Residuo 8 296,920 Totale 11 Cochran' test C=0,58 n.s.
4.3.3 Specie più abbondanti
Questa analisi non ha evidenziato significative differenze tra profondità e tra siti per tutte le specie .
E’ da notare che per Flabellia petiolata, Womersleyella setacea i valori di P sono molto vicini alla soglia di significatività (Tabelle 4.3.3.1, 4.3.3.6).
Tabella 4.3.3.1 Risultati dell’analisi della varianza sul ricoprimento medio percentuale di
Flabellia petiolata (n.s.= non significativo).
Flabellia Sorgente di gl MS F P Profondit 1 4387,2 17,5 0,052 6 Sito 2 250,4 2,45 0,148 Residu 8 102,3 Total 11 Cochran's C=0,73
(I valori in grassetto sono significativi)
Figura 4.3.3.1 Ricoprimento medio percentuale di Flabellia petiolata nei due siti campionati (S= 25 m. , D= 35 m.). R ic o p ri m e n to % 0 10 20 30 40 50 60 70 S1 S2 D1 D2
Tabella 4.3.3.2 Risultati dell’analisi della varianza sul ricoprimento medio percentuale di
Meredithia microphylla (n.s.= non significativo).
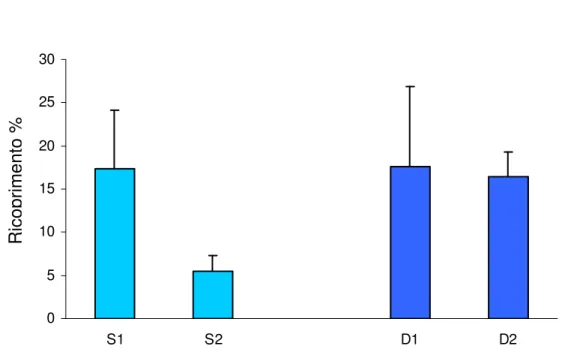
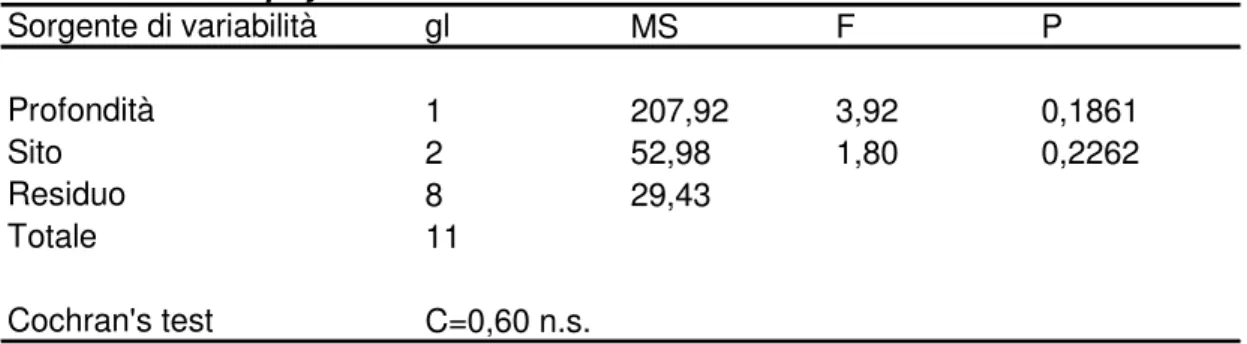
Meredithia microphylla Sorgente di variabilità gl MS F P Profondità 1 207,92 3,92 0,1861 Sito 2 52,98 1,80 0,2262 Residuo 8 29,43 Totale 11 Cochran's test C=0,60 n.s.
Figura 4.3.3.2 Ricoprimento medio percentuale di Meredithia microphylla nei due siti campionati (S= 25 m. , D= 35 m.). R ic o p ri m e n to % 0 2 4 6 8 10 12 14 16 18 20 S1 S2 D1 D2
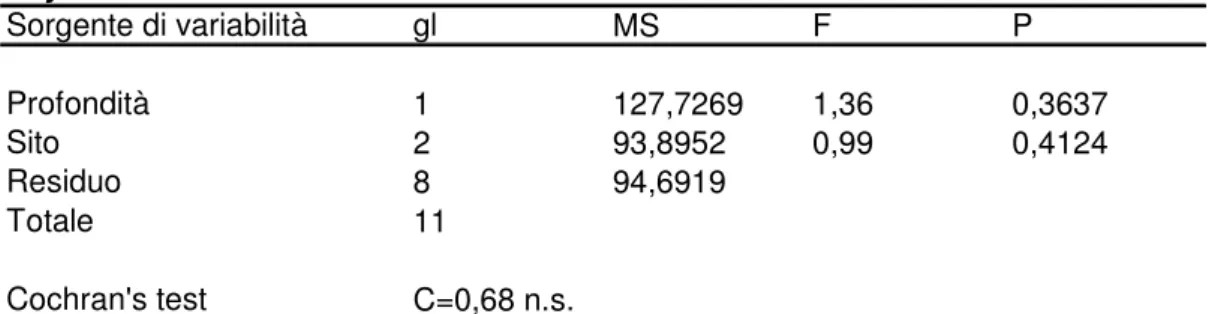
Tabella 4.3.3.3 Risultati dell’analisi della varianza di Peyssonnelia rubra in relazione alla profondità e al sito (n.s.= non significativo).
Peyssonnelia rubra Sorgente di variabilità gl MS F P Profondità 1 127,7269 1,36 0,3637 Sito 2 93,8952 0,99 0,4124 Residuo 8 94,6919 Totale 11 Cochran's test C=0,68 n.s.
Figura 4.3.3.3 Rcoprimento medio percentuale dI Peyssonnelia rubra nei due siti campionati (S= 25 m. , D= 35 m.). R ic o p ri m e n to % 0 5 10 15 20 25 30 S1 S2 D1 D2
Tabella 4.3.3.4 Risultati dell’analisi della varianza sul ricoprimento medio percentuale di
Phyllophora crispa in relazione alla profondità e al sito (n.s.= non significativo).
Phyllophora crispa Sorgente di variabilità gl MS F P Profondità 1 489,75 2,78 0,2375 Sito 2 168,75 1,67 0,2476 Residuo 8 101 Totale 11 Cochran's test C=0,99 (P<0,01)
Figura 4.3.3.4 Ricoprimento medio percentuale di Phyllophora crispa nei due siti campionati (S= 25 m. , D= 35 m.). R ic o p ri m e n to % 0 5 10 15 20 25 30 35 S1 S2 D1 D2
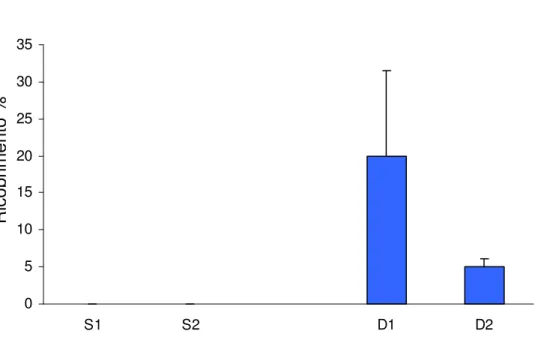
Tabella 4.3.3.5 Risultati dell’analisi della varianza sul ricoprimento medio percentuale diTricleocarpa fragilis in relazione alla profondità e al sito (n.s.= non significativo).
Tricleocarpa fragilis Sorgente di variabilità gl MS F P Profondità 1 247,5208 2,42 0,2600 Sito 2 102,2708 4,19 0,0568 Residuo 8 24,3958 Totale 11 Cochran's test C=0,59 n.s.
Figura 4.3.3.5 Ricoprimento medio percentuale di Tricleocarpa fragilis nei due siti campionati (S= 25 m. , D= 35 m.). R ic o p ri m e n to % 0 5 10 15 20 25 S1 S2 D1 D2
Tabella 4.3.3.6 Risultati dell’analisi della varianza sul ricoprimento medio percentuale di Womersleyella setacea (n.s.= non significativo).
Womersleyella Sorgente di gl MS F P Profondit 1 241,203 16,4 0,055 9 Sito 2 14,690 1,13 0,369 Residu 8 12,984 Total 11 Cochran's C=0,47 (I valori in grassetto sono significativi)
Figura 4.3.3.6 Ricoprimento medio percentuale di Womersleyella setacea nei due siti campionati (S= 25 m., D= 35 m.) R ic o p ri m e n to % 0 2 4 6 8 10 12 14 16 18 20 S1 S2 D1 D2