dell’etano
Si riportano le principali caratteristiche fisiche e termodinamiche dell’etano, per completare le informazioni relative a questo propellente riportate nel Capitolo 2.
C.1.
Proprietà termodinamiche
Temperatura Pressione Densità
del liquido Densità del vapore Entalpia del liquido Entalpia del vapore Entropia del liquido Entropia del vapore [°K] [kPa] [kg m^-3] [kg m^-3] [kJ/kg] [kJ/kg] [kJ kg^-1 °K^-1)] [kJ kg^-1 °K^-1)] 223.15 551.72 499.3 10.17 272.48 698.19 3.6149 5.5224 228.15 657.44 492.1 12.05 285.33 702.08 3.6706 5.4973 233.15 777.57 485 14.19 298.52 705.64 3.7267 5.473 238.15 912.9 477.8 16.63 312.17 708.95 3.7836 5.4495 243.15 1065 470 19.41 326.28 711.97 3.8406 5.4269 248.15 1233.7 461.5 22.54 340.47 714.64 3.8992 5.4068 253.15 1422.9 452.6 26.11 355.38 716.95 3.9549 5.383 258.15 1630.8 443.5 30.16 370.91 718.87 4.0135 5.3612 263.15 1859.3 433.9 34.73 386.32 720.38 4.0708 5.3403 268.15 2110.4 423 39.97 402.23 721.43 4.1286 5.3189 273.15 2385 411.7 45.98 418.68 721.97 4.1868 5.2971 278.15 2686 399.5 53.19 435.8 720.84 4.2463 5.2712
283.15 3015.5 386.5 62 454.06 718.25 4.3082 5.2415 288.15 3376.4 369.5 73.21 473.57 712.59 4.3769 5.2025 293.15 3774.6 350.2 87.49 494.88 705.1 4.4422 5.1594 298.15 4214.9 326 106.7 518.53 693.5 4.518 5.105 303.15 4707.2 286 142 553.03 668.67 4.6273 5.0003 304.15 4815.1 271 156 565.22 658.58 4.6662 4.9605 305.25 4932.7 213 213 610.23 610.23 4.8123 4.8123
Tabella C.1 Proprietà termodinamiche dell’etano in condizioni di vapore saturo.
220 240 260 280 300 320 250 300 350 400 450 500 550 600 650
Entalpia del liquido C2H6 sulla linea di saturazione
Temperatura [°K] En ta lp ia [kJ kg -1] 220 240 260 280 300 320 600 620 640 660 680 700 720 740
Entalpia del vapore C2H6 sulla linea di saturazione
Temperatura [°K] En ta lp ia [kJ kg -1]
220 230 240 250 260 270 280 290 300 310 0 50 100 150 200 250 300 350 400 450
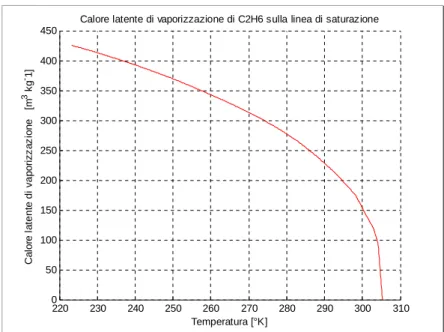
Calore latente di vaporizzazione di C2H6 sulla linea di saturazione
Temperatura [°K] C a lo re l a tent e di vap o rizz a z io n e [m 3 kg -1]
Figura C.2 Calore latente di vaporizzazione C2H6 in condizioni di vapore saturo.
220 240 260 280 300 320 3.6 3.8 4 4.2 4.4 4.6 4.8 5
Entropia del liquido di C2H6 sulla linea di saturazione
Temperatura [°K] En tr o p ia [kJ kg -1 °K -1] 220 240 260 280 300 320 4.8 4.9 5 5.1 5.2 5.3 5.4 5.5 5.6
Entropia del vapore di C2H6 sulla linea di saturazione
Temperatura [°K] En tr o p ia [kJ kg -1 °K -1)]
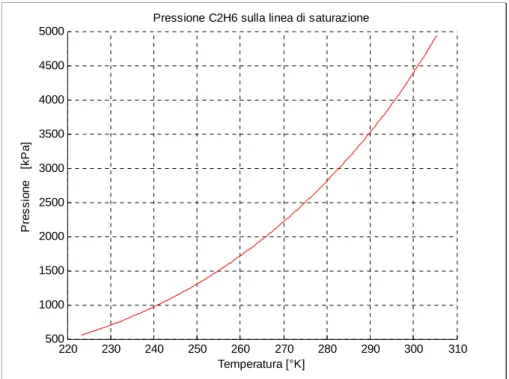
220 230 240 250 260 270 280 290 300 310 500 1000 1500 2000 2500 3000 3500 4000 4500 5000
Pressione C2H6 sulla linea di saturazione
Temperatura [°K] Pr e s sio n e [kPa ]
Figura C.4 Pressione del C2H6 sulla linea di saturazione.
220 240 260 280 300 320 2 2.5 3 3.5 4 4.5 5x 10 -3
Volume specifico del liquido di C2H6 sulla linea di saturazione
Temperatura [°K] Vo lu me s p ecifico [m 3 kg -1] 220 240 260 280 300 320 0 0.01 0.02 0.03 0.04 0.05 0.06 0.07 0.08 0.09 0.1
Volume specifico del vapore di C2H6 sulla linea di saturazione
Temperatura [°K] Vo lu me s p ecifico [m 3 kg -1]
Temperatura critica [°k] 305.25
Pressione critica [kPa] 4932.7
Volume specifico critico [m^3 kg^-1] 0.0046948
a Van der Waals [kPa m^6 kg^-2] 0.60861
b Van der Waals [m^3/kg] 0.0021377
Tabella C.2 Coefficienti di Van der Waals per l’etano.
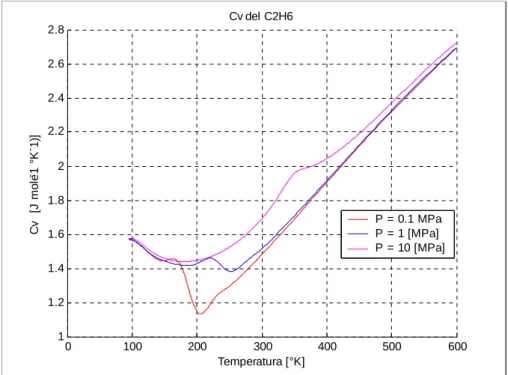
Temperatura Calore specifico a volume costante
[°K] [J mol^-1 °K^-1)]
Pressione = 0.1 Mpa Pressione = 1 Mpa Pressione = 10 Mpa
95 47.2 47.3 47.4 100 47.1 47.2 47.4 125 45 45 45.5 150 43.4 43.4 43.9 175 42.7 42.7 43.3 200 34.5 42.9 43.5 225 36.5 43.8 44.3 250 38.9 41.6 45.8 275 41.6 43.2 47.9 300 44.5 45.5 50.8 325 47.6 48.3 54.7 350 50.7 51.3 58.8 375 54 54.4 60 400 57.2 57.5 61.4 450 63.6 63.8 65.8 500 69.7 69.9 71.2 600 80.9 81 81.8
0 100 200 300 400 500 600 1 1.2 1.4 1.6 1.8 2 2.2 2.4 2.6 2.8 Cv del C2H6 Temperatura [°K] C v [J mo le -1 °K -1)] P = 0.1 MPa P = 1 [MPa] P = 10 [MPa]
Figura C.6 Calore specifico a volume costante per l’etano.
Con i valori riportati nelle tabelle è possibile costruire la campana del C2H6
0.002 0.004 0.006 0.008 0.01 0.012 0.014 0.016 0.018 0.02 270 275 280 285 290 295 300 305 310 Campana del C2H6 T em peratu ra [°K ] Volume specifico [m3 kg-1] Titolo = 0.2 Titolo = 0.4 Titolo = 0.6 Titolo = 0.8
C.2.
Riferimenti
[1] CRC Press Handbook of chemistry and physics David R. Lide, Editor in chief 84th edition 2003-2004