Strategie terapeutiche per modulare lo stress da ossigeno nel tumore e nell’infiammazione
Le specie reattive dell’ ossigeno (ROS) comprendono non solo i radicali dell’ ossigeno (anione radicale superossido O2·¯, radicale ossidrile ·OH etc)
ma anche alcuni derivati non radicali di O2 (perossido d’ idrogeno, H2O2,
ossigeno singoletto, alchil perossidi, -O-O-R, etc ) (6). Sono molecole molto piccole e molto reattive a causa della presenza di elettroni spaiati nel guscio di valenza. Le ROS sono potenzialmente pericolose e possono essere un sottoprodotto del metabolismo cellulare. Esse sono coinvolte anche in varie funzioni nello sviluppo cellulare, nella crescita, nella sopravvivenza, nella morte cellulare, nell’invecchiamento, nel metabolismo di farmaci, nella patogenesi delle infezioni virali e nello sviluppo del cancro.
Durante la produzione delle ROS, l’ossigeno molecolare normalmente agisce da accettore di elettroni per diventare radicali liberi dell’ ossigeno. Nelle specie aerobiche, dove l’ ossigeno molecolare è ubiquitario, le ROS diventano i principali mediatori di reazioni di radicali liberi nelle cellule, che sono generati durante la produzione di ATP mediante il metabolismo aerobico a livello dei mitocondri. La perdita di elettroni dai mitocondri durante le fasi di trasporto di questi nella produzione di ATP, genera ROS, come O2·¯. O2·¯ viene convertito dalla superossido dismutasi (SOD) in
H2O2, da cui è generato il radicale ossidrile ·OH in una reazione catalizzata
dagli ioni Fe2+ o Cu2+. Oltre alle ROS, si formano anche radicali liberi dell’ azoto (·NO, ·NO2 ) o specie reattive dell’ azoto (RNS), che giocano ruoli
importanti, simili a quelli delle ROS.
Sia ROS che RNS sono molecole altamente reattive, in grado di reagire velocemente e danneggiare vari tipi di biomolecole, comprese le proteine, il DNA e i lipidi. In condizioni fisiologiche, per superare la potenziale
tossicità delle ROS, le cellule hanno sviluppato una serie di sistemi di difesa antiossidanti per contrastare queste specie altamente pericolose ed estremamente reattive. Questi sistemi di difesa includono la SOD intracellulare, la catalasi e la glutatione perossidasi che eliminano O2·¯ e
H2O2. Ci sono anche altri enzimi o composti che contribuiscono ad
eliminare i radicali liberi (per esempio la eme-ossigenasi-1 (HO-1), l’acido ascorbico, il tocoferolo e il glutatione), per mezzo dei quali gli insulti cellulari causati dalle ROS sono ridotti ad un livello non tossico (Figura 3).
Figura 3. Metabolismo di ROS e RNS e sistemi di difesa antiossidanti negli
Ros e cancro: sistemi di difesa endogeni contro le ROS nelle cellule tumorali come unico bersaglio antitumorale.
Come discusso in precedenza, il bilancio della formazione delle ROS e il livello di difesa antiossidante è fondamentale per la sopravvivenza e la crescita cellulare, ed è molto importante per la cellula rimuovere le ROS correttamente per sopravvivere e mantenere la sua funzione vitale. Per esempio, la maggior parte dei batteri aerobi hanno sviluppato un sistema di antiossidanti, tra cui SOD e catalasi, che può eliminare ROS pericolose, derivati dalla respirazione aerobica o dall’ ambiente ossigenato, riducendo così i potenziali insulti. Quando è generato un enzima antiossidante difettoso mutante (es: SOD(-)) la crescita dei batteri in condizioni aerobiche viene soppressa, mentre la crescita in condizioni anaerobiche è normale. I cosiddetti batteri facoltativi possono regolare il proprio metabolismo in funzione della pressione di ossigeno (6). Un fenomeno simile è stato trovato nelle cellule tumorali. Le cellule tumorali, particolarmente nella zona centrale del nodulo o della massa tumorale, dove la pressione dell'ossigeno ambientale è bassa, cioè in condizioni di ipossia, si adattano di più come i batteri anaerobici, ed hanno bassi livelli di fosforilazione ossidativa mitocondriale. Questo fenomeno è noto da tempo come effetto Warburg. In tali condizioni di ipossia, la produzione di ATP deriva prevalentemente da glicolisi, o dalla la fermentazione degli amminoacidi. Recentemente è stato riportato che l'acetil-CoA sintetasi svolge un ruolo importante nella produzione di ATP per le cellule tumorali (7).
Vale a dire, la generazione di ATP nelle cellule tumorali ipossiche non è un fenomeno ossigeno-dipendente. Parallelamente si è osservato che le cellule tumorali sono spesso carenti degli enzimi antiossidanti cruciali, come la catalasi, la glutatione perossidasi e la SOD.
Ciò significa che le cellule tumorali presentano una elevata vulnerabilità alle ROS. In realtà, molti farmaci antitumorali convenzionali, inclusi
vinblastina, doxorubicina, camptotecina, cisplatino e inostamycin, devono in parte, se non del tutto la loro attività antitumorale alla generazione di ROS se non del tutto. In accordo con queste osservazioni, è stata sviluppata una strategia antitumorale unica chiamata "terapia di ossidazione": provocando eccesso di stress ossidativo nelle cellule tumorali o interrompendo i sistemi di difesa
antiossidanti delle cellule tumorali (6).
Un altro ruolo delle ROS nel cancro
Per quanto riguarda la relazione tra ROS e cancro, tuttavia, va notato che gli effetti biologici delle ROS nel cancro sono molteplici e non lineari. Vale a dire livelli elevati di stress ossidativo mostrano citotossicità come detto sopra, in quanto inibiscono la proliferazione cellulare e portano ad apoptosi, a morte necrotica delle cellule; mentre livelli bassi o intermedi di stress ossidativo sono più efficaci nei danni al DNA, in quanto causano mutazioni, reazioni infiammatorie e promuovono la proliferazione cellulare ed infine inducono la carcinogenesi attraverso l'iniziazione, e fanno progredire lo sviluppo del cancro. Infatti, vari studi hanno indicato che Ros sono una classe di agenti cancerogeni endogeni che attivano la mutazione delle cellule. L'infezione cronica da Helicobacter pylori, virus dell'epatite C, virus del papilloma umano e la loro carcinogenesi può essere spiegata con questo meccanismo. Vale a dire, livelli patologici di ROS inducono un aumento del danno al DNA, che accompagna l’ inizio della mutagenesi attraverso le modifiche del DNA e l’ alterazione della riparazione (8/9). Inoltre, le RNS, compreso l’ ossido nitrico e suoi derivati, come il perossinitrito (ONOO¯) svolgono un ruolo importante nello sviluppo del cancro e nelle infezioni virali. Maeda e altri ricercatori hanno trovato che
nel corso di infezioni virali e batteriche, la produzione di NO è rafforzata attraverso la up-regolazione di ossido nitrico sintasi inducibile (iNOS) nel sito di infezione o di infiammazione, parallelamente è noto che si ha produzione di O2·¯ dall’ attivazione di xantina ossidasi o dall'attivazione di
NADPH fino alla generazione di NO (10/11).
NO e O2·¯, reagiscono immediatamente e, viene generato ONOO¯, che
gioca probabilmente il ruolo più importante nella carcinogenesi, e anche nelle metastasi attivando metalloproteinasi della matrice (MMP). E’ stato inoltre riportato che in tali condizioni di ampia generazione di ONOO¯, c’è un aumento delle mutazioni virali e batteriche. Inoltre lo stress ossidativo può stimolare l’espansione dei cloni delle cellule mutate attraverso la modulazione dei geni che è legata alla proliferazione e alla produzione della cascata di segnale redox-sensibili, come il fattore di crescita epidermico (EGF), la fosforilazione della tirosina, la proteina chinasi C (PKC), e fattori di trascrizione che regolano l’infiammazione e l’apoptosi, incluso NF-kB, la proteina attivatrice 1(AP-1), e il fattore Nrf2 (NF-E2 related factor). In aggiunta, ASK1, che è membro della famiglia mitogeno-attivata di proteine chinasi chinasi chinasi ( MAPKKK) , gioca un ruolo cruciale nelle risposte cellulari ROS-mediate ( ES H2O2 ). Ossia, ROS come H2O2 attivano ASK1
, che in seguito attiva sia la proteina p38 che i pathway intracellulari della chinasi c-jun N-terminale (JNK), provocando un’ ampia varietà di risposte cellulari come la proliferazione, la differenzazione, la senescenza e l’apoptosi.La famiglie delle ASK, che consiste in ASK1 e ASK2 caratterizzata di recente, probabilmente potrebbe essere coinvolta nella carcinogenesi mediata dalle ROS e in altre patologie umane che attraverso la cascata di segnalazione della MAPK (Mithogen Activated Protein Kinase) innescano l’ apoptosi e l’ infiammazione. Riguardo a queste vie di segnali di transduzione, è stato recentemente riportato da alcui autori che la 8-nitroguanosina monofosfato 3’-5’ ciclica(8-nitro-cGmp) che è un
derivato della cGMP NO-dipendente, gioca un ruolo importante nel segnale di trasduzione attraverso s-guanilazione di una proteina sensore che segnala la proteina kelch-like associata (Keap1) (12).
8-nitro-cGmp
Il s-guanilazione accompagna la inattivazione di accompagnamento di Keap1 da 8-nitro-cGMP ciò si tradurrà in esportazione nucleare di Nrf2 e l'attivazione di attività trascrizionale di Nrf2, che di conseguenza induce poi l'espressione di enzimi antiossidanti come HO-1 e regola la progressione dell'infiammazione. Pertanto, la 8-nitro-cGMP sembra essere un secondo messaggero di NO, che può così essere strettamente associato con ROS / RNS indotti da processi patologici e la carcinogenesi infiammatoria successiva.
Di conseguenza, è fondamentale controllare la quantità di ROS nella terapia cosiddetta di ossidazione, perché insufficiente induzione di ROS sarà inversamente proporzionale ad un aumento della crescita dei tumori.
Altre malattie correlate con le ROS
Come è noto, le ROS, sono implicate in molte malattie, oltre il cancro a causa della loro elevata reattività e citotossicità. In condizioni patologiche come l'infezione acuta e cronica e l'infiammazione, la sovrapproduzione di questi metaboliti altamente reattivi può indurre danni letali per l'integrità e
la sopravvivenza cellulare, con conseguente danno tissutale reversibile o irreversibile
Questi cambiamenti patologici, cioè le malattie e i vari disordini correlati alle ROS comprendono infezioni microbiche, infiammazione, aterosclerosi, diabete, lesioni da ischemia-riperfusione (I / R), disturbi neurologici, morbo di Parkinson, ipertensione, lesioni ai tessuti indotte da farmaci antitumorali, malattie correlate al fumo , e l'invecchiamento. Quindi, è ragionevole mettere a punto farmaci per queste malattie correlate con le ROS che agiscano sopprimendo la generazione di ROS. In effetti, questo razionale approccio terapeutico è stato contestato da molti gruppi di ricerca, con l'uso di vari agenti antiossidanti naturali a basso peso molecolare, come gli enzimi SOD e catalasi.
Inoltre, l’enzima XO inibitore della formazione di ROS o l’ enzima MO-1induttore di antiossidanti sono stati considerati in queste linee. Queste strategie terapeutiche, però, sono contrarie per quanto riguarda il meccanismo alla strategia antitumorale della citotossicità ROS-dipendente come sopra descritto.
Sebbene sembri essere controverso, è stato accertato sperimentalmente che se si riesce a controllare la produzione di ROS a livello del sito patologico, per esempio inducendo la produzione di ROS nel tessuto tumorale in maniera selettiva. Per il trattamento dell’ infiammazione e di altre malattie ROS-correlate, la soppressione o l'eliminazione della produzione di ROS può essere un rimedio.
Terapia antitumorale mediata dalle ROS
Un problema fondamentale da risolvere per la strategia antitumorale con le ROS è quello di avere come obiettivo la produzione di ROS selettivamente nei tessuti tumorali; in caso contrario si verificheranno effetti collaterali inattesi.
Questo problema molto importante può essere efficacemente risolto aumentando la permeabilità e (EPR)-effetto di ritenzione con farmaci macromolecolari, micelle polimeriche o nano particelle.
L’ effetto EPR è un fenomeno universale osservato in tumori solidi per i farmaci macromolecolari o polimerici che si accumulano e rimangono selettivamente nel tessuto tumorale solido; è stato osservato anche nei tessuti infiammatori a causa delle caratteristiche anatomiche e fisiopatologiche reazione di questi tessuti. Vale a dire, i fattori vascolari di mediazione, come la bradichinina e NO giocano un ruolo chiave nel processo di extravasazione. Così l’ effetto EPR sta diventando un ottimo standard per la progettazione di farmaci antitumorali. In aggiunta al meccanismo tropico del tumore per l’ effetto EPR, agenti terapeutici macromolecolari (per esempio le proteine PEGilate) offriranno una migliore farmacocinetica (più lunga emivita plasmatica), e potranno essere così utilizzati per varie altre malattie come l'infiammazione(13).
Strategie terapeutiche che prevedono l’ inibizione della produzione di ROS: l'uso di agenti antiossidanti
Gli agenti antiossidanti includono scavangers a piccola molecola delle ROS, gli inibitori di enzimi che generano ROS, così come gli enzimi antiossidanti. Il primo agente antiossidante applicato in clinica è il 3-metil-1-fenil-2-pirazolin-5-one (MCI-186, edaravone, Radient®), scavenger delle
ROS a piccola molecola, che è stato approvato per l'infarto cerebrale acuto in Giappone nel 2001(14). Altri importanti agenti antiossidanti sono gli inibitori della XO (enzima che genera O2·¯), della SOD e della HO-1
inibitori della xantina ossidasi e della Superossido dismutasi derivati pirazolopirimidinici (AHPP): gli inibitori di XO.
O2·¯ potrebbe essere prodotta da diversi enzimi ossidasi diversi, tra cui XO,
ossidasi NADPH-dipendente, lipossigenasi, e NO sintasi, tra queste XO/xantina è una delle fonti principali per la produzione di O2·¯ nei sistemi
vascolari e nella maggior parte delle lesioni infiammatorie(15). E’ quindi ipotizzabile che la soppressione di produzione di O2·¯ con l'impiego degli
inibitori della XO può essere vantaggioso per l'ospite come un mezzo terapeutico.
A questo proposito, Allopurinolo è un noto inibitore XO, che è un analogo strutturale delle alloxanthine tra i derivati pirazolopirimidinici (Figura 4).
Figura 4. Struttura chimica della xantina e dei suoi analoghi. (A), xantina; (B),
ipoxantina; (C), allopurinolo; (D), AHPP; (E), alloxantina.
L'allopurinolo è usato per curare la gotta, che è causata da alti livelli di acido urico nel corpo. Tuttavia, un problema inerente l'uso di allopurinolo è
che il suo effetto terapeutico non è dose-dipendente: ad alte dosi diventa il substrato per la XO, che a sua volta produce O2·¯ e quindi se non abbiamo
un dosaggio adeguato, fa aggravare la malattia.
Questa delicata ottimizzazione della dose di allopurinolo limita la sua applicazione per il trattamento di malattie legate alla produzione di O2·¯.
Recentemente è stato trovato un inibitore molto potente della XO, la 4-amino-6-idrossipirazolo [3,4-d] pirimidina (AHPP), AHPP ha mostrato un valore apparente di Ki di 0,17 µM, che è circa 3 volte inferiore a quello dell’ allopurinolo (Ki di 0,5 µM), e non può essere il substrato della XO a maggiore concentrazione.
L'effetto terapeutico di AHPP è stato esaminato in primo luogo in un modello di ratto spontaneamente iperteso (SHR), in cui è stato ipotizzato che il meccanismo di ipertensione fosse attribuibile alla produzione di O2·
¯
da parte della XO nell' endotelio vascolare che spazza via NO a causa della reazione rapida tra loro. Invece, NO reagisce con O2·¯ in maniera limitata
dalla velocità di diffusione, sei volte più velocemente rispetto alla rimozione di O2·¯ di Cu, Zn-SOD. Così il consumo di NO si tradurrebbe in
ipertensione. Vale a dire, la XO dell’ endotelio vascolare può neutralizzare la vasodilatazione NO-indotto indirettamente dalla generazione di O2·¯.
Quindi l'inibizione dell’ attività di XO può portare ad un effetto antiipertensivo (vasodilatazione), attraverso l’ incremento del livello di NO nel sistema vascolare. Questo offre una nuova strategia contro
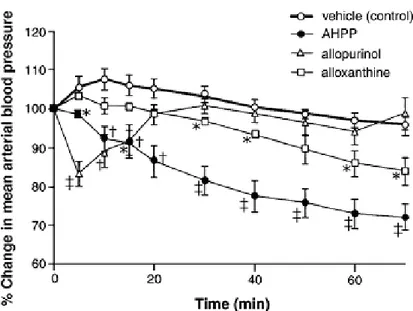
l’ ipertensione. Come previsto, AHPP significativamente aumenta la vasodilatazione NO-mediata di anelli di aorta, sia di coniglio che di SHR in maniera dose-dipendente; l’ iniezione intravenosa di AHPP riduce la pressione sanguigna di SHR del 70% rispetto alla pressione iniziale, che è quasi il livello dei ratti normali (Figura 5).
Figura 5. Effetto di AHPP, somministrato per via i.v., sulla pressione sanguigna
di ratti spontaneamente ipertesi.
Questi dati suggeriscono il potenziale terapeutico di AHPP. Tuttavia, la scarsa solubilità di AHPP, che è veramente poco solubile in soluzioni fisiologiche, rende la sua applicazione terapeutica impossibile. Per ovviare a questo inconveniente, è stato preparato un copolimero di stirene-acido maleico (SMA PM ≥ 280) coniugato con AHPP (SMA-AHPP), che mostra una relativamente elevata solubilità in acqua, e contemporaneamente possiede una migliore farmacocinetica in vivo a causa della natura macromolecolare dei coniugati (16) (Figura. 6).
Figura 6 Rappresentazione schematica per la formazione del coniugato SMA–
AHPP attraverso la reazione di accoppiamento di SMA con AHPP in presenza di una carbodiimide solubile in acqua (EDAC).
Simile a AHPP, SMA-AHPP mostra per la XO una potente attività inibitoria, e cosa più importante, un notevole effetto antiipertensivo con entrambe la somministrazioni, i.v. o orale, in SHR. Inoltre, la XO è indotto in molte malattie infettive e infiammatorie come l'infezione da virus influenzale e la malattia infiammatoria intestinale e O2·¯, che è il principale
fattore patologico in queste malattie viene poi generato lì. L'effetto della SMA-AHPP è stato esaminato in un modello di colite nel topo, indotto, con la somministrazione orale di destrano sodio solfato (DSS). Dati preliminari hanno mostrato che i sintomi, così come il tasso di sopravvivenza dei topi di questo modello di colite sono stati notevolmente migliorati dalla somministrazione di SMA-AHPP.
Sod e suoi polimeri coniugati
Grande interesse è stato focalizzato per la terapia con SOD, incluso Cu, Zn-SOD and Mn-Zn-SOD che sono tra i maggiori scavanger di O2·¯. Comunque, a
causa delle sue scarse proprietà farmacologiche, come nel tempo di clearence plasmatica molto rapido ( e.s. nei topi l’emivita del plasma è <5 min), l’ instabilità e l’ immunogenicità in vivo, l’applicazione clinica della SOD come agente terapeutico era veramente limitata. Lo studio in doppio cieco clinicamente controllato non ha riportato effetti positivi delle SOD in malattie infiammatorie croniche o autoimmuni nell’ uomo.
Molti altri studi sulla SOD nativa/ricombinante non hanno mostrato efficacia clinica. Una spiegazione a questi problemi può essere data attraverso queste ragioni: la SOD stessa catalizza la dismutazione dell’ O2·
¯
per produrre H2O2 (Figura 7), la quale sarà poi convertita a ·OH attraverso
la
Figura 7. Reazione di dismutazione dello ione superossido
reazione di Fenton dal Cu2+ o altri metalli come Fe2+, e il più importante Cu2+, è rilasciato da Cu,Zn-SOD (Figura 8).
Figura 8. Struttura tridimensionale di una Cu,Zn-SOD
La reazione di dismutazione procede tramite due step di uguale velocità: nel primo si ha la formazione di ossigeno molecolare a partire dal radicale superossido con la conseguente riduzione di Cu(II) a Cu(I), mentre nel secondo si ha la riduzione a H2O2 da parte di un altro anione superossido
rigenerando in questo modo il centro catalitico (Figura 9).
E Cu(II) + O
2−→ E Cu(I) + O
2E Cu(I) + O
2−+ 2H
+→ E Cu(II) + H
2O
22 O
2−+ 2H
+→ H
2O
2+ O
2Figura 9. Meccanismo catalitico e reazione complessiva della Cu,Zn-SOD
Questa generazione di ·OH mediata da Cu2+ può essere responsabile degli effetti avversi nella terapia con SOD.
In questo contesto, quando combinato, con la catalasi, l’effetto della SOD è enormemente migliorato. In aggiunta, questa generazione di ·OH SOD-mediata, può essere inibita da modificazioni chimiche della SOD con la capacità chelante del Cu2+, per esempio è stato osservato nel co-polimero
SOD-pirano un effetto chelante del dicarbossilato del pirano che può annullare questa reazione(6).
Per migliorare questi problemi farmacologici e biochimici, un’ampia varietà di coniugati della Cu e Zn-SOD sono stati inizialmente sviluppati incluso il coniugato polimerico del pirano con la SOD, glicol polietilenico SOD (PEG-SOD), Ficoll-SOD, SOD lecitinizzata, CO-polimero stirene, acido maleico (SMA)-SOD, coniugati di gelatina o albumina con SOD. Questi complessi coniugati con la SOD hanno una emivita più lunga rispetto a quelli non coniugati, un’ elevata stabilità e una minore immunogenicità(17). E’ stato studiato il ruolo dell’ O2·¯ in varie patologie, specialmente nelle
infezioni virali, e sviluppato il coniugato polimerico pirano-SOD che si è dimostrato il più utile tra tutti gli altri(6).
Nella patogenesi di varie malattie virali compresa l’influenza, il virus dell’ herpes simplex, il virus di Sendai, e alcune infezioni batteriche, la principale fonte di O2·¯ 1) macrofagi e granulociti (neutrofili) propri spite
nel “burst respiratorio”, e 2) XO, che è enormemente elevato nel siero e nei tessuti dopo l’infezione da virus influenzale. Vale a dire, la XO è 30-
400 volte più elevata nei polmoni di topi infettati da virus rispetto ai topi sani di controllo. Pertanto, il trattamento è stato effettuato mediante l'uso di inibitori della SOD o della XO. Infatti il copolimero Pirano-SOD è stato sviluppato nel 1989 per questo scopo. Rispetto alla SOD nativa, il coniugato polimerico del pirano-SOD migliora le proprietà farmacologiche, per esempio, prolungata emivita plasmatica, 6h vs circa 4 min della SOD nativa, mantenendo circa l'80% dell'attività enzimatica.
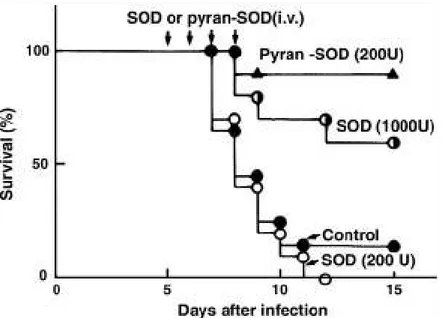
L’iniezione i.v. giornaliera del coniugato polimerico pirano-SOD alla dose di 200 U/topo dal quinto giorno all’ottavo dopo l’infezione da virus influenzale ha protetto il 95% dei topi dalla morte mentre meno del 5% sopravvive senza questo trattamento (Figura 10)
Figura 10. Effetto terapeutico della SOD e del coniugato polimerico pirano-SOD su topi
infettati da virus influenzale.
Da notare che, in questo modello di topo, non c’era nessun virus rilevabile mentre la malattia ha raggiunto il massimo, come giudicato da consolidamento del polmone e della mortalità, nonché dalla infiltrazione delle cellule del plasma nel compartimento alveolare.
Questi studi hanno così dimostrato per la prima volta che la vera causa di questa malattia virale è il radicale O2·¯ ma non il virus di per sé. Seguendo
questa linea, è stato sviluppato un coniugato gelatina-SOD, che ha mostrato significativi effetti soppressivi contro l'artrite collagene-indotta nel modello di topo, che ha indicato che il radicale O2·¯ è coinvolto anche nell’ artrite(17).
Nel frattempo, molti altri gruppi di ricerca hanno riportato simili effetti terapeutici in diverse patologie comprese le lesioni da ischemia/riperfusione, mediante l'uso di vari coniugati della SOD. Tra questi, la Cu, Zn-SOD lecitinizzata (PC-SOD), in cui un derivato della lecitina è legato covalentemente alla SOD umana ricombinate(18), ha mostrato promettente efficacia terapeutica verso varie patologie legate alle ROS, come le lesioni ischemiche, l'infiammazione e l'infezione da HIV, ed
è in fase di studio clinico per la colite ulcerosa e la polmonite interstiziale(19).
Eme ossigenasi
La eme ossigenasi (HO), è un enzima chiave per regolare il livello intracellulare di eme, che catalizza la degradazione ossidativa dell’ eme, causando la formazione di biliverdina, monossido di carbonio (CO), e ferro libero. La biliverdina viene successivamente ridotta dalla biliverdina reduttasi a bilirubina, un potente e cruciale antiossidante (Figura bill).
Figura bill
Nei mammiferi sono state individuate tre isoforme di HO: HO-1, HO-2 e HO-3. HO-1 è la forma inducibile dell'enzima, ma è altamente espressa nel fegato e nella milza in condizioni fisiologiche, ed anche nella maggior parte delle cellule tumorali. HO-2 è l'isoforma costitutiva, espressa soprattutto nel cervello e nei testicoli. HO-3 è una isoforma recentemente identificato, ed è stata rilevata in molti organi, ma la sua attività è molto basso rispetto a
quella delle altre due isoforme, e quindi il suo ruolo fisiologico rimane poco chiaro.
Tra queste 3 isoforme la HO-1 gioca il ruolo più importante nella crescita e nella morte cellulare, proteggendo le cellule contro lo stress ossidativo dannoso e contro l’ apoptosi(20). HO-1 appartiene anche a un membro della famiglia delle proteine da shock termico (Hsp-32), la cui espressione è innescata da una serie di stimoli stressanti tra cui l'ipossia, metalli pesanti, irradiazione UV, ROS e RNS come H2O2 e NO. E 'stato riportato che l’
HO-1 stimola la crescita cellulare e la proliferazione delle varie cellule compresi i cheratinociti epidermici, le cellule dell’ endotelio vascolare e dell’ endotelio coronarico, attraverso il suo effetto citoprotettivo e antiapoptotico. Studi con topi HO-1 deficienti hanno mostrato la perdita embrionale e successiva morte in modo significativo.Inoltre è stat osservata un’ infiammazione cronica del rene e del fegato in topi adultiHO-1 - / -, ciò ha ulteriormente supportato questo ruolo della HO. E’ stato proprio che l'effetto antiossidante e antiapoptotico di HO-1 sia collegato a molteplici meccanismi: 1) Diminuzione del livello di proossidante (eme), 2) aumento del livello di antiossidanti (bilirubina), 3) produzione di CO molecola antiossidante, antiapoptotica; 4) induzione di ferritina, che rimuove e detossifica lo ione ferrico libero, una potente fonte di generazione ·OH; e 5) previene l’ eccesso di stimolazione della risposta immunitaria (Figura 11). A causa di questo effetto antiossidante e antiapoptotico, il potente ruolo citoprotettivo di HO-1, è stato osservato in diverse malattie e disordini, tra cui l'aterosclerosi, l'ipertensione, il danno renale acuto, la nefropatia tossica, il rigetto da trapianto, lo shock endotossico, la malattia polmonare cronica ostruttiva, le malattie gastrointestinali, e il morbo di Alzheimer.
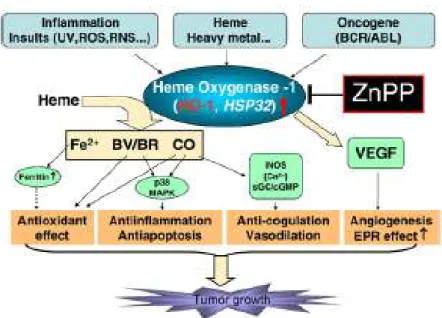
Figura 11. Rappresentazione schematica del ruolo citoprotettivo della HO-1 e
meccanismi dell’effetto antitumorale della zincoprotoporfirina (ZnPP) e dei suoi derivati polimerici (micelle).
Tutto ciò suggerisce che HO-1 è un possibile target in queste malattie. Infatti, l'inibizione di HO-1 con inibitori specifici come ZnPP (zincoprotoporfirina) o protoporfirina stagno ha determinato il peggioramento delle malattie. D'altra parte, la somministrazione di HO-1 induttori, come la cobalto protoporfirina, l’ emina e l’ acidotrinitrobenzensolforico o la HO-1 transfezione genica ha mostrato un significativo effetto terapeutico in molte malattie come la lesione I / R pregiudizio, la nefrotossicità da cisplatino e l’ipossia indotta da danno polmonare .
Per quanto riguarda gli agenti collegati alla HO-1, l’ emina è un potente induttore di HO-1, ed è stata utilizzata per la porfiria acuta intermittente in USA e in Europa come farmaco orfano, però, ha incontrato numerose difficoltà tecniche e complicanze, ed è associata a un elevato rischio di disturbi della coagulazione e tromboflebite. Successivamente è stata sviluppata una forma solubile in acqua di emina, l’eme arginato
(normosang®), tuttavia, la sua emivita plasmatica è relativamente breve, soprattutto a causa del suo legame all’ emopexina.
Per superare questi problemi e per ottenere una migliore farmacocinetica, è stato sintetizzato il PEG emina coniugato della emina con polietilenglicole, che si comporta come micelle solubili in acqua, ed ha una emivita plasmatica molto più lunga come molti altri agenti PEGilati, per esempio il PEGinterferone. In alcuni esperimenti preliminari, l'aggiunta di PEG-emina a colture cellulari ha indotto in modo significativo l'espressione di HO-1; l’ iniezione i.v. di PEG-emina ha notevolmente alleviato il danno epatico in un modello di topo I / R, come rilevatodal valore degli enzimi epatici nel plasma (AST, ALT, LDH).
Così è emerso che la PEG-emina potrebbe essere un agente potenzialmente utile in varie malattie correlate alle ROSanche se sono necessarie ulteriori indagini.
Ossido di azoto ( NO )
L’ NO prodotto nei sistemi biologici esercita un ruolo fisiopatologico. L’ eccessiva formazione di NO a livello del sito locale, come il cancro e l'infiammazione ha effetti pro-infiammatori, come la formazione di edema che coinvolge un aumento della permeabilità vascolare, infiltrazione di cellule infiammatorie, e citotossicità, probabilmente attraverso la successiva formazione di ONOO¯ e altri RNS. E’ stato osservato che NO è prodotto nel sito di infezioni virali e batteriche, della NO sintasi inducibile (iNOS), che è principalmente espressa nei leucociti infiammatori, dalla L-arginina come substrato. L'inibizione della produzione di NO mediante inibitori della NOS o l’ abbattimento della iNOS ha notevolmente migliorato i cambiamenti istopatologici e inibito la progressione della malattia.
Tuttavia, è stato trovato che NO utile anche a livello basso o moderato, comprese le attività antinfiammatoria, antiapoptotica e gli effetti antiossidanti. E’ stato inoltre riportato che NO presenta un notevole effetto citoprotettivo per le lesioni da I/R. La mancanza di NO può anche contribuire alla patogenesi di I/R, in quanto una diminuzione di NO può innescare l'adesione dei neutrofili, l'aggregazione piastrinica ed essudati nella zona di ischemia, che aggrava il danno da riperfusione. Per quanto riguarda l’ effetto citoprotettivo di NO nelle lesioni da I/R infortuni, è stato sviluppato un inibitore della S-nitroso α1-proteasi (S-NO-α1-PI) che è
stabile all’ attività dell 1S NO endogeno, con una lunga emivita plasmatica ed una farmacocinetica superiore. Il trattamento con S-NO-α1-PI sopprime
significativamente l'aumento degli enzimi epatici (AST, ALT, LDH), l’ accumulo di neutrofili e l'apoptosi delle cellule epatiche nel modello di I/R di ratto. Inoltre, è migliorato il flusso sanguigno epatico(21). Analogamente, un altro NO, l’ albumina S-nitrosata, ha mostrato notevole effetto citoprotettivo contro le lesioni da I/R di fegato di ratto e infezioni batteriche. Questi dati indicano che NO ben progettati possono essere utili per l’ applicazione clinica.
Canololo, scavanger fenolico delle ROS estratto dalle piante
Vari flavonoidi e composti fenolici mostrano una potente attività antiossidante. E’ stato recentemente isolato un composto fenolico dall’olio grasso di canola (specifica varietà di colza) il 4-vinil-2,6-dimetossifenolo, o canololo, che mostra una potente attività antiossidante(22). La potenza neutralizzante del canololo contro i radicali alchilperossilici (ROO·) è ben più alta rispetto ai comuni antiossidanti, come il tocoferolo, la vit C, il β-
carotene, la rutina e la quercitina. Il canololo inoltre mostra una grande capacità neutralizzante contro i mutageni endogeni, ONOO¯, perciò ha una grande capacità di annullare le mutazioni batteriche, di proteggere il DNA dai danni ossidativi, come l’inibizione dell’ossidazione di lipidi e proteine.
Inoltre, il canololo esercita un’azione citoprotettiva contro la citotossicità ONOO—indottain cellule epiteliali renali umane MEK293 ed in cellule epiteliali bronchiali umane HBE140. Il canololo può altresì indurre la soppressione di iNOS e di molte citochine infiammatorie come l’interleuchina 1β ( IL-1β ), il fattore-α della necrosi tumorale, l’ interferone ϓ e la COX 2.
Come conseguenza, la carcinogenesi gastrica è marcatamente soppressa nelle infezioni da H.Pylori in animali da esperimento. La cosa interessante, è che l’aspetto biologico dell’H.Pylori non cambia in seguito ad una dieta a base di canololo.Questi risultati suggeriscono che l’effetto del canololo risulta essere quello di guarire le infiammazioni e le carcinogenesi causate dalle ROS, ma non uccide i batteri. In pratica è lo stesso meccanismo del SOD-Pirano nei confronti delle infezioni virali. Inoltre, recentemente è stato scoperto che il canololo possiede un chiaro effetto terapeutico in un modello di colite murina, indotto da somministrazione orale di DSS (destrano solfato sodico).
Questi dati suggeriscono la potenziale attività del canololo come agente preventivo per il cancro, tramite gli effetti antiinfiammatori.
Per quanto riguarda l'attività del canololo, si deve rilevare che elimina direttamente le ROS (ONOO¯, O2·¯, ROO· etc)(23), ma sopprime
indirettamente anche l'induzione di mediatori infiammatori (come per es. IL-1β, TNF-α, IFN-γ e COX-2) a livello di mRNA, che è lo stesso meccanismo visto in molti flavonoidi e altri composti fenolici da diverse piante(24) .
Terapia antitumorale indotta da stress ossidativo: la terapia di ossidazione
Come discusso in precedenza, a causa della natura tossica delle ROS e di insufficienti enzimi antiossidanti nelle cellule tumorali, la sovrapproduzione di ROS elimina cellule cancerose indesiderate. Sulla base di questo principio, è stato introdotta una "terapia di ossidazione" unica. Un modo per realizzare questa terapia antitumorale è di fornire gli enzimi che generano le ROS direttamente nei tessuti tumorali, come la glucosio-ossidasi, XO e DAO (D-amminoacido ossidasi), dove un rilascio più selettivo può essere ottenuto con effetto EPR dopo pegilazione di queste ossidasi. L’ effetto EPR (aumento della permeabilità effetto di ritenzione) consente a molecole ad alto peso molecolare di raggiungere e di
accumularsi nell’ ambiente peritumorale.
Un altro approccio è quello di sopprimere i sistemi antiossidanti nel tumore usando inibitori dell’ enzima HO-1 che è altamente up-regolato in molti tumori. Questi sistemi antiossidativi sono importanti per le cellule tumorali per difenderle dallo stress ossidativo (ROS e RNS). Quindi l'inibizione di enzimi antiossidanti per es. HO-1 nei tumori può anche essere una terapia antitumorale.
Per sfruttare la terapia di ossidazione, sono stati sviluppati diversi polimeri coniugati di enzimi generanti ROS (XO e DAO) e composti inibitori di HO-1 (ZnPP). La glucosio ossidasi non è stata selezionata per questa tecnica perché il suo substrato, il glucosio, è disponibile ubiquitariamente in vivo e quindi non ci sarebbe nessuna regolamentazione per la produzione di ROS, questo enzima viene iniettato in vivo. I coniugati polimerici mostrano caratteristiche di colpire il tumore sfruttando l’ effetto EPR, con effetti antitumorali notevoli.
Coniugati di polietilenglicole e xantina ossidasi ( PEG-XO )
Come descritto in precedenza, XO, uno dei principali enzimi generanti O2· ¯
è una metalloflavoprotiena ( PM 298 KDa ), un etero dimero che catalizza l'ossidazione della xantina / ipoxantina per generare O2·¯, che viene
successivamente convertito in H2O2 dalla SOD.
XO è stato quindi considerato un candidato per la terapia di ossidazione. Tuttavia, quando XO è usato come enzima nativo, la sua alta affinità per i vasi sanguigni limita la sua applicazione, in quanto può indurre danni vascolari sistemici e ipertensione. Questo inconveniente può essere evitato la PEGilazione di XO a PEG-XO via coniugando PEG a gruppi Σ-amminici dei residui di lisina di XO, che svolgono un ruolo cruciale per il legame alla superficie luminale della parete vascolare. Inoltre, sono state dimostrate l'effetto EPR di XO, l’ eccellente farmacocinetica e l’ attività di PEG-XO è stato mantenuta nel tumore da più di 96 ore. Tuttavia, per il trattamento in vivo è stato trovato che l'infusione dei substrati (xantina o ipoxantina) deve essere effettuata con un intervallo di tempo adeguato dopo l’ iniezione i.v. di PEG-XO, per garantire l'accumulo di PEG-XO a livello del tumore, questo intervallo sarà generalmente maggiore di 24 ore
altrimenti l’ enzima ( XO ) in circolazione genererà O2·¯ per via sistemica a
causa del substrato in arrivo, causando effetti collaterali sistemici. Secondo il protocollo di cui sopra, un effetto antitumorale significativo è stato raggiunto con PEG-XO, più la successiva infusione del substrato, ipoxantina; la crescita del tumore è stata notevolmente soppressa almeno fino a 52 giorni, quando è stata osservata la completa regressione della crescita tumorale in tre topi su sette, portatori di tumore. Contemporaneamente, non sono stati osservati senza effetti collaterali apparenti dopo questo trattamento.
Polietilenglicole coniugato con D-amminoacido ossidasi ( PEG-DAO )
L’ attenzione di alcuni ricercatori è stata recentemente focalizzata sull’ enzima DAO. DAO è una flavoproteina (PM 39 KDa) che catalizza la deaminazione ossidativa stereoselettiva di aminoacidi D- ai corrispondenti α-chetoacidi, durante il quale viene utilizzato ossigeno molecolare come accettore di elettroni, e viene generato H2O2.Un merito importante di DAO
è che il substrato (amminoacido-D) in condizioni normali è sufficiente i quantità molto piccola, rendendo così possibile il controllo della produzione di H2O2 attraverso il controllo dell’ infusione esogena di
D-amminoacidi. E’ stato quindi preparato un coniugato di DAO con PEG per ottenere macromolecole (PM circa 63 KDa) che sono risultate capaci di accumularsi selettivamente a livello del tumore, a causa dell’ effetto EPR(25).
Di conseguenza, il sistema PEG-DAO/D-amminoacidi renderà migliore la generazione di H2O2 tumore-selettivo attraverso un doppio effetto di
targeting. Vale a dire, è stato somministrato D-prolina con un certo intervallo di tempo (circa 4 ore) dopo l’ iniezione di PEG-DAO. Questo
intervallo di tempo, ha permesso che PEG-DAO si accumulasse nel tumore primario. La somministrazione successiva di D-prolina sarà poi convertita in H2O2 soprattutto nei tumori. Secondo quanto previsto, in questo
trattamento è stata osservata la soppressione significativa della crescita del tumore, con un incremento significativo del tasso di sopravvivenza nei topi con tumore.
Quindi PEG-DAO è diventata il candidato migliore per la terapia di ossidazione.
In aggiunta, DAO è una proteina monomerica semplice facile da maneggiare e da sintetizzare con la tecnologia ricombinante. In confronto con DAO, XO, è difficile da preparare con la tecnologia ricombinante, in quanto è una molecola relativamente grande; è un eterodimero con una struttura complessa. Recentemente è stata riportata la preparazione
di DAO porcina ricombinate usando E. Coli, con alte rese (20mg/l) e un’ elevata attività enzimatica (5,3U/mg) ed una buona stabilità(25). Tra gli enzimi antiossidativi, la catalasi gioca un ruolo centrale contro H2O2.
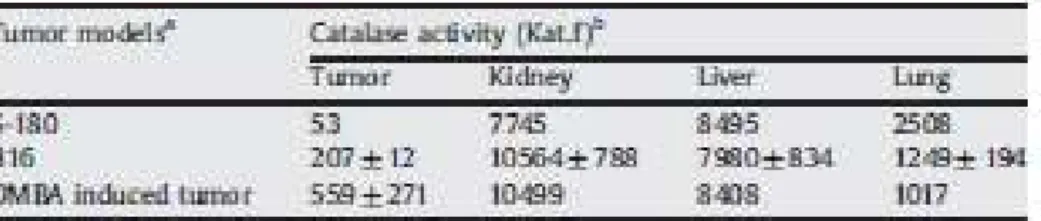
Benchè alcuni epatocarcinomi esprimano un alto livello di catalasi, è noto che in molti tumori l’ attività della catalasi è notevolmente ridotta. Simili situazioni sono state osservate anche misurando l’ attività della catalasi sia nei tessuti tumorali che quelli normali come fegato, rene e polmone, sia nel tumore sperimentale del topo che nei tumori chimicamente indotti dei ratti (Tabella 1).
Tabella 1. Attività della catalasi nei tessuti tumorali e nei tessuti normali (25)
a S-180: sarcoma S-180 di topo; B16: melanoma B16 di topo; DMBA (12-dimetilbenz (a)antracene) induce
cancro alla mammella nei ratti
b
Gli animali con tumore di circa 10 mm di diametro erano uccisi e quindi soggetti a riperfusione con soluzione salina contenente eparina (5U/ml). I tessuti successivamente raccolti erano omogeneizzati e sottoposti ai saggi di attività della catalasi.
In coincidenza con queste osservazioni, è stata trovata una IC30
significativamente più alta (la concentrazione di farmacoquando la crescita cellulare è inibita del 30% rispetto alle cellule non trattate) rispetto a PEG-DAO/ D-prolina (H2O2) contro le cellule normali.Queste scoperte
supportano la validità e la sicurezza delle terapie anticancro indotte dal ROS, come per es. il trattamento PEG-DAO/D-prolina dipendente(25).
Nonostante H2O2 sia stata utilizzata come antitumorale in alcuni studi, in
accordo con la sua cititossicità potenzialmente elevata, è da notare che l’ H2O2 esiste fisiologicamente in molti organismi e che è il prodotto
risultante dalla dismutazione dell’ O2·¯ madiata dalla SOD.
In riguardo alla funzione fisiologica dell’ H2O2 è stato recentemente
riportato che essa gioca un ruolo importante nella vasodilatazione, simile alla funzione dell’ NO.
Inoltre, in studi sul PEG-DAO/D-prolina, è stato osservato che, nonostante potesse succedere la produzione casuale di H2O2, questa è comunque ad un
livello più basso rispetto a quella generata nei tumori grazie all’ effetto EPR ed alle infusioni ad intervalli di tempo nel substrato. Mentre, ancora più importante, le piccole produzioni di H2O2 generate sistematicamente
possono incrementare il flusso sanguigno nei tumori a causa della
vasodilatazione indotta come descritto sopra, e ciò fa aumentare l’ effetto EPR, di conseguenza migliora l’ attività terapeutica della PEG-DAO/D-prolina. Questa osservazione però necessita di ulteriori studi.
HO inibitore: zinco protoporfirina IX (ZnPP)
Come descritto sopra, HO-1 lavora come un enzima chiave contro lo stress ossidativo. E’ ben noto ormai che è up-regolato e che gioca un ruolo cruciale in molti tumori, incluso il carcinoma delle cellule renali e il tumore
della prostata nell’ uomo e i tumori solidi negli animali da esperimento come l’epatocarcinoma AH136B del ratto e il sarcoma S-180 del topo. HO-1, conosciuto anche come una proteina dello shock termico (Hsp32), è considerato una fattore di sopravvivenza per le cellule tumorali. E’ stato inoltre realizzato che il danneggiamento o l’inibizione di questa molecole difensiva nelle cellule tumorali potrebbe essere utile come target terapeutico, ipotesi successivamente confermata in molti tumori solidi sperimentali, attraverso l’uso di ZnPP ( Zinco proto porfirina ) un potente HO inibitore ZnPP, indicando un potenziale ruolo benefico dell’ HO inibitore ossia ZnPP come nuovo farmaco anticancro.
Polimeri coniugati di ZnPP (PEG-ZnPP) e SMA-micelle di ZnPP (SMA-ZnPP)
ZnPP è quasi insolubile in soluzione fisiologica, e questo limita il suo uso come farmaco. Era stata poi effettuata la PEGilazione ZnPP che aveva condotto ad un incremento della solubilità in acqua, fatto ancora più importante, dava origine a micelle macromolecolari di peso molecolare maggiore a 70 KDa in ambiente acquoso, come dimostrato con la cromatografia Sephadex G-75.
Inoltre, era stato osservato, un diametro idrodinamico di circa 200 nm del PEG-Znpp G31; indicava una forma associata multimolecolare di micelle. Quando PEG-ZnPP è somministrato per via i.v., mostra un tempo di permanenza più lungo nel plasma, 40 volte maggiore rispetto allo ZnPP libero non coniugato.
In aggiunta, PEG-ZnPP si accumula preferenzialmente nei tumori solidi (una concentrazione di circa 5-10 volte più alta rispetto agli organi normali) a causa dell’ effetto EPR come previsto.
PEG-ZnPP sopprime marcatamente la crescita di S-180 e del tumore 38 del colon impiantati rispettivamente nei topi ddY e Balb/C, mentre nessun effetto o piccolissimi effetti sono stati registrati in questo esperimento. Inoltre il trattamento con ZnPP induce in modo significativo la soppressione selettiva del tumore, nonostante la proteina HO-1 sembrasse in aumento dopo tale trattamento, fatto dovuto probabilmente all’apoptosi delle cellule tumorali attraverso l’ incremento dello stress ossidativo.
Oltre al PEG-ZnPP, è stata preparata con successo una forma micellare altamente solubile in acqua di ZnPP usando SMA (stirene-acido maleico), che rivela una natura macromolecolare con peso molecolare e grandezza delle micelle di 144 kDa e 176,5 nm, rispettivamente, nelle soluzioni acquose fisiologiche.
In modo simile al PEG-ZnPP, SMA-ZnPP ha mostrato un potente effetto antitumorale in molti modelli di tumori solidi, incluso DMBA, cancro indotto alla mammella nei ratti e il fibrosarcoma Meth-A, ed il cancro del colon 38 nei topi, mentre non si sono osservati effetti collaterali persino ad una dose di 200mg/Kg quando iniettato per via i.v..
PEG-ZnPP/SMA-ZnPP per la terapia fotodinamica (PDT)
E’ ben noto che i derivati della porfirina sono ottimi fotosensibilizzatori per la terapia fotodinamica (PDT) ed è tra queste promettenti e meno invasive modalità di trattamento antitumorale che vengono utilizzati i raggi laser per generare ossigeno singoletto(26). Inoltre è fattibile per ZnPP, specialmente per i suoi derivati polimerici (PEG-ZnPP, SMA-ZnPP) essere applicato nella terapia PDT.
Un vantaggio di PEG-ZnPP/SMA-ZnPP rispetto ai convenzionali foto sensibilizzanti (Photopyrina, una porfirina) usati per la terapia PDT, è che
ZnPP non richiede raggi laser, mentre la Photopyrina richiede raggi laser a 630nm. In contrasto ZnPP risulta attivo persino sotto le convenzionali luci allo xenon e sotto fonti di luce endoscopica.
Come previsto ZnPP genera in modo efficace da ossigeno singoletto altamente reattivo con luce visibile, laser e luci allo xenon.
Utilizzando luce al tungsteno-Xenon come fonte di irradiazione SMA-ZnPP/PEG-ZnPP inducono la regressione del tumore nel topo, sia del tumore xenografico, che del cancro al seno indotto chimicamente. La fonte di luce usata in questo studio per attivare ZnPP è la più usata luce endoscopica (Philips TL-D 15 W) o il bulbo usato per l’ itterizia.
L’ apparato laser per la convenzionale PDT è molto costoso rispetto alla fonte di luce allo xenon , che è usata in endoscopia nella maggior parte degli ospedali e cliniche, l’applicazione dello SMA-ZnPP o PEG-ZnPP sotto l’irradiazione di luci endoscopiche può essere molto più pratica per certi tipi di cancro come quello all’ esofago, al seno, al polmone, al colon, alla vescica e al collo dell’ utero.
Altri aspetti di ZnPP e dei suoi polimeri derivati.
In combinazione con ROS o sistemi di generazione di ROS (PEG, DAO) studi preliminari hanno mostrato un effetto sinergico di PEG-ZnPP con i convenzionali agenti chemioterapici. Cioè, le cellule SW480 in vitro trattate con PEG-ZnPP diventano molto più vulnerabili ai danni causati dalle ROS o dai farmaci anticancro generanti ROS come la doxorubicina(27) e la camptotecina. Vale a dire, i valori IC50 vengono ridotti al 75%, 61%, 17% e 39% per H2O2, il t-butyl idroperossido, la camptotechna e la doxorubicina
Successivamente esperimenti in vivo, hanno verificato che queste nozioni erano valide usando PEG-DAO/D-prolina in aggiunt a PEG-ZnPP.
Nuova comprensione dei meccanismi di citotossicità di PEG-ZnPP/SMA-ZnPP
Per quanto riguarda il meccanismo antitumorale basato sulla riduzione della difesa anti-ROS attraverso l’ inibizione dell’ HO-1 nelle cellule tumorali, alcuni studi hanno rilevato che PEG-ZnPP o SMA-ZnPP possono regolare l’ oncogene BCR/ABL nella leucemia mieloide cronica (CML), portando ad apoptosi delle cellule CML(28/29).
Inoltre sia PEG-ZnPP che SMA-ZnPP, sono risultati efficaci nei casi di CML e di leucemia linfoblastica acuto su imathinib (Gleevec) resistenti. Queste scoperte suggeriscono che HO-1 (Hsp-32) è un target molecolare importante e con molte funzioni per la chemioterapia del cancro. L’inibizione dell’ HO-1 con PEG-ZnPP e SMA-ZnPP, non solo induce la cititossicità legata alle ROS, ma porta anche alla morte delle cellule cancerose attraverso altri meccanismi senza avere una tossicità dannosa per
Doxorubicina
il paziente, questo incrementerà molto l’ efficacia terapeutica e l’ uso clinico di questi due copolimeri. Inoltre potrebbero esserci altri meccanismi per l’ azione di PEG-ZnPP e SMA-ZnPP che riguardano lo zinco intracellulare(30), in cui la porfirina può avere la funzione di trasportatore dello zinco.
Prudenza per la terapia d’ ossidazione.
Benchè gli studi preclinici della terapia d’ ossidazione mostrino risultati promettenti, come dimostrato, è necessario controllare attentamente la quantità del ROS. Come descritto sopra, gli effetti antitumorali delle ROS sono dose-dipendenti; in ogni modo, dosi basse o inadeguate, provocherebbero la progressione del tumore. E’ quindi necessario inviare un eccesso di ROS nel tumore, ad esempio concentrazioni millimolari; altrimenti potrebbero verificarsi effetti avversi come la progressione del tumore. In alcuni esperimenti(6) usando enzimi generati dalle ROS, venivano applicate dosi relativamente alte degli enzimi(25) e dei loro substrati (2u/topo di PEG-DAO e 0,5 millimoli/topo di D-prolina) ROS e l’invio di ROS al tumore bersaglio era certemente raggiunta usando coniugati polimerici e l’ infusione di substrato scandita nel tempo; tutto ciò fa successivamente incrementare la concentrazione intratumorale delle ROS e riduce gli effetti collaterali del sistema. In realtà livello di dosaggio di DAO e D-prolina nel topo, non è stata osservata tossicità né morte o significativa perdita di peso nella cavia. Naturalmente nella manipolazione e sviluppo di efficaci sistemi di targeting tumorale è necessaria una certa cautela, così come sono necessari ulteriori studi per sviluppare la terapia d’ossidazione per l’ applicazione clinica.
Le ROS, un gruppo di molecole altamente reattive, mostrano un ruolo vitale negli organismi aerobici come fattore indispensabile di trasduzione del segnale al fine di regolare la crescita cellulare e il metabolismo dei farmaci.In condizioni fisiologiche, i danni sono ridotti dalle difese cellulari antiossidanti (SOD, catalasi, HO-1) e meccanismi di riparazione. Tuttavia, in circostanze patologiche come l'infiammazione, l'eccessivo carico di ROS porta a danni tissutali reversibili o irreversibili. Vale a dire, le ROS sono potenzialmente dannose in quanto reagiscono con le proteine, DNA e altre molecole vitali, e danneggiano la sopravvivenza delle cellule. Per tale motivo possono indurre varie malattie, compreso il cancro. E 'stato quindi suggerito che l'inibizione o l’ eliminazione delle ROS potrebbe essere una valida terapia per le malattie correlate alle ROS, utilizzando la presenza di sostanze antiossidanti (Radicut® e canololo) o di enzimi antiossidanti (SOD, HO-1).Tuttavia, la SOD nativa o ZnPP a basso peso molecolare (HO inibitore) non hanno mostrato significative potenzialità terapeutiche, ma quando sono state utilizzate come coniugati polimerici (PEGilazione o formazioni micellari), hanno mostrato di raggiungere selettivamente il bersaglio e di avere una migliore farmacocinetica, così come in vivo hanno mostrato marcati effetti.
D'altra parte, la citossicità delle ROS può anche servire come terminatore di tumore se viene prodotta selettivamente nel tumore stesso. Questa terapia antitumorale è stato definita "terapia di ossidazione". Uno dei recenti sviluppi promettenti è la PEG-ZnPP, che sembra avere un meccanismo molto valido contro il cancro, compreso l’ aumento della sensibilità delle cellule tumorali alle ROS e modulazione di cascata di trasduzione del segnale.
In conclusione, tutti gli studi per controllare la generazione di ROS serviranno a fornire informazioni utili per il trattamento di varie malattie
tra cui il cancro e l'ipertensione, attraverso la modulazione della produzione di ROS, che potrebbe essere l’ approccio futuro.