Messa a punto dei metodi analitici per la determinazione delle vitamine.
Sviluppo del metodo cromatografico tramite HPLC
Lo sviluppo della metodica HPLC per la determinazione delle 5 vitamine idrosolubili oggetto del nostro studio è partito dalla valutazione del comportamento dei composti di riferimento su fasi stazionarie di diversa tipologia, utilizzando colonne HPLC di tipo analitico standard per cromatografia ad interazioni idrofiliche (HILIC) e per cromatografia di adsorbimento in fase inversa (RP-HPLC). La cromatografia HILIC è stata condotta su una fase stazionaria costituita da silice funzionalizzata con ponti etilenici (“cross -linking” tra due residui silanolici), priva di end-capping. Per quanto riguarda la cromatografia in fase inversa, sono state utilizzate fasi stazionarie costituite da diversi materiali: silice funzionalizzata con catene alchilammidiche (RP-Amide), e silice funzionalizzata con catene octadeciliche (RP-C18), di due diverse tipologie.
Le vitamine idrosolubili hanno un grado di polarità e di idrofilicità più o meno marcato, che rende conto, come mostrato dalla letteratura, di uno scarso grado di ritenzione da parte di materiali adsorbenti in fase inversa (silice C18), anche con l'utilizzo di eluenti con frazione acquosa molto elevata; una maggiore efficienza viene raggiunta utilizzando colonne più lunghe (generalmente 150 o 250 mm) e fasi stazionarie a granulometria più fine e caratterizzate da minore attività silanolica residua. Anche per questo motivo, sono stati selezionati tre diversi materiali adsorbenti in silice C18, tutti dotati di end-capping, in colonne da 250 mm.
In particolare, le colonne utilizzate nelle fasi preliminari dello studio HPLC sono indicate in tab. 1:
Per quanto riguarda la fase mobile, questa varia sostanzialmente a seconda dell'approccio utilizzato (HILIC - fase inversa); per la cromatografia HILIC, i pochi esempi applicativi che si ritrovano in letteratura sono concordi su:
l'uso di soluzioni acquose o tamponi (formiato, acetato) a pH acido l'uso di acetonitrile come fase organica
Riguardo la cromatografia in fase inversa invece, sia RP-C18 che RP-ammidica, l'analisi della letteratura mette in luce alcuni elementi comuni, tra cui:
l'uso di soluzioni acquose o tamponi (formiato, acetato, fosfato) a pH acido l'uso di acetonitrile o metanolo come fase organica
l'uso di fattori di coppie ioniche o compatibilizzanti (solo per le C18)
l'applicazione di eluizioni in gradiente, che prevedono percentuali iniziali di fase acquosa prossime o pari al 100 % (sia per le C18 che per le RP-ammidiche)
Dimensioni Particelle (μm) Porosità (Å) Carico di Carbonio (%) Stabilità (pH) End-capping Luna HILIC 5 200 5.7 1.5-8.0 no SUPELCO LC-ABZ RP-Amide 5 120 12.0 2.0-9.0 si MEDITERRAN EA SEA C18 5 - - 1.0-12.0 si Gemini C18 5 110 14.0 1.0-12.0 si
Inoltre, i tamponi acetato e formiato, a differenza del fosfato, risultano miscibili con acetonitrile in tutte le proporzioni, e si rendono necessari nel caso in cui l'acetonitrile sia da preferirsi rispetto ad altri componenti organici (metanolo, isopropanolo, etc.).
Le vitamine in esame, eccezion fatta per la riboflavina, sono tutte molto solubili in acqua (Merck Index): è possibile avere soluzioni acquose con concentrazione superiore alle 1000 ppm senza alcun problema di stabilità (precipitazione) a basse temperature (in condizioni di stoccaggio, + 4°C). La riboflavina, invece, mostra una solubilità inferiore in H2O a temperatura ambiente (minore di 50 ppm).
Cromatografia ad interazioni idrofiliche (HILIC)
Data l’esperienza fatta sul comportamento di alcuni tannini e di alcuni composti standard di riferimento (acido gallico, catechina, acido tannico), nell’ambito dello sviluppo del metodo di separazione di composti idrofili e molto polari, si è voluto verificare il comportamento delle vitamine idrosolubili con la cromatografia HILIC. Nella sezione “Sviluppo del metodo cromatografico per i tannini” sono già state fatte alcune considerazioni sull’utilizzo di questa fase stazionaria, in particolare riguardo alle fasi mobili che possono essere impiegate.
Dalla letteratura si rileva che l'utilizzo delle colonne HILIC per l'analisi di miscele di vitamine idrosolubili non è molto studiato, nonostante le principali ditte produttrici di colonne HILIC riportino, nelle note applicative, metodiche che descrivono l'analisi di miscele di vitamine idrosolubili.
Nel nostro studio è stata valutata l'efficacia di fasi mobili costituite da acetonitrile e due diversi tamponi a pH acido, in analogia con quanto riportato in letteratura41:
tampone ammonio formiato 50 e 100 mM, pH 3.2 tampone ammonio acetato 50 e 100 mM, pH 5.8
Inizialmente, la separazione cromatografica delle vitamine in esame è stata valutata tramite eluizione isocratica con miscela costituita da acetonitrile/tampone 90:10.
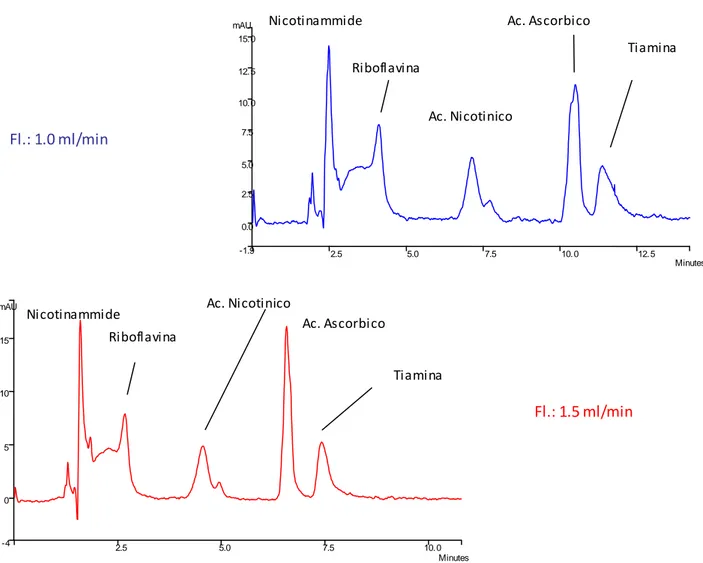
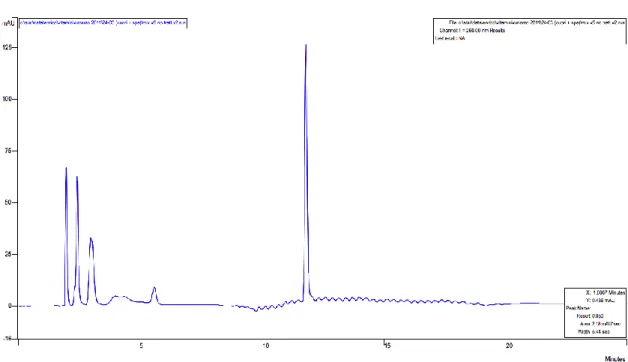
Utilizzando il tampone acetato 100 mM con flusso di fase mobile di 1.0 e 1.5 ml/min, i cromatogrammi ottenuti sono riportati in fig. 1. L'aumento del flusso comporta la formazione di picchi più definiti, anche se i composti, con l'eccezione della nicotinammide, eluiscono come picchi scodati e/o sdoppiati. Non è stato possibile aumentare ulteriormente il flusso dell’eluente per l’insorgenza di contropressioni troppo alte. E’ da notare che i composti maggiormente idrofili (polari) eluiscono a tempi di ritenzione via via maggiori, confermando i presupposti del tipo di metodica separativa.
Fig. 1: cromatografia HILIC, eluizione isocratica con tampone acetato 100 mM. Miscela di standards:
nicotinammide 13.2 ppm, riboflavina 11.5 ppm, acido nicotinico 13.6 ppm, tiamina 12.5 ppm e acido ascorbico 76 ppm.
Fl.: 1.0 ml/min
Acido Nicotinico Acido Ascorbico Tiamina Riboflavina Nicotinammide Fl.: 1.5 ml/min 2.5 5.0 7.5 10. 0 12. 5 Minutes -3 0 5 10 15 20 25 mAU
Acido Nicotinico Acido Ascorbico Tiamina Riboflavina Nicotinammide 2.5 5.0 7.5 10. 0 12. 5 Minutes -3 0 5 10 15 20 25 30 mAU
Diminuendo la concentrazione del tampone a 50 mM, si osserva innanzitutto l’inversione dei picchi di tiamina ed acido ascorbico; inoltre, il profilo migliora nettamente per acido nicotinico, tiamina ed acido ascorbico, che mostrano picchi più simmetrici e definiti, mentre la riboflavina continua ad fluire generando un picco poco risolto e parzialmente sovrapposto a quello della nicotinammide (fig. 2). Aumentando il flusso da 1.0 a 1.5 ml/min, i composti presentano un tempo di ritenzione inferiore, con buona separazione e risoluzione.
Fig. 2: cromatografia HILIC, eluizione isocratica con tampone acetato 50 mM. Miscela di standards:
nicotinammide 13.2 ppm, riboflavina 11.5 ppm, acido nicotinico 13.6 ppm, tiamina 12.5 ppm e acido ascorbico 76 ppm. Ac. Nicotinico Ac. Ascorbico Tiamina Riboflavina Nicotinammide Fl.: 1.5 ml/min Ac. Nicotinico Ac. Ascorbico Tiamina Riboflavina Nicotinammide Fl.: 1.0 ml/min 2.5 5 5.0 0 7.5 5 10. 0 0 12. 5 5 Minutes s -1.9 1.9 0.0 0 2.5 5 5.0 0 7.5 5 10. 0 0 12. 5 5 15. 0 0 mAU U 2.5 5.0 7.5 10. 0 Minutes -4 0 5 10 15 mAU
L'utilizzo del tampone formiato ha prodotto risultati in parte simili: alla concentrazi one di 100 mM l'aumento del flusso comporta un profilo migliore ma la tiamina e l’acido ascorbico coeluiscono, mentre alla concentrazione di 50 mM il flusso maggiore provoca la sovrapposizione dei picchi di acido ascorbico ed acido nicotinico (fig. 3 e 4). La diminuzione della concentrazione da 100 a 50 mM, in questo caso, non causa l’inversione dei tempi di ritenzione di tiamina ed acido ascorbico. In ultima analisi, l’uso del tampone 50 mM non comporta un miglioramento della forma dei picchi rispetto al 100 mM, come osservato attraverso l’uso del tampone acetato.
Fig. 3: cromatografia HILIC, eluizione isocratica con tampone formiato 100 mM. Miscela di standards:
nicotinammide 13.2 ppm, riboflavina 11.5 ppm, acido nicotinico 13.6 ppm, tiamina 12.5 ppm e acido ascorbico 76 ppm. Fl.: 1.5 ml/min Fl.: 1.0 ml/min 2.5 5.0 7.5 10.0 12.5 Minutes -3 0 5 10 15 mAU Tiamina+ Acido Ascorbico Acido Nicotinico Tiamina Acido Ascorbico Acido Nicotinico 5 10 15 20 25 Minutes -5 0 5 10 15 20 25 mAU
Le prove effettuate dimostrano come l’utilizzo del tampone acetato consenta la separazione di tutte e cinque le vitamine esaminate, un risultato che non è stato possibile ottenere con il tampone formiato; inoltre, la concentrazione finale pari a 5 mM comporta una maggiore selettività della colonna verso gli analiti, dimostrata da una migliore forma dei picchi ottenuti.
Fig. 4 cromatografia HILIC, eluizione isocratica con tampone formiato 50 mM. Miscela di standards:
nicotinammide 13.2 ppm, riboflavina 11.5 ppm, acido nicotinico 13.6 ppm, tiamina 12.5 ppm e acido ascorbico 76 ppm. Fl.: 1.5 ml/min Fl.: 1.0 ml/min 2.5 5.0 7.5 10.0 12.5 Minutes -3 0 5 10 15 mAU X: Tiamina Acido Ascorbico Acido Nicotinico 1 2 3 4 5 6 7 8 9 -3.3 -2.5 0.0 2.5 5.0 7.5 mAU Acido Nicotinico Tiamina Acido Ascorbico Minutes
Cromatografia in fase inversa (RP-amide)
Nelle fasi preliminari, tutte le prove sono state effettuate con un flusso della fase mobile pari a 1.0 ml/min e monitorate alla lunghezza d'onda di 260 nm.
I tamponi che sono stati utilizzati per la composizione della fase mobile sono:
tampone sodio fosfato 10 e 25 mM, pH 3.5 tampone ammonio formiato 10 e 25 mM, pH 3.5 tampone ammonio acetato 25 mM, pH 5.8
Le colonne in fase inversa che sono state utilizzate sono costituite da materiale di impaccamento differenti, suddivisibili in due categorie: silice funzionalizzata con residui alchilamminici (“RP-amide stationary phase”), relativa alla colonna SUPELCO LC-ABZ, e silice funzionalizzata con catene alchiliche ottadeciliche (RP-C18), relativa alle colonne Teknokroma Mediterranea SEA C18 e Gemini C18.
Studio con la colonna SUPELCO LC-ABZ alchilammidica (RP-amide)
Il comportamento dei composti di riferimento sulla colonna ammidica LC -ABZ è stato valutato, inizialmente, in modalità isocratica con tampone fosfato 100 % (25 mM, pH 3.5). Questo non ha fornito buoni risultati in termini di separazione e selettività. Infatti, tiamina e acido ascorbico coeluiscono presso il fronte (Rt= 2 min ca.), mentre acido nicotinico e nicotinammide vengono rilevati come picchi scodati (fig. 5 a). La riboflavina esce intorno ai 20 min con un gradiente di acetonitrile da 0 a 30 % (in un intervallo compreso tra 5 e 20 min; fig. 5 b).
Successivamente, come fase mobile sono state valutate miscele di tampone ammonio formiato 25 mM a pH 3.5 e acetonitrile (rapporto 80:20, 85:15, 90:10 e 95:5 v/v), in modalità isocratica. In tutti i casi le vitamine analizzate, con l'eccezione della riboflavina, coeluiscono presso il fronte del solvente, come mostrato nel cromatogramma relativo alla miscela 95:5 (fig. 6): tiamina e acido ascorbico escono a 2 min ca., mentre la riboflavina eluisce dopo ca. 51 min.
Fig. 5: cromatografia RP-ammidica, eluizione isocratica con tampone formiato di nicotinammide 13.2
ppm, acido nicotinico 13.6 ppm, tiamina 12.5 ppm e acido ascorbico 33 ppm (a) e di riboflavina 46 ppm (b). Tiamina + Acido Ascorbico Acido Nicotinico Nicotinammide 2.5 5.0 7.5 10.0 12.5 Minutes -1.7 0.0 2.5 5.0 7.5 10.0 12.5 15.0 mAU Y: Riboflavina
a
b
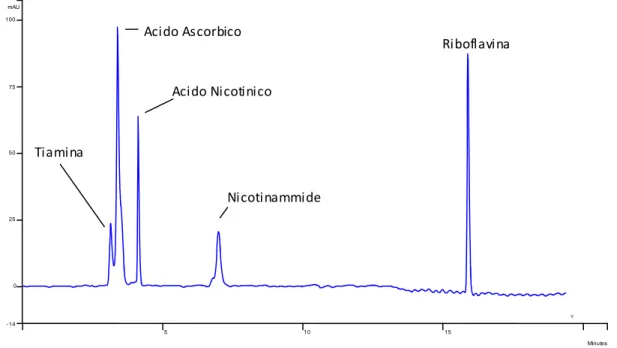
L'utilizzo del solo tampone come fase mobile, invece, comporta la buona separazione di acido ascorbico, acido nicotinico, tiamina e nicotinammide entro i primi 7.5 min, mentre la riboflavina continua ad eluire intorno a 51 min (fig 7 a-b). Quanto osservato è coerente con la letteratura esaminata relativa a questo tipo di fase stazionaria, poiché diversi metodi di separazione proposti prevedono l'uso della sola fase acquosa come condizioni iniziali34,36.
Fig. 6: cromatografia RP-ammidica, eluizione isocratica di tiamina 50 ppm (rosso), acido ascorbico 129
ppm (blu) e riboflavina 10 ppm (verde) tramite eluizione isocratica con tampone formiato.
10 20 30 40 50 Minutes -21 0 50 100 150 200 mAU
Successivamente, per separare i cinque composti (disciolti in AcOH 1 % in H2O) in un unica corsa, è stata effettuata una eluizione con un gradiente lineare (gradiente ‘a’) con tampone ammonio formiato (25 mM a pH 3.5) ed una percentuale di acetonitrile crescente, da 0 a 30 % (in un tempo compreso tra 8 e 12 min, tab. 2); il risultato ottenuto è mostrato in fig. 8.
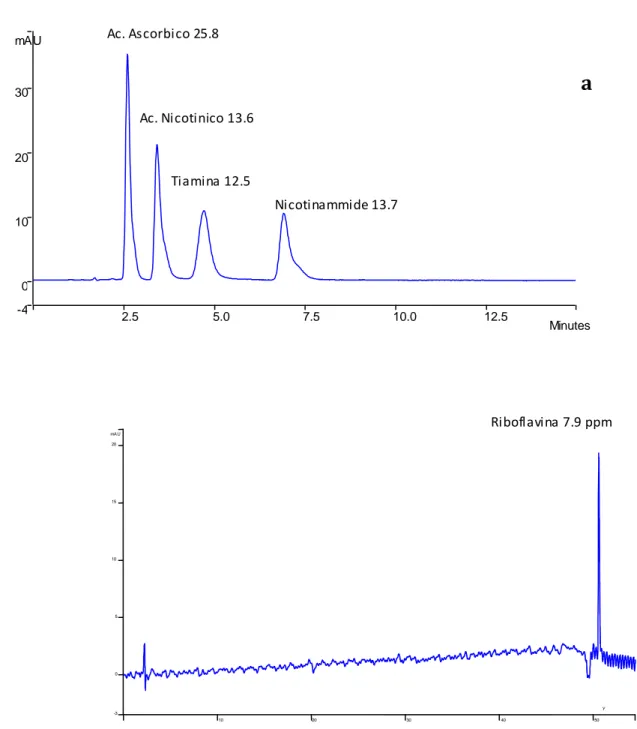
Fig. 7: cromatografia RP-ammidica, eluizione isocratica di nicotinammide 13.2 ppm,, acido nicotinico 13.6
ppm, tiamina 12.5 ppm e acido ascorbico 25.8 ppm (a) e di riboflavina 7.9 ppm (b).
a
Ac. Ascorbico 25.8 Nicotinammide 13.7 Ac. Nicotinico 13.6 Tiamina 12.5 2.5 5.0 7.5 10.0 12.5 Minutes -4 0 10 20 30 mAU 10 20 30 40 50 -3 0 5 10 15 20 mAU Y:b
Riboflavina 7.9 ppmTutti i composti escono separati e ntro i 17 min, ed inoltre si nota il diverso ordine di eluizione, dal tempo di ritenzione della tiamina a ca. 2.5 min, visibile come picco non risolto.
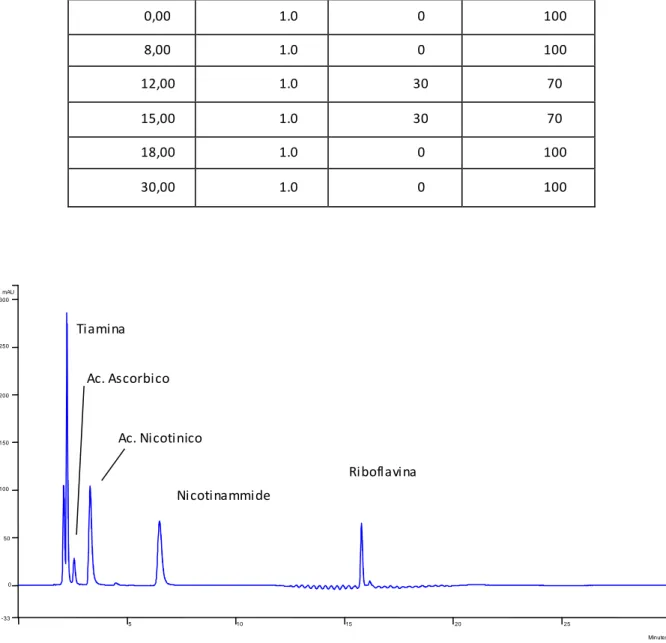
Tempo (min) Flusso (ml/min) %ACN % Tampone 0,00 1.0 0 100 8,00 1.0 0 100 12,00 1.0 30 70 15,00 1.0 30 70 18,00 1.0 0 100 30,00 1.0 0 100
Tabella 2: schema del gradiente 'a'
Fig. 8: cromatografia RP-ammidica, eluizione in gradiente ‘a’ di una miscela 50 ppm cad. (eccetto tiamina
100 ppm e riboflavina 14 ppm). Ac. Ascorbico Tiamina Ac. Nicotinico Nicotinammide Riboflavina 5 10 15 20 25 Minutes -33 0 50 100 150 200 250 300 mAU
Come si può vedere dalla ritenzione dei tre composti con carattere idrofilo più spiccato e che eluiscono più vicini al fronte, ovvero tiamina, acido ascorbico e acido nicotinico, questo tipo di colonna è fortemente sensibile anche a percentuali basse di fase organica: l'uso di condizioni isocratiche iniziali col 100 % di fase acquosa è necessario per migliorare la ritenzione e la separazione dei composti.
La separazione ottenuta in queste condizioni è soddisfacente, inoltre sono da sottolineare la velocità complessiva dell'analisi e la semplicità della metodica nel suo insieme; per questi motivi, questo metodo è stato utilizzato per un'indagine preliminare sullo studio di purificazione di miscele vitaminiche svolta fase solida (SPE), di cui riportiamo il protocollo sperimentale. Le fasi stazionarie esaminate sono costituite da diversi materiali: silice C18, polimero divinilbenzenico, silice a scambio cationico. I passaggi di caricamento del campione, lavaggio del campione ed eluizione dei componenti sono stati effettuati con diversi solventi a seconda del materiale adsorbente considerato (tab. 3 a – b):
caricamento campione 1 - 2 ml
lavaggio con tampone ammonio
formiato 25 mM, pH 3.5 A1 – A2(1 ml cad.)
eluizionecon miscela
tampone-metanolo 70:30 B1 – B2(1 ml cad.)
eluizione con MeOH 100 % C1 – C2(1 ml cad.)
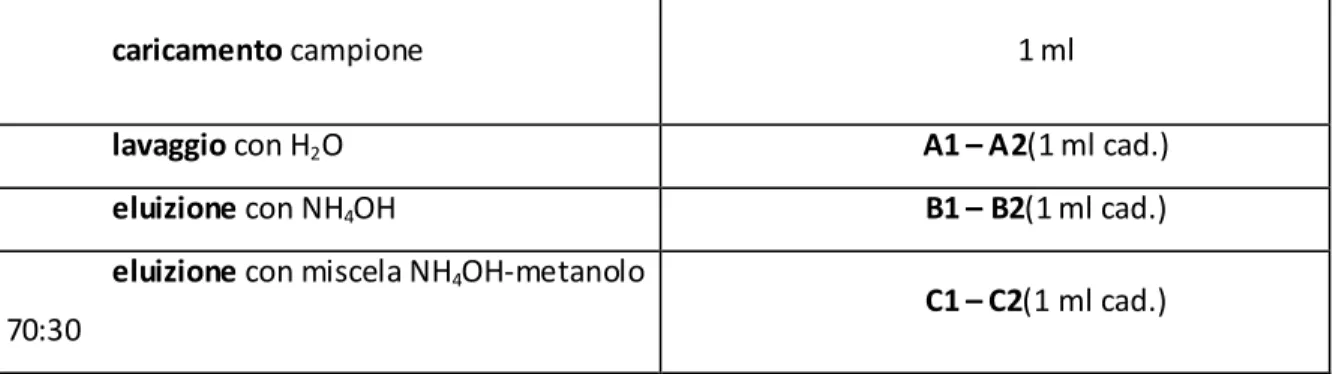
caricamento campione 1 ml
lavaggio con H2O A1 – A2(1 ml cad.)
eluizione con NH4OH B1 – B2(1 ml cad.)
eluizione con miscela NH4OH-metanolo
70:30 C1 – C2(1 ml cad.)
Il gradiente di acetonitrile (denominato gradiente ‘b’) passa da 0 a 20 % ma con una rampa leggermente più corta e anticipata (5 - 8 min, tab. 4), ed il tracciato ottenuto per una miscela di standards (20 ppm) è mostrato in fig. 9. Si nota la diminuzione del tempo di ritenzione di nicotinammide e riboflavina.
Tempo (min) Flusso (ml/min) %ACN % Tampone 0,00 1.0 0 100 5,00 1.0 0 100 8,00 1.0 20 80 15,00 1.0 20 80 18,00 1.0 0 100 30,00 1.0 0 100
Tabella 3 b: passaggi di trattamento delle cartucce SPE a scambio cationico.
L'uso del tampone ammonio acetato (25 mM, pH 5.8) ha prodotto i risultati illustrati qui di seguito: l'eluizione isocratica con tampone 100 % provoca la coeluizione di tiamina e nicotinammide a ca. 10 min, a differenza di quanto visto col tampone formiato (fig. 10 a). Inoltre, l'applicazione del gradiente ‘a’ causa l'uscita della riboflavina a ca. 17 min (fig. 10 b).
b
Acido Ascorbico 33 ppm Acido Nicotinico 13.6 ppm Tiamina 12.5 ppm + Nicotinammide 13.7 ppma
Riboflavina 46 ppmFig. 10 a: cromatografia RP-ammidica, eluizione eluizione isocratica con tampone acetato di
nicotinammide 13.7 ppm, acido nicotinico 13.6 ppm, tiamina 12.5 ppm e acido ascorbico 33 ppm.
b: cromatografia RP-ammidica, eluizione di riboflavina 11.5 ppm tramite eluizione con
Cromatografia in fase inversa (RP-C18)
Nelle fasi preliminari, tutte le prove sono state effettuate con un flusso della fase mobile pari a 1.0 ml/min e monitorate alla lunghezza d'onda di 260 nm, tranne ove indicato; inoltre, sono state utilizzate soluzioni dei nostri analiti in H2O 100 % o in soluzioni acquose di AcOH (1 %).
Studio con la colonna TEKNOKROMA Mediterranea SEA C18
Anche per le colonne C18 abbiamo voluto verificare inizialmente il grado di ritenzione delle vitamine in oggetto, in particolare dei composti con caratteristiche idrofiliche più spiccate.
Applicando le condizioni del gradiente ‘a’, con miscela iniziale acetonitrile/tampone formiato 25 mMpH 3.5 (5:95 v/v, 0 - 8 min.) seguite da uno step con acetonitrile dal 5 al 30 % (8 – 12min; v. tab. 2), si nota la sovrapposizione di tiamina ed acido ascorbico presso il fronte del solvente (fig. 11), in modo simile a quanto già osservato con la colonna RP-ammidica.
Fig. 11: cromatografia RP-C18, eluizione con gradiente ‘a’ e tampone formiato di una miscela 10 ppm cad
(eccetto acido ascorbico, 30 ppm).
Tiamina Acido Ascorbico Acido Nicotinico Nicotinammide Riboflavina 5 10 15 Minutes -14 0 25 50 75 100 mAU Y:
Utilizzando acetonitrile e tampone fosfato 10 mM a pH 3.5 nello stesso rapporto iniziale (5:95), la coeluizione dei due composti è ancora più netta (fig. 12).
L’eluizione dei composti cambia, invece, con l’uso del tampone ammonio acetato (25 mM, pH 5.8): la tiamina esce a 8.3 min. ma mostra un picco slargato, quasi unito alla nicotinammide (fig. 13).
Fig. 12: cromatografia RP-C18, eluizione con gradiente ‘a’ e tampone fosfato di una miscela 10 ppm
cad. Acido Nicotinico Tiamina + Acido Ascorbico 5 10 15 20 Minutes -12 0 25 50 75 mAU
Fig. 13: cromatografie RP-C18, eluizione con gradiente ‘a’ e tampone acetato di una miscela 10 ppm
cad (eccetto acido ascorbico; blu) e di acido ascorbico, 30 ppm (verde).
Acido Ascorbico
Acido Nicotinico
Nicotinammide Tiamina
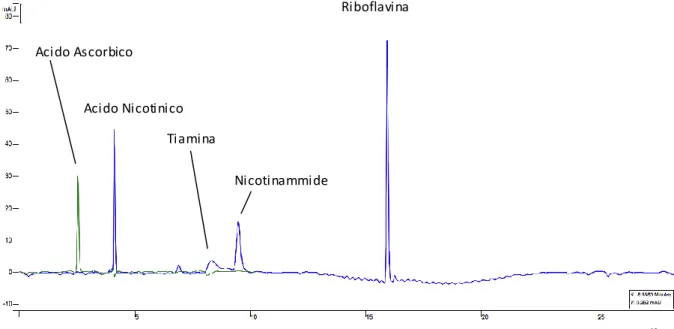
Lo stesso gradiente ‘a’, applicato utilizzando tampone formiato 100 % come eluente iniziale e acetonitrile (0 – 30 %) fornisce invece la separazione mostrata in fig. 14 a - b: i composti escono tutti tra i 5 ed i 18 min, con picchi sufficientemente risolti e defi niti tranne per l'acido ascorbico, che tende a scodare. Anche in questo caso c'è la comparsa di alterazione della linea di base in corrispondenza del gradiente. Le due analisi mostrate sono state eseguite a cinque mesi di distanza, e sono relative a concentrazioni diverse del tampone: 10 mM (14 a) e 25 mM (14 b). Con il tampone più concentrato, l’acido ascorbico fornisce un picco più simmetrico, per il resto non si ottengono variazioni sostanziali.
Come osservato per la colonna con fase ammidica, l’uso del 100 % di fase acquosa nella porzione iniziale del metodo cromatografico è indispensabile per la buona separazione di acido ascorbico, tiamina ed acido nicotinico: la ritenzione di questi composti è molto ridotta quando si aggiunge un 5 % di componente organico (tranne la tiamina con l’uso del tampone acetato).
La miscela acetonitrile-metanolo 80:20 utilizzata al posto di acetonitrile 100 % come fase organica provoca una leggera diminuzione dei tempi di ritenzione di nicotinammide e riboflavina, accompagnata però da una migliore forma dei picchi dei composti (fig. 15). La
Fig. 14: cromatografie RP-C18, eluizione con gradiente ‘a’ e tampone formiato di una miscela 40 ppm
cad (eccetto riboflavina, 35 ppm).
5 10 15 20 Minutes -47 0 100 200 300 400 mAU
miscela acetonitrile – tampone 30:70 alla fine della rampa viene mantenuta per 6 min invece di 3, ed il metodo prende il nome di gradiente ‘c’ (tab. 5).
Tempo (min) Flusso (ml/min) %Organico % Tampone
0,00 1.0 0 100
8,00 1.0 0 100
12,00 1.0 30 70
18,00 1.0 30 70
30,00 1.0 0 100
Tabella 5: Composizione del gradiente 'c'.
Fig. 15: cromatografia RP-C18, eluizione con gradiente ‘c’ e tampone formiato di una miscela 40
ppm cad (eccetto riboflavina, 35 ppm).
Tiamina Acido Ascorbico Acido Nicotinico Nicotinammide Riboflavina 5 10 15 20 0 25 Minutes s -21 0 50 100 150 mAU U
Il gradiente appena descritto è stato poi modificato aggiungendo uno step finale di pulizia della colonna, con frazione di componente organico pari all'80 % (v. tab. 6, gradiente ‘d’), in modo da predisporre la metodica all'analisi di matrici complesse che possono contenere anche composti meno idrofili e che tendono ad uscire dalla colonna con concentrazioni alte di componente organico. Il metodo si conclude in 34 min, compresa la riequilibratura, ed il risultato è illustrato in fig. 16.
Tempo (min) Flusso (ml/min) %Organico % Tampone
0,00 1.0 0 100 8,00 1.0 0 100 12,00 1.0 30 70 18,00 1.0 30 70 25,00 1.0 80 20 29,00 1.0 80 20
Fig. 16: cromatografia RP-C18, eluizione con gradiente ‘c’ e tampone formiato pH 3.5 di una miscela 40
ppm cad (eccetto riboflavina, 35 ppm).
2.5 5.0 7.5 10.0 12.5 15.0 17.5 Minutes -13 0 25 50 75 100 mAU X: Y:
a
Tiamina Acido Ascorbico Acido Nicotinico Nicotinammide Riboflavina Tabella 6: Composizione del gradiente 'd'.Al fine di una valutazione quantitativa, in queste condizioni cromatografiche, è stato valutato il comportamento di un pool di composti a struttura benzenica o piridinica (fig. 17) tra i quali poter individuare uno standard interno compatibile con il profilo cromatografico degli analiti e dei campioni in esame. I composti sono stati selezionati poichè possiedono caratteristiche compatibili con uno standard interno efficace:
hanno struttura simile ai composti ricercati
hanno spettro di assorbimento UV simile ai composti ricercati sono assenti nel campione naturale analizzato
Nella figura 18 viene confrontata l'eluizione di soluzioni standard (50 ppm in H2O) dei cinque composti elencati a 260 nm.
NH2 CONH2 N Cl COOH N NH2 COOH N OH H3C COOH N OH H3C
Antranilammide Acido 2-cloro-nicotinico Acido
2-idrossi-6-metil-nicotinico
2-idrossi-6-metil-piridina Acido 2-ammino-nicotinico
La fig. 16 mostra una efficiente separazione delle vitamine ottenuta col tampone formiato 10 mM a pH 3.5, tuttavia l’acido ascorbico risulta meno risolto. Un ulteriore esperimento è stato effettuato con un tampone più acido (pH 3.0), per favorire una maggiore protonazione dell’acido ascorbico (pka 3.2 ca.) e migliorare il suo comportamento cromatografico. In realtà, ciò che si osserva è la minore ritenzione della tiamina, che coeluisce con l’acido ascorbico. Inoltre, i picchi di acido nicotinico e nicotinammide tendono a scodare (fig.19).
Fig. 18: cromatografia RP-C18, eluizione con gradiente ‘d’ e tampone formiato dei composti valutati
come standard interno. Blu: antranilammide; rosso: acido 2-cloro-nicotinico; verde: acido 2-idrossi-6-metil-nicotinico; marrone: acido 2-ammino-nicotinico; fucsia: 2-idrossi-6-metil-piridina (50 ppm cad.)
5 10 15 20 25 Minutes 0 10 20 30 mAU 0 10 20 30 mAU 0 10 20 30 mAU 0 10 20 30 mAU 0 10 20 30 mAU
Studio con la colonna PHENOMENEX Gemini C18
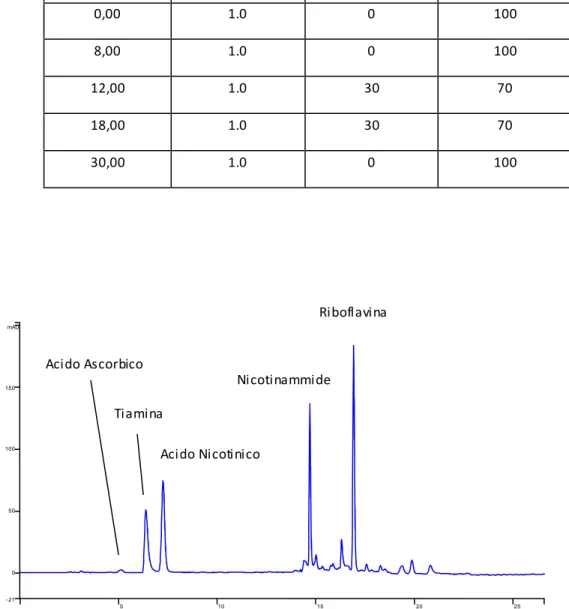
Viste le indicazioni fornite dagli esperimenti condotti in via preliminare sulla colonna Teknokroma C18, il comportamento della colonna Gemini C18 è stato valutato, inizialmente, con l'applicazione del gradiente ‘d’ (componente organico a percentuale crescente 0 – 30 – 80 %), riportato in tab. 5. Il risultato ottenuto con tampone formiato 25mMa pH 3.5 è illustrato in fig. 20: tiamina ed acido ascorbico coeluiscono intorno a 4 min, mentre gli altri composti sono ben separati e definiti.
Fig. 19: cromatografia RP-C18, eluizione con gradiente ‘d’ e tampone formiato, pH 3.0.di una miscela 40
ppm cad (eccetto riboflavina, 30 ppm).
5 10 15 20 25 Minutes -20 0 25 50 75 100 125 mAU Acido Nicotinico Nicotinammide Acido Ascorbico Tiamina Riboflavina
Per migliorare la risoluzione dei picchi di acido ascorbico e tiamina, è stato variato il pH della fase mobile, in modo da ottenere la protonazione completa. Infatti, variando il pH da 3.5 a 3.0, l’acido ascorbico eluisce con tempo di ritenzione maggiore, cambiando l'ordine di eluizione e separandosi nettamente dalla tiamina che invece risulta insensibile alla variazione (fig. 21).
Fig. 20: cromatografia RP-C18, eluizione con gradiente ‘d’ e tampone formiato a pH 3.5 di una miscela 40
ppm cad (eccetto riboflavina, 30 ppm).
5 10 15 20 25 Minutes -32 0 50 100 150 200 mAU Ni cotinammide Acido Ni cotini co Ri bofla vina Tiamina Acido Ascorbico
Fig. 21: cromatografia di una miscela 40 ppm cad (eccetto riboflavina, 30 ppm) ottenuta tramite
eluizione con gradiente ‘d’ e tampone formiato, pH 3.0.
5 10 15 20 25 -30 0 50 100 150 200 mAU Tiamina Acido Ascorbico
I picchi presenti nel cromatogramma sono tutti ben separati e definiti, evidenziando che la colonna Gemini, nelle condizioni appena descritte, dimostra verso i composti analizzati una selettività superiore a quella ottenuta con le altre colonne in fas e inversa utilizzate in questo studio, sia di tipo RP-C18 che di tipo RP-ammidica.
Riassumendo, i dati sperimentali ottenuti hanno portato a definire un protocollo cromatografico in fase inversa così costituito:
fase stazionaria: colonna Gemini C18 (250 x 4.6 mm, granulometria 5 µm)
eluente: gradiente di acetonitrile/metanolo (80:20 v/v) in tampone ammonio formiato (25 mM, pH 3.0; gradiente ‘d’), flusso 1.0 ml /min.
rivelazione: detector UV-DAD a 260 nm.
Inoltre, in queste condizioni è stato valutato il comportamento dei composti selezionati per la scelta di uno standard interno: l’analisi di una miscela di vitamine standard, con aggiunte sequenziali dei diversi composti suddetti, viene mostrato in fig. 22.
E’ stato valutato il comportamento di altre colonne in fase inversa (Hypersil C18, Varian C18) che non hanno fornito buoni risultati.
Per concludere, le prove effettuate con le diverse fasi stazionarie in nostro possesso (HILIC, RP-amide, RP-C18) hanno permesso di sviluppare un protocollo cromatografico per la separazione delle vitamine idrosolubili considerate. Per la cromatografia HILIC, una separazione soddisfacente è stata ottenuta tramite eluizione isocratica con miscela acetonitrile – tampone ammonio acetato (50 mM, pH 5.8); la fase inversa di tipo alchilammidico ci ha consentito una buona separazione tramite l’applicazione dei gradienti ‘a’ e ‘b’ utilizzando acetonitrile e
Fig. 22: cromatografia di una miscela 40 ppm cad (eccetto riboflavina, 30 ppm) con aggiunta dei cinque
standard interni selezionati, ottenuta tramite eluizione con gradiente ‘d’ e tampone formiato, pH 3.0.
Antranilammide Acido 2-cloro-nicotinico Acido 2-idrossi-6-metil-nicotinico 2-idrossi-6-metil-piridina Acido 2-ammino-nicotinico
tampone ammonio formiato 25 mM a pH 3.5, mentre le fasi inverse C18 hanno mostrato una buona capacità separativa tramite eluizione con i gradienti ‘c’ e ‘d’ utilizzando acetonitrile (o acetonitrile/metanolo 80:20) e tampone ammonio formiato 25 mM a pH 3.5 e 3.0. In particolare, la colonna Gemini C18 ha mostrato un ottima separazione con l’utilizzo del tampone a pH 3.0, dimostrando una selettività verso gli analiti in questione maggiore rispetto alle altre colonne a fase inversa che sono state studiate.
Sviluppo del metodo cromatografico tramite CE
Per quanto riguarda lo sviluppo di un metodo cromatografico in elettroforesi capillare (CE), inizialmente si è cercato di valutare il comportamento delle vitamine idrosolubili prese in esame tramite tutti i principali approcci descritti in letteratura, vale a dire l’elettroforesi capillare zonale (CZE), l’elettroforesi micellare elettrocinetica (MEKC) e la cromatografia elettrocinetica in microemulsione (MEEKC).
Si è deciso di riproporre un metodo riportato in letteratura dal gruppo di ricerca di Changna Yin47 in cui venivano determinate numerose vitamine (B2, B3, B5, M, H, C, E, D3, B6, B12) in formulazioni farmaceutiche multivitaminiche. Questo metodo (MEEKC) prevede di utilizzare una microemulsione costituita da: SDS (1.2 g), n-esano (0.8 g), n-butanolo (21 ml) e acetonitrile (18 ml) portati a volume di 100 ml con tampone borato (20 mM, pH 8.7).
Il metodo prevede per ogni analisi le seguenti fasi:
Lavaggio con acqua (3 minuti) e tampone di separazione (3 minuti) a 20 psi Iniezione a 0,5 psi con durata di 7 secondi
Separazione a 25 kV con tampone di separazione
I primi esperimenti con questa metodica non hanno dato buoni risultati: il sistema si è dimostrato instabile portando alla formazione di un elevato rumore di fondo che impediva l’ottenimento di analisi riproducibili, come è possibile evidenziare dall’ elettroferogramma riportato in figura 23.
Successivamente, si è deciso di variare le quantità dei componenti della microemulsione con lo scopo di ridurre la tensione superficiale, aumentando di conseguenza la stabilità della microemulsione stessa. Sono state quindi modificate le quantità di SDS e di acetonitrile singolarmente o in combinazione. Le variazioni apportate al metodo non hanno però permes so di ottenere buoni risultati in quanto si sono presentati problemi di dispersione di corrente e/o instabilità del sistema.
Alla luce di questi risultati sono stati presi in esame altri tipi di microemulsione; in particolare si è riproposto il metodo utilizzato per la determinazione di vitamine (A palmitato, E acetato, K3, D3, B2) in formulazioni multivitaminiche, che prevede l’utilizzo di due co-surfactanti e l’assenza di acetonitrile (SDS 80 mM, 0.8% n-ottano, 15% 1-propanolo, 5% butanolo, tampone borato 40 mM a pH 5.1)48. I dati ottenuti hanno evidenziato come l’utilizzo di un secondo surfactante permetta di ottenere una maggiore stabilità della microemulsione sebbene l’assenza di acetonitrile comporti una risoluzione poco efficiente degli anal iti di nostro interesse (fig. 24). Minutes 0 2 4 6 8 10 12 14 16 18 20 AU -0.002 -0.001 0.000 0.001
Data la scarsa risoluzione ottenuta utilizzando la tecnica MEEKC, è stata riproposta un'altra metodica che prevede l’utilizzo di ciclodestrine per la determinazione delle vitamine A, E, B1, B2, B8, B12, C e H49.
Questa prevede l’utilizzo di un tampone a pH 7.6 costituito da:
Tetraborato di sodio (0,1 M)
Diidrogenofosfato di sodio (0,05 M) γ - ciclodestrine (3 mM)
SDS (30 mM)
Il protocollo strumentale consiste nelle seguenti fasi:
Lavaggio iniziale di cinque minuti (20 psi) con tampone di separazione in direzione inversa (“reverse”) Minutes 0 5 10 15 20 25 30 35 40 45 50 55 60 AU 0.00 0.01 0.02 0.03 0.04
Fig.24: elettroforesi capillare in modalità MEEKC, analisi di nicotinammide, acido nicotinico, acido
Iniezione a 0.5 psi con durata 7.0 secondi
Separazione a 20kV con tampone di separazione
Lavaggio con acqua per un minuto (20 psi), NaOH per tre minuti (20 psi), acqua per due minuti (20 psi)
Le temperature della cartuccia e del campione sono rispettivamente di 24 e 25 °C.
La separazione delle soluzioni con questo metodo ha dato risultati incoraggiati durante le analisi di singole vitamine (fig. 25):
[A] [B]
[C] [D]
[E] [F]
Fig. 25: elettroforesi capillare in modalità MEEKC, analisi delle vitamine standard (200 ppm cad. eccetto
Successivamente si è passati ad analizzare la miscela di tutte le vitamine descritte. In tali condizioni, la soluzione portava alla formazione di un precipitato bianco che occludeva il capillare; è stato possibile osservare tale fenomeno anche dal tracciato della corrente (fig. 26).
A seguito di questi risultati, si è provato ad analizzare solamente le vitamine idrosolubili. In letteratura si è potuto osservare che la maggior parte dei metodi effettua la separazione dei composti con elettroforesi zonale (CZE) ed elettroforesi micellare (MEKC).
Per quanto concerne l’utilizzo della CE in modalità MEKC, è stato preso in considerazione quanto riportato in letteratura dal gruppo di ricerca di Mazina46 che prevede la determinazione di differenti vitamine (B1, B3, B5, B6 e C) in alcuni alimenti (lievito, birra e bevande-sciroppi). Secondo questo metodo, il tampone di separazione è costituito da acido borico (40 mM) e SDS (60 mM a pH 8.2).
Il metodo di analisi prevede le seguenti fasi:
Lavaggio con NaOH per tre minuti (20 psi), e a seguire tre minuti di tampone (20 psi) Iniezione a 0.5 psi con durata di 7 secondi
Separazione a 20 kV Minutes 0 1 2 3 4 5 6 7 8 9 10 µA 0 10 20 30 40 50 60 µA 0 10 20 30 40 50 60 Current nic_vitE
La temperatura della cartuccia e del campione erano rispettivamente di 25 e 20 °C. Queste condizioni sperimentali permettono di ottenere una buona separazione delle cinque vitamine in oggetto con un tempo di analisi complessivo di circa venticinque minuti (fig. 27).
Con lo scopo di diminuire il tempo di analisi si è deciso di variare il voltaggio nella procedura MEKC applicando una differenza di potenziale di 20, 25 e 30 kV (fig. 28). Come è possibile osservare, a 30 kV il tempo di analisi e la risoluzione degli analiti risulta eccellente.
Fig. 27: elettroferogramma MEKC delle cinque vitamine idrosolubili (nicotinamide [A], a. ascorbico
[B], a. nicotinico [C], riboflavina [D] e tiamina [E]) alla concentrazione di 50ppm.
A B C D E 0.003 0.004 0.005 Minutes 0 2 4 6 8 10 12 14 16 18 20 22 24 26 28 30 AU 0.000 0.001 0.002
Fig. 28: elettroferogramma MEKC di una miscela di standard (100 ppm cad.) con voltaggio di 20 kV [A], 25 kV [B] e 30 kV [C]. [B] [A] [C] Minutes 0 2 4 6 8 10 12 14 16 18 20 22 24 26 28 30 Minutes 0 2 4 6 8 10 12 14 16 18 20 22 24 26 28 30 Area Minu tes 0 2 4 6 8 1 0 1 2 1 4 1 6 1 8 2 0 PDA - 260nm Miscela vitamine30min30k V Ar ea
A seguito di ciò, si è voluto valutare l’effettiva importanza dell’SDS nel processo cromatografico, provando ad effettuare l’analisi con il solo tampone borato in assenza di surfactante (modalità CZE). La separazione delle cinque vitamine è stata quindi condotta utilizzando tampone borato 0.1 M a pH 8,2.
Il metodo finale da noi sviluppato prevede le seguenti fasi di analisi:
Lavaggio con NaOH per tre minuti (20 psi) e a seguire tre minuti di tampone (20 psi) Iniezione a 0.5 psi con durata di 7 secondi
Separazione a 20kV
La temperatura della cartuccia e del campione sono rispettivamente di 20 e 15 °C.
In assenza di SDS, il flusso elettrosmotico è maggiore e, di conseguenza, si ottiene un elettroferogramma completo in tempi più brevi. Inoltre, in queste condizioni di analisi, la tiamina presenta una maggiore mobilità elettroforetica essendo l’unica vitamina caricata positivamente a pH basico (8.2).
Come è possibile osservare dall’elettroferogramma ottenuto tramite tecnica CZE (fig. 29), applicando un voltaggio di 20 kV con temperatura 20 °C, si ha una risoluzione non ottimale della tiamina e della riboflavina.
Fig. 29: elettroferogramma CZE delle cinque vitamine idrosolubili a concentrazione di 50 ppm, voltaggio
Per migliorare quindi questo aspetto, sono state svolte prove con variazione di voltaggio, di temperatura e di pH.
Le analisi condotte hanno evidenziato che variando sia il voltaggio ad un valore di 15 kV che l’acidità del tampone (pH 8.0) non si ottiene una maggiore risoluzione degli analiti. Tuttavia variando la temperatura del campione da 20 °C a 15 °C e applicando un voltaggio di 20 kV è stato possibile osservare una migliore risoluzione di tutti gli analiti (fig. 30).
E’ stata inoltre valutata l’influenza della concentrazione degli analiti sulla risoluzione attraverso l’analisi di miscele a concentrazioni diverse (fig. 31). Come è possibile osservare dal confronto dei due elettroferogrammi (50 e 60 ppm), la risoluzione degli analiti è direttamente proporzionale alla concentrazione.
Fig. 30: elettroferogramma CZE delle cinque vitamine idrosolubili a concentrazione di 50ppm,
I composti selezionati inizialmente come potenziali standard interni sono stati analizzati anche con la modalità CZE. La fig. 32 mostra l’analisi di una miscela di vitamine standard con l’aggiunta di acido 2-amminonicotinico: il composto risulta separato bene dagli altri 5 picchi uscendo a Rt = 6.8 min.
[B]
[A]
Minutes 3.5 4.0 4.5 5.0 5.5 6.0 6.5 7.0 7.5 8.0 AU -0.001 0.000 0.001 0.002 PDA - 260nm mix5+a.2 amminonicotinico Area
Per quanto riguarda la preparazione delle soluzioni delle vitamine, per tutti i tipi di analisi queste sono state solubilizzate in acqua (B1, B3, C) e nel tampone di separazione (B2). Maggiore attenzione è stata posta per la riboflavina in quanto presenta una sca rsa solubilità in acqua che varia notevolmente in base alla struttura cristallina (Merck Index). Infatti, nel caso della microemulsione, la solubilizzazione massima è stata di 250 ppm, mentre, utilizzando le ciclodestrine, il tampone borato (CZE) e cromatografia micellare elettrocinetica (MEKC), è stato possibile avere il massimo della solubilizzazione a 100 ppm.
Una volta messe a punto le due metodiche cromatografiche (CZE e MEKC) e trovate le condizioni ottimali di temperatura e voltaggio, sono state cos truite per tutte e cinque le vitamine (con entrambi i metodi) rette di taratura per valutare i limiti di quantificazione (LOQ) e determinazione (LOD) e i range di linearità.
Acido 2-amminonicotinico
Applicazioni su farmaci commerciali.
In via preliminare, per verificare l’applicabilità delle metodiche cromatografiche (HPLC) ed elettroforetiche (CE) sviluppate su miscele di standard all’analisi di matrici complesse a titolo noto, sono stati analizzati due integratori vitaminici commerciali: SUSTENIUM PLUS® e Berocca Plus®. L’integratore SUSTENIUM PLUS® è un granulato a base di vitamine (B1, C), sali minerali (magnesio, zinco e ferro), aminoacidi (acido L-aspartico e L-Arginina) e creatina, mentre l’integratore Berocca Plus® è una compressa ricca di vitamine del gruppo B (B1, B2, B3, B5, B6, B8, B9, B12), vitamina C e Sali minerali (Calcio, Magnesio e Zinco).
Per la preparazione dei campioni sono stati pesati circa 2,5 grammi della compressa e del granulato e fatti sciogliere, rispettivamente, in 5 o 4 ml di HCl (O,1 N), e sottoposti ad agitazione a 70°C per 5 min. Il campione viene successivamente centrifugato e il surnatante diluito con tampone borato (250 µl surnatante + 250 µl di tampone).
In elettroforesi capillare, In un primo momento è stata utilizzata solamente la tecnica zonale (CZE) per evitare eventuali interferenze con i vari eccipienti presenti.
Dai risultati cromatografici ottenuti, è stato possibile osservare che tutte le vitamine sono state rilevate (fig. 33). La conferma di tali risultati è stata ottenuta effettuando l’aggiunta di vitamine standard ai campioni.
Le soluzioni ottenute dall’estrazione sono state analizzate anche in HPLC in fase inversa con colonna Gemini C18 e gradiente ‘d’. Anche in questo caso, tutti i componenti vitaminici riportati in etichetta sono stati determinati, dimostrando la validità delle procedure analitiche sviluppate all’analisi di matrici complesse preparate artificialmente (fig. 34).
Minutes 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 AU 0.00 0.01 0.02 0.03 0.04 0.05 0.06 [A] Acido ascorbico Tiamina Minutes 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 AU 0.00 0.01 0.02 0.03 0.04 0.05 [B] Nicotinamide Acido ascorbico Tiamina
Fig. 33: nell’elettroferogramma [A] è riportata l'analisi dell'integratore SUSTENIUM PLUS® mentre
Nel complesso, la metodica elettroforetica in modalità CZE ha consentito una risoluzione migliore per le vitamine contenute nei campioni analizzati rispetto alla metodica in modalità MEKC ed all’analisi HPLC, rivelandosi la migliore per l’analisi di campioni di questo tipo.
Fig. 34: analisi HPLC dell'integratore SUSTENIUM PLUS® (a) e dell'integratore Berocca Plus® (b).
a
Costruzione delle rette di taratura delle vitamine idrosolubili
Rette di taratura - HPLC
Preparazione delle soluzioni madre
Le soluzioni madre (50 ppm) di acido ascorbico, tiamina, acido nicotinico e nicotinammide sono state preparate sciogliendo 5.0 mg es attamente pesati in acqua MilliQ in matraccio tarato, agitando e portando a volume di 50 ml. La soluzione madre di riboflavina è stata preparata alla stessa maniera, ma è stato necessario aggiungere il solvente un poco alla volta, agitando ogni volta, e sonicare la soluzione ottenuta per 15 min. In questo modo è stata ottenuta una soluzione limpida e stabile anche alla temperatura di 4 °C.
Tutte le soluzioni madre sono state conservate in frigo (4 °C) e preparate di fresco ogni settimana, tranne per acido ascorbico e tiamina che sono state preparate giornalmente.
Preparazione delle diluizioni per le rette di taratura
Per ciascuna vitamina, sono stati prelevati 2.0 ml di soluzione madre (soluz. M, 50 ppm) e portati a volume di 10 ml in matraccio, ottenendo la soluzione 10 ppm (soluz. A); da questa, allo stesso modo, è stata preparata la soluzione di riferimento 2 ppm (soluz. B), e da quest'ultima è stata preparata la soluzione 0.4 ppm (soluz. C). Infine, per ogni composto sono state preparate ulteriori diluizioni, come riportato in tabella 6, ed utilizzate per la costruzione della retta di taratura.
Le analisi sono state effettuate sulla colonna Gemini C18 utilizzando il metodo descritto dal gradiente ‘d’, riportato in tab. 6, e lettura UV a 260 nm.
Le soluzioni sono state iniettate in ordine di concentrazione rigorosamente crescente, con analisi ripetute in triplicato. Per ogni diluizione, è stata calcolata la media dell'area del picco ottenuta nelle tre analisi e la deviazione standard. La media delle aree è stata riportata in grafico in funzione della concentrazione, e dal grafico di dispersione è stata ottenuta la retta di regressione lineare, la relativa equazione ed il coefficiente di linearità (espresso come R2), come riportato in fig. 35 a - e. I parametri analitici ottenuti sono riassunti in tab. 7.
Composto Concentrazione (ppm) Soluzione di origine; volume prelevato Volume finale Tiamina 15 M; 300 ul 1.0 ml 8 A; 800 ul 1.0 ml 4 A; 400 ul 1.0 ml 1 B; 500 ul 1.0 ml 0.4 B; 400 ul 2.0 ml Acido Ascorbico 20 M; 400 ul 1.0 ml 6 A; 600 ul 1.0 ml 4 A; 400 ul 1.0 ml 1 B; 500 ul 1.0 ml 0.4 B; 400 ul 2.0 ml Acido Nicotinico 4 A; 400 ul 1.0 ml
1 B; 500 ul 1.0 ml 0.8 B; 800 ul 2.0 ml 0.2 C; 500 ul 1.0 ml 0.1 C; 800 ul 2.0 ml Nicotinammide 8 A; 800 ul 1.0 ml 4 A; 400 ul 1.0 ml 1.6 B; 800 ul 1.0 ml 0.8 B; 800 ul 2.0 ml 0.4 B; 400 ul 2.0 ml Riboflavina 40 M; 800 ul 1.0 ml 20 M; 400 ul 1.0 ml 6 A; 600 ul 1.0 ml 4 A; 400 ul 1.0 ml 1 B; 500 ul 1.0 ml
Costruzione delle rette di taratura - HPLC
Le rette di taratura delle vitamine idrosolubili vengono riportate qui di seguito (fig. 1 a – e). I parametri analitici relativi alle cinque vitamine e derivati dalla costruzione delle rette di taratura sono riportati in tab. 8.
Tiamina y = 17,379x + 0,9417 R2 = 0,9983 0 50 100 150 200 250 300 0 2 4 6 8 10 12 14 16 ppm m A U Tiamina Lineare (Tiamina)
Acido Ascorbico y = 14,048x - 5,9144 R2 = 0,9987 -50 0 50 100 150 200 250 300 0 5 10 15 20 25 ppm m A U Acido Ascorbico
Lineare (Acido Ascorbico)
Fig. 35 - c: retta di taratura dell’acido nicotinico
Acido Nicotinico y = 22,656x + 0,5528 R2 = 0,9977 0 10 20 30 40 50 60 70 80 90 100 0 1 2 3 4 5 ppm m A U Acido Nicotinico
Lineare (Acido Nicotinico)
Nicotinammide y = 22,502x - 0,4571 R2 = 0,9999 0 50 100 150 200 250 0 2 4 6 8 10 12 ppm m A U Nicotinammide Lineare (Nicotinammide)
Fig. 35 - d: retta di taratura della nicotinammide.
Riboflavina y = 49,567x + 5,7478 R2 = 0,9985 0 500 1000 1500 2000 2500 0 10 20 30 40 50 ppm m A U Riboflavina Lineare (Riboflavina)
Rette di taratura - CE
Preparazione delle soluzioni madre e delle relative diluizioni
Sono state preparate soluzioni alla concentrazione di 0,5 mg/ml (500 ppm) di tiamina, nicotinamide, acido nicotinico e acido ascorbico, sciogliendo 5 mg esattamente pesati di
Analita LOQ (ppm) Range Linearità (ppm) R2 Acido Ascorbico 0.4 0.4 - 20 0.9987 Tiamina 0.4 0.4 – 15 0.9983 Acido Nicotinico 0.1 0.1 - 4 0.9977 Nicotinammide 0.4 0.4 – 10 0.9999 Riboflavina 1 1 - 40 0.9985
Tabella 8: Parametri analitici delle vitamine id rosolubili con la colonna Gemini C18 ed il gradiente selezionato per
composto in acqua Milli-Q e portando a volume di 10 ml in un matraccio tarato; da ciascuna di queste soluzioni (delle vitamine B1, B2, B3 e C) sono stati prelevati 2 ml e portati a volume di 10 ml, ottenendo una soluzione di 100 ppm. Da quest’ultima, per diluizioni con acqua sono state preparate le seguenti soluzioni: 80 ppm, 60 ppm, 40 ppm, 30 ppm, 20 ppm e 10 ppm. Per la riboflavina, invece, è stata preparata una soluzione alla concentrazione 0,1 mg/ml (100 ppm) sciogliendo 1 mg di campione con tampone di separazione e portando a volume di 10 ml in un matraccio tarato. Da quest’ultima per diluizione col tampone di separazione sono state preparate le seguenti diluizioni: 80 ppm, 60 ppm, 40 ppm, 30 ppm, 20 ppm e 10 ppm.
Costruzione delle rette di taratura con tampone borato-SDS (MEKC):
Le rette di taratura ottenute per le cinque vitamine in modalità MEKC sono
illustrate in fig. 36.
Figura 36 - a: retta di taratura della tiamina
Figura 36 - c: retta di taratura dell’acido nicotinico
Costruzione delle rette di taratura con tampone borato (CZE):
Le rette di taratura ottenute per le cinque vitamine in modalità CZE sono illustrate
in fig. 37.
Figura 37 - a: retta di taratura dell’acido ascorbico
Figura 37 - c: retta di taratura dell’acido nicotinico