Introduzione
Il mesotelioma pleurico
Il mesotelioma pleurico maligno è una rara forma di tumore che colpisce principalmente le cellule sierose della cavità pleurica. Noto per la sua aggressività e resistenza alle comuni terapie, consente una sopravvivenza media di 7,7 mesi in un range che va da 1 a 72 mesi dal momento della diagnosi (Magnani et al., 2002). L’età maggiormente colpita è compresa tra i 40 e i 60 anni con il sesso maschile affetto nel 60% dei casi (Bianchi et al., 2004).
L’incidenza di questa neoplasia appare in crescita in tutto il mondo (Peto et al., 1999) e, secondo recenti studi inglesi e nord americani, è dell’ordine di 2,2 casi per milione di abitanti. Negli Stati Uniti uccide ogni anno approssimativamente 2500 persone, e si ritiene che una grossa percentuale di essi possono essere causati dall’esposizione a fibre di asbesto, anche comunemente chiamato amianto (Price et al., 2003).
Il mesotelioma e SV40
E’ noto un possibile ruolo del virus SV 40 nell’ eziologia di questa malattia (Xu et al., 1999). SV40 è un virus endogeno della scimmia Macacus rhesus.
Tra il 1955 e il 1963 furono distribuiti vaccini contro la poliomielite e adenovaccini che erano stati preparati con colture cellulari cresciute su monostrati di cellule di rene di scimmia macaco, che portavano il virus. Poiché questo virus non porta danni citotossici, non fu trovato fino al 1960. Solo negli Stati Uniti è stato stimato un contagio di circa 98 milioni di persone attraverso l’inoculo del vaccino anti poliomielite (Fisher et al. 1999). Studi
sperimentali hanno mostrato che l’iniezione intrapleurica di SV 40 è in grado di indurre mesotelioma maligno nel 100% degli animali indipendentemente dall’esposizione all’amianto.
Le proteine di SV 40 responsabili dell’oncogenesi sono codificate da una piccola regione del DNA virale. Tale agente svolgerebbe la sua azione non mediante integrazione nel DNA della cellula mesoteliale, ma con un meccanismo episomiale che produce oncoproteine virali che causano alterazioni a geni regolatori del ciclo cellulare. Le proteine di SV40 associate con l’oncogenicità sono l’antigene T grande (Tag) e l’antigene t piccolo (tag). Le oncoproteine prodotte de SV 40 sono mutageniche in quanto alterano direttamente il cariotipo inducendo alterazioni cromosomiche sia strutturali che numeriche, inattivano geni soppressori tumorali della famiglia Rb come
p53, che alterando il ciclo cellulare probabilmente se non provocano, contribuiscono al fenotipo maligno (Gazdar e Carbone, 2003). La presenza di SV40 nella cellula quindi può, da una parte mutare direttamente il DNA, dall’altra dare più tempo alla cellula di accumulare sufficienti alterazioni genetiche che portano a fenotipo tumorale quando l’antigene di SV40 va a legare p53 e inibire l’apoptosi. L’analisi di 48 mesoteliomi umani con PCR ha mostrato che in 29 di essi era presente la sequenza di SV40 (60%) (Carbone et al., 1994). In accordo con questa ipotesi, l’asbesto stesso può essere sufficiente a causare il tumore, ma fattori addizionali, come SV40 o l’esposizione a radiazioni o ad altri agenti tossici possono aumentarne il rischio (Rizzo et al., 2001).
L’amianto quale cancerogeno
Il primo a studiare una possibile correlazione tra asbesto e mesotelioma fu Wagner, che già nel 1960 pubblicava sul “British Journal of Cancer” un articolo intitolato “Diffuse pleural mesothelioma and asbestos exposure in the
North Western Cape Province”, in cui si parla dei minatori di Kimberley in Sud Africa, i quali avevano sviluppato tumore alla pleura, il mesotelioma, in seguito ad esposizione con crocidolite, minerale da cui si estrae l’asbesto. Il passo successivo fu quello di inoculare amianto in animali da esperimento: si dimostrò così, nel 1965, la cancerogenità del minerale, poiché gli animali trattati con l’asbesto si ammalavano di questo tipo di tumore. Si arrivò così al primo articolo di Selikoff che nel 1965 pubblicò su JAVA: “Reletion between exposure to asbestos and mesothelioma”, in cui viene assodata la correlazione tra esposizione all’amianto e sviluppo tumorale. I primi risultati di questi studi servirono a prestare maggiore attenzione a questo minerale che in quegli stessi anni aveva il suo massimo impiego. Da questo momento infatti numerosi studi si susseguirono a dimostrare i possibili danni del minerale che comunque continuò ad essere largamente utilizzato (Bourdes et al., 2000).
L’amianto e le attività antropiche
Dall'antichità fino all'epoca moderna, l'amianto è stato usato per scopi "magici" e "rituali". I Persiani ed anche i Romani disponevano di manufatti in amianto per avvolgere i cadaveri da cremare, allo scopo di ottenere ceneri più pure e chiare. Una credenza popolare diceva che l'amianto fosse la "lana della salamandra", l'animale che per questo poteva sfidare il fuoco senza danno.
Marco Polo, ne “Il Milione”, sfata questa leggenda e racconta che nella provincia cinese di Chingitalas, filando questo minerale si otteneva un tessuto impiegato per confezionare oggetti di uso domestico, come per esempio tovaglie. Risale al '600 la ricetta del medico naturalista Boezio che dimostra l'uso dell'amianto nella preparazione di medicamenti dell'epoca: "Dall'asbesto si fa spesso un unguento miracoloso per il lattime e per le
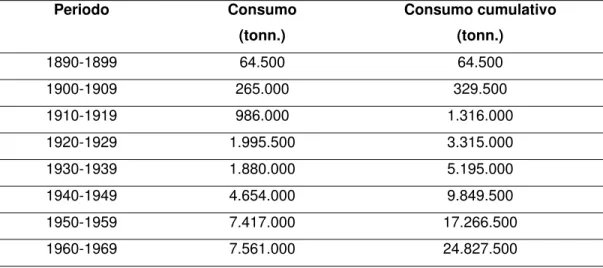
ulcerazioni delle gambe. Si prendono quattro once di asbesto, due once di piombo, due once di ruta e vengono bruciate, quindi, ridotte in polvere, vengono macerate in un recipiente di vetro con l'aceto ed ogni giorno, per una volta al giorno per un mese l'impasto viene agitato. (…….). Allora si unge tutto il capo del fanciullo per farlo rapidamente guarire: per la scabbia e le vene varicose le parti vengono unte al tramonto finchè non sopravvenga la guarigione". L'amianto è rimasto presente nei farmaci sino ai recenti anni '60 per due tipi di preparati: una polvere contro la sudorazione dei piedi ed una pasta dentaria per le otturazioni. La prima utilizzazione dell'amianto da parte dell'industria risale agli ultimi decenni dell'800. L'incremento nell'estrazione e nell'impiego è ben illustrato dalla tabella 1 che descrive la situazione degli Stati Uniti d'America.
Tabella 1. Consumo (espresso in tonnellate) di amianto negli Stati Uniti d’America tra il 1890 e il 1970 (I. J. Selikoff riportato da Carnevale et al., 1992) Periodo Consumo (tonn.) Consumo cumulativo (tonn.) 1890-1899 64.500 64.500 1900-1909 265.000 329.500 1910-1919 986.000 1.316.000 1920-1929 1.995.500 3.315.000 1930-1939 1.880.000 5.195.000 1940-1949 4.654.000 9.849.500 1950-1959 7.417.000 17.266.500 1960-1969 7.561.000 24.827.500
Nel 1903, 83 persone perirono in seguito ad un incendio nella Metropolitana di Parigi. Questo fatto clamoroso indusse la sostituzione di tutti i materiali
infiammabili con manufatti contenenti amianto, compresi i freni delle carrozze. Simili interventi furono adottati anche nella metropolitana di Londra e, nel 1932, per la coibentazione del transatlantico Queen Mary. Questi eventi indussero una eccessiva confidenza con l'amianto fino a favorirne una massiccia diffusione in campo edilizio per la coibentazione di scuole, ospedali, palestre, cinema. In Italia, nella seconda metà degli anni '50, si coibentarono con l'amianto le carrozze ferroviarie, che fino ad allora venivano isolate con il sughero. Nel 1893 inizia in Austria la produzione del cemento-amianto (Eternit ®), e nel 1912 un ingegnere italiano costruisce per primo una macchina per la produzione di tubi in questo materiale. L’amianto era largamente impiegato in tutto il mondo anche per oggetti di uso domestico come stufe, asciugacapelli, ferri da stiro, guanti da forno, macchine per il caffè, freni per autovetture, frizioni, guarnizioni, vernici antirombo. Si arrivò addirittura a produrre con questo minerale anche i filtri delle sigarette che furono pubblicizzate proprio per questa innovazione. E’ stato calcolato che un fumatore che abbia consumato un pacchetto al giorno di tali sigarette, avrebbe inalato in un anno più di 130 milioni di fibre di crocidolite (Longo et al., 1995). La tendenza alla crescita si è interrotta decisamente soltanto a partire dalla seconda metà degli anni '70, quando ne è stata riconosciuta la pericolosità. La produzione e l'uso di manufatti in Eternit per l'edilizia è cessata solamente pochi anni fa quando ne è stato vietato l’utilizzo (per l’Italia Legge n. 257 del 27 marzo 1992) (Carnevale e Chellini, 1992).
Gli effetti biologici delle fibre di amianto
Tutti i minerali da cui si estrae l’asbesto (crocidolite o amianto blu, amosite o amianto bruno, crisotile o amianto bianco) possono favorire l’insorgenza di mesotelioma. Ogni tipo di minerale ha una diversa durabilità, ove per durabilità si intende la capacità di permanere nei tessuti senza subire alterazioni. La durabilità è massima per gli amianti anfibolici (crocidolite e amosite) che persistono indefinitamente nei tessuti, mentre è minima per l’ amianto bianco le cui fibre, nel corso degli anni, vengono alterate dai liquidi organici con meccanismo chimico di lisciviazione. Gli amianti anfibolici, in quanto più persistenti sono quelli dotati di maggiore cancerogenicità . Tra questi minerali esiste anche una diversa pericolosità poiché possiedono una diversa struttura microscopica. Le fibre di amianto si presentano come aghi dello spessore di 1 m e della lunghezza variabile da 3 a 300 m. Essi possono passare dagli alveoli polmonari o dai bronchioli nell’interstizio interalveolare e in quello pleurico per migrazione passiva, favorita dalla loro forma a spiga. Allo stato attuale delle conoscenze si ritiene che l’amianto possa indurre mesotelioma pleurico attraverso i seguenti possibili meccanismi di azione. Il primo prevede che la pleura vada incontro a degenerazione maligna in seguito ad un persistente stato infiammatorio (Manning et al., 2002).
Tale stato può essere attivato da citochine e fattori di crescita rilasciati dalle cellule polmonari infiammate per l’esposizione alle fibre (Driscoll et al., 1995), oppure essere dovuto alla persistenza delle fibre stesse nella pleura (Muhle e Mangelsdorf, 2003).
Un secondo meccanismo è quello ipotizzato da Upadhyay e Kamp (2003), i quali hanno trovato che le fibre di amianto possono generare infiammazione dei tessuti e favorire lo sviluppo, internamente ad essi, di specie reattive dell’ossigeno. Infatti, all’interno delle fibre di asbesto o superficialmente ad
esse possono essere presenti, quali contaminanti, atomi di ferro in quantità tali da effettuare la catalisi come avviene nella reazione di Heber-Weiss: Fe(II) + H2O2 OH− + •OH + Fe(III) (1)
O2− + H2O2 Iron HO− + •OH + O2 (2)
O2 + Fe(II) O2− + Fe(III) (3)
Alte concentrazioni di asbesto possono generare radicali liberi in sistemi “cell-free” e in cellule coinvolte negli stati infiammatori (Goodglick e Kane, 1990; Nyberg e Klockars, 1990; Hedenborg e Klockars, 1987) e rotture a singolo filamento del DNA di cellule mesoteliali (Ollikainen et al., 1999). Le fibre anfiboliche (contenute in crocidolite e amosite) hanno un alto contenuto di ferro (27%-33%), mentre l’amianto bianco (crisotile) ne ha un basso contenuto interno (6%), ma viene facilmente contaminato superficialmente. I radicali liberi, a livello cellulare possono danneggiare il DNA colpendo le basi azotate oppure il ribosio, e portare così la cellula ad eventi mutageni come rotture della singola, ma anche doppia elica, e a legami errati sia inter- che intra- elica. La riparazione di queste lesioni in molti casi riporta il DNA alla sua struttura fisiologica, ma in alcuni casi, una riparazione del DNA errata può portare a fissare una mutazione genica o aberrazione a livello cromosomico. Così, eventi come delezioni e riarrangiamenti cromosomici (traslocazioni, inserzioni ed amplificazioni) portano a cambiamenti genomici permanenti.
Tra i vari meccanismi d’azione ipotizzati dell’asbesto è anche stato dimostrato, in colture tissutali, che l’asbesto può fisicamente interagire con il fuso mitotico ed indurre aneuploidia o altri danni cromosomici (Ault et al., 1995).
Inoltre, fibre di asbesto possono indurre fosforilazione del recettore del fattore di crescita epidermico, trasducendo così il segnale che porta ad un’aumentata espressione di JUN e FOS, due protoncogeni che codificano
per fattori di trascrizione attivanti geni critici per l’inizio della sintesi del DNA (Mossman et al., 1996). Una persistente attivazione di questi induttori da parte dell’asbesto, potrebbe aumentare la proliferazione cellulare e potrebbe rendere le cellule colpite più suscettibili alle mutazioni successive.
Infine si ipotizza anche che l’asbesto abbia un ruolo nell’alterare la risposta immunitaria favorendo la comparsa di neoplasie (Upadhyay e Kamp, 2003).
L’amianto nell’ambiente
Dal momento in cui si è scoperta la nocività di questo materiale è stato proibito il suo impiego ed è iniziata un’ opera di smaltimento, ma tutt’oggi un’alta percentuale di polveri sono presenti nell’atmosfera. Per esempio, nel momento in cui viene chiusa una miniera o una fabbrica che lavora l’amianto, in quella zona si può rilevare un livello di fibre nell’aria pari a 103 ogni metro cubo o addirittura più alti, e un metro cubo di aria è quanto un uomo in media respira in un’ora.
Un livello tale di polveri si può riscontrare anche vicino ad abitazioni in cui per la loro costruzione sono stati impiegati oggetti costruiti con l’asbesto e questi oggetti sono esposti alle intemperie, che ne provocano erosione e dispersione nell’aria. In zone apparentemente non inquinate dalle polveri, come l’aria di una zona rurale, sono presenti 10 fibre in un metro cubo di aria. Nell’aria che si respira all’interno degli edifici invece la concentrazione di asbesto è variabile in funzione del fatto che l’amianto sia stato utilizzato per la coibentazione e l’isolamento termo–acustico, e dalle condizioni in cui si trovano questi materiali. Le concentrazioni misurate in case, scuole ed altre costruzioni che contengono asbesto si trovano in un range che va da 30 a 6000 fibre ogni metro cubo. Chiunque può essere stato esposto all’asbesto quindi, sia direttamente, sia indirettamente. Per esempio è molto facile che un individuo possa aver bevuto acqua inquinata poiché le fibre che sono
presenti nel minerale vengono erose dalla pioggia ma non si dissolvono nell’acqua. Per di più, per la conservazione dell’acqua sono stati utilizzati fino a pochi anni fa contenitori costruiti con cemento–amianto, mentre per la filtrazione dell’acqua erano utilizzati filtri che contenevano asbesto. In questi casi sono state misurate concentrazioni di circa poco meno di 105 di fibre in
ogni litro. In alcuni luoghi inquinati sono stati trovati valori dell’ordine di 106–
307 di fibre per litro. Poiché in media un uomo beve due litri di acqua al giorno, ci si rende conto dell’entità che riveste questo tipo di esposizione (ATSDR, Agency for toxic substances and desease registry).
Asbesto e xenobiotici
Per i tumori sporadici maligni si ammette oggi che la comparsa della malattia costituisca il risultato dell’interazione di più fattori esogeni ed endogeni. La malattia si manifesterebbe quando i sistemi di difesa cellulari e/o dell’intero organismo sono stati superati, pertanto il grado di suscettibilità individuale verso un determinato tipo di tumore rientrerebbe in un complesso quadro eziologico multi fattoriale. Secondo questo modello, si potrebbe assumere che, nell’eziologia del mesotelioma maligno, le caratteristiche genetiche peculiari dell’individuo siano tali da rendere certi soggetti assai più sensibili di altri all’azione cancerogena dell’amianto sulla pleura (Parkes, 1973), in analogia ad altri tipi di interazione tra background genetico ed esposizione ambientale, come ad esempio il cancro alla vescica e l’esposizione alle ammine aromatiche (Hung et al., 2004) o il cancro al polmone e l’inalazione di fumo di sigaretta (Sorensen et al., 2004).
Le sostanze esogene, anche dette “xenobiotici”, a cui siamo più o meno comunemente esposti (ad esempio i contaminanti ambientali, i costituenti naturali della dieta, gli additivi alimentari, ecc. ecc.), sono affrontate
dall’organismo utilizzando batterie di enzimi che provvedono alla loro biotrasformazione e a renderli più facilmente eliminabili (idrosolubili).
Il metabolismo degli xenobiotici si suddivide schematicamente in due fasi principali , entrambe catalizzate da diverse classi di enzimi riportate in:
Fase I o di funzionalizzazione: consiste in reazioni che introducono nella molecola esogena un centro funzionale o reattivo, spesso elettrofilo, quali i gruppi –OH (nel caso di una ossidazione), -COOH (nel caso di una carbossilazione) o –NH2 (nel caso di una amminazione);
Fase II o di coniugazione: consiste nell’introduzione di un gruppo idrofilico (glutatione, acetile, metile, sulfidrile, glucuronide) o direttamente sullo xenobiotico o sul metabolita attivato nelle reazioni di fase I, rendendolo idrosolubile e quindi eliminabile per via renale o biliare (Smith et al., 1995).
Metabolita
DANNO
attivato
AL
DNA
Funzionalizzazione Coniugazione(Fase I) (Fase II)
Sostanza
esogena
Coniugazione Prodotto (Fase II) idrosolubile
Di solito il metabolismo di queste sostanze ha un'azione detossificante in quanto, attraverso queste vie enzimatiche, viene favorita l’eliminazione delle sostanze esogene. Talvolta però, l’introduzione di un gruppo funzionale rende gli intermedi metabolici altamente reattivi e capaci di attaccare macromolecole nucleofile come le proteine o il DNA, formando addotti specifici pericolosi per la cellula. Il legame con il DNA, in seguito, può innescare processi che portano a modificazioni permanenti del corredo genetico, come mutazioni geniche o cromosomiche, processi che sono direttamente coinvolti nell’insorgenza dei tumori (Devlin, 1997).
Le principali famiglie di enzimi che prendono parte al metabolismo degli xenobiotici sono:
Fase I : funzionalizzazione Fase II : coniugazione
Monossigenasi citocromo P450 Glutatione S-transferasi
Flavoproteine monossigenasi N-acetiltransferasi
Monoammine ossidasi N-aciltransferasi
Alcool deidrogenasi UDP-Glucoronil transferasi
Aldeide deidrogenasi Sulfotransferasi
Arilesterasi Metiltransferasi
Colinesterasi Epossido idrolasi
Epossido idrolisi Nitroriduttasi
I geni coinvolti nel metabolismo degli xenobiotici sono polimorfici, ossia sono presenti nella popolazione con diversi alleli (ciascuno con una frequenza almeno dell’1%), ai quali corrispondono attività enzimatiche diverse.
E’ stato anche considerato il possibile legame tra la variabilità genetica di questi enzimi e la suscettibilità individuale agli effetti tossici e cancerogeni degli xenobiotici, in quanto diverse combinazioni delle varianti alleliche
possono essere connesse a diverse capacità metaboliche e possono comportare, pertanto, importanti differenze interindividuali nel rischio di sviluppare alcune forme di cancro correlabili all’esposizione alle sostanze esogene (Labuda et al.,1999). Individui con un’alta attività per gli enzimi di fase I e bassa attività per quelli di fase II presumibilmente producono una quantità maggiore di intermedi reattivi e quindi sarebbero più soggetti a subire danni al DNA, mentre individui con una minor attività catalitica degli enzimi di fase I e una più alta attività per quelli di fase II avrebbero una minore probabilità di incorrere in danni al DNA (Rojas et al., 2000).
Dato che le fibre di asbesto possono alterare e favorire l’insorgere di reazioni di ossidazione e la produzione di radicali liberi, alcuni degli enzimi di fase I e fase II potrebbero modulare tali meccanismi e conferire maggiore o minore suscettibilità all’azione di tali fibre nella pleura.
Esposizione all’asbesto e suscettibilità individuale al
mesotelioma
A partire dagli anni ’70, oltre ai casi di mesotelioma comparsi in lavoratori esposti per tempi prolungati ad alte concentrazioni di fibre, sono stati riscontrati molti casi in lavoratori esposti all’amianto per periodi molto brevi della loro storia professionale (da poche settimane a pochi mesi). Sono riportati in letteratura i casi di un barbiere che serviva una clientela di operai dell’ industria produttrice di cemento-amianto, il soggetto che ha prestato servizio militare in Marina, la figlia di un addetto agli scambi ferroviari, e l’attore Steve Mc Queen che aveva lavorato in gioventù per soli due mesi nel cantiere navale della nave Liberty.
Inoltre, si sono osservati anche casi in soggetti esposti esclusivamente nell’ambiente domestico, come ad esempio familiari di lavoratori che portavano a casa i camici impolverati dalle fibre di amianto. Tra le numerose casistiche, si può citare quella raccolta in Italia, nella zone dei cantieri navali
di Monfalcone: su 92 casi 8 sono comparsi in quattro famiglie ed hanno colpito due volte padre e figlio, una volta suocera e genero, una volta marito e moglie. Tra questi due ultimi casi c’era una differenza di carico polmonare d’amianto pari a 1000 volte (marito operaio nei cantieri, moglie casalinga). Anche nelle due coppie di padre e figlio esisteva una notevole differenza nell’esposizione: il padre era stato esposto per vari decenni, mentre il figlio per circa un mese. Questi dati, oltre a documentare l’esistenza di una suscettibilità genetica nei confronti del tumore, confermano ulteriormente la scarsa importanza della dose innescante la malattia (Bianchi et al., 2004) . Si sono riscontrati inoltre anche casi dove l’esposizione era prevalentemente ambientale: abitanti in aree geografiche circostanti ad industrie utilizzatrici di amianto (in Italia i casi più famosi sono quelli di Casale Monferrato, Monfalcone, Trieste) o in cui l’amianto è presente nella struttura geologica del terreno (Corsica, Turchia, Grecia, Sud Africa).
Il fatto che alcuni dei pazienti siano stati esposti a dosi molto basse di amianto, suggerirebbe l’esistenza di individui con una incrementata suscettibilità. Questa idea sarebbe ulteriormente rafforzata dall’osservazione che nelle coorti di lavoratori esposti ad elevati livelli di polverosità dell’asbesto compaiono con frequenza elevata malattie quali l’asbestosi e il cancro polmonare, mentre il mesotelioma maligno, pur comparendo più frequentemente rispetto alla popolazione non esposta, si presenta in una bassa percentuale degli esposti. Nonostante più dell’ 80% dei casi di mesotelioma pleurico siano attribuibili all’esposizione all’asbesto, solo una frazione di tutta la popolazione esposta sviluppa questo tumore (Powers e Carbone, 2003).
L’idea che esistano soggetti ad incrementata suscettibilità (probabilmente determinata dal genotipo individuale) scaturirebbe anche da alcuni studi effettuati in tre villaggi della Cappadocia (Turchia). Karain, Tuzkoy e Karlik sono stati costruiti con gli stessi materiali tra cui la erionite, minerale che contiene asbesto nella sua composizione. Tuttavia si è scoperto che anche
se le popolazioni sono soggette allo stesso grado di esposizione a questo materiale, l’incidenza di affetti da mesotelioma pleurico maligno varia tra i tre villaggi. A Karain e Tuzkoy infatti, il mesotelioma causa il 50% dei decessi e si può notare che alcune famiglie sono più colpite di altre. A Karlik solo una donna è risultata affetta, e questa è immigrata da Karain per scopi matrimoniali. Si suppone che in queste famiglie lo schema di ereditarietà sia di tipo autosomico dominante. Il ruolo genetico è anche sottolineato dal fatto che essendo questi paesi piuttosto isolati, sono frequenti le unioni tra consanguinei, che aumentano il rischio di essere individualmente suscettibili. Inoltre è stato notato che l’incidenza di questo tumore dei cittadini di Karain e Tuzkoy, immigrati in Germania o Svezia, è uguale o maggiore di quella nei residenti in Turchia. Tra questi, vi sono anche individui che sono partiti dal paese natale in età infantile o adolescenziale: anche questo dato conferma che lo sviluppo della malattia non è correlata alla durata dell’esposizione all’erionite, ma che il mesotelioma è un tumore in cui fattori ambientali (asbesto) e genetici possono agire indipendentemente o insieme nel causare la patologia (Heineman et al.,1996; Ascoli et al., 1998; Roushdy-Hammady et al., 2001; Musti et al., 2002).
Altre prove che sembrerebbero suggerire un ruolo della suscettibilità genetica individuale deriverebbero da studi in vitro sulle lesioni citogenetiche ritrovate in linfociti di sangue periferico. E’ stato evidenziato un significativo aumento nella frequenza di micronuclei nei casi di mesotelioma rispetto a quelli che presentano cancro al polmone, problemi respiratori e controlli sani, mentre non è stata trovata un’associazione tra micronuclei e soggetti esposti all’asbesto (Bolognesi et al., 2002).
Precedenti studi di associazione caso-controllo su specifici
geni candidati
Pochi sono gli studi che mirano ad identificare gli alleli di suscettibilità per il mesotelioma. Questo in gran parte è dovuto al fatto che la raccolta dei “casi” è difficoltosa per la rarità della malattia. Alcuni geni metabolici sono stati considerati come fattori di rischio per il mesotelioma. Studi iniziali hanno indicato che patologie non maligne associate all’esposizione all’asbesto si sviluppavano più frequentemente in soggetti occupazionalmente esposti e che portavano delezione omozigote (genotipo nullo) del gene GSTM1
(Smith et al., 1994). Inoltre individui che oltre al genotipo nullo per il gene
GSTM1 recavano anche quello di lenti acetilatori del gene NAT2 avevano un rischio doppio di sviluppare queste patologie (Hirvonen et al., 1995) . E’ stato inoltre dimostrato che in individui che hanno contemporaneamente problemi in GSTM1 e NAT2 possiedono un rischio di sviluppare mesotelioma pleurico quattro volte superiore di quelli che hanno un genotipo con GSTM1 presente e NAT2 rapido acetilatore. Soprattutto, il rischio di soggetti altamente esposti e che presentano il genotipo più sfavorevole è sette volte maggiore di quelli con il genotipo migliore per i geni GSTM1 e NAT2 (Hirvonen et al.,1995). Un’altro studio più recente invece non è servito a mostrare associazione tra mesotelioma pleurico maligno e individui che presentano genotipo con il gene MnSOD nullo, gene coinvolto nella detossificazione di xenobiotici derivati anche dal metabolismo dell’ossigeno (Hirvonen et al., 2002).
Geni candidati per la suscettibilità al mesotelioma
Sulla base dei meccanismi molecolari discussi in precedenza esistono svariate categorie di geni polimorfici che potrebbero modulare il rischio di contrarre la malattia in seguito ad esposizione ad asbesto. Tra di essi possiamo annoverare i geni che regolano la risposta cellulare al danno al DNA, quelli che sono deputati al metabolismo degli xenobiotici e anche quelli che controllano la divisione e la crescita cellulare.
Le varianti alleliche di questi geni infatti possono variare la capacità individuale di produrre intermedi reattivi dell’ossigeno, oppure modulare la capacità di riparare le lesioni al DNA. Un aumento della produzione di intermedi reattivi, o una debole riduzione della capacità di rimuovere le lesioni al DNA può portare ad un incremento di lesioni che vengono fissate come mutazioni nel corso della divisione cellulare. Questo si tradurrebbe in un aumento del rischio di cancro.
I geni presi in esame nel nostro studio sono quelli implicati nel metabolismo degli xenobiotici di fase I, quelli di fase II, geni coinvolti nella riparazione del DNA, geni controllori del ciclo cellulare, geni che codificano per modulatori della crescita cellulare, geni coinvolti nel processo infiammatorio.
In particolare sono stati scelti i seguenti 30 geni :
ADH2, ALDH2, COMT, CYP1A1, CYP1A2, CYP1B1, CYP2A6, CYP2C19, CYP2C9, CYP2D6, CYP2E1, CYP3A4, DRD2, DRD4, EPHX1, GRPR, GSTA4, GSTM1, GSTP1, GSTT1, MDM2, MGMT, MTHFR, NAT1, NAT2, OGG1, SOD2, SULT1A1, TPMT, UGT1A7.
Analisi di polimorfismi genetici tramite nuove metodiche
. Gli SNPs (Single Nucleotide Polymorphisms) sono molto diffusi in tutto il genoma umano: si stima che, in media, esista una variazione nucleotidica ogni mille paia di basi. L’analisi degli SNPs ha cominciato a dare un contributo importante nella ricerca di geni coinvolti nelle malattie multifattoriali attraverso studi di associazione e nel futuro avrà un forte impulso quando sarà possibile il mappaggio mediante “wide genome linkage disequilibrium scan” (Shafer and Hawkins, 1998).Oltre a permettere lo studio della suscettibilità alle malattie complesse, lo studio degli SNPs è e sarà sempre più di notevole importanza per la progettazione di farmaci sempre più efficaci nei confronti di chi possiede un certo genotipo piuttosto che un altro (Nebert,1997).
I classici metodi di studio per l’analisi degli SNPs sono basati sull’amplificazione di DNA bersaglio mediante PCR (Polimerase Chain Reaction) e ibridazione con sonde fatte da oligonucleotidi allele specifici (ASO), oppure utilizzando enzimi che tagliano gli acidi nucleici in siti specifici, come gli enzimi di restrizione (da qui i “restriction lenght fragment polymorphisms”, RFLP). Tuttavia, recentemente sono apparse nuove metodiche di genotipizzazione degli SNPs. Alcune si basano su sistemi di ibridazione specifici (tipo il “TaqMan®”), altri invece utilizzano substrati solidi,
come le metodiche basate sui “micro-arrays”. Tra queste, una delle più promettenti è la cosiddetta “APEX” (Arrayed Primer EXtension).
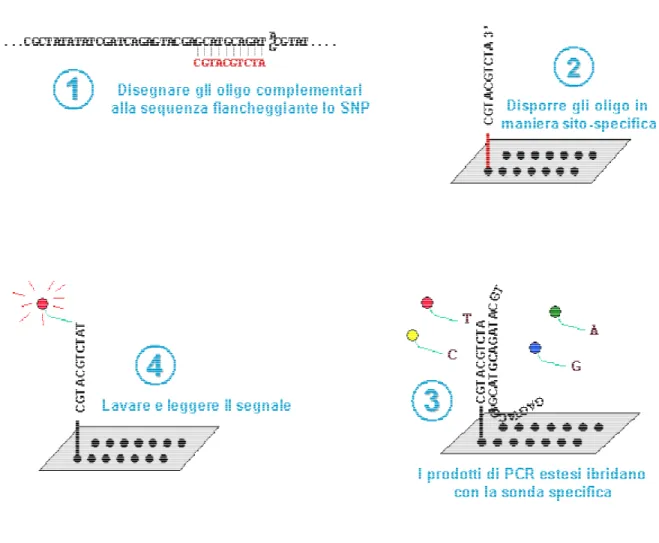
Gli oligonucleotidi necessari per la reazione APEX sono fatti ancorare covalentemente su un normale vetrino da microscopio (attivato tramite trattamento con silano), utilizzando un gruppo amminico posto al termine di una coda di 12 carboni legata al 5’ dell’oligonucleotide stesso. L’oligonucleotide si lega covalentemnete al vetro dal 5’ ed ha invece il terminale 3’ libero di reagire. L’oligonucleotide è disegnato in maniera da terminare una base precedente al polimorfismo sotto investigazione. Si possono stampare molti oligonucleotidi diversi sullo stesso supporto per permettere l’analisi parallela di più polimorfismi. La stampa dei vetrini è fatta in maniera opportuna affinchè la distanza tra spot e spot sia di circa 100 µm e ogni spot rechi una quantità molto piccola di oligonucleotide (si calcola un minimo di 1 milione di molecole per spot).
I frammenti di DNA amplificati tramite PCR vengono mescolati e posti sul vetrino, insieme alla miscela di reazione contenente DNA polimerasi e i 4 di-deossi nucleotidi trifosfati (terminatori) marcati con 4 differenti fluorocromi. Ogni frammento ibriderà specificamente con l’oligonucleotide specifico per la sequenza e la DNA polimerasi estenderà la base complementare, che è quella polimorfica. Il terminatore incorporato reca un fluorocromo specifico, per cui la lettura della fluorescenza emessa da ogni spot indicherà quali basi sono state incorporate e quindi il genotipo dell’individuo (Syvänen et al.,
1990; Sokolov, 1990; Kuppuswamy et al. 1991). In figura 2 è riportato uno schema del principio su cui si basa la APEX. Il maggiore vantaggio di questa tecnica è dato dalla sua specificità, in quanto aggiunge alla specificità dell’ibridazione anche quella dell’accuratezza con la quale la DNA polimerasi incorpora il nucleotide variante, che ha una probabilità di un errore ogni 104-105 reazioni (Eckert and Kunkel, 1990). Questa tecnica permette una
precisa discriminazione tra genotipi omozigoti ed eterozigoti; inoltre non è troppo sensibile a piccole variazioni delle condizioni di reazione. Questa tecnica attualmente rende possibile l’analisi parallela di centinaia di polimorfismi a costi relativamente contenuti. In futuro lo sviluppo di nuove tecnologie permetterà di avere, a costi ancora più contenuti, l’analisi di un grandissimo numero di polimorfismi, proiettandoci dentro la “whole genome genotyping”. Nel nostro caso, la APEX è stata utilizzata al fine di stabilire il genotipo dei pazienti e dei relativi controlli al fine di effettuare uno studio di associazione di tipo caso-controllo analizzando 77 SNPs in 30 geni candidati ritenuti di rilevanza per la patologia investigata.
Figura 2: Rappresentazione schematica della tecnica “Apex”. (A) L’estremità 5’ dell’oligonucleotide C12 amminolinker è ancorata al vetrino. (B) I prodotti di PCR frammentati si ibridano. (C) La reazione di estensione inserisce un ddNTP complementare al DNA del soggetto, marcato con un fluorocromo. (D) Il ddNTP incorporato (che corrisponde allo SNP del soggetto) viene legato covalentemente e non viene lavato via. A questo punto il vetrino è pronto per la scansione.