33
Capitolo 2
PROBLEMATICHE CONNESSE ALL’USO DEI
FARMACI ANTIELMINTICI DI SINTESI
2.1 ANTIELMINTICO RESISTENZA
La scoperta delle molecole antielmintiche ad ampio spettro ha fornito un ottimo mezzo di controllo per le parassitosi gastro-intestinali degli
animali domestici dagli anni sessanta ad oggi; l’uso eccessivo e spesso scorretto che ne è stato fatto, soprattutto per quanto riguarda gli
allevamenti ovi-caprini, ha però permesso lo sviluppo di una marcata resistenza da parte di questi nematodi verso tali farmaci (Taylor et al., 2002; Waller, 1997; Van Wyk, 2001).
Un farmaco viene considerato efficace quando, a seguito della sua
somministrazione, si ottiene una riduzione di almeno il 99% dei parassiti all’interno dell’ospite; percentuali di riduzione della carica parassitaria inferiori al 95% indicano una accertata farmaco-resistenza nei confronti della molecola somministrata; mentre valori percentuali di riduzione del numero dei parassiti compresi fra il 95% ed il 99% indicano un sospetto di farmaco-resistenza da parte dei parassiti nei confronti di quel farmaco (Coles et al., 2006).
L’antielmintico-resistenza può essere responsabile del totale fallimento dei trattamenti contro le elmintiasi parassitarie e rappresenta un grande
34
problema per gli allevamenti dei piccoli ruminanti, soprattutto in quelle regioni dove l’ovinicoltura rappresenta una grande risorsa economica come il Sud Africa (Van Wyk et al., 1999), l’Australia (Love e Coles, 2002) e la Nuova Zelanda (Hughes et al., 2007; Sutherland, 2008).
Ad oggi sono stati documentati vari episodi di antielmintico resistenza negli allevamenti di bovini, equini ed ovi-caprini in tutto il mondo, ma è proprio in questi ultimi che il problema assume un carattere più drammatico.
Nel 1954 negli Stati Uniti d’America per la prima volta viene documentata farmaco resistenza da parte degli strongili gastrointestinali degli ovini nei confronti della fenotiazina (il farmaco di elezione a quell’epoca) ( Prichard et al.,1980; Genchi, 2006). Una decina di anni dopo, sempre negli USA, viene riscontrata resistenza anche nei confronti dei benzimidazoli (Conway, 1964; Genchi, 2006). Attualmente tutte le categorie di farmaci antielmintici ad ampio spettro utilizzati per il controllo della strongilosi gastrointestinale, benzimidazoli, probenzimidazoli, lattoni macrociclici ed iminopirimidine, sono soggetti a fenomeni di resistenza da parte di questi nematodi in tutto il mondo.
35
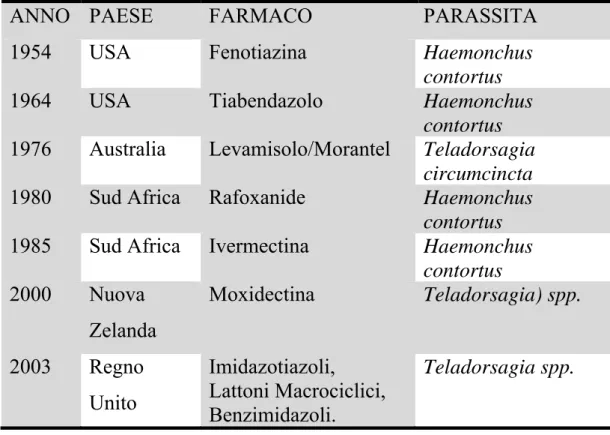
Tabella 2.1: Prime segnalazioni di antielmintico-resistenza in nematodi
parassiti degli ovini (da Genchi, 2006):
ANNO PAESE FARMACO PARASSITA 1954 USA Fenotiazina Haemonchus
contortus
1964 USA Tiabendazolo Haemonchus contortus
1976 Australia Levamisolo/Morantel Teladorsagia circumcincta
1980 Sud Africa Rafoxanide Haemonchus contortus
1985 Sud Africa Ivermectina Haemonchus contortus 2000 Nuova Zelanda Moxidectina Teladorsagia) spp. 2003 Regno Unito Imidazotiazoli, Lattoni Macrociclici, Benzimidazoli. Teladorsagia spp.
36
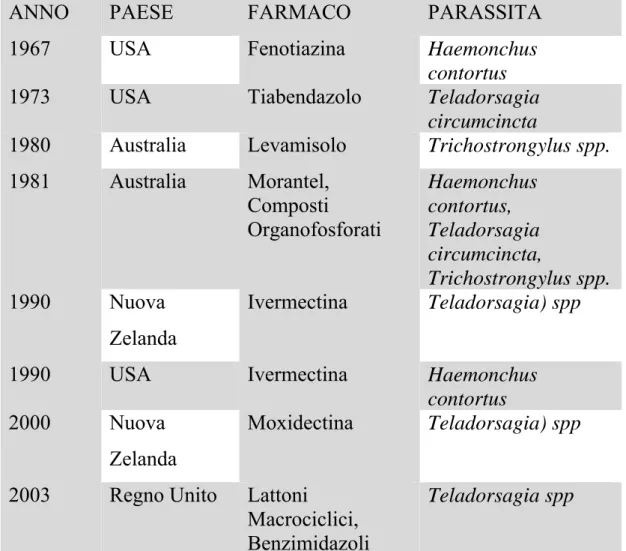
Tabella 2.2: Prime segnalazioni di antielmintico-resistenza in nematodi
parassiti dei caprini (da Genchi, 2006):
ANNO PAESE FARMACO PARASSITA 1967 USA Fenotiazina Haemonchus
contortus
1973 USA Tiabendazolo Teladorsagia circumcincta
1980 Australia Levamisolo Trichostrongylus spp.
1981 Australia Morantel, Composti Organofosforati Haemonchus contortus, Teladorsagia circumcincta, Trichostrongylus spp. 1990 Nuova Zelanda Ivermectina Teladorsagia) spp
1990 USA Ivermectina Haemonchus contortus
2000 Nuova Zelanda
Moxidectina Teladorsagia) spp
2003 Regno Unito Lattoni
Macrociclici, Benzimidazoli
Teladorsagia spp
In alcuni casi questi parassiti sono risultati essere resistenti anche alle associazioni di diversi farmaci antielmintici di sintesi di classe diversa, vanificando anche l’uso di tale strategia di controllo.
Nell’emisfero meridionale le tre specie di strongili gastro-intestinali più importanti (Haemonchus contortus, Teladorsagia circumcincta e
37
resistenti a molecole appartenenti alle più importanti classi di antielmintici (Kaplan, 2004).
Anche in Europa, sebbene con carattere meno drammatico, è ampiamente dimostrata la presenza di antielmintico-resistenza nei confronti delle comuni molecole ad ampio spettro da parte degli strongili gastro-intestinali degli ovi-caprini allevati.
La prima segnalazione europea di tale fenomeno si deve a Jackson e coll. nel 1992, i quali documentarono un caso di resistenza in un ceppo di
Teladorsagia circumcincta nei confronti dei benzimidazolici e
dell’ivermectina.
Ad oggi sono numerosissime le segnalazioni di casi di antelmintico resistenza, anche multipla, da parte degli strongili gastro-intestinali negli allevamenti ovi-caprini di gran parte degli stati europei: Regno Unito (Bartley et al., 2003; Mitchell et al., 2006), Olanda (Borgsteede et al., 2007), Belgio (Vercruysse et al., 1989), Germania (Bauer, 2001), Spagna (Alvarez-Sanchez et al., 2006), Grecia (Papadopolous et al., 2001), Svizzera (Artho et al., 2007).
Per quanto riguarda l’Italia, sebbene le infestazioni da strongili gastro-intestinali dei piccoli ruminanti domestici siano presenti in tutto il paese con valori di prevalenza elevati (fino al 91-94%), le informazioni riguardanti l’antielmintico-resistenza da parte di questi parassiti sono ancora scarse e frammentarie (Traversa et al., 2007)
Nonostante un primo studio abbia escluso la presenza di farmaco resistenza nel nostro paese (Genchi et al., 1993), ad oggi è stata dimostrata resistenza da parte di Trichostrongylus spp ai benzimidazolici in un allevamento di capre (Cringoli et al., 2007) e resistenza multipla in
38
popolazioni di Teladorsagia circumcincta e Trichostrongylus spp. in allevamenti di pecore (Traversa et al., 2007).
La resistenza ai farmaci antielmintici è la conseguenza della selezione di ceppi di elminti in grado di tollerare una dose di un farmaco di norma letale nei confronti della maggior parte degli individui della stessa specie ( > 95% ).
Nell’ambito di ogni popolazione naturale esistono individui o una frazione di individui tolleranti, la cui suscettibilità all’azione tossica del farmaco è nulla o inferiore alla norma anche prima che la popolazione venga a contatto con il farmaco (Loveridge et al., 2003).
L’aumento della frequenza di individui tolleranti è alla base della farmaco-resistenza; infatti i farmaci agiscono sugli individui suscettibili consentendo la sopravvivenza ai resistenti che riproducendosi trasmettono alla progenie i geni della resistenza che è un fattore ereditabile (Prichard et al.,1980; Genchi, 2006).
Il fenomeno, su base genetica, è conseguente alla pressione esercitata dal farmaco e l’enorme potenzialità riproduttiva dei parassiti ha consentito la rapida accelerazione del processo di antielmintico-resistenza (Genchi, 2006).
Vi sono vari fattori che influenzano la pressione selettiva da parte degli elminti parassiti per la resistenza ai farmaci: alcuni sono associati alla genetica dei parassiti, altri alla biologia dei parassiti ed altri ancora alla relazione fra ospite e parassita. Riguardo alla genetica risultano importanti il numero di geni interessati dal fenomeno, il carattere dominante o recessivo degli alleli coinvolti e l’elevata variabilità genetica che si riscontra nelle popolazioni dei nematodi parassiti. Per
39
quanto concerne la biologia degli elminti bisogna ricordare la grande capacità riproduttiva associata ad un ciclo vitale breve, che permette di avere molti individui di varie generazioni in breve tempo, aumentando la diffusione di alleli per la resistenza nella popolazione, il ciclo vitale diretto, che permette che non venga persa la resistenza nel passaggio in un ospite intermedio, la possibilità della popolazione di colonizzare nuove aree seguendo lo spostamento degli ospiti. I fattori di spinta alla pressione selettiva riferibili alla relazione fra ospite e parassita sono la somministrazione ripetuta di farmaci antielmintici in modo scorretto e la possibilità dei parassiti di arrestare lo sviluppo larvale all’interno dell’ospite grazie alla strategia dell’ipobiosi (Wolstenholme et al., 2004). Attualmente la conoscenza riguardo ai meccanismi molecolari dell’antielmintico resistenza è limitata a quelli che si instaurano in corso di resistenza ai benzimidazoli, in cui si riscontra una mutazione del gene della β-tubulina che in tal modo non permette il legame del farmaco al sito d’azione e così non si ha l’inibizione della polimerizzazione della tubulina per la formazione dei microtubuli (Taylor et al., 2002; Wolstenholme et al., 2004).
I meccanismi molecolari che regolano la resistenza nei confronti degli altri farmaci antielmintici risultano ancora sconosciuti. Per quanto riguarda il levamisolo, si pensa che la resistenza sia associata alla riduzione del numero dei recettori nicotinici dell’acetilcolina dei nematodi o in una modificazione delle loro caratteristiche di legame (Sangster et al., 1988). La resistenza nei confronti delle avermectine e milbemicine sembra essere associata al cambio di frequenza di due alleli del gene per la sub-unità α del recettore del glutammato del canale del
40
cloro della membrana delle cellule neuromuscolari (Blackhall et al., 1998); ciò impedisce il legame del farmaco ed evita così l’induzione dell’iperpolarizzazione della membrana responsabile della paralisi (Taylor, 1999; Taylor et al., 2002).
Generalmente si sospetta antielmintico-resistenza quando si nota una minore risposta clinica al trattamento antielmintico (Kelly and Hall, 1979 a,b; Taylor et al., 2002).
Ci sono numerosi fattori da considerare per essere certi che si tratti effettivamente di antielmintico-resistenza: in primo luogo bisogna ricordare che varie condizioni possono determinare segni clinici simili a quelli normalmente associati a queste malattie parassitarie; secondariamente, oltre alla resistenza, ci sono molte altre ragioni per cui gli antielmintici possono mostrare un’ insufficiente efficacia nel controllo dei nematodi (Prichard e Hennessy, 1979; Prichard, 1980; Charleston, 1981; Taylor et al., 2002).
Il fallimento in questi casi può essere attribuito a vari fattori fra cui una inadeguata attrezzatura per la somministrazione del farmaco, un dosaggio inferiore dovuto ad una valutazione inesatta del peso corporeo, oppure una mancata ingestione del farmaco da parte dell’animale (Taylor et al., 2002; Cabaret, 2004).
Attualmente vengono utilizzati vari metodi attendibili e standardizzati per scoprire e monitorare l’antielmintico-resistenza.
Il metodo maggiormente utilizzato è il cosiddetto test di riduzione del conteggio delle uova nelle feci o faecal egg count reduction test (FECRT), col quale è possibile valutare la resistenza in vivo basandosi sulla riduzione del numero delle uova presenti nelle feci dopo il
41
trattamento farmacologico (Boersema, 1983; Presidente, 1985; Coles et al., 1992; Taylor et al.,2002).
Per effettuare il test bisogna suddividere gli animali da trattare in due gruppi di cui uno verrà trattato con la molecola da analizzare e l’altro fungerà da controllo non trattato; si effettua un primo conteggio delle uova presenti nelle feci subito prima di trattare gli animali ed un secondo conteggio dopo 14 giorni dal trattamento.
Si calcola il valore della riduzione delle uova sia del gruppo trattato che di quello non trattato e con i valori ottenuti si può calcolare la riduzione percentuale della conta fecale (R) utilizzando la formula: R=[1-(UPGt/UPGc)]x100, dove con UPGt si indica il valore di riduzione del gruppo trattato e con UPGc il valore del gruppo di controllo.
Valori di R inferiori od uguali al 95% con un livello di confidenza più basso del 90% sono considerati indicativi di farmaco-resistenza (Coles et al., 1992; Traversa et al., 2007).
Tuttavia, i risultati della prova non possono valutare esattamente l’efficacia antielmintica perché vengono considerati soltanto gli effetti sulla produzione delle uova (Taylor et al., 2002), evento che dipende da vari fattori oltre la resistenza ai farmaci, primo fra tutti la diversa prolificità dei vari generi.
Quindi sono stati messi a punto anche alcuni test per la valutazione dell’ antielmintico-resistenza in vitro in modo da valutare l’efficacia dei farmaci antielmintici sulla schiusa delle uova, sullo sviluppo e sulla motilità delle larve.
Uno di questi metodi riguarda l’analisi della schiusa delle uova (Egg Hatch Assay o EHA) (Coles et al., 1992; Taylor et al., 2002; Pessoa et
42
al., 2002; Alawa et al., 2003; Assis et al., 2003): si mettono ad incubare le uova non larvate con concentrazioni scalari della molecola da analizzare e si verifica l’inibizione della schiusa da parte della sostanza in esame.
Viene quindi determinata la percentuale di schiusa delle uova ad ogni concentrazione correggendo la mortalità per cause naturali grazie all’utilizzo di controlli non trattati e si traccia una linea dose-risposta per la concentrazione della sostanza.
Si può così calcolare la Dose Letale 50 (LD 50), cioè la concentrazione di farmaco necessaria per inibire la schiusa del 50% delle uova (Taylor et al., 2002).
Un secondo metodo si basa sulla prova di paralisi/mortalità larvale (Larval Motility Test o LMT), in cui le larve di terzo stadio, ottenute da coprocultura, vengono lasciate per 24 ore a contatto con diverse diluizioni della sostanza da testare.
Trascorso questo tempo viene determinata la percentuale di larve paralizzate per ogni concentrazione testata e si può tracciare una linea dose-risposta nei confronti delle larve di ciascun genere identificato (Taylor et al., 2002).
Poiché questo tipo di test mostra spesso dei risultati discordanti, si è a lungo dibattuto sulle possibili cause di questa imprecisione e Boersema (1983) ne ha attribuito la responsabilità ad una reversibilità della paralisi, mentre secondo Geerts e coll. (1989) la discordanza dipenderebbe dall’ età delle larve.
È stato anche impiegato un test che misura la motilità delle larve e dei nematodi adulti, dopo che sono stati incubati con l’antielmintico, con
43
l’utilizzo di un microprocessore in grado di misurare il movimento tramite la deviazione dell’angolo di rifrazione; il microprocessore trasmette poi le informazioni ad un calcolatore che individua l’indice di motilità (Bennett e Pax, 1986, 1987; Taylor et al., 2002).In questo modo si può osservare la risposta della motilità dei parassiti in seguito al trattamento antielmintico (Folz et al., 1988; Taylor et al., 2002).
Inoltre è stato descritto il test di inibizione dello sviluppo delle larve dal primo al terzo stadio utilizzando delle copro culture che inizialmente prevedevano soltanto la presenza di Escherichia coli liofilizzato e trattato termicamente (Coles et al., 1988; Taylor et al., 2002) ma in seguito fu aggiunto a queste copro-colture anche estratto di lievito (Taylor, 1990; Taylor et al.,2002) e poi si è introdotto l’agar (Lacey et al.,1991; Taylor et al.,2002). Infine Hubert e Kerbouef (1992) hanno messo appunto un terreno nutritivo contenente EBSS (Earle’s Balanced salts solution), estratto di lievito e batteri.
Con questa prova si valuta la capacità di un farmaco diluito a varie concentrazioni di inibire lo sviluppo larvale dallo stadio L1 fino allo stadio L3. La percentuale di larve che non sono riuscite a completare lo sviluppo al terzo stadio è utilizzata per valutare l’efficacia della sostanza in esame ed anche in questo caso si può calcolare la LD50, cioè la concentrazione di farmaco efficace sul 50% delle larve.
Infine, è possibile anche effettuare un test basato sulla biologia molecolare per svelare la presenza di antielmintico resistenza nei confronti dei benzimidazoli negli strongili gastrointestinali dei piccoli ruminanti utilizzando la tecnica della PCR (nested-PCR): si amplifica il tratto di DNA delle larve che forma l’isotipo 1 del gene che codifica la
44
β-tubulina utilizzando l’enzima di restrizione Rsa I e quattro primers di cui due allele- non specifici e due allele-specifici (Coles et al., 2006). Con questa tecnica è possibile svelare la mutazione di una fenilalanina in tirosina al residuo 200 dell’isotipo 1 del gene per la β-tubulina, responsabile dell’acquisizione della resistenza verso i benzimidazoli (Kwa et al., 1994, 1995; Elard et al., 1996, 1999).
Il principale fattore a cui è imputabile lo sviluppo di una così elevata resistenza è sicuramente l’uso eccessivo che si è fatto nel corso degli anni scorsi di farmaci antielmintici ad ampio spettro, sia ad uso terapeutico che ad uso profilattico, per contrastare le infestazioni da nematodi spesso senza che ve ne fosse realmente necessità (Waller, 1997; Van Wyk 2001; Lawrence et al., 2006; Genchi, 2006).
Particolare attenzione va posta anche alla dose di farmaco somministrata, poiché una dose bassa favorisce l’instaurarsi di resistenza e questo è un problema molto comune nel trattamento degli ovi-caprini, infatti, spesso si incorre a sottodosaggio per errata valutazione del peso corporeo dell’animale, per inadeguata attrezzatura per la somministrazione ed anche a causa della pratica errata di somministrare uno stesso dosaggio alle capre ed alle pecore, mentre per le prime il dosaggio deve essere molto maggiore (Taylor et al., 2002; Silvestre et al. 2002; Genchi 2006). Svolge un ruolo molto importante anche l’immissione di strongili farmaco-resistenti con l’introduzione di animali parassitati provenienti da aree dove l’antielmintico resistenza è elevata (Lawrence et al., 2006). Infine, bisogna ricordare quanto sia importante mantenere una adeguata popolazione di parassiti in “refugia”, cioè che non entrano in contatto
45
con il farmaco, per avere una minor selezione di individui resistenti (Van Wyk, 2001; Van Wyk et al., 2006; Hughes et al., 2007).
Essendo la farmaco resistenza un problema serio ed in molti paesi anche causa di danni economici gravi per la zootecnia, si cerca da tempo di riuscire a trovare soluzioni a tale problema.
Per questo motivo si sta cercando di trovare nuove strategie che permettano di controllare le infestazioni parassitarie riducendo al minimo l’utilizzo di farmaci chemioterapici: fra queste nuove strategie troviamo l’uso della medicina non convenzionale ( fitoterapia ed omeopatia ),la ricerca di nuovi principi attivi ed un attento management nella somministrazione degli antiparassitari che prevede il loro uso solo in caso di effettiva necessità.
2.2 IMPATTO AMBIENTALE, TOSSICITA’ E RESIDUI DEI FARMACI ANTIELMINTICI.
I comuni farmaci antielmintici attualmente utilizzati per il controllo della strongilosi gastrointestinale difficilmente vengono completamente
metabolizzati a principi inattivi all’interno dell’organismo, di
conseguenza si ha un inquinamento sia ambientale, perché attraverso le secrezioni e le escrezioni degli animali trattati si ha la liberazione
nell’ambiente esterno di molecole ancora attive, sia dei prodotti di origine animali, in cui si possono accumulare metaboliti attivi dei farmaci somministrati (Mc Kellar, 1997).
46
Inoltre, molti di questi farmaci possono essere causa di tossicità diretta negli animali trattati: è riportata una spiccata azione teratogenetica ed embriotossica da parte dei benzimidazoli negli ovini se somministrati nella prima fase della gravidanza (Adams 1999).
L’ accumulo di molecole attive nei prodotti di origine animale può essere causa di episodi di farmaco-resistenza da parte di parassiti patogeni per l’uomo a causa dell’assunzione prolungata di basse dosi di principi attivi da parte di soggetti umani o animali che si alimentano con alimenti inquinati da residui di farmaci antiparassitari; ciò comporta l’utilizzo, in futuro, di farmaci sempre più potenti e quindi anche potenzialmente più tossici (AIAB, 1996; Taylor et al., 2002; Alawa et al., 2003).
Il rispetto dei tempi di sospensione previsti per i farmaci antielmintici può determinare anche una notevole perdita economica per gli allevatori: ad esempio per il tiabendazolo sono previsti 21 giorni per la carne e 7 giorni per il latte, per l’ivermectina 30 giorni per la carne e per il
levamisolo 7 giorni per la carne e da 0 a 4 giorni per il latte (Mc Kellar, 1997; Thompson e Roberts 2001; Alawa et al. 2003).
Nella maggior parte dei casi, i farmaci antielmintici utilizzati per il trattamento e la profilassi degli strongili gastrointestinali dei ruminanti vengono escreti in una certa quantità con le feci degli animali trattati in forma ancora attiva; è dimostrato che i membri del gruppo delle
avermectine/milbemicine possono avere effetti deleteri su organismi non-bersaglio che utilizzano le feci (Mc Kellar, 1997).
L’impatto ambientale dei chemioterapici antiparassitari dipende da diversi fattori (Mc Kellar, 1997):
47
• l’effetto tossico che i metaboliti attivi hanno direttamente sugli
organismi sensibili nel sito dove sono stati emessi gli escrementi degli animali trattati;
• la somma degli effetti tossici in caso di somministrazioni contemporanee di più farmaci;
• la quantità di sostanza attiva presente nell’ambiente, che può dipendere dalla dose di farmaco somministrata o dal suo metabolismo all’interno dell’organismo dell’animale trattato;
• la durata temporale dell’escrezione delle molecole tossiche, ciò dipende dal tempo di emivita del farmaco; infatti, un antielmintico con tempo di permanenza breve nell’organismo subirà una rapida espulsione e quindi i principi tossici si troveranno nelle feci per un periodo limitato. Al
contrario, un farmaco con un lungo tempo di permanenza o associato ad un eccipiente che ne aumenti la persistenza nell’organismo prolungherà l’escrezione di residui tossici con le feci per un periodo maggiore; • la stabilità dei residui eco-tossici nell’ambiente;
• la possibilità di tali molecole di essere trasportate nell’ambiente da organismi invertebrati che ne vengono a contatto, soprattutto ditteri e coleotteri volanti che possono disseminarli anche a notevole distanza. Questi fenomeni di eco-tossicità possono causare un danno alla
biodiversità (Suarez, 2002); infatti, si riscontra una potente attività tossica da parte dell’ivermectina negli invertebrati, soprattutto ditteri e coleotteri, che colonizzano le feci degli erbivori lasciate sui pascoli (Mc Kellar, 1997; Errouissi et al., 2001; Strong et al., 1996).
48
Esiste anche la possibilità di un inquinamento dei pascoli per una prolungata persistenza delle deiezioni dovuta ad una riduzione della rimozione delle feci conseguente al fatto che vengono a mancare quegli organismi, come larve di ditteri e coleotteri o nematodi specifici del letame, che nutrendosi con le feci ne accelerano la decomposizione (Barth et al.,1993).
2.3 LIMITAZIONI DEI CHEMIOTERAPICI NELL’ALLEVAMENTO BIOLOGICO
L’impiego dei farmaci antielmintici di sintesi è fortemente limitato, ma non del tutto proibito, negli allevamenti biologici; infatti essi sono regolamentati da una normativa piuttosto rigorosa ( Reg. CE 2092/91; Reg. CE 1804/99 ) la quale prevede che per la cura degli animali si dia la priorità all’utilizzo della medicina alternativa come l’omeopatia o la fitoterapia e che si ricorra alla medicina tradizionale solo nel caso in cui non si riesca a risolvere il problema con la medicina naturale. È
assolutamente vietato utilizzare farmaci allopatici a scopo preventivo. I farmaci utilizzati negli allevamenti biologici, secondo il DM del 04/08/2000, devono mostrare un basso impatto ambientale , una rapida metabolizzazione, limitati effetti tossici e tempi di sospensione inferiori ai 10 giorni. E’ comunque obbligatorio rispettare tempi di sospensione doppi rispetto a quelli riferiti dal produttore del farmaco.
Nell’allevamento biologico, quindi, per il controllo delle malattie parassitarie si preferisce adottare la tecnica cosiddetta del “Controllo
49
Integrato” (Thamsborgh et al., 1999, 2001; Waller e Thamsborgh, 2004): si tratta di seguire delle misure preventive in modo combinato associate ad un’adeguata gestione dell’allevamento in modo da ridurre al minimo il ricorso a terapie farmacologiche convenzionali (Thamsborgh et al., 1999).
Lo scopo di questa tecnica è quello di creare una situazione di equilibrio tra parassita ed ospite, facendo in modo di abbassare la carica
parassitaria e permettendo all’ospite di sviluppare una sorta di resistenza immunitaria nei confronti dei parassiti.
Le misure previste dal controllo integrato comprendono: la gestione razionale del pascolo, l’alimentazione bilanciata, il controllo biologico dei parassiti, l’utilizzo di razze resistenti ed il ricorso alle terapie alternative quali la fitoterapia e l’omeopatia (Thamsborg, 2001).
2.4 ELEVATO COSTO DEI FARMACI TRADIZIONALI
Un altro aspetto da non sottovalutare e che può limitare l’utilizzo dei comuni farmaci antielmintici di sintesi è il costo spesso elevato di queste molecole sul commercio; questo è un problema maggiormente sentito nei paesi in via di sviluppo dove l’allevamento degli ovi-caprini svolge un ruolo di primaria importanza nel sostentamento economico della
popolazione. Pertanto, attualmente, si è accresciuto l’interesse per la ricerca di nuovi principi attivi naturali, che siano facilmente reperibili in natura ed economicamente abbordabili, soprattutto di origine vegetale, con attività antielmintica come valida alternativa ai farmaci
50
chemioterapici, potendo in tal modo eliminare le problematiche e le limitazioni, citate sopra, imputabili alla somministrazione delle molecole di sintesi (Vieira et al., 1992; Assis et al., 2003; Alawa et al.,2003).