1 UNIVERSITÀ DI PISA
FACOLTÀ DI MEDICINA E CHIRURGIA
CORSO DI LAUREA SPECIALISTICA IN MEDICINA E CHIRURGIA
TESI DI LAUREA
“ANALISI DEI COSTI DELL’ESAME DI
COLONSCOPIA VIRTUALE NELLA PRATICA
DIAGNOSTICA”
RELATORE
CHIAR.MO PROF. Carlo Bartolozzi
CANDIDATO
SIG. Ilaria Biondi
2
SOMMARIO
1. RIASSUNTO ANALITICO ... 3
1.1. Introduzione ... 3
1.2. Scopo della tesi ... 5
1.3. Materiali e metodi ... 5
1.4. Risultati ... 7
1.5. Discussione ... 7
1.6. Conclusioni ... 9
2. INTRODUZIONE ... 10
2.1. Il carcinoma del colon retto ... 10
2.2. Screening ... 16
2.3. Il ruolo della colonscopia virtuale ... 27
3. SCOPO DELLA TESI ... 35
4. MATERIALI E METODI ... 36
5. RISULTATI ... 44
6. DISCUSSIONE ... 50
7. CONCLUSIONI ... 56
3
1. RIASSUNTO ANALITICO
1.1. Introduzione
Il carcinoma del colon retto (CCR) è una delle neoplasia più frequenti per incidenza e mortalità, rappresentando il terzo tumore più comune negli uomini ed il secondo nelle donne in tutto il mondo.
Nonostante l’eziologia del CCR sia tuttora sconosciuta, studi epidemiologici hanno evidenziato svariati fattori di rischio sia ambientali che genetici i quali
predispongono all’ insorgenza di questa neoplasia.
La patogenesi del CCR è un processo multistep caratterizzato da una concatenazione di alterazioni genetiche, il cui corrispettivo anatomopatologico è la sequenza
adenoma – carcinoma, che giustifica l’impiego delle metodiche di screening per la diagnosi precoce.
Lo screening del CCR rappresenta il migliore strumento di prevenzione secondaria in grado di ridurre la mortalità ad esso correlata, consentendo di rilevare e
conseguentemente rimuovere le lesioni sospette e di diagnosticare il carcinoma prima che il paziente diventi sintomatico.
4 Un programma di screening si riferisce ad una popolazione apparentemente sana e quindi, prima di essere attuato, dovrebbe essere sottoposto ad un attento esame dei benefici, dei danni e dei costi.
Con l’obbiettivo di migliorare l’efficienza allocativa di un sistema sanitario sono state messe a punto specifiche tecniche di valutazione economica in sanità. L’analisi di costo - efficacia (ACE) è uno strumento analitico che supporta il
processo decisionale attraverso il confronto tra i benefici in termini di salute e i costi dei diversi interventi.
La scelta di quale sia la metodica più costo – efficace presenta una certa complessità essendo molteplici gli elementi da valutare.
Molteplici vantaggi della CV ne hanno permesso la rapida distribuzione in tutto il territorio ed è un esame in rapida e continua evoluzione tecnologica.
Negli USA, a partire dal Marzo 2008, anche la CV è stata ufficialmente approvata per lo screening da diverse società scientifiche, tuttavia sempre nello stesso anno, i Centri per i Servizi Medicare e Medicaid ne hanno negato il rimborso come test di screening.
Secondo le Linee Guida Europee la CV non viene raccomandata come test di screening nei pazienti a medio rischio , a causa di una mancata evidenza nella letteratura dell’alta sensibilità della CV.
Tuttora non esistono elementi di prova sufficienti a giustificare l’uso della CV come indagine di screening di massa, dal momento che non si tratta ancora di un esame standardizzato, inoltre l’impatto economico di tale metodica sul SSN resta ancora
5 da valutare.
1.2. Scopo della tesi
Analizzare quale sia l’attuale impatto economico della CV sul SSN calcolandone i c osti effettivi al dettaglio nella nostra U.O.
I dati così ottenuti sono stati poi confrontati con le attuali tariffe di rimborso assegnate dal Tariffario Sanitario della Regione Toscana, e successivamente rapportati ai dati relativi alla valutazione economica della colonscopia ottica.
1.3. Materiali e metodi
Abbiamo stimato i costi effettivi delle risorse umane, apparecchiature e materiali di consumo impiegati per eseguire una CV nella nostra U.O. utilizzando protocolli a bassa dose.
I costi delle risorse umane e delle attrezzature sono stati calcolati assumendo che i tempi medi di esecuzione e refertazione siano rispettivamente di 30 e 15 minuti.
6 Personale Medico/Paramedico: 1 radiologo 1 tecnico di radiologia 1 infermiere Apparecchiature radiologiche: Insufflatore PROTOCO2 L
Tomografia Computerizzata a 64 strati (GE-Healtcare) Workstation di elaborazione (GE-Healthcare)
Dispositivi medici:
Set per l’insufflazione di CO2
nel colon 2 paia di guanti
1 siringa da 2,5 mL 1 agocannula
1 benda premi-fistola sterile
1 camice, paio di pantaloncini e telo per il paziente Farmaci:
50 mL di Gastrografin®
250 mL di acqua per preparazioni iniettabili Lidocaina cloridrato (Nefluan® gel)
20 mg di Buscopan®
7
1.4. Risultati
I costi effettivi sostenuti dalla nostra Azienda Ospedaliera per ogni categoria (per esame) sono i seguenti:
Personale Medico/Paramedico : 74,19 € Apparecchiature radiologiche : 72,20 € Dispositivi medici : 38,88 € Farmaci : 12,09 € Costo effettivo CV ……….. 197,4 € Tariffa di rimborso SSN .………. 184 € Debito ospedaliero .……….. 13,4 €
1.5. Discussione
La CV è una metodica ormai nota e consolidata come indagine radiologica per lo studio del colon, effettuata in alternativa e in integrazione alla colonscopia
tradizionale in determinate condizioni cliniche. Nonostante ciò, la CV ha un ruolo dibattuto e non ancora pienamente accettato come metodica di screening di massa.
8 Nella nostra U.O. abbiamo calcolato il costo reale di un singolo esame di CV che ammonta a 197,40 €, e successivamente, lo abbiamo rapportato alla corrispettiva tariffa di rimborso del SSN, che è pari a 184 €.
Dall’analisi dei costi emerge che l’attuale rimborso allocato dal SSN non è in grado di coprire pienamente il costo effettivo degli esami di CV, cosicchè la nostra
Azienda Ospedaliera contrae un debito pari a 13,40 €/esame.
I tassi di rimborso hanno finalità di soddisfare molteplici esigenze con l’obiettivo di remunerare i servizi forniti dagli operatori sanitari, ottimizzare l’allocazione delle risorse, e garantire i livelli essenziali di assistenza, in conformità agli standard stabiliti dal SSN. Tuttavia, secondo la nostra analisi, il SSN non offre un rimborso adeguato alla CV perché non la riconosce ancora una metodica costo/efficace nel rilevamento del CCR rispetto a metodiche già collaudate e standardizzate come la colonscopia ottica.
Dal confronto tra il costo effettivo della CV con quello della colonscopia ottica (pari a 154,37 €) emerge una differenza di 43,03 €, percui risulta più vantaggiosa ripetto alla CV. Tuttavia, per mettere a confronto le due metodiche in prospettiva di un programma di screening bisogna valutarne la differenza oltre che nei costi anche nell’efficacia (sensibilità, complicanze, esposizione a radiazioni ionizzanti, rilevamento di reperti extra-colici, compliance del paziente.)
9
1.6. Conclusioni
La CV non è ancora riconosciuta in Italia come metodica di screening per il CCR e i rimborsi attuali non sono in grado di coprire interamente i costi effettivi dell’esame. Un rimborso adeguato rappresenta un fattore chiave per lo sviluppo di questa metodica soprattutto se consideriamo che non ha un costo molto superiore alla colonscopia tradizionale ed è efficace grazie all’elevata accuratezza diagnostica e una sempre maggiore accettabilità da parte dei pazienti
10
2. INTRODUZIONE
2.1. Il carcinoma del colon retto
Il carcinoma del colon retto (CCR) è una delle neoplasie più frequenti per incidenza e mortalità, rappresentando il terzo tumore più comune negli uomini (663.000 casi, 10% del totale) ed il secondo nelle donne (571.000 casi, 9.4% del totale) in tutto il mondo. Circa la metà di questi pazienti muoiono, rendendo il CCR la quarta causa di decesso per cancro in tutto il mondo, e la seconda nei paesi industrializzati.1
Negli Stati Uniti, secondo il resoconto dell’American Cancer Society (ACS), si stima che durante il 2011 siano stati diagnosticati 141.210 nuovi casi di CCR (circa il 72 % nel colon e il 28 % nel retto) e che ci siano stati complessivamente 49.380 decessi. In Europa, ogni anno sono effettuate circa 435.000 nuove diagnosi di CCR (Ferlay, Parkin e Steliarova- Foucher 2010).
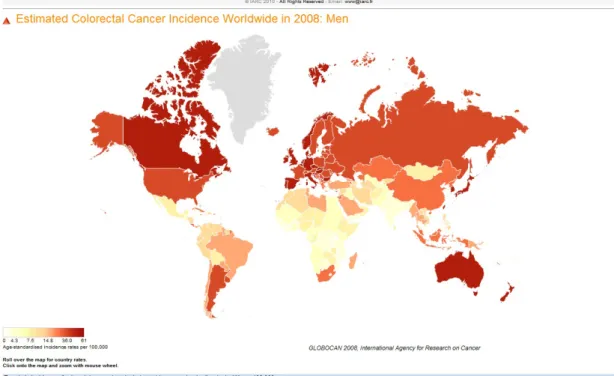
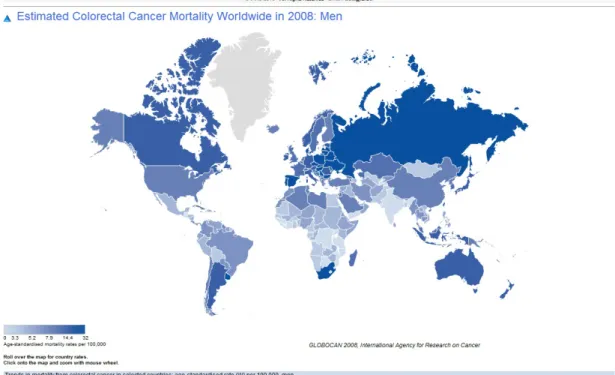
In Italia, l’Associazione Italiana Registri Tumori (AIRTUM) ha stimato che il tasso d’incidenza di CCR per anno sia in media di 88.8 casi per 100.000 negli uomini e 70.3 casi per 100.000 nelle donne. Tale incidenza annuale aumenta linearmente con l’età, in particolare a partire dai 50-60 anni, superando i 90 casi per 100.000. Inoltre, i dati italiani mostrano una variabilità geografica del CCR, con tassi d’incidenza più bassi nell’Italia meridionale e insulare2 (Fig. 1, 2, 3, 4, 5).
11 Fig. 1: Incidenza del CCR nel mondo nel sesso maschile: tasso di incidenza su
100000 soggetti
Fig. 2: Incidenza del CCR nel mondo nel sesso femminile: tasso di incidenza su 100000 soggetti
12 Fig. 3: Mortalità per CCR nel mondo nel sesso maschile: tasso di mortalità su 100000 soggetti
Fig. 4: Mortalità per CCR nel mondo nel sesso femminile: tasso di mortalità su 100000 soggetti
13 Fig. 5: Incidenza del cancro del colon-retto in Italia
Nonostante l’eziologia del CCR sia tuttora sconosciuta, studi epidemiologici hanno evidenziato svariati fattori di rischio sia ambientali (dieta di tipo occidentale, caratterizzata da un’alimentazione povera di fibre e ricca di grassi), che genetici (poliposi familiare adenomatosa, carcinoma ereditario del colon non polipoide, malattie infiammatorie croniche intestinali), i quali predispongono all’insorgenza di questa neoplasia. Bisogna precisare che, nonostante i numerosi fattori predisponenti,
14 la maggior parte dei soggetti (circa il 75%) sviluppa questa neoplasia senza presentare fattori di rischio specifici.3
Si distinguono così nella popolazione soggetti a rischio medio (età superiore a 50 anni, nessun fattore di rischio personale e assenza di familiarità per CCR) e soggetti a rischio alto, che possono presentare:
- Una storia personale di CCR o poliposi
- Una storia personale di malattie infiammatorie intestinali (colite ulcerosa o morbo di Crohn)
- Una storia familiare di CCR o poliposi
- Una storia familiare nota di una sindrome ereditaria del CCR, come la poliposi adenomatosa familiare (FAP) o il carcinoma ereditario del colon non polipoide (HNPCC).4
Fig. 6: Poliposi adenomatosa familiare Fig. 7:Polipo intestinale
15 La patogenesi del CCR è un processo multistep caratterizzato da una concatenazione di alterazioni genetiche, il cui corrispettivo anatomopatologico è la sequenza adenoma – carcinoma, che giustifica l’impiego delle metodiche di screening per la diagnosi precoce5. In particolare, le lesioni polipoidi più a rischio di cancerizzazione sono quelle che presentano istotipo villoso, di grandi dimensioni (>2 cm), e morfologicamente di aspetto sessile. Oltre il 90% dei CCR origina da polipi adenomatosi con un tempo di progressione di circa 10 anni; solo una piccola quota si sviluppa senza evidenza di un precursore adenomatoso, suggerendo che alcune lesioni possono andare incontro a trasformazione maligna senza attraversare la fase polipoide6.
16 Fig. 9: Processo di evoluzione del carcinoma del colon-retto
2.2. Screening
Lo screening del CCR rappresenta il migliore strumento di prevenzione secondaria in grado di ridurre la mortalità ad esso correlata, consentendo di rilevare e conseguentemente rimuovere le lesioni sospette (lesioni precancerose, adenomi), e di diagnosticare il carcinoma prima che il paziente diventi sintomatico. Infatti, se il CCR al momento della diagnosi si trova in una fase precoce, il tasso di sopravvivenza relativo a 5 anni è di circa il 90%4.
17 Negli USA, secondo le linee guida dell’ACS lo screening del CCR è indicato per tutti i pazienti a rischio medio e d’età superiore ai 50 anni, mediante l’impiego di uno dei seguenti test (Tab 1):
Rettosigmoidoscopia flessibile ogni 5 anni Colonscopia ogni 10 anni
Clisma opaco a doppio contrasto ogni 5 anni Colonscopia virtuale ogni 5 anni
Test del sangue occulto fecale ogni anno Test immunochimico fecale ogni anno Test del DNA sgabello4
Tab.1: Linee guida dell’ACS per lo screening del CCR negli individui a medio rischio.
Nei 27 Stati membri dell’Unione Europea (UE), invece, non esiste ancora una linea comune per lo screening del CCR. Un primo passo è stato fatto nel Febbraio 2011, quando la Commissione Europea ha pubblicato la prima edizione delle Linee Guida Europee per la garanzia di qualità nello screening e nella diagnosi del CCR, in cui si
18 elencano le migliori pratiche in materia e si definiscono gli standard per una diagnosi efficace. Gli Stati membri sono esortati a svolgere controlli sistematici sulla popolazione maggiormente a rischio (soggetti tra i 50 e i 74 anni di età), a migliorare la qualità dei test e dei trattamenti per il CCR, e ad intraprendere una pianificazione per i programmi di screening, che tenga conto delle linee guida e le adatti alle diverse situazioni nazionali. Al termine di questa fase potrà essere lanciata un’iniziativa pilota di monitoraggio durante la quale si valuterà l’efficacia del programma di screening. Una volta messo a punto il programma e verificatane l’efficacia, si potrà quindi estendere il monitoraggio a tutto il territorio nazionale. La piena applicazione delle linee guida richiede una preparazione attenta e una molteplicità d’iniziative che vanno dalla sensibilizzazione sul CCR allo scambio di conoscenze tra esperti dei diversi Stati membri. Si prevede che tali linee guida, se applicate correttamente, ridurranno del 15% la mortalità per CCR.
Ad oggi, l’UE raccomanda l’esame per la ricerca del sangue occulto nelle feci (SOF) per tutti i soggetti di età compresa tra i 50 ed i 74 anni, sebbene l’uso delle pratiche endoscopiche sia in netto aumento.
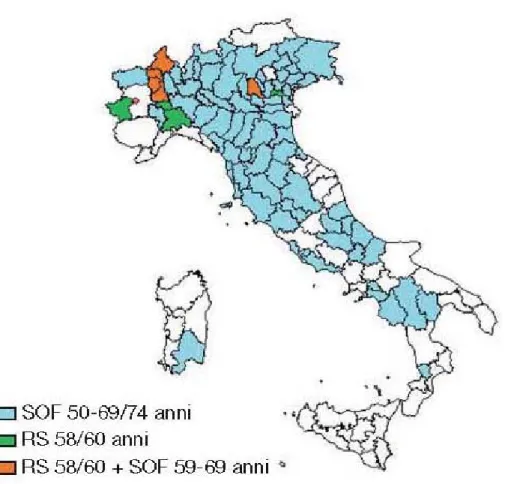
19 In Italia, vi sono importanti differenze tra i programmi di screening colo-rettale: la grande maggioranza utilizza il test per la ricerca del sangue occulto nelle feci con cadenza biennale; alcuni programmi propongono la rettosigmoidoscopia una tantum; altri invece una combinazione di entrambi i test. Tutti i programmi SOF prevedono l’esecuzione di un test immunochimico, su un singolo prelievo e senza restrizioni dietetiche. Il test è di tipo quantitativo e come criterio di positività si fa riferimento alla soglia di 100 ng/ml di emoglobina, eccetto che per un solo programma in cui la soglia è di 80 ng/ml. Ai soggetti con test negativo il risultato è inviato tramite posta, con il consiglio di ripetere il test dopo due anni. Invece, i soggetti con SOF positivo sono contattati ed invitati a sottoporsi ad una colonscopia ottica o, se questa non è eseguibile o è rifiutata dal paziente, un clisma a doppio contrasto.
Le regioni che dal 2008 sono interamente coperte da programmi di screening sono solo le seguenti: Abruzzo, Basilicata, Emilia-Romagna, Friuli Venezia Giulia,
20 Lombardia, Molise, Toscana, Umbria, Valle d’Aosta e la Provincia autonoma di Trento7 (Fig. 10).
Fig. 10: Programmi di screening colon-rettale: test di primo livello e popolazione target
Un test di screening ottimale dovrebbe rispondere ad alcuni requisiti: Sensibilità e specificità
Ripetibilità Innocuità
21 Elevata tolleranza da parte del paziente
Convenienza in termini di costi-benefici
Disponibilità di una terapia efficace per la diagnosi che ne deriva.
Un programma di screening si riferisce ad una popolazione apparentemente sana e quindi, prima di essere attuato, dovrebbe essere sottoposto ad un attento esame dei benefici, dei danni e dei costi8, soprattutto in un momento dove la maggior parte dei paesi si trova ad affrontare problemi di deficit nel bilancio statale, ed è necessario che le risorse a disposizione vengano utilizzate in modo efficiente, scegliendo l’opzione di screening più conveniente9. Secondo l’Organizzazione Mondiale della Sanità (OMS), lo screening dovrebbe essere attuato solo quando c’è un buon equilibrio tra i costi ed i benefici che ne derivano8. Purtroppo non esiste una definizione universale di “equilibrio” e le valutazioni degli Stati possono essere diverse8.
Con l’obiettivo di migliorare l’efficienza allocativa di un sistema sanitario sono state messe a punto specifiche tecniche di valutazione economica in sanità.
L’analisi di costo-efficacia (ACE) è uno strumento analitico che supporta il processo decisionale attraverso il confronto tra i benefici in termini di salute e i costi dei diversi interventi. L’ACE non dà la possibilità di determinare quale sarà il test o la metodica ottimale, piuttosto permette di identificare quale metodica fornirà i benefici maggiori date le risorse economiche disponibili8.
In sostanza, quando si dice che un test, una metodica o un’indagine diagnostica è costo-efficace, si intende che essa presenta un favorevole rapporto costo-beneficio e che i benefici addizionali valgono davvero il costo aggiuntivo rispetto alle altre
22 indagini alternative già disponibili. In un’ACE è tipicamente utilizzato un modello matematico che monitorizza i benefici e i rischi di una metodica. Il modello registra, inoltre, i costi associati all’intervento, compresi quelli degli eventuali effetti collaterali. I risultati sono poi confrontati per determinare il beneficio netto o il danno netto, e riassunti in un rapporto di costo-efficacia.
Il Rapporto Incrementale di Costo-Efficacia (ICER) rappresenta oggi lo strumento maggiormente impiegato nella valutazione economica delle terapie farmacologiche e delle indagini diagnostiche, permettendo di definire a quali costi addizionali si ottiene un esito sanitario aggiuntivo in termini di efficacia tramite il seguente rapporto: ICER = (C1 - C2) / (E1 - E2)
C1= Costo nuova metodica C2 = Costo metodica di confronto E1 = Efficacia nuova metodica E2= Efficacia metodica di confronto10
Inoltre, quando si analizzano i costi, dovrebbero essere identificati tutti i costi rilevanti: il costo della metodica, del test o dell’indagine diagnostica, dell’interpretazione radiologica, delle attività infermieristiche, del trasporto del paziente, del trattamento di eventuali complicanze, del tempo lavorativo impiegato dagli accompagnatori di pazienti gravemente ammalati o disabili, etc11.
In aggiunta, i costi sanitari si possono suddividere in due sottocategorie: costi diretti e costi indiretti.
23 - esami di laboratorio - visite specialistiche - terapie farmacologiche - degenza ospedaliera - prestazioni riabilitative
- prestazioni di diagnostica strumentale
Costi indiretti o non sanitari: - trasporti
- diete particolari - servizi sociali - assistenza informale
Costi di produttività persa
I costi indiretti per lo screening del CCR sono un dato importante perché possono influenzare l’adesione allo screening stesso, o la modalità di screening scelta. Le Linee Guida pubblicate raccomandano, infatti, che i costi non sanitari siano inclusi nelle valutazioni economiche di un programma di screening; anche se sono comunemente omessi dalle valutazioni economiche dei programmi sanitari12.
Il “microcosting” è metodo più accurato per definire i costi, che consiste nell’identificazione e nella quantificazione in unità di costo di ogni risorsa utilizzata. Le stime tengono conto anche dei costi pregressi e dovrebbero fare riferimento al
24 potere di acquisto della moneta di un anno che deve essere specificato (per esempio: dollaro del 2000, euro del 2002) e alla stima dell’inflazione (per esempio se l’inflazione è al 4%, un costo di 100 euro stimato 1 anno fa, equivale oggi a un aumento del 4%, cioè a 104 euro). In più un modello di analisi economica dovrebbe avere un orizzonte temporale che si estende per vari anni nel futuro.
Un ritardo nella ricezione di una somma di denaro determina la perdita dell’opportunità di beneficiare dell’impiego di tale somma; si parla perciò di costo dell’opportunità perduta. Per includere nell’ACE il costo dell’opportunità perduta bisogna ritoccare in basso (“discounting” o sconto) tutti i costi futuri in valuta corrente, esattamente come i costi pregressi sono ritoccati verso l’alto tenendo conto dell’inflazione, allo scopo di ottenere una stima dei costi correnti. Per esempio, un esame TC che costerà 100 euro tra un anno, con un tasso di sconto del 3%, è convertito in un costo corrente stimato di 97,87 euro.
Recentemente negli USA, il gruppo per lo studio dei costi in radiologia ha definito in modo più preciso i costi dei principali esami radiologici, sia come costi tecnici sia come unità di valore tecnico relativo, e ha proposto di adottare questo strumento per eseguire un confronto tra diverse realtà ospedaliere, così da promuovere le pratiche più virtuose. Analizzando la misura dell’efficacia, dobbiamo considerare il miglioramento della salute come prodotto finale. L’unità di misura più comune in questo tipo di analisi è il QALY (Quality Adjusted Life Year: anno di vita guadagnato ponderato per la qualità della vita), che tiene conto non tanto del numero degli anni di vita guadagnati, quanto della qualità di vita. La preferenza per ogni stato di salute è pesata secondo la valutazione media calcolata su un collettivo, indicando la scelta del paziente in una scala che va da un minimo di zero (decesso) a
25 un massimo di uno (perfetta salute). Il punteggio è poi moltiplicato per il periodo di tempo passato in quel determinato stato di salute. Il QALY è impiegato come strumento di programmazione sanitaria per distribuire le risorse disponibili, decidere quali prestazioni erogare e per quali categorie di pazienti10.
La scelta di quale sia la metodica più costo-efficace presenta una certa complessità essendo molteplici gli elementi da valutare. Inoltre, le politiche sanitarie che valutano le metodiche sono notevolmente diverse tra i vari Stati, per cui risulta difficile trarre delle conclusioni che siano valide per tutti. Infatti, se negli Stati Uniti le Linee Guida sono state emesse da organizzazioni che non considerano tanto il costo quanto piuttosto l’efficacia di una metodica, in Europa le decisioni sulla sanità vengono prese dai vari governi così che l’attenzione cade molto più sulle questioni economiche che sui benefici8. In più i costi dei test sono molto inferiori in Europa e in Asia rispetto agli USA, così come cambiano anche le caratteristiche e le preferenze della popolazione locale.
Inoltre, in una valutazione costo-efficacia bisogna considerare l’adesione ad un programma di screening o comunque la capacità di fare aderire allo screening anche quella parte di popolazione altrimenti non schermata. Per tale motivo la “compliance”, e cioè l’accettabilità del test da parte del paziente, è un punto cruciale, soprattutto perché lo screening è rivolto alla popolazione in buona salute ed asintomtica8. Occorre a tal proprosito un’opportuna campagna di informazione e sensibilizzazione, e la diffusione di metodiche che riducano al minimo gli impedimenti a sottoporsi al test (dolore, disagio, lesioni associate all’esame, test imbarazzante etc..). I tassi di adesione allo screening oggi sono sempre inferiori al
26 50% della popolazione “schermabile” sia in Europa che negli Stati Uniti13. Per questo si cercano delle soluzioni nella combinazione di strategie già esistenti o in nuove tecnologie, tra cui anche la CV, che mirino ad eliminare questi ostacoli.
Un altro elemento importante è la sensibilità e la specificità dello screening. Più l’esame è preciso e più c’è anche un risparmio in costi, in quanto si evitano le eventuali spese di follow-up. La ricerca del sangue occulto nelle feci, pur essendo di facile esecuzione e non invasivo, è scarsamente sensibile e dà un elevato numero di falsi negativi. La rettosigmoidoscopia è di solito ben tollerata, ma ha il limite di poter diagnosticare l’eventuale presenza di patologia solo se questa è situata a livello del retto e/o del sigma. La colonscopia ottica è considerata, invece, il gold standard perché rileva direttamente le lesioni polipoidi anche di dimensioni piccolissime (sotto i 6 mm) con una sensibilità intorno al 90-100% e consente di eseguire anche polipectomie durante la stessa procedura. Tuttavia, ha dei limiti importanti: in primo luogo il rischio di complicanze (sanguinamento post-polipectomia, perforazione) che seppur basso è pur sempre presente; in secondo luogo anche per la colonscopia è fondamentale la competenza dell’endoscopista per cui ci possono essere lesioni che non vengono rilevate13; in terzo luogo non può essere praticata in tutti i pazienti, sia per problemi di stenosi, masse o dolico-colon, che non consentono all’endoscopista di esplorare tutto il lume intestinale, e sia per problemi di scarsa compliance del paziente, spesso legati anche alla stessa preparazione intestinale.
Il clima a doppio contrasto può essere utilizzato nei casi in cui l’esame endoscopico tradizionale non consenta la completa visualizzazione del colon, mediante opacizzazione del colon, ottenuta con mezzo di contrasto radiopaco introdotto per via rettale, e successiva insufflazione con aria. Si tratta di un esame dinamico che studia
27 in tempo reale il progredire del mezzo di contrasto attraverso le varie porzioni dell’intestino, presentando tuttavia un’accuratezza diagnostica inferiore rispetto alla colonscopia tradizionale, e per tale motivo oggi è sempre più sostituito dalla CV. Per conciliare le differenze nei risultati ottenuti nei vari studi, si utilizzano modelli matematici che però non sostituiscono le valutazioni cliniche sull’efficacia dei test, assolutamente necessarie per ridurre il grado di incertezza sulle analisi di costo-efficacia13.
Tutti questi studi dimostrano che, valutando le varie procedure, tutte le metodiche di screening sono più costo-efficaci rispetto al non screening, ma nessuna strategia ha costantemente un ICER a suo favore se confrontata con un'altra metodica8, 13.
2.3. Il ruolo della colonscopia virtuale
La Colonscopia Virtuale (CV) è un esame radiologico non invasivo di Tomografia Computerizzata (TC) dell’addome, eseguito previa preparazione catartica intestinale, marcatura fecale e distensione del colon tramite anidride carbonica. È un’indagine che, mediante l’impiego di un software dedicato, consente di navigare virtualmente all’interno del colon del paziente e di studiare le sue patologie (colite, polipi, diverticoli, neoplasie) anche nei casi in cui la colonscopia tradizionale è ostacolata dalla presenza di stenosi, masse, o dolico-colon. L’affidabilità della simulazione endoscopica tridimensionale dipende da una costante correlazione con le immagini
28 bidimensionali, da un’adeguata pulizia intestinale, da un’omogenea marcatura fecale e dall’esperienza del medico radiologo14-16.
I molteplici vantaggi della CV ne hanno permesso la rapida distribuzione in tutto il territorio, fra cui:
- Elevata accuratezza diagnostica - Alta sensibilità e specificità - Sicurezza
- Non invasività
- Buona compliance del paziente - Valutazione completa del colon - Rilevazione dei reperti extracolici
- Riduzione dei costi indiretti (tempi di esecuzione ridotti, nessuna necessità di accompagnatore, ecc.)9, 17
29 In Italia ormai da alcuni anni, la CV è una metodica ampiamente utilizzata in tutte le Regioni, rappresentando un esame in rapida e continua evoluzione tecnologica. Continui studi introducono svariati elementi innovativi, che ne migliorano la qualità e l’affidabilità con risultati clinici talvolta controversi, ma comunque sempre più incoraggianti. Più di recente, ulteriori sforzi sono stati compiuti nel proporre al paziente tecniche di preparazione limitate al giorno precedente l’esame o addirittura al giorno stesso. In sostanza, la tolleranza del paziente a questo esame è molto superiore a quella per la colonscopia tradizionale e per il clisma a doppio contrasto. L’introduzione nella pratica clinica delle apparecchiature multistrato (TC a 64 strati ha consentito di raggiungere una vera e propria isotropia del voxel acquisito, con la possibilità di utilizzare tutti i piani dello spazio per ricostruzioni 3D estremamente affidabili. Purtroppo a fronte di questi vantaggi, coesiste un incremento della dose radiante se l’esame viene eseguito con protocolli standard. Per ovviare a questa problematica sono stati proposti protocolli a dose bassa e ultrabassa.
Un ulteriore progresso tecnologico è legato alla possibilità di utilizzare per lo pneumocolon un insufflatore automatico di anidride carbonica. La CO2 presenta alcuni vantaggi rispetto all’aria: è insufflata lentamente monitorando pressione e volume del colon, ed è meglio assorbita dalla parete intestinale limitando il residuo gassoso post-esame. In sostanza è meglio tollerata dal paziente e riduce il rischio di perforazione.
Sin dalla nascita della CV è iniziato il dibattito circa la più idonea modalità di visualizzazione delle immagini: ovverosia se sia meglio un’analisi primaria 2D oppure 3D. L’analisi primaria 2D prevede la valutazione su una workstation delle
30 singole scansioni assiali ed eventualmente delle ricostruzioni multiplanari, riservando le immagini 3D endoluminali esclusivamente alla soluzione di problemi di interpretazione (ad esempio, diagnosi differenziale tra un polipo e una plica ipertrofica). Questo approccio ha il vantaggio della rapidità di analisi dei dati unita alla possibilità di visualizzare le immagini anche su workstation scarsamente performanti. D’altra parte è evidente la difficoltà d’interpretazione dei dati 2D, che richiede pertanto una maggiore esperienza da parte dell’operatore. L’analisi primaria 3D riconosce, invece, la navigazione endoluminale quale prima modalità di visualizzazione delle immagini che fornisce un’accuratezza più elevata soprattutto per le piccole lesioni polipoidi. Con il 3D però il tempo di analisi dei dati è più lungo e, comunque, vi è la necessità di valutare le immagini 2D per la diagnosi differenziale (ad esempio distinguere un polipo da un residuo fecale). Pertanto alla domanda se sia meglio l’approccio primario 2D o 3D, la risposta è che solo dalla combinazione delle diverse modalità di rappresentazione dei dati si ottengono le migliori informazioni.
Inoltre il progresso dell’hardware e del software ha offerto innovazioni sempre più interessanti. Infatti alla classica navigazione virtuale si sono affiancate nuove modalità di visualizzazione, come il cosidetto “unfolded cubing” o la “dissezione virtuale” nelle quali il volume di dati 3D viene aperto e “sezionato”, al fine di ottenere una più rapida analisi delle immagini priva delle problematiche tipiche della navigazione endoscopica (polipi nascosti dalle pliche; difficoltà di analisi dell’intera superficie mucosa, ecc..). Parallelamente alle nuove modalità di visualizzazione ci sono inoltre sistemi di diagnosi assistita, i cosidetti “ CAD, Computer Assisted Diagnosis”. Si tratta di software “intelligenti” che hanno la capacità di identificare i
31 polipi o i tumori e di presentarli al radiologo per la valutazione definitiva al fine di ridurre gli errori di percezione sempre insiti nella metodica.
32 La CV necessita di una buona esperienza per l’analisi e l’interpretazione delle immagini per cui l’addestramento e assolutamente necessario. A tal fine diversi centri accademici e non, sia in Italia che all’estero, offrono corsi di addestramento dedicati. In particolare l’ESGAR (European Society of Gastrointestinal and Abdominal Radiology) organizza dei corsi di formazione teorico-pratici nei quali, alle classiche lezioni frontali, si aggiungono diverse ore di addestramento alla workstation sotto l’attenta guida di tutori esperti della metodica. L’addestramento pratico è infatti riconosciuto come basilare per ottenere un’idonea capacità di interpretazione delle immagini. Non solo, è anche importante che venga effettuato sul software utilizzato dall’utente nella realtà operativa, che vi sia un sufficiente numero di casi rappresentativi delle diverse patologie, comuni e non (l’ ESGAR ha strutturato a tal fine un database) e che vi sia un feed-back a quanto osservato singolarmente dall’utente.
Oggi la CV è considerata, dalla maggior parte dei centri che la eseguono, un’efficace alternativa al clisma a doppio contrasto nei soggetti sintomatici, che rifiutano o che hanno eseguito una colonscopia convenzionale incompleta.
Studi evidenziano, infatti, una significativa superiorità della CV rispetto al clisma a doppio contrasto in termini di accuratezza diagnostica e tolleranza da parte del paziente. Nonostante ciò sul territorio italiano la diffusione della CV è piuttosto irregolare in quanto in alcune realtà regionali o di area vasta l’esame non viene di fatto praticato. L’uso della colonscopia virtuale per la prevenzione del CCR, e quindi nel soggetto asintomatico, è ancora dibattuto18.
33 Fig.15: Visualizzazione di un polipo intestinale in colonscopia virtuale
Ad oggi alla CV come metodica di screening si possono riconoscere due ruoli: uno attuale e uno potenziale. Il ruolo attuale è, come già citato, l’integrazione nei programmi di screening esistenti in sostituzione al clisma opaco in caso di colonscopia incompleta o non eseguibile. Numerosi studi in letteratura dimostrano la netta superiorità della CV sul clisma opaco nel rilevamento delle lesioni polipoidi e del CCR. Inoltre, dal 2006 l’American Gastroenterological Association (AGA) Clinical Practice e l’Economics Committee hanno sostenuto la CV come metodo di scelta per lo studio del colon nei casi di colonscopia incompleta.
34 Il ruolo potenziale, invece, riguarda l’uso della CV come metodo di screening di prima scelta insieme alla ricerca del sangue occulto nelle feci, alla rettosigmoidoscopia e alla colonscopia tradizionale17.
Negli USA, a partire dal Marzo 2008, anche la colonscopia virtuale è stata ufficialmente suggerita per lo screening da diverse società scientifiche tra cui l’ACS, la US Multi-Society Task Force on Colorectal Cancer e l’American College of Radiology (ACR). Tuttavia, sempre nello stesso anno, i Centri per i Servizi Medicare e Medicaid hanno negato il rimborso per la CV come test di screening17.
Per quanto riguarda invece le Linee Guida Europee, la CV non è raccomandata come test di screening nei pazienti a medio rischio a causa di una mancata evidenza in letteratura dell’alta sensibilità della CV; sebbene tale posizione è stata contestata dall’ESGAR, in quanto esistevano già studi che evidenziavano l’efficacia della CV nei pazienti asintomatici.
Tuttora non esistono elementi di prova sufficienti a giustificare l’uso della CV come indagine di screening di massa, dal momento che non si tratta ancora di un esame standardizzato, a causa dei differenti protocolli di esecuzione dell’esame di CV utilizzati nei vari centri. Inoltre, l’impatto economico di tale metodica sul Servizio Sanitario Nazionale (SSN) resta ancora da valutare.
35
3. SCOPO DELLA TESI
Analizzare quale sia l’attuale impatto economico della CV sul Servizio Sanitario Nazionale (SSN) calcolandone i costi effettivi al dettaglio nella nostra Unità Operativa.
I dati così ottenuti sono stati poi confrontati con le attuali tariffe di rimborso assegnate dal Tariffario Sanitario della Regione Toscana, e successivamente rapportati ai dati relativi alla valutazione economica della colonscopia ottica, oggi ritenuta dalla letteratura scientifica più vantaggiosa in termini di costo-efficacia nello screening del CCR rispetto alla CV.
36
4. MATERIALI E METODI
In questo studio è stato valutato un esame di CV eseguito nella nostra Unità Operativa, utilizzando protocolli a bassa dose, assumendo che i tempi medi di esecuzione e refertazione siano rispettivamente di 30 e 15 minuti.
Il paziente giunge alla nostra osservazione dopo aver condotto un regime di preparazione che consiste nelle seguenti fasi:
il giorno precedente l’esame una dieta priva di fibre, evitando pane, pasta, riso, frutta, verdure e legumi
alle 14.30, 4 compresse di Lovoldyl®
5mg (Promefarm) dalle 17.00, soluzione Lovol-esse®
confezione da 4 buste, sciolte in acqua per un totale di 2 litri (Promefarm): 250 mL ogni 15 minuti fino ad esaurimento dei 2 litri (terminare l’assunzione entro le ore 19.00).
Il giorno dell’esame il paziente deve restare a digiuno (prendere solo un tè o un caffè zuccherato).
Nella presente tesi abbiamo considerato una suddivisione dell’esame in due fasi: l’esecuzione della procedura (preparazione, insufflazione, acquisizione TC) e la refertazione.
Il paziente è opportunamente invitato a indossare appositi indumenti (un camice e un paio di pantaloncini) dopodiché viene fatto posizionare sul lettino porta-pazienti
37 della TAC in decubito laterale sinistro con le ginocchia leggermente flesse sul tronco in in modo da poter inserire una piccola sonda nel retto (Fig. 17), per compiere questa operazione si utilizza lidocaina cloridrato (Nefluan® gel). Una volta inserita, prima di procedere alla marcatura, si gonfia un palloncino all’estremità della sonda, che serve ad ancorarla al retto.
La marcatura fecale si ottiene iniettando per via rettale una soluzione costituita da 50 mL di Gastrografin® (Fig. 16), cioè mezzo di contrasto iodato ionico, diluito in 250 mL di acqua, utilizzando una sacca per clisma collegata direttamente alla sonda, già posizionata nel retto, così che il liquido della soluzione possa raggiungere l’intestino del paziente. Questa sonda è la stessa che servirà, successivamente, per insufflare la CO2nel colon. In questa fase, il paziente è invitato a cambiare il proprio decubito per permettere al liquido marcato di distribuirsi omogeneamente sulle pareti intestinali e raggiungere il colon di destra. Alla fine la sonda è collegata ad un insufflatore automatico di CO2(insufflatore PROTOCO2L Colon Insufflator System; E-Z-EM, NY,USA) (Fig.18). Questa apparecchiatura monitorizza costantemente pressione e volume di introduzione della CO2 all’interno del colon. Di solito ne vengono insufflati 3 L ma si può arrivare fino a 4L. L’utilizzo della CO2anziché dell’aria è giustificato dal fatto che è meglio assorbita dalla parete intestinale, riducendo sia il dolore (soprattutto crampiforme), sia il meteorismo post-esame. Generalmente prima dell’esame TC si ricorre all’uso di farmaci miorilassanti e spasmolitici come un anticolinergico (Buscopan®) che viene somministrato endovena in quantità di una fiala da 20 mg con una siringa di 2,5 mL. Questo ha la finalità di minimizzare la peristalsi intestinale e di ridurre lo spasmo colico, permettendo di visualizzare una più ampia superficie colica, di rendere l’insufflazione più tollerabile da parte del
38 paziente e di ridurre gli artefatti dovuti ad esempio a spasmi della muscolatura colica19. Controindicazioni assolute all’uso del Buscopan® per via endovenosa sono il glaucoma ad angolo acuto, le aritmie cardiache e l’ipertrofia prostatica. La mancata utilizzazione di uno spasmolitico non impedisce comunque l’effettuazione dello pneumocolon, anche se alcuni segmenti colici con attività peristaltica significativa potranno collassare riducendo così la visibilità del lume colico. Durante l’insufflazione il paziente è invitato a rilassare la muscolatura addominale, a respirare lentamente e a segnalare il momento in cui la distensione crea un dolore non sopportabile. E’ necessario verificare che la distensione abbia interessato tutti i segmenti colici mediante l’acquisizione di uno scanogramma TC nelle proiezioni antero-posteriore (AP) e latero-laterale (LL). Se la distensione non fosse sufficiente è indicato procedere all’insufflazione di altra CO220.
A questo punto sono eseguite le scansioni con TC a 64 strati (GE- Healthcare) (Fig. 20) in apnea, sia in posizione supina e sia in posizione prona. Infatti, l’utilizzo di entrambi i decubiti permette di ottenere una differente disposizione dell’aria nei vari segmenti intestinali, una ridistribuzione nelle sedi più declivi del contenuto fluido e la mobilizzazione di eventuali residui fecali solidi, migliorando la performance diagnostica rispetto a quella che si avrebbe esaminando solo quelle in posizione supina. Successivamente, le immagini sono trasferite su una workstation di elaborazione (GE- Healthcare) e inizia la seconda fase dell’esame.
39 Fig. 16 : Gastrografin
40 Fig. 19: Immagine scout di pneumocolon ottenuto mediante insufflazione CO2
41 In totale per la prima fase dell’esame (esecuzione della CV), di durata media di 30 minuti, sono necessari:
1. Personale medico: 1 radiologo 1 tecnico di radiologia 1 infermiere 2. Apparecchiature radiologiche: 1 insufflatore (PROTOCO2L) 1 TC a 64 strati (GE- Healthcare)
3. Dispositivi medici:
1 set per l’insufflazione di CO2 nel colon 1 sacca per clisma
2 paia di guanti 1 siringa da 2,5 mL 1 agocannula
1 benda premi-fistola sterile 1 telo
1 camice per il paziente
1 paio di pantaloncini per il paziente
42 50 mL di sodio amidotrizoato + meglumina amidotrizoato (Gastrografin®
) 250 mL di acqua per preparazioni iniettabili
lidocaina cloridrato (Nefluan® gel) 20 mg joscina butilbromuro (Buscopan®
) 4L di CO2 (consumo medio)
La seconda fase dell’esame è quella della refertazione dell’esame colon-TC (si stima che abbia una durata di 15 minuti).
Le immagini TC ottenute sono inviate ad una workstation dotata di un software per le ricostruzioni 3D e, nello specifico, per l’endoscopia virtuale, permettendo di visualizzare le pareti del colon secondo una prospettiva molto simile a quella di un’ipotetica visione umana mediante endoscopio. Il grosso intestino è esaminato in senso retrogrado dal retto sino al cieco, come se l’occhio dell’operatore fosse posizionato all’interno del colon.
Per la refertazione sono necessari: 1 radiologo
1 workstation di elaborazione (GE- Healthcare)
Ricapitolando, per i costi del personale viene calcolato il costo in base al tempo di lavoro:
Radiologo 30 minuti per l’esecuzione TAC + 15 minuti per la refertazione Tecnico di radiologia 30 minuti per l’esecuzione TAC
43 Per le apparecchiature radiologiche viene calcolato il costo per esame che si ottiene valutando il costo totale del macchinario, le spese di manutenzione fatte ogni 5 anni, l’ammortamento delle attrezzature sanitarie, in rapporto al numero di esami effettuati, che sono stati rispettivamente:
8603 esami per la TC a 64 strati (GE- Healthcare)
8603 esami per la Workstation di elaborazione (GE- Healthcare)
200 esami per l’insufflatore PROTOCO2L (considerando esclusivamente le CV).
Per i dispositivi medici e per i farmaci il costo è stato calcolato considerando la quantità usata.
In collaborazione con l’Unità Operativa di Gastroenterologia di Pisa sono stati valutati i costi al dettaglio per eseguire una colonscopia ottica in sedazione cosciente, considerando:
il personale dedicato il materiale monouso
44
5. RISULTATI
I costi effettivi sostenuti dalla nostra Azienda Ospedaliera per esame e per categoria sono i seguenti:
1. FASE DI ESECUZIONE DELL’ ESAME DI CV: Personale medico:
Radiologo (30 minuti) = 31,89 €
Tecnico di radiologia (30 minuti) = 13,81 € Infermiere (30 minuti) = 12,56 €
Totale = 58,26 €
Apparecchiature radiologiche:
TC a 64 strati (costo per esame) = 38,36 €
Insufflatore PROTOCO2L (costo per esame) = 30,00 € Totale = 68,36 €
Dispositivi medici:
sacca per clisma (costo per unità) = 4,98 € guanti (costo per due paia) = 0,04 €
siringa da 2,5 mL (costo per unità) = 0,04 € agocannula (costo per unità) = 0,26 €
45 telo (costo per unità) = 0,71 €
camice per il paziente (costo per unità) = 1,16 € pantaloncini per il paziente (costo per unità) = 0,30 €
set di somministrazione della CO2 nel colon (costo per unità) = 31,20 € Totale = 38,88 €
Farmaci:
Gastrografin®
100 mL (costo per quantità utilizzata) = 2,10 €
Acqua per preparazioni iniettabili da 500 mL (costo per quantità utilizzata) = 0,19 €
Nefluan®
gel (costo per unità) = 2,64 € Buscopan®
20 mg (costo per fiala) = 0,23 € Anidride Carbonica (costo per 4 L) = 6,94 € Totale = 12,10 €
Il costo totale della prima fase dell’esame di CV è 177,00 €.
2. FASE DI REFERTAZIONE DELL’ESAME DI CV: Personale medico:
Radiologo (15 minuti): 15,94 € Apparecchiature radiologiche:
Workstation di elaborazione (costo per esame): 3,84 € Il costo totale della seconda fase dell’esame di CV è 19,78 €.
46 Il costo effettivo dell’intera procedura è di 197,4 €.
Tab. 2: Tabella riassuntiva dei costi della CV
47 Tab. 3: Tabella riassuntiva dei costi delle apparecchiature radiologiche
48 La tariffa di rimborso del Servizio Sanitario Nazionale per un esame di CV ammonta a 184 €, in quanto tale esame è rimborsato come TC dell’addome senza mezzo di contrasto e non come CV. In rapporto al costo reale della CV, la nostra Unità Operativa contrae un debito ospedaliero pari a 13,4 € per singolo esame.
In collaborazione con l’Unità Operativa di Gastroenterologia di Pisa sono stati vautati i dati della colonscopia ottica in sedazione cosciente, riguardanti i costi al dettaglio necessari per la procedura (Tab. 5):
49 Tab. 5: Tabella riassuntiva dei costi della colonscopia tradizionale
50
6. DISCUSSIONE
La CV è una metodica ormai nota e consolidata come indagine radiologica per lo studio del colon, effettuata in alternativa e in integrazione alla colonscopia tradizionale in determinate condizioni cliniche. La sua indicazione principale è rappresentata dal completamento dello studio del colon in tutte quelle situazioni in cui l’esame endoscopico tradizionale sia incompleto per la presenza di esiti aderenziali post-chirurgici, di varianti anatomiche come il dolico-colon, nei casi di scarsa compliance del paziente, o qualora un’importante diverticolite con periviscerite renda rischioso il proseguimento dell’endoscopio.
Oggi l’esame di CV è proposto nei soggetti oltre i 50 anni di età con familiarità per CCR, nei pazienti già sottoposti a pregressa polipectomia nei quali sia opportuno un follow-up o in quei pazienti che, per età avanzata o per la presenza di patologie concomitanti, la colonscopia tradizionale potrebbe comportare un aumentato rischio di complicanze. Nonostante ciò, la CV ha un ruolo dibattuto e non ancora pienamente accettato come metodica di screening di massa.
Ancor oggi, la colonscopia ottica è considerata il gold-standard nei casi in cui si sospetta una lesione neoplastica del colon, ed è eseguita come prima scelta sia nei pazienti che siano risultati positivi al test del SOF, sia in quelli ad alto rischio (familiarità, malattie infiammatorie croniche intestinali, storia personale di CCR, etc..), consentendo di visualizzare il lume intestinale e le lesioni polipoidi anche di piccolissime dimensioni.
51 Nella nostra Unità Operativa abbiamo calcolato il costo reale di un singolo esame di CV, che ammonta a 197,40 €, e successivamente, lo abbiamo rapportato alla corrispettiva tariffa di rimborso del SSN, che è pari a 184 €.
Dall’analisi dei costi emerge che l’attuale rimborso allocato dal SSN non è in grado di coprire pienamente il costo effettivo degli esami di CV, cosicché la nostra Azienda Ospedaliera contrae un debito pari a 13,4 €/esame.
I tassi di rimborso, infatti, hanno finalità di soddisfare molteplici esigenze con l’obiettivo di remunerare i servizi forniti dagli operatori sanitari, ottimizzare l’allocazione delle risorse, e garantire i livelli essenziali di assistenza, in conformità agli standard stabiliti dal SSN. Tuttavia, secondo la nostra analisi, il SSN non offre un rimborso adeguato alla CV perché non la riconosce ancora una metodica costo-efficace nel rilevamento del CCR rispetto a metodiche già collaudate e standardizzate come la colonscopia ottica. Nonostante ciò, il debito contratto pari a 13,4 €/esame non rappresenta un valore così cospicuo, ed è sicuramente legato al fatto che la CV è rimborsata come una TC addome senza mezzo di contrasto.
Dal confronto tra il costo effettivo della CV con quello della colonscopia ottica (pari a 154,37 €) emerge una differenza di 43,03 €, per cui risulta più vantaggiosa rispetto alla CV. Tuttavia, per mettere a confronto le due metodiche in prospettiva di un programma di screening bisogna valutarne la differenza oltre che nei costi anche nell’efficacia.
Per quanto riguarda l’efficacia facciamo riferimento ai numerosissimi studi presenti in letteratura che ci forniscono dati circa la sensibilità e la specificità delle due metodiche. In base alle dimensioni delle lesioni polipoidi, la colonscopia tradizionale ha una sensibilità dell’80% per i polipi 5 mm, dell’85% per i polipi tra i 6-9 mm e
52 del 90% per quelli 10 mm, con una specificità del 90%. Invece la sensibilità della CV per i polipi 5 mm è di 48%, per quelli tra i 6-9 mm è del 70% e per i polipi 10 mm è dell’85%, con una specificità dell’86%21.
La CV ha quindi una buona sensibilità e specificità sui polipi di dimensioni maggiori (6 mm) che è paragonabile a quella della colonscopia ottica, mentre le differenze aumentano notevolmente se consideriamo polipi di dimensioni 5 mm.
Su questo confronto Hassan et al. hanno realizzato uno studio applicando un modello di Markov a una popolazione di 100.000 persone di età compresa tra i 50 e gli 80 anni, facendo una proiezione su un periodo di tempo di 10 anni. Le conclusioni sono state che se noi assumessimo come valore soglia una dimensione minima del polipo di 6 mm, la CV sarebbe più costo-efficace della colonscopia ottica. Questo è possibile in quanto i polipi di dimensioni <5 mm non hanno nessun particolare significato clinico, poiché solo meno dell’1% rappresenta una lesione maligna. In più possiamo considerare che l’accuratezza diagnostica della CV nel rilevamento di lesioni minime potrà aumentare ulteriormente nel futuro21.
Sebbene la colonscopia tradizionale sia considerata il metodo di screening più efficace consentendo di poter asportare le lesioni polipoidi durante la stessa procedura, presenta dei rischi legati all’invasività della metodica, come la perforazione (nel 0,1%-0,2% dei casi)17 e il sanguinamento post-polipectomia. Inoltre, è una procedura operatore-dipendente, i cui risultati sono spesso inficiati dalla scarsa compliance dei pazienti, legata al dolore, al disagio, e alla preparazione intestinale. Per tale motivo l’aderenza a questa metodica in Italia è del 2,8% nel Sud e 12,4% nel Centro-Nord17.
53 Dal canto suo la CV permette la completa visualizzazione del colon senza ostacoli ed è una metodica più sicura rispetto alla colonscopia ottica, con un tasso di perforazione compreso tra 0,06% e 0,08%17. Le eventuali complicazioni nella maggior parte dei casi sono dovute a fattori tecnici quali la distensione colica (ora minimizzati dall’uso di insufflatori elettronici che monitorizzano pressione e volume), l’utilizzo di cateteri rigidi per l’insufflazione (ora sostituiti da dispositivi flessibili e sottili) e il personale sanitario non specializzato17. L’inconveniente principale è rappresentato dall’esposizione a radiazioni ionizzanti, anche se oggi l’impiego di protocolli a basse dosi garantisce una maggiore sicurezza in termini di radioprotezione17.
Un altro punto cruciale riguarda il rilevamento di reperti extra-colici durante l’esecuzione dell’esame, permettendo così di ottenere informazioni non solo su una precisa localizzazione topografica e una corretta valutazione dell’estensione del CCR, ma anche su eventuali reperti extra-colici come aneurismi dell’aorta addominale, tumori localizzati nel fegato, nel rene, etc. Questo può migliorare notevolmente l’efficacia della metodica in termini di anni di vita guadagnati come dimostrato da Hassan et al.; ma inevitabilmente ciò può determinare la richiesta di ulteriori esami a completamento diagnostico, causando dei costi aggiuntivi. Tuttavia l’impiego di protocolli a bassa dose riduce il rilevamento dei reperti extra-colici, e conseguentemente solo i reperti degni di nota verranno segnalati con una riduzione dei costi che ne derivano22.
Rispetto alla colonscopia tradizionale, la CV ha dimostrato da subito una buona compliance da parte dei pazienti17, poiché è un esame non invasivo, scarsamente fastidioso per il paziente, che richiede una preparazione intestinale più tollerabile e
54 con costi indiretti sostanzialmente inferiori rispetto a quelli della colonscopia ottica. Nella nostra Unità Operativa abbiamo constatato un aumento annuale di circa il 10-15% dei pazienti che si sottopongono all’esame. Tale percentuale potrebbe ulteriormente aumentare nei prossimi anni grazie ad una maggiore sensibilizzazione e informazione sulla metodica non solo per i pazienti, ma anche per gli stessi medici di base13. Analisi e studi sull’adesione alle nuove metodiche di screening per il CCR sono ancora in corso e non siamo in possesso di risultati definitivi, tuttavia è importante valutarli in quanto l’accettabilità ad un programma ne aumenta l’efficienza.
55 Fig.21: Confronto tra colonscopia ottica e colonscopia virtuale nella visualizzazione di un polipo intestinale.
Fig.22: Confronto tra colonscopia ottica e colonscopia virtuale nella visualizzazione di un polipo intestinale.
56
7. CONCLUSIONI
La CV non è ancora validata in Italia come metodica di screening per il CCR e i rimborsi attuali non sono in grado di coprire interamente i costi effettivi dell’esame. Per tale motivo occorre una standardizzazione della procedura che consenta di ridurre i costi e rendere la CV più conforme ad un programma di screening del CCR. Un rimborso adeguato rappresenta un fattore chiave per lo sviluppo di questa metodica, soprattutto se consideriamo che non ha un costo molto superiore alla colonscopia tradizionale ed è efficace grazie all’elevata accuratezza diagnostica e una sempre maggiore accettabilità da parte dei pazienti.
57
8. BIBLIOGRAFIA
1. Neri E, Halligan S, Hellström M, et al.; ESGAR CT Colonography Working Group. The second ESGAR consensus statement on CT colonography. Eur Radiol 2012 Sep 15 [Epub ahead of print]
2. Taylor SA, Laghi A, Lefere P, Halligan S, Stoker J. European Society of
Gastrointestinal and Abdominal Radiology (ESGAR): consensus statement on CT colonography. Eur Radiol. 2007 Feb;17(2):575-9.
3. Johnson CD, Chen MH, Toledano AY, Heiken JP, Dachman A, Kuo MD, Menias CO, Siewert B, Cheema JI, Obregon RG, Fidler JL, Zimmerman P, Horton KM, Coakley K, Iyer RB, Hara AK, Halvorsen RA Jr, Casola G, Yee J, Herman BA, Burgart LJ, Limburg PJ. Accuracy of CT colonography for detection of large adenomas and cancers. N Engl J Med. 2008 Sep 18;359(12):1207-17.
4. Regge D, Laudi C, Galatola G, Della Monica P, Bonelli L, Angelelli G, Asnaghi R, Barbaro B, Bartolozzi C, Bielen D, Boni L, Borghi C, Bruzzi P, Cassinis MC, Galia M, Gallo TM, Grasso A, Hassan C, Laghi A, Martina MC, Neri E, Senore C, Simonetti G, Venturini S, Gandini G. Diagnostic accuracy of computed
tomographic colonography for the detection of advanced neoplasia in individuals at increased risk of colorectal cancer. JAMA. 2009 Jun 17;301(23):2453-61.
5. Graser A, Stieber P, Nagel D, Schäfer C, Horst D, Becker CR, Nikolaou K, Lottes A, Geisbüsch S, Kramer H, Wagner AC, Diepolder H, Schirra J, Roth HJ, Seidel D, Göke B, Reiser MF, Kolligs FT. Comparison of CT colonography, colonoscopy, sigmoidoscopy and faecal occult blood tests for the detection of advanced adenoma in an average risk population. Gut. 2009 Feb;58(2):241-8.
58
Giardiello FM, Glick S, Levin TR, Pickhardt P, Rex DK, Thorson A, Winawer SJ; American Cancer Society Colorectal Cancer Advisory Group; US Multi-Society Task Force; American College of Radiology Colon Cancer Committee. Screening and surveillance for the early detection of colorectal cancer and adenomatous polyps, 2008: a joint guideline from the American Cancer Society, the US Multi-Society Task Force on Colorectal Cancer, and the American College of Radiology. CA Cancer J Clin. 2008 May-Jun;58(3):130-60. Epub 2008 Mar 5.
7. McFarland EG, Fletcher JG, Pickhardt P, Dachman A, Yee J, McCollough CH, Macari M, Knechtges P, Zalis M, Barish M, Kim DH, Keysor KJ, Johnson CD; American College of Radiology. ACR Colon Cancer Committee white paper: status of CT colonography 2009. J Am Coll Radiol. 2009 Nov;6(11):756-772.e4.
8. Mang T, Graser A, Schima W, Maier A. CT colonography: techniques, indications, findings. Eur J Radiol. 2007 Mar;61(3):388-99. Epub 2007 Jan 16. Review.
9. Yee J. CT colonography: techniques and applications. Radiol Clin North Am. 2009 Jan;47(1):133-45. Review.
10. Yee J, Rosen MP, Blake MA, Baker ME, Cash BD, Fidler JL, Grant TH, Greene FL, Jones B, Katz DS, Lalani T, Miller FH, Small WC, Sudakoff GS, Warshauer DM. ACR Appropriateness Criteria on colorectal cancer screening. J Am Coll Radiol. 2010 Sep;7(9):670-8.
11. Cash BD. Establishing a CT colonography service. Gastrointest Endosc Clin N Am. 2010 Apr;20(2):379-98. Review.
12. Mang T, Schima W, Brownstone E, Gschwantler M, Tscholakoff D, Weiss W, Uggowitzer MM, Aigner F, Zitt M, Böhm G, Maier A. [Consensus statement of the Austrian Society of Radiology, the Austrian Society of Gastroenterology and Hepatology and the Austrian Society of Surgery on CT colonography (Virtual Colonoscopy)]. Rofo. 2011 Feb;183(2):177-84.
59 13. Cronbach L. J.. Coefficient alpha and the internal structure of tests.
Psychometrika, 1951. 16:3.
14. Graham B, Regehr G, Wright JG. Delphi as a method to establish consensus for diagnostic criteria. J Clin Epidemiol. 2003 Dec;56(12):1150-6.
15. Vakil N. Editorial: consensus guidelines: method or madness? Am J Gastroenterol. 2011 Feb;106(2):225-7; quiz 228.
16. Burling D; International Collaboration for CT colonography Standards. CT colonography standards. Clin Radiol. 2010 Jun;65(6):474-80.
17. Boone D, Halligan S, Frost R, Kay C, Laghi A, Lefere P, Neri E, Stoker J, Taylor SA. CT colonography: who attends training? A survey of participants at educational workshops. Clin Radiol. 2011 Jun;66(6):510-6.
18. Shinners TJ, Pickhardt PJ, Taylor AJ, Jones DA, Olsen CH. Patient-controlled room air insufflation versus automated carbon dioxide delivery for CT colonography. AJR Am J Roentgenol. 2006 Jun;186(6):1491-6.
19. Burling D, Taylor SA, Halligan S, Gartner L, Paliwalla M, Peiris C, Singh L, Bassett P, Bartram C. Automated insufflation of carbon dioxide for MDCT
colonography: distension and patient experience compared with manual insufflation. AJR Am J Roentgenol. 2006 Jan;186(1):96-103.
20. Kim SY, Park SH, Choi EK, Lee SS, Lee KH, Kim JC, Yu CS, Kim HC, Kim AY, Ha HK. Automated carbon dioxide insufflation for CT colonography:
effectiveness of colonic distention in cancer patients with severe luminal narrowing. AJR Am J Roentgenol. 2008 Mar;190(3):698-706.
21. Neri E, Laghi A, Regge D. Re: Colonic perforation during screening CT colonography using automated CO2 insufflation in an asymptomatic adult. Abdom Imaging. 2008 Nov-Dec;33(6):748-9.
60
Optimizing colonic distention for multi-detector row CT colonography: effect of hyoscine butylbromide and rectal balloon catheter. Radiology. 2003 Oct;229(1):99-108.
23. Rogalla P, Lembcke A, Rückert JC, Hein E, Bollow M, Rogalla NE, Hamm B. Spasmolysis at CT colonography: butyl scopolamine versus glucagon.
Radiology. 2005 Jul;236(1):184-8.
24. Gryspeerdt SS, Herman MJ, Baekelandt MA, van Holsbeeck BG, Lefere PA. Supine/left decubitus scanning: a valuable alternative to supine/prone scanning in CT colonography. Eur Radiol. 2004 May;14(5):768-77.
25. Buchach CM, Kim DH, Pickhardt PJ. Performing an additional decubitus series at CT colonography. Abdom Imaging. 2011 Oct;36(5):538-44.
26. Graser A, Wintersperger BJ, Suess C, Reiser MF, Becker CR. Dose reduction and image quality in MDCT colonography using tube current modulation. AJR Am J Roentgenol. 2006 Sep;187(3):695-701.
27. Liedenbaum MH, Venema HW, Stoker J. Radiation dose in CT
colonography--trends in time and differences between daily practice and screening protocols. Eur Radiol. 2008 Oct;18(10):2222-30.
28. Filippone A, Ambrosini R, Fuschi M, Marinelli T, Genovesi D, Bonomo L. Preoperative T and N staging of colorectal cancer: accuracy of contrast-enhanced multi-detector row CT colonography--initial experience. Radiology. 2004
Apr;231(1):83-90.
29. Mainenti PP, Cirillo LC, Camera L, Persico F, Cantalupo T, Pace L, De Palma GD, Persico G, Salvatore M. Accuracy of single phase contrast enhanced multidetector CT colonography in the preoperative staging of colo-rectal cancer. Eur J Radiol. 2006 Dec;60(3):453-9.
61
Honeyfield L, McQuillan J, Amin H, Dehmeshki J. Polyp detection with CT colonography: primary 3D endoluminal analysis versus primary 2D transverse analysis with computer-assisted reader software. Radiology. 2006 Jun;239(3):759-67.
31. Neri E, Vannozzi F, Vagli P, Bardine A, Bartolozzi C. Time efficiency of CT colonography: 2D vs 3D visualization. Comput Med Imaging Graph. 2006 Apr;30(3):175-80. Epub 2006 May 26.
32. Mang T, Schaefer-Prokop C, Schima W, Maier A, Schober E, Mueller-Mang C, Weber M, Prokop M. Comparison of axial, coronal, and primary 3D review in MDCT colonography for the detection of small polyps: a phantom study. Eur J Radiol. 2009 Apr;70(1):86-93.
33. Mang T, Kolligs FT, Schaefer C, Reiser MF, Graser A. Comparison of diagnostic accuracy and interpretation times for a standard and an advanced 3D visualisation technique in CT colonography. Eur Radiol. 2011 Mar;21(3):653-62.
34. Lostumbo A, Wanamaker C, Tsai J, Suzuki K, Dachman AH. Comparison of 2D and 3D views for evaluation of flat lesions in CT colonography. Acad Radiol. 2010 Jan;17(1):39-47.
35. Baker ME, Bogoni L, Obuchowski NA, Dass C, Kendzierski RM, Remer EM, Einstein DM, Cathier P, Jerebko A, Lakare S, Blum A, Caroline DF, Macari M. Computer-aided detection of colorectal polyps: can it improve sensitivity of less-experienced readers? Preliminary findings. Radiology. 2007 Oct;245(1):140-9.
36. Taylor SA, Burling D, Roddie M, Honeyfield L, McQuillan J, Bassett P, Halligan S. Computer-aided detection for CT colonography: incremental benefit of observer training. Br J Radiol. 2008 Mar;81(963):180-6.
37. Petrick N, Haider M, Summers RM, Yeshwant SC, Brown L, Iuliano EM, Louie A, Choi JR, Pickhardt PJ. CT colonography with computer-aided detection
62
as a second reader: observer performance study. Radiology. 2008 Jan;246(1):148-56.
38. Taylor SA, Charman SC, Lefere P, McFarland EG, Paulson EK, Yee J, Aslam R, Barlow JM, Gupta A, Kim DH, Miller CM, Halligan S. CT colonography: investigation of the optimum reader paradigm by using computer-aided detection software. Radiology. 2008 Feb;246(2):463-71.
39. Regge D, Hassan C, Pickhardt PJ, Laghi A, Zullo A, Kim DH, Iafrate F, Morini S. Impact of computer-aided detection on the cost-effectiveness of CT colonography. Radiology. 2009 Feb;250(2):488-97.
40. de Vries AH, Jensch S, Liedenbaum MH, Florie J, Nio CY, Truyen R, Bipat S, Dekker E, Fockens P, Baak LC, Stoker J. Does a computer-aided detection algorithm in a second read paradigm enhance the performance of experienced computed tomography colonography readers in a population of increased risk? Eur Radiol. 2009 Apr;19(4):941-50.
41. Fisichella VA, Jäderling F, Horvath S, Stotzer PO, Kilander A, Båth M, Hellström M. Computer-aided detection (CAD) as a second reader using
perspective filet view at CT colonography: effect on performance of inexperienced readers. Clin Radiol. 2009 Oct;64(10):972-82.
42. Halligan S, Mallett S, Altman DG, McQuillan J, Proud M, Beddoe G, Honeyfield L, Taylor SA. Incremental benefit of computer-aided detection when used as a second and concurrent reader of CT colonographic data: multiobserver study. Radiology. 2011 Feb;258(2):469-76.
43. Dachman AH, Obuchowski NA, Hoffmeister JW, Hinshaw JL, Frew MI, Winter TC, Van Uitert RL, Periaswamy S, Summers RM, Hillman BJ. Effect of computer-aided detection for CT colonography in a multireader, multicase trial. Radiology. 2010 Sep;256(3):827-35.
63 44. Punwani S, Halligan S, Irving P, Bloom S, Bungay A, Greenhalgh R,
Godbold J, Taylor SA, Altman DG. Measurement of colonic polyps by radiologists and endoscopists: who is most accurate? Eur Radiol. 2008 May;18(5):874-81.
45. Jeong JY, Kim MJ, Kim SS. Manual and automated polyp measurement comparison of CT colonography with optical colonoscopy. Acad Radiol. 2008 Feb;15(2):231-9.
46. Zalis ME, Barish MA, Choi JR, Dachman AH, Fenlon HM, Ferrucci JT, Glick SN, Laghi A, Macari M, McFarland EG, Morrin MM, Pickhardt PJ, Soto J, Yee J; Working Group on Virtual Colonoscopy. CT colonography reporting and data system: a consensus proposal. Radiology. 2005 Jul;236(1):3-9.
47. Kim DH, Pickhardt PJ, Taylor AJ. Characteristics of advanced adenomas detected at CT colonographic screening: implications for appropriate polyp size thresholds for polypectomy versus surveillance. AJR Am J Roentgenol. 2007 Apr;188(4):940-4.
48. Pickhardt PJ, Hassan C, Laghi A, Zullo A, Kim DH, Iafrate F, Morini S. Clinical management of small (6- to 9-mm) polyps detected at screening CT colonography: a cost-effectiveness analysis. AJR Am J Roentgenol. 2008 Nov;191(5):1509-16.
49. Shah JP, Hynan LS, Rockey DC. Management of small polyps detected by screening CT colonography: patient and physician preferences. Am J Med. 2009 Jul;122(7):687.e1-9.
50. Heresbach D, Chauvin P, Hess-Migliorretti A, Riou F, Grolier J, Josselin JM. Cost-effectiveness of colorectal cancer screening with computed tomography colonography according to a polyp size threshold for polypectomy. Eur J
Gastroenterol Hepatol. 2010 Jun;22(6):716-23.
64
C. Patients' preferences about follow-up of medium size polyps detected at screening CT colonography. Abdom Imaging. 2011 Dec;36(6):713-7.
52. Pickhardt PJ, Lee AD, McFarland EG, Taylor AJ. Linear polyp measurement at CT colonography: in vitro and in vivo comparison of
two-dimensional and three-two-dimensional displays. Radiology. 2005 Sep;236(3):872-8.
53. Burling D, Halligan S, Altman DG, Atkin W, Bartram C, Fenlon H, Laghi A, Stoker J, Taylor S, Frost R, Dessey G, De Villiers M, Florie J, Foley S, Honeyfield L, Iannaccone R, Gallo T, Kay C, Lefere P, Lowe A, Mangiapane F, Marrannes J, Neri E, Nieddu G, Nicholson D, O'Hare A, Ori S, Politi B, Poulus M, Regge D, Renaut L, Rudralingham V, Signoretta S, Vagli P, Van der Hulst V, Williams-Butt J. Polyp measurement and size categorisation by CT colonography: effect of
observer experience in a multi-centre setting. Eur Radiol. 2006 Aug;16(8):1737-44.
54. Park SH, Choi EK, Lee SS, Byeon JS, Jo JY, Kim YH, Lee KH, Ha HK, Han JK. Polyp measurement reliability, accuracy, and discrepancy: optical
colonoscopy versus CT colonography with pig colonic specimens. Radiology. 2007 Jul;244(1):157-64.
55. Park SH, Choi EK, Lee SS, Woo JY, Chung SY, Kim YJ, Han JK, Ha HK. Linear polyp measurement at CT colonography: 3D endoluminal measurement with optimized surface-rendering threshold value and automated measurement. Radiology. 2008 Jan;246(1):157-67.
56. Bethea E, Nwawka OK, Dachman AH. Comparison of polyp size and volume at CT colonography: implications for follow-up CT colonography. AJR Am J Roentgenol. 2009 Dec;193(6):1561-7.
57. Pickhardt PJ. Editorial: CTC interpretation by gastroenterologists: feasible but largely impractical, undesirable, and misguided. Am J Gastroenterol. 2009 Dec;104(12):2932-4.