CAPITOLO 2
I
DROLISIA
CIDOC
ATALIZZATA DIB
IOMASSE PER LAS
INTESI DIA
CIDOL
EVULINICOI combustibili fossili sono attualmente le principali fonti energetiche e di carbonio utilizzate per produrre energia e chemicals. Le biomasse, costituite principalmente da materiali lignocellulosici, sono fonti rinnovabili e possono essere utilizzate per gli stessi scopi. La biomassa scelta è fondamentale per valutare positivamente l’economicità del processo di idrolisi. Durante i primi studi di questo tipo l’attenzione era concentrata su fonti pregiate come zuccheri puri (fruttosio, glucosio e saccarosio), amido e cellulosa; successivamente l’attenzione si è spostata, come nel presente lavoro di tesi, verso materie prime di scarso valore come piante di tipo erbaceo e scarti di lavorazioni agroindustriali.
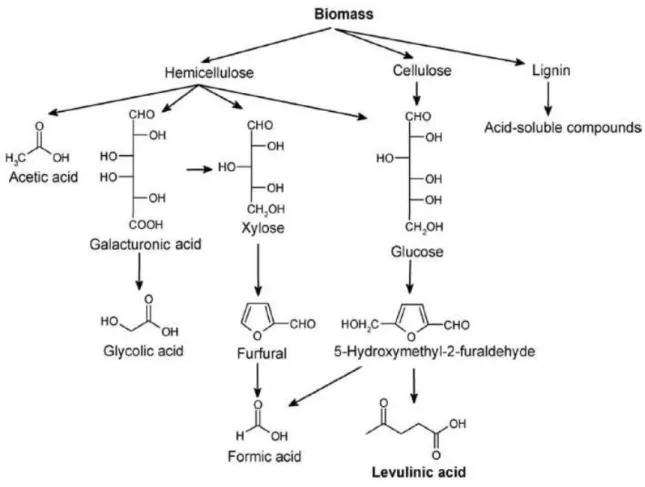
I lavori di ricerca dedicati allo studio delle trasformazioni di biomasse riportati in letteratura si basano su reazioni di idrolisi acido catalizzate in cui le componenti cellulosiche ed emicellulosiche vengono valorizzate convertendole, rispettivamente, in acido levulinico e furfurale (Fig. 1) [1].
2.1 CONVERSIONE DI MATERIALI LIGNOCELLULOSICI IN ACIDO LEVULINICO
È possibile suddividere, schematicamente, il processo globale di conversione di biomassa in acido levulinico e furfurale in due stadi [2]:
1. idrolisi acida della biomassa con depolimerizzazione di cellulosa ed emicellulosa e liberazione dei monomeri costituenti, essenzialmente esosi e pentosi;
2. conversione di glucosio (derivante dalla cellulosa) in acido levulinico e formico; conversione di xilosio (derivante dalla frazione emicellulosica) in furfurale.
I due stadi possono avvenire nello stesso ambiente di reazione o in ambienti di reazione diversi. In ogni caso l’idrolisi della biomassa segue uno schema di reazione complesso che coinvolge vari intermedi e coprodotti: dalle emicellulose si ottengono, tra gli altri, acido galatturonico e acido acetico mentre dalle lignine si ottengono diversi composti solubili lignino - derivati. In particolare i composti derivanti dalle lignine tendono a reagire tra loro formando un residuo nero insolubile costituito essenzialmente da materiali polimerici detti umine. Visto che sottoprodotti uminici si formano anche a partire da glucosio le rese in acido levulinico diminuiscono di circa 1 / 3 rispetto al valore massimo teorico [1].
Il processo globale produce quindi un residuo solido e una soluzione contenente i prodotti di interesse: furfurale ed acido levulinico; tali prodotti sono già richiesti dal marcato, sia per un loro diretto utilizzo come solventi e additivi, che come piattaforme chimiche per produrre fine chemicals di alto valore aggiunto.
Sono riportati (Tab. 1) i prodotti ottenuti mediante specifici processi di depolimerizzazione di alcuni materiali lignocellulosici, rilevati da uno studio condotto in Spagna nel 2004 [3].
L’acido levulinico (o acido 4-oxopentanoico o acido γ-chetovalerico o AL), è un acido grasso a basso peso molecolare con una funzionalità chetonica ed una carbossilica; la presenza contemporanea di questi due gruppi rende la molecola molto polare e solubile nei comuni solventi polari: acqua, esteri, acidi carbossilici, alcoli, aldeidi e chetoni. È miscibile o parzialmente miscibile anche in idrocarburi alifatici e aromatici.
Tabella 2 - Alcune caratteristiche dell'AL.
Il suo utilizzo è ancora limitato a causa degli alti costi dei processi fino ad ora utilizzati per produrlo; tuttavia l’acido levulinico è un interessante intermedio chimico visto che presenta la tipica reattività sia del gruppo carbonilico che del gruppo carbossilico, oltre a quella derivante dall’effetto combinato dei due. Per questo la ricerca sta cercando di sviluppare processi di produzione economicamente vantaggiosi per farne una valida piattaforma chimica [4].
L’AL si può produrre, mediante idrolisi acida, da materiali contenenti esosi secondo la reazione di figura 3.
La reazione prevede un coprodotto, l’acido formico, che limitata la resa teorica massima ponderale in acido levulinico. La resa ponderale massima ottenibile a partire dalla cellulosa è del 71,6 % mentre a partire da un esoso è del 64,5 % [5].
T ebollizione 246 °C T fusione 37 °C Densità 1,14 g / cm3 Pka 4,59 PM 116,11 Figura 2 - Struttura dell'acido levulinico. Figura 3 - Idrolisi acida di cellulosa e reazione di formazione dell'acido levulinico a partire da glucosio.
Esistono molti brevetti riguardanti la produzione di acido levulinico a partire da diverse materie prime. In un tipico processo di conversione ad un solo stadio si invia al reattore una miscela eterogenea contenente la biomassa, l’acido e l’eventuale riciclo; il reattore, tipicamente batch, deve essere resistente all’ambiente acido. Al termine della reazione si separa la fase solida, costituita essenzialmente da lignina, da una soluzione contenente, tra gli altri, acido levulinico e furfurale, che verrà frazionata in una o più colonne.
Il processo di trasformazione di biomassa in acido levulinico può essere realizzato anche in due stadi, mediante due reattori. Nel primo stadio si ha l’idrolisi e la conversione dei polimeri contenenti esosi in HMF ad una temperatura e con un acido minerale (ed una sua quantità) ottimali e specifici per ogni biomassa; nel secondo step, in un secondo reattore che opera in condizioni variabili a temperatura superiore rispetto al precedente, l’HMF si idrata per dare acido levulinico e acido formico.
2.2 IL MECCANISMO DI REAZIONE
Il processo di trasformazione di un materiale contenente lignocellulosa in acido levulinico può essere suddiviso in 3 stadi:
1. idrolisi della cellulosa con formazione di esosi (reazione eterogenea, stadio lento); 2. conversione degli esosi in HMF (reazione omogenea, stadio veloce);
3. conversione di HMF in acido levulinico e acido formico (reazione omogenea, stadio veloce).
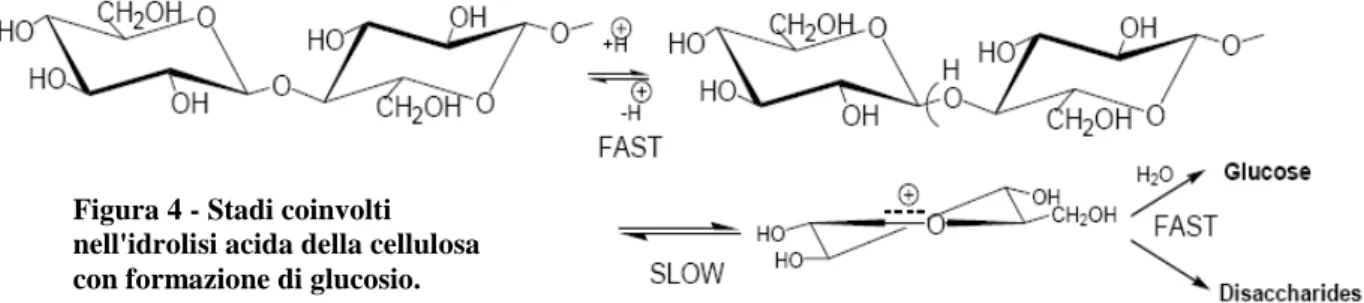
Nella prima fase la cellulosa è depolimerizzata mediante attacco acido al legame glicosidico dell’ossigeno in ambiente acquoso (Fig. 4): la reazione inizia con la rapida addizione di un H+ all’ossigeno glicosidico. La rottura del legame nel glicoside protonato (stadio lento) porta alla formazione di un carbocatione e di glucosio libero, per rapida addizione di acqua [6].
Figura 4 - Stadi coinvolti nell'idrolisi acida della cellulosa con formazione di glucosio.
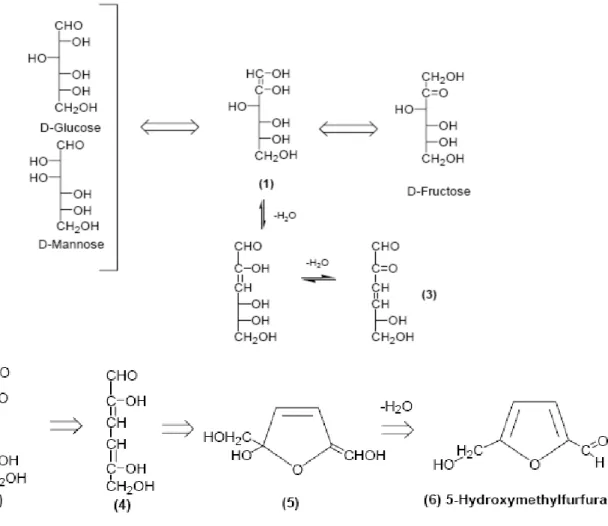
Nella seconda fase (Fig. 5) il glucosio reagisce per formare l’HMF (6). La reazione ha come intermedio fondamentale di isomerizzazione il fruttosio; la sua disidratazione ad HMF, che avviene per perdita di 3 molecole d’acqua, è molto più veloce di quella del glucosio: ogni molecola di fruttosio che si forma si converte rapidamente in HMF. L’ 1,2-enendiolo (4), ottenuto dall’enolizzazione del D-glucosio e del D-fruttosio, è il composto chiave nella formazione dell’HMF [7].
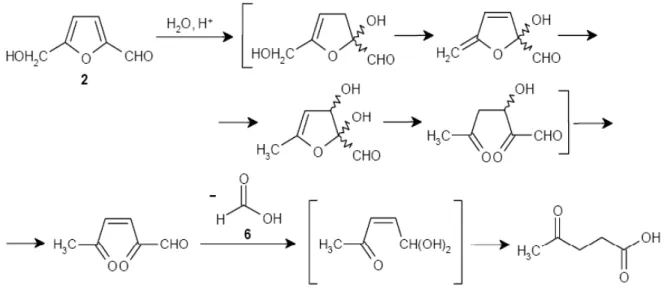
L’idratazione dell’HMF in acido levulinico (Fig. 6), ovvero il terzo stadio, ha un meccanismo non ancora del tutto chiarito; nell’ipotesi meccanicistica più plausibile la reazione inizia con l’addizione di acqua al legame olefinico dell’anello furanico formando un intermedio tricarbonilico instabile che decompone ad acido levulinico e formico.
2.3 LA CINETICA DEL PROCESSO
La cinetica completa della reazione è stata studiata mediante modelli empirici in cui si determinano le rese in acido levulinico in base alle variabili considerate più importanti: temperatura, tempo di reazione, tipo e concentrazione del catalizzatore acido, rapporto solido / liquido e agitazione. Dai dati ottenuti e dalla loro trattazione statistica si evince che due sono i fattori di primaria importanza: la concentrazione di acido e il rapporto tra solido e liquido. L’elaborazione dei dati di lavori che utilizzano feedstocks lignocellulosici è complessa e non è ancora stata del tutto chiarita mentre
in letteratura sono riportati studi cinetici dettagliati sulla reazione di conversione del glucosio in acido levulinico.
Per prima cosa è necessario notare che il D-glucosio, in soluzioni acquose acide, è in equilibrio nelle sue due forme anomeriche, la forma α-D-glucopiranosio e quella β-D-glucopiranosio (Fig. 7).
Figura 6 - Stadi coinvolti nella formazione di AL a partire da HMF.
Queste strutture possono essere coinvolte in una serie di reazioni che portano alla formazione di prodotti di regressione. Tali prodotti consistono in una complessa miscela di dimeri, oligosaccaridi e glicosidi interni generati da reazioni di condensazione intramolecolare (levoglucosano) o intermolecolare (isomaltosio e gentiobiosio). I prodotti di regressione, che sono presenti nella fase iniziale dell’idrolisi, sono assenti quando la conversione del glucosio è praticamente completa. Le concentrazioni massime di questi prodotti nel corso nella reazione sono comunque molto basse (generalmente inferiori allo 0,1% in peso) [1].
2.3.1 Formazione di acido levulinico da glucosio
Il glucosio può decomporre in un’ampia varietà di prodotti insolubili e solubili, tra cui l’HMF, l’acido formico e l’acido levulinico. Per determinare la cinetica di decomposizione è necessario utilizzare un modello semplificato in cui ogni step è considerato come una reazione irreversibile del primo ordine.
Il modello comunemente riportato in letteratura [8] può essere schematizzato come un processo che coinvolge tre stadi (Fig. 8).
Le equazioni cinetiche che descrivono l’andamento delle concentrazioni di glucosio, HMF e acido levulinico, considerando le reazioni 1 e 2 come consecutive, sono:
dove: k = k1 + k3
I coefficienti cinetici sono correlati alla temperatura mediante l’equazione di Arrhenius [12]. L’equazione può essere rimodellata per includere l’effetto della concentrazione dell’acido ottenendo, ad esempio:
dove: a e n sono due costanti del modello; C è la concentrazione di acido. ] [ ] [ glu k dt glu d =− ⋅ − ] [ ] [ ] [ 2 1 glu k HMF k dt HMF d = ⋅ − ] [ ] [ 2 AL k dt AL d = ⋅ RT E n e C a k 1 1 1 1 − ⋅ =
Figura 8 - Rappresentazione del modello cinetico di conversione di glucosio in AL. Umine Levulinico Acido HMF 5 Glucosio 3 2 1 k k k ↓ → − →
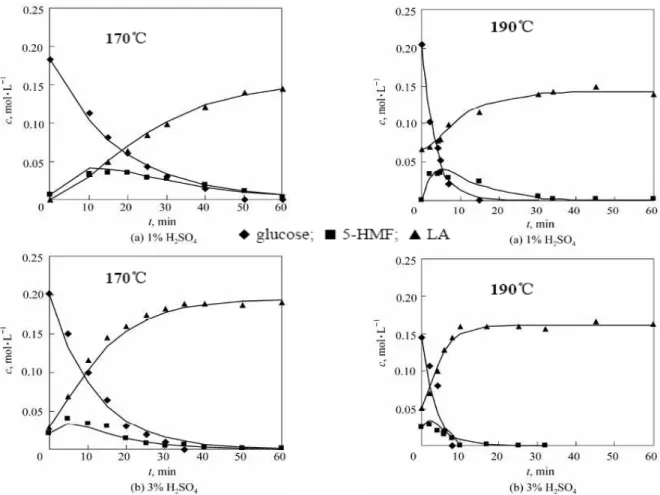
Le reazioni effettuate nello studio sono state condotte a 170, 190 e 210 °C e con una concentrazione di H2SO4 dell’1, 3 e 5 % in peso. È stato dimostrato che la velocità di scomparsa del glucosio aumenta rapidamente con la temperatura; conducendo la reazione a 210 °C con concentrazioni di acido superiori al 3 % si raggiunge la completa conversione di glucosio e HMF in 1,5 minuti. A causa del breve lasso temporale, per il vero e proprio studio cinetico sono state utilizzate le temperature di 170 e 190 °C (Fig. 9).
L’andamento dei trend delle concentrazioni conferma il fatto che le reazioni 1 e 2 sono consecutive e approssimabili ad un andamento cinetico del primo ordine; si dimostra inoltre che temperatura e concentrazione di acido hanno un effetto rilevante sulla velocità di decomposizione del glucosio e sulla formazione di HMF e AL. Le reazioni parallele di decomposizione del glucosio a dare HMF e prodotti uminici sono trattate come due reazione del primo ordine in cui la percentuale di glucosio che si decompone e le costanti cinetiche di entrambe aumentano all’aumentare della concentrazione di acido e / o della temperatura. La velocità delle due reazioni, nelle diverse condizioni oggetto dello studio, è paragonabile: questo rende impossibile raggiungere la resa massima teorica in acido levulinico.
Figura 9 - Andamento temporale, a concentrazioni di acido e temperature diverse, delle concentrazioni di glucosio, HMF e LA.
Il meccanismo che porta alla formazione dell’HMF è molto complicato e prevede la formazione di molti intermedi non identificati; comunque la formazione di HMF può essere trattata come una serie di reazioni consecutive del primo ordine. Aumentando la concentrazione di acido a temperatura costante o aumentando la temperatura a concentrazione di acido costante, k1 aumenta. Questo andamento però non rispecchia l’andamento della concentrazione di HMF, visto che questa diminuisce all’aumentare della temperatura e / o all’aumentare della concentrazione di acido [9].
Nello studio in esame la massima resa in acido levulinico (80,7 % della resa massima teorica) è stata ottenuta a 170 °C utilizzando il 5 % in peso di acido.
2.3.2 Formazione di acido levulinico da glucani
La cinetica di idrolisi degli 1,4-β-glucani è stata studiata sia a temperature prossime a quella ambiente che ad alte temperature (190°C). Vari autori hanno prodotto modelli, più o meno semplificati, per descrivere la reazione di idrolisi della cellulosa pura.
Gli studi condotti da Freudenberg e altri [10] a basse temperature hanno dimostrato che la velocità di idrolisi, utilizzando H2SO4 al 50 % in peso, diminuisce significativamente all’aumentare del grado di polimerizzazione del glucano mentre studiando la reattività della cellulosa all’idrolisi acida tra 40 e 50 °C è stata determinata l’energia di attivazione che durante la reazione varia tra 102 e 147 kJ/mol.
Nei suoi studi Saeman [11] ha definito un modello cinetico in cui la degradazione della cellulosa con acidi diluiti (0,2-2% in peso di acido) a 170 - 190° è suddivisa in 2 reazioni omogenee:
Cellulosa → Glucosio Glucosio → Prodotti
Secondo questo modello l’idrolisi dei legami glicosidici della cellulosa segue una cinetica del primo ordine rispetto alla concentrazione di H+; l’energia di attivazione associata alla reazione è valutata 179 kJ/mol.
La presenza di domini cristallini e amorfi presenti naturalmente nelle fibre di cellulosa ha un forte effetto sulla cinetica di reazione. L’idrolisi e la depolimerizzazione nei domini amorfi è molto più rapida di quella nei domini cristallini.
L’aspetto fondamentale da tenere presente è che questo modello considera la reazione come omogenea mentre è chiaramente eterogenea, almeno all’inizio. Ci sono altri fattori fisici,
come il grado di cristallinità e il grado di disgregazione della biomassa, che possono influenzare il processo complessivo tanto che la cinetica di idrolisi della cellulosa in fase eterogenea è due volte più lenta dell’idrolisi omogenea dei composti di riferimento.
In successivi studi [12] sono stati sviluppati modelli più precisi che considerano la presenza della fase amorfa della cellulosa e dei prodotti di regressione: parte della cellulosa si converte in oligomeri, generalmente insolubili, non convertibili in glucosio. Tuttavia è difficile correlare questi fattori a quelli che definiscono generalmente l’eterogeneità di un processo: il tipo di solvente utilizzato, per esempio, contribuisce in maniera più o meno forte a disgregare il polimero rendendolo più o meno disponibile all’attacco acido.
Quando si contestualizza la reazione di idrolisi della cellulosa pura, mettendola in relazione alla biomassa lignocellulosica nel suo complesso, diventa praticamente impossibile definire un modello cinetico preciso, anche per quanto riguarda la sola componente cellulosica, a causa sia delle interazioni esistenti tra le tre componenti della biomassa che delle diverse interazioni esistenti in vari tipi di biomassa.
2.4 STATO DELL’ARTE: PROCESSI DI CONVERSIONE AD AL RIPORTATI IN LETTERATURA
Analizzando la letteratura disponibile si nota che la degradazione acido catalizzata di esosi a dare acido levulinico è condotta in processi batch che utilizzano due differenti approcci: acidi minerali in alte concentrazioni a basse temperature o acidi minerali diluiti ad alte temperature. Il primo approccio prevede l’impiego di acidi minerali in alte concentrazioni (15 - 16 N di HCl o 31 - 70 % in peso di H2SO4) a basse temperature, fino a 50 °C. Il problema principale di questo processo è il recupero dell’acido utilizzato (che viene riciclato ma in parte comunque deve essere neutralizzato e smaltito) ed il grande costo del materiale utilizzato per la costruzione del reattore e del sistema di recupero dell’acido: sono necessarie leghe speciali che devono avere grande resistenza alla corrosione [13].
Il secondo approccio impiega come catalizzatore un acido minerale diluito (HCl, H2SO4, HBr, H3PO4) a elevate temperature di processo (170 - 240 °C). In questo caso i problemi di corrosione e recupero del catalizzatore omogeneo utilizzato permangono ma sono sicuramente meno rilevanti [14]. Sono stati studiati anche catalizzatori acidi eterogenei (resine e zeoliti).
In tabella 3 sono riassunti i principali processi di conversione riportati in letteratura.
Tabella 3 - Processi di conversione di biomassa ad acido levulinico.
Biomassa C0 a Acido Cacido (% w/w) T (°C) t (h) Resa % ALb Rif. Segatura di legno 20 HCl 1,5 190 0,5 9 [31] Legno di pino/abete 10 - 20 H2SO4 5 200 - 240 2 - 4 13 - 18 [38] Legno di pioppo 10 H2SO4 1 - 5 150 - 250 2 - 7 < 15,5 [39] Legno di pioppo 10 HCl 1 - 5 150 - 250 2 - 7 < 12,4 [39] Legno di pioppo 10 HBr 1 - 5 150 - 250 2 - 7 < 13 [39] Chicchi di sorgo 10 H2SO4 8 200 0,67 32,6 [41] Canna da zucchero 28 HCl 18 100 24 15 [19] Glucosio 29 HCl 6,5 162 1 24 [21] Glucosio 10 HCl 6 160 0,25 41,4 [29] Glucosio 32 HCl 20 T. R.c 24 15 [20] Glucosio 5 - 20 H2SO4 0,1 - 4 160 - 240 f (T) d 35,4 [28] Glucosio 27 Amberlite IR 120 19 T. R.c 124 5,8 [27]
Glucosio 12 Cataliz. Clay 3 150 24 12 [36]
Glucosio 12 Zeolite HY 3 150 24 6 [37] Saccarosio 29 HCl 6,5 162 1 29 [21] Saccarosio 6 HCl 9,7 125 16 43 [26] Saccarosio 6 HBr 9 125 16 50 [26] Saccarosio 6 H2SO4 9 125 16 30 [26] Saccarosio 27 Amberlite IR 120 19 T. R.c 41 15,6 [27]
Saccarosio 20 Resina Dowex 6,25 100 24 17 [34]
Fruttosio 29 HCl 6,5 162 1 25 [21]
Fruttosio 4,5 - 18 HCl 2 - 7,5 100 24 52 [33]
Fruttosio 27 Amberlite IR 120 19 T. R.c 27 23,5 [27]
Fruttosio 50 Zeolite LZY 50 150 15 43,2 [35]
Amido 26,5 HCl 5,2 T. R.c 24 19 [24] Amido di mais 29 HCl 6,5 162 1 26 [21] Amido di mais 33 HCl 1,8 200 0,5 35 [23] Liquore di amido di mais 42 HCl 7,4 T. R. c 22 25 [22] Riso 14 HCl 1 160 3 10,3 [25] Paglia di riso 14 HCl 1 160 3 5,5 [25] Cotone 14 HCl 1 160 3 7,4 [25] Steli di cotone n. d.e H2SO4 5 180 - 190 2 6,13 [30] Bagassa 9 H2SO4 1,3 25 - 195 2 17,5 [32] Estruso di paglia 25 H2SO4 4 200 0,67 47,5 [42] Carta di giornale 30 H2SO4 10 150 8 12,8 [40] Cellulosa 10 H2SO4 1 - 5 150 - 250 2 - 7 < 25,2 [39] Cellulosa 10 H2SO4 3 250 2 25,2 [38]
a
= Co è la concentrazione iniziale dell’alimentazione definita come il rapporto tra la massa della biomassa utilizzata e la massa totale dell’alimentazione;
b = la resa percentuale in AL espressa come rapporto tra la massa di AL ottenuta e la massa dell’alimentazione; c = temperatura di riflusso;
d = tempo in funzione della temperatura; e
= dato non disponibile;
f = resa riferita ad una certa % della massima resa teorica ottenibile g = % in peso.
La sintesi di acido levulinico da carboidrati mediante l’uso di catalizzatori acidi minerali è conosciuta fin del 1840: Mulder e altri hanno realizzato la sintesi su scala laboratorio ottenendo il coprodotto acido formico e gli altri sottoprodotti tipici della reazione [43].
Uno dei primi studi dettagliati sulla sintesi dell’acido levulinico prodotto a partire da glucosio risale al 1930 [20]; nel lavoro si nota che le rese in acido levulinico sono apprezzabili solo a temperature superiori a 110 °C perché a temperature inferiori la trasformazione degli esosi in acido levulinico è cineticamente molto lenta e in soluzione rimangono rilevanti quantità dell’intermedio di sintesi HMF. Negli esperimenti condotti a partire da glucosio è stata ottenuta una resa massima in acido levulinico del 15 % in peso rispetto al glucosio alimentato. La reazione è stata condotta in condizioni di riflusso per 24 h in presenza di HCl al 25 % in peso; quando la quantità di prodotti uminici formati era rilevante questi venivano allontanati tramite filtrazione. Al termine della reazione, mediante distillazione a 125 °C e pressione atmosferica, veniva recuperata la soluzione catalitica acquosa; mediante distillazione a pressione ridotta viene successivamente purificato l’acido levulinico.
In un successivo lavoro del 1931 [21] i substrati utilizzati per la sintesi dell’acido levulinico in catalisi acida sono stati galattosio e saccarosio. Trattando per 1 h a 162 °C il saccarosio è stata ottenuta una resa in acido levulinico del 42 % in peso rispetto al substrato alimentato.
Biomassa C0 a Acido Cacido (% w/w) T (°C) t (h) Resa % ALb Rif. Cellulosa 10 HCl 1 - 5 150 - 250 2 - 7 < 28,8 [39] Cellulosa 10 HBr 1 - 5 150 - 250 2 - 7 < 26,9 [39] Saccarosio 3 HsSO4 1 - 5 100 - 125 0,25 79 f [44] Cellulosa 10 CaSO4 n. d. e 250 4 18,4 [38] Glucosio n. d.e MFI (ZRP-30) 50 180 4 35,8 [46]
Cellulosa 10 TiO2 solfatato 7 240 0,25 27,2 [47]
Paglia di riso 6,5 SO4 -2 / Fe2O3 Al2O3 13,3 200 0,20 70 f [48] Saccarosio 16 Nafion-NR50 7 240 0,25 27,2 [53] Alghe marine 4,7 H2SO4 3 160 0,67 19,5 [54] Paglia di riso 10 H2SO4 6 220 0,6 28,4 [55]
Il lavoro di Moyer [23] è il primo in cui si produce acido levulinico a partire da biomassa (amido di mais); questa è sottoposta ad un pretrattamento a 100 °C in presenza di una soluzione di HCl per migliorare l’accessibilità delle componenti della biomassa al successivo attacco acido ad alte temperature. Nel secondo stadio, utilizzando HCl (1,8 % in peso) e operando a 175 - 215 °C, sotto agitazione e in presenza di vapore sotto pressione, sono state ottenute rese in acido levulinico del 35 % in peso (rispetto all’amido alimentato) in 30 minuti; viste le alte temperature di reazione è inevitabile e notevole la formazione di prodotti uminici. Il processo, messo a punto su scala laboratorio, prevedeva anche gli stadi di purificazione del prodotto (Fig. 10).
Nel lavoro di Wiggins [26] è stato sintetizzato l’acido levulinico a partire da saccarosio. Conducendo la reazione nelle stesse condizioni sperimentali, ma variando la concentrazione di substrato, Wiggins dimostrò che la concentrazione di saccarosio era un fattore critico visto che le rese più alte furono ottenute con soluzioni diluite; inoltre, conducendo la reazione nelle stesse condizioni sperimentali (T = 125 °C, t = 16 min e concentrazioni di acido del 9 % in peso circa) ma variando il catalizzatore acido dimostrò che l’efficacia di vari acidi minerali era diversa ed in particolare era nell’ordine: HBr > HCl > H2SO4.
In uno studio del 1966 [31] è stato invece realizzato un processo su scala laboratorio che utilizzava segatura di legno per produrre acido levulinico (resa del 9 % in peso rispetto alla biomassa alimentata); la biomassa veniva pretrattata a 80 - 110 °C in presenza della soluzione acquosa catalitica (fresca e di riciclo) e di una parte della miscela reagita e filtrata; l’alimentazione così ottenuta veniva inviata al reattore di idrolisi che operava a 170 - 210 °C, in presenza di vapore sotto pressione utilizzando HCl diluito (1,5 % in peso). Il tempo di
residenza era di circa 30 minuti. Il processo viene completato dalle unità di recupero e purificazione dell’acido levulinico.
In un lavoro del 1985 [44] sono riportate buone rese in acido levulinico, a partire da soluzioni di saccarosio al 3 % in peso, utilizzando H2SO4 (resa pari al 79 % della massima resa teorica ottenibile) piuttosto che HCl.
Nel 1987 nel reparto di ingegneria chimica dell’Università del Michigan viene elaborato uno studio [35] che permette di convertire il D-fruttosio in acido levulinico mediante un catalizzatore solido: la zeolite LZY; nel reattore, che opera a 140 °C, il tempo di reazione è stato variato da 0,5 a 15 ore. L’analisi HPLC dei prodotti ha rilevato che la resa massima in acido (0,432 g per grammo di fruttosio) si ottiene dopo 15 ore. L’attività acida di questo tipo di catalizzatore è dovuta ai siti acidi di Lewis presenti nelle nanocavità della zeolite. Come è dettagliatamente spiegato nel capitolo 4 del presente lavoro di tesi, utilizzare un catalizzatore eterogeneo in sostituzione di uno omogeneo, comporta numerosi vantaggi: il catalizzatore può facilmente essere separato dalla miscela reagita (e poi rigenerato e ricilato), i problemi di corrosione delle apparecchiature sono abbattuti e con essi i costi di esercizio dell’impianto stesso. Purtroppo l’acido eterogeneo si dimostra idoneo sostanzialmente per i substrati solubili o comunque molto accessibili.
Nei lavori di Lourvanij e Rorrer del 1994 [36] e 1997 [37] sono stati testati altri catalizzatori solidi per convertire glucosio in acido levulinico. Lavorando a 150 °C per 24 ore sono state ottenute rese del 12 % in peso rispetto alla biomassa di partenza utilizzando Fe-Montmorillonite e del 6 % in peso utilizzando la zeolite HY. Come si può vedere dalla tabella 3, utilizzare catalizzatori solidi per convertire anche substrati semplici come il glucosio, produce rese minori rispetto ai catalizzatori acidi minerali normalmente utilizzati.
Nel 1996 [45] è stata studiata la possibilità di utilizzare soluzioni acquose di acidi minerali e dei loro rispettivi sali nel tentativo di aumentare le rese in acido levulinico ottenute a partire da cellulosa; le rese sono state incrementate, al massimo, del 19 %. Visti i buoni risultati ottenuti nel 1998 [38] è stata valutata la possibilità di condurre la reazione di idrolisi di cellulosa e alcuni tipi di legno (abete, pino, faggio) in presenza di sali. In particolare, conducendo la reazione a 230 - 240 °C per 4 ore ed in presenza di H2SO4 al 3 - 4 % in peso, sono state ottenute rese in acido levulinico, a partire da cellulosa del 35,1 %, a partire dai diversi tipi di legno del 16 - 18 %. Conducendo la reazione di idrolisi della cellulosa a 250 °C, in presenza di H2SO4 sono state ottenute rese in acido levulinico del 25,2 %, in presenza di Fe(SO4)2 sono state ottenute rese del 4,7 % mentre usando Al2(SO4)3 sono state ottenute rese del 18,4 %.
In uno studio del 2000 [40] è stato messo a punto un metodo di produzione di acido levulinico e furfurale, mediante idrolisi acida, da vari materiali vegetali. La biomassa viene miscelata e preidrolizzata, a 40 °C per 90 min, con una soluzione acquosa di acido al 10 - 30 % in peso (rispetto agli acidi testati quello solforico, a parità di concentrazione, permette di ottenere le rese più alte); la biomassa deve costituire il 20 - 40 % in peso dell’alimentazione così ottenuta. Successivamente questa è trattata a 110 - 160 °C per 2 - 10 h per idrolizzare le componenti della biomassa e produrre acido levulinico e furfurale. La miscela reagita viene filtrata per allontanare il solido e purificata per ottenere acido levulinico. La resa massima in acido levulinico ottenuta a partire da carta di giornale (contenuto di cellulosa dell’85%) è stata del 12,8 %. Le prestazioni rivendicate in questo brevetto hanno punti di debolezza nei lunghi tempi globali di reazione richiesti per conseguire rese non elevate, nonostante la biomassa di partenza abbia un elevato contenuto di cellulosa.
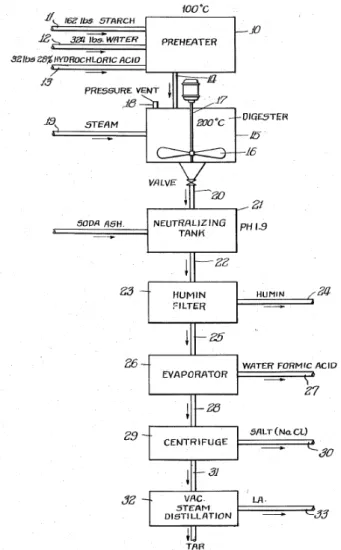
In uno studio del 2002 [41] i chicchi di sorgo (contenuto di amido del 74 %) vengono sottoposti a idrolisi acida, a temperature
comprese tra 160 e 200 °C, con soluzioni acquose di H2SO4 al 2, 5 e 8 % in peso. La resa massima in acido levulinico, 32,6 % in peso rispetto alla biomassa alimentata, è stata ottenuta trattando la biomassa per 40 minuti a 200 °C utilizzando H2SO4 all’8 % in peso; il carico ottimale di biomassa nell’alimentazione è del 10 % in peso (Fig. 11). A parità delle altre condizioni di reazione, aumentando le concentrazioni di acido o la temperatura, sono state incrementate le rese in acido levulinico; al contrario, aumentando la percentuale di
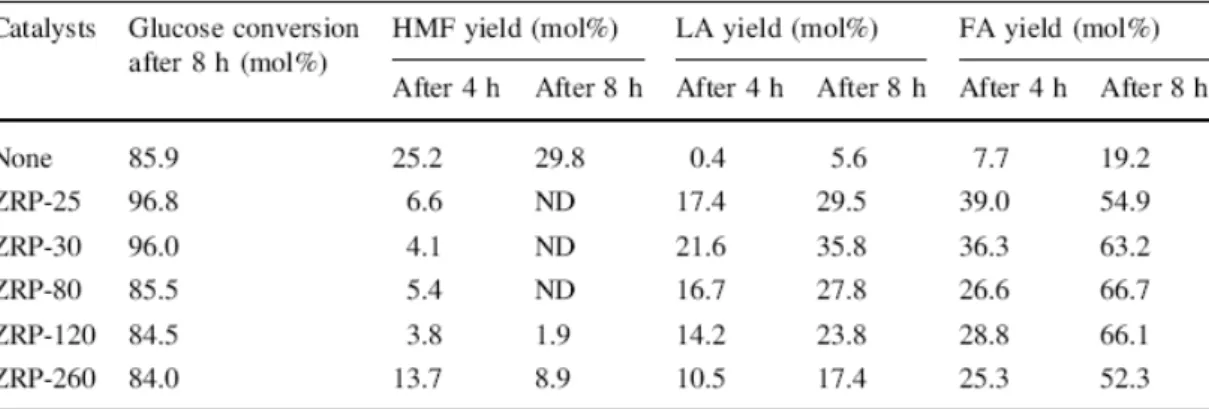
biomassa nell’alimentazione sono state ottenute rese in acido levulinico minori (Fig. 11). In uno studio del 2010 [46] è stata esaminata la possibilità di condurre la reazione di conversione del glucosio in acido levulinico utilizzando catalizzatori solidi, ed in particolare zeoliti del tipo MFI con diverso rapporto Si / Al, in condizioni moderate. Prima di essere utilizzate le zeoliti testate sono state calcinate a 823 K per 4 ore. In particolare, 400 ml di una soluzione contenente 4 g di glucosio e 3 g di zeolite sono trattati in autoclave, a 453 K e 1,7 MPa, sotto agitazione per 8 h. Nel lavoro è stato valutato l’andamento della reazione
Figura 11 - Rese in AL in funzione della percentuale di biomassa nell'alimentazione e della concentrazione di acido solforico.
effettuando prelievi ogni ora. A parità delle altre condizioni di reazione, le rese in acido levulinico aumentano al diminuire del rapporto Si / Al nella zeolite (Fig. 12). La resa massima in acido levulinico (35,8 % in peso rispetto al glucosio utilizzato) si ottiene con la zeolite ZRP-30 (rapporto Si / Al = 30).
Nel 2007 è stato riportato un lavoro di ricerca in cui viene impiegata come materia prima la paglia di frumento macinata (contenuto di cellulosa del 40,4 %). Nelle condizioni ottimali di reazione (concentrazione della biomassa nell’alimentazione 6,4 % in peso, 3,5 % in peso di H2SO4, temperatura di reazione 209 °C, tempo di residenza 37 minuti) gli autori rivendicano una resa ponderale del 19,8 % (corrispondente al 68,8 % della resa massima teorica ottenibile).
In uno studio del gennaio 2010 [47] è stata valutata la possibilità di utilizzare catalizzatori acidi solidi per la produzione di AL a partire da cellulosa; il catalizzatore utilizzato, TiO2 solfatato, è un catalizzatore preparato appositamente per precipitazione / impregnazione in presenza di acido solforico. Le condizioni ottimali per ottenere le maggiori rese in acido levulinico (27,2 % sul solido secco utilizzato) sono l’utilizzo di una temperatura di 240 °C e di 0,7 g di TiO2 solfato per un tempo di reazione di 15 minuti. Le prove di riciclo del catalizzatore indicano una sua sensibile perdita di attività catalitica dopo essere stato utilizzato 2 volte.
In uno studio del 2010 [48] è stato testato l’utilizzo di catalizzatori acidi solidi solfatati, del tipo SO42- / Fe2O3 - Al2O3 - SiO2 (anche in questo caso catalizzatori preparati per precipitazione / impregnazione in presenza di acido solforico), per la conversione di paglia di riso, sottoposta a steam explosion, ad acido levulinico. I risultati hanno rivelato che questo catalizzatore potrebbe sostituire i classici catalizzatori omogenei normalmente utilizzati in
questo particolare tipo di processo; la steam explosion migliora infatti l’accessibilità della cellulosa presente nella biomassa reagente. Nelle condizioni di reazione ottimali (200 °C, 13,3 % in peso di acido solido e rapporto solido / liquido 1 / 15) sono state ottenute, in soli 10 minuti, rese in acido levulinico pari al 70 % della massima resa teorica ottenibile.
Un lavoro molto interessante è stato proposto da Jeong nel 2010 [54]: è stata studiata la conversione di alghe marine, mediante catalisi acida, in zuccheri (glucosio e galattosio) ed acido levulinico. Dal particolare tipo di alga utilizzata come biomassa (Gelidium amansii), nelle condizioni ottimali di reazione per la sintesi dell’acido levulinico, mediante trattamento con acido solforico al 3 % in peso a 160 °C per 43 minuti, è stata ottenuta una resa massima in AL del 28,4 % in peso rispetto alla biomassa utilizzata. L’impiego di questo tipo di risorsa apre l’orizzonte all’utilizzo di specie vegetali, non solo terrestri, ma anche marine.
Dalle ultime pubblicazioni è chiaro che si sta cercando di sviluppare catalizzatori solidi, soprattutto zeoliti, in grado di sostituire i catalizzatori acidi minerali, che operano in fase omogenea, comunemente utilizzati; tuttavia questi catalizzatori, nonostante forniscano discreti risultati per la conversioni catalitica di substrati semplici (esosi e pentosi puri o cellulosa pura), difficilmente potranno fornire risultati simili per la conversione delle complesse matrici lignocellulosiche insolubili.
2.4.1 Processi di conversione sviluppati nell’Università di Pisa
Nel lavoro di V. De Luise (2008 - 2010) [15] è stata valutata la produzione, in autoclave, di acido levulinico da biomasse di scarto (polvere di costole di tabacco, fanghi di cartiera e scorze di limone) e da colture dedicate (Arundo Donax Linnaeus, Miscanthus X Giganteus e Pioppo) mediante idrolisi acida in presenza di H2SO4, HCl e di sali.
Nelle condizioni ottimali di reazione per il trattamento della polvere di costole di tabacco, in presenza di H2SO4 0,25 M (1,75 g di biomassa, 24 ml di H2O, pressione 30 atm, temperatura 200 °C, tempi di residenza 30 minuti) è stata ottenuta una resa in acido levulinico del 3 % in peso rispetto alla biomassa utilizzata (corrispondente al 12 % di resa rispetto al contenuto di cellulosa e al 16,9 % della massima resa teorica ottenibile). Aumentando la concentrazione dell’acido in soluzione fino a 1 M è stata incrementata la resa al 5,1 % in peso rispetto alla biomassa di partenza. Questa è stata trattata, nelle stesse condizioni di reazione, anche con HCl 0,5 M ottenendo una resa in AL del 5,2 %. È quindi possibile sostituire l’acido solforico
con l’acido cloridrico, anche in concentrazioni minori, senza variare le rese in acido levulinico.
È stato dimostrato che conducendo la reazione in presenza di HCl 0,5 M e sali quali NaCl e LiCl (0,25 M) si aumentano le rese ottenute, rispettivamente, al 7,4 e 8 % in peso. La biomassa, inoltre, prima di essere trattata nelle stesse condizioni con la soluzione catalitica di HCl e sali ad alte temperature, è stata sottoposta ad un pretrattamento idrotermale di 2 ore a temperature di 80 - 120 °C; effettuare il pretrattamento a 120 °C ha permesso di incrementare la resa in acido levulinico al 15 % in peso. Il pretrattamento degrada il materiale lignocellulosico rendendo la cellulosa più disponibile all’attacco acido.
Dopo un pretrattamento di 2 h a 120 °C, nelle condizioni ottimali per il trattamento dei fanghi di cartiera (1 g di biomassa, 36 ml di H2O, HCl 1 M, NaCl 0,25 M, pressione 30 atm, temperatura 200 °C, tempi di reazione 30 min), è stata ottenuta una resa in acido levulinico del 33 % in peso rispetto alla biomassa utilizzata. È necessario tenere presente che i fanghi di cartiera contengono il 57 % circa di cellulosa mentre le costole di tabacco ne contengono solo il 25 %. È stato dimostrato che è possibile valorizzare scarti, di industrie peraltro molto diffuse, realizzandone la depolimerizzazione e conversione ad acido levulinico mediante HCl. Sottoponendo 2,5 g di pioppo ad un pretrattamento (2 h ad una temperatura di 80 °C) ed a un successivo stadio di reazione in condizioni ottimali per 60 minuti (36 ml di H2O, HCl 0,5 M, NaCl 0,25 M, temperatura 200 °C, pressione 30 atm) sono state ottenute rese in AL del 22,3 % in peso. Operando nelle stesse condizioni di reazione ma aumentando la concentrazione di HCl a 1,3 M sono state ottenute rese in AL del 30 %.
Utilizzando come feedstock il miscanto (1,3 g in 36 ml di acqua), dopo un pretrattamento di 2 h ad una temperatura di 80 °C, nelle condizioni ottimali di reazione (HCl 1,3 M, NaCl 0,25 M, temperatura 190 °C, pressione 30 atm, tempo di reazione 1 h) è stata ottenuta una resa in AL del 18 % in peso. Mantenendo inalterate le condizioni di reazione appena descritte, ma effettuando il pretrattamento della biomassa mediante steam explosion, è possibile incrementare le rese ottenute fino al 25 % in peso.
Utilizzando come feedstock l’arundo (2,5 g in 36 ml di H2O), dopo un pretrattamento di 2 h ad una temperatura di 80 °C, nelle stesse condizioni ottimali di reazione del miscanto (HCl 1,3 M, NaCl 0,25 M, temperatura 190 °C, pressione 30 atm, tempo di reazione 1 h) è stata ottenuta una resa in AL del 22,2 % in peso. È necessario tenere presente che il contenuto di cellulosa nel pioppo è del 57,8 % in peso mentre nell’arundo è del 36,6 %; nonostante questa rilevante differenza, nelle stesse condizioni di reazione, le rese in acido levulinico sono paragonabili.
Il rilevante incremento della resa ponderale percentuale in acido levulinico ottenuto conducendo la reazione su una particolare biomassa in analoghe condizioni di reazione, ma aggiungendo dei sali all’alimentazione, può essere spiegato con la teoria di Donnan applicata all’idrolisi della cellulosa condotta in acidi diluiti [59]. Il primo stadio della conversione di un materiale contenente cellulosa in acido levulinico consiste nella sua depolimerizzazione a glucosio; questo è lo stadio lento dell’intero processo. Nel secondo stadio, infatti, il glucosio in soluzione si converte rapidamente in acido levulinico e acido formico. Lo stadio lento può essere velocizzato con l’aggiunta di un elettrolita neutro, un sale (“salt effect”) che aumenta la bagnabilità della cellulosa [58]. La teoria di Donnan afferma che la differenza di concentrazione tra ioni H+ posti ai due lati di una membrana può essere ridotta aggiungendo un elettrolita neutro.
Nel primo stadio del processo, la parte amorfa della cellulosa si depolimerizza rapidamente mentre la parte cristallina, meno accessibile e più resistente all’attacco acido, si idrolizza lentamente. Questo significa che nelle soluzione acquosa e nella parte amorfa della cellulosa la concentrazioni di H+ è maggiore che nelle cellulosa cristallina. Nel lavoro è stato dimostrato che l’aggiunta di un elettrolita incrementa la concentrazione di H+ nella cellulosa cristallina e quindi aumenta la possibilità che lo ione possa protonare l’ossigeno glicosidico e dare inizio all’idrolisi della cellulosa.
Nel lavoro svolto nel gruppo di ricerca [16] sono state ottimizzate le condizioni di idrolisi, sia mediante riscaldamento tradizionale in autoclave che mediante riscaldamento a microonde (MW), per la produzione di furfurale e acido levulinico a partire da arundo, miscanto e sorgo; è anche stata considerata la valorizzazione delle frazione ligninica solida residua al trattamento acido.
Un’alimentazione costituita da 1,75 g d’arundo (contenuto di cellulosa del 36,6 %), 0,95 ml di HCl al 37 % w/w e 24 g di acqua, è stata sottoposta alla depolimerizzazione in autoclave a 170 °C e 30 atm; è stata ottenuta una resa in acido levulinico dell’8,6 % in peso (corrispondente al 29 % della massima resa teorica ottenibile). Sottoponendo il feedstock ad un pretrattamento idrotermale (80 °C per 120 min) è stata aumentata la resa al 18,3 % in peso; se tutto il processo è condotto in presenza di 0,35 g di NaCl la resa ottenuta è stata ulteriormente aumentata al 20,6 % in peso.
La reazione è stata condotta anche mediante riscaldamento a microonde: trattando a 200 °C per 20 minuti 0,25 g di biomassa con 0,3 ml di HCl al 37 % w/w e 3,57 ml di acqua, è stata ottenuta una resa in acido levulinico del 21,2 % in peso (corrispondente all’81,7 % della massima resa teorica ottenibile).
L’idrolisi in microonde consente di ottenere rese migliori rispetto al trattamento in autoclave con il vantaggio di ridurre i tempi di residenza ed i costi energetici; inoltre lo stadio di pretrattamento idrotermale non è necessario. Se l’arundo viene sottoposto ad un pretrattamento di steam explosion, e successivamente al trattamento con MW nelle stesse condizioni di reazione, è possibile ottenere rese ponderali in acido levulinico simili (19,5 %) ma con un tempo di residenza di soli 10 min.
Tabella 4 - Rese in AL, ottenute da varie biomasse, negli studi condotti a Pisa.
1 = Costole di tabacco;
2 = la biomassa può essere pretrattata per trattamento idrotermale o steam explosion.
Sottoponendo al trattamento con MW, nelle stesse condizioni di reazione, un feedstock costituito da 0,25 g di miscanto, 0,30 ml di HCl al 37 % w/w e 3,57 g di acqua, sono state ottenute rese ponderali in acido levulinico del 22,1 %. A 190 e 200 °C è stata ottenuta una resa ponderale in residuo solido del 30 % circa. A temperature inferiori tale resa aumenta (fino ad oltre il 50 % a temperature minori di 150 °C) a causa della depolimerizzazione parziale della componente cellulosica della biomassa. Sottoponendo al trattamento con MW a
Fonte
calore Biomassa Alimentazione
Catalizzatore (conc. in mol / l) T (°C) t (h) Resa % AL Trad. C. tabacco1 1,75 g / 24 ml H2O H2SO4 - 1 200 30 5,1 Trad. C. tabacco1 1,75 g / 24 ml H2O HCl - 0,5 200 30 5,2
Trad. C. tabacco1 1,75 g / 24 ml H2O HCl - 0,5 / NaCl - 0,25 200 30 7,4
Trad. C. tabacco1 1,75 g / 24 ml H2O HCl - 0,5 / LiCl - 0,25 200 30 8
Trad. C. tabacco1 1,75 g / 24 ml H2O
pret2. a 120 °C per 2 h HCl - 0,5 / NaCl - 0,25 200 30 15 Trad. Fanghi
cartiera
1 g / 36 ml H2O
pret2. a 120 °C per 2h HCl - 1 / NaCl - 0,25 200 30 33 Trad. Pioppo 2,5 g / 36 ml H2O
pret2. a 80 °C per 2 h HCl - 0,5 / NaCl - 0,25 200 60 22,3 Trad. Pioppo 2,5 g / 36 ml H2O
pret2. a 80 °C per 2 h HCl - 1,3 / NaCl - 0,25 200 60 30 Trad. Miscanto 1,3 g / 36 ml H2O
pret2. a 80 °C per 2 h HCl - 1,3 / NaCl - 0,25 190 60 18 Trad. Miscanto 1,3 g / 36 ml H2O
pret2. s. explosion HCl - 1,3 / NaCl - 0,25 190 60 25 Trad. Arundo 2,5 g / 36 ml H2O
pret2. a 80 °C per 2 h HCl - 1,3 / NaCl - 0,25 190 60 22,2
MW Arundo 0,25 g / 3,57 ml H2O HCl - 1 200 20 21,2 MW Arundo 0,25 g / 3,57 ml H2O pret2. s. explosion HCl - 1 200 10 19,5 MW Miscanto 0,25 g / 3 ,57 ml H O HCl - 1 200 20 22,1 MW Sorgo 0,35 g / 5 g H2O HCl - 0,5 190 20 23,3
190 °C per 20 minuti un feedstock costituito da 0,35 g di sorgo, 0,2 ml di HCl e 5 g di acqua, è stata ottenuta una resa ponderale in furfurale del 23,3 % e in residuo solido del 27,5 %. Sottoporre le biomasse testate ad un trattamento di idrolisi a temperature inferiori ai 180 °C causa un notevole decremento delle rese in acido levulinico (fino al 40 - 50 %).
In tutti e due gli studi la determinazione dell’acido levulinico è effettuata mediante un gas cromatografo fornito di rilevatore FID.
2.4.1.1 Valorizzazione del residuo solido ligninico
Negli studi condotti nel dipartimento di Chimica a Chimica Industriale dell’Università di Pisa [15][16] è stata valorizzata la frazione ligninica residua ottenuta dal trattamento idrotermale delle biomasse. Il residuo solido ottenuto dalle diverse biomasse a varie temperature è stato analizzato mediante microscopia ottica (condizioni di trattamento drastiche rendono il solido bruno e di pezzatura fine) (Fig. 13), caratterizzazione 1H - NMR (sono stati quantificati i gruppi funzionali idrossilici, alifatici idrossilici e metossilici), caratterizzazione FT - IR (confrontando il residuo solido prodotto a diverse temperature di idrolisi con quello della lignina e della cellulosa di riferimento, è stato definito l’intervallo di temperatura (150 - 170 °C) in cui la cellulosa si depolimerizza completamente rendendo disponibili i gruppi funzionali della lignina), caratterizzazione GPC (il peso molecolare medio numerale della lignina acetilata è stato stimato tra 200 e 402 mentre il peso molecolare medio ponderale è stato stimato tra 466 e 764) e caratterizzazione termogravimetrica.
È stato effettuato uno studio per determinale la resa ponderale in solido residuo al variare della temperatura.
Effettuando il trattamento termico con microonde per 15 minuti su un feedstock formato da 2,45 g d’arundo, 1,45 ml di HCl al 37 % w/w e 35 g di acqua è stato dimostrato che la resa in
Figura 13 - Aspetto del solido (microscopio ottico) residuo ottenuto a 190 °C (a sinistra) ed a 150 °C (a destra).
solido residuo diminuisce all’aumentare della temperatura: a 120 °C la resa è stata del 54,7 %, a 140 °C è stata del 40 %, a 150 °C è stata del 30 % mentre a temperature comprese tra 160 e 190 °C la resa ha subito una diminuzione minima (a 190 °C è del 27,7 %). In queste condizioni quindi, a temperature superiori a 150 °C, la componente cellulosica della biomassa è completamente degradata mentre a temperature inferiori lo è solo parzialmente.
L’uso come combustibile del residuo solido ligninico è limitato dall’alto contenuto (fino al 25 % in peso) di materiale inorganico: al termine della combustione le ceneri devono essere smaltite; inoltre, sia nei processi di gassificazione che di combustione, si formano vapori contenenti metalli alcalini e alcalino terrosi che sporcano e intasano le apparecchiature rendendo necessarie frequenti fermate degli impianti. Nell’ottica di una valorizzazione in linea con la green chemistry, sono state effettuate numerose ricerche per definire altri ambiti di utilizzo della lignina: in ambito agricolo è un buon fertilizzante, può essere presente (dispersa) nella produzione di cementi e può essere usata come agente flocculante, complessante e antiossidante (la lignina Kraft è usato come antiossidante per l’olio di mais) [17]. Di particolare interesse è lo sviluppo di materiali polimerici a base di lignina: poliuretani, resine acriliche, resine epossidiche e resine fenoliche. In questo ambito, l’alto contenuto di gruppi funzionali e il basso peso molecolare sono indice della sua capacità di “scavenging” di radicali liberi; la sua incorporazione in polimeri di sintesi limita la fotoossidazione e la termoossidazione prevenendone quindi la depolimerizzazione [18]. Di particolare interesse si è rivelato l’impiego della lignina per la sintesi di materiali poliuretanici; il residuo solido dell’idrolisi condotta a 190 °C è ligninosimile ed è stato usato dai ricercatori del dipartimento di Ingegneria Chimica dell’Università di Pisa per sintetizzare una resina le cui caratteristiche sono risultate simili a quelle dei materiali polimerici ottenuti nelle produzioni tradizionali.
2.4.2 Processi di conversione sviluppati su scala industriale
In questa sezione sono descritti i processi di produzione di acido levulinico, normalmente integrati alla produzione di furfurale, già sviluppati su scala semi industriale, industriale o in procinto di esserlo.
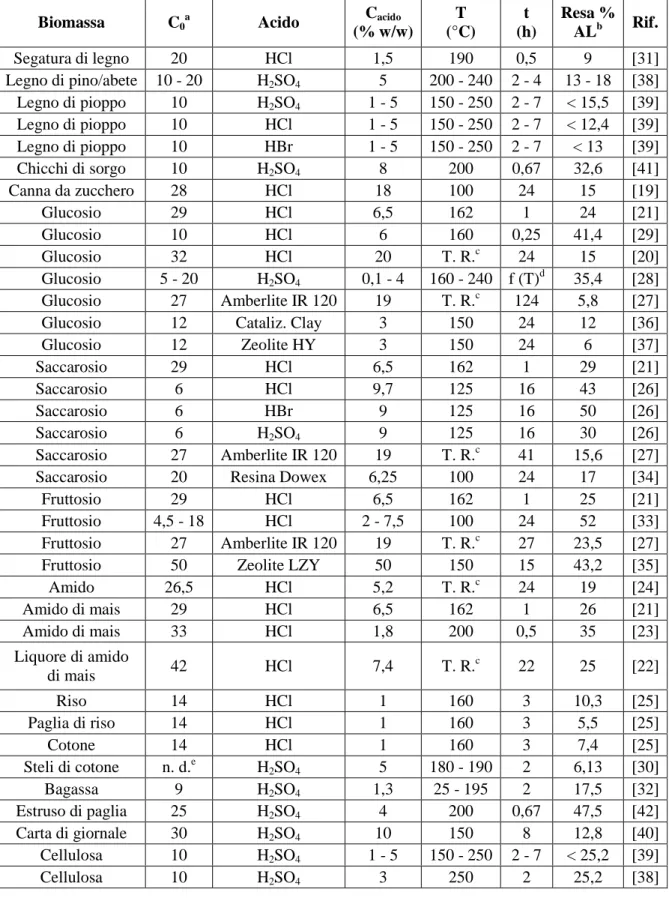
La produzione di acido levulinico in un’ottica commerciale iniziò negli Stati Uniti ad opera della Un. E. Staley Co. nel 1940. L’impianto realizzato convertiva la biomassa in acido levulinico in due stadi (Fig. 14). In un’unità di pretrattamento che operava a 100 °C sono
alimentati HCl, acqua e biomassa (amido). Successivamente la miscela così trattata veniva invita in un reattore che opera a 200 °C in presenza di vapore sotto pressione; qui avveniva la reazione di idrolisi e la formazione di acido levulinico. L’isolamento dell’AL si realizzava mediante distillazione sotto vuoto dopo una parziale neutralizzazione della miscela reagita e una sua filtrazione e centrifugazione per allontanare i prodotti uminici [23]. Il brevetto Dunlop e Wells (1957) [49] descrive un processo continuo di produzione di acido levulinico a pressione atmosferica a partire da varie sostanze contenenti esosi (cellulosa, saccarosio e scarti della lavorazione del legno). Il catalizzatore utilizzato è
H2SO4 in soluzione al 3 % in peso. I reagenti erano inviati ad un reattore che operava a 169 °C, dove rimanevano 2 ore. Il residuo solido veniva allontanato mediante filtrazione (Fig. 15).
Figura 14 - Schema a blocchi del processo Staley.
Figura 15 - Flow sheet del processo Dunlop e Welss.
L’acido levulinico veniva estratto con metil isobutile chetone, immiscibile con l’acqua, dalla soluzione acquosa in cui rimaneva il catalizzatore acido. La fase acquosa era riciclata mentre la fase organica veniva inviata ad un evaporatore in cui si separava il solvente, che era riciclato alla colonna di estrazione, dall’acido levulinico e dal furfurale; AL e furfurale erano separati e purificati mediante distillazione sotto vuoto. Sono state ottenute rese in AL del 20 % in peso rispetto alla biomassa secca utilizzata.
Nel brevetto di Carlson e Wash (1962) [49] è stato messo a punto un processo continuo in cui la cellulosa era idrolizzata e convertita in AL utilizzando un acido minerale diluito ad alta temperatura. La particolarità di questo processo era il riciclo del 6 - 10 % dell’acido levulinico prodotto al reattore di idrolisi; solo l’8 - 12 % veniva inviato alla separazione e purificazione. Nel reattore, che operava a 140 200 °C, avvenivano quindi vari cicli di idrolisi, in genere 6 -7: ogni ciclo incrementava la resa in acido levulinico dell’1,5 - 2 %; il tempo di residenza era compreso tra 10 e 60 minuti. Al termine della reazione il residuo solido e la maggior parte dell’acqua erano separati dall’acido levulinico mediante filtrazione e rapido raffreddamento; la corrente così ottenuta in parte
veniva riciclata al reattore e in parte era invita alla purificazione. La purificazione dell’acido levulinico avveniva mediante successivi passaggi di evaporazione, filtrazione, distillazione a pressione ridotta e condensazione (Fig. 16).
Nel brevetto di Sassenrath e Shilling (1966) è stato messo a punto un processo, commerciale ed economicamente valido, in cui le rese in acido levulinico sono state aumentate, come nel brevetto di Carlson e Wash, riciclando parte dell’acido levulinico prodotto al reattore [49]. Dopo la reazione di idrolisi la miscela uscente dal reattore veniva invita alla separazione e purificazione dell’AL: il residuo
Figura 16 - Flow sheet del
processo Carlson e Wash.
solido veniva eliminato tramite filtrazione, l’acqua e l’acido formico mediante evaporazione, il catalizzatore era recuperato mediante estrazione con solvente o distillazione e, alla fine, l’acido levulinico veniva purificato mediante distillazione (Fig. 17).
2.4.2.1 Processo Biofine
Uno dei processi per la produzione di acido levulinico già sviluppato su scala industriale è quello dell’industria Le Calorie di Caserta. L’industria inizialmente utilizzava un brevetto, proposto da Fitzpatrick [51][52], per la produzione di acido levulinico da biomasse e scarti di origine organica contenenti cellulosa (fanghi di cartiera, vinaccia esausta, cruschello e trucioli di legno). Questo processo sulla carta consentiva di convertire rifiuti in prodotti riutilizzabili riducendo i costi per la produzione dell’acido. Il processo è stato realizzato in collaborazione con NYSERDA (New York State Energy Research and Development Authority) e con DOE (US Department of Energy) seguendo il brevetto originario della Biofine [50].
↓
Figura 17 - Flow shett del processo Sassenrath e Shilling.
La novità del brevetto consiste in una disposizione impiantistica in continuo che prevede alcune fasi (Fig. 18).
- Preparazione della materia prima: per rendere efficiente il processo di idrolisi il diametro delle particelle di biomassa messe a reagire deve essere al massimo di 1 cm; le particelle di biomassa sono trasportate al reattore di miscelazione mediante un sistema di iniezione ad aria compressa.
- Miscelazione e reazione: viene aggiunto il solvente (acqua) e il catalizzatore acido (H2SO4 in concentrazione compresa tra 1,5 - 3 % in peso, in funzione delle caratteristiche della biomassa); l’alimentazione così formata viene inviata in due reattori di idrolisi disposti in serie che lavorano in condizioni tali da minimizzare la formazioni di sottoprodotti di degradazione.
- Nel primo reattore avviene l’idrolisi acida del polisaccaride per dare l’intermedio solubile HMF. Il reattore, di tipo tubolare, lavora a una temperatura di 210 - 220 °C e ad una pressione di 25 bar. È richiesto un tempo di residenza nel reattore di 12 secondi. I prodotti sono rimossi continuamente dal reattore.
- Nel secondo reattore si realizzano le condizioni che massimizzano la selettività della reazione che produce AL da HMF, minimizzando le reazioni di condensazione che condurrebbero a prodotti ad alto peso molecolare. La concentrazione dell’acido è la stessa del primo reattore ma le condizioni di reazione sono meno severe (190 - 200 °C, 14 bar). Questo reattore è notevolmente più grande del primo a causa del tempo di residenza più alto richiesto (20 minuti). La maggior parte del furfurale e degli altri prodotti volatili sono rimossi in questo stadio; la soluzione contenente acido levulinico e solido residuo passa alla purificazione.
- Rimozione dei solidi e recupero dell’acido levulinico: tramite decantatori, filtri ed evaporatori, viene separato un solido organico (inviato ad un impianto di gassificazione per la produzione di energia elettrica) da una corrente liquida contenente acido levulinico.
In particolare il residuo solido viene inviato ad un’unità di disidratazione, operante a pressione ridotta, dove vengono allontanate l’acqua e le componenti volatili. Dalla soluzione si ottiene acido levulinico grezzo (purezza di circa il 75%); l’AL può essere ulteriormente purificato fino al 98%. Il catalizzatore acido è recuperato e riciclato.
La resa massima teorica in AL ottenibile a partire da esosi è del 71,6 % vista la presenza di acido formico come coprodotto. L’obbiettivo di ogni processo industriale è quello di ottenere una resa uguale a quella massima teorica; nell’idrolisi di matrici complesse come le biomasse si formano numerosi prodotti intermedi, fino a 100; questo rende impossibile ottenere una resa in AL prossima a quella teorica. Il processo messo a punto dalla Biofine, grazie all’efficienza del reattore e all’uso di inibitori di polimerizzazione che riducono la formazione di umine, rivendica rese del 70 - 80 % rispetto al massimo teorico. In simulazioni di processo condotte in impianto pilota a partire da scarti della lavorazione della carta sono stati ottenuti da 0,42 a 0,594 kg di acido levulinico per chilo di cellulosa (cioè tra il 59 e l’83% della resa massima teorica ottenibile). L’impianto industriale costruito a Caserta (Fig. 19) può trattare 50 tonnellate di biomassa secca al giorno.
Purtroppo l’impianto era stato costruito soprattutto nell’ottica di usare come materia prima uno scarto della produzione agricola campana a valore negativo: la polvere di costole di tabacco. Particolare non trascurabile, tale biomassa ha un elevato contenuto di calcio che, in presenza di acido solforico, precipita; questo, insieme alla deposizione di sottoprodotti uminici, ha provocato il rapido intasamento del reattore tubolare del processo Biofine e l’ingestibilità nelle condizioni brevettali nonostante gli autori rivendichino l’aggiunta di 2-200 ppm di sodio o potassio solfito per prevenire l’intasamento di questo primo reattore caratterizzato da un alto rapporto altezza / diametro interno.
2.4.2.2 Produzione di acido levulinico mediante estrusione
In uno studio condotto nella University of Nebraska è stato messo a punto un processo continuo di estrusione reattiva, che utilizza acidi omogenei diluiti, per la sintesi di acido di levulinico da amido [49].
L’estrusione (Fig. 20) è un’operazione in cui un materiale è costretto a muoversi attraverso un dado di metallo. Gli autori rivendicano che un processo di conversione di questo tipo, oltre ad essere utilizzabile in continuo, richieda pochi stadi (essendo semplice) e necessiti di tempi di reazione ridotti consentendo la produzione di una notevole quantità di prodotto a costi minori.
Nel reattore ad estrusione a doppia vite si può realizzare un profilo variabile di temperatura; la carica di amido che vi arriva è precondizionata, poi estrusa, filtrata, distillata sotto vuoto, condensata, centrifugata e, in parte, riciclata. Sono state ottenute rese del 48 % in peso rispetto all’amido introdotto (circa il 70 % della massima resa teorica ottenibile) (Fig. 21). Il processo può anche essere utilizzato per produrre, mediante idrogenazione di acido levulinico, il γ-valerolattone.
Figura 20 - Funzionamento di un estrusore. Figura 19 - L'impianto Biofine costruito a Caserta.
L’alimentazione (amido, acqua e catalizzatore acido) è inviata ad un precondizionatore. Lo slurry così formato è inviato all’estrusore. La miscela uscente dall’estrusore viene filtrata e inviata ad una colonna di distillazione che opera sotto vuoto e da cui si recupera, in testa, l’acido di levulinico. Gli acidi che possono essere utilizzati sono HBr e HCl.
Il precondizionamento della carica, che dura da 3 a 4 ore, è necessario per assicurare un buon miscelamento tra amido, acqua e catalizzatore. I rapporti ottimali tra i reagenti sono: 54 - 67 parti di amido, 30 - 40 parti di acqua e 3 - 6 parti di acido. Il pH risultante dello slurry è minore di 1. L’estrusore migliore è un Brabender (modello D - 6) a doppia vite; questo può essere provvisto di un apparato di degasamento per l’allontanamento dei volatili che si formano durante il processo di estrusione.
La temperatura dell’estrusore varia lungo la sua lunghezza da 120 a 160 °C. Ci sono zone più o meno lunghe in cui la temperatura varia tra 80 e 100 °C e tra 120 e 150 °C o rimane costante a 150 o 160 °C. Dopo una neutralizzazione parziale i prodotti di reazione sono filtrati ed inviati ad una colonna di distillazione a pressione ridotta. L’acido levulinico che si recupera dalla testa può ulteriormente essere purificato per centrifugazione.
In questo processo si possono alimentare al precondizionatore 820 kg / h di amido di mais, 40 kg / h di acido solforico al 5 % in peso e 290 kg / h di acqua a 60 °C; nel precondizionatore la temperatura raggiunge i 100 °C mentre nell’estrusore passa da 100 a 150 °C.
Dopo una filtrazione i prodotto sono inviati ad una colonna di distillazione a pressione ridotta Chemtowers VDC -125. La testa della colonna, contenente acido levulinico (fino al 48 % in peso rispetto all’amido di partenza), è condensata e centrifugata.
2.4.2.3 Il processo brevettato nell’Università di Pisa
Nel 2008, per ovviare agli inconvenienti del processo Biofine, è stato brevettato un nuovo processo nel Dipartimento di Chimica e Chimica Industriale dell’Università di Pisa [55]. È fondamentale limitare la formazione dei derivati uminici, in particolare quelli solidi ad alto peso molecolare, perché, oltre ad abbassare la resa del processo, creano grandi problematiche dal punto di vista impiantistico provocando notevole sporcamento ed eventuale intasamento del reattore e dei separatori; inoltre la loro deposizione sulle pareti rende difficile lo scambio termico ed il controllo della temperatura di processo. È necessario anche limitare i costi di gestione e costruzione dell’impianto; il processo Biotine utilizza due diversi reattori, costruiti in materiali speciali data la corrosività dell’ambiente di reazione, mentre nel brevetto messo a punto a Pisa è sufficiente un solo reattore.
Nel brevetto viene descritto un procedimento di trasformazione di materie prime rinnovabili e di prodotti di scarto di origine vegetale (cellulosa, scarti di cartiera, coste di tabacco, bucce di agrumi esauste, scarti della lavorazione del legno e dei cereali, sansa esausta e frazione umida dei rifiuti solidi urbani) a dare acido levulinico e furfurale. Il procedimento permette di impiegare le biomasse grezze, in soluzione o sospensione acquosa, senza preliminari trattamenti o purificazioni. Il processo di trasformazione è caratterizzato da una elevata selettività in acido levulinico e da basse quantità di sottoprodotti, in particolare delle umine insolubili.
Una caratteristica comune ai materiali lignocellulosici utilizzati è la presenza di ioni metallici in alta concentrazione, in particolare calcio (4,2 % nelle costole di tabacco e 25 % nei reflui di cartiera) e magnesio; questi rendono impossibile l’impiego dell’acido solforico senza che si abbia significativa precipitazione dei corrispondenti solfati con conseguente sporcamento e intasamento del reattore e passivazione del reagente solido da convertire.
Nel brevetto si impiega HCl in bassa concentrazione (1,5 - 5 % in peso) in combinazione con uno o più sali (NaCl, NaBr, KCl, LiCl, ZnCl2, NH4Cl, CuCl2, NaHSO4) che facilitano l’idrolisi della materia prima. E’ infatti noto l’effetto positivo dell’aggiunta di un elettrolita (teoria di Donnan) sulla velocità di idrolisi della cellulosa in presenza di acidi protici. Il sale è impiegato in concentrazioni comprese tra 0,1 e 0,5 moli / litro.
La conversione della biomassa in acido levulinico e furfurale è condotta sottoponendo l’alimentazione, addizionata dell’acido e del sale, ad uno stadio di preriscaldamento (70 - 150 °C) che facilita il processo di preliminare depolimerizzazione. Il preriscaldamento è seguito da un successivo stadio di conversione finale ad acido levulinico condotto a più alta temperatura (180 - 220 °C). I due stadi possono essere condotti vantaggiosamente in un unico reattore batch agitato o in un reattore operante in continuo. Questo processo permette di
raggiungere rese in acido levulinico, rispetto alla cellulosa presente nel substrato, prossime alla resa massima teorica ottenibile, evitando la formazione dei sottoprodotti uminici solidi che renderebbero complessa ed onerosa la gestione del processo industriale.
Lo stesso trattamento può essere condotto in presenza di alcol per ottenere il corrispondente derivato estero senza formazione di sottoprodotti insolubili.
Conducendo il processo sotto agitazione in autoclave nelle condizioni ottimali di reazione (24 ml di acqua, 1,75 grammi di polvere di coste di tabacco, temperatura 200 °C e tempo di reazione 30 minuti) utilizzando H2SO4 al 5 % in peso, si ottiene una resa in AL del 13,7 %. Al termine della reazione si ottiene un deposizione significativa di prodotti uminici e solfato di calcio.
Effettuando il processo nelle stesse condizioni, ma utilizzando HCl all’1,7 % in peso, si ottiene una resa in AL del 16,8 % in peso senza la deposizione di prodotti uminici e sali inorganici. Usando HCl al 4,5 % in peso è stata aumentata la resa al 42,5 % in peso rispetto alla cellulosa introdotta. Effettuando il processo nelle stesse condizioni, ma aggiungendo 0,17 g di LiCl e preriscaldando la miscela a 80 °C per 2 ore, è stata ottenuta una resa del 57 % in peso rispetto alla cellulosa introdotta, corrispondente al 79,7 % della resa massima teoricamente raggiungibile. Effettuando queste prova con una minore quantità di HCl e 0,35 g di NaCl è stata ottenuta una resa del 60 % in peso rispetto alla cellulosa introdotta, corrispondente all’ 83,9 % della resa massima teoricamente raggiungibile.
La stessa prova, condotta a partire da fanghi di cartiera ha fornito una resa in acido levulinico del 52 % rispetto alla cellulosa introdotta, condotta a partire dalla frazione umida dei rifiuti solidi urbani (dopo omogeneizzazione di un campione significativo) ha fornito una resa del 10,2 %.
Per gli utilizzi dell’acido levulinico si veda il capitolo 5 del presente lavoro di tesi.
1. B. Girisuta, L. P. B. M. Janssen, H. J. Heeres, Ind. Eng. Chem. Res., 2007, 46, 1696. B. Girisuta, L. P. B. M. Janssen, H. J. Heeres, Chem. Eng. Res. Des., 2006, 84, 339. B. Girisuta, L. P. B. M. Janssen, H. J. Heeres, Green Chem., 2006, 8, 701.
2. J. F. Harris, A. J. Baker, A. H. Conner, T. W. Jeffries, J. L. Minor, R. C. Pettersen, R. W. Scott, E. L. Springer, T. H. Wegner, J. I. Zerbe, General Technical Report
FPL-GTR-45, U.S. Department of Agriculture, Forest Service, 1985, 1.
3. J. C. Parajò, G. Garrote, J. M. Cruz e H. Dominguez, Food Science & Technology, 2004, 15, 115.
4. Maki-Arvela, B. Holmbom, T. Salmi, D. Yu. Murzin, Catalysis Rev., 2007, 49 (3), 197. 5. R. H. Leonard, Ind. Eng. Chem., 1956, 48, 1330.
6. V. E. Tarabanko, M. Y. Chernyak, S. V. Aralova, B. N. Kuznetsov, Reac. Kinetics &
Cat. Letters, 75 (1), 2002 , 117.
7. B. V. Timokhin, V. A. Baransky, G. D. Eliseeva, Rus. Chem. Rev., 1999, 68, 73. 8. C. Chang, X. Ma, P. Cen, Chinese J. Chem. Eng., 2006, 14 (5), 2006, 708. 9. J. J. McParland, H. E. Grethlein, Solar Energy, 1982, 28 (1), 55.
10. K. Freudenberg, G. Blomqvist, Ber. Dtsch. Chem. Ges., 1935, 68, 2070.
11. J. F. Saeman, Ind. Eng.Chem., 1945, 37, 43.
12. J. Bouchard, N. Abatzoglou, E. Chornet, Wood Sci. Technol., 1989, 23, 343. 13. F. Camacho, J. Chem. Tech. Biotech., 1996, 67, 350.
14. N. S. Mosier, Character. Cell. Hydrol., 2001, 17, 474.
15. V. De Luise, Catalytic Conversion of renewable products to fine-chemicals, Tesi di dottorato, 2008-2010, Università degli Studi di Pisa, Facoltà di Chimica e Chimica Industriale.
16. D. Licursi, Valorizzazione catalitica integrale di biomasse erbacee a dare furfurale,
acido levulinico e lignina reattiva, Tesi specialistica, 2008-2009, Università degli Studi
di Pisa, Facoltà di Chimica e Chimica Industriale.
17. B. Kosikova, A. Gregorova, Appl. Polym. Sci., 2005, 97, 924.
18. C. Pouteau, P. Dole, B. Cathala, L. Averous, Polym. Degrad. Stab., 2003, 81, 9. 19. B. F. McKenzie, Organic Syntheses (IX). John Wiley and Sons: New York, 1929, 50. 20. P. P. T. Sah, S. Y. Ma, J. Am. Chem. Soc., 1930, 52, 4880.
21. R. W. Thomas, H. A. Schuette, J. Am. Chem. Soc., 1931, 53, 2324. 22. A. Thompson, US patent 2,206,311, 1940.
23. W. W. Moyer, US patent 2,270,328, 1942.
24. C. H. G. Hands, F. R. Whitt, J. Soc. Chem. Ind., 1947, 66, 415. 25. Y. Sumiki, Japanese Patent 176,438, 1948.
26. L. F. Wiggins, Adv. Carbohydr. Chem. Biochem., 1949, 4, 293. 27. B. C. Redmon, US patent 2,738,367, 1956.
28. S. McKibbins, J. F. Harris, J. F. Saeman, W. K. Neill, Forest Prod. J., 1962, 12, 17. 29. L. J. Carlson, US patent 3,065,263, 1962.
30. V. S. Minina, A. E. Sarukhanova, K. U. Usmanov, Fiz. i Khim. Prirodn. i Sintetich.
Polimerov, Akad. Nauk Uz. SSR, Inst. Khim. Polimerov, 1962, 87.
31. C. P. Sassenrath, W. L. Shilling, US patent 3,258,481, 1966. 32. E. Ramos-Rodriguez, US patent 3,701,789, 1972.
33. B. F. M. Kuster, H. S. Van der Baan, Carbohydr. Res., 1977, 54, 165.
34. R. A. Schraufnagel, H. Rase, Ind. & Eng. Chem. Prod. Res. & Develop., 1975, 14, 40. 35. J. Jow, G. L. Rorrer, M. C. Hawley, D. T. A. Lamport, Biomass, 1987, 14, 185. 36. K. Lourvanij, G. L. Rorrer, App. Catalysis Gen., 1994, 109, 147.
37. K. Lourvanij, G. L. Rorrer, J. Chem. Technol. Biotechnol., 1997, 69, 35. 38. A. Efremov, G. Pervyshina, B. Kuznetsov, Chem. Nat. Compd., 1998, 34, 182. 39. A. Efremov, G. Pervyshina, B. Kuznetsov, Chem. Nat. Compd., 1997, 33, 84. 40. W. A. Farone, J. E. Cuzens, US patent 6,054,611, 2000.
41. Q. Fang, M. A. Hanna, Bioresour. Technol, 2002, 81, 187. 42. J. Y. Cha, M. A. Hanna, Ind. Crop. Prod., 2002, 16, 109. 43. G. J. Mulder, J. Prakt. Chem., 1840.
44. J. J. Thomas, G. R. Barile, Biomass Wastes, 1985, 8, 1461. 45. V. Carlusis, L. J. Torres, US Patent 3,267,136, 1996.
46. W. Zeng, D. Cheng, H. Zhang, F. Chen, Reac. Kinet. Mech. Cat., 2010, 100, 377. 47. P. Vang, S. Zhan, H. Yu, Adv. Mat. Res., 2010, 96, 183.
48. H. Jiang, L. Zeng, B. Yin, J. Gan, B. Liu, Chem. Ind. Forest Prod., 2010, 6. 49. G. Viswas, H. Milford, US Patent 5,859,263, 1999.
50. J. Hayes, S. W. Fitzpatrick, M. H. B. Hayes, J. R. H. Ross, Biorefineries, Ind. Proc. &
Products, 2006, 1.
51. S. W. Fitzpatrik, US patent 4,897,497, 1990. 52. S. W. Fitzpatrik, US patent 5,608,105, 1997.
53. H. Mehdi, V. Fabos, R. Tuba, A. Bodor, L. Mika, I. Horvàth, Top. Catal., 2008, 48, 49. 54. G. Jeong, D. Park, Appl. Biochem. Biotech., 2010, 161, 41.
55. C. Zhou, Renew. En. Res., 2010, 1, 14.
56. A. M. Raspolli Galletti, A. Troiano, S. Fugalli, It patent CE2008A 000002, 2008. 57. C. Chang, P. Cen, X. Ma, Biores. Technol., 2007, 98, 1448.
58. M. F. Zaranyika, P. Moses, J. Pol. Sci. A: Pol. Chem., 1990, 28 (13), 3565. 59. C. Tanford, Phys. Chem. Macromol., 1963, 221.
![Tabella 1 - Substrati derivanti dall'idrolisi di alcune biomasse [3].](https://thumb-eu.123doks.com/thumbv2/123dokorg/7547285.108932/2.892.93.764.879.1100/tabella-substrati-derivanti-idrolisi-alcune-biomasse.webp)