Sezione 3 – Capitolo III
Caratterizzazione morfologica e molecolare di
Pseudomicrothorax dubius (Maupas, 1883) Penard, 1922
e dei simbionti ad esso associati
Parte Prima
Introduzione
III.1.1: Caratteristiche generali del gen. Pseudomicrothorax
Il genere Pseudomicrothorax (MERMOD 1914) PENARD 1922 comprende quattro specie (Pseudomicrothorax agilis, Pseudomicrothorax dubius, Pseudomicrothorax foliformis,
Pseudomicrothorax gracilis) relativamente poco differenziate fra loro (Inamori, 2006). In Pseudomicrothorax spp., le cellule presentano un corpo cellulare marcatamente appiattito in
senso dorsoventrale. Entrambi i bordi laterali non sono paralleli all’asse anteroposteriore, bensì incurvati verso l’esterno, in modo più o meno marcato. La curvatura del lato destro è maggiormente pronunciata rispetto a quella del lato sinistro: ciò conferire all’interno organismo un aspetto curvo ed asimmetrico rispetto all’asse centrale. L’intera cellula appare rigida e poco flessibile a causa della presenza di numerosi elementi citoscheletrici a funzione di sostegno, collocati in un sottile spazio (“epiplasma”: Peck, 1977) al di sotto della struttura corticale. La ciliatura somatica è costituita da circa 15 cinezie, distribuite fra faccia dorsale e ventrale: sul lato ventrale, le cilia si presentano più sottili e allungate rispetto al lato dorsale. Il citostoma si apre ad un terzo della lunghezza del corpo cellulare, presso l’estremità anteriore, alloggiato in una piccola depressione. La struttura del citofaringe appare molto complessa, probabilmente a causa del peculiare tipo di alimentazione presente in questo genere di nassulidi (vd. sotto), ed in P. dubius è stata oggetto di numerosi lavori (es. Hausmann and Peck, 1979; Hauser and Hausmann, 1982). Numerose, grandi tricocisti sono presenti (Peck, 1977). Il macronucleo appare di forma ovale, più o meno allungato, centralmente posto rispetto alla cellula; è presente un solo micronucleo (Inamori, 2006). Come accennato, la specie P. dubius è stata oggetto di numerosi studi volti a chiarire le particolari modalità di alimentazione presenti in questa specie. P dubius si nutre infatti di alghe azzurre filamentose, che ingerisce, partendo dall’estremità del filamento, per mezzo di
un cestello citofaringeo modificato (Hausmann and Peck, 1979). Il filamento non viene tagliato durante l’ingestione, bensì fagocitato dalla cellula alla velocità di circa 15 μm al secondo. Il cestello faringeo si compone di cilia orali ed elementi citoscheletrici (microtubuli, microfilamenti), che collegano il lume del cestello stesso con la regione citoplasmatica immediatamente conseguente ad esso; fasci di microfilamenti convogliano il cibo ingerito oltre il cestello, verso la zona citoplasmatica ove avviene la formazione dei vacuoli alimentari destinati a contenere i cianobatteri ingeriti; i fagosomi vengono infine trasportati verso l’interno della cellula. Nell’intera zona appare presente una forte attività ATPasica, indice degli elevati costi energetici che tale tipo di nutrizione comporta (Hauser and Hausmann, 1982). Questo tipo di nutrizione è stato segnalato in alcuni protozoi sarcomastigofori (Rosati, pers. comm.); fra i ciliati appare tuttavia raro, limitato a poche specie ficofaghe quasi tutte appartenenti alla cl. Nassophorea SMALL AND LYNN 1981. La struttura fine del cestello faringeo di Pseudomicrothorax spp. appare comunque differire da quella, anch’essa ben conosciuta, di Nassula spp., e probabilmente rappresenta una carattere proprio del genere (Hausmann and Peck, 1979).
Una seconda struttura cellulare presente in Pseudomicrothorax spp. e particolarmente sviluppata nella specie P. dubius (Peck, 1977), è costituita da uno strato subcorticale denominato “epiplasma”. Già nelle prime descrizioni di P. dubius veniva segnalata la presenza di una zona elettrondensa spessa alcune centinaia di nanometri, definita “lamina
corticalis” (Fauré-Frémiet and André, 1967; in Peck, 1977), collocata al di sotto della
membrana più interna dello strato alveolare, e apparentemente in contatto con i corpuscoli basali delle cinezie somatiche. L’ultrastruttura della lamina corticalis, in seguito rinominato “epiplasma”(Pitelka, 1969; in Peck, 1977) è stata in seguito analizzata: tale strato si sviluppa per tutto il corpo cellulare ad eccezione della regione citostomale, del citoprocto e presso il vacuolo contrattile; nelle regioni in cui è presente, si trova compresa fra la membrana alveolare interna e la lamina terminale in cui si collocano i corpi basali corticali (Peck, 1977). L’altezza dello strato epiplasmatico può variare nelle differenti regioni del corpo cellulare oltre che, ovviamente, fra le diverse specie di ciliati (in P. dubius, presenta in media uno spessore di 120-200 nm); anche la sua struttura fine è soggetta a variazioni interspecifiche (Peck, 1977). L’epiplasma si compone di una matrice microfibrillare, a propria volta suddivisa in varie “laminae” (quattro in P. dubius) di differente spessore, che costituiscono il corpo principale dell’intera struttura. Fasci citoscheletrici attraversano la struttura in senso parallelo alla cortex, conferendo alla cellula, come accennato in precedenza, una notevole rigidità. Nelle zone sottostanti le cinezie somatiche, i microtubuli che compongono le cilia passano attraverso lo strato epiplasmatico per prendere rapporto con la lamina terminale in cui si inseriscono i corpuscoli basali. Allo stesso modo, l’epiplasma è attraversato da altre strutture quali tricocisti, sacche parasomali ed alveolocisti. Tale struttura
sembra assolvere più di una funzione. In primo luogo, fornisce prevalentemente un supporto strutturale, sia diretto, essendo contenuti in essa elementi citoscheletrici, sia indiretto, fungendo da matrice nella quale sono integrati numerosi altri elementi corticali (corpi basali, fibrille corticali, mucocisti, tricocisti, membrana alveolare), in un insieme strutturalmente coerente (Peck, 1977). In aggiunta a tale funzione, l’epiplasma sembra avere un ruolo nel processo di posizionamento degli elementi corticali di nuova formazione, specialmente delle strutture voluminose quali le tricocisti di P. dubius: esso agirebbe in questo caso come
framework, consentendo l’inserzione nella cortex e determinando il corretto orientamento dei
nuovi elementi corticali mediante movimenti citoscheletrici (Peck, 1977). La presenza di una struttura epiplasmatica non è un carattere peculiare al gen. Pseudomicrothorax, essendo questa stata ritrovata in numerose altre specie di ciliati; in tale genere, tuttavia, essa è stata descritta in dettaglio, e ne è stata chiarito il ruolo strutturale e funzionale (Peck, 1977).
- Batteri simbionti in Pseudomicrothorax
Le numerose indagini ultrastrutturali compiute su P. dubius, prevalentemente mirate allo studio dell’ultrastruttura corticale o del citofaringe, (es. Peck, 1977; Hausmann and Peck, 1979; Hauser and Hausmann, 1982) non hanno rivelato la presenza di batteri ecto- o endosimbionti. È possibile che organismi endosimbionti eventualmente presenti, ma collocati nelle regioni citoplasmatiche più interne e/o nel nucleoplasma possano essere sistematicamente sfuggiti ad una simile osservazione, rivolta soprattutto all’analisi degli strati corticali esterni della cellula; è tuttavia più probabile che tali organismi non fossero presenti nelle colture utilizzate in dette analisi.
Allo stato attuale delle conoscenze, non esistono in letteratura dati relativi alla presenza di simbionti per nessuna delle specie appartenenti al gen. Pseudomicrothorax.
Sezione 3 – Capitolo III
Parte Seconda
Risultati dell’analisi
III.2.1: Isolamento e messa in coltura di P. dubius
Durante il presente lavoro, esemplari di P. dubius sono stati individuati esclusivamente in campioni raccolti nello Stagno 2 in data 10-05-2006. A causa delle forti piogge, la salinità dello Stagno 2 si era notevolmente ridotta nel periodo immediatamente precedente al campionamento; misurazioni mediante salinometro a diffrazione eseguite sul posto in data 10-05-2006 e successivamente ripetute in laboratorio nei campioni prelevati hanno dato un valore di salinità dello 0‰. È probabile che la salinità reale dell’ambiente fosse maggiore della percentuale riportata, ma al di sotto del limite di fondoscala rilevabile dallo strumento. La popolazione di P. dubius presente nei campioni, osservata subito dopo la raccolta, appariva numerosa e stabile. Alcuni esemplari sono stati prelevati da tale popolazione ed isolati in acqua dolce sterile.
Sono state eseguite prove di alimentazione su alcune decine di esemplari, utilizzando come nutrimento l’alga verde Dunaliella salina, batteri amilotrofi (immettendo del riso bollito nelle colture in modo da favorirne la crescita) e cianobatteri autotrofi della specie
Oscillatoria formosa (per le condizioni di allevamento di tali organismi cfr. Sezione 2: Materiali e Metodi). Le prove hanno dato esito positivo soltanto in quest’ultimo caso.
Sono stati effettuati 13 tentativi di stabilire colture monoclonali di P. dubius, somministrando come alimento colonie filamentose di O. formosa a cadenza giornaliera o settimanale a seconda dello stato delle cellule. Tutti gli esemplari isolati hanno originato in breve tempo (sei-sette giorni) colture monoclonali di circa un centinaio di cloni. Tali colture sono state mantenute in cella termostatata a 19±1°C, con alternanza luce-buio di 12 ore: sono state via via trasferite in contenitori più capienti in ragione dell’aumento del numero di individui. Esse sono apparse stabili per oltre un mese: trascorso tale periodo, le cellule di alcuni ceppi hanno cessato di dividersi, e gran parte delle colture sono andate incontro ad estinzione. È probabile che tali estinzioni siano state determinate da errori insiti nel metodo adottato per il mantenimento delle colture piuttosto che da una intrinseca difficoltà di allevamento in condizioni di laboratorio della specie in esame (cfr. Parte Terza, Discussione
Due colture monoclonali (MS 11/1, MS 12/1) sono state mantenute per circa due mesi. È stato comunque possibile prelevare periodicamente grandi quantità di cellule da ciascuno di tali ceppi, dato il notevole tasso di accrescimento della specie allevata.
III.2.2: Caratterizzazione morfologica
L’identificazione morfologica della specie è stata condotta soprattutto sulla base della caratteristiche osservate in vivo (lunghezza, larghezza, grado di curvatura delle pareti laterali) o mediante impregnazione argentica (numero di cinezie dorsali e ventrali, localizzazione del citostoma). Sono state inoltre applicate specifiche tecniche per l’osservazione dell’apparato nucleare (colorazione di Feulgen). Le cellule utilizzate per eseguire tali colorazioni sono state prelevate dalla popolazione presente originariamente nel campione, indicata come PSM1, o dal ceppo monoclonale MS11/1.
Gli esemplari osservati hanno mostrato caratteristiche morfologiche comuni a tutte le specie appartenenti al gen. Pseudomicrothorax: la forma generale del corpo appare ellissoidale, marcatamente asimmetrica, appiattita dorsoventralmente; la presenza dello strato epiplasmatico conferisce rigidità alla cuticola cellulare; è presente un cestello faringeo; il vacuolo contrattile, relativamente piccolo, si colloca al centro della cellula, mentre il macronucleo, ellissoidale, è situato nel terzo anteriore del corpo cellulare; è presente un unico micronucleo. L’osservazione di tali caratteri ha permesso di collocare con sicurezza la specie all’interno del gen. Pseudomicrothorax; essi non sono tuttavia utili per discriminare fra le quattro specie comprese in tale genere. La lunghezza media osservata in vivo (ca. 45-50 μm) appare tuttavia leggermente inferiore a quella riportata per P. agilis e P. gracilis (48-58 μm: Inamori, 2006).
L’impregnazione argentica ha rivelato un numero di cinezie per individuo complessivamente superiore a 10 (in media 15): il lato ventrale presenta più cinezie di quello dorsale. Non sembrano presenti elementi citoscheletrici ortogonali ad esse: l’assenza di tali elementi consente di escludere le specie P. agilis e P. gracilis (tali organismi, molto simili, venivano precedentemente considerati come un’unica specie: Kahl, 1926; in Inamori, 2006). Le tricocisti sono presenti nella maggior parte degli esemplari; la loro collocazione ed il loro numero appaiono tuttavia variare da individuo ad individuo. L’ultrastruttura delle tricocisti (vd. oltre) appare identica a quanto riportato da Peck (1977) per P. dubius. Allo stesso modo, le caratteristiche sin qui osservate coincidono con la descrizione di P. dubius (Peck, 1977). La specie è stata identificata come Pseudomicrothorax dubius (MAUPAS 1883) PENARD 1922.
III.2.3: Caratterizzazione molecolare
La sequenza parziale del 18S rDNA è stata caratterizzata a partire da una estrazione di DNA condotta su oltre 30 cellule prelevate dalla popolazione presente nei campioni raccolti il 10-05-2006 (popolazione PSM1). Gli individui sono stati selezionati su base morfologica, mediante osservazione al microscopio binoculare prima della fissazione (la presenza di una seconda specie del gen. Pseudomicrothorax avrebbe inficiato tale metodo, vista la difficoltà di discriminare tali organismi su base morfologica; l’aver ottenuto una sequenza monomorfica dal sequenziamento diretto del prodotto di amplificazione costituisce per contro una prova dell’assenza di sibling species, relativamente a tale organismo, nell’ambiente oggetto di studio).
Sono stati utilizzati i primer F9 (5’- CTG GTT GAT CCT GCC AG-3’) e R1513hypo (5’- TGA TCC TTC YGC AGG TTC-3’) (quest’ultimo innesco è specifico per ciliati ipotrichi; la presenza di una degenerazione in posizione centrale ne consente tuttavia l’appaiamento con le sequenze geniche di altri organismi, ad es. Sonderia spp.: cfr. Parte Seconda: Risultati, in
Sezione 3: Capitolo IV: Caratterizzazione morfologica e molecolare di Sonderia cfr. vorax e dei simbionti ad essa associati). L’annealing è avvenuto a 50° C; l’estensione è stata
prolungata per 2’ a 72° C.
La sequenza parziale ottenuta è stata confrontata con quelle già presenti nella banca dati di riferimento (NCBI GenBank). Essa è risultata identica, relativamente alla regione confrontata, alla sequenza di P. dubius X65151 (Bernhard, Leipe, Sogin, Schlegel 1995). Tale risultato ha confermato l’identificazione precedentemente formulata sulla base dell’analisi morfologica.
III.2.4: Indagine ultrastrutturale
Alcune cellule provenienti dalla popolazione PSM1 sono state utilizzate per analisi di tipo ultrastrutturale mediante microscopio elettronico a trasmissione. Obiettivo dell’analisi era l’osservazione delle tricocisti presenti in tali organismi onde effettuare una comparazione con la descrizione fornita da Peck (1977) riguardo le tricocisti di P. dubius, al fine di confermare ulteriormente, in caso di esito positivo del confronto, l’identificazione della specie. Parallelamente, sarebbe stata osservata l’ultrastruttura dei batteri simbionti eventualmente presenti.
In tutti gli esemplari osservati al T.E.M. sono state individuate tricocisti, benché da precedenti osservazioni fosse apparso evidente che alcune cellule possono non presentarne (la stessa osservazione è riportata in Peck, 1977 per P. dubius). Tali estrusomi sono apparsi di grandi dimensioni (ca. 10-15 μm). Risultano in genere collocate immediatamente al di sotto della superficie corticale, in rapporto con lo strato epiplasmatico (cfr. Parte Prima:
Introduzione, presente capitolo); sono circondate da membrana. L’ultrastruttura di tali
organelli appare complessa: in sezione longitudinale, la morfologia generale è allungata, con un leggero rigonfiamento nella regione centrale; lateralmente sono presenti quattro coste, elettrondense, circondanti uno spazio centrale di aspetto traslucido. Le coste laterali non sono parallele l’un l’altra, bensì tendono progressivamente ad avvicinarsi procedendo dal centro verso le estremità distali della struttura, che appare in tal modo fusiforme. Esse non prendono però contatto fra loro: risultano invece interrotte presso i vertici, e sono connesse al materiale componente la regione centrale della tricocisti mediante una matrice fibrillare, apparentemente lassa, meno elettrondensa delle coste stesse. La sezione trasversale risulta grosso modo quadrata, con le quattro coste elettrondense disposte ai vertici: da ciò è possibile arguire che la struttura tridimensionale della tricocisti sia grosso modo parallelepipoidale, e che le quattro coste ne delimitino gli spigoli. Una membrana riveste l’intero organello e prende rapporto con l’epiplasma circostante. Le caratteristiche sin qui osservate sono simili a quanto descritto per le tricocisti di P. dubius (Peck, 1977).
Durante tale indagine sono stati individuati numerosi batteri endosimbionti, localizzati nel citoplasma della cellula. Tali batteri non risultavano collocati in batteriosomi, o comunque circondati da membrana cellulare, bensì inseriti liberamente nella matrice citoplasmatica. Per l’interpretazione di tali risultati cfr. Parte Terza: Discussione dei risultati ottenuti, presente capitolo.
III.2.5: Caratterizzazione del simbionte
Come precedentemente affermato, la presenza di batteri simbionti in P. dubius (e più in generale all’interno del gen. Pseudomicrothorax) non è stata precedentememte segnalata in letteratura, benché tale specie sia stata oggetto di diversi studi (cfr. Parte Prima:
Introduzione, presente capitolo). Le indagini ultrastrutturali compiute durante le fasi di
caratterizzazione dell’ospite (vd. sopra) sulla popolazione PSM1 hanno confermato la presenza di numerosi batteri endosimbionti. Come previsto dal protocollo adottato, sono state in seguito effettuate una serie di ibridazioni in situ onde identificare il gruppo tassonomico di appartenenza del batterio individuato.
- Ibridazioni preliminari con sonde ad ampio spettro
Cellule provenienti dalla popolazione PSM1, nonché dalle colture monoclonali MS11/1 e MS 12/1, sono state utilizzate in esperimenti di ibridazione in situ con sonde universali (Eub338) e gruppo-specifiche, onde individuare il gruppo tassonomico di appartenenza del simbionte; è stata inoltre impiegata la sonda Rhei1245, specifica per γ-proteobatteri filogeneticamente correlati al gen. Rheinheimera (cfr. Sezione 2: Materiali e Metodi).
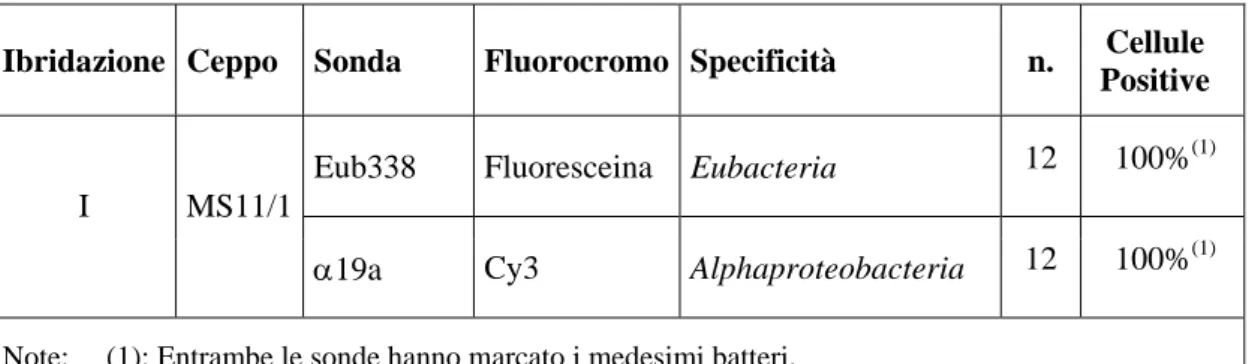
La Tabella III.1 riporta i risultati di tali ibridazioni. Le ibridazioni compiute sulle cellule provenienti dalla popolazione PSM1 sono state effettuate impiegando unicamente la sonda Eub338 (tali ibridazioni non sono riportate nella Tabella III.1). La percentuale di infezione in tale popolazione si è rivelata vicina al 100% - sono state comunque segnalate cellule prive di simbionti.
Ibridazione Ceppo Sonda Fluorocromo Specificità n. Cellule
Positive
Eub338 Fluoresceina Eubacteria 12 100%(1)
I MS11/1
α19a Cy3 Alphaproteobacteria 12 100%(1) Note: (1): Entrambe le sonde hanno marcato i medesimi batteri.
Tabella III.1: Risultati delle ibridazioni preliminari per l’identificazione del simbionte di P. dubius. La prima colonna riporta il numero della ibridazione; la seconda il ceppo monoclonale utilizzato nell’esperimento. La penultima colonna indica il numero di cellule osservate complessivamente nell’ibridazione; l’ultima riporta la percentuale di cellule positive alla sonda impiegata sul totale delle cellule osservate.
Le ibridazioni hanno rivelato la presenza di simbionti batterici nella maggior parte delle cellule osservate. Tale batteri apparivano di forma coccoide, di dimensioni medio-piccole (3-5 μm), presenti in grandi quantità nel citoplasma degli individui infetti. La positività dell’ibridazione con la sonda α19a ha condotto ad ipotizzare la probabile appartenenza del simbionte alla cl. Alphaproteobacteria.
- Caratterizzazione molecolare
Avendo determinato l’appartenenza del simbionte alla cl. Alphaproteobacteria (vd. sopra), è stato possibile ottimizzare le procedure per l’amplificazione tramite PCR del gene per il 16S rRNA. La sequenza è stata caratterizzata a partire da una estrazione di DNA condotta su oltre 30 cellule prelevate dalla popolazione presente nei campioni raccolti il 10-05-2006 (popolazione PSM1). Procedendo da cellule estratte direttamente da campione, benché sciacquate in mezzo sterile e tenute a digiuno per 24h prima della fissazione, è stato ritenuto opportuno effettuare la reazione ad alte condizioni di stringenza, in modo da minimizzare l’amplificazione di contaminanti ed aumentare la resa quantitativa dell’amplificato del gene bersaglio. Non conoscendo la sequenza del 16S rDNA dell’organismo oggetto di indagine, non è stato possibile preselezionare la combinazione di inneschi aventi maggiore specificità per tale sequenza. Sono pertanto stati testati i primer specifici per α-proteobatteri α19a
(5’-CCT GGC TCA GAA CGA ACG-3’) e α19b (5’-CCT GGC TCA GAG CGA ACG-3’), in combinazione con il primer αR1517 (5’-TGA TCC AGC CGC AGG TTC-3’), anch’esso specifico per tale classe. Sono state impostate due reazioni di touchdown PCR, con
temperature di annealing di 63, 57 e 50° C. Entrambe le reazioni hanno reso buone quantità di prodotto. L’amplificato ottenuto dalla prima mix di reazione (α19a-αR1517) è stato sequenziato con il primer F343, in modo da ottenere una sequenza parziale del gene. La sequenza così ottenuta si è rivelata di cattiva qualità: l’elettroferogramma mostrava infatti una sequenza secondaria sottesa a quella dominante, i cui picchi risultavano sovrapposti in numerosi punti a quelli della sequenza principale. La sequenza dominante, riveduta e corretta manualmente, è stata comunque confrontata con quelle presenti nella banca dati di riferimento (NCBI GenBank): presentava il più alto valore di similarità con la sequenza AE017197 (McLeod et al., 2004) di Rickettsia typhi ceppo Wilmington. È stata ipotizzata la presenza di un secondo batterio nel campione di partenza, il cui 16S rDNA fosse stato amplificato assieme a quello del simbionte principale di P. dubius (verosimilmente il batterio
Rickettsia-simile) in quantità minori ma non trascurabili ai fini della determinazione della
sequenza tramite amplificazione e sequenziamento diretto. È stato pertanto fatto ricorso a procedure molecolari basate sull’amplificazione e clonaggio delle sequenze geniche bersaglio presenti nel campione iniziale (cfr. Sezione 2: Materiali e Metodi), in modo da poter discriminare far le varie sequenze di α-proteobatteri contenute nel campione.
L’amplicone precedentemente ottenuto (primer α19a-αR1517), di cui era stato tentato il sequenziamento diretto, è stato inserito in vettori plasmidici, con i quali sono stati trasformate cellule competenti di E. coli (cfr. Sezione 2: Materiali e Metodi). 32 colonie, fra quelle correttamente trasformate, sono state sottoposte a digestione mediante enzimi di restrizione. Alcune delle colonie dei gruppi di pattern di restrizione più rappresentati sono state sequenziate. Vengono qui di seguito riportati i risultati ottenuti.
GRUPPO Pattern Risultato Sequenziamento Interpretazione Rappresentatività
1 I + II Rickettsia spp. Possibile
simbionte 25/32
2 III Rhizobium/Sinorhizobium Contaminante
ambientale 2/32
Pattern unici Contaminanti
ambientali 4/32
Pattern di dubbia assegnazione [nessuna] 1/32
Digestioni fallite 0/32
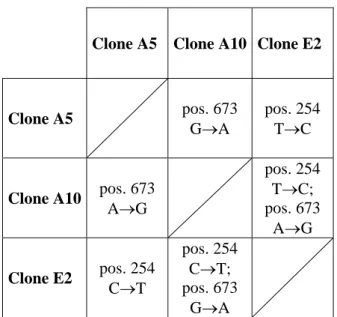
La maggior parte degli amplificati sottoposti a digestione (78,1%) ha prodotto due pattern riconducibili ad un unico gruppo (il verso di inserzione dell’amplicone nel vettore influenza il pattern di restrizione: cfr. Sezione 2: Materiali e Metodi). I geni contenuti in tre cloni appartenenti a tale gruppo (cloni A5, A10 ed E2) sono stati caratterizzati.
Le sequenze ottenute misurano 1442 pb. Le differenze nucleotidiche presenti fra di esse sono di seguito riportate (Tabella III.2).
Clone A5 Clone A10 Clone E2
Clone A5 pos. 673 G→A pos. 254 T→C
Clone A10 pos. 673 A→G
pos. 254 T→C; pos. 673 A→G Clone E2 pos. 254 C→T pos. 254 C→T; pos. 673 G→A
Tabella III.2: Differenze nucleotidiche fra le sequenze dei cloni A5, A10 ed E2 trasformati con amplificato del 16S rDNA del simbionte di P. dubius. La posizione indicata è quella del nucleotide sostituito, calcolata sulla lunghezza del gene; la prima delle basi riportate corrisponde a quella presente nella sequenza del clone indicato sulla riga, la seconda a quella presente nella sequenza del clone riportato in colonna.
Tali sequenze sono state confrontate con quelle presenti nella banca dati di riferimento (NCBI GenBank). Per tutte, il massimo valore di affinità registrato (90-91%) è dato dal confronto con la sequenza CP000087 (Ogata et al., 2006) di Rickettsia bellii RML369-C. Risultano comunque molto simili (percentuali di identità superiori al 90%) a numerose sequenze di Rickettsia spp. precedentemente depositate, fra cui R. typhi ceppo Wilmington. Le tre sequenze sono state successivamente confrontate con quelle già presenti nel data base di riferimento. Esse risultano inserite all’interno del gruppo comprendente la famiglia
Rickettsiaceae PINKERTON 1936 (ord. Rickettsiales GIESZCZYKIEWICZ 1939).
L’analisi filogenetica delle sequenze così ottenute è stata effettuata utilizzando, per l’elaborazione di alberi filogenetici, una selezione di 42 sequenze, di cui 18 appartenenti a specie comprese nella fam. Holosporaceae e 24 facenti parte della fam. Rickettsiaceae. Sono stati elaborati tre alberi, basati rispettivamente sul Parsimony criterion, sul
Maximum-likelihood criterion e sul Neighbor-joining method; per ciascuno di essi sono stati applicati
un filtro di classe “termini” ed uno specifico per α-proteobatteri. Sono stati successivamente elaborati tre ulteriori alberi, calcolati secondo i medesimi criteri: in essi è stato però impiegato il solo filtro classe-specifico. Non sono emerse sostanziali differenze con gli alberi calcolati impiegando entrambi i filtri.
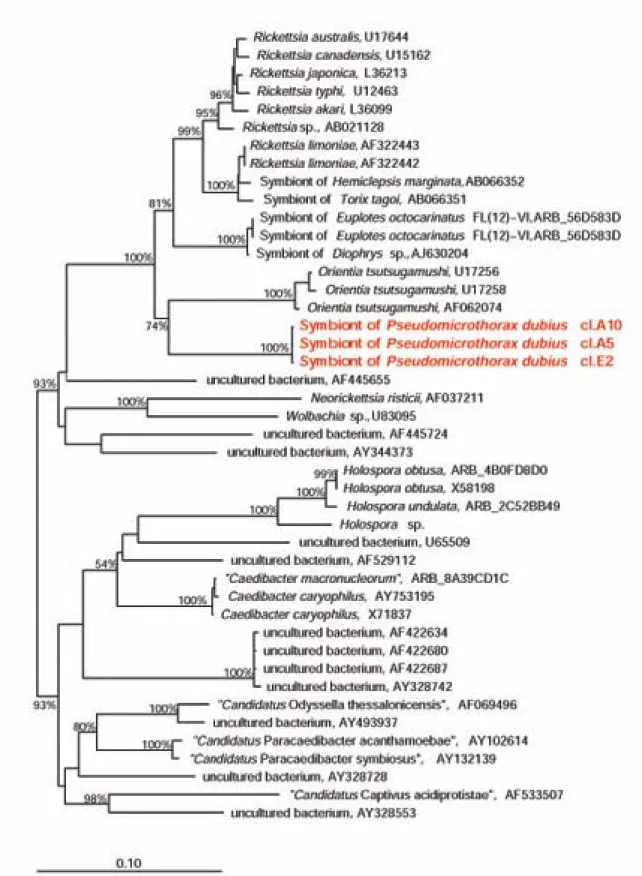
Entrambi gli alberi elaborati mediante il Parsimony criterion mostrano l’associazione delle sequenze dei tre cloni con il clade comprendente tre diverse sequenze di Orientia
tsutsugamushi (U17258, U17256: Stothard and Fuerst 1994; AF062074: Odorico et al.,
1998). Il valore di bootstrap calcolato per il nodo alla base di tale associazione è 74% (1000 pseudorepliche). Il clade così formato si colloca come sister group rispetto a quello che comprende sia le specie del gen. Rickettsia simbionti (spesso patogene) di metazoi, sia
alcune sequenze di simbionti di ciliati ipotrichi dei genn. Euplotes e Diophrys precedentemente caratterizzate (Vannini et al., 2005b; Vannini, unpubl.). L’inserimento delle nuove sequenze lascia comunque invariata la monofileticità della famiglia
Rickettsiaceae: il nodo alla base di tale gruppo è supportato da un valore di bootstrap del
100% (1000 pseudorepliche). Un esempio di albero filogenetico ottenuto con questa selezione di specie è riportato al termine della presente sezione (Figura III.1).
La medesima topologia si ritrova negli alberi calcolati con il Maximum-likelihood criterion, utilizzando la stessa selezione di specie. La distanza filogenetica misurabile fra i nodi di separazione dei diversi cladi, comprendenti le sequenze di O. tsutsugamushi e quelle del simbionte di P. dubius, appare significativa. Più ridotta appare, invece, la distanza fra i nodi da cui originano il cluster comprendente il gen. Rickettsia e quello comprendente le sequenze di O. tsutsugamushi e del simbionte di P. dubius.
Le posizioni relative dei cladi in esame nei due alberi elaborati secondo il Neighbor-joining
method risultano invece differenti rispetto a quanto illustrato sinora. In essi il clade formato
dalle tre sequenze del simbionte di P. dubius risulta basale a quello comprendente il cluster “Rickettsia” e le sequenze di O. tsutsugamushi, che risultano associati come sister group. Tuttavia, la distanza misurata fra i nodi da cui originano i cladi comprendenti le sequenze del simbionte di P. dubius ed il gruppo “Rickettsia-Orientia” appare molto ridotta, suggerendo la scarsa significatività delle posizioni relative di tali cladi nei due dendrogrammi in questione. La sequenza caratterizzata dai cloni presentanti il secondo gruppo di pattern numericamente più abbondante è risultata appartenere ad un rizobatterio: essa presenta infatti una percentuale di identità piuttosto alta (97%) con la sequenza DQ337571 di Rhizobium sp. CHNTR26 (Maxwell, Sims, Chee-Sanford 2006); presenta la medesima similarità (97%) con la sequenza AF357225 di Sinorhizobium sp. 9702-M4 (Janecka et al., 2002). Data la scarsa rappresentatività di tale sequenza nella library ottenuta (6,25%) è stato ipotizzato che potesse trattarsi di una contaminazione ambientale. È possibile che la contaminazione sia originata a causa del rilascio di rizobatteri dalle radici di alcune piante leguminose presenti lungo la sponda dello Stagno 2 (il gen. Rhizobium comprende specie batteriche simbionti di tali piante).
- Ibridazione con sonde gruppo-specifiche selezionate in base alla sequenza del 16S rRNA caratterizzata
Le sequenze dei cloni caratterizzati sono risultate appartenere a batteri filogeneticamente affini al gen. Rickettsia. Per verificare che tali sequenze appartenessero effettivamente al simbionte di P. dubius, è stato effettuato un esperimento di ibridazione in situ utilizzando la sonda Rick527, già esistente e considerata specifica per Rickettsia spp.
La sonda ha legato specificamente i batteri simbionti in tutte le cellule osservate. Un controllo negativo, effettuato sulle medesime cellule con la sonda Caedibacter-specifica CC23a ha dato l’esito atteso. L’identificazione dell’organismo simbionte con il batterio
Rickettsia-simile precedentemente caratterizzato è stata pertanto confermata.
- Osservazione dell’ultrastruttura del simbionte
Come precedentemente accennato, la realizzazione di preparati per il microscopio elettronico a trasmissione è stata effettuata al fine di chiarire alcuni dettagli dell’ultrastruttura dell’ospite (vd. sopra). Nel corso di tale esperimento, sono stati osservate cellule procariotiche presenti all’interno di tutte le cellule analizzate. I batteri simbionti di P. dubius non sembrano possedere caratteristiche morfologiche particolari: citoplasma uniforme ed apparentemente non compartimentalizzato, struttura della parete riconducibile alla tipica organizzazione dei batteri G-. In alcuni esemplari il citoplasma appare differentemente addensato e più elettrondenso rispetto alla maggior parte delle cellule. La collocazione del simbionte sembra essere esclusivamente citoplasmatica. È stato osservato che tali organismi, benché talvolta circondati da una zona citoplasmatica apparentemente meno elettrondensa, non sono mai inclusi all’interno di vacuoli circondati da membrana (batteriosomi): tale caratteristica è tipica dei batteri endosimbionti appartenenti alla fam. Rickettsiaceae (Fredricks, 2005).
Figura III.1:
Cladogramma filogenetico di una selezione di specie di α-proteobatteri appartenenti alle
famiglie Rickettsiaceae ed Anaplasmataceae (clade in alto), ed Holosporaceae (clade in basso) dell’ordine Rickettsiales (per dettagli si rimanda al presente capitolo). È stata evidenziata la collocazione della sequenza del batterio Rickettsia-simile simbionte di P. dubius. I valori di bootstrap riportati sono calcolati su 1000 pseudorepliche. La lunghezza della componente orizzontale rappresenta la distanza evolutiva fra le sequenze: la barra misurante la scala corrisponde a 10 cambiamenti nucleotidici ogni 100 posizioni.Sezione 3 – Capitolo III
Parte Terza
Discussione dei risultati ottenuti
III.3.1: Considerazioni sull’allevamento di P. dubius
Durante il presente lavoro, sono state stabilite e mantenute per alcune settimane numerose colture monoclonali di P. dubius utilizzando come alimento il cianobatterio O. formosa. Nessuno degli altri alimenti somministrati (alghe verdi unicellulari non coloniali, batteri eterotrofi) ha invece dato esito positivo. È possibile supporre che lo speciale adattamento sviluppato da questa specie, che le consente di fagocitare interi filamenti algali grazie a modificazioni a carico del citofaringe e del sistema citoscheletrico retrostante (Hausmann and Peck, 1979) renda per contro problematico il ritorno ad una nutrizione di tipo sospensivoro. L’utilizzo di O. formosa per l’allevamento di P. dubius era del resto già stato segnalato in letteratura (Peck, 1977). I risultati ottenuti hanno confermato l’idoneità di tale alimento per l’allevamento di P. dubius.
Non è invece stato determinata la causa dei fenomeni di estinzione che si sono verificati in tutte le 13 colture monoclonali ottenute nel corso del presente lavoro. Come precedentemente ricordato, le fasi iniziali dell’allevamento non presentano difficoltà, ed è possibile ottenere grandi quantitativi di cellule in breve tempo. Trascorso un certo periodo (uno-due mesi di allevamento), le cellule smettono di dividersi e la coltura si estingue rapidamente. È stato supposto che la causa di tali estinzioni sia da ricercarsi nella modalità utilizzate per la somministrazione del nutrimento. Le cellule delle colture di recente creazione presentano infatti numerosi vacuoli alimentari all’interno, tanto da apparire di colore verde-azzurro; esse si presentano invece invariabilmente trasparenti nelle colture prossime all’estinzione, come se non fossero riuscite ad alimentarsi per un determinato periodo. L’aggiunta di O. formosa durante questa fase non ha consentito in nessun caso il recupero della coltura. È stato supposto che il nutrimento non fosse stato aggiunto in quantità e/o alla frequenza adeguata per supportare le fasi finali della crescita esponenziale della popolazione, e che P. dubius fosse particolarmente suscettibile ai danni conseguenti a periodi di digiuno anche brevi (3-4 giorni) durante tali fasi (non è stato comunque possibile incrementare la quantità di O. formosa periodicamente somministrata in modo che potesse essere consumata in più giorni, evitando quindi il digiuno, poiché l’alga azzurra non è in
grado di sopravvivere a lungo nel mezzo di coltura di P. dubius, e le quantità non consumate al momento della somministrazione avrebbero contribuito all’inquinamento progressivo del mezzo di coltura). Ciò non spiega tuttavia il periodo di circa 30 giorni in cui è stato possibile allevare senza problemi tale specie. È stato anche ipotizzato che gli elementi in tracce contenuti nel mezzo di coltura (salino) delle alghe azzurre possano aver influenzato cronicamente la salinità dell’acqua, rendendola progressivamente inadatta a P. dubius. Tali ipotesi non sono al momento verificabili. Il metodo di allevamento sin qui adottato dovrà essere perfezionato al fine di ottenere colture monoclonali della specie in esame stabili nel tempo.
III.3.2: Caratterizzazione morfologica e molecolare
La specie oggetto di studio è stata descritta come Pseudomicrothorax dubius in base alle caratteristiche morfologiche osservate, che ne hanno permesso la distinzione da P. agilis e P.
gracilis, due specie estremamente simili fra loro (Kahl, 1926; in Inamori, 2006). Data
l’accertata somiglianza con P. dubius, non è stato ritenuto necessario effettuare una comparazione dettagliata anche con la specie P. foliformis, che sembra peraltro essere una specie rara ed è, ad oggi, poco documentata (descritta in Kahl, 1926; in Inamori, 2006). La caratterizzazione della sequenza del 18S rDNA ha confermato l’identità del marcatore molecolare utilizzato con quello precedentemente caratterizzato in P. dubius e depositato nella banca dati di riferimento (sequenza X65151). In tale data base non sono tuttavia presenti altre sequenze di Pseudomicrothorax spp. a cui estendere il confronto. Tale risultato ha comunque contribuito ad avvalorare l’identificazione degli organismi oggetto di studio con la specie P. dubius.
III.3.3: Caratterizzazione del simbionte
Gli organismi endosimbionti presenti nella popolazione di P. dubius oggetto di studio sono stati identificati come α.proteobatteri filogeneticamente correlati al genere Rickettsia. Tuttavia, la distanza evolutiva, calcolata in base al marcatore molecolare utilizzato (16S rDNA), è tale da suggerire l’appartenenza della specie in questione ad un genere diverso da
Rickettsia.
- Cenni sulle caratteristiche dell’ord. Rickettsiales
L’ordine Rickettsiales (cl. Alphaproteobacteria) comprende numerose specie batteriche Gram-negative ed aerobie; tutte le specie comprese nell’ordine risultano essere endosimbionti obbligati (Emelyanov, 2001). Infezioni da batteri appartenenti a tale ordine
sono state documentate in una grande varietà di organismi, sia protozoi che metazoi (uomo compreso). Nella maggior parte dei casi, la natura del rapporto simbiotico non è stata chiarita; è stato tuttavia documentato il ruolo patogeno esercitato dal simbionte in alcune di tali associazioni.
L’ordine Rickettsiales può essere suddiviso in cinque sottogruppi principali, comprendenti rispettivamente i genn. Rickettsia, Ehrlichia, Neorickettsia, Wolbachia e Holospora (Fredricks, 2005), ciascuno dei quali risulta monofiletico sulla base dell’analisi della sequenza del 16S rDNA (Fredricks, 2005). L’esatto status tassonomico di tali gruppi non è sempre ben definito od unanimamente riconosciuto, così come la collocazione dei generi all’interno delle varie famiglie non appare sempre stabile (Yu and Walker, 2003; Fredricks, 2005). Nel presente lavoro è stato fatto riferimento principalmente alla classificazione riportata nella seconda edizione del Bergey’s Manual of Systematic Bacteriology (Springer, 2005). I gruppi tassonomici principali sono costituiti dalle famm. Rickettsiaceae PINKERTON 1936, Anaplasmataceae PHILIP 1957 ed Holosporaceae GÖRTZ AND SCHMIDT 2005; secondo alcuni autori (Fredricks, 2005), nell’ordine devono essere ugualmente compresi i genn. Bartonella e Grahamella (fam. Bartonellaceae), benché presentino significative differenze a livello dell’ultrastruttura e della sequenza del 16S rDNA
La famiglia Rickettsiaceae comprende il maggior numero di specie, suddivise nei genn.
Rickettsia DA ROCHA AND LIMA 1916 e Orientia TAMURA, OHASHI, URAKMI, MIYAMURA 1995. Caratteristiche comuni a tali specie, conseguenti all’adattamento alla vita endosimbiotica, sono le ridotte dimensioni del genoma (circa un quarto rispetto a quello di E.
coli) e l’incapacità di sopravvivere all’esterno della cellula ospite (Yu and Walker, 2003),
così come l’assenza di batteriosomi circondanti i simbionti all’interno del citoplasma della cellula. Il gen. Rickettsia è stato suddiviso in due sottogruppi in ragione della somiglianza filogenetica e, soprattutto, delle caratteristiche cliniche della malattia sviluppata dall’uomo in conseguenza dell’infezione (Fredricks, 2005); per alcuni autori (Ogata et al., 2006) un terzo gruppo potrebbe essere costituito dalla sola specie R. bellii, simbionte di alcune zecche dei genn. Dermacentor e Amblyomma e debolmente patogena per piccoli mammiferi.
Il primo gruppo (specie di riferimento: R. rickettsii, R. conorii, R. mongolotimonae, R.
slovaca, R. akari, R. japonica, R. sibirica, R. africae, R. helvetica, R. australis, R. honei:
Fredricks, 2005) comprende specie simbionti di zecche dei genn. Dermacentor,
Rhipicephalus e Amblyomma, che ne costituiscono sia il serbatoio naturale che il veicolo
d’infezione. La trasmissione del batterio avviene per via verticale, poiché questi si trasmettono alla progenie della zecca infetta tramite le uova (via transovarica). Nelle specie non patogene, tale via costituisce l’unico sistema di propagazione della specie (Yu and Walker, 2003). Se trasmesse all’uomo (solitamente tramite il morso di una zecca infetta), alcune specie sono in grado di provocare la patologia nota come RMSF (Rocky Mountain
spotted fever), una rickettsiosi caratterizzata da forte stato febbrile e presenza di eruzioni
cutanee estese, che può occasionalmente avere decorso letale. Per tali specie, la trasmissione orizzontale è possibile, in quanto una zecca non portatrice di Rickettsia può contrarre l’infezione nutrendosi del sangue di un mammifero precedentemente infettato da una zecca associata al simbionte. Le specie di Rickettsia appartenenti a questo gruppo hanno distribuzione cosmopolita.
Nel secondo gruppo (specie di riferimento: R. prowazekii, R. typhi, R. felis: Fredricks, 2005) sono comprese le specie di Rickettsia ritenute agenti eziologici, nell’uomo, di tifo esantematico. L’infezione da R. prowazekii determina nell’uomo uno stato patologico (tifo) caratterizzata da stato febbrile intenso, eruzioni cutanee, alterazioni a carico del sistema nervoso e dell’apparato digerente, con esito spesso fatale se trascurato (Yu and Walker, 2003). Tale infezione viene contratta dall’uomo tramite il morso di insetti ematofagi (pulci) associati al simbionte: può assumere carattere epidemico (Yu and Walker, 2003). Serbatoi naturali dell’infezione appaiono essere alcune specie di piccoli mammiferi (es. scoiattolo volante americano): in alcune aree geografiche il serbatoio non è stato ad oggi identificato (Fredricks, 2005). R. typhi e R. felis sono gli agenti eziologici del tifo murino e del cosiddetto “tifo della pulce del gatto” o CFT (cat flea typhus). La sintomatologia di tali infezioni è simile a quella descritta per il tifo epidemico. L’infezione è trasmessa dal morso di ectoparassiti infetti (solitamente pulci), rispettivamente di piccoli mammiferi (topi, ratti, opossum) e del gatto. Tutte le specie citate sono cosmopolite.
Il genere Orientia comprende la sola specie O. tsutsugamushi, precedentemente nota come
Rickettsia tsutsugamushi: la separazione dal gen. Rickettsia è stata recentemente effettuata
sulla base di differenze a carico dell’ultrastruttura del batterio (parete cellulare priva di strato lipopolisaccaridico e di peptidoglicano) e della sequenza del 16s rDNA (Tamura et al., 1995, in Fredricks, 2005). Tale specie è endosimbionte obbligata di alcune specie di acari trombiculidi, che ne costituiscono tanto l’ospite principale quanto il serbatoio naturale ed il veicolo di trasmissione (Fredricks, 2005). Il simbionte si propaga per trasmissione verticale (via transovarica): non è documentata la trasmissione orizzontale, neppure in acari parassiti di mammiferi infetti (Yu and Walker, 2003). L’infezione nell’uomo, trasmessa delle larve dell’acaro, determina una forma di tifo nota come ST (scrub typhus), caratterizzata da febbre, necrosi della pelle, lesioni a carico dell’apparato digerente, possibili complicazioni a livello polmonare e/o neurologico, determinando eventualmente la morte (Odorico et al., 1998). Benché prevalentemente diffusa nelle regioni asiatiche, O. tsutsugamushi è specie ormai cosmopolita (Yu and Walker, 2003).
Recentemente, due nuove specie batteriche, non patogene, sono state descritti come simbionti di due sanguisughe dulciacquicole, appartenenti rispettivamente alle spp. Torix
sequenza del 16S rDNA collocano tali specie all’interno della famiglia delle Rickettsiaceae, benché l’analisi filogenetica abbia rivelato la loro posizione basale rispetto al clade comprendente le sequenze di Rickettsia spp. tradizionalmente associate agli artropodi.
La famiglia Anaplasmataceae comprende i genn. Anaplasma THEILER 1910, Ehlichia MOSHKOUSKI 1945, Neorickettsia PHILIP, HADLOW, HUGHES 1953 e Wolbachia HERTIG, 1936. Come le precedenti, anche le specie comprese in tali generi sono simbionti intracellulari di altri organismi; alcune di esse possono essere patogene se associate a mammiferi. Tali batteri risiedono normalmente all’interno del citoplasma della cellula ospite, inseriti in batteriosomi circondati da membrana, a differenza di quanto descritto per le specie appartenenti alla fam. Rickettsiaceae (Fredricks, 2005). Alcune specie formano aggregati cellulari caratteristici, denominati “morulae”, all’interno delle cellule dell’ospite. Ciascuna di tali formazioni è collocata all’interno di un vacuolo circondato da membrana.
Il genere Anaplasma comprende specie batteriche caratterizzate da un ciclo cellulare complesso, che prevede la presenza di un ospite intermedio (solitamente un grande mammifero, che può inoltre costituire un serbatoio naturale) ed uno definitivo (una zecca;
Anaplasma spp. è generalmente associato a zecche del genere Ixodes: Yu and Walker, 2003).
Il batterio si riproduce all’interno dei tessuti della zecca, e viene in contatto col mammifero tramite il morso di questa: la trasmissione orizzontale ad altre zecche avviene tramite il mammifero infetto. Anaplasma spp. non si trasmette per via transovarica e la simbiosi con la zecca, a differenza di quella col mammifero, appare instabile nel tempo (Yu and Walker, 2003). L’infezione da Anaplasma spp. può essere contratta dall’uomo tramite trasmissione meccanica dell’infezione, conseguente al contatto con liquidi organici infetti e/o alla puntura di mosche ematofaghe contaminate (la mosca non costituisce di per sé un serbatoio per
Anaplasma spp.: Yu and Walker, 2003), oltre che dal morso della zecca infetta;
l’associazione simbiotica stabilita con l’uomo è transitoria e di natura patogena (anaplasmosi).
Il genere Ehrlichia appare strettamente correlato, in termini filogenetici, al gen. Anaplasma. Anche le specie appartenenti a tale genere presentano un ciclo vitale comprendente due ospiti: l’ospite definitivo è in questo caso una zecca del gen. Amblyomma, Dermacentor o
Ixodes (Yu and Walker, 2003; Fredricks, 2005) mentre l’ospite intermedio è di solito un
grande mammifero, che ne costituisce il serbatoio naturale. Il genere Ehrlichia viene normalmente suddiviso in sottogruppi in ragione della patogenicità dell’associazione con l’uomo delle specie in questione.
Le sole specie attualmente comprese nel gen. Neorickettsia sono N. helimnthoeca, N. risticii e N. sennetsu (queste ultime erano precedentemente classificate nel gen. Ehrlichia: Yu and Walker, 2003; Fredricks, 2005). Caratteristica di tali specie è l’associazione con platelminti trematodi, generalmente parassiti di salmonidi dulciacquicoli, che ne costituiscono sia il
serbatoio che il veicolo d’infezione. L’infezione da Neorickettsia spp. può trasmettersi ai mammiferi carnivori mediante ingestione di pesce contenente trematodi infetti, e ai mammiferi erbivori tramite ingestione accidentale di cercarie infette. Nell’uomo, l’infezione da N. sennetsu (causata da un trematode parassita attualmente non identificato: Fredricks, 2005) può causare una patologia mononucleosi-simile, non grave, denominata “sennetsu
fever”.
Il genere Wolbachia comprende batteri simbionti altamente specializzati. Tali organismi sono endosimbionti obbligati di artropodi (prevalentemente insetti: si stima che il 16% delle specie comprese in questa classe possa essere associato a Wolbachia spp: Yu and Walker, 2003) e nematodi. In alcune specie di nematodi (filarie) la presenza del batterio è indispensabile per la riproduzione dell’ospite: l’associazione può essere considerata di tipo mutualistico (Yu and Walker, 2003). La presenza di batteri Wolbachia-simili è stata tuttavia segnalata anche in associazione con alghe dei genn. Cosmocladium e Pleurastrum (Fredricks, 2005). L’associazione con artropodi viene trasmessa quasi esclusivamente per via transovarica (trasmissione verticale): poiché l’ospite maschio non è in grado di trasmettere l’infezione alla progenie, numerose specie di Wolbachia hanno sviluppato la capacità di interferire nei meccanismi riproduttivi della specie ospite, selezionando positivamente la produzione di embrioni di sesso femminile, in modo da ottimizzare la trasmissione dell’infezione. Tali adattamenti includono la femminilizzazione o la soppressione degli embrioni di sesso maschile, l’induzione alla partenogenesi, ed un generale incremento della fecondità negli individui infetti (Fredricks, 2005). Le specie di Wolbachia non sono patogene per i mammiferi, benché i metaboliti prodotte da queste possano rendere maggiormente virulente le infezioni da filarie infette (Yu and Walker, 2003).
Per le caratteristiche generali del gen. Holospora (fam. Holosporaceae) cfr. Parte Terza:
Discussione dei risultati ottenuti, in Capitolo II: Caratterizzazione morfologica e molecolare della specie Frontonia salmastra e dei simbionti ad essa associati).
Infine, il clade monofiletico in cui sono comprese tutte le sequenze di rDNA mitocondriale sinora caratterizzate origina dal’ord. Rickettsiales, il che lascia supporre che il simbionte ancestrale delle cellule eucariotiche, da cui sono derivati i mitocondri, potesse essere un batterio Rickettsia-simile (Emelyanov, 2001).
- Associazioni simbiotiche fra batteri Rickettsia-simili e protisti e considerazioni sul simbionte di P. dubius
Precedenti studi (Steinert et al., 1997, Steinert et al., 1998, Scriwan et al., 2002, in Vannini
et al., 2005b; Ogata et al., 2006) hanno dimostrato la capacità di alcune specie di Rickettsia
(es. Rickettsia bellii) di poter colonizzare protisti sarcomastigofori del gen. Acanthamoeba in condizioni di laboratorio. Nessuna di tali associazioni è però stata ritrovata in popolazioni
naturali. Successivamente, è stata segnalata una associazione presente in natura fra una specie di Rickettsia ed una popolazione di un ciliato ipotrico marino (Diophrys
appendiculata: Vannini et al., 2005b). La sequenza del simbionte caratterizzato è risultata
basalmente posta rispetto al clade comprendente le specie di Rickettsia associate agli artropodi (Vannini et al., 2005b). Analoga collocazione ha mostrato la sequenza di un secondo organismo Rickettsia-simile, presente come simbionte secondario in un ciliato ipotrico del gen. Euplotes (E. octocarinatus ceppo FL(12)-VI: Vannini, unpubl.): è stato ipotizzato che tali batteri possano rappresentare un nuovo genere all’interno della fam.
Rickettsiaceae.
Il simbionte di Pseudomicrothorax dubius, caratterizzato nel presente lavoro, rappresenta un ulteriore esempio di associazione simbiotica fra tale gruppo di procariorti e protozoi ciliati. Le posizioni relative dei cladi comprendenti le sequenze dei simbionti di D. appendiculata e
E. octocarinatus e quella del simbionte di P. dubius all’interno della famiglia Rickettsiaceae
sono tuttavia tali da suggerire un basso grado di parentela fra gli organismi in questione. Le prime due specie, relativamente al marcatore utilizzato, mostrano un alto grado di somiglianza reciproca: l’associazione fra di esse appare stabile e la percentuale di dissimilarità bassa (Vannini, unpubl.). Risultano collocate in posizione basale al clade “Rickettsia”, a propria volta suddiviso in due sister-groups comprendenti rispettivamente le rickettsie associate ad artropodi ed il clade formato da R.. limoniae e dalle due specie simbionti di sanguisughe recentemente caratterizzate. La posizione del simbionte di P.
dubius appare per contro indipendente dal “Rickettsia cluster”; il clade comprendente tale
sequenza e quelle di O. tsutsugamushi, suo sister group, è posto basalmente rispetto a tale
cluster, e la distanza filogenetica misurabile tra i nodi dai quali questi raggruppamenti
originano appare elevata. La classificazione in un genere diverso da Rickettsia è stata proposta già per i simbionti di D. appendiculata, e conseguentemente anche di E.
octocarinatus (Vannini et al., 2005b): dato che il simbionte di P. dubius si colloca
basalmente rispetto a tali organismi, appare vieppiù legittima l’ipotesi di una sua classificazione all’interno di un genere, appartenente alla fam. Rickettsiaceae, diverso da
Rickettsia. Allo stesso modo, l’associazione al gen. Orientia non è supportata da elevati
valori di bootstrap, e la posizione appare mutevole in ragione dell’algoritmo utilizzato per l’elaborazione dell’albero (cfr. Parte seconda: Risultati dell’analisi, presente capitolo). Le percentuali di similarità calcolabili fra la sequenza di O. tsutsugamushi e quella del simbionte oggetto di studio risultano del resto non elevate (89% con O. tsutsugamushi AF062074). È pertanto ipotizzabile che l’organismo di nuova caratterizzazione non sia da ascrivere neppure al gen. Orientia. Le caratteristiche ultrastrutturali osservate differenziano il simbionte di P. dubius dalle specie comprese nella fam. Anaplasmataceae; l’analisi filogenetica della sequenza ha confermato tale differenziazione. È dunque possibile
ipotizzare per tale organismo la collocazione in un nuovo genere compreso all’interno della famiglia Rickettsiaceae.
Per quanto riguarda la tipologia dell’associazione simbiotica ritrovata in P. dubius, essa non è stata definita. Come precedentemente affermato, associazioni simbiotiche con procarioti non sono mai state segnalate per tale specie: la popolazione oggetto di studio è apparsa per contro massicciamente infetta; l’infezione è inoltre apparsa stabile nel tempo, tanto in condizioni di laboratorio che in natura. La medesima situazione è stata riportata per D.
appendiculata (Vannini et al., 2005b). Benché sia possibile che tale associazione sia
costantemente sfuggita all’osservazione nel corso degli studi precedentemente condotti su tale specie, appare tuttavia maggiormente probabile che essa non fosse presente nelle popolazioni allora analizzate. La simbiosi osservata nell’ambiente oggetto del presente studio non appare tuttavia come un evento occasionale e sporadico, a carico di pochi individui, ma ben diffusa e rappresentata nella popolazione nonché, come accennato, stabile nel tempo. L’ipotesi conseguente a tali osservazioni è che P. dubius non rappresenti, in generale, l’ospite abituale del simbionte Rickettsia-simile caratterizzato, e che non sia coevoluto con esso; la popolazione in oggetto potrebbe essere piuttosto venuta accidentalmente in contatto con tale organismo, dotato di alte capacità infettive e di bassa specificità d’ospite. Queste caratteristiche, come precedentemente enunciato, sono proprie di numerose specie appartenenti all’ord. Rickettisales. Poiché attualmente non sono state descritti organismi Rickettsia-simili a vita libera, né del resto la loro esistenza appare probabile in quanto tutte le specie comprese in tale gruppo sono specializzate per la vita simbiotica (Fredricks 2005), è possibile ipotizzare la presenza, nell’ambiente oggetto di studio, di una o più specie ospiti costituenti il serbatoio naturale del batterio caratterizzato. L’associazione con P. dubius, come affermato, è apparsa stabile durante i due mesi in cui essa è stata seguita, tanto in natura che nelle colture monoclonali; non è tuttavia possibile stabilire se tale specie possa costituire il serbatoio permanente del batterio. Organismi
Rickettsia-simili non sono stati segnalati in nessuna delle altre specie di protozoi ciliati
sottoposte a screening durante il presente lavoro; è tuttavia possibile che l’eventuale ulteriore ospite possa non essere un protista bensì un metazoo. È nota la capacità di molte specie appartenenti all’ord. Rickettsiales di infettare e riprodursi in ospiti differenti: per alcune di esse (genn. Anaplasma, Ehrlichia) la presenza di due ospiti è necessaria per il completamento del ciclo vitale (Yu and Walker, 2003). La capacità di sopravvivere in ospiti unicellulari è del resto documentata per molte rickettsie simbionti di artropodi (Steinert et
al., 1997, Steinert et al., 1998, Scriwan et al., 2002, in Vannini et al., 2005b) o di anellidi
(Ogata et al., 2006).
In conclusione, è possibile che l’associazione descritta non sia propria della specie P. dubius, ma rappresenti un caso di infezione sporadica, forse circoscritto alla sola popolazione
oggetto di studio, da parte di un simbionte Rickettsia-simile altamente infettivo. Tale infezione potrebbe rappresentare una specifica fase del ciclo vitale del batterio, nel caso in cui questo preveda la presenza di più ospiti (come accade in altre specie dell’ordine
Rickettsiales: Yu and Walker, 2003), oppure un’associazione definitiva e stabile nel tempo
(in tal caso il ciliato costituirebbe il serbatoio naturale del batterio in questione). La ricerca di possibili eucarioti associati al medesimo batterio simbionte, presenti nell’ambiente oggetto di studio, rappresenterebbe un possibile sviluppo delle indagini sin qui compiute (cfr. Sezione
4: Conclusioni e Prospettive Future).
La natura dell’associazione fra P. dubius ed il simbionte caratterizzato non è stata chiarita. Apparentemente, la presenza del batterio non impedisce l’accrescimento e/o i processi vegetativi dell’ospite (mancano dati relativi ad eventuali anomalie indotte dal simbionte nei processi sessuali). La stessa considerazione è stata riportata per gli endosimbionti Rickettsia-simili di D. appendiculata (Vannini et al., 2005b) ed E. octocarinatus (Vannini, unpubl.). È possibile che tali organismi non esercitino un’azione patogena sugli ospiti ciliati, benché possano comunque costituire una forma di parassitismo intracellulare. Il ritrovamento di individui vitali privi di simbionti tanto nelle popolazioni naturali che nelle colture monoclonali di P. dubius (oltre che alla mancanza di segnalazioni del batterio in altre popolazioni della medesima specie) suggerisce che tale associazione sia effettivamente non necessaria per l’ospite.
Se è possibile escludere un effetto patogeno a carico del ciliato, non si conoscono al momento gli effetti dell’infezione da parte del batterio simbionte di P. dubius in ospiti pluricellulari. La mancata patogenicità dell’organismo nei confronti del ciliato non costituisce una prova della sua innocuità per altre specie (la maggior parte delle rickettsie patogene per grandi mammiferi non provocano danni sensibili alle zecche che le veicolano). Stabilire il livello di patogenicità di questo batterio Rickettsia-simile nei confronti di metazoi, ed in particolare nei vertebrati, potrebbe costituire un campo di studi futuri potenzialmente interessante, tanto per la conoscenza dei cicli vitali di simili organismi, quanto per le eventuali ricadute in ambito sanitario ed epidemiologico.