Capitolo 1 – Introduzione
1.1 Le piante medicinali e aromatiche
L’organizzazione mondiale della sanità (OMS) ha puntualizzato il termine di “pianta medicinale” assegnandola ad “ogni vegetale che contiene sostanze che possono essere utilizzate per scopi terapeutici o preventivi, sotto forma di preparati semplici, oppure, dopo averle isolate e modificate chimicamente, possono far parte di prodotti farmaceutici e quindi sono i precursori di sintesi chimico-farmaceutiche”. Con questa definizione si è voluto rivalutare tutta una serie di piante, di norma conosciute con l’espressione di “piante della medicina popolare”, che costituivano fino a pochi decenni fa la base della scienza medica, spesso dimenticate con l’avvento successivo dei farmaci di sintesi (De Maria G., 1992). Tuttavia negli ultimi anni questo interesse sembra aver ripreso vigore poiché, secondo quanto riportato dalla World Health Organization, più del 25% della popolazione nei Paesi industrializzati e più dell’80% nei Paesi in via di sviluppo si cura con rimedi naturali (Canter P. et al., 2005).
Con la definizione di “pianta aromatica” vengono indicate quelle piante dotate di una o più sostanze che conferiscono particolari odori o sapori e che vengono impiegate nella preparazione di bevande, profumi, cosmetici e per condire e alimenti. Spesso le due definizioni di “pianta medicinale” e “pianta aromatica” vengono incluse nell’unica accezione di pianta officinale (ISMEA, 1994).
Negli ultimi decenni abbiamo assistito ad un rinnovato interesse per l’ uso di prodotti derivanti da piante medicinali e ad un elevato interesse nei “nutraceuticals” o cibi funzionali, nei quali i costituenti fitochimici possono promuovere azione salutare a lungo termine o avere proprietà medicinali. Sebbene la distinzione tra piante medicinali e nutraceutici può talvolta essere vaga, caratteristica primaria dei nutraceutici è quella di avere un ruolo nutrizionale e i benefici nella salute possono essere raggiunti attraverso un loro utilizzo a lungo termine come cibi. In contrasto, molte piante medicinali esibiscono specifiche azioni curative senza avere un ruolo nutrizionale nella dieta umana e possono, quindi, essere usate in risposta a specifici problemi di salute al di fuori di intervalli a breve o lungo termine.
Molte piante medicinali sono oggetto di interesse della ricerca fitochimica e della farmacognosia: nell’area della fitochimica, le piante medicinali sono state caratterizzate per composti bioattivi che sono stati isolati e sottoposti ad analisi strutturali; la ricerca da un punto di vista farmacognostico ha coinvolto saggi di bioattività, identificazione di potenziali modalità di azione e siti target per composti fitomedicinali attivi (Briskin D.P., 2000).
1.2 Principi attivi: i prodotti del metabolismo secondario
I principi attivi, responsabili dell’attività curativa delle piante, sono prodotti del metabolismo secondario e la loro sintesi non è altro che l’attuazione di una strategia di difesa della pianta svolgendo un ruolo fondamentale nell’ecofisiologia delle piante; i prodotti secondari hanno un ruolo di difesa contro erbivori, attacchi patogeni e nella competizione tra piante e un ruolo attrattivo nei confronti di organismi benefici quali impollinatori e simbionti; inoltre, i metaboliti secondari hanno azione protettiva nei confronti di stress abiotici . Lavori recenti hanno indicato i ruoli potenziali dei prodotti secondari a livello cellulare come regolatori di crescita delle piante, modulatori dell’espressione genica , e composti implicati nella trasduzione del segnale (Berlin J., 1988; Briskin D.P., 2000).
Grazie alla loro attività biologica i metaboliti secondari sono stati utilizzati per secoli nella medicina tradizionale: attualmente corrispondono a preziosi composti quali farmaceutici, cosmetici, chimici o più recentemente nutraceutici (Bourgaud F., 2001).
I composti secondari delle piante sono generalmente classificati, in accordo con la loro via biosintetica, in tre grandi famiglie molecolari: fenoli, terpeni e steroidi, alcaloidi (Bourgaud F., 2001).
Gli effetti benefici derivano dalla combinazione di prodotti secondari presenti nelle piante medicinali che sono raggruppati per specie o per gruppo tassonomico.
A differenza dei farmaci di sintesi basati su un singolo principio attivo, molte fitomedicine esibiscono i loro effetti benefici attraverso l’azione additiva o sinergica di molti composti chimici che agiscono ad un singolo o a molteplici siti target associati con un fisiologico processo (Briskin D.P., 2000).
1.3 L’importanza delle moderne biotecnologie per le piante medicinali
Le droghe, cioè le parti di pianta utilizzate a fini terapeutici, si possono ricavare da piante spontanee o coltivate; il metodo di produzione usato in ogni singolo caso è in gran parte determinato da fattori economici: può essere conveniente raccogliere la droga da piante spontanee, se queste sono abbondanti ed i costi relativamente bassi, mentre alti costi ed una carenza della pianta spontanea rende la coltivazione un’alternativa più economica (De Maria G., 1992; Samuelsson G., 2003)
La maggioranza delle piante sono raccolte allo stato spontaneo senza che esista alcuna regolamentazione, perciò di esse molte sono in via di estinzione e solo una piccola percentuale
risulta essere coltivata (Canter P. et al., 2005). Da qui nasce la preoccupazione per la diminuzione delle piante allo stato spontaneo, per la perdita della diversità genetica e per la degradazione dell’habitat.
Inoltre la pianta selvatica dà spesso un prodotto molto eterogeneo, inadatto soprattutto ad un rifornimento continuo e all’ottenimento di un prodotto standardizzato.
La coltivazione in pieno campo è solo una risposta all’insufficiente reperimento del materiale vegetale che presenta una notevole variabilità nella concentrazione dei metaboliti secondari. Per questo, per la loro estrazione, l’impiego di sistemi di coltura artificiale biotecnologici potrebbe essere una valida alternativa alla coltivazione tradizionale. Questi elementi, insieme alla necessità di aumentare la produzione di materiale vegetale con caratteristiche qualitative uniformi, spingono le case farmaceutiche ad innovare i sistemi di ricerca puntando anche sulle tecnologie geniche e cellulari, note come Biotecnologie (Falcone A.M.,1990).
1.4 Biotecnologie vegetali: colture in vitro di cellule e tessuti vegetali
La coltivazione di un tessuto vegetale su di un mezzo artificiale è stata descritta per la prima volta nel 1939 (White Philip R.) ma la maggior parte del lavoro in questo campo è iniziata intorno agli anni ’50 soprattutto grazie a Skoog e suoi collaboratori. Oggi, la coltura di cellule e tessuti vegetali rappresenta una tecnica importante in diversi campi, quali la produzione commerciale di piante ornamentali, il miglioramento genetico di vegetali e gli studi sulla biosintesi di metaboliti secondari. Di notevole interesse è anche la produzione industriale di sostanze naturali di origine vegetale, inclusi i farmaci (Samuelsson G., 2003).
L’obiettivo dell’attività biotecnologica in vitro applicata alle piante medicinali è quello di selezionare e propagare linee cellulari con elevata capacità di sintesi dei composti attivi utili in ambito farmaceutico e alimentare, avendo una particolare attenzione per quelli contenuti in specie ormai poco disponibili in natura sia allo stato spontaneo che allo stato coltivato (Bajaj Y.P.S., 1998; Minghetti, 2003).
I principali vantaggi delle colture cellulari sono:
- Sintesi dei metaboliti secondari bioattivi in ambiente controllato e, quindi, indipendenza dalle condizioni climatiche e del terreno;
- Eliminazione delle influenze biologiche negative che colpiscono la produzione dei metaboliti secondari in natura, quali microrganismi ed insetti;
- Selezione delle cultivars che possiedono una più elevata produzione di metaboliti secondari;
- Presenza di definiti sistemi di produzione che portano ad una migliore qualità e resa del prodotto;
- Assenza, negli estratti, di residui di erbicidi o di inquinanti ambientali, in quanto la coltura è condotta in condizioni asettiche;
- Estrazione effettuata appena la coltura ha raggiunto le dimensioni adeguate; eliminando così il problema della raccolta, trasporto e stoccaggio del prodotto;
- Salvaguardia dell’ambiente in quanto non si effettua una raccolta intensiva; - Conservazione del materiale riprodotto per lunghi periodi.
I sistemi di coltivazione in vitro permettono di sfruttare cellule, tessuti, organi o interi organismi coltivandoli e manipolandoli geneticamente per ottenerne composti desiderati ( Ramachandra Rao S., 2002).
La vera potenzialità delle colture in vitro è data dalla sinergia di vari aspetti fondamentali: la coltura delle cellule vegetali permette la produzione su larga scala di numerosi metaboliti secondari, mentre le trasformazioni genetiche permettono l’attivazione di vie metaboliche secondarie o la produzione ex-novo di molecole.
La rigenerazione in vitro si presenta come primo e fondamentale passaggio per ottenere un numero indefinito di cloni di una stessa pianta prescelta (Debergh et al., 1981).
La produzione di biomassa in vitro può essere ottenuta attraverso la coltura intensiva di piantine complete (micropropagazione), di organi o tessuti particolari (radici, hairy roots), di embrioni somatici (biomassa differenziata) o attraverso la produzione di callo su substrato solido e di colture e sospensioni cellulari in substrato liquido (biomassa indifferenziata) (Debergh et al., 1981).
La micropropagazione utilizza come espianto iniziale un meristema (l’apice proliferativo di un germoglio della pianta o di una gemme dormiente) da cui è possibile ottenere un germoglio che, dopo ripetuti cicli di moltiplicazione, può essere indotto a radicare mediante trasferimento su un idoneo terreno di coltura, per dare origine ad una piantina completa. Con la micropropagazione vengono prodotte, in breve tempo, un elevato numero di piante, geneticamente uniformi ed esenti da virus (Rossi et al., 2004).
La morfogenesi è invece quel processo di differenziazione ex novo di tessuti e strutture organizzate a partire da un espianto o da un callo, che può riguardare un embrione oppure singoli organi. Nel primo caso si parla di organogenesi e più precisamente di caulogenesi (rigenerazione di germogli) e di rizogensi (rigenerazione di radici), nel secondo caso il processo si definisce embriogenesi e gli embrioni sono detti somatici.
Sia l’embriogenesi che l’organogenesi possono essere processi diretti o indiretti a seconda che la morfogenesi prenda avvio rispettivamente dalle cellule dell’espianto o da quelle del callo da esse prodotto (Barcaccia C. e Falcinelli M., 2006).
La rigenerazione avventizia parte dallo sviluppo di germogli avventizi da tessuti od organi privi di strutture preformate (porzioni fogliari, segmenti internodali, cotiledoni, strutture fiorali) indotto attraverso un processo di organogenesi diretta o indiretta.
L’embriogenesi somatica prevede lo sviluppo di embrioni a partire da tessuti somatici; mentre un embrione somatico dal punto di vista genetico è perfettamente identico alla pianta donatrice, nel caso dell’embrione zigotico ogni individuo è diverso geneticamente per effetto della ricombinazione dei caratteri maschili e femminili che si ha attraverso la meiosi (Rossi et al., 2004).
• ORGANOGENESI
L’organogenesi, la capacità dei tessuti vegetali di formare organi ex novo, rappresenta la base della propagazione asessuale delle piante a partire da tessuti somatici poiché le cellule vegetali hanno la caratteristica di essere totipotenti, cioè hanno la capacità di potersi differenziare in tutte le cellule di un organismo adulto per poter quindi rigenerare una pianta intera completa in tutti i suoi tessuti ed identica alla pianta di partenza .
Le cellule, prima di poter essere indotte alla produzione di primordi, devono divenire competenti, ovvero devono acquisire la capacità di rispondere allo stimolo organogenetico. Questa tappa di solito viene raggiunta con l’aggiunta nel mezzo di coltura di fitoregolatori di crescita. Una volta avuta la produzione dei primordi si dice che il tessuto è “determinato”.
Le cellule isolate da organi o tessuti di una pianta possono moltiplicarsi secondo un processo di organogenesi se poste in un terreno di coltura in determinate condizioni nutrizionali, ambientali e ormonali (Rossi et al., 2004).
Esistono due processi di sviluppo in grado di condurre all’organogenesi:
• Organogenesi diretta: le cellule dell’espianto agiscono come i precursori diretti del primordio senza passare dalla fase di callo. La rigenerazione diretta di un germoglio può partire da alcune cellule meristematiche che, dopo alcune divisioni cellulari, intraprendono il percorso dell’organogenesi; in seguito alla formazione di radici, avrà origine dal germoglio una plantula geneticamente identica alla pianta madre;
• Organogenesi indiretta: partendo dall’espianto primario, per arrivare ad avere cellule meristemoidi e poi i primordi, si passa da una fase di callo (cellule dedifferenziate totipotenti); la formazione di un callo avviene in seguito ad una proliferazione cellulare non organizzata, e tale callo può moltiplicarsi tal quale, oppure può seguire un percorso
di organogenesi che porta alla produzione di germogli e radici, in seguito a specifici stimoli ormonali (Schwarz et al., 2003).
Un ulteriore metodo di propagazione in vitro è quello dell’embriogenesi somatica è un processo attraverso il quale gruppi di cellule o tessuti portano alla formazione di embrioni, detti appunto somatici, che assomigliano agli embrioni zigotici dei semi, mantenendo infatti la capacità di svilupparsi in plantula se posti in un mezzo di coltura opportuno. Gli embrioni somatici sono strutture bipolari con un meristema apicale ad uno radicale che portano, appunto, alla formazione di individui completi (Barcaccia C. e Falcinelli M., 2006).
La rigenerazione di intere piante tramite embriogenesi somatica a partire da singole cellule, indotte a produrre un embrione e poi a svilupparsi in pianta adulta, offre notevoli vantaggi rispetto alla micropropagazione classica tramite organogenesi (Bajaj Y.P.S., 1991), questo grazie al tasso di moltiplicazione maggiore e ai minori costi sostenuti per plantula. Gli embrioni somatici possono infatti essere indotti a proliferare in sospensione in una coltura adeguata e, quando sub-colturati settimanalmente, arrivano a produrre una grande quantità di embrioni molto rapidamente.
L’embriogenesi somatica applicata alle piante medicinali è relativamente recente, i primi studi risalgono ai primi anni novanta; in generale è stato notato che la diminuzione della concentrazione dei regolatori di crescita ha promosso lo sviluppo di embrioni e la loro germinazione (Rout G.R. et al, 2000).
Una evoluzione di questa tecnica è rappresentata dalla ibridazione somatica mediante fusione di protoplasti. Un protoplasto è una cellula vegetale sprovvista di parete cellulare la cui eliminazione può avvenire in diversi modi e secondo diverse tecniche. Un protoplasto può essere isolato per rigenerare una pianta dalla singola cellula oppure, se necessario, per ibridare due specie sessualmente incompatibili. L’eliminazione della parete, seguita dalla fusione dei protoplasti, permette di aggirare il problema dell’incompatibilità tra due specie, permettendo di ottenere una piantina con caratteristiche diverse provenienti rispettivamente dalle due specie di partenza (Bajaj Y.P.S., 1988).
Molti degli ibridi ottenuti per alcune specie sono stati studiati per l’aumento del contenuto in metaboliti secondari, per ottenere piante medicinali resistenti ad antibiotici, nematodi, virus e patogeni in genere.
Alcune piante medicinali sono state rigenerate da colture di protoplasti, che permettono di ottenere un grande numero di individui, ma che possono essere anche una ricca sorgente di variabilità genetica e variazione somaclonale. La variazione somaclonale è il risultato di cambiamenti genetici indotti da fattori ambientali (mutazioni) o da danni meccanici sui cromosomi a seguito del quale le
linee cellulari derivanti da protoplasti differenti variano considerevolmente nelle loro proprietà biologiche (Samuelsson G., 2003).
I protoplasti sono utilizzati anche in ingegneria genetica nelle operazioni di trasformazione, in quanto la mancanza della parete cellulare facilita notevolmente l’inserzione del frammento di DNA all’interno della cellula (Bajaj Y.P.S, 1988).
Una metodologia molto affermata è quella delle colture di calli e colture cellulari in sospensione. Le colture cellulari vegetali sono definite anche “fabbriche chimiche di metaboliti secondari” (Ramachandra Rao S., 2002) e rappresentano a oggi una valida alternativa alla coltivazione di piante medicinali provenienti o meno dal vitro.
Il motivo principale alla base di questo modo di ottenere metaboliti secondari preziosi per le case farmaceutiche è la dispendiosità di tempo, denaro e rese finali effettive che la normale coltivazione di piante medicinali in campo comporta per alcune specie.
Come per la precedente metodologia anche l’uso di colture cellulari o di callo sfrutta la totipotenza cellulare che mantiene l’informazione genetica ed è quindi in grado di produrre quel range di principi attivi presenti nella piante madre (Ruffoni B., 2007).
Una coltura di callo può iniziare da una singola cellula, che è capace di moltiplicarsi per divisione e formare un ammasso di cellule interconnesse (Samuelsson G., 2003).
Il termine callo si riferisce ad un tessuto disorganizzato costituito da un ammasso di cellule parenchimatiche in attiva divisione ottenuto da tessuti differenziati che si sdifferenziano su idonei substrati colturali e in opportune condizioni ambientali.
Le cellule vengono mantenute nello stato di callo mediante l’utilizzo di fitoregolatori nel substrato di crescita: le auxine stimolano la crescita cellulare attraverso l’induzione della sintesi dell’enzima cellulasi che determina l’elasticità delle pareti cellulari, favorendo la distensione e l’accrescimento cellulare, mentre le citochinine stimolano la moltiplicazione cellulare attraverso un’azione a livello ribosomiale con l’incremento della sintesi dell’RNA e con l’induzione della sintesi di proteine specifiche (Minghetti, 2003).
Generalmente per iniziare una coltura di callo si utilizzano piccoli pezzi di tessuti vegetale (espianti) provenienti da una porzione della pianta in cui la divisione cellulare è sempre attiva. Le parti più adatte sono apici culinari e radicali, foglie, cotiledoni di piante molto giovani, tessuti di ovari o stami, parti di zone cambiali di radici o steli.
Il callo viene fatto crescere in un substrato semi-solido, ma generalmente, per la produzione di metaboliti secondari viene preferita la coltura in sospensione in cui si può utilizzare lo stesso mezzo di coltura impiegato per il callo, evitando l’aggiunta dell’agar.
La differenza tra coltura di callo e quella cellulare in sospensione risiede nel fatto che mentre in una coltura di callo si ha la formazione di un tessuto disorganizzato, dove ciascuna cellula vegetale è in contatto con le altre, nella coltura in sospensione le singole cellule sono indipendenti nel mezzo di coltura oppure formano piccoli aggregati.
Le colture in sospensione vengono solitamente iniziate dalle colture di callo friabile: la friabilità facilita l’inizio di una coltura in sospensione poiché è sufficiente agitarlo nel mezzo di coltura per ottenere la separazione tra cellule (Samuelsson G., 2003).
Per ottenere un’elevata resa di metaboliti, è necessario quindi trasferire il callo in un substrato liquido in agitazione, di solito dispensato prima in beute da laboratorio sistemate su piattaforme a movimento orbitale e poi in reattori (Ruffoni B., 2007).
Lo stato liquido del substrato facilita gli scambi gassosi e nutritivi tra le cellule e il mezzo di coltura; mentre l’agitazione ne consente l’aerazione e previene i fenomeni di aggregazione cellulare.
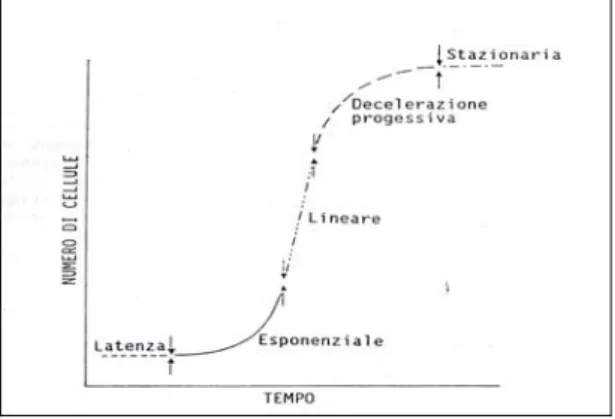
Lo sviluppo cellulare avviene secondo una tipica curva di crescita (Fig. 1.1).
Nella prima fase, chiamata fase di latenza, il numero di cellule rimane costante mentre si intensificano tutte le attività metaboliche; la lunghezza di questa fase varia a secondo dello stato fisiologico delle cellule. A livello biochimico coincide con un aumento di ATP per effetto della ossidazione dei carboidrati, aumento di proteine e acidi nucleici
Fig. 1.1: curva di crescita del callo suddivisa nelle varie fasi
Nella seconda fase, chiamata fase di crescita esponenziale, la maggior parte delle cellule sono morfologicamente indifferenziate (cellule meristematiche) e la velocità di crescita diminuisce in presenza di uno o più fattori limitanti (zucchero, vitamine, amminoacidi). Nella terza fase, la fase lineare, aumenta la dimensione cellulare, mentre nella successiva fase di decelerazione la moltiplicazione cellulare rallenta fino ad arrestarsi. Infine, si raggiunge la fase stazionaria (plateau) nella quale la crescita raggiunge un plateau, mentre continuano ancora le attività metaboliche ed
aumenta la quantità di cellule con grandi vacuoli. La crescita è normalmente calcolata come peso fresco o peso secco (Falcone, 1990).
Nell’ultimo decennio si sta sviluppando l’uso di fermentatori o bioreattori per una produzione massiccia di cellule vegetali, “hairy roots“ o addirittura, piantine intere. I bioreattori sono dei sistemi di coltura sofisticati in cui tutte le condizioni di crescita sono tenute rigorosamente sotto controllo, infatti la crescita di cellule in tali apparecchi permette un controllo preciso di parametri quali concentrazione di ossigeno e anidride carbonica, pH e rimescolamento delle sostanze nutritive. In altre parole i bioreattori permettono la coltura in massa di cellule vegetali in contenitori da 2 ad alcune decine di migliaia di litri ”(Taticek et al.,1991).
Da un punto di vista industriale, la produzione di prodotti naturali attraverso la coltivazione di cellule vegetali in fermentatori, invece che da piante intere, potrebbe offrire diversi vantaggi quali:
Indipendenza da tutti i fattori ambientali e da variazioni geografiche e stagionali
Un sistema di produzione definitivo, che assicura un continuo approvvigionamento di prodotti uniformi e di alta qualità
Possibilità di produzione di nuovi composti che non sono normalmente presenti nelle pianti madri
Produzione rapida del materiale
Le cellule vegetali possono operare biotrasformazioni stereo- e regiospecifiche per la produzioni di nuovi composti a partire da precursori di scarso valore (Ramachandra Rao S., 2002; Samuelsson G., 2003).
I sistemi di coltura adottati sono principalmente di due tipi: i sistemi chiusi e i sistemi continui. I SISTEMI CHIUSI consistono in colture cellulari ottenute aggiungendo una determinata quantità di cellule ad un volume fisso di substrato di crescita; la quantità di callo utilizzata come inoculo iniziale è variabile dal 5 al 20% v/v. In questo tipo di sistemi la biomassa aumenta finché un fattore nutritivo diviene limitante ed i metaboliti vengono recuperati direttamente dal mezzo di coltura. Nei SISTEMI CONTINUI i fattori nutritivi sono forniti da una continua aggiunta di mezzo fresco accompagnata dal prelievo di un uguale volume di coltura. Questo ricambio di substrato è possibile mediante particolari apparecchiature chiamate chemostati che consentono di mantenere il volume della coltura costante per mezzo di prelievi fatti attraverso uno scarico di “troppo pieno”(Taticek et al.,1991).
1.5 Colture di tessuti trasformati – trasformazione genetica
La trasformazione genetica prevede la manipolazione di sequenze di DNA e il trasferimento di geni da un organismo ad un altro per poter ottenere piante con nuovi tratti morfo-fisiologici e/o una più alta produzione, da parte delle colture, di principi attivi.
La manipolazione diretta di sequenze di DNA per alterare l’espressione genica nelle piante medicinali è un’area della ricerca in forte espansione, soprattutto nell’ambito dell’alterazione delle vie biosintetiche per la produzione di metaboliti secondari, per la produzione di principi attivi ad attività terapeutica, componenti alimentari e pesticidi (Canter P. et al., 2005).
I metodi di trasformazione possono essere indiretti, quando si avvalgono dell’uso di vettori, quali virus e batteri, o possono essere diretti nel trasferimento del DNA .
La trasformazione con batteri sfrutta la capacità dell’agente patogeno di trasferire il proprio DNA plasmidico nelle cellule vegetali. Il plasmide, nel quale viene introdotto un segmento genico di interesse, si integra nei cromosomi delle cellule vegetali che, riproducendosi, acquisiranno stabilmente i caratteri introdotti e li trasmetteranno alla progenie (Ramachandra Rao S., 2002). Geni estranei possono essere introdotti nelle cellule vegetali delle dicotiledoni con l’aiuto di batteri del suolo appartenenti al genere Agrobacterium che causano due malattie nelle piante: il tumore del colletto e le radici pelose.
La conseguenza dell’infezione è che il DNA contenuto nelle regioni T del plasmide (chiamate T-DNA) viene trasferito dal batterio ed incorporato nel DNA nucleare della pianta ospite. Plasmidi provenienti da Agrobacterium tumefaciens causano lo sviluppo del tumore del colletto e perciò vengono chiamati plamidi Ti (plasmidi che Inducono il tumore). Piante infettate con Agrobacterium rhizogenes sviluppano un gran numero di radici laterali o hairy roots (letteralmente “radici pelose”) come risultato dell’espressione dell’informazione genetica contenuta nel plasmide Ri (plasmide che induce radici): i geni rol (o locus root) presenti nel T-DNA incrementano la sensibilità alle auxine piuttosto che codificare per la sua biosintesi.
L’interesse per tali radici nasce dal fatto che queste hanno la capacità di accrescersi molto rapidamente senza l’aggiunta di auxine di sintesi e, grazie alla loro stabilità genetica, hanno un livello di produzione di metaboliti secondari piuttosto stabile (Ramachandra Rao S., 2002; Samuelsson G., 2003).
Finora, colture di radici trasformate “hairy roots” sono state ottenute da più di 100 specie diverse. I prodotti ritrovati in colture di radici trasformate comprendono alcaloidi (alcaloidi indolici, isochinolinici, pirrolizidinici, chinolinici, quinolizidinici, tropanici, ecc), terpenoidi (monoterpeni,
sesquiterpeni, diterpeni, triterpeni, steroidi, cardenolidi), flavonoidi, composti fenolici (cumarine, tannini), antrachinoni, chinoni, lignani, proteine, ecc. (Ruffoni B., 2007).
1.6 Colture in vitro: produzione di metaboliti secondari
L’attuale aumentata domanda di prodotti alimentari naturali e di sostanze medicinali di origine vegetale porta la produzione in vitro di metaboliti secondari delle piante ad essere una valida alternativa alla produzione industriale di prodotti sintetici.
La produzione di queste sostanze mediante la coltura di tessuti vegetali si basa sulla premessa che gli stessi prodotti rinvenuti in natura all’interno di un organo, di un frutto o di altri tessuti vegetali, possono essere indotti ad accumularsi in cellule indifferenziate (Smith M.L.A., 2003).
La sintesi dei metaboliti secondari, nelle sospensioni cellulari, si verifica quando la cellula rallenta o cessa la sua attività di divisione e quindi quando si riduce il suo metabolismo primario (Berardi G., 1991).
I fattori che influiscono sulla sintesi di metaboliti secondari in vitro sono molteplici: tipo di materiale di partenza, condizioni ambientali e climatiche, mezzo di coltura (ad esempio la quantità di carboidrati presenti influisce sulla biomassa, in quanto la crescita è eterotrofa), tipo e quantità di ormoni presenti, luce (il passaggio della luce ad intensità ed in quantità ottimali rappresenta un prerequisito per la massima espressione dei metaboliti), temperatura(Smith M.A.L., 2003).
I metodi che oggi vengono usati per aumentare la produzione di metaboliti secondari sono: ottimizzazione del mezzo e dei fattori ambientali, selezione di linee cellulari ad alte rese, elicitazione e coltivazione di organi, specialmente “radici pelose”(Samuelsson G., 2003).
La composizione del mezzo, specialmente riguardo ai sali ed ai regolatori della crescita, ha una grande influenza sulla produzione dei metaboliti secondari. Inoltre, le aggiunte successive di glucosio al substrato possono aumentare l’accumulo di metaboliti secondari qualora vengano confrontate con colture in cui viene utilizzata una concentrazione fissa (Smith M.A.L., 2003).
Molti ricercatori stanno provando a comprendere i percorsi biosintetici messi in atto dalle piante per produrre i composti organici, al fine di poterne indurre una resa maggiore: a questo scopo occorre agire sulle tappe enzimatiche che portano alla produzione del metabolica di interesse e ciò può essere realizzato attraverso l’utilizzo di elicitori (Ramachandra Rao S., 2002). Questi composti, sono rilasciati quando i microrganismi attaccano le piante ed attivano i geni delle piante che codificano per gli enzimi necessari per la sintesi delle fitoalessine (Samuelsson G., 2003).
Gli elicitori possono essere di origine biotica (estratti proteici, omogenati fungini o batterici autoclavati, polisaccaridi, chitosano, glicoproteine) o abiotica (raggi UV, sali di metalli pesanti, agenti chimici di vario tipo) e sono appunto sostanze in grado di indurre stress nelle cellule e che, una volta aggiunti al mezzo di coltura, stimolano la produzione dei composti attivi (Ramachandra Rao S., 2002).
L’infezione di piante causata da microrganismi spesso induce la produzione di metaboliti che normalmente non sono presenti nella pianta sana: queste sostanze, chiamate fitoalessine, sono dannose per gli organismi infettanti e fanno parte del sistema di difesa.
La produzione di metaboliti secondari da colture di cellule viene oggi effettuata per quelle molecole che hanno costi di estrazione elevati e basse rese da materiale vegetale proveniente da coltivazione (Dornenburg H., 1997; Ravishankar G.A., 1993).
A livello commerciale su vasta scala sono stati messi a punto protocolli per la produzione ed estrazione di: berberina, shikonina e saponine del Ginseng (Ramachandra Rao, 2002; Smith M.A.L., 1995) attraverso l’uso di bioreattori. La berberina è prodotta in vitro da due membri della Famiglia delle Ranuncolaceae (Thalictrum minus e Coptis japonica); la shikonina è prodotta in vitro da Lithospermum erythrorhizon in quantità 800 volte maggiore rispetto a quella ottenibile dalle radici della pianta; le saponine sono prodotte in vitro da Panax ginseng.
Sono state inoltre effettuate ricerche nel campo di altri metaboliti secondari quali: aromi (es. vanillina prodotta in bioreattori da callo derivato da espianti vegetativi di Vanilla planifolia dalla industria ESCAgenetic Corporation- San Carlos- CA), coloranti per alimenti (es. antocianine da Euphorbia millii), composti medicinali (es. taxolo), diversi olii essenziali e insetticidi naturali (Ramachandra Rao, 2002).
• PRODUZIONE DI ANTIOSSIDANTI NATURALI IN VITRO
I composti reattivi dell’ossigeno (ROS: Reactive Oxygen Species-radicali liberi), sono composti instabili e altamente reattivi ad emivita brevissima, responsabili del danno ossidativo a carico di macromolecole biologiche, come DNA, carboidrati e proteine. Questi composti agiscono come ossidanti, ovvero sono in grado di donare l’atomo di ossigeno “instabile” ad altre sostanze. I ROS sono continuamente prodotti nell’organismo come conseguenza dei normali processi metabolici (Halliwell et al., 1989).
Per contrastare l’azione dei ROS, l’organismo ha a disposizione una serie di meccanismi enzimatici, quali la superossido dismutasi, attiva contro il radicale superossido e la catalasi, che riduce il perossido di idrogeno a acqua e ossigeno molecolare, oppure l’organismo attiva meccanismi non enzimatici di difesa: quest’ultimi sono composti antiossidanti endogeni a basso peso molecolare,
che reagiscono con i composti ossidanti riducendone il potenziale nocivo (glutatione, ubichinolo e acido urico, tutti normali prodotti del metabolismo corporeo).
Per antiossidante intendiamo “qualsiasi sostanza che, presente in concentrazione molto bassa rispetto a quella di un substrato ossidabile, è in grado di ritardare o inibire significativamente l’ossidazione di quel substrato” (Halliwell et al., 1989).
La nutrizione svolge un ruolo fondamentale nel mantenere l’efficacia delle difese enzimatiche antiossidanti: molti oligoelementi essenziali, tra cui selenio, rame, manganese e zinco sono coinvolti nella struttura molecolare o nell’attività catalitica di questi enzimi.
I principali composti antiossidanti di origine alimentare sono: acido ascorbico (vitamina C), tocoferoli (vitamina E), carotenoidi, flavonoidi.
I carotenoidi sono pigmenti naturali rossi, gialli e arancioni contenuti in molti vegetali che, essendo lipofili, entrano nei meccanismi di protezione delle lipoproteine (in particolare LDL) esposte alla perossidazione lipidica (Maffei M.,1999).
I flavonoidi sono antiossidanti polifenolici contenuti nella frutta, in molti vegetali e in bevande come il tè, il vino e la birra; è un termine che riassume molti gruppi di sostanze strutturalmente diverse (Siani A., 2000).
L’attenzione dell’industria farmaceutica ed alimentare si è concentrata sui composti antiossidanti di origine alimentare per promuovere le proprietà benefiche degli alimenti, in quanto i dati disponibili mostrano che un aumento dell’assunzione degli antiossidanti da fonti naturali, in particolare frutta e vegetali, può risultare utile nella prevenzione di varie malattie. La loro produzione può essere efficacemente ottenuta attraverso le colture in vitro.
• COMPOSTI FENOLICI
I composti fenolici rappresentano una delle principali classi di metaboliti secondari, la quale comprende un ampio spettro di sostanze molto eterogenee ma tutte caratterizzate dalla presenza di un anello aromatico con uno o più sostituenti ossidrilici .
Il contenuto dei composti fenolici nei tessuti vegetali varia in funzione della specie, della varietà, dell’organo considerato, dello stadio fisiologico e delle condizioni pedoclimatiche.
La grande varietà di strutture fenoliche riflette un altrettanto grande diversificazione delle loro funzioni: possono fungere da pigmenti fiorali a basso peso molecolare, da antibiotici, da schermo nei confronti delle radiazioni UV, da repellenti per gli insetti e da segnali nelle interazione pianta-microorganismi.
I composti fenolici si accumulano preferenzialmente negli organi aerei della pianta (steli, foglie, fiori e frutti) piuttosto che nelle radici. Questa localizzazione preferenziale viene messa in relazione
con l’effetto induttore della luce sul metabolismo fenolico, nonchè con il ruolo protettivo esercitato dai composti fenolici nei confronti delle radiazioni ultraviolette. I flavonoidi e gli acidi fenolici sono i più importanti antiossidanti polifenolici presenti nella dieta (Maffei M.,1999).
N atomi di carbonio Scheletro base Classe
6 C6 Fenoli semplici Benzochinoni 7 C6-C1 Acidi fenolici 8 C6-C2 Acetofenoni Acidi fenilacetici 9 C6-C3 Acidi idrossicinnamici Fenilpropeni Cumarine 10 C6-C4 Naftochinoni 13 C6-C1-C6 Xantoni 14 C6-C2-C6 Stilbeni Antrachinoni 15 C6-C3-C6 Flavonoidi Isoflavonoidi 18 (C6-C3)2 Lignani 30 (C6-C3-C6)2 Biflavonoidi n (C6-C3)n (C6) n (C6C3C6) n Lignine Melanine Tannini condensati
Fig. 1.2: principali composti fenolici presenti nelle piante
FLAVONOIDI
I flavonoidi sono metaboliti secondari delle piante, principalmente idrosolubili, appartenenti alla grande famiglia dei polifenoli (Pietta P., 2005).
La struttura chimica di questi composti, presenti in tutte le parti della pianta, possiede uno scheletro base C6-C3-C6: gli atomo di carbonio all’interno dello scheletro provengono da due distinte vie metaboliche, una unità C6 deriva dall’acido cinnamico, mentre l’unità C6-C3 deriva dalla condensazione testa coda di 3 unità di acetato (Salisbury et al.,1992).
Sono presenti nelle felci e in tutte le piante superiori, dove si trovano sia allo stato libero, ma in maggior misura come glicosidi. Essi differiscono per i loro sostituenti, rappresentati principalmente
da gruppi ossidrilici e metossilici, e per la natura e la posizione della parte zuccherina legata all’aglicone. Sono stati isolati più di 2000 composti ed essi costituiscono la più ampia classe di prodotti naturali di tipo fenolico .
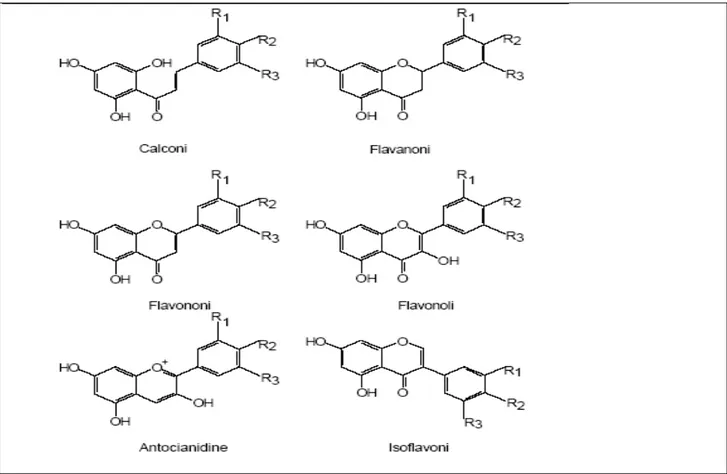
Nell’ambito della famiglia dei flavonoidi è possibile distinguere sei classi principali: flavanoli (catechina, epicatechina), flavonoli (quercetina), flavanoni, flavoni, isoflavoni, antocianine (Fig. 1.3).
Fig. 1.3: formule di struttura delle principali classi di flavonoidi. R1, R2, R3 possono essere costituiti da: H, OH e OCH3.
Sono composti variamente colorati, in genere in giallo, e contribuiscono al colore dei fiori e frutti, dove sono presenti come glicosidi sciolti nel succo cellulare. Una particolare eccezione è rappresentata dalle antocianidine e dai loro glucosidi (conosciuti come antocianine), che sono rossi, violetti o blu a seconda del pH del succo della cellula (Samuelsson G., 2003). Assorbono fortemente le radiazioni ultraviolette ed il loro accumulo nell’epidermide delle foglie suggerisce una funzione specifica di protezione, da parte di tali composti, dal danno che queste radiazioni causano al DNA delle cellule (Pietta P., 2005).
Per tali costituenti sono state descritte le seguenti attività: anti-infiammatoria, antiepatotossica, antitumorale, antimicrobica, antivirale, inibitrice di enzimi, antiossidante, protezione contro la fragilità capillare. Attualmente i flavonoidi sono presi in considerazione soprattutto per l’attività antiossidante e quella di “scavenger” nei confronti dei radicali liberi dell’ossigeno che sono sostanze chimiche altamente instabili molto dannose per l’organismo in quanto possono accelerare i processi di invecchiamento cellulare.
ACIDI FENOLICI
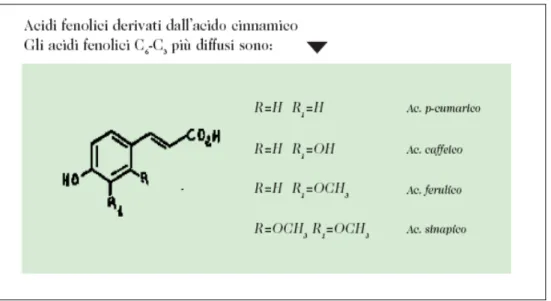
Gli acidi fenolici sono composti polifenolici e rappresentano un gruppo di sostanze ampiamente presenti nelle piante superiori.
Sono caratterizzati da un anello aromatico con una catena alifatica laterale con tre atomi di carbonio (scheletro carbonioso di base C6-C3).
Sono derivati dell’acido cinnamico e i più diffusi sono: l’acido caffeico, l’acido p-cumarinico, l’acido ferulico, l’acido gallico e l’acido sinapico . Spesso questi ultimi si trovano esterificati con alcoli alifatici (acido cicorico) o con acido quinico (acido clorogenico) o con glucosio ed altri zuccheri (echinacoside). Sono metaboliti secondari delle piante e sono considerati sostanze farmacologicamente attive come agenti antiossidanti, antimutageni e anticancerogeni (Fig. 1.4) (Maffei M.,1999).