Le forze elettrostatiche cambiano
all’avvicinarsi dei due atomi di idrogeno. Queste forze elettrostatiche sono:
attrazione tra gli elettroni e il nucleo repulsione tra i due nuclei
repulsione tra i due elettroni
+ e– + e–
1s
H
H
1s2 atomi di H: ogni elettrone subisce la forza attrattiva di un protone
molecola di H2 : ogni elettrone subisce la forza attrattiva di entrambi i protoni
1s
H
H
1ssovrapposizione in fase di due orbitali 1s dell’idrogeno
s legame dell’ H2
H
H
Legame s : gli orbitali si sovrappongono lungo l’asse internucleare.
La sezione di un orbitale perpendicolare all’asse internucleare è un cerchio.
H
H
Gli orbitali 1s di due atomi di idrogeno separati sono lontani. Non c’è interazione. Ogni elettrone è associato a un solo
protone.
Appena i due atomi di idrogeno si avvicinano, i loro orbitali 1s cominciano a sovrapporsi e ogni elettrone comincia a subire la forza attrattiva di entrambi i protoni.
Gli atomi di idrogeno sono abbastanza vicini da fare si che una sovrapposizione apprezzabile ci sia tra i due orbitali 1s. La densità elettronica nella regione tra i due protoni è ora più facilmente individuabile.
Molecola dell’ H2. I due orbitali 1s dell’idrogeno sono stati sostituiti da un nuovo orbitale che comprende entrambi gli atomi e gli elettroni.
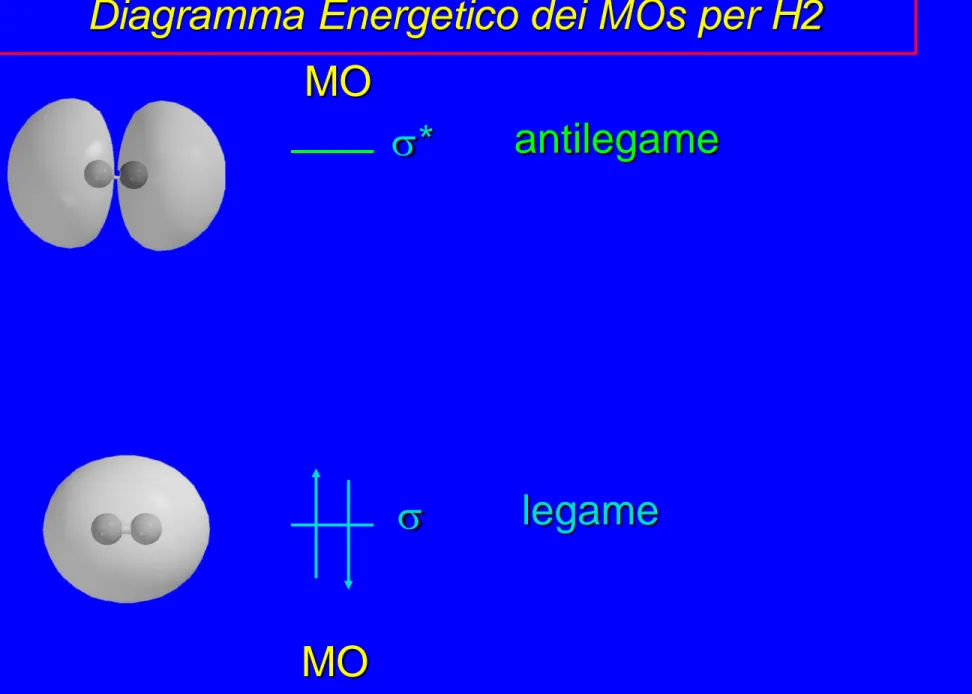
Il legame nell’ H2:
Gli elettroni in una molecola occupano orbitali
molecolari (MO) così come negli atomi occupano Orbitali atomici (AO).
(due elettroni per MO, analogamente a due per AO)
Gli orbitali molecolari si ottengono per
combinazione matematica di orbitali atomici Principi di Base
Due AOs forniscono due MOs
Combinazione di legame Combinazione di Antilegame yMO = y(H)1s + y(H')1s y'MO = y(H)1s - y(H')1s
Il metodo della combinazione lineare degli orbitali atomici esprime le funzioni d’onda molecolari
come somme e differenze delle funzioni d’onda degli orbitali atomici.
1s 1s AO
AO
legame antilegame s s* MO MO
legame antilegame s s* MO MO
legame antilegame s s* MO MO
Legame p legante Per sovrapposizione Di 2 orbitali p Legame s legante Per sovrapposizione Di 2 orbitali p
Legame nel metano e ibridazione orbitalica
tetraedro
Angoli di legame = 109.5° Distanze di legame = 1,10 A
Ma la struttura non sembra coerente con La configurazione elettronica del carbonio
Configurazione elettronica del Carbonio
2s
2p Solo due elettroni spaiati
Dovrebbero formare legami s solo con due Atomi di idrogeno
I legami dovrebbero essere ad angolo retto l’uno rispetto all’altro
2s 2p
Passaggio du un elettrone da orbitali 2s a orbitali 2p
2s
2p 2p
2s
2p
2s L’orbitale 2s
e i tre orbitali 2p si “ibridano”
2p
2s
2 sp3
4 orbitali equivalenti
semipieni sono in
accordo con quattro
legami e la
geometria tetraedrica
Forma degli orbitali
s p
Proprietà nodali degli orbitali
s
p + –
Forma degli orbitali ibridi sp3
s
p + –
+
prendere l’orbitale s e piazzarlo sull’orbitale p
s + p + + –
la funzione d’onda si rafforza nelle regioni in cui il segno è lo stesso
si ha interferenza distruttiva in regioni dotate di segno opposto
sp3 ibrido
L’orbitale mostrato è un ibrido sp
3analogo procedura, usando due
orbitali p e uno s dà gli ibridi sp
2la forma degli ibridi sp
2è simile
+ –
sp ibrido
l’orbitale ibrido non è simmetrico
La più alta probabilità di trovare un elettrone su un solo lato del nucleo favorisce legami più forti.
+ –
–
+ –
Il legame C—H
s
nel Metanosp3
s H C
H—C s H C
…forma un legame s .
la sovrapposizione in fase di un orbitale 1s semipieno dell’H con un orbitale ibrido sp3 semipieno del carbonio…
+
Giustificazione dell’Ibridazione Orbitalica
-in accordo con la struttura del metano
-permette la formazione di 4 invece che 2 legami
-legami che coinvolgono orbitali ibridi sp
3sono
più forti di quelli che prevedono sovrapposizione
s-s o p-p in quanto l’sp
3possiede un lobo più
grande il quale sovrapponndosi all’orbitale dell’al
tro atomo forma legami più forti
Ibridazione sp3 e legame nell’etano
Struttura dell’etano
CH3CH3 C2H6
geometria tetraedrica per ogni carbonio C—H distanza di legame = 1,10 A
Sovrapposizione in fase degli orbitali ibridi sp3 di un carbonio con gli ibridi sp3 di un altro.
La sovrapposizione è lungo l’asse
internucleare per fornire un legame s.
Il legame
s
C—C nell’EtanoSovrapposizione in fase degli orbitali ibridi sp3 di un carbonio con gli ibridi sp3 di un altro.
La sovrapposizione è lungo l’asse
Ibridazione sp2 e legame nell’etilene
C2H4
H2C=CH2
planare
angoli di legame: vicini 120°
distanze di legame: C—H = 1,10 A C=C = 1,34 A
2s 2p
Passaggio di un elettrone dall’orbitale 2s all’orbitale 2p
2s
2p 2p
2s
2p
2s
L’ibridazione avviene tra un
orbitale 2s e due dei tre orbitali 2p Ibridazione orbitalica sp2
2p 2s 2 sp2
3 orbitali semipieni
sp
2ibridi più un
orbitale 1 p non
ibridato
Ibridazione orbitalica sp22 sp2
2 dei 3 orbitali sp2
sono coinvolti in legami s agli
idrogeni; l’altro forma un legame s con il carbonio
p
2 sp2 p s s s s s Ibridazione orbitalica sp2
Legame
p
nell’Etilene2 sp2
l’orbitale p non ibridato del carbonio forma un legame p con l’altro carbonio
p
p
Bonding in Ethylenep
Bonding in Ethylene Bonding in Ethylene2
2 spsp22 p p
each carbon has an unhybridized 2
each carbon has an unhybridized 2p orbital p orbital
axis of orbital is perpendicular to the plane of the
axis of orbital is perpendicular to the plane of the ss bonds bonds Legame
p
nell’Etileneogni carbonio ha un orbitale non ibridato 2p
p
Bonding in Ethylenep
p
Bonding in Ethylene Bonding in Ethylene2
2 spsp22 p p
side-by-side overlap of half-filled
side-by-side overlap of half-filled
p
p orbitals gives a orbitals gives a p p bondbond
double bond in ethylene has a
double bond in ethylene has a s
s component and a component and a pp component component
Legame
p
nell’EtileneLa sovrapposizione laterale degli orbitali
p semipieni crea un legame p
il doppio legame nell’etilene ha una componente s e una p
Ibridazione sp
C2H2 lineare angoli di legame: 180° distanze di legame: C—H = 1,06 A C C = 1,20 A Struttura dell’acetilene HC CH
2s 2p
Passaggio di un elettrone dall’orbitale 2s al 2p
2s
2p 2p
2s
2p
2s
Ibridazione orbitalica sp
L’ibridazione avviene tra un
2p 2s 2 sp 2 p
Ibridazione orbitalica sp
2 orbitali semipieni
sp ibridi più due
orbitali 1 p non
ibridati
2 sp 2 p
Ibridazione orbitalica sp
1 dei 2 orbitali sp
è coinvolto in un legame s con
l’idrogeno; l’altro forma un legame s con il carbonio
s s s 2 sp 2 p
Ibridazione orbitalica sp
Legame
p
nell’acetilenegli orbitali non ibridi p del carbonio formano 2 distinti legami p con l’altro carbonio
2 sp 2 p
p
Bonding in Acetylenep
p
Bonding in Acetylene Bonding in Acetyleneone
one p bond involves one of the p orbitals on each carbonp bond involves one of the p orbitals on each carbon
there is a second
there is a second pp bond perpendicular to this one bond perpendicular to this one
2
2 spsp
2
2 pp
Legame
p
nell’acetileneUn legame p impiega uno degli orbitali p di ogni carbonio
p
Bonding in Acetylenep
p
Bonding in Acetylene Bonding in Acetylene2
2 spsp
2
2 pp
p
Bonding in Acetylenep
p
Bonding in Acetylene Bonding in Acetylene2
2 spsp
2
2 pp
Quale teoria
Tre Modelli
Lewis
la più comune e facile da applicare
Legame di valenza (Ibridazione degli orbitali)
- è più completa del modello di Lewis
- l’abilità di collegare struttura e reattività all’ibridazione si sviluppa con la pratica
Orbitali molecolari
potenzialmente il metodo migliore ma è il più astratto
richiede più esperienza per essere usato con efficacia
Geometria Tetraedrica H—C—H angolo = 109.5°
Metano
Geometria Tetraedrcia
L’assetto più stabile di gruppi legati a un atomo centrale è quello in cui si ha la massima
separazione delle coppie elettroniche (condivise o non condivise).
Repulsione delle Coppie Elettroniche di Valenza
Geometria distorta
H—O—H angolo = 105°
Da notare l’assetto tetraedrico delle coppie elettronoche
O
H
..
H
:
Acquageometria trigonale piramidale H—N—H angolo = 107°
N
H
H
H
:
AmmoniacaDa notare l’assetto tetraedrico delle coppie elettronoche
F—B—F angolo = 120° geometria trigonale planare
permette la massima separazione di tre coppie elettroniche
I doppi legami a 4 elettroni e i tripli legami
a 6 elettroni sono equiparabili a un singolo legame a 2 elettroni per ciò che riguarda i loro requisiti
spaziali.
H—C—H e H—C—O
gli angoli sono prossimi a 120° geometria trigonale planare
C
O
H
H
O—C—O angolo = 180° geometria lineare
O
C
O
+
—
non polare
Una sostanza possiede un momento dipolare se i centri della carica positiva e quella negativa
non coincidono.
m
= e x d(espressa in unità Debye)
—
+
polare
Momento Dipolare
Una sostanza possiede un momento dipolare se i centri della carica positiva e quella negativa
non coincidono.
m
= e x dla molecola deve avere legami polari necessario, ma non sufficiente
bisogna conoscere la forma della molecola perchè legami polari individuali
si possono cancellare
O
C
O
d+
d- d-
O
C
O
Il diossido di carbonio non ha momento dipolare: m = 0 D
m
= 1.62 Dm
= 0 DTetracloruro di Carbonio Diclorometano
La risultante di
questi due dipoli è
m
= 0 DIl tetracloruro di carbonio non ha momento dipolare perchè i contributi individuali dei legami polari si
cancellano.
La risultante di
questi due dipoli è Tetracloruro di carbonio
m
= 1.62 DI contributi individuali dei legami polari non si
cancellano nel diclorometano : esso ha un momento dipolare.
Diclorometano
La risultante di
questi due dipoli è
La risultante di