Possiamo giudicare il cuore di un uomo
dal modo in cui tratta gli animali…
INDICE
Abstract Pag. 1
Introduzione Pag. 2
CAPITOLO I: STOMACO: RICHIAMI DI ANATOMIA E FISIOLOGIA
Pag. 6
1.1 Cenni anatomici Pag. 6
1.1.1 Variazione e capacità Pag. 7
1.1.2 Conformazione esterna Pag. 7
1.1.3 Conformazione interna Pag. 9
1.1.4 Struttura Pag. 10
1.1.5 Vasi e nervi Pag. 11
1.1.6 Mezzi di fissità Pag. 12
1.2 Fisiologia gastrica Pag. 12
CAPITOLO II: LA SINDROME DELLA DILATAZIONE-TORSIONE GASTRICA
Pag. 15
2.1 Generalità Pag. 15
2.2 Cause e fattori predisponenti Pag. 15
2.3 Patogenesi Pag. 21
2.5 Diagnosi Pag. 26
2.6 Approccio terapeutico Pag. 31
2.6.1 Trattamento medico Pag. 31
2.6.2 Trattamento chirurgico Pag. 34
2.6.2.1 Detorsione in chirurgia Pag. 34
2.6.2.2 Intervento di gastropessi Pag. 38
2.6.2.3 Criteri di valutazione della necrosi gastrica
Pag. 43
CAPITOLO III: IL LATTATO PLASMATICO Pag. 46
3.1 Generalità Pag. 46
3.2 Modalità di misurazione Pag. 50
3.3 Utilità clinica Pag. 54
3.4 Studi precedenti sul lattato plasmatico in corso di GDV Pag. 55
CAPITOLO IV: STUDIO CLINICO Pag. 59
4.1 Scopo dello studio Pag. 59
4.2 Materiali e metodi Pag. 59
4.3 Risultati Pag. 74
4.4 Discussioni Pag. 89
4.5 Conclusioni Pag. 102
1
RIASSUNTO
Parole chiave: cane, sindrome dilatazione-torsione gastrica, lattato plasmatico, alterazioni della perfusione, outcome.
Obbiettivo: monitorare la concentrazione del lattato plasmatico nell’arco delle 24h dall’arrivo del paziente
affetto da sindrome della dilatazione-torsione gastrica (GDV) in pronto soccorso e valutare se l’andamento possa fornire informazioni sul miglioramento della perfusione tissutale rispetto alla lattatemia in entrata. Verificare se ad all’iperlattatemia all’arrivo corrisponda la presenza di alterazioni della perfusione gastrica o un peggiore outcome del paziente.
Materiali e metodi: sono stati arruolati 87 casi nel periodo compreso tra Gennaio 2006 e Maggio 2014. 11 casi
sono stati raccolti presso l’Ospedale D. ‘M. Modenato’ (PI) e 12 casi presso la Clinica 24H (FI) e di questi sono stati elaborati i lattati all’arrivo, dopo 12 ore e dopo 24. I rimanenti 64 casi sono stati raccolti presso la Clinica Vet. Strada Ovest (TV) dei quali sono stati elaborati i lattati solo all’arrivo. I dati ottenuti vengono elaborati attraverso due analisi: nella prima sono inclusi tutti gli 87 casi e viene valutata la lattatemia all’arrivo, la presenza e gravità di alterazioni della perfusione vascolare e l’outcome. Viene poi valutata la % di incidenza delle diverse alterazioni della perfusione vascolare; la % di mortalità, la media e ds del lattato plasmatico nei pazienti sopravvissuti e non; la media, la ds e la % di mortalità nei vari gruppi di soggetti divisi a seconda della gravità della lesione. Nella seconda analisi sono inclusi gli 11 casi dell’Ospedale D. ‘ M. Modenato’ (FI) e i 12 della Clinica 24h (PI). Viene valutata la lattatemia all’arrivo, post-intervento (entro 12 ore), dopo 24 ore; la presenza e gravità di alterazioni della perfusione vascolare/ischemia e l’outcome. Viene poi valutata la % di incidenza delle diverse alterazioni della perfusione vascolare; la media e ds delle concentrazioni del lattato plasmatico all’arrivo, entro 12 ore, dopo 24 ore; la % di diminuzione della lattatemia con il passare delle ore.
Risultati: la % di mortalità dei soggetti risulta essere in accordo con la bibliografia precedente. Risulta esserci
una correlazione positiva tra aumento della lattatemia, la gravità delle lesioni sulla parete gastrica e la mortalità. Risulta che una lattatemia ≥ 6mmol/L non costituisca un buon fattore predittivo né di presenza di necrosi né dell’outcome. Risulta invece più importante la valutazione del trend della lattatemia nel post 12 ore per dare una parere positivo o negativo sulla prognosi del paziente.
Conclusioni: la valutazione della lattatemia all’ingresso non rappresenta un buon indice predittivo di necrosi e
di prognosi del paziente. I risultati ottenuti suggeriscono quindi di valutare la lattatemia insieme agli altri parametri diagnostici, alla clinica e la valutazione del trend della lattatemia nel post 12 e 24 ore dall’intervento chirurgico.
ABSTRACT
Key Words: dog syndrome, gastric dilatation- volvulus syndrome, plasma lactate, gastric perfusion abnormalities, outcome.
Objective: monitoring the concentration of plasma lactate with the passing of the hours in those patients with
gastric dilatation- volvulus syndrome (GDV ) from presentation in Emergency Setting and during the time of charge. Verify if the trend of lactatemia can be helpful in providing more information about the improvement of perfusion tissue compared to the single input parameter. Check whether a high value plasma lactate on arrival corresponds the presence of gastric perfusion abnormalities or a worse outcome of the patient.
Materials and Methods: 87 cases are enrolled in the period from January 2006 to May 2014. 11 cases were
collected at the Vet Hospital 'M. Modenato '(PI) and 12 cases from the Clinic 24h (FI). Lactatemia was recorded on arrival, after 12 hours and after 24. The remaining 64 cases were collected at the Vet Clinic Strada Ovest (TV) which lactate were recorded upon arrival. Collected data were processed through two analyzes: the first included all 87 cases and the concentration of plasma lactate on arrival, presence and severity of gastric perfusion abnormalities/ ischemia and outcome are evalued. Of these is evaluated the % incidence of different vascular perfusion abnormalities; the % mortality, and the average ds of plasma lactate in patients survived and no; the mean, the ds and the % mortality in various groups of subjects divided depending on the severity of the lesion. The second analysis included: 11 cases of the Vet Hospital 'M. Modenato ' (PI) and 12 of the Clinic 24h ( FI). The lactatemia on arrival, post-intervention (within 12 hours ) after 24 hours was recorded; the presence and severity of gastric perfusion abnormalities and outcome are evalued. Of these is evaluated: the % incidence of different vascular perfusion abnormalities; ds and the average concentrations of plasma lactate on arrival, within 12 hours, after 24 hours; the % decrease in lattatemia with the passing of time.
Conclusion: the evaluation of the concentration plasma lactate on arrival is not a good predictor of necrosis and
prognosis of the patient. It is suggested to evaluate the lactatemia along with other diagnostic parameters, the clinic and the assessment of plasma lactate trends in the post 12 and 24 hours after surgery.
2
INTRODUZIONE
La sindrome dilatazione-torsione gastrica (Gastric Dilatation Volvolus, GDV) ha rappresentato e rappresenta ancora oggi un’importante patologia dei cani di taglia grande e gigante.
Rappresenta un’emergenza sia clinica che chirurgica e ad oggi il tasso di mortalità è stimato intorno al 15% (Brockman et al., 1995; Beck et al., 2006).
Numerosi sono gli studi fatti sulla ricerca delle cause di torsione che però rimangono ancora oggi sconosciute. Si può parlare quindi di fattori predisponenti: legati alla razza, all’età, al sesso, ai fattori genetici, al carattere dell’animale, alla dieta e anche ai fattori climatici.
La sindrome è caratterizzata da una progressiva dilatazione dello stomaco che può passare da una semplice dilatazione ad una torsione. Nella maggior parte dei casi la dilatazione gastrica precede la torsione, altre volte la torsione può verificarsi in assenza di una precedente dilatazione. Quando si parla di torsione questa può avvenire in senso orario o antiorario e può variare dai 90° ai 360°.
Durante la torsione lo stomaco trascina dietro di sé la milza, la cui posizione varia a seconda del grado di torsione gastrica. L'occlusione dei vasi splenici, causa una forte congestione dell’organo in seguito anche alla stenosi della vena porta.
Si instaurano così una serie di alterazioni fisiopatologiche importanti quali lo schiacciamento del diaframma da parte dello stomaco, compressione della vena cava caudale e vena porta con conseguente esclusione del fegato e del distretto splancnico e posteriore dal circolo. Il ritorno venoso al cuore non è più garantito e questo porta ad una perdita
3
del volume intravascolare che contribuisce alla scarsa perfusione d’organo, edema interstiziale, ipossia e ischemia locali.
Diversi organi addominali sono interessati da uno shock distributivo e da inadeguata perfusione tissutale, come il rene, il cuore, il pancreas, lo stomaco e l’intestino tenue.
In corso di GDV si possono istaurare squilibri elettrolitici e acido-base. L’alterazione più frequente è l’acidosi metabolica accompagnata anche da un’acidosi respiratoria per ridotta compliance polmonare. L’aumento della produzione del lattato plasmatico è il principale responsabile dell’acidemia causata dall’ipoperfusione sistemica. Talvolta si ha ipokaliemia.
In generale diagnosticare la sindrome della dilatazione-torsione gastrica è piuttosto semplice basandoci sulla sintomatologia clinica e il segnalamento. Un cane con GDV può presentare un’anamnesi di distensione addominale con timpanismo, falsa cifosi, conati di vomito non produttivo con emissione di sola saliva vischio-schiumosa, irrequietezza, oppure il proprietario può semplicemente trovare l’animale in decubito e depresso con l’addome dilatato o addirittura in uno stato comatoso.
Spesso i cani si presentano in shock cardiovascolare, con pallore delle mucose, aumento del tempo di riempimento capillare, estremità fredde, tachipnea, dispnea, polso debole.
Per fare diagnosi certa ci si avvale però dell’ RX che ci permette anche di fare distinzione tra la dilatazione e torsione.
Dopo aver formulato la diagnosi occorre iniziare al più presto la terapia che si basa su trattamento medico e chirurgico.
Il trattamento medico è volto alla stabilizzazione del paziente e alla decompressione dello stomaco. Si basa quindi sulla fluidoterapia, somministrazione di ossigeno, gastrocentesi e lavanda gastrica.
4
Il trattamento chirurgico risulta necessario quando non è possibile riposizionare lo stomaco attraverso l’uso della sonda gastrica durante l’esecuzione della lavanda. Inoltre risulta essere di fondamentale importanza per evitare l’insorgenza di recidive che risultano avere una percentuale elevata (80%) (Bojrab et al., 2001).
Risulta essere di notevole importanza l’esecuzione dell’emogasanalisi che permette di valutare l’equilibrio acido base e gli elettroliti del paziente. L’aumento della concentrazione del lattato plasmatico risulta essere la principale causa dell’acidosi metabolica che si verifica in questi pazienti.
Numerosi sono gli studi fatti sulla ricerca di una correlazione tra iperlattatemia, presenza di aree di necrosi gastrica e prognosi nel paziente.
Uno studio del 1999 definiva un cut-off di 6mmol/L come indice predittivo di prognosi fausta o infausta del paziente (de Papp et al.; 1999). Due studi successivi, uno del 2010 e uno del 2011, mettono in evidenza l’importanza della misurazione seriale della concentrazione del lattato plasmatico come fattore predittivo circa la prognosi (Zacher et al., 2010; Green et al., 2011). Infine uno studio più recente del 2013 indica un cut-off di 7,4 mmol/L come indice predittivo di necrosi e outcome (Santoro Beer et al., 2013).
Risulta quindi evidente che esiste una correlazione tra iperlattatemia e presenza di aree di sofferenza vascolare/necrosi e prognosi del paziente.
Non ci sono invece, a nostra conoscenza, studi attuali riguardo la valutazione di un cut-off che eventualmente permetta di dire se la prognosi del paziente è fausta o infausta, se questo risulta essere sempre vero o se risulta avere maggiore utilità la valutazione del trend della lattatemia nel corso del management della sindrome.
5
Lo scopo della tesi è dunque quello di valutare e monitorare la concentrazione del lattato plasmatico con il passare delle ore dall’arrivo del paziente in pronto soccorso e che questo possa essere utile nel fornire maggiori informazioni circa il miglioramento della perfusione tissutale rispetto alla valutazione del singolo parametro all’ingresso e possa permettere di valutare se ad un valore elevato all’arrivo di lattati corrisponda effettivamente la presenza di necrosi gastrica o un peggiore out come del paziente.
Per raggiungere tale scopo andremo dunque a valutare la concentrazione dei lattati all’arrivo in pronto soccorso, dopo 12 ore e dopo 24 dall’intervento chirurgico per esprimere, quindi, un parere positivo o meno sulla prognosi del paziente.
6
CAPITOLO I
STOMACO: RICHIAMI DI ANATOMIA E
FISIOLOGIA
1.1 CENNI ANATOMICI
Lo stomaco è una porzione dilatata del tubo digerente che fa seguito all’esofago, a livello del cardias e si continua, in corrispondenza del piloro, nell’intestino tenue. Rappresenta un serbatoio piegato su se stesso e sospeso, caudalmente al fegato, al centro della cupola
diaframmatica. È il primo degli organi essenziali per la digestione, è qui che iniziano i fenomeni chimici. La sua mucosa secerne il succo gastrico, ricco di acido cloridrico e di enzimi, di cui il principale la pepsina agisce sulle sostanze proteiche, mentre altri meno abbondanti, agiscono sui grassi.
Gli alimenti, sotto l’azione combinata di questa secrezione e dei movimenti esercitati dalla potente tonaca muscolare sono trasformati in una massa fluida, il chimo, la cui digestione verrà completata nell’intestino.
La specie canina è dotata, come la maggior parte dei mammiferi, di uno stomaco definito “semplice” o “uniloculare”, la cui mucosa è interamente ghiandolare (Barone, 2003).
7
1.1.1 VARIAZIONI E CAPACITÀ
Nel cane il volume dello stomaco varia molto non solo in base ad età e taglia del soggetto, ma anche in base al regime alimentare e allo stato di replezione.
L’organo è completamente nascosto sotto l’ipocondrio sinistro quando è vuoto e può arrivare a sospingere la massa intestinale fin verso la regione dopo un pasto molto abbondante. Nei grandi soggetti la sua capacità media arriva fino a 7 litri (Barone, 2003).
1.1.2 CONFORMAZIONE ESTERNA
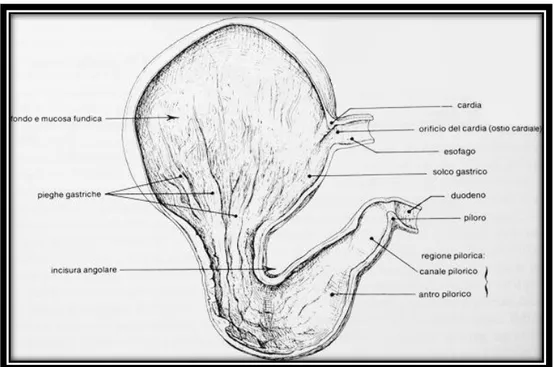
La forma dello stomaco varia a seconda dello stato di replezione ed in funzione della contrazione della tonaca muscolare. In generale forma un sacco allungato, leggermente appiattito in senso cranio-caudale, la sua parte sinistra, più voluminosa, è situata più in alto rispetto alla destra; la sua parte convessa è ventro-caudale. Si riconoscono così due facce, due curvature e due estremità, di cui la sinistra è la più grossa e rappresenta il Fondo, la destra più piccola è rappresentata dal Piloro (Fig. 1.1). Le due facce, anteriore o parietale e posteriore o viscerale, sono entrambe lisce, convesse, rivestite dal peritoneo viscerale e percorse dai vasi. La piccola curvatura è concava, guarda a destra e verso l’alto; relativamente breve s’inizia a sinistra del cardias continuandosi fino al piloro. Dà attacco su tutta la sua estensione al legamento epato-gastrico, parte del piccolo omento.
La grande curvatura è molto più lunga ed estensibile. Inizia dalla sommità del fondo e si porta, come la precedente, al piloro. È orientata verso sinistra e in basso, passando per la parte più declive dell’organo. Dà attacco, su tutta la sua lunghezza, al grande omento o epiploon.
8
Il fondo gastrico forma un fondo cieco arrotondato che si alza a sinistra, al di sopra del cardias. Determina, insieme all’inserzione dell’esofago, l’incisura cardiale. La parte pilorica si restringe, portandosi verso destra e in alto. Termina mediante il piloro, segnato da un restringimento anulare e da una maggiore consistenza. Le inserzioni dei due omenti si continuano in questa sezione, giungendo fino al tratto iniziale del duodeno. La conformazione esterna di uno stomaco mediamente pieno è caratterizzata dal fondo breve e dalla parte pilorica ristretta, che s’innalza considerevolmente a destra del corpo gastrico, con il piloro vicino al cardias. La porzione pilorica risulta più breve nelle razze piccole; si dilata molto solo quando lo stomaco è pieno. Il cardias è situato in alto ed è segnato da un brusco svasamento della terminazione dell’esofago (Barone, 2003).
Figura 1.1: Stomaco di cane: conformazione esterna, modica replezione, veduta posteriore
9
1.1.3 CONFORMAZIONE INTERNA
La cavità dello stomaco presenta le stesse divisioni esterne appena descritte, ripetendone esattamente la forma. È rivestita dalla mucosa gastrica e mostra gli orifici del cardias e del piloro (Fig. 1.2).
La mucosa gastrica non ha ovunque lo stesso aspetto, è molle, rossastra o rosea e forma pieghe regolari e numerose che scompaiono con la distensione, le pieghe gastriche. L’orificio del cardias è delimitato dall’insieme delle formazioni parietali che lo costituiscono. Segue da lì, in direzione dell’antro pilorico, il solco gastrico. L’orificio pilorico è circoscritto dal piloro, la sua parete è molto più ispessita di quella delle parti adiacenti (Barone, 2003).
10
1.1.4 STRUTTURA
La parete dello stomaco si compone di quattro tonache, dall’esterno verso l’interno, la tonaca sierosa, la tonaca muscolare, la tonaca sottomucosa e la tonaca mucosa.
La tonaca sierosa è costituita dal peritoneo viscerale che aderisce intimamente alla superficie esterna dell’organo, tranne che lungo alcuni tratti delle curvature.
La tonaca muscolare è composta da tre piani di fibre:
- lo strato longitudinale, più esterno, immediatamente sotto la sierosa;
- lo strato circolare, assente a livello del fondo, dà origine allo sfintere pilorico ispessendosi nella parte pilorica; - lo strato profondo, con un ispessimento al fondo dell’incisura cardiale, l’ansa cardiale, che circonda il cardias.
La tonaca sottomucosa è costituita da tessuto connettivo lasso, ricco in vasi sanguigni e reti nervose, formanti il plesso sottomucoso, il quale aderisce in modo lasso al piano muscolare e segue la mucosa nelle sue pliche.
La tonaca mucosa si solleva a stomaco vuoto in numerose pieghe regolari, ondulate, disposte più longitudinalmente a livello del canale pilorico.
Nel cane la superficie interna è rivestita dalla mucosa fundica, o mucosa gastrica propriamente detta, a livello del corpo e del fondo dello stomaco, popolata da ghiandole secernenti pepsinogeno ed HCl, ma anche gastrina e serotonina; segue la mucosa pilorica nell’area corrispondente alla grande curvatura, all’incisura angolare ed all’intera
11
regione pilorica, con ghiandole secernenti muco. Infine la mucosa esofagea si arresta in maniera netta a livello del cardias. La differenza di colore tra la parte pilorica, giallastra, e la restante mucosa, più rossa, è molto netta (Barone, 2003).
1.1.5 VASI E NERVI
Lo stomaco riceve sangue arterioso dai tre rami del tronco celiaco: - l’arteria gastrica sinistra;
- l’arteria lienale;
- l’arteria epatica, divisa in arteria gastrica destra e in gastro-epiploica destra.
Tutti i rami di queste arterie sono molto flessuosi, così da potersi adattare alle variazioni di volume dello stomaco, decorrono per un certo tratto al di sotto della sierosa, dando poi origine a diverse reti arteriose della parete: una rete sottosierosa, una rete muscolare, una rete sottomucosa e una rete mucosa.
Le vene si originano da una rete di grossi capillari che si anastomizzano attorno alle cripte, sotto la superficie della mucosa, dove ricevono i capillari perighiandolari. Da lì si dipartono in piccole vene, dando forma a numerose reti nella mucosa sottoghiandolare, nella sottomucosa, nella muscolare e nella sottosierosa. Da quest’ultimo tratto partono le vene dello stomaco propriamente dette.
Le grandi vene dello stomaco ripetono dapprima la disposizione delle arterie; in seguito se ne separano, cosicché le vene gastriche, lienale e gastro-duodenale convergono nella vena porta, raggiungendo il fegato.
I linfatici che si dipartono dallo stomaco nascono, a fondo cieco, sotto l’epitelio della mucosa, si uniscono precocemente in una rete mucosa, attraversando le varie componenti della parete dello stomaco
12
fino a fare capo al linfocentro celiaco, da cui si originano i linfonodi celiaci, gastrici, lienali, pilorici e duodenali.
I nervi provengono dal Sistema Parasimpatico mediante il Sistema, che è responsabile dell’aumento del tono, della motilità, e della secrezione dell’organo; dal Sistema Simpatico proviene la rete nervosa del Plesso Celiaco, la cui funzione è qui inibitrice (Barone, 2003).
1.1.6 MEZZI DI FISSITÀ
Mantenuto nella sua posizione dalla continuità dell’esofago e dell’intestino, lo stomaco è sospeso al centro di una cornice peritoneale, che prende attacco su tutta la sua periferia e le cui divisioni topografiche sono:
- il piccolo omento, che si porta dal fegato alla piccola curvatura dello stomaco ed alla parte iniziale del duodeno; - il legamento gastro-frenico, breve e robusto, prende attacco, a partire dalla terminazione dell'esofago, da una parte sul pilastro sinistro del diaframma, e dall’altra parte sul fondo dello stomaco;
- il grande omento che prende origine su tutta la grande curvatura dello stomaco. Nel cane è finemente fenestrato, infiltrato di grasso e molto sviluppato. Le sue due pareti, adiacenti ma non accollate, avvolgono quasi interamente la matassa intestinale (Barone, 2003).
1.2 FISIOLOGIA GASTRICA
Nello stomaco del cane l’alimento ingerito soggiorna più o meno a lungo ed è sottoposto ad una prima serie di processi demolitivi
13
enzimi secreti dalle ghiandole della mucosa fundica come acido cloridrico, pepsinogeno e chimosina.
Lo stomaco ha il compito di convogliare gradualmente nel duodeno, attraverso lo sfintere pilorico, il materiale parzialmente digerito.
Dopo un pasto lo stomaco risulta disteso dall’alimento e le sue pareti si addossano tonicamente al contenuto, pur senza comprimerlo in maniera energica. In questa fase lo sfintere pilorico è rilasciato, l’alimento ingerito rimane nel fondo dello stomaco, dove hanno luogo processi amilolitici e fermentativi, prima che la digestione gastrica vera e propria interessi l’intera massa alimentare. Lentamente il materiale alimentare a contatto con le pareti dello stomaco, sotto l’azione degli enzimi gastrici, si colliqua sempre di più e viene sospinto da onde peristaltiche superficiali verso la porzione pilorica. Le onde insorgono a livello cardiale ma manifestano la loro massima energia a partire dal corpo dello stomaco. Aumentano progressivamente di energia e di frequenza, facilitando il rimescolamento del succo gastrico con l’alimento ingerito, estendendosi sempre più verso la regione pilorica e sospingendovi il materiale colliquato. Il propagarsi di un’onda peristaltica fino al piloro ne determina una temporanea chiusura, bloccando sia il flusso di chimo dallo stomaco che il reflusso di secreti duodenali allo stomaco.
Alla contrazione dell’onda peristaltica dello stomaco spesso fa seguito una contrazione duodenale che sospinge il chimo lungo l’intestino tenue.
I movimenti gastrici risultano regolati dall’innervazione vagale e splancnica, mediante una serie di riflessi vegetativi, a partire dai recettori gastrici di stiramento, di pressione e di pH.
14
Costituiti da fibre sensitive e motrici, la stimolazione del vago esercita sullo stomaco un’azione generalmente eccito-motrice, mentre la stimolazione degli splancnici inibisce la motilità gastrica.
La motilità dello stomaco e la velocità del suo svuotamento, oltre che dall’eccitazione di recettori gastrici, sono condizionati anche da riflessi nervosi ed umorali insorgenti dall’area duodenale all'arrivo del chimo acido. L’acidità in questa zona scatena un riflesso vagale, il riflesso enterogastrico, che inibisce la motilità dello stomaco. Dal punto di vista umorale, l’elevata concentrazione di grassi assorbibili, acidi grassi e sali biliari, provocano la liberazione da parte della mucosa intestinale di enterogastroni, agenti umorali che inibiscono sia la secrezione sia la motilità dello stomaco, riducendo la forza ma non la frequenza delle onde peristaltiche.
Indipendentemente dai predetti meccanismi di regolazione, in generale la velocità di svuotamento dello stomaco è strettamente legata alle caratteristiche fisiche dell’alimento ingerito, per cui gli alimenti solidi soggiornano nello stomaco più a lungo di quelli semisolidi o liquidi (Aguggini et al., 2006).
15
CAPITOLO II
LA SINDROME DELLA
DILATAZIONE-TORSIONE GASTRICA
2.1 GENERALITA’:
Per dilatazione-torsione gastrica (Gastric Dilatation Volvolus, GDV) si intende l’aumento di volume dello stomaco, associato alla rotazione sul suo asse mesenterico.
Non sempre però si arriva alla fase di dilatazione-torsione, ma può anche verificarsi la sola dilatazione dell’organo in cui lo stomaco appare sovradisteso con accumulo di aria o liquido.
La sindrome GDV rappresenta un’emergenza sia medica che chirurgica. Studi recenti hanno dimostrato che il tasso di mortalità è diminuito nel corso degli anni e nel complesso si aggira al 15% (Brockman et al., 1995; Beck et al., 2006), ma rimane più alto quando all’intervento è associata splenectomia (32%), gastrectomia parziale (35%), o entrambi (55%) (Brourman et al., 1996).
2.2 CAUSE E FATTORI PREDISPONENTI:
La causa scatenante la sindrome dilatazione-torsione gastrica è sconosciuta (Fossum et al., 2013).
16
A fronte della mancanza di una causa diretta responsabile dello sviluppo della sindrome, esistono invece una serie di fattori predisponenti e ‘concause’.
Ruolo della dieta:
Il ruolo che il tipo di alimento possa avere nella manifestazione della sindrome, non è stato confermato da studi epidemiologici a riguardo, che non hanno appunto evidenziato relazioni causali dirette tra la somministrazione di alcuni tipologie di alimento come quello secco e GDV (Fossum et al, 2013).
Uno studio ha però messo in evidenza che il consumo di alimenti secchi accompagnati da olio o grassi può aumentare il rischio di GDV, mentre alimenti ad alto tenore proteico, sono associati a una riduzione dell’incidenza (Raghavan et al., 2006).
Inoltre, alcuni cani alimentati sempre con la stessa tipologia di cibo, sembrano mostrare una maggior incidenza della patologia rispetto a cani alimentati in maniera più variata.
La complementazione della dieta con alimenti di tipo casalingo o alimenti umidi in scatola in cani di grossa taglia o razze giganti, sembra associarsi ad un calo dell’incidenza della GDV, rispettivamente del 59% e del 28% (Glickman et al., 1997).
Uno studio ha indicato che nei cani alimentati con un volume di cibo maggiore per ogni singolo pasto, il rischio di GDV è significativamente accresciuto, quasi duplice, indipendentemente dal numero di pasti effettuati, risultando essere massimo in quei cani che compiono un unico ed abbondante pasto al giorno (Raghavan et al., 2004).
17
Ruolo dell’accumulo di gas e fluidi nello stomaco:
Si presume che l’aumento della dimensione dello stomaco sia associato ad un’ostruzione funzionale e/o meccanica del deflusso gastrico.
Una volta che l’organo è dilatato, i normali mezzi fisiologici di rimozione dell’aria (eruttazione, vomito e svuotamento pilorico) sono ostacolati per l’ostruzione degli orifizi esofageo e pilorico.
Lo stomaco si dilata per l’accumulo di gas e/o fluidi nel lume. Il gas accumulato, può provenire dall’aerofagia, dalla fermentazione batterica o dei carboidrati, dalla diffusione dal torrente circolatorio e da alcune reazioni metaboliche.
Secondo ultimi studi il gas contenuto nello stomaco in dilatazione-torsione non risulta essere dovuto all’aerofagia. In particolare è stato evidenziato che, poiché la CO2 contenuta nell’atmosfera è inferiore
all’1%, mentre il gas nello stomaco presenta un contenuto pari al 13-20% di CO2 possiamo supporre che il gas non sia il solo risultato dell’aerofagia. Inoltre la concentrazione di ossigeno e azoto sono ridotti: in particolare l’O2 contenuto nel gas nello stomaco è circa 12-19% contro
il 20,9% di composizione atmosferica, mentre l’N2 è circa 41-68% contro il 78,1 % atmosferico. Tutto questo fa ipotizzare che il gas prodotto durante la GDV sia dato dalla fermentazione batterica risultante o da batteri acquisiti con l'alimentazione o dalla flora dell’intestino derivante dal reflusso dal duodeno nel lume gastrico che è un evento che frequentemente accade (Kruiningen et al., 2013).
I fluidi possono derivare dalla normale secrezione gastrica e dalla trasudazione di liquido dovuta alla congestione venosa.
18
Ruolo dell’età e del sesso:
È stato visto che il sesso maschile e l’età avanzata che porta ad una conseguente maggiore lassità dei legamenti che tengono in situ lo stomaco sono ritenuti essere fattori predisponenti al verificarsi della GDV(Glickman et al., 1997).
Fattori genetici:
Fattore molto importante da considerare anche nell’eventuale raccomandazione per una gastropessi preventiva è la parentela di primo grado con un soggetto con anamnesi di GDV. È stato visto che la parentela è associata significativamente con un incremento del rischio di sviluppare la patologia. È stato ipotizzato che la predisposizione genetica alla GDV può avvenire attraverso l'ereditarietà di conformazione, personalità o temperamento che predispone alla condizione (Silverstein et al., 2008).
È quindi molto importante non utilizzare tali cani per la riproduzione.
Fattori legati alla razza:
Come visto in precedenza le razze giganti e comunque i cani di grossa taglia, sono protagonisti degli studi effettuati. In generale le razze maggiormente predisposte sono quelle elencate nella Tabella 2.1.
19 Razza Alano San Bernardo Weimaraner Setter Irlandese Gordon Setter Barbone Medio Basset Hound Doberman Bobtail
German Shorthaired pointer Newfoundland Pastore Tedesco
Airdale Terrier Alaskan Malamute
Retriver della Baia di Chesapeake Boxer
Collie Labrador Retriver Springer Spaniel Inglese
Samoyedo Bassotto Tedesco Golden Retriver Rottweiler Meticcio Cocker Americano Barbone Nano Rischio GDV 41.3 21.8 19.3 14.2 12.3 8.8 5.9 5.5 4.8 4.5 4.4 4.2 4.1 4.1 3.7 3.7 2.8 2.0 1.6 1.0 1.2 1.1 1.1 1.0 0.6 0.3
20
Ruolo della presenza di corpi estranei gastrici:
La presenza di un corpo estraneo gastrico risulta essere correlato con una maggiore incidenza di GDV. I risultati dello studio suggeriscono che un cane di grande taglia o razza gigante con un corpo estraneo gastrico presentano una probabilità di sviluppare la GDV di circa 5 volte maggiore rispetto ad un cane simile senza corpo estraneo (de Battisti et al., 2012).
Ruolo dei fattori climatici:
Sono stati fatti numerosi studi per valutare l’eventuale correlazione tra incidenza di GDV e fattori climatici. In particolare i fattori climatici influenzano una grande varietà di condizioni patologiche negli esseri umani così come in altre specie animali.
Nella specie canina non è stata osservata correlazione tra fattori atmosferici, temperatura, umidità e la sindrome dilatazione-torsione gastrica (Dennler et al., 2005). Uno studio più recente ha invece messo in evidenza l’associazione positiva fra pressione atmosferica minima e massima del giorno in cui è avvenuta la GDV e la pressione massima del giorno precedente (Moore et al., 2008).
Altri fattori:
Esistono numerosi altri fattori che predispongono all’insorgenza della patologia. Si pensa che anche l’esercizio fisico vi contribuisca soprattutto se effettuato dopo l’ingestione di cibo altamente raffinato e di acqua (Glickman et al., 1997).
Anche cani sottopeso sembrano essere maggiormente predisposti (Glickman et al., 1997).
21
Altri fattori considerati avere una relazione sono ad esempio la posizione sopraelevata della ciotola e la voracità nell’alimentarsi. Ancora un altro fattore predisponente è la conformazione del torace, in particolar modo il torace più stretto e profondo fa variare le relazioni anatomiche tra lo stomaco e l’esofago in modo da ridurre la capacità di eruttazione del cane (Glickman et al., 2000).
2.3 PATOGENESI:
Una progressiva dilatazione dello stomaco può passare da una semplice dilatazione ad una torsione.
Nella maggior parte dei casi la dilatazione gastrica precede la torsione, altre volte la torsione può verificarsi in assenza di una precedente dilatazione.
Questo suggerisce che la dilatazione non è il solo fattore che predisponga alla torsione.
Nella torsione la grande curvatura dello stomaco si sposta ventralmente, causando uno spostamento dorsale e a sinistra del piloro che si posiziona adiacente all'esofago. Questo spostamento trascina la milza attraverso i legamenti gastrosplenici. In genere lo stomaco ruota in senso orario. La rotazione può variare dai 90° ai 360° ma generalmente è compresa tra i 200° e 270°.
La rotazione oraria inizia da uno spostamento del piloro e dell'antro che si spostano dalla parete addominale destra alla linea mediana per poi passare oltre il fondo ed il corpo dello stomaco e situarsi nel quadrante di sinistra dell'addome mentre il corpo dello stomaco è situato nel quadrante di destra.
La torsione dello stomaco in senso antiorario avviene più raramente ed il massimo grado di torsione è di 90°. In questo caso il
22
piloro e l'antro si dislocano dorsalmente e cranialmente lungo la parete addominale destra posizionandosi adiacenti all'esofago.
La posizione della milza varia e dipende dal grado di torsione gastrica.
L'occlusione dei vasi splenici, causa una forte congestione dell’organo in seguito anche alla stenosi della vena porta. La milza è anche sottoposta ad una torsione oraria od antioraria del suo peduncolo vascolare contribuendo alla splenomegalia.
In Figura 2.2 è rappresentata schematicamente la temporalità degli eventi che si verificano in corso di GDV.
Figura 2.2: in alto a sinistra rotazione di 90°, in basso rotazione di 180°; in alto a destra
rotazione di 270° e in basso rotazione di 360°. Illustration by Dr. Gheorghe Constantinescu (The Merck Veterinary Manual)
Lo schiacciamento del diaframma da parte dello stomaco, la compressione della vena cava caudale e della vena porta con conseguente esclusione del fegato e di tutto il distretto splancnico e posteriore dal
23
circolo sono alcune tra le alterazioni fisiopatologiche più importanti. La formazione di circolo collaterale, non è grado, completamente, di garantire un adeguato ritorno venoso al cuore e, con il passare del tempo ciò conduce ad una perdita di volume intravascolare che contribuisce ulteriormente alla scarsa perfusione d’organo, edema interstiziale, ipossia e ischemia locali.
Si ha una riduzione della pressione venosa centrale, della gittata cardiaca, della pressione arteriosa media. Diversi organi addominali sono interessati da uno shock maldistributivo e da inadeguata perfusione tissutale, come il rene, il cuore, il pancreas, lo stomaco e l’intestino tenue.
Inoltre lo schiacciamento del diaframma impedisce l’escursione respiratoria normale. Per compensare a questo la frequenza respiratoria e lo sforzo respiratorio possono aumentare. Questi sforzi possono diventare insufficienti e l’eventuale acidosi respiratoria, dovuta all’ alterata clearance dell'anidride carbonica, potrebbe contribuire ulteriormente all’ acidosi metabolica prodotta secondariamente alla scarsa perfusione tissutale (acidosi lattica).
L'aumento delle pressioni gastriche endoluminali alterano il flusso del sistema vascolare della parete gastrica e ciò, unito alla scarsa gittata cardiaca, può portare a necrosi gastrica.
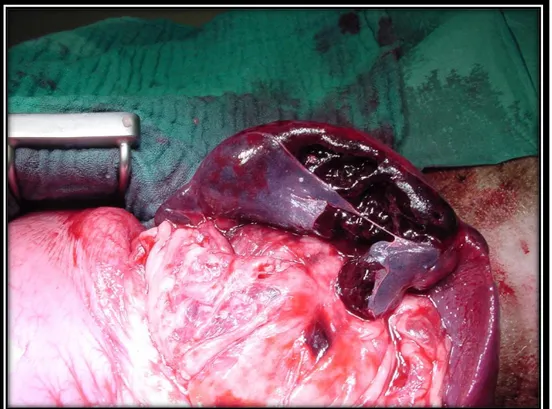
Fenomeni di avulsione, trombosi e lo stiramento delle brevi arterie gastriche sono comuni e questi contribuiscono ulteriormente alla riduzione di perfusione dello stomaco. Nella Figura 2.3 viene riportata un’immagine che mostra stasi e probabile trombosi delle arterie gastriche.
24
Figura 2.3: immagine che mostra stasi e probabile trombosi delle arterie gastriche (foto del
Dott. Sangion F.)
La suscettibilità della mucosa gastrica al danneggiamento da ipoperfusione può essere aggravata dall’ ambiente acido del lume gastrico e dalle alte richieste metaboliche.
Il risultato dell’ipoperfusione gastrica sono emorragie della sierosa ed edema della parete gastrica che inizia dal fondo e che si diffonde al corpo dello stomaco. La grave compromissione della parete gastrica può tradursi in necrosi e perforazione con conseguente peritonite.
È stato visto che c’è una correlazione diretta tra GDV e aritmia cardiaca soprattutto in presenza di necrosi gastrica. Le aritmie cardiache, soprattutto quelle di origine ventricolare, le troviamo in circa il 40% dei pazienti con GDV (Muir et al., 1982). Diversi fattori sono implicati nella causa di aritmie cardiache. Il flusso coronarico nelle GDV sperimentalmente indotte è diminuito del 50%. Lesioni istologiche
25
compatibili con ischemia miocardica sono riportate sia in GDV sperimentalmente indotte che spontanee e sono date da attività elettrica anormale (Horne et al.; 1985).
Riguardo agli squilibri elettrolitici e acido-base possiamo dire che non si vedono costantemente nei cani con sindrome dilatazione-torsione gastrica. L’ipossia cellulare causata da ipoperfusione sistemica può provocare un aumento della produzione di acido lattico per la produzione di energia anaerobica, con conseguente acidosi metabolica.
Il pH del sangue può essere normalizzato da un alcalosi metabolica concorrente causata dal sequestro di ioni idrogeno e cloruro nel lume dello stomaco (causando un disordine acido-base misto).
Spesso possiamo trovare ipokaliemia, la cui origine può essere data da numerosi eventi fisiopatologici, compresa la somministrazione di grandi volumi di fluidi con bassa concentrazione di potassio, sequestro di potassio all’interno dello stomaco o la perdita di questo attraverso il vomito o la lavanda gastrica, alcalosi ipercloremica metabolica con spostamento transcellulare.
2.4 SINTOMATOLOGIA:
La sintomatologia è molto variabile a seconda del grado di torsione e del tempo trascorso dall’inizio della patologia. Un cane con GDV può presentare un’anamnesi di distensione addominale con timpanismo, falsa cifosi, conati di vomito non produttivo con emissione di sola saliva vischio-schiumosa, irrequietezza, oppure il proprietario può semplicemente trovare l’animale in decubito e depresso con l’addome dilatato o addirittura in uno stato comatoso.
Spesso i cani si presentano in shock cardiovascolare, con pallore delle mucose, aumento del tempo di riempimento capillare, estremità fredde, tachipnea, dispnea, polso debole.
26
In alcuni cani si può verificare una GDV cronica cioè una sindrome di solito progressiva, ma non pericolosa per la sopravvivenza, associata a vomito, anoressia e perdita di peso. Questi cani presentano sintomi intermittenti (Paris et al., 2011).
Di seguito un’immagine di Labrador con GDV presso un’unità di Pronto Soccorso.
Figura 2.4: Labrador in corso di GDV presso un’unità di Pronto Soccorso (da internet).
2.5 DIAGNOSI:
In generale diagnosticare la sindrome della dilatazione-torsione gastrica è piuttosto semplice basandoci sulla sintomatologia clinica tipica descritta in precedenza e il segnalamento.
Per differenziare però la dilatazione semplice dalla dilatazione con torsione è indispensabile la valutazione radiografica. Bisogna però considerare che l’esame radiografico può provocare ulteriore stress nel
27
paziente. Il soggetto in GDV presenta difficoltà respiratoria che può essere ulteriormente aggravata dal decubito laterale richiesto per la radiografia.
Prima di effettuare la radiografia è quindi opportuno decomprimere lo stomaco tramite gastrocentesi in modo tale da dare sollievo al diaframma e ai polmoni.
Si preferiscono le proiezioni laterali destro e dorso ventrale che ci permettono un maggior riempimento del piloro dislocato e pieno di aria. In condizioni fisiologiche il piloro è localizzato ventralmente al fondo nella proiezione laterale e a destra nella proiezione dorsoventrale. In un paziente con GDV lo stomaco ci appare notevolmente aumentato di volume, radiotrasparente per la presenza di aria ed il piloro si trova dislocato cranialmente al corpo dello stomaco ed è separato dallo stomaco da una falda di tessuto molle quindi radiopaca (segno della C rovesciata o della doppia bolla). Nella proiezione dorsoventrale si trova a sinistra e ci appare fortemente radiotrasparente per la presenza di aria e molto dilatato. Nelle figure 2.5 e 2.6 vengono riportate due immagine radiografiche in posizione latero-laterale di soggetti in torsione gastrica.
28
Figura 2.5: immagine radiografica di un cane in GDV (esperienza personale presso Ospedale
didattico “M. Modenato”).
Figura 2.6: immagine radiografica di un cane in GDV (esperienza personale presso Ospedale
29
Per completare l’iter diagnostico è possibile eseguire un esame emocromocitometrico completo che può rivelare in questi casi emoconcentrazione e un leucogramma da stress. È possibile inoltre evidenziare trombocitopenia da consumo e la presenza di tre o più parametri emostatici anormali (tempo di protrombina prolungato, così come il tempo di tromboplastina parziale, ipofibrinogenemia, elevata degradazione della fibrina e esaurimento dell’ antitrombina III ) sono correlati con danno gastrico accompagnato da CID (Coagulazione Intravasale Disseminata).
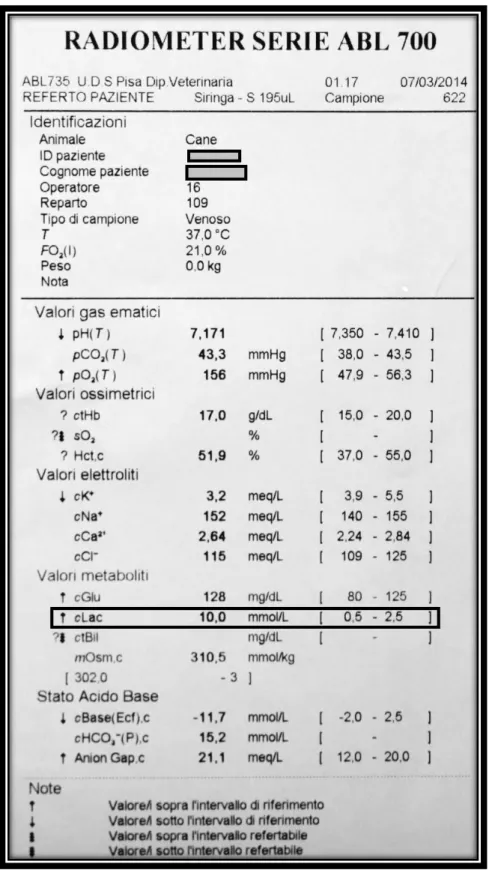
Fondamentale in corso di GDV è l’esecuzione di emogasanalisi venoso o arterioso là dove possibile, che permette di inquadrare lo stato metabolico dell’animale, evidenziando la presenza e la gravità dell’acidosi metabolica descritta in precedenza, permette di valutare il grado di perfusione attraverso il valore di lattatemia, e permette di valutare l’eventuale capacità di compensazione dell’animale a tale disequilibrio. Sarà poi fondamentale ai fini terapeutici per corretta fluidoterapia da somministrare al paziente.
Qui sotto troviamo un esempio di referto emogasanalisi di un caso di GDV arrivato presso l’Ospedale Didattico “M. Modenato”. Da notare il valore del lattato plasmatico.
30
Figura 2.7: Referto emogasanalisi: esperienza personale presso Ospedale Didattico “M.
31
2.6 APPROCCIO TERAPEUTICO
2.6.1 TRATTAMENTO MEDICODopo aver formulato la diagnosi occorre iniziare al più presto la terapia. In particolare questa è rivolta in primis alla stabilizzazione del paziente e alla decompressione dello stomaco e, successivamente, al riposizionamento dei visceri.
La stabilizzazione del paziente consiste nel somministrare all’animale boli di soluzioni cristalloidi e/o collodi in relazione al grado di shock e ipotensione e rivalutare ogni 15 minuti i parametri di perfusione e aggiustare di conseguenza la velocità di fluidi da infondere (Macinitire et al., 2012). La scelta sarà in relazione all’equilibrio acido base ed elettrolitico del paziente, ma in prima battuta la soluzione di Ringer è ottima. La somministrazione avverrà per via endovenosa previo inserimento di un catetere venoso di grosso calibro (es. 18G) possibilmente in entrambe le vene cefaliche. L’accesso alle vene posteriori va evitato perché sono temporaneamente escluse dal circolo per la compressione della vena cava caudale.
In caso di dispnea si può somministrare ossigeno con maschera che risulta anche essere utile per ottimizzare la saturazione dell’emoglobina.
Durante la fluidoterapia è necessario monitorare la pressione arteriosa media, il polso femorale e la frequenza cardiaca, monitorando elettrocardiograficamente l’animale per individuare precocemente eventuali aritmie cardiache.
Contemporaneamente alla fluidoterapia si effettua la decompressione gastrica. La decompressione si può effettuare mediante gastrocentesi con ago da 18G infisso 4-8 cm caudalmente all’ultima
32
costa oppure direttamente con la sonda gastrica che poi utilizzeremo per fare la lavanda, anche se quest’ultima risulta talvolta più difficile poiché il gas esercita una notevole pressione sul cardias che quindi risulta difficile oltrepassare.
In particolare per la gastrocentesi, il soggetto viene tenuto in decubito laterale o in stazione, si identifica l’area di maggiore timpanismo mediante percussione e lì andremo ad infiggere l’ago e verifichiamo l’uscita del gas fino all’emissione di liquido. Anche in condizioni di emergenza è raccomandato effettuare la tricotomia e successiva disinfezione della parte con betadine e alcool o clorexidina.
Se la fuoriuscita di gas sembra terminata e la percussione rileva ulteriore timpanismo occorre ripetere la paracentesi fino alla completa, o quasi, decompressione dell’addome.
Dopo la decompressione sarà possibile effettuare la lavanda gastrica.
Per eseguire la lavanda è necessario avere a disposizione una serie di sonde trasparenti di vario diametro (1,5-4 cm) che saranno scelte a seconda della mole del cane, sarà inoltre necessario avere a disposizione un contenitore capiente e un imbuto. La sonda della misura prescelta viene misurata sul paziente dalla punta del naso all’ultima costa. Questa distanza corrisponde alla profondità di inserimento della sonda.
Prima di intervenire è opportuno sedare il paziente a tale scopo può essere utilizzato un oppiaceo a rapida azione come il fentanyl (5-10 µg/Kg IV), metadone (0,2-0,4 mg/Kg IV) associati o meno a benzodiazepine come diazepam (0,25-0,5 mg/kg IV) o midazolam (0,3-0,4 mg/Kg IV) seguiti da propofol (2-8 mg/Kg IV) per l’induzione e intubazione endotracheale del paziente (Corletto, 2004).
Andremo quindi a lubrificare la sonda e, seguendo il palato duro prima e il palato molle dopo, andremo a inserirlo in orofaringe. Se si
33
incontrano difficoltà nell’avanzare la sonda verso lo stomaco può essere utile variare la posizione dell’animale. È consigliabile non forzare se si incontra resistenza al passaggio altrimenti si rischia di perforare l’esofago.
Una volta arrivati a livello del cardias la sonda può trovare difficoltà a procedere a causa della torsione. In questo caso un assistente mantiene la sonda inserita nell’esofago a contatto con il punto di ostruzione, un altro afferra il paziente per la cute del collo e lo tiene sospeso nel vuoto. Si dovrebbero così determinare dei sussulti allo stomaco con conseguente distensione cardiale che favorisce così il passaggio della sonda.
La sensazione di scivolamento improvviso e il rumore di fuoriuscita di gas ci avverte dell’avvenuto passaggio.
Una volta inserita la sonda il paziente viene riposizionato in decubito laterale e praticheremo la lavanda vera e propria. Se lo stomaco non viene irrigato, solitamente interviene una nuova, rapida dilatazione dopo la rimozione della sonda.
È necessario dunque introdurre nello stomaco 1 litro di acqua a temperatura corporea (37° C circa) ogni 15 kg di peso che si mescolerà quindi con il contenuto gastrico. Il tubo viene tenuto con l’estremità in alto facendo attenzione che rimanga ben pieno di acqua (innescato). Successivamente la sonda sarà abbassata bruscamente così da sfruttare il cosiddetto effetto sifone in modo tale da far defluire l’acqua e il contenuto gastrico all’interno del contenitore capiente. Questo lavaggio verrà ripetuto per circa 4-5 volte fino a che il liquido refluo non è pressoché pulito.
Per favorire la completa fuoriuscita del contenuto gastrico può essere utile che l’assistente provochi dei movimenti di ballottamento sull’addome in modo tale da favorire il completo mescolamento con
34
l’acqua e la fuoriuscita di tutto il materiale che la sonda non riesce a pescare direttamente.
L’aspetto del liquido dei primi lavaggi ci fornisce informazioni sulle condizioni dello stomaco: la presenza di sangue ci indica l’eventuale presenza di un danno alla mucosa quindi è molto importante andare ad intervenire chirurgicamente in modo tempestivo.
Nei casi in cui non si riesce a praticare il sondaggio gastrico perché non si riesce ad oltrepassare il cardias oppure anche nei casi in cui il contenuto gastrico non permetta la lavanda perché di dimensioni troppo grosse si procederà direttamente con l’intervento chirurgico e lo svuotamento manuale dello stomaco.
2.6.2 TRATTAMENTO CHIRURGICO
Il trattamento chirurgico deve seguire sempre il trattamento medico, anche se lo stomaco è stato decompresso e deve essere svolto appena il paziente si stabilizza.
Come detto in precedenza, prima dell’intervento chirurgico l’animale deve essere stabilizzato: ricevere fluidi per via endovenosa, antibiotici e bisogna correggere le anomalie importanti degli elettroliti e dell’equilibrio acido-base. Parte integrante della stabilizzazione, è rivestita dalla somministrazione di analgesici oppiacei, che hanno il vantaggio di conferire una tranquillizzazione all’animale quasi sempre spaventato e agitato.
2.6.2.1 DETORSIONE IN CHIRURGIA
Nel caso in cui con la sonda non si riesca a riposizionare lo stomaco bisogna procedere chirurgicamente.
Dopo laparatomia mediana la prima struttura che il chirurgo incontra è l’omento (come mostra la Figura 2.8). La mano del chirurgo
35
va ad interporsi tra lo stomaco ed il fegato retraendo caudalmente lo stomaco così da eliminare l’inclinazione craniale. Poi lo stomaco viene afferrato per sollevare il piloro e abbassare il fondo e viene quindi delicatamente ruotato in senso antiorario fino al raggiungimento della posizione normale. Durante questa manovra è importante accompagnare la milza per evitare lesioni o l’avulsione delle connessioni vascolari spleniche e gastriche. La completezza della detorsione viene determinata palpando e visualizzando il cardias e l’esofago intraddominale, inoltre la facilità di passaggio della sondaci ci indica la detorsione completa.
Figura 2.8: immagine caratteristica di uno stomaco in torsione: la prima struttura che ci
troviamo di fronte è l’omento che ricopre completamente lo stomaco (foto del Dott. Sangion F.).
36
Figura 2.9: immagine di rottura di milza in seguito a torsione gastrica (foto del Dott. Sangion
F.)
Dopo aver riposizionato lo stomaco si deve valutare la vitalità gastrica ed asportare mediante gastrectomia parziale, o invaginare le aree devitalizzate.
La gastrectomia parziale prevede quindi l’asportazione delle aree di tessuto necrotico, può essere eseguita applicando o meno degli enterostati atraumatici che minimizzano la possibilità di fuoriuscita di materiale gastrico. Viene poi eseguita una sutura in due strati introflettente che penetra tutti gli strati di parete in materiale monofilamento non riassorbibile (Bojrab et al., 2001). Nella figura 2.10 è rappresentata la tecnica chirurgica di gastrectomia parziale.
37
Figura 2.10- rappresentazione intervento di gastrectomia parziale (Fossum et al., 2013).
Altra tecnica possibile è quella dell’invaginamento della parete. In questo caso si spinge verso il lume gastrico la parte necrotica, senza asportarla, e sui margini sani si pratica una sutura introflettente a doppio strato come appena descritto. La porzione di parete così invaginata verrà “autodigerita” dallo stomaco. I vantaggi di questa tecnica sono dati dalla velocità e semplicità di esecuzione che permette al chirurgo di non necessitare per forza di un aiuto.
Le complicanze sono date da una maggiore dolorabilità nel postoperatorio con possibile presenza di melena ed ematemesi, alterazioni della motilità gastrica e con una guarigione dei margini di sutura ancora incompleta a due settimane (Sangion, da internet).
Un’ ulteriore tecnica chirurgica di gastrectomia si avvale di suturatici automatiche. Le controindicazioni a questo tipo di approccio chirurgico sono essenzialmente legate all’alto costo della strumentazione (Clark et al., 1991).
38
Dopo avere aver riposizionato lo stomaco, avere valutato la condizione della parete gastrica ed avere effettuato eventualmente la gastrectomia o invaginamento delle porzioni necrotiche occorre effettuare l’intervento di gastropessi. Inoltre l’alta percentuale di recidive (80%) impongono l’intervento di gastropessi per evitare una nuova GDV (Bojrab et al., 2001).
2.6.2.2 INTERVENTO DI GASTROPESSI
Esistono diverse tecniche per effettuare la gastropessi. Vediamo le più importanti:
Gastropessi incisionale: dopo avere effettuato laparatomia mediana si identifica l’antro pilorico e lo si porta al centro del campo operatorio aiutandosi con delle pinze anatomiche. Eseguire un’incisione nello strato sieromuscolare dell’antro gastrico e un’altra nella parete muscolare addominale ventrolaterale destra, interessando il peritoneo e la fascia interna dei muscoli retto dell’addome o trasverso (Figura 2.11-A).
Suturare i margini dell’incisione addominale all’incisione gastrica con sutura continua semplice (Figura 2.11-B). Assicurarsi che lo strato muscolare dello stomaco sia in contatto con la parete addominale (Figura 2.11-C).
39
Figura 2.11: gastropessi incisionale: sequenza dei passaggi chirurgici: A: eseguire un’incisione
nello strato sieromuscolare dell’antro gastrico e un’altra nella parete muscolare addominale ventrolaterale destra; B: suturare i margini dell’incisione addominale all’incisione gastrica con
sutura continua semplice; C: assicurarsi che lo strato muscolare dello stomaco sia in contatto con la parete addominale (Fossum et al., 2013).
Gastropessi ventrale mediana: si effettua laparatomia sulla linea alba dalla cartilagine xifoidea fino ad un punto intermedio tra ombelico e pube. Dopo aver asportato il grasso falciforme, l’aiuto afferra tra il pollice ed indice la parete gastrica nell’area dell’antro pilorico, (Figura 2.12-A) portandola verso la parte craniale dell’incisione
40
addominale (Figura 2.12-B). All’estremità caudale dell’incisione laparatomica si inizia una sutura continua in materiale sintetico a lento assorbimento. La parete gastrica viene fissata incorporandola nella parte craniale della sutura principale della linea alba per una lunghezza di circa 5 cm. (Figura 2.12-C). Questa sutura comprende la muscolaris dello stomaco senza penetrare nel lume dell’organo (Bojrab et al., 2001). I proprietari del paziente devono essere informati del posizionamento dello stomaco per eventuali interventi successivi per evitare l’incisione con il bisturi della parete gastrica inclusa nella sutura della laparotomia.
Figura 2.12: gastropessi ventrale mediana- sequenza dei passaggi chirurgici: A: afferrare tra il
pollice ed indice la parete gastrica nell’area dell’antro pilorico; B: portare la porzione verso la parte craniale dell’incisione addominale; C: la parete gastrica viene fissata incorporandola nella
41
Gastropessi circumcostale: effettuare laparotomia mediana ed individuare lo stomaco. Preparare un lembo a perno, singolo o doppio, con un’incisione che interessa gli strati sieromuscolari dell’antro pilorico (Figura 2.13-A e B). La mucosa non deve essere incisa quindi non ci deve essere penetrazione nel lume gastrico. Eseguire poi un’incisione di circa 5-6cm sull’undicesima o dodicesima costa a livello della giunzione costocondrale. Creare un tunnel sotto alla costa utilizzando una pinza emostatica (Figura 2.13-C). Inserire il lembo gastrico antrale craniodorsalmente sotto la costa e suturarlo al suo margine gastrico di origine nel caso della tecnica a lembo singolo o all’altro lembo nel caso si utilizzi il doppio lembo (Figura 2.13-D) (Fossum et al., 2013). Il vantaggio di questa tecnica è che è resistente, ma presenta maggiore difficoltà di esecuzione, si ha rischio di pneumotorace, fratture costali (Fossum et al., 2013).
42
Figura 2.13:- gastropessi circumcostale- sequenza dei passaggi chirurgici.: A: preparare un
lembo a perno singolo o B: doppio, con un’incisione che interessa gli strati sieromuscolari dell’antro pilorico; C: eseguire un’incisione di circa 5-6cm sull’undicesima o dodicesima costa
a livello della giunzione costocondrale e creare un tunnel sotto alla costa; D: inserire il lembo gastrico sotto la costa e suturarlo al suo margine gastrico di origine nel caso della tecnica a
lembo singolo o all’altro lembo nel caso si utilizzi il doppio lembo (Fossum et al., 2013).
Gastropessi con ansa a cintura: dopo laparatomia mediana ed esposizione dello stomaco preparare un lembo sieromuscolare sull’antro dello stomaco (Figura 2.14-A). Eseguire nella parete addominale ventrolateralmente due incisioni trasversali che interessano il peritoneo e la muscolatura addominale e utilizzando delle pinze creare un tunnel sotto la muscolatura addominale (Figura 2.14-B). Passare
43
quindi il lembo craniocaudalmente sotto il lembo muscolare (Figura 2.14- C). Suturare il lembo al suo margine gastrico di origine (Figura 2.14-D) (Fossum et al., 2013).
Figura 2.14: gastropessi con ansa a cintura: sequenza dei passaggi chirurgici: A: preparare un
lembo sieromuscolare sull’antro dello stomaco; B: eseguire nella parete addominale ventrolateralmente due incisioni trasversali che intereessano il peritoneo e la muscolatura addominale e creare un tunnel sotto la muscolatura addominale; C: passare quindi il lembo craniocaudalmente sotto il lembo muscolare; D: suturare il lembo al suo margine gastrico di
origine (Fossum et al., 2013).
2.6.2.3 CRITERI DI VALUTAZIONE DELLA NECROSI GASTRICA
I criteri clinici per valutare la presenza e l’estensione della necrosi a carico della parete gastrica sono essenzialmente di tre tipi:
44
Esami di laboratorio ed in particolare la valutazione del lattato plasmatico (de Papp et al., 1999; Zacher et al., 2010; Green et al., 2011; Beer et al., 2013). Segni radiografici come la presenza di
pneumoaddome, indice di una perforazione e pneumatosi della parete gastrica.
Esami diretti sullo stomaco per valutare la sua condizione comprendono:
Gastroscintigrafia: descritta nel 1991, ha un’accuratezza clinica del 90,28% (Berardi et al., 1991).
Esame con fluorosceina: descritta nel 1986, si incappa in molti falsi positivi, infatti l’accuratezza clinica scende al 58% (Wheaton et al., 1986).
Esame clinico: si prendono in considerazione la colorazione della sierosa, la consistenza alla palpazione della parete, la presenza di trombosi o avulsione vascolare. Con questo metodo, che più rispetta le esigenze della chirurgia d’urgenza, si arriva, anche in base all’esperienza del chirurgo, ad un’accuratezza dell’ 85%, percentuale che può essere considerata soddisfacente (Sangion, da internet).
La presenza di diffuse emorragie petecchiali ed ecchimotiche della sierosa gastrica indicano un danno vascolare, tuttavia non richiedono la resezione tissutale. Aree emorragiche diffuse rosso scuro o
45
rosso porpora indicano una compromissione più grave ma anche esse non richiedono in genere la resezione. Una volta riposizionato lo stomaco e quindi il deflusso venoso, l’aspetto della sierosa può migliorare visibilmente nel corso di 5-10 minuti: ciò indica che il flusso ematico intraparietale è intatto. Anche nelle aree di colore blu-nero, i tessuti possono sopravvivere in seguito alla risoluzione della compromissione vascolare che segue al riposizionamento gastrico (Bojrab et al., 2001) .
Se, effettuando delle breve incisioni della sierosa in corrispondenza di queste aree, compare sangue arterioso, è probabile che il tessuto sopravvivrà; al contrario se non compare sangue arterioso significa che si è istaurata una grave lesione ipossica e necrosi tissutale, quindi il segmento interessato deve essere asportato. Colorazioni grigiastre o verdastre della sierosa indicano un grave danno vascolare e necrosi tissutale richiedendo quindi l’asportazione. Inoltre tutte le aree che risultano assottigliate a cui si associa una sierosa di aspetto anormale e lacerata sono considerate devitalizzare e quindi devono essere asportate
46
CAPITOLO III
IL LATTATO PLASMATICO
3.1 GENERALITA’
Il Lattato è uno ione a carica negativa derivante dall’acido lattico. In particolare lo ione lattato viene prodotto durante l’acidosi lattica e può derivare da un’aumentata produzione a causa di ipossia tissutale (acidosi lattica di tipo A) o da un’alterazione biochimica della glicolisi (acidosi lattica di tipo B). L’acidosi di tipo A e B sono causate da una fisiopatologia paragonabile, infatti in entrambi i casi l’incremento del lattato ematico deriva da una ridotta capacità mitocondriale di produrre energia mediante il ciclo di Krebs con conseguente riduzione nella produzione di ATP e di NADH a favore del NAD+.
Più in dettaglio, il glucosio viene ossidato attraverso la glicolisi in piruvato. Il piruvato può prendere tre strade:
in condizioni di aerobiosi viene ossidato con perdita del suo gruppo carbossilico sotto forma di CO2 formando l’Acetil CoA che a sua volta viene ossidato a CO2 + H2O e si ha la sintesi di ATP (ciclo di KREBS) (Nelson et al., 2006).
in condizione di anaerobiosi si ha la fermentazione lattica con la riduzione del piruvato in lattato. Quando un tessuto deve funzionare in condizioni di ipossia, il NADH non può essere riossidato a NAD+ che è essenziale come accettore di elettroni per le ulteriori ossidazioni del piruvato. In queste
47
condizioni il piruvato viene ridotto dall’enzima lattato deidrogenasi (LDH) a lattato, accettando gli elettroni dal NADH e rigenerando così il NAD+ necessario per far procedere la glicolisi (Nelson et al., 2006).
Piruvato + NADH + ⇔ Lattato + NAD+.
Nella figura 3.1 la rappresentazione schematica della formula.
Figura 3.1: rappresentazione schematica della riduzione del piruvato in lattato ad opera
dell’enzima lattato deidrogenasi (Nelson et al., 2006).
in condizioni di anaerobiosi viene convertito in etanolo: la fermentazione alcolica o etanolica che possiamo ritrovare in alcuni invertebrati, protisti e microrganismi come il lievito di birra (Nelson et al., 2006).
48
Figura 3.2: rappresentazione schematica del destino del Piruvato: in condizioni di aerobiosi
viene ossidato con perdita del suo gruppo carbossilico sotto forma di CO2 formando l’Acetil CoA che a sua volta viene ossidato a CO2 + H2O e si ha la sintesi di ATP; in condizioni di
anaerobiosi o si ha la formazione di lattato attraverso la fermentazione lattica oppure si ha fermentazione alcolica con formazione di etanolo (Nelson et al., 2006).
In condizioni di ipossia quindi il lattato prodotto dal metabolismo anaerobico non può essere riossidato a piruvato, di conseguenza si ha un incremento della concentrazione di lattato rispetto al piruvato. Maggiore è la quantità di lattato prodotto, maggiore sarà la quantità di idrogenioni presenti che causano acidosi lattica. La capacità dell’organismo di tamponare l’acidosi lattica dipendono dalla quantità di basi disponibili. In condizioni normali, cioè in aerobiosi, il lattato prodotto è convertito in piruvato, ossidato ed utilizzato nella gluconeogenesi a livello epatico e renale consumando gli ioni e producendo anidride carbonica tamponata od eliminata con la ventilazione (Vigano et al., 2006).
49
Le cause di un’ acidosi lattica di tipo A sono da ricondursi a: necrosi parete gastrica, ischemia di altri visceri,
tromboembolismo aortico, grave ipossiemia, grave anemia, attività muscolare eccessiva, epilessia e tremori (Allen et al., 2008).
Le cause di un’acidosi lattica di tipo B sono da ricondursi a:
patologie che causano ridotta clearance del lattato: sindromi quali diabete mellito, grave malattia epatica, tumori maligni, sepsi, feocromocitoma, deficit di tiamina (Allen et al., 2008).
intossicazioni da farmaci o tossine che interferiscono con la fosforilazione ossidativa: paracetamolo, cianuri, adrenalina, etanolo, glicole etilenico, insulina, metanolo, morfina, glicole propilenico, terbutalina (Allen et al., 2008) .
difetti mitocondriali (Allen et al, 2008).
I tessuti che producono e rilasciano lattato sono i muscoli, l’intestino, la midollare renale, il cervello, la cute e i globuli rossi. Mentre i tessuti in grado di metabolizzare il lattato sono il fegato che trasforma il lattato in piruvato e sfruttandolo per la gluconeogenesi; ed il tessuto muscolare che converte il lattato in glicogeno.
Valori di lattatemia compresi tra 0,5-2,5 mmol/L sono considerati normali, valori compresi tra 3-5 mmol/L sono considerati lievemente aumentati, valori compresi tra 5-7 mmol/L indicano una ipoperfusione moderata, mentre valori superiori a 8 mmol/L sono considerati indice di grave ipoperfusione.