RbAp48 è coinvolto nella biologia delle cellule
staminali adulte di planaria
(I dati di questo lavoro sono pubblicati in Bonuccelli et al., J. Cell Science 2010; vedere allegato 2).
Isolamento e analisi dell’espressione di DjRbAp48
In questo lavoro di dottorato è stata investigata la funzione del gene corrispondente al clone EST Gi32900731, omologo a Rbp4 (retinoblastoma-binding protein), precedentemente identificato in uno studio di microarray (Rossi et al., 2007).
Prima di tutto è stata completata la sequenza di questo clone mediante la metodica della 5’ e 3’ RACE. Il gene completo ottenuto è stato nominato
DjRbAp48 (Fig. 2.12).
Questo gene codifica per una putativa proteina che contiene la tipica ripetizione multipla WD-40 all’estremità carbossiterminale (residui 210 to 249; 260 to 299; 306 to 345; 350 to 389; 407 to 446), che ci permette di considerarla come un nuovo membro della famiglia di proteine WD-40 (Neere et al., 1994) (Fig. 2.13). La proteina WD-40 che ha una omologia di sequenza con
DjRbAp48 è la retino blastoma-binding protein 4 (Rbp4) di Danio rerio.
DjRbAp48 è espresso nei neoblasti e il suo pattern di espressione è molto
simile a quello del marker molecolare DjMCM2 in planarie intatte (Rossi et al., 2007). Durante la rigenerazione i trascritti di DjRbAp48 sono localizzati vicino all’epitelio della ferita dopo un giorno dal taglio e sono presenti nella regione del blastema dopo due o tre giorni (Fig. 2.14).
5’CGATTAAGCAGTGGTATCAACGCAGAGTACGCGGGGACAAATATAAATTATAAAACTTAAAT TTTTCATTTTTATTTGGAAACCATTTTATAATGACTGAAAAAGGTTTTAACAATATAAATTTTA GATAATTTTTTTAATTTTGTAGATTTTGATGATGGGATTGAGGAACGTGTTATTAACGAAGAAT ACAAAATTTGGAAGAAAAATACTCCTTTTTTGTATGATTTGGTAATGACTCATGCTTTGGAGTG GCCTAGTTTAACAGCGCAATGGTTACCAGAAGTAACTTGCCCAGAGGGAAAAGATTATGGCTTA CATAGACTCATTCTTGGTACTCATACGTCTGATGAACAAAATCATTTGCTTATAGCTACTGCTC ATATACCCACAGATTCTAATGAATTTGACATAAATAAGTATGAACCAGATAAGGGTGAATTCGG TGGTTTCGGATCTGTTAATGGTAAAATTGAAATCAACATAAAGATCAATCACGATGGTGAAGTA AATCGGGCGCGATATTTGCCTCAAAATCCTACAATTATTGCTACAAAGTCTCCTAGTTCTGACG TACTCGTATTCGATTACACGAAACATCCCGCTAAACCCGATCCGAATGGATTGTGTCAACCCGA TCTTAGATTAAAAGGCCATCAAAAAGAAGGTTACGGATTAAGTTGGAACCCTAAACGAAGCGGG TATCTATTGAGTGCGTCTGATGACAACACGATTTGTATGTGGGACATCAACACTTCCCCTCGCG ACCAACGAATCATTGACGCATTGAGCATTTTCACGGGTCATTCGAGTGTCGTCGAAGATGTCAG TTGGCATTTGCTGCATGAACATATATTCGGTTCAGTGGCAGACGATCGACAATTGATGATCTGG GACACACGCACCAGTGTTACGAATCGACCCAGCCAATCAGTAGACGCGCATTCAGCCGAGGTTA ACTGTATCAGTTTCAATCCATTCTCAGAATACATTTTAGCGACCGGCAGTGCCGATCGAACTGT GGCCCTCTGGGATCTCCGTAATCTTAATTTGAAATTGCATTCGTTCGAGTCGCACAAAGACGAA ATATTCCAAGTCCAATGGTCACCGCATCACGAAACTATTCTCGCATCGAGCGGCACTGATCGTC GGTTGCATGTGTGGGATCTCAGCAGAATAGGGGAAGAACAGTTTGCTGAGGATGCCGAAGATGG TCCCCCGGAATTGCTCTTCATTCATGGCGGCCATACCGCAAAGATTTCCGATTTCAGCTGGAGT CCAAACACTCCGTGGTTGATTTGCTCAGTTTCAGAAGATAACATTTTACAGGTTTGGCAAATGG CAGAGAACATTTACAACGACGAAGATCTTGACAGTGCAACGAAGGAGGTCGTTCAAAACAGCTC ATAATTTTTTATATTTATATTTATAAAAGTGGGAAATGTTTGTTATTTATTAAATGAAAATAAA TCTGTTAATGTTAAATTAACTAACTGTCCGTCTCGTGTAAATCAATCAACCACCATGTGTATTC TATGGGTATAGTAAATAAATTTTAATACTTTTATAAACAAGAAAAAAAAAAAAAAAAAAAAAAA 3’
Fig. 2.12: Sequenza nucleotidica ricavata dal sequenziamento degli amplificati derivanti dalla 3’-5’RACE. In grassetto: ATG codone di inizio (Met) e TAA codone di terminazione
MTHALEWPSLTAQWLPEVTCPEGKDYGLHRLILGTHTSDEQNHLLIATAHIPTDSNEFDINKYE PDKGEFGGFGSVNGKIEINIKINHDGEVNRARYLPQNPTIIATKSPSSDVLVFDYTKHPAKPDP
NGLCQPDLRLKGHQKEGYGLSWNPKRSGYLLSASDDNTICMWDINTSPRDQRIIDALSIFTGHS
SVVEDVSWHLLHEHIFGSVADDRQLMIWDTRTSVTNRPSQSVDAHSAEVNCISFNPFSEYILAT
GSADRTVALWDLRNLNLKLHSFESHKDEIFQVQWSPHHETILASSGTDRRLHVWDLSRIGEEQF
AEDAEDGPPELLFIHGGHTAKISDFSWSPNTPWLICSVSEDNILQVWQMAENIYNDEDLDSATK EVVQNSSZFFIFIFIKVGNVCYLLNENKSVNVKLTNCPSRVNQSTTMCILWVZZINFNTFINKK KKKKKK
Fig. 2.13: Sequenza della proteina putativa codificata da DjRbAp48, costituita da 293 amminoacidi. In rosso sono indicati gli aminoacidi che costituiscono i domini WD40.
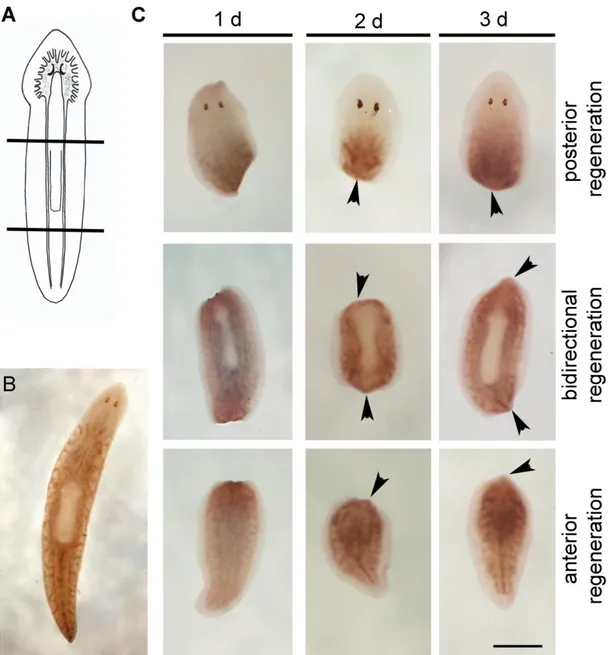
Fig. 2.14: Analisi dell’espressione di DjRbAp48 mediante ibridazione in situ whole mount in planarie di controllo. (A) Schema di taglio. (B) Espressione di
DjRbAp48 in una planaria intatta. (C) Espressione di DjRbAp48 a 1, 2, 3 giorni
(d) dal taglio. Le punte di freccia indicano l’espressione dei trascritti DjRbAp48 nella regione del blastema. Scale bar: 0,8 mm in B; 1 mm in C.
Ruolo di DjRbAp48 nella rigenerazione
Per studiare la funzione di DjRbAp48 nella biologia dei neoblasti, è stato analizzato l’effetto del silenziamento del gene durante la rigenerazione. Planarie tagliate dopo sette giorni dalla prima iniezione sono in grado di formare un blastema a due giorni dal taglio ma poi a quindici giorni dopo il taglio cominciano a mostrare una ridotta motilità e diversi difetti, come un incurvamento dei bordi dell’animale (curling) e regressione dei tessuti (30/30); 40 giorni dopo il taglio, tutti gli animali trattati con il dsDjRbAp48 sono morti (dati non mostrati). E’ interessante notare che planarie tagliate 20 giorni dopo la prima iniezione non sono in grado di formare un blastema (dati non mostrati).
Quando il blastema viene tagliato al terzo giorno di prima rigenerazione, (seconda rigenerazione) i frammenti della testa (n=50) iniettati non sono in grado di iniziare il processi di seconda rigenerazione. Questi animali non sono in grado di formare un blastema (Fig. 2.15A, B) nemmeno dopo 14 giorni dal taglio (Fig. 2.15D), mentre i controlli hanno completamente rigenerato le parti mancanti del corpo (Fig. 2.15C). I frammenti di code iniettati con RNA a doppia elica dsDjRbAp48 formano un blastema ma più piccolo rispetto ai controlli ed essi rigenerano una testa piccola, anormale e spesso con un solo occhio centrale. Questi frammenti di coda non sono in grado di formare un blastema tre giorni dopo una quarta amputazione (dati non mostrati). I frammenti trattati con il dsDjRbAp48 muoiono 30 giorni dopo il secondo taglio (50/50). Sulla base di queste osservazioni negli esperimenti di questo lavoro sono state utilizzate planarie alla seconda rigenerazione.
Per capire se l’incapacità di formare un blastema è dovuta ad una perdita di neoblasti è stata analizzata l’espressione del marcatore DjMCM2 (Salvetti et al., 2000) negli animali rigeneranti. Un numero consistente di cellule esprimenti
DjMCM2 sono presenti vicino alla ferita 4 giorni dopo il taglio (Fig. 2.15E, F).
Questo accumulo si ritrova normalmente in planarie di controllo a due giorni dal taglio (dati non mostrati). Due settimane più tardi, si ha una riduzione del numero di cellule DjMCM2 positive disperse nel parenchima, ma è ancora
Dato che in planarie trattate con il dsDjRbAp48 incapaci di produrre un blastema rigenerativo è presente un significante numero di neoblasti vicino al sito della ferita, ci siamo chiesti se queste cellule sono in grado di proliferare. Per questo scopo, è stato utilizzato l’anticorpo antifosfo-istone H3, un marcatore di cellule mitotiche (Newmark e Sanchez Alvarado, 2000; Wei et al., 1998), per contare il numero di cellule capaci di entrare nella fase M del ciclo cellulare. 4 giorni dopo il taglio, sono presenti cellule mitotiche nel parenchima e al di sotto dell’epitelio della ferita (Fig. 2.15I, J), ma in numero ridotto rispetto rispetto ai controlli (Fig. 2.15M). A 22 giorni dal taglio, le cellule mitotiche sparse nel parenchima sono fortemente ridotte in numero negli animali trattati con
dsDjRbAp48 rispetto ai controlli, ma si ritrovano molte cellule mitotiche
accumulate sotto l’epitelio della ferita (Fig. 2.15K, L).
In seguito è stato investigato se DjRbAp48 può influire sul differenziamento dei tessuti durante la rigenerazione della testa in frammenti di code iniettati con
dsDjRbAp48 capaci di produrre un piccolo blastema. A tale scopo è stata
analizzata l’espressione di DjSyt (Tazaki et al., 1999), DjAHNAK (Rossi et al., 2007) e Djinx1 (Nogi e Levin, 2005), marcatori del sistema nervoso, dell’epidermide e dell’intestino rispettivamente, mediante ibridazione in situ whole-mount. Sebbene i frammenti delle code in cui è stato silenziato il gene mostrano un significante numero di neoblasti (Fig. 2.16B) essi rigenerano un sistema nervoso più piccolo rispetto ai controlli (Fig. 2.16C, D). Inoltre, sono stati trovati difetti nella rigenerazione dell’intestino (ad es. falliscono nel rigenerare il ramo anteriore dell’intestino) (Fig. 2.16E, F), e una densità cellulare epiteliale ridotta (Fig. 2.16G, H), dopo il silenziamento di DjRbAp48.
L’analisi al TEM dei frammenti di teste iniettati con dsDjRbAp48 incapaci di rigenerare (n=5) mostra l’assenza di neoblasti in prossimità dell’epitelio della ferita (Fig. 2.17). In particolare, questi animali hanno sotto l’epitelio della ferita pochi neoblasti insieme a cellule differenziate, e cellule apoptotiche che mostrano condensazione e emarginazione della cromatina (Fig. 2.17B). Nella regione corrispondente nei controlli invece sono presenti numerosi neoblasti (Fig. 2.17A). Negli animali iniettati con dsDjRbAp48, nella regione distante dalla ferita si trovano accumulati gruppi di molti neoblasti polarizzati (Fig. 2.17D). Questi neoblasti sono localizzati nella regione che probabilmente corrisponde alla zona in cui si ritrovano accumulate le cellule che esprimono
DjMCM2 visualizzate mediante ibridazione in situ whole-mount. La presenza di
cellule apoptotiche negli animali trattati con dsDjRbAp48 è stata confermata dal saggio della diffusione del DNA, utilizzato per quantificare la morte cellulare per apoptotsi (Singh, 2005). Usando questo metodo, i nuclei apoptotici mostrano un alone di DNA granulare con i contorni esterni non ben definiti. Le cellule apoptotiche possono essere distinte dalle cellule necrotiche, in quanto queste ultime presentano nuclei grandi, omogenei e dai contorni ben definiti (Singh, 2000).
Per capire se i cluster di cellule apoptotiche che si accumulano sotto la regione della ferita degli animali rigeneranti trattati con dsDjRbAp48 sono neoblasti morenti, è stata iniettata la BrdU in animali trattati con dsDjRbAp48 e poi è stata analizzata l’incorporazione di BrdU mediante analisi al TEM. Dato che i neoblasti sono le uniche cellule proliferanti nelle planarie asessuate, ci aspettiamo di trovare la BrdU nei neoblasti, nella progenie di neoblasti in via di differenziamento e in alcune cellule differenziate. Nei nostri esperimenti le cellule marcate con BrdU si trovano localizzate sotto l’epitelio della ferita ma non nell’epitelio a 3 e 6 giorni dopo trattatamento con dsDjRbAp48 (Fig. 2.18F), un tempo sufficiente per il differenziamento delle cellule epiteliali (Newmark e Sanchez Alvarado, 2000). La figura 2.18G mostra l’involucro nucleare e la cromatina di cellule marcate con la BrdU.
Fig. 2.15: Effetto del silenziamento di DjRbAp48 durante la rigenerazione. (A,D) Immagine in luce di organismi iniettati a diversi giorni dal secondo taglio Le planarie in cui è stato silenziato DjRbAp48 non formano il blastema. Il blastema è indicato da due asterischi in un animale di controllo. (E-H) Espressione di DjMCM2 visualizzata mediante ibridazione in situ whole mount in animali rigneranti silenziati per DjRbAp48 (RNAi) e di controllo (control). Le frecce nere indicano le cellule DjMCM2 positive accumulate sotto l’epitelio della ferita. (I-L) Immunolocalizzazione con anticorpo anti istone H3 fosforilato su sezioni longitudinali ottenute da frammenti di testa trattate con dsDjRbAp48 (RNAi) e planarie di controllo (control). Le frecce bianche indicano le cellule mitotiche accumulate sotto l’epitelio della ferita. (M) Analisi di cellule mitotiche in frammenti di testa (heads) e di coda (tails) trattati con dsDjRbAp48 e di controllo (c). Il numero di cellule capaci di entrare nella fase M è stato analizzato in una finestra temporale di 6 ore. I valori sono espressi come percentuale rispetto alle planarie di controllo a cui è stato dato arbitrariamente il valore di 100%. Ogni valore rappresenta la deviazione media standard di tre campioni indipendenti analizzati in duplicato. ** Significativo con p<0,01. La significatività statistica è stata calcolata con il t-test Student’s. Scale bar: (A-H) 1mm; (I-L) 150 μm.
Fig. 2.16: Analisi dell’espressione di DjMCM2, DjSyt, DjAHNAK, Djinx1 mediante ibridazione in situ whole mount in frammenti di coda di controllo (control) e trattati con dsDjRbAp48 (RNAi) a differenti giorni (d) dal secondo taglio. Le frecce indicano gli occhi. L’asterisco indica una regione del corpo dove l’epitelio è stato perso durante l’ibridazione. Scale bar: 1 mm in A-F; 350 μm in G, H.
Fig. 2.17: Analisi di planarie rigeneranti trattate con dsDjRbAp48 mediante microscopia elettronica a trasmissione (TEM) e mediante saggio della diffusione del DNA. (A-D) Immagini al microscopio elettronico di animali, al terzo giorno di seconda rigenerazione, di controllo (control) e trattati con dsDjRbAp48 (RNAi) che non hanno blastema. (A) I neoblasti sono accumulati sotto l’epitelio della ferita di un controllo. (B) Cellule apoptotiche accumulate sotto l’epitelio della ferita di animali trattati con dsDjRbAp48 (RNAi). (C) Disegno schematico di una planaria in rigenerazione. Il rettangolo nero indica la regione del corpo corrispondente alle immagini A e B. L’asterisco indica la regione del corpo corrispondente all’immagine D. (D) Neoblasti orientati accumulati negli animali trattati con dsDjRbAp48. (E) Saggio di diffusione del DNA di nuclei ottenuti da animali di controllo (control) e da animali trattati con dsDjRbAp48 (4d) 4 giorni dopo la prima iniezione. Le cellule dissociate sono state preparate da 3 planarie per campione. I nuclei classificati come tipo IV sono state considerate apoptotiche. I valori sono espressi come percentuale di nuclei apoptotici rispetto al numero totale di nuclei contati. Ogni valore è la deviazione standard media di almeno tre campioni indipendenti contati in duplicato. (F, G). Analisi al TEM delle cellule marcate con BrdU. (F) Regione dell’epitelio della ferita (we) di planarie al terzo giorno di seconda rigenerazione iniettate con BrdU in cui è stato silenziato il gene DjRbAp48. (G) Ingrandimento della regione evidenziata in F che mostra due cellule apoptotiche con gruppi di particelle di oro nei loro nuclei e una cellula epiteliale (ep) che non ha alcuna particella di oro nel suo nucleo. La freccia bianca indica l’involucro nucleare. La significatività è stata assegnata con il t-test Student’s. Scale bar: 5 μm in A e B; 6 μm in D; 10 μm in E; 4 μm in F; 1 μm in G.
Ruolo di DjRbAp48 in planarie intatte
Gli animali intatti in cui è stato silenziato il gene DjRbAp48 iniziano a mostrare una ridotta motilità 30 giorni dopo la prima iniezione, successivamente segue un incurvamento dei bordi dell’animale (curling) e una progressiva regressione della testa (Fig. 2.18A). Le planarie muoiono dopo circa 40/50 giorni (n=50). Nessun difetto viene osservato negli animali di controllo che sopravvivono oltre le 9 settimane (n=25).
Dato che questo fenotipo è tipico di planarie che hanno perso i neoblasti abbiamo analizzato l’espressione di alcuni marcatori di neoblasti, quali
DjMCM2 (Salvetti et al., 2000), DjPiwi (Rossi et al., 2006) e Djnos (Sato et al.,
2006) in animali iniettati a 20, 30, 40 giorni dopo il trattamento con
dsDjRbAp48 mediante ibridazione in situ whole-mount (Fig. 2.18B). Negli
animali in cui è stato silenziato DjRbAp48 si assiste ad una riduzione nel numero di cellule che esprimono DjMCM2 sparse nel parenchima, e localizzate anteriormente al faringe e lungo le linee laterali dorsali. Generalmente, i neoblasti decrescono in numero più rapidamente nella regione anteriore del corpo che in quella posteriore. Cellule che esprimono DjMCM2 sono ancora presenti lungo la linea mediana del corpo posteriore al faringe, anche in animali con una forte regressione della testa. Sono state contate il numero di cellule che esprimono DjMCM2 in una popolazione di cellule dissociate ottenute dal controllo e da animali trattati con dsDjRbAp48. I risultati ottenuti hanno confermato la riduzione del numero di neoblasti 20 giorni dopo il trattamento con dsDjRbAp48 rispetto ai controlli (Fig. 2.19A). Risultati simili sono stati ottenuti analizzando l’espressione del marcatore di neoblasti, DjMCM2 mediante real-time PCR in planarie in cui è stato silenziato DjRbAp48 a 20 e a 30 giorni dopo la prima iniezione (Fig. 2.20A). I dati ottenuti confermano la presenza di un significante, sebbene ridotto, numero di neoblasti negli animali trattati con dsDjRbAp48 rispetto ai controlli.
Cellule DjPiwi-1 positive sono visibili lungo la linea mediana dorsale del corpo anteriore al faringe a tutti i tempi analizzati ed anche in fenotipi con
dsDjRbAp48, si osserva una riduzione del numero di cellule Djnos positive
rispetto ai controlli, ma si hanno ancora alcuni clusters posteriori al faringe. A 40 giorni dopo la prima iniezione, non è presente alcuna cellula Djnos positiva.
Avendo dimostrato che, nelle planarie intatte, il silenziamento di DjRbAp48 induce una parziale riduzione nel numero di neoblasti seguita dalla morte degli animali iniettati, sono stati condotti esperimenti per valutare la velocità di proliferazione dei neoblasti negli animali trattati con dsDjRbAp48. E’ stato contato il numero di cellule capaci di entrare nella fase M e S del ciclo cellulare. Il numero di cellule mitotiche è ridotto rispetto ai controlli 20 giorni dopo trattamento con dsDjRbAp48 e poi rimane relativamente costante nei successivi tempi analizzati (Fig. 2.19B). Lo studio delle cellule BrdU positive ha confermato i risultati ottenuti con l’analisi delle mitosi (Fig. 2.19C). La riduzione delle cellule proliferanti è stata dimostrata anche mediante immunoistochimica con l’anticorpo H3P negli animali iniettati con dsDjRbAp48 (Fig. 2.19D, E). Inoltre, è stata effettuata anche un’analisi al FACS delle frazioni di neoblasti sensibili all’irraggiamento (X1 e X2) (Hayashi et al., 2006; Reddien et al., 2005b). I nostri risultati hanno rivelato che il numero delle cellule X1 e X2 in una frazione cellulare arricchita in neoblasti ottenuta da animali trattati con dsDjRbAp48 che non presentavano regressione della testa era ridotto rispetto ai controlli (Fig. 2.20F). L’analisi al FACS ha anche rivelato che la frazione di cellule Xis, che rappresenta la frazione di cellule radio resistenti, è solo leggermente ridotta in numero (10%). Quando è stato analizzato il numero totale di cellule in una frazione arricchita in cellule differenziate (cellule con diametro maggiore di 25 μm) ottenuta dai controlli e da animali trattati con dsDjRbAp48, è stata trovata una riduzione più forte del numero di cellule differenziate Xis (30%). Per verificare meglio la riduzione delle cellule differenziate dopo il trattamento con dsDjRbAp48, è stata analizzata l’espressione di alcuni marcatori di cellule differenziate mediante real-time RT-PCR [DjIFb (Tazaki et al., 2002); DjMHC-B (Kobayashi et al., 1998) e mediante ibridazione in situ whole-mount (DjAHNAK)]. I risultati dimostrano che questi marcatori sono ridotti negli animali trattati con
dsDjRbAp48 rispetto ai controlli (Fig. 2.20A, B). Analisi istologiche di animali
iniettati con dsDjRbAp48, che non mostrano nessuna regressione dei tessuti evidente, rivelano una perdita dell’organizzazione tissutale e una riduzione della
densità cellulare (Fig. 2.21C, F). Ulteriori analisi al TEM rivelano la presenza di cellule apoptotiche in animali a 20 e 30 giorni dopo la prima iniezione, ma non nei controlli (Fig. 2.22A). Questi risultati sono confermati dal saggio della diffusione del DNA, che indica che un significante numero di cellule apoptotiche sono presenti in una frazione cellulare arricchita in neoblasti, ma non in una sospensione cellulare arricchita in cellule differenziate, ottenuta da animali uccisi dopo 20 giorni dal trattamento con dsDjRbAp48 rispetto a planarie di controllo (Fig. 2.22B).
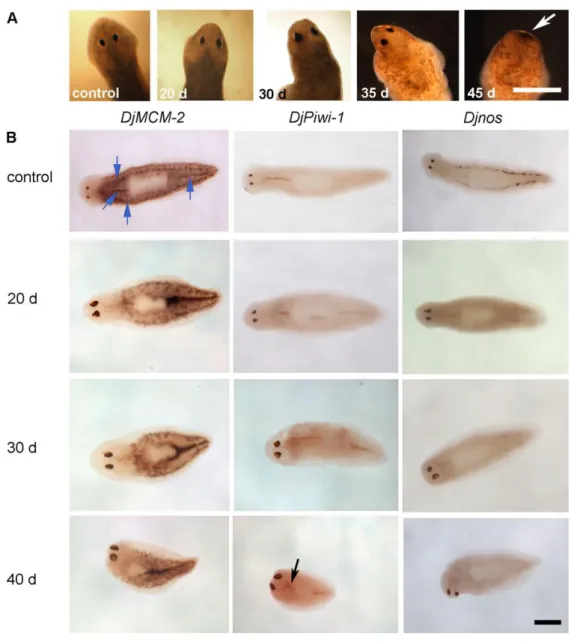
Fig. 2.18: Il silenziamento di DjRbAp48 induce regressione della testa e morte in planarie intatte. (A) Immagini in luce di un controllo e organismi iniettati a differenti giorni (d) dopo la prima iniezione. La freccia bianca indica la completa regressione della testa in una planaria iniettata con dsDjRbAp48. (B) Espressione di DjMCM2, DjPiwi-1 e Djnos visualizzata mediante ibridazione in
situ whole mount nei controlli e in planarie iniettate con dsDjRbAp48 a
differenti giorni (d) dalla prima iniezione. Le frecce blu indicano neoblasti localizzati lungo la linea mediana del corpo e nel parenchima dorso-laterale in una planaria di controllo. La freccia nera indica le cellule DjPiwi-1 positive davanti al faringe. Scale bar: 1mm.
Fig. 2.19: Analisi di cellule proliferanti in planarie intatte trattate con
dsDjRbAp48. (A) Immagini rappresentative di cellule esprimenti DjMCM2. Le
cellule DjMCM2 positive sono state contate in animali di controllo (c) e trattati con il dsDjRbAp48 (20d). I valori sono espressi come percentuale rispetto alle planarie di controllo a cui è stato dato arbitariamente il valore di 100%. Ogni valore rappresenta la deviazione media standard di tre campioni indipendenti analizzati in duplicato. * Significativo con p<0,05. (B, C) Analisi delle cellule mitotiche e delle cellule in fase S in un controllo e in animali trattati con
immunolocalizzazione con l’anticorpo anti istone H3 fosforilato su sezioni trasversali ottenute dalla regione del corpo anteriore al faringe. L’epitelio dorsale si trova in alto. Gli asterischi indicano il sistema nervoso. (F) Profilo al FACS di cellule marcate con ioduro di propidio (PI) e calceina. L’analisi è stata condotta in una popolazione di cellule arricchita in neoblasti (< 25 μm) e in una popolazione di cellule arricchita in cellule differenziate ( > 25 μm) ottenute da planarie di controllo (d) e trattate con dsDjRbAp48 (30 d) 30 giorni dopo la prima iniezione. Le popolazioni X1 (rosso) e X2 (blu) sono sensibili alle radiazioni, la popolazione Xis è resistente ai raggi X. La significatività è stata assegnata con il t-test Student’s Scale bar : 10 μm in A; 200 μm in D, E.
Fig. 2.20: Analisi del differenziamento cellulare in planarie intatte in cui è sttao silenziato il gene DjRbAp48. (A) Analisi mediante real-time RT-PCR. I livelli di espressione sono indicati in unità relative, assumendo il valore di 100 per le planarie di controllo. Ogni valore è la deviazione standard media di tre campioni indipendenti (n=3) analizzati in duplicato. L’espressione di DjRbAp48 è fortemente ridotta dopo trattamento con il dsDjRbAp48. Il livello di espressione di DjMCM2 è ridotto 20 e 30 giorni dopo trattamento con
dsDjRbAp48. Il livello di espressione di DjIFb e DjMHC-B è ridotto dopo
trammento con dsDjRbAp48. * Significatico con p<0,05. (B) Espressione di
DjAHNAK analizzata mediante ibridazione in situ whole mount. I livelli di
espressione di DjAHNAK nell’epidermide dorsale e ventrale degli animali trattati con dsDjRbAp48 sono più bassi rispetto alle planarie di controllo. L’epitelio dorsale si trova verso l’alto. (C-F) Analisi istologica di sezioni trasversali di tessuto colorate con ematossilina ed eosina. L’epitelio dorsale si trova verso l’alto. Gli animali trattati con dsDjRbAp48 mostrano una ridotta densità cellulare e disorganizzazione dei tessuti. g, intestino. La significatività è stata calcolata con il t-test Student’s. Scale bar: 1 mm in B; 100 μm in C, D; 50 μm in E, F.
Fig. 2.21: Analisi dell’apoptosi in planarie intatte trattate con dsDjRbAp48. (A) Immagine al microscopio elettronico di un insieme di cellule apoptotiche in animali trattati con dsDjRbAp48. (B) Ingrandimento della regione evidenziata in A che mostra la condensazione della cromatina. (C) Saggio della diffusione del DNA in planarie di controllo e in planarie trattate con dsDjRbAp48 (20 d) 20 giorni dopo la prima iniezione. Le cellule classificate come tipo IV sono state considerate cellule apoptotiche. Le cellule apoptotiche sono state trovate in una frazione cellulare ottenuta da animali trattati con dsDjRbAp48 mediante filtrazione attraverso un filtro con i pori di 20 μm, una frazione cellulare che contiene principalmente neoblasti e neoblasti in via di differenziamento. I valori sono espressi come percentuale di nuclei apoptotici rispetto al numero totale di nuclei contati. Ogni valore è la deviazione standard media di almeno tre campioni indipendenti contati in duplicato. Sono state contate 50 cellule per ogni campione. ** Significativo con p<0,01. La significatività è stata assegnata con il t-test Student’s. Scale bar: 3 μm in A; 1 μm in B.
Effetto del silenziamento di DjRbAp48 sull’architettura della cromatina
Dato che RbAp46 e RbAp48 sono fattori coinvolti nel metabolismo della cromatina a differenti livelli, ci siamo chiesti se il silenziamento di DjRbAp48 induce cambiamenti nella cromatina dei neoblasti. A questo scopo, è stata analizzata la grandezza dei nuclei e la quantità di fluorescenza emessa dai nuclei di neoblasti colorati con Hoechst. I nuclei sono stati ottenuti da animali sacrificati dieci giorni dopo il primo trattamento con il dsDjRbAp48, un tempo in cui le planarie non mostrano fenotipo (Fig. 2.22). Si è ottenuto che la dimensione dei nuclei in interfase è più grande (10%) negli animali trattati con
dsDjRbAp48 rispetto ai controlli (dati non mostrati) e che la media della
fluorescenza nucleare dei neoblasti negli animali trattati con dsDjRbAp48 è più alta (35%) rispetto ai nuclei interfasici di controllo (Fig. 2.22A). Quando l’analisi viene condotta su una popolazione selezionata di neoblasti con un’area più piccola di 25000 quadrati pixels, la fluorescenza nucleare totale è del 65% più alta negli animali trattati con dsDjRbAp48 rispetto ai controlli (Fig. 2.22D, E). Allo stesso modo, il trattamento delle planarie con NaBt, un agente capace di alterare la struttura della cromatina (Davie, 2003), induce un aumento della fluorescenza totale dei nuclei dei neoblasti rispetto ai controlli non trattati con NaBt (Fig. 2.22B, F, G). Per studiare l’effetto del silenziamento di DjRbAp48 sull’attività enzimatica delle deacetilasi, sono stati preparati estratti nucleari da animali trattati con dsDjRbAp48 e di controllo ed è stato condotto un saggio di attività enzimatica. I risultati ottenuti indicano che l’attività delle deacetilasi non è influenzata significativamente dal silenziamento di DjRbAp48.
Fig. 2.22: Analisi dei nuclei interfasici di neoblasti in planarie intatte trattate con dsDjRbAp48. (A) Immagini rappresentative di nuclei interfasici di neoblasti ottenuti da animali di controllo (c) e da animali trattati con dsDjRbAp48 (10 d) 10 giorni dopo la prima iniezione e (B) da animali di controllo (c) e animali trattati con NaBt (NaBt). I nuclei sono stati colorati con Hoechst No.33342.
I valori della fluorescenza nucleare media sono stati espressi come percentuale rispetto al controllo a cui è stato arbitrariamente attribuito il valore di 100. Ogni valore è la deviazione standard media di almeno 60 nuclei indipendenti. ** Significativo con p<0,01. (C) Attività dell’enzima deacetilasi misurata in estratti nucleari ottenuti da animali di controllo (c) e da animali trattati con
dsDjRbAp48 (10 d) 10 giorni (d) dopo la prima iniezione. L’attività dell’enzima
è espressa come percentuale rispetto al controllo a cui è stato arbitrariamente attribuito il valore di 100%. * Significativo con p<0,05. (D, E) Analisi della fluorescenza media nucleare in una sottopopolazione di neoblasti ottenuta da animali di controllo e trattati con dsDjRbAp48. (F, G) Analisi della fluorescenza media nucleare in una sottopopolazione di neoblasti ottenuta da animali di controllo e trattati con NaBt. Un quadrato bianco corrisponde ad un nucleo di controllo; un rombo nero corrisponde ad un nucleo di animali trattati con
dsDjRbAp48 o trattati con NaBt. L’area è indicata in square pixels e calcolata
con il programma Image J. I valori della fluorescenza nucleare media sono stati espressi come percentuale rispetto al controllo a cui è stato arbitrariamente attribuito il valore di 100%. Ogni valore è la deviazione standard media di almeno 25 nuclei indipendenti. ** Significativo a p<0,01. La significatività è stata assegnata con il t-test Student’s. Scale bar: 0,8 mm in B; 1 mm in C.
Discussione
Durante la rigenerazione, dopo la chiusura della ferita, le cellule staminali proliferano, migrano e si accumulano generando un blastema. La progenie di neoblasti che si trova nel blastema differenzia e si organizza a formare le parti mancanti del corpo della planaria.
DjRbAp48 è espresso nei neoblasti (Rossi et al., 2007) e gli animali in cui è
stata silenziata la sua espressione non sono capaci di formare un blastema. Tuttavia, la perdita dei neoblasti non è la causa primaria della mancata rigenerazione negli animali trattati con dsDjRbAp48. Infatti, i neoblasti rispondono all’amputazione proliferando e accumulandosi sotto l’epitelio della ferita in animali in cui l’espressione di DjRbAp48 è stata silenziata mediante RNAi e che non sono capaci di formare un blastema funzionale.
Inoltre, gli animali trattati con dsDjRbAp48 hanno un numero di cellule apoptotiche maggiore rispetto ai controlli. In particolare, l’analisi al TEM ha mostrato la presenza di gruppi di cellule apoptotiche marcate con BrdU, in prossimità della ferita, in una regione corrispondente a dove si forma il blastema negli animali di controllo. Dato che i neoblasti sono le uniche cellule proliferanti in planaria, si può ipotizzare che questi clusters di cellule apoptotiche siano la progenie dei neoblasti proliferanti presenti nel post-blastema che, dopo aver smesso di proliferare, migrano nella regione soprastante per poi morire per apoptosi.
Sulla base di queste osservazioni, si può concludere che DjRbAp48 non è coinvolto nel mantenimento dei neoblasti ma nei processi di determinazione e/o differenziamento della progenie dei neoblasti. Un possibile ruolo di DjRbAp48 in questo contesto, è supportato anche dall’evidenza che questo gene è espresso nella regione del blastema di animali rigeneranti di controllo. L’ipotesi è che in animali trattati con dsDjRbAp48, i neoblasti siano attivati dal taglio, ma non potendo differenziare, muoiano per apoptosi. I neoblasti rimanenti continuano a proliferare per cercare di produrre un blastema, ma non riuscendo a formarlo, l’animale muore. L’ipotesi che DjRbAp48 non è coinvolto nel mantenimento dei neoblasti viene confermata da evidenze sperimentali in cui animali rigeneranti silenziati per un gene che è coinvolto nel mantenimento dei neoblasti, DjPum, non mostrano neoblasti accumulati sotto l’epidermide della ferita. (Salvetti et
al., 2005). Un’altra conferma che DjRbAp48 non è coinvolto nel mantenimento viene da esperimenti in cui il silenziamento di un altro gene richiesto per il mantenimento delle cellule staminali, Smed-bruli, causa la perdita di neoblasti durante la rigenerazione (Guo et al., 2006).
La nostra ipotesi è supportata anche dai risultati ottenuti negli animali intatti. Sebbene planarie in cui il gene DjRbAp48 era stato silenziato mostravano un fenotipo tipico di animali irradiati, è presente ancora un numero significante di neoblasti, anche in animali in cui si ha regressione della testa come indica l’espressione dei marcatori molecolari di neoblasti DjMCM2, DjPiwi-1, Djnos e la conta dei neoblasti in fase M e S. Inoltre, l’analisi al FACS ha dimostrato che, nonostante la frazione di cellule X1, che contiene principalmente cellule proliferanti, e la frazione X2, contenente un numero limitato di cellule non proliferanti, siano ridotte dopo trattamento con dsDjRbAp48, un numero significante di neoblasti sono sempre visibili negli animali intatti silenziati per
DjRbAp48. In particolare è stato trovato che la maggior parte dei neoblasti
dispersi nel parenchima, la progenie di neoblasti di transito altamente proliferante (Salvetti et al., 2009), scompare 20 giorni dopo il trattamento con
dsDjRbAp48, mentre i neoblasti localizzati lungo la linea mediana del corpo
sono sempre presenti, anche in animali con fenotipo. I neoblasti localizzati nelle regioni anteriori del corpo sembrano scomparire più rapidamente di quelli localizzati nelle regioni posteriori dopo trattamento con dsDjRbAp48 anche se non si può stabilire un gradiente antero-posteriore nell’espressione di DjMCM2. Una possibile spiegazione è che il complesso di organi e sistemi che sono principalmente localizzati nella regione anteriore, può essere soggetta ad un ricambio cellulare maggiore di quelli localizzati nella regione posteriore del corpo (Oviedo e Levin, 2007).
Perchè gli animali in cui DjRbAp48 è stato silenziato muoiono? Tenendo presente, i risultati ottenuti negli animali rigeneranti trattati con dsDjRbAp48, noi proponiamo che gli animali silenziati per dsDjRbAp48 muoiono perché non possono rimpiazzare le cellule differenziate perse perché la progenie dei
alcuna regressione dei tessuti evidente, hanno tessuti disorganizzati. Inoltre, essi mostrano induzione di apoptosi, riduzione della densità cellulare e del numero di cellule differenziate e riduzione dell’espressione di marcatori dei tessuti differenziati. Anche se le mitosi sono state trovate in tutti i tempi analizzati, la progenie dei neoblasti può comunque non riuscire a differenziarsi e mantenere il fisiologico ricambio cellulare, che alla fine porta alla morte degli animali iniettati con dsDjRbAp48. Un fenotipo simile è stato ottenuto silenziando il gene
smedwi-2. Anche in questo caso si otteneva regressione della testa e morte degli
animali iniettati con il dssmedwi-2, un fenotipo tipico di animali privi di neoblasti. Tuttavia, negli animali con fenotipo sono presenti neoblasti e quindi gli autori suggeriscono che gli animali trattati con dssmedwi-2 muoiono perché la progenie dei neoblasti nonostante proliferi e migri nei siti dove è necessario il ricambio cellulare, non è in grado di differenziare e di sostituire le cellule differenziate morte (Reddien et al., 2005b).
I nostri risultati indicano che il silenziamento di DjRbAp48 induce un cambiamento nella misura del nucleo e nella fluorescenza nucleare, suggerendo che DjRbAp48 può essere un fattore epigenetico. Una possiblità è che
DjRbAp48 come altre proteine associate a retino blastoma, possa controllare
l’espressione di geni necessari per il differenziamento dei neoblasti influenzando l’architettura della cromatina. Infatti, la coordinazione tra attivazione e silenziamento genico, necessaria per il differenziamento cellulare, richiede un rimodellamento della architettura della cromatina su larga scala per silenziare geni a lungo termine (Cremer e Cremer, 2001). I fattori RbAp46 e RbAp48 sono componenti di molti complessi implicati nel rimodellamento della cromatina, ed è stato riportato in altri organismi che, RbAp48 e E2F-1 sono fisicamente associati in presenza di Rb e HDAC, suggerendo che RbAp48 potrebbe essere coinvolto nella repressione trascrizionale dei geni regolati da E2F (Nicolas et al., 2000). Tuttavia, le funzioni di RbAp46 e RbAp48 nei complessi di rimodellamento della cromatina non sono ancora stati del tutto stabiliti. I nostri dati suggeriscono che il silenziamento di DjRbAp48 non influenza significatamente l’attività delle deacetilasi. Una possibilità è che
DjRbAp48 non sia funzionalmente associato alle HDAC, e/o può essere un
componente di complessi del rimodellamento della cromatina che non contengono HDAC. Sebbene siano necessari ulteriori studi per capire a quale
livello DjRbAp48 può influire sul metabolismo della cromatina, i nostri risultati rappresentano la prima evidenza in vivo che un fattore associato alla proteina retinoblastoma è coinvolto nella biologia delle cellule staminali adulte.