Struttura cristallina dell’Isocorismato Sintasi Enterobactina-specifico (EntC) di Escherichia Coli legato al suo prodotto di reazione, l’Isocorismato:
implicazioni per il meccanismo enzimatico e attività differenziale degli enzimi che utilizzano corismato
EntC, una delle due isocorismato sintasi in Escherichia coli, è specifico per la biosintesi del sideroforo enterobactina. In letteratura è riportata la sua struttura cristallina nel complesso con isocorismato e Mg2+ alla risoluzione di 2.3 Å, la prima struttura di un enzima che utilizza corismato con un prodotto di reazione non aromatica [44]. EntC mostra un complesso α+ß fold simile agli altri enzimi che utilizzano corismato, come la salicilato sintasi e l’antranilato sintasi. Il confronto tra le strutture del sito attivo ha permesso l’identificazione di diversi residui che potrebbero essere importanti per l’attività dell’isocorismato di EntC. Sebbene EntC, MenF e Irp9 convertano tutti il corismato in isocorismato, solo Irp9 mostra in seguito attività di isocorismato piruvato liasi che portano alla formazione di salicilato e piruvato come prodotti della reazione. Allo scopo di comprendere i ruoli di questi residui amminoacidici nella conversione del corismato in isocorismato e di ottenere indizi sull’attività della piruvato liasi di Irp9, sono stati creati diversi mutanti di EntC nei quali i residui selezionati in EntC sono stati sostituiti con quelli di Irp9: questi comprendevano le mutazioni, A303T, L304A, F327Y, I346L e F359Q. Le analisi biochimiche di questi mutanti hanno indicato che la catena laterale di A303 in EntC può essere cruciale nell’orientamento del carbonile per permettere la formazione di un legame a idrogeno con l’isocorismato. Alcune mutazioni, come L304A e F359Q, danno luogo a una perdita di attività catalitica, mentre altre, come F327Y e I346L, mostrano che leggeri cambiamenti nei siti attivi altrimenti strettamente simili influenzano l’attività. E’ stata trovata una combinazione di questi residui che abbia conferito attività di piruvato liasi.
I siderofori chelanti del ferro sono essenziali per la sopravvivenza di batteri patogeni in condizioni di carenza di ferro in un organismo umano. L’enterobactina è il più potente chelante del ferro conosciuto con una costante di associazione di 1052 M-1 ed è utilizzato da alcuni batteri per competere efficacemente per il ferro presente nel loro ambiente. Il corismato, prodotto della via dello scichimato, viene successivamente convertito nell’Escherichia Coli dalle attività enzimatiche di EntC, EntB[45] e EntA [46] a 2,3-diidrossibenzoato, dal quale l’enterobactina viene prodotta attraverso EntE [45], EntD [45] e EntF [47]. I geni responsabili per la biosintesi di enterobactina sono organizzati in due gruppi bidirezionali. L’ operone entCEBA(X) forma un gruppo e entD e entF sono codificati nell’altro. La fase di lettura aperta di entX, che segue entA nello stesso operone è di funzione sconosciuta [44].
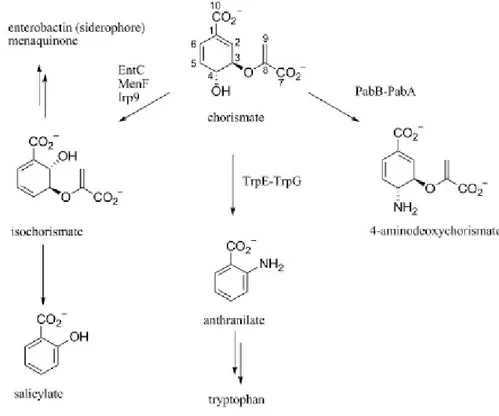
EntC catalizza la conversione di corismato in isocorismato (Fig. 14). L’enzima appartiene a una superfamiglia che utilizza corismato come substrato (Fig. 14) [48].
L’attività di sintesi dell’ isocorismato di EntC è specifica per la via di biosintesi dell’enterobactina. Inoltre, E. coli ha un’attività di sintesi dell’isocorismato che utilizza in modo specifico la via di biosintesi del menachinone codificata dal gene menF [49].
L’enterobactina viene sintetizzata in condizioni di carenza di ferro, mentre i menachinoni sono richiesti per il trasporto di elettroni in condizioni aerobiche. Di conseguenza, i gruppi genici responsabili per la sintesi di enterobactina e menachinoni sono regolati in modo diverso. Buss e al. hanno dimostrato anche che in E.coli c’è incanalazione dell’isocorismato in entrambe queste vie e questo può essere riferito alle posizioni cromosomiche relative dei geni responsabili della biosintesi di questi due composti nei loro rispettivi gruppi genici [50]. Le strutture cristalline a raggi X di diversi enzimi che utilizzano corismato sono note. Knochel e al. per primi hanno riportato la struttura dell’ antranilato sintasi di Sulfobolus solfataricus TrpE\TrpG [51]. Le strutture degli omologhi dell’ antranilato sintasi di Salmonella typhimurium [10] e Serratia marcescens [9] sono state successivamente risolte. E’ stata riportata anche la prima struttura di una salicilitato sintasi (Yersenia enterocolitica Irp9) [52] e successivamente è stata descritta la struttura del suo omologo da Mycobacterium tubercolosis [53]. La struttura dell’isocorismato sintasi di E.coli MenF è stata riportata da Kolappan e al.[48] e, più di recente, è stata riportata la struttura di MenF con Mg2+ e solfato legati nel sito attivo [54]. Un sito di legame del triptofano è stato identificato nell’antranilato sintasi (componente TrpE) e nell’amminodeossicorismato sintasi (PabB) [55]. Il triptofano è coinvolto nell’inibizione a feedback dell’antranilato sintasi, ma sembra giocare solo un ruolo strutturale in PabB [55].
Gli enzimi che utilizzano corismato catalizzano trasformazioni distinte del corismato (Fig.14). Tutte le reazioni implicano perdita iniziale del gruppo idrossilico del C4. Nella reazione catalizzata dall’isocorismato sintasi questo è sostituito da una molecola d’acqua che si attacca in C4; comunque, il
meccanismo preciso per questa reazione non è conosciuto [48]. Nell’antranilato sintasi (complesso TrpE-TrpG) il nucleofilo in C2 è l’ammoniaca, che è generata dalla sottounità glutaminasi (TrpG) e trasferita alla subunità bifunzionale TrpE [51]. Il TrpE di conseguenza opera la conversione del corismato in 2-amminodeossicorismato, seguita dall’eliminazione del piruvato (attività di piruvato liasi). La salicilato sintasi (Irp9) è un enzima bifunzionale che inizialmente catalizza la conversione del corismato in isocorismato e la successiva formazione di salicilato e piruvato [56, 57].
In PabB, la catena laterale di Lys274 agisce come nucleofilo sul C2 per formare un legame intermedio con l’enzima e successivamente reagisce sul C4 con ammoniaca, che è generata da una glutaminasi associata (PabA) [55].
E’ stata riportata la prima struttura a raggi X di EntC di E.coli legata all’isocorismato [44]. Il ruolo di alcuni residui vicini alla posizione finale del sito attivo sono stati studiati usando saggi biochimici di mutanti specifici.
I residui mutati sono stati scelti principalmente sulla base del confronto strutturale con Irp9. Sono stati identificati residui per porre la questione del perché EntC catalizza solo la conversione del corismato in isocorismato, mentre Irp9 catalizza anche la successiva conversione dell’isocorismato in salicilato [44].
Struttura di EntC
La struttura di EntC di E. coli (Fig. 15) è stata risolta usando un singolo rimpiazzamento isomorfo con diffusione anomala con wild-type e i dataset di selenometionil derivati.
Figura 15: (a) La struttura di EntC di E. coli mostrata in versione animata usando i colori dell’arcobaleno dall’N al C terminale. La bolla comprende la regione del sito attivo di EntC, mostrata ingrandita in (b). Isocorismato, grigio; ione magnesio, sfera verde; e acqua; sfera blu. Sono mostrati diversi siti attivi ma, per chiarezza, sono mostrati solo le catene laterali dei residui. Le figure sono state generate usando PyMOL (www.pymol.org).
La struttura è stata perfezionata a una risoluzione di 2.3 Å con un fattore R finale del 20% e un R free del 25.5% (Tabella 4).
Tabella 4:
Ci sono due molecole proteiche, ognuna con una molecola di isocorismato legata nel sito attivo, 293 molecole d’acqua, e quattro ioni di magnesio (due per molecola proteica) nell’unità asimmetrica. Le due molecole proteiche nell’unità asimmetrica sono collegate da simmetria non cristallografica impropria. Una
chiara densità elettronica è stata osservata per i residui 14-391 per entrambe le catene proteiche nell’unità asimmetrica. Le posizioni Cα delle due catene potevano essere sovrapposte con un RMSD di 0.35 Å.
EntC adotta un ripiegamento α+β simile a quello delle strutture conosciute di altri enzimi che utilizzano corismato [51]. La struttura complessiva ha nove α-eliche e 18 filamenti β. I filamenti β2, β3, β7 e β11 formano un foglietto β ripiegato, che crea un sandwich β ortogonale con un secondo foglietto ripiegato formato dai filamenti β5, β6, β17 e β18. I residui L212, A 213, G214 e S215 di β15 insieme a H276 di β17 ricoprono il sito attivo. Le α-eliche stanno sulla superficie della molecola.
La sovrapposizione delle strutture della isocorismato sintasi menachinone-specifica di E. coli (MenF) e EntC dimostrano l’esistenza di elementi strutturali addizionali secondari in MenF, formati dai residui 1-40 e 118-154. In modo simile, le strutture degli altri enzimi che utilizzano corismato mostrano elementi strutturali addizionali secondari nelle metà N-terminali quando confrontate con la struttura di EntC. EntC contiene un’elica, etichettata α2a (Fig. 15 e 16), che non si riscontra in nessuna altra struttura presa in esame [44].
α2a è collocato tra β7 e β9 che sono comuni a tutte queste strutture. La sua posizione è quasi perpendicolare a quella di α1, come osservato in tutte le altre strutture tranne in EntC. β7 continua come β8 che è assente in EntC. La presenza di α2a e la sua collocazione sono entrambi specifici di EntC tra gli enzimi che utilizzano corismato. EntC ha la sequenza più corta (391 residui) e la struttura più compatta di questa famiglia e può essere considerato come l’enzima rappresentativo centrale. Sebbene EntC abbia un’identità di sequenza solo del 20-28% con altri membri della famiglia, essi mostrano un alto grado di somiglianza strutturale [44]. Come si può vedere nell’allineamento della sequenza basata sulla struttura per le proteine rappresentative (Fig. 16), l’area più conservata è in direzione del C-terminale.
Figura 16: Sequenza di allineamento della struttura base degli enzimi rappresentativi utilizzanti corismato e sequenze di EntC generate utilizzando il programma ESPript [70]. ecEntC, isocorismato sintasi enterobactina-specifica di E. coli; ecMenF, isocorismato sintasi menachinone-specifica di E. coli; yeIrp9, salicilato sintasi di Y. enterocolitica; ssTrpE, componente TrpE dell’antranilato sintasi di S. sulfotoricus; ecPabB, p-aminodeossicorismato sintasi di E. coli. La sequenza altamente variabile N-terminale non è mostrata nell’allineamento. Lo schema numerico utilizzato per gli elementi di struttura secondaria di ecEntC segue quello di ssTrpE [51]. α2a è unico per ecEntC, che è anche mancante di α1.
Il sito attivo di EntC
Il sito attivo di EntC è collocato alla base di un’apertura formata da parti di α7, β15 e i loop o le spirali tra α8 e α9, β18 e β19, β19 e β20, e β21 e α10 (Fig. 15a). Nel sito attivo c’è chiara densità per l’isocorismato, il prodotto della reazione catalizzata da EntC e uno ione magnesio. L’anello dell’isocorismato si trova approssimativamente tra la catena laterale di una lisina conservata (K380) da una parte, e il carbonile del legame peptidico tra L212 e A213, dall’altra (Fig. 15b). L’idrossile sul C2 dell’isocorismato forma un legame a idrogeno con il carbonile di A303. Il gruppo enol-piruvil dell’isocorismato legato è inserito tra le catene laterali di K380 e I346. Uno degli ossigeni dell’enol-piruvil carbossilato è legato con un legame a idrogeno con l’azoto η1 e di R347 e l’altro all’azoto ammidico dello scheletro di G361 e ad una molecola d’acqua. Questa molecola d’acqua crea un legame a idrogeno con l’azoto ammidico dello scheletro di R347 e il carbonile dello scheletro di F359 (Fig. 17a). Lo ione magnesio è coordinato dal carbossilato C1 dell’isocorismato e le catene laterali dei residui conservati E241 e E376 (Fig. 17a).
Questa è la prima struttura in cui un prodotto non aromatico si trova legato al sito attivo di un enzima che utilizza corismato. Le posizioni dell’anello dell’isocorismato e la catena laterale dell’enol-piruvil legato al sito attivo di EntC sono molto simili rispettivamente a quelle dell’anello di salicilato e del piruvato legate nel sito attivo della salicilato sintasi (Irp9) (Fig. 17c). Le interazioni dei prodotti di legame sono di conseguenza simili. Lo ione magnesio è legato in posizioni identiche in EntC, MenF, e Irp9 con leganti equivalenti (Fig.17). Si è riscontrato che la mutazione del residuo di arginina (R387A) in MenF che corrisponde a R347 nella tasca di legame del piruvil in EntC porta ad un enzima inattivo [48].
Figura 17: Siti attivi di EntC (a), MenF (b) e Irp9 (c). Lo ione magnesio è rappresentato da una sfera verde e le molecole d’acqua da sfere blu. ISC, isocorismato; SAL, salicilato; PYR, piruvato. Per chiarezza, sono mostrati solo alcune delle interazioni legami a idrogeno (linee tratteggiate).
Si ritiene che ci siano diversi residui in EntC coinvolti nella catalisi che sono conservati tra gli enzimi che utilizzano corismato (Fig. 17a). K147 che corrisponde a K 190 in MenF, sembra che agisca come base catalitica attraverso l’attivazione di una molecola d’acqua nucleofilica e che si formi anche un legame a idrogeno con l’idrossile sul C2 dell’isocorismato nel sito attivo. Il gruppo carbossilico di E197 (MenF E240) si dirige verso il C4 dell’isocorismato legato e si pensa che agisca come acido generico per la perdita del gruppo idrossilico in C4 del corismato. Questo è compatibile con l’osservazione che MenF E240Q è inattivo (Schema 6).
Studi su wild-type e forme mutanti di EntC
L’allineamento strutturale e il confronto dei siti attivi di EntC, MenF e Irp9 rivelano un alto grado di conservazione e indicano le differenze. I residui che corrisponono a K147, E197,L212-S215, E241, H276, R347, A360-A362, E376 e K380 sono conservati tra questi enzimi (Fig. 16 e 17). H276, L212-S215 e A360-A362 interagiscono direttamente con il prodotto in EntC. I residui vicini A303, L304 e I346 non sono strettamente conservati nei tre enzimi. A303 è conservato tra EntC e MenF ma sostituito da treonina in Irp9. L304 è sostituito da valina in MenF e alanina in Irp9. I346 è sostituito da leucina sia in MenF che in Irp9. Il confronto strutturale rivela anche che i residui vicini all’enolpiruvil carbossilato del legame all’isocorismato non sono conservati in questi enzimi. Nelle posizioni 327 e 359 c’è la fenilalanina di EntC, mentre MenF ha la tirosina (Y368 e Y399) e Irp9 ha una tirosina (Y372) e una glutammina (Q403) in posizioni equivalenti. Stranamente, gli orientamenti delle catene laterali di F327 e F359 in EntC sono significativamente diversi dai residui equivalenti in MenF e Irp9 (Fig. 17). Tra i cinque enzimi confrontati nell’allineamento strutturale (Fig. 16) solo EntC mostra che F327 si allontana dal sito attivo con il Cε1 dell’anello che approssimativamente occupa la posizione dell’atomo Cζ di Y399 di MenF. In Irp9, la tirosina equivalente (Y372) si orienta verso il sito attivo con l’ossigeno dell’idrossile della catena laterale a una distanza di 2.5 Å da O1 del legame al piruvato. Gli equivalenti residui di tirosina in MenF e TrpE e il triptofano in PabB si orientano verso il sito attivo in questi enzimi. Il residuo in posizione 359 non è conservato in questi cinque enzimi che utilizzano corismato. F359 di EntC si orienta verso il sito attivo e il suo anello occupa parzialmente la posizione Y372 in Irp9. L’equivalente tirosina (Y399) in MenF si allontana dal sito attivo nella direzione di e occupando parzialmente la posizione dell’anello di F327 di EntC.
EntC, MenF e Irp9 trasformano tutti il corismato in isocorismato; tuttavia solo Irp9 in seguito mostra attività di piruvato liasi dell’isocorismato che si risolve
nella formazione di salicilato e piruvato come prodotti della reazione. Numerosi residui del sito attivo degli enzimi che utilizzano corismato sono stati studiati utilizzando analisi mutazionale per comprendere i ruoli di questi residui nella catalisi di questi enzimi [10, 55].
Sono state tentate sostituzioni singole, doppie, triple e quadruple di amminoacidi in EntC [44] nelle posizioni non conservate 303, 304,327, 346 e 359, nel tentativo di far luce sui ruoli di questi residui nell’attività di EntC e di capire meglio le differenze di attività rispetto a Irp9. Sono stati sostituiti i residui in queste posizioni in EntC con gli equivalenti residui di Irp9 (i.e. A303T, L304A, F327Y, I346L e F359Q) per vedere se qualcuna di queste sostituzioni, presa singolarmente o in combinazione con altre, potrebbe trasmettere attività di salicilato sintasi a EntC.
I vari enzimi mutanti di EntC che contengono sostituzioni di amminoacidi doppie, triple e quadruple, o hanno ridotto significativamente l’attività di isocorismato sintasi o sono inattivi. La produzione di salicilato è stata monitorata in assenza di PchB (che converte l’isocorismato in salicilato); in questi saggi, né EntC di wild-type, né nessuno dei degli enzimi mutanti hanno mostrato attività di salicilato sintasi.
I residui A303, L304, I346 sono allineati sopra il C3 e il gruppo enolpiruvato dell’isocorismato (Fig. 17a), con l’ossigeno carbonilico dello scheletro di A303 solo a 3.1 Å dall’ossigeno idrossilico di C2. Ci si aspetterebbe quindi che mutazioni in quest’area influenzino l’attività. Il mutante I346L di EntC ha un
kcat/Km(corismato) 12 volte più bassa dell’enzima degli wild-type e la mutazione doppia L304A, F359Q ha dato luogo a un enzima con attività non percepibile. La
kcat/Km (corismato) per il mutante A303T di EntCi è 130 volte più bassa di quella per EntC di wild-type. Inoltre, tutte le doppie, triple e quadruple sostituzioni di amminoacidi fatte coinvolgendo questa mutazione A303T, hanno avuto come risultato un enzima con attività non percepibile. E’ stato riportato che la
mutazione analoga in MenF (A344T) ha dato come risultato la perdita completa di attività e di conseguenza è stato proposto un ruolo per questo residuo nello step di isomerizzazione [48]. Perché l’attacco nucleofilo alla posizione C2 del corismato dia il prodotto con la corretta geometria, la molecola d’acqua si deve avvicinare al corismato dal lato si. La struttura di EntC mostra che c’è un’interazione tra il gruppo carbonilico dello scheletro di A303 e l’isocorismato, il che suggerisce un’interazione simile tra il carbonile dello scheletro e l’acqua coinvolta nell’attacco nucleofilo in C4 del corismato. Il cambiamento di dimensione della catena laterale di questo residuo produce presumibilmente un qualche riorientamento del carbonile dello scheletro, che potrebbe ben disturbare lo stato di transizione. L’altro residuo che contribuisce al lato si dell’acqua in posizione C2 è K147, essendo necessaria la lisina per attivare l’acqua per l’attacco nucleofilo.
La diminuzione di attività di EntC che incorpora le sostituzioni L304A e I346L mostra che sottili cambiamenti nel sito attivo influenzano la capacità dell’enzima di mantenere il substrato in una conformazione appropriata affinché la reazione proceda. La struttura cristallina di EntC con il prodotto legato mostra che esso lega l’isocorismato in una conformazione pseudo assiale, che si calcola essere 8.0 – 10.1 kcal/mol meno stabile della conformazione pseudo equatoriale a più bassa energia [58]. Si suppone che i riarrangiamenti {3,3} sigmatropici dal corismato al prefenato e dall’isocorismato all’isoprefrenato [59] il riarrangiamento{1,5} sigmatropico dall’isocorismato al salicilato e al piruvato (Schema 7) richiedano l’adozione della conformazione assiale a più alta energia. La cavità del sito attivo in EntC è leggermente più ampia di quella in Irp9 e possiede una piccola apertura idrofobica formata dai residui Leu304 e Gly361, che è assente da Irp9. Il gruppo enolpiruvil si lega attraverso questa apertura in modo che l’angolo diedrale risultante C2-C3-O-C8 sia 72° con la catena laterale tenuta lontano dall’anello centrale. E’ improbabile che questa catena faciliti i riarrangiamenti sigmatropici e potrebbe spiegare sia la mancanza di attività di piruvato liasi di EntC
(riarrangiamento {1,5} sigmatropico) che l’assenza di prodotti laterali associati con riarrangiamenti {3,3} sigmatropici sia del substrato (corismato) che del prodotto (isocorismato).
Schema 7: Ri-arrangiamenti sigma tropici del corismato e dell’isocorismato.
Le differenze negli orientamenti delle catene laterali di F327 e F359 in EntC paragonati con altri enzimi che utilizzano corismato (Fig. 17) ha suggerito un’indagine degli effetti delle sostituzioni di ammino acidi in questa regione. Le mutazioni F327Y e F359Q hanno dato come risultato kcat/Km 48 volte e10 volte
più bassa dell’enzima di EntC di wild-type. Inaspettatamente, la mutazione doppia F327Y/F359Q ha mostrato solo una riduzione di otto volte in kcat/Km. Non
è chiaro se la sostituzione in posizione 359 possa parzialmente recuperare la perdita di attività derivante dalla sostituzione in posizione 327. Gli enzimi con mutazioni doppie F327Y/I346L o F359Q/I346L hanno kcat/Km 750 volte e 130 volte più bassa dell’enzima di wild-type. Il confronto tra le architetture di EntC, MenF e Irp9 in quest’area mostra che può essere possibile, per questi residui in EntC, essere posizionati in direzioni simili a quelle di MenF. Comunque, la
struttura di EntC mostra che la tirosina in posizione 327 può essere adattata nella stessa direzione della fenilalanina nell’enzima di wild-type . Non è stato possibile conciliare i risultati dei saggi di attività con le informazioni strutturali poiché gli enzimi che incorporano le sostituzioni F327Y e F359Q non potevano essere cristallizzati. Studi sul mutante Y327F di Irp9 (corrispondente a F327 in EntC) hanno confermato che la tirosina non è coinvolta in un meccanismo di protonazione per l’eliminazione del piruvato in questo enzima [52].
EntC e i corrispondenti enzimi che utilizzano corismato sono coinvolti in vie biosintetiche essenziali nei batteri patogeni. La disponibilità della struttura di EntC con il prodotto legato è importante per capire il meccanismo dell’enzima e per una progettazione razionale di inibitori a piccola molecola. Alcuni studi [44] mostrano che, nonostante gli enzimi che utilizzano corismato abbiano architetture del sito attivo altamente simili, sottili differenze nei residui del sito attivo sono sufficienti per acquisire un’attività biochimica distinta.

![Figura 16: Sequenza di allineamento della struttura base degli enzimi rappresentativi utilizzanti corismato e sequenze di EntC generate utilizzando il programma ESPript [70]](https://thumb-eu.123doks.com/thumbv2/123dokorg/7533804.107355/8.892.195.793.126.828/sequenza-allineamento-struttura-rappresentativi-utilizzanti-corismato-utilizzando-programma.webp)
