4.
Risultati e discussione
4.1 Desensibilizzazione omologa del β
2-AR
Lo scopo principale di questo lavoro di ricerca è stato quello di valutare l’effetto della combinazione tra agonisti PPAR-γ e salbutamolo per l’identificazione di nuove potenziali strategie terapeutiche nell’asma. Il disegno sperimentale prevedeva l’impiego di modelli, in vitro, per lo studio di due aspetti che hanno una notevole rilevanza clinica: (i) la desensibilizzazione recettoriale correlata all’uso prolungato dei β2-agonisti che, non solo limita l’utilità terapeutica di questi
farmaci, ma può incrementare il rischio di sviluppo di reazioni avverse potenzialmente fatali (Janssen et al., 2006); e (ii) l’iperplasia della componente muscolare liscia delle vie respiratorie, un elemento fondamentale del rimodellamento tissutale che caratterizza la progressione della malattia asmatica (Ebina et al., 1993).
Il razionale di questa associazione farmacologica si basa principalmente su evidenze sperimentali precedentemente acquisite che hanno sottolineato le proprietà anti-infiammatorie e antiproliferative dei ligandi PPAR-γ, nell'asma e nella BPCO (Belvisi et al., 2006), suggerendo che la terapia "a bersaglio" su questi recettori potrebbe interferire con le vie di segnalazione coinvolte nella fisiopatologia dei processi infiammatori cronici delle vie respiratorie.
La realizzazione del modello di desensibilizzazione omologa del recettore β2
adrenergico (β2-AR) si è basata sull’esposizione al salbutamolo per 24 h di cellule
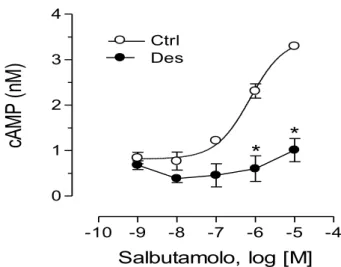
bronchiali muscolari lisce (BSMC) umane e misurando i livelli intracellulari di cAMP, dopo stimolazione con lo stesso agonista. Come evidenziato in Figura 14,
le cellule BSMC sono particolarmente responsive al trattamento con il β2
-agonista, mostrando un andamento della curva concentrazione-risposta di tipo sigmoidale nell’intervallo delle concentrazioni saggiate (10-5÷10-9). La
concentrazione 1 µM di salbutamolo è stata scelta per indurre la desensitizzazione in quanto simile al valore di EC50 ottenuto nei controlli (0.46 ± 0.13 µM), mentre
il tempo di esposizione di 24 h è stato selezionato in quanto ritenuto adeguato per un modello di esposizione cronica in vitro (Hall et al., 1992).
Nelle cellule pretrattate con salbutamolo si verifica una riduzione nella sintesi intracellulare di cAMP rispetto al controllo; tale variazione risulta essere significativa (P<0.05) a concentrazioni ≥1 µM (Figura 14).
Fig. 14. Curva dose-risposta per il salbutamolo nelle BSMC trattate con il
veicolo (Ctrl) o desensibilizzate con salbutamolo 1 µM per 24 h (Des). I dati sono riportati come valore medio ± SEM. *P<0.05.
Per chiarire meglio il meccanismo molecolare coinvolto nel processo di desensibilizazione omologa, le cellule precedentemente trattate con salbutamolo
-10 -9 -8 -7 -6 -5 -4 0 1 2 3 4 Ctrl Des
*
*
Salbutamolo, log [M]cA
M
P
(n
M
)
sono state esposte a diversi cAMP stimolanti tra cui lo stesso β2-agonista, la
forskolina (un attivatore dell’adenilato ciclasi) e la prostaglandina E2 (PGE2), che
agisce sui propri recettori attivando la stessa proteina Gs coinvolta nella cascata di
trasduzione del β2-AR. I risultati riportati nella Figura 15 dimostrano che il
pretrattamento con salbutamolo porta ad una sostanziale riduzione della risposta cellulare al β2 agonista rispetto ai controlli (P<0,05), mentre tale condizione non
ha alcun effetto sulla produzione di cAMP indotta dalla forskolina e dalla PGE2.
Fig. 15. Effetto della desensibilizzazione omologa del β2-AR sulla
responsività in vitro a diversi cAMP stimolanti nelle BSMC. Ctrl: controllo; Des: desensibilizzato (salbutamolo 1 µM per 24 h). Sal: salbutamolo; Fsk: forskolina; PGE2: prostaglandina E2. I dati sono
riportati come valore medio ± SEM. *P<0.05.
Come si può facilmente comprendere dai grafici, la desensitizzazione a carico del recettore β2-AR non comporta nessuna alterazione della trasduzione del segnale
che accomuna le 3 sostanze, ovvero del complesso proteina Gs/adenilato ciclasi. In accordo con queste osservazioni, lo studio condotto da Hall et al. (1992) ha
M µ Sal 10 M µ Fsk 1 m µ - 10 2 PGE 0.0 0.5 1.0 1.5 2.0 2.5 3.0 3.5 Ctrl Des
*
cA MP ( nm )evidenziato che la desensibilizzazione omologa con isoprenalina non sembra essere correlata a variazioni nella sensibilità dell’adenilato ciclasi, quindi la causa di questa riduzione della produzione di cAMP si è spostata sul recettore β2. Poiché
in letteratura l’esposizione cronica ai β2−agonisti è stata correlata al fenomeno
della down-regulation (Nishikawa et al., 1993), sono stati realizzati studi di espressione genica in cellule desensibilizzate con salbutamolo. I risultati ottenuti mediante tecnica RT-PCR hanno dimostrato che non vi sono differenze significative nel rapporto β2AR/GAPDH del trattato rispetto al controllo
(rispettivamente 0.78 ± 0.14 e 0.71 ± 0.21; P=0.37) (Figura 16) e quindi la causa di questa diminuita responsività non deriva da una variazione dell’espressione genica.
Fig. 16. Espressione di β2-AR in BSMC trattate con veicolo (Ctrl) o
desensibilizzate con salbutamolo 1µM per 24 h (Des).
Ctrl Des 0.0 0.2 0.4 0.6 0.8 1.0 1.2
β
2-A
R
/G
A
P
D
H
m
R
N
A
Parallelamente, sono stati condotti studi in RT-PCR e mediante tecnica EMSA per valutare, rispettivamente, i livelli di espressione e la presenza della proteina PPAR-γ nelle cellule BSMC. Dagli esperimenti effettuati è emerso che il recettore in esame è ampiamente espresso nelle BMSC. I livelli di espressione del gene che codifica per il recettore PPAR-γ sono paragonabili a quelli del gene di riferimento (housekeeping gene; GAPDH) e non ci sono differenze sostanziali tra cellule desensibilizzate e cellule di controllo (Figura 17). L’identificazione a livello nucleare del PPAR-γ ha dimostrato, in accordo con il dato di espressione, che la desensibilizzazione omologa non modifica la quantità di proteina nucleare rispetto al controllo (Figura 18).
Fig. 17. Livelli di trascrizione del gene che codifica per il PPAR-γ, in BSMC,
trattate con il veicolo (Ctrl) o desensibilizate con salbutamolo 1µM per 24 h.
Fig. 18. Livelli di espressione della proteina
PPAR-γ nei nuclei delle BSMC trattate con il veicolo (Ctrl) o desensibilizzate con salbutamolo 1 µΜ per 24 h.
Ctrl 2 +PGJ Des 2 + PGJ 0 1 2 3 4
***
# cA M P ( nM )4.2 Effetto dei PPAR-γ agonisti sulla desensitizzazione
omologa del β
2-AR
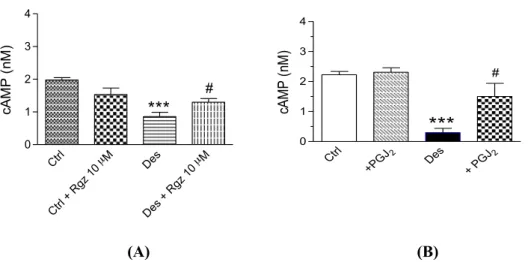
La presenza del recettore del PPAR-γ ha permesso di poter proseguire alla fase sperimentale successiva, ovvero testare degli agonisti di tale recettore sulla desensibilizzazione omologa indotta dal salbutamolo. Il trattamento delle cellule desensibilizzate con il rosiglitazone o con l’agonista endogeno PGJ2, alla
concentrazione di 10 µM per 24 ore, si è dimostrato capace di ripristinare, almeno in parte, la responsività al salbutamolo (Figura 19).
(A) (B)
Fig. 19. Livelli intracellulari di cAMP dopo trattamento con rosiglitazone (A) e con PGJ2 (B) alla
concentrazione 10 µM per 24 h nelle cellule di controllo (Ctrl) o desensibilizzate (Des). ***P<0.005; rispetto
alle cellule di controllo. #P<0.05, rispetto alle cellule desensibilizzate.
Ctrl µM Ctrl + Rgz 10 Des M µ Des + R gz 10 0 1 2 3 4
***
# cA M P ( nM )L’effetto protettivo osservato con il rosiglitazone e la PGJ2, non sembra essere
correlato a variazioni trascrizionali nell’espressione del recettore β2-AR (Figura 20).
Nonostante il meccanismo d'azione sia in larga parte legato a modificazioni dell'espressione genica, trattandosi di recettori nucleari, gli effetti genomici non spiegano in modo esaustivo le proprietà farmacologiche degli agonisti PPAR-γ. A tal proposito, alcuni autori (Heppner et al., 2005; Kinoshita et al., 2006) hanno dimostrato la capacità di queste sostanze di modulare i canali al potassio e al calcio, indicando che tali composti potrebbero alterare la responsività delle cellule muscolari lisce delle vie aeree anche modificando la conduttanza ionica.
(A)
(B)
Fig. 20. Livelli di espressione del PPAR-γ dopo trattamento con rosiglitazone (A) e
con PGJ2 (B) alla concentrazione 10 µM per 24 h nelle cellule di controllo (Ctrl) o
Ctr
l
µ
M
+De
x 10
Des
µ
M
+ Dex
10
0
1
2
3
4
5
**
**
cA
M
P
(
nM
)
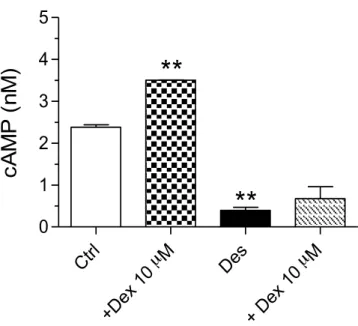
Successivamente, lo stesso modello è stato utilizzato per testare uno dei farmaci di riferimento nelle patologie respiratorie croniche, ovvero il desametasone. Alcuni autori hanno evidenziato che il desametasone è in grado di esercitare un effetto protettivo sulla desensitizzazione agendo sulla down-regulation recettoriale prodotta dalla somministrazione di β2-agonisti (Hall et al., 1992). Nei nostri
esperimenti, sebbene nei controlli il pretrattamento con 10 µM di desametasone per 24 h producesse un aumento significativo della risposta cellulare al salbutamolo, nelle cellule desensibilizzate il cortisonico non esercitava alcun effetto protettivo (Figura 21).
Fig. 21. Livelli intracellulari di cAMP nei controlli (Ctrl) o nelle cellule
desensibilizzate (Des) con un pre-trattamento di 10 µM di desametasone per 24 h. **P<0.01, rispetto al controllo.
In accordo con le nostre osservazioni, il potenziamento della risposta al salbutamolo da parte del desametasone nelle cellule non desensibilizzate è stato osservato anche dall’equipe di Aksoy (2002). Tale aumento nei livelli intracellulari di cAMP, in seguito a trattamento con desametasone 1 µΜ per 24 ore, è stato correlato ad un aumento dell’espressione della proteina Gsα piuttosto
che ad una up-regulation del gene codificante per il β2-AR. Il lavoro pubblicato
da Hall et al. (1992), peraltro, evidenzia che su cellule muscolari lisce respiratorie il pretrattamento con il cortisonico, anche a concentrazioni elevate (100 µM per 16 ore), non era in grado di ripristinare la responsività all’isoprenalina, in termini di produzione di cAMP, nelle cellule desensibilizate.
4.3 Proliferazione delle BSMC
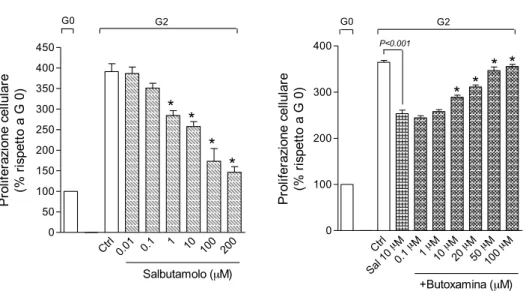
L’analisi dell’effetto della combinazione degli agonisti PPAR-γ con il salbutamolo sulla proliferazione delle BMSC è stato effettuato mediante il calcolo dell’indice di combinazione (Combination Index, CI; Chou et al., 1994). Per ottenere i parametri necessari per il calcolo del CI, sono state effettuate curve di crescita per ogni singolo farmaco o composto in esame, esponendo le cellule all’agente farmacologico per 48 h. La scelta del tempo di esposizione pari a 48 h è stata dettata dal fatto che le cellule prese in esame avessero un tempo di replicazione di circa 24 h e quindi per la valutazione dell’effetto antiproliferativo fossero necessarie almeno due duplicazioni cellulari. Come atteso, i fattori di crescita contenuti nel mezzo di coltura stimolano la proliferazione cellulare
aumentando di circa quattro volte il numero di cellule rispetto a quelle inizialmente seminate (Giorno 0; Figura 22). Il trattamento con salbutamolo nell’intervallo di concentrazioni da 1 a 200 µM, inibiva la crescita cellulare in modo concentrazione-dipendente (Figura 22) con un valore di IC50 pari a 7.37 ±
1.75 µM. È interessante notare che alla massima concentrazione testata, non si assisteva ad un decremento del numero di cellule rispetto a quelle inizialmente seminate e risultava paragonabile a quello ottenuto dalla coltura nel mezzo privo di siero e di fattori di crescita.
Questi risultati indicano che il salbutamolo, nell’intervallo di concentrazioni saggiate, svolge un effetto citostatico. In accordo con tale affermazione, la vitalità cellulare nei campioni trattati con salbutamolo 100 µM (valutata al termine del periodo di esposizione mediante colorazione con tripan blu) non era diversa da quella dei controlli.
Fig. 22. Effetto del salbutamolo sulla proliferazione delle BSMC in presenza (a) od in assenza (b)
dell’antagonista selettivo β2-ADR, butoxamina. I dati sono espressi come valore medio ± SEM. *P
< 0.05, rispetto al controllo (a) o al tratamento con salbutamolo da solo (n=3).
Ctrl0.01 0.1 1 10 100 200 0 50 100 150 200 250 300 350 400 450 * * * * G0 G2 Salbutamolo (µM) Pr ol ife ra zi on e ce llu la re (% r is pe tt o a G 0) Ctrl Mµ Sal 10 M µ 0.1 M µ 1 10 µM20 µM50 µM µM 100 0 100 200 300 400 +Butoxamina (µM) G0 G2 P<0.001 * * * * Pr ol ife ra zi on e ce llu la re (% ri sp et to a G 0 )
L’effetto antiproliferativo del salbutamolo sembra essere mediato dal recettore β2
-AR in quanto: (i) la butoxamina, un antagonista β2 selettivo, riduceva il blocco
della crescita cellulare indotto dall’agonista in modo concentrazione-dipendente; (ii) l’effetto protettivo risultava essere già significativo quando antagonista ed agonista venivano usati in concentrazione equimolare (Figura 22).
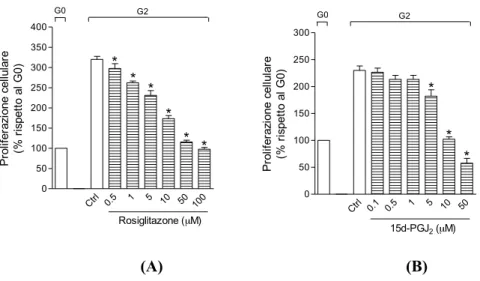
L’effetto del rosiglitazione e della PGJ2 è stato testato nelle stesse condizioni
sperimentali. Entrambi i PPAR-γ agonisti prevengono l’azione mitogenica dei fattori di crescita in modo concentrazione-dipendente (Figura 23A e 23B).
(A) (B)
Fig. 23. L’effetto antiproliferativo del rosiglitazone (Rgz) o della PGJ2 (B) su cellule BSMC. I dati
son espressi come valore medio ± SEM. *P <0.05, rapportati al controllo (A) o al rosiglitazone da solo (n=3).
Alla massima concentrazione saggiata (100 µM), il rosiglitazone blocca completamente la crescita cellulare; infatti, il numero di cellule al termine del periodo di esposizione al farmaco era simile al numero di cellule seminate all’inizio dell’esperimento (Figura 23A). Invece, il trattamento con PGJ2 50 µM
Ctrl 0.5 1 5 10 50 100 0 50 100 150 200 250 300 350 400 * * * * * * G0 G2 Rosiglitazone (µM) Pr ol ife ra zi on e ce llu la re (% r is pe tt o al G0 ) Ctrl 0.1 0.5 1 5 10 50 0 50 100 150 200 250 300 * * * G0 G2 15d-PGJ2 (µM) Pr ol ife ra zi on e ce llu la re (% r is pe tt o al G0 )
per 48 ore ha comportato una riduzione significativa del numero di cellule rispetto a quelle iniziali, indicando chiaramente un effetto citotossico dovuto ad una concentrazione troppo elevata.
(A) (B)
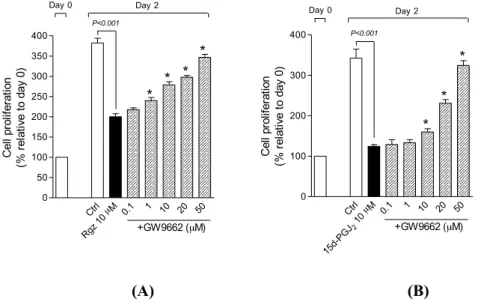
Fig. 24. L’effetto dell’antagonista selettivo PPAR-γ, GW9662 sull’inibizione della proliferazione
dai fattori di crescita ad opera di rosiglitazone (Rgz) (a) o PGJ2 (b). I dati sono espressi come
valore medio ± SEM (n=3). *P < 0.05, comparato con i trattamenti con solo l’agonista PPAR-γ.
Per capire se tale effetto fosse mediato dal recettore PPAR-γ, sono stati effetuati degli esperimenti che prevedevano l’utilizzo di un antagonista PPAR-γ selettivo, GW9662. Come mostrato in Figura 24A e 24B, l’inibizione a carico del recettore PPAR ha provocato un blocco dell’attività antiproliferativa sia del rosiglitazone che della PGJ2 in modo concentrazione-dipendente, riportando la crescita cellulare
a livelli simili a quelli ottenuti nei controlli. Questi dati sono in linea con quelli ottenuti da Ward et al. (2004) che dimostrano l’azione inibitoria della 15d-PGJ2,
Ctrl µM Rgz 1 0 0.1 1 10 20 50 0 50 100 150 200 250 300 350 400 Day 0 Day 2 P<0.001 * * * * +GW9662 (µM) Ce ll pr ol ife ra tio n (% r el at iv e to d ay 0 ) Ctrl µM 10 2 15d-P GJ 0.1 1 10 20 50 0 100 200 300 400 P<0.001 * Day 0 Day 2 * * +GW9662 (µM) Ce ll pr ol ife ra tio n (% r el at iv e to d ay 0 )
del rosiglitazone e del ciglitazone su cellule di muscolatura liscia bronchiale umana, in assenza di fenomeni apoptotici.
L'associazione tra corticosteroidi e β2-agonisti rappresenta uno degli schemi
farmacologici più usati nei pazienti con asma persistente (Johnson et al., 2004). L'efficacia di tale combinazione deriva dall'interazione di questi farmaci a livello molecolare e comprende l'attivazione sincronizzata di fattori di trascrizione, con un potenziamento dell'effetto antiproliferativo già riconosciuto ad entrambe le classi farmacologiche (Roth et al., 2002). In base a tali considerazioni, sono stati effettuati nel nostro laboratorio alcuni esperimenti con il desametasone, in modo da confrontare l’effetto dei PPAR-γ agonisti con quelli ottenuti mediante l’impiego di un farmaco di riferimento.
Nel nostro modello sperimentale, il desametasone inibisce la proliferazione cellulare indotta dai fattori di crescita EGF e bFGF con un IC50 pari a 34.8 ± 1.60
µM. L’effetto è significativo già alla concentrazione 1 µM e alla massima concentrazione saggiata (100 µM), il desametasone non sembra indurre effetti citotossici (Figura 25).
(A) (B)
Fig. 25. L’effetto antiproliferativo del desametasone (Dex) su cellule BSMC in assenza
(A) o in presenza (B) dell’antagonista selettivo mifepristone (RU486). I dati sono espressi come valore medio ± SEM. *P < 0.05, comparato al controllo (A) o al desametasone da solo (B) (n=3).
L’inibizione della crescita cellulare promossa dal desametasone è recettore-mediata in quanto completamente bloccata dall’antagonista RU486 (Figura 25B). Dalle curve dose-risposta ottenute per i singoli farmaci o composti esaminati è stato possibile calcolare i valori di IC50 (Tabella 1).
Sulla base dei valori ottenuti, per gli esperimenti di combinazione, sono state prese in considerazione le concentrazioni di farmaco che non fossero capaci di esercitare un significativo o evidente effetto citostatico. Visti i valori di IC50 molto
simili tra loro, per la combinazione, sono state testate concentrazioni di farmaci in rapporto 1:1 tra loro. Nella combinazione tra salbutamolo e PPAR-γ agonisti, è stato evidenziato un potenziamento dell’effetto rispetto ai singoli farmaci a
Ctrl 0.1 0.5 1 5 10 50100 0 50 100 150 200 250 300 350 G0 G2 Desametasone (µM) * * * * * Pr ol ife ra zi on e ce llu la re (% r is pe tt o al G0 ) Ctrl µM Dex 50 0. 1 1 10 20 50 100 0 50 100 150 200 250 300 350 400 +RU486 (µM) G2 G0 P<0.001 * * * * Pr ol ife ra zi on e ce llu la re (% r is pe tt o al G0 )
concentrazioni sub-micromolari (Figura 26A e 26B). Tale effetto è paragonabile a quello osservato per la combinazione salbutamolo/desametasone (Figura 26C).
Trattamento IC50 µM (media ± SEM)
Salbutamolo 7.37 ± 1.75
Rosiglitazone 8.52 ± 1.26
15d-PGJ2 10.1 ± 1.37
Desametasone 34.8 ± 1.60
Tabella 1. Valori di IC50 di salbutamolo, rosiglitazione, PGJ2 e
(A) (B)
(C)
Fig. 26. Gli effetti di salbutamolo (Sal), rosiglitazone (Rgz) e PGJ2 (15d-PGJ2), da soli od in
combinazione su cellule BSMC. ***Differenze significative (p<0.001) sono riscontrabili, tra l’effetto delle singole dosi e le combinazioni. Tutti i dati sono espressi come valore medio ± SEM (n=3).
Il calcolo successivo del CI mostra che la combinazione del β2-agonista con i
PPAR-γ agonisti è sinergica con valori paragonabili a quelli ottenuti dalla combinazione del β2-agonista con il cortisonico (Tabella 2).
Ctrl µM Sal 0 .1 µM 0.1 2 PGJ M µ 0.1 2 M + P GJ µ Sal 0 .1 M µ Sal 0 .5 M µ 0.5 2 PGJ M µ 0.5 2 M + P GJ µ Sal 0 .5 0 100 200 300 400 *** *** Day 0 Day 2 Ce ll pr ol ife ra tio n (% r el at iv e to d ay 0 ) Ctrl µM Sal 0.1 M µ Rgz 0.1 M µ M + Rg z 0.1 µ Sal 0.1 M µ Sal 0.5 M µ Rgz 0.5 M µ M + Rg z 0.5 µ Sal 0.5 0 100 200 300 400 *** *** Day 0 Day 2 Ce ll pr ol ife ra tio n (% r el at iv e to d ay 0 ) Ctrl Sal 0.1 mM Dex 0.1m M Sal 0.1 mM + Dex 0.1m M Sal 0.5 mM Dex 0.5m M Sal 0.5 mM + Dex 0.5m M 0 100 200 300 400 Day 0 Day 2 *** *** Ce ll pr ol ife ra tio n ( % r el ati ve t o da y 0 )
Tabella 2. Valori di Combination Index (CI) e Indice di Riduzione della Dose (DRI), per il
salbutamolo in combinazione con rosiglitazone e PGJ2 o desametasone dopo 48 h di trattamento su
cellule BSMC.
Il vantaggio della combinazione di farmaci che hanno diverso meccanismo d’azione e diverso profilo tossicologico consiste nella possibilità di mantenere l’effetto terapeutico a dosi più basse con un notevole guadagno in termini di tollerabilità del paziente al trattamento farmacologico. L’indice di riduzione della dose (dose reduction index, DRI), rappresenta un parametro che permette la quantificazione di questo vantaggio.
La combinazione del salbutamolo con i PPAR-γ agonisti o con il desametasone porta ad una riduzione di circa il 50% della proliferazione cellulare indotta dai fattori di crescita, a concentrazioni da 2 a 12 volte inferiori rispetto a quelle richieste per ciascun farmaco da solo (Tabella 2). Come regola generale, una riduzione della dose, comporta una riduzione della tossicità e di conseguenza un miglioramento complessivo del risultato terapeutico.
Il potenziale apoptotico e necrotizzante delle diverse combinazioni è stato infine valutato allo scopo di verificare se l’effetto sinergico sulla proliferazione cellulare fosse correlato alla presenza di citotossicità. Come evidenziato in (Figura 27), le diverse combinazioni di farmaci o composti, in condizioni sperimentali tali da
Concentrazioni (µM) Inibizione (%) CI DRI
Sal Rgz 15d-PGJ2 Dex Alb Rgz PGJ2 Dex
0,1 0,1 35,9 ± 5,48 0,66 2,31 4,45 0,5 0,5 52,9.7 ± 3,07 0,52 4,72 3,21 0,1 0,1 47,7 ± 1,52 0,18 12,4 9,87 0,5 0,5 54,6 ± 2,06 0,51 5,88 2,88 0,1 0.1 41,5 ± 2,25 0,29 5,22 10 0,5 0.5 47,6 ± 0,57 0,70 2,40 3,56
bloccare la proliferazione di circa il 50% delle cellule muscolari lisce bronchiali, non inducono morte cellulare né per apoptosi né per necrosi. Sulla base di questi risultati e dell’analogia con il meccanismo d’azione molecolare dei glucocorticoidi, è ragionevole supporre che l’effetto sinergico dei PPAR-γ agonisti e del salbutamolo si realizzi mediante un’interazione con il ciclo cellulare. I dati della letteratura sono a sostegno di tale ipotesi, infatti, Roth et al. (2002) hanno evidenziato che la combinazione di salmeterolo e budesonide induce l’arresto della proliferazione cellulare mediante l’attivazione prolungata della
p21waf1/Cip1, una proteina che svolge un ruolo centrale nel controllo del ciclo
cellulare.
Fig. 27. Assenza di apoptosi e
necrosi dopo trattamento delle BSMC con diverse combinazioni di farmaci a concentrazioni che inducono inibizione della crescita cellulare al 50 % rispetto ai controlli. T:trattati; Ctrl: controlli. I dati sono espressi come valore medio ± SEM.
Per chiarire meglio il meccanismo mediante il quale si esercita questo sinergismo, sono stati effetuati degli esperimenti atti a vericare se ci fossero alterazioni a carico della regolazione del ciclo cellulare. Studi di citofluorimetria hanno
Apoptosis Necrosis 0 1 Sal 0.1 µM Rgz 0.1 µM 15d-PGJ20.1 µM Dex 0.1 µM + + + + + + + + + + + + Sal 0.5 µM Rgz 0.5 µM 15d-PGJ20.5 µM Dex 0.5 µM + + + + + + + + + + + + Mo rt e ce llu la re (r ap po rt o T /Ct rl )
dimostrato che il trattamento con la combinazione tra il rosiglitazone (500 nM) salbutamolo (500 nM) rispetto al controllo, porta ad una significativa riduzione delle cellule in fase G2/M, facendo aumentare in proporzione quelle in fase G0/1.
Questi dati suggeriscono che l’inibizione della crescita cellulare indotta dalla combinazione, avvenga mediante il blocco del passaggio delle cellule dalla fase G0/1 alla fase S (Figura 28).
Fig. 28. Analisi del ciclo cellulare su cellule di controllo e trattate con la combinazione di farmaci
composta da salbutamolo e rosiglitazone alla concentrazione di 0.5 µM
4.4 Attività proinfiammatoria delle Microparticelle
L’attività proinfiammatoria a carico delle cellule della muscolatura liscia bronchiale umana indotta dalle microparticelle è stata valutata mediante:
• la possibile desensitizzazione eterologa del recettore β2-adrenergico
• l’induzione della COX-2.
Gli esperimenti effettuati hanno permesso di stabilire che in condizioni basali, le cellule esprimevano livelli di IL-8 di circa 260 pg/ml. A seguito della stimolazione con le MP tale valore veniva incrementato di circa 4 volte (Figura
29).
Fig. 29. Livelli di IL-8 in cellule di controllo e trattate con MP
Studi di espressione genica hanno dimostrato che l’incremento del release di IL-8 a seguito del trattamento con MP, anche se non paragonabile come intensità a quello riscontrato mediante saggio ELISA, era ricollegabile ad un’aumento trascrizionale del gene (Figura 30).
Fig. 30. Livelli di espressione di IL-8 e GAPDH nelle cellule di
controllo (Ctrl) e dopo l’esposizione alle MP per 24 h.
Successivamente, sempre per quanto riguarda gli studi di espressione genica, sono stati valutati gli effetti l’esposizione delle cellule bronchiali alle MP sul gene COX-2. La Figura 31 evidenzia i diversi livelli trascrizionali delle cellule esposte alle microparticelle rispetto a quelle di controllo.
Fig. 31. Livelli di espressione della COX-2 e GAPDH nelle cellule di
controllo (Ctrl) e dopo l’esposizione alle MP per 24.
L’aumento dell’espressione di COX-2 evidenzia ulteriormente l’effetto pro-infiammatorio delle MP e potrebbe essere correlato alla desensitizzazione eterologa indotta dalle MP sulle BSMC, mediante l’incremento del release della PGE2. Studi a riguardo, hanno dimostrato che il trattamento cronico con le MP portano ad un notevole incremento della produzione di prostaglandina (Figura
32). Per accreditare tale ipotesi, sono stati effettuati degli esperimenti che
prevedevano l’utilizzo di 2 inibitori dell’enzima COX-2, l’indometacina (inibitore non selettivo) ed il NS-398 (inibitore selettivo), per verificare se il blocco di tale enzima fosse capace di ripristinare la risposta al β2-agonista, in cellule
Fig. 32. Livelli di PGE2 in cellule di controllo e trattate con MP
I dati ottenuti (Figura 33 e 34) mostrano come entrambi gli inibitori abbiano un effetto sulle cellule esposte cronicamente alle MP. Nello specifico, i risultati ottenuti hanno evidenziato una maggiore capacità da parte dell’inibitore selettivo della COX-2, il NS-398, rispetto all’indometacina, nel ripristinare l’attività del recettore β2-adrenergico.
Fig. 33. Misurazione dei livelli di cAMP su BSMC a seguito del
Fig. 34. Misurazione dei livelli di cAMP su BSMC a seguito del trattamento
con MP e NS-398 di BSMC (*p<0.05, **p<0.01).
Successivamente, su tale modello sperimentale, è stato testato il montelukast (MTK), un antagonista del recettore per i leucotrieni impiegato largamente in clinica come antiasmatico. Gli esperimenti condotti per la valutazione del release di IL-8, hanno evidenziato la capacità del farmaco di inibire la produzione della citochina, mentre non risultava modulare l’output dalla cellula della proteina nelle cellule di controllo (Figura 35).
Fig. 35. Release della citichina IL-8 in cellule di controllo (Ctrl) e a seguito del
trattamento con MP e MTK (test ANOVA; *p<0,05, **p<0,01)
Il montelukast ha dimostrato una discreta capacità di proteggere nei confronti della desensitizzazione eterologa del recettore β2-adrenergico, indotta dalle MP
(Figura 36).
Fig. 36. Livelli di cAMP in cellule di controllo (Ctrl) e a seguito del trattamento con
Dati gli effetti positivi riscontrati a seguito del trattamento con il montelukast, sono stati effettuati degli esperimenti per cercare di caratterizzare i meccanismi d’azione alla base di effetti favorevoli. L’ipotesi più accreditata e che è stata presa in considerazione è stata una modulazione negativa del fattore di trascrizione NF-kB, in quanto precedenti studi avevano messo in evidenza come le microparticelle fossero capaci di attivare tale proteina. Come si può facilmente comprendere dalla
Figura 37, le cellule di controllo non presentano elevati livelli di NF-kB, mentre
la stimolazione overnight con MP incrementa notevolmente il passaggio della proteina dal citosol a nucleo. Non meno evidente risulta essere l’attività inibitoria del montelukast sull’effetto delle microparticelle, in quanto, il pre-trattamento di 2 h con l’antagonista leucotrienico era capace di schermare totalmente le cellule dallo stimolo pro-infiammatorio.
Fig. 37. Misurazione dei livelli di NF-kB e relativa densitometria in cellule di controllo (Ctrl),
Per verificare tale ipotesi, ovvero che gli effetti causati dalle microparticelle (inibizione del rilascio di IL-8 e della desensitizzazione del recettore β2
-adrenergico) fossero correlati alla modulazione del fattore di trascrizione NF-kB, sono state effettuate una serie di prove sperimentali nelle quali è stato impiegato un inibitore di quest’ultimo, il BAY 11-7082. Per quanto riguarda il release di IL-8 delle cellule bronchiali, i dati ottenuti (Figura 3IL-8A) mostrano un’elevata capacità del BAY 11-7082 di riuscire a contrastare gli effetti indotti dalle microparticelle, provocando un decremento nel rilascio della citochina e portandola a valori prossimi a quelli delle cellule di controllo. Invece, per valutare l’azione dell’inibitore dell’NF-kB sulla desensitizzazione, sono stati misurati i livelli di PGE2 liberati dalle cellule della muscolatura liscia bronchiale, dal momento che questa prostaglandina risulta essere capace di indurre la desensibilizzazione del recettore adrenergico (Hu et al., 2008). Come riportato in
Figura 38B, si può facilmente osservare il notevole incremento nel rilascio di
PGE2 (circa 20 volte i valori ottenuti nelle cellule di controllo) a seguito dell’esposizione delle cellule con le microparticelle, e come il trattamento con l’inibitore dell’NF-kB sia in grado di attenuarlo considerevolemente.
Fig. 38. Effetti del trattamento con il BAY 11-7082 in cellule di controllo ed esposte alle MP sul
release di IL-8 (A) e PGE2 (B).
Le considerazioni emerse analizzando complessivamente i dati ottenuti mediante l’utilizzo del BAY 11-7082, hanno permesso di consolidare l’ipotetico meccanismo di azione del montelukast nel riuscire a contrastare l’attività pro-infiammatoria delle microparticelle agendo direttamente sul fattore di trascrizione NF-kB, proteina fortemente coinvolta nel processo infiammatorio, sia per quanto riguarda l’incremento di espressione e di successiva sintesi della citochina IL-8, sia per quanto concerne la ridotta responsibilità del recettoriale a stimoli β2