Capitolo 2:
Applicazioni stazionarie di sistemi a celle a
combustibile
Il perfezionamento della tecnologie delle celle a combustibile ed i buoni risultati ottenuti nei rendimenti, sia in termini assoluti, sia di indipendenza dalla taglia e di costanza al variare del carico, stanno spingendo i programmi di ricerca dei principali Paesi industrializzati nel mondo, compreso quelli dell’Unione Europea, ad approfondire le potenzialità di tali tecnologie anche nelle applicazioni stazionarie per la produzione di energia elettrica.
Le celle a combustibile, se alimentate direttamente ad idrogeno consentono di ottenere buone efficienze con bassissime emissioni di gas nocivi; inoltre, il loro utilizzo in sistemi integrati con lo steam-reformer, con il quale si produce idrogeno da idrocarburi, permette di ottenere vere e proprie unità per la cogenerazione di energia elettrica e calore.
Rientrando per questi motivi nell’ottica degli obiettivi del protocollo di Kyoto, questi sistemi stanno ricevendo un’attenzione sempre maggiore.
2.1 Generalità
La ricerca sui sistemi e le pile a celle a combustibile si è notevolmente intensificata negli ultimi cinquant’anni.
Le celle a combustibile, nate nel 1839 grazie ad un esperimento di William Grove (ritratto nell’immagine di
fianco), che riuscì a generare energia elettrica con una cella contenente acido solforico e nella quale erano stati immersi due elettrodi, costituiti da
sottili fogli di platino, sui quali convergevano rispettivamente idrogeno ed ossigeno, iniziarono a ricevere reale interesse a partire dal 1960, quando la NASA inserì nel programma spaziale “Gemini e la capsula Apollo” le “Bacon cell”, celle alcaline con elettrodi di nichel da 5 kW, inventate dall’Ing. Francis T. Bacon nel 1959.
Da allora la NASA ha intensificato i suoi studi su questo tipo di tecnologie, ritenendo che queste avrebbero consentito di evitare l'uso sui veicoli spaziali di energia nucleare, ritenuta troppo rischiosa, e l’impiego di batterie o energia solare, considerate troppo ingombranti.
Oggi nello Shuttle si produce elettricità tramite le fuel cell e le stesse producono acqua per l'equipaggio.
Sempre alla fine degli anni cinquanta si fa risalire la prima applicazione delle celle all’autotrazione: il primo veicolo ad idrogeno fu un trattore, alimentato con un propulsore a celle da 20CV di potenza, sviluppato dalla "Allis - Chalmers Manufactiong Company". Dall’inizio degli anni novanta, si è assistito ad una vera e propria impennata delle sperimentazioni nell’ambito dell’autotrazione, fenomeno dovuto all’esigenza di liberare le città dalle emissioni di gas nocivi: il maggior vantaggio della mobilità ad idrogeno è proprio quello di relegare le emissioni di inquinanti alla fase di produzione industriale del combustibile (l’idrogeno) e, quindi, di salvaguardare l’ecosistema urbano, pur ottenendo mezzi di trasporto con prestazioni paragonabili a quelle dei propulsori a benzina e gasolio, e con meno problemi di accumulo energetico rispetto alle vetture elettriche; di qui il primo prototipo di bus a celle nel 1993.
Figura 2.1 - Prototipo di 4° generazione (2000) di bus a celle a combustibile della XCELLSIS
Inoltre, dal 1997, anche sotto la spinta di Kyoto, bisogna registrare l’intensificarsi dell’attività di ricerca sulle celle attuata dalle maggiori case automobilistiche al mondo: con questi studi si è riuscito a sviluppare prototipi con un buon livello di prestazioni e quasi commerciabili.
Solo recentemente, però, caratteristiche delle celle, quali ridotte emissioni, indipendenza dell’efficienza dalla taglia dell’impianto, costanza del rendimento al variare del carico, potenziali applicazioni nella cogenerazione, hanno reso interessante questa tecnologia anche per la generazione distribuita di elettricità e calore per utenze residenziali.
2.1 Descrizione di sistemi di generazione a celle a
combustibile
L’esigenza di diminuire le emissioni di gas nocivi, la necessità di ridurre i picchi di potenza sulle reti e il graduale sviluppo della generazione distribuita stanno portando allo sviluppo di diverse tecnologie per impianti di produzione di energia elettrica in piccola taglia: tra questi figurano anche i sistemi a celle a combustibile.
Riguardo a questi ultimi, bisogna distinguere gli impianti funzionanti ad idrogeno puro, da quelli che prevedono in maniera integrata il trattamento ed il processo di estrazione dell’idrogeno dal combustibile fossile di alimentazione: questi impianti hanno il vantaggio di non avere bisogno di strutture di trasporto e di distribuzione dell’idrogeno, per i quali occorrerebbero onerosi investimenti; inoltre, consentono l’ottimizzazione degli scambi termici e si prestano con semplici accorgimenti alla cogenerazione.
A loro volta, gli impianti che prevedono la lavorazione integrata del combustibile vanno distinti tra quelli che la prevedono internamente alla cella e quelli che utilizzano un processo esterno: questo dipende dalle caratteristiche del tipo di fuel cell utilizzato; infatti, mentre vi sono alcune celle, come quelle a carbonati fusi (MCFC) ed a ossidi solidi (SOFC) che, essendo tolleranti alle impurità, consentono il reforming interno del combustibile, ve ne sono altre come quelle ad elettrolita polimerico (PEM, o anche dette PEFC) o ad acido fosforico (PAFC) che necessitano di un reforming esterno quasi perfetto, in quanto per esse risultano velenose anche piccole quantità di monossido di carbonio.
In definitiva, un impianto a celle a combustibile e' composto dal modulo di fuel
elettrochimica) e dalla sezione di condizionamento della potenza, in cui si
trasforma la corrente continua generata dallo stack (pila composta da più celle in serie) in corrente alternata alla tensione e alla frequenza desiderate.
Di seguito si riportano gli schemi generali di entrambe le tipologie di impianto sopra menzionate:
Figura 2.3 - Schema generale di un sistema di generazione a celle a combustibile con trattamento del combustibile esterno
Figura 2.4 - Schema generale di un sistema di generazione a celle a combustibile con reforming interno
Per quanto concerne il grado di sviluppo dei sistemi di generazione a celle a combustibile, bisogna affermare che anche questo dipende dal tipo di fuel cell utilizzato. Ad oggi i sistemi più avanzati sono quelli con celle ad acido fosforico, che hanno raggiunto già un livello praticamente commerciale, come mostrano, ad
Reforming interno + Modulo di potenza Convertitore elettronico di potenza Ossigeno esausti Gas
Calore Acqua
Combustibile Corrente continua Corrente alternata Trattamento del combustibile Modulo di potenza Convertitore elettronico di potenza Ossigeno esausti Gas
Calore Acqua Combustibile Gas ricco di
idrogeno
Corrente
continua Correntealternata
esempio, gli impianti da 200kWe prodotti dalla ONSI, divisione dell’IFC (International Fuel Cells);
invece, gli impianti con fuel cell ad ossidi solidi ed a carbonati fusi, che avrebbero migliori efficienze rispetto agli altri, sono ancora in una fase sperimentale;
i sistemi con celle ad elettrolita polimerico, dopo aver avuto un buon sviluppo nelle applicazioni aerospaziali, nelle quali hanno sostituito le tecnologie basate sulle celle alcaline (AFC), si sono diffusi sia nell’ambito dell’autotrazione, sia in quello della generazione e cogenerazione per utenze residenziali.
Questi ultimi, rispetto ai sistemi con celle ad acido fosforico, risultano avere alcuni importanti vantaggi nelle applicazioni di piccola taglia, proprio grazie alle caratteristiche della cella: una PEM ha una maggiore efficienza di conversione energetica ed una più alta densità di potenza; la membrana, essendo inerte, è più stabile e meno problematica di altri elettroliti; è più veloce nelle fasi di avviamento e spegnimento; è più affidabile e longeva.
2.2 Modulo di potenza elettrochimica: celle a combustibile
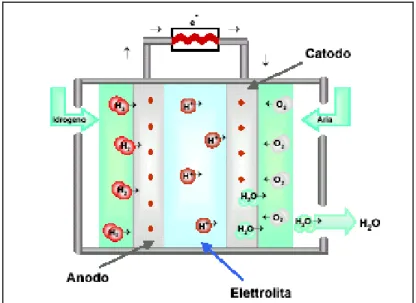
Una cella a combustibile è un generatore elettrochimico in cui si convertedirettamente l’energia liberata dalla reazione chimica tra un combustibile (tipicamente idrogeno) e un ossidante (ossigeno o aria) in energia elettrica e calore [12].
E’ simile ad una batteria e, quindi, come gli altri elementi voltaici, una cella a combustibile e' formata essenzialmente da due elettrodi, catodo ed anodo, su cui avvengono rispettivamente le reazioni di riduzione e di ossidazione, e da un elettrolita che, permettendo la migrazione degli ioni, funge da chiusura del circuito elettrico all’interno della cella.
Diversamente dalle batterie comuni, nella cella a combustibile, la materia attiva viene continuamente rinnovata e quindi la corrente elettrica, ovviamente continua, può essere erogata indefinitamente se si garantisce l'alimentazione del combustibile e dei gas
ossidanti. L’idrogeno e i gas ossidanti (di solito ossigeno o aria) lambiscono rispettivamente l'anodo e il catodo (sulle facce opposte a quelle in contatto con l'elettrolita). Grazie alla porosità degli elettrodi, vengono continuamente alimentate le reazioni di ossidazione del combustibile e di riduzione dei gas ossidanti.
Le celle possono essere pensate come strumenti che attuano l'inverso dell’elettrolisi dell'acqua. Questo risulta evidente analizzando il processo di una cella alimentata con idrogeno puro ed ossigeno:
– all’interno della cella, in corrispondenza dell’anodo gli atomi di idrogeno perdono elettroni (ossidazione) e sotto forma di ioni H+ lasciano l’elettrodo, migrando attraverso l’elettrolita; contemporaneamente gli elettroni persi si muovono lungo l’anodo e si accumulano sull’estremità esterna, pertanto l’anodo assume carica negativa all’esterno (a contatto con il filo metallico) e positiva all’interno ( a contatto con l’elettrolita).
– al catodo le molecole di ossigeno acquistano gli elettroni provenienti dal circuito esterno (riduzione) e lasciano l’elettrodo sottoforma di ioni O2-, per poi ricombinarsi con gli ioni H+ a formare acqua. Pertanto tale elettrodo assume carica positiva all’esterno (a contatto con il filo metallico) e negativa all’interno (a contatto con l’elettrolita).
Il passaggio di corrente avviene, dunque, grazie alla differenza di potenziale fra l’elettrodo negativo (anodo) e l’elettrodo positivo (catodo). L’elettrolita permette, invece, il crearsi di una corrente ionica, ossia consente il passaggio di ioni positivi o negativi prodotti sugli elettrodi impedendo, invece, il passaggio degli elettroni.
A seconda delle reazioni che intervengono, nella cella a combustibile si può avere produzione di acqua all’anodo o al catodo; inoltre, a seconda della filiera tecnologica utilizzata, può essere presente un esausto gassoso (p.e. anidride carbonica o monossido di carbonio).
La differenza in termini di energia fra l’energia termica di reazione (reazione chimica esotermica) e l’energia elettrica prodotta (flusso di elettroni) viene liberata sotto forma di calore alla temperatura operativa della cella.
Questa temperatura, per un funzionamento isotermico della cella, deve essere mantenuta costante; il calore in eccesso viene, quindi, asportato tramite un sistema di raffreddamento e può essere utilizzato per scopi cogenerativi.
Le celle a combustibile a bassa temperatura necessitano della presenza sugli elettrodi di un catalizzatore, ossia di un materiale che favorisca la reazione chimica. Infatti in tali celle, proprio a causa della bassa temperatura, la velocità di reazione risulta essere troppo bassa e occorre quindi aumentarla.
Il catalizzatore, finemente triturato, viene disperso sugli elettrodi realizzati in materiale poroso, in modo da aumentare la superficie utilizzabile dal combustibile e dall’ossidante per reagire.
Da un punto di vista strutturale, una cella ha una conformazione piatta a tre strati, di cui quello centrale, compreso fra il catodo e l'anodo, costituisce o contiene l'elettrolita. Alcuni tipi di celle funzionano in orizzontale, altri in verticale. L’importante è che le superfici delle facce siano tarate in base alle correnti massime di lavoro. Si può così arrivare, in funzione dell'applicazione e della filiera di celle, a superfici dell'ordine dei decimetri quadrati.
Le singole celle (caratterizzate da tensioni comprese tra mezzo volt e un volt circa) vengono sovrapposte una all'altra,
collegandole in serie in modo da ricavare una tensione complessiva del valore desiderato: si forma, così, il cosiddetto stack (o "pila"), che rappresenta la base della sezione elettrochimica.
2.3.1 Classificazione delle celle a combustibile
Esistono diversi tipi di classificazione per le celle a combustibile, a seconda di quale caratteristica si voglia analizzare.
Tra le classificazioni più diffuse vi sono quella basata sulla temperatura di funzionamento e quella fondata sul tipo di elettrolita usato.
Per quanto riguarda la temperatura di funzionamento, le celle si dividono in bassa (25-100 °C), media (100-500 °C), alta (500-1000 °C) e altissima (oltre 1000 °C) temperatura: le celle a combustibile a bassa e media temperatura (AFC, PEM, PAFC) presentano minori problemi tecnologici, permettono l'uso di materiali strutturali non particolarmente pregiati (sono, però, richiesti catalizzatori a base di metalli nobili) e hanno rendimenti che possono arrivare fino al 40%-50%; solo le celle alcaline raggiungono quasi il 60%.
Le celle a combustibile ad alta temperatura (MCFC, SOFC) presentano maggiori difficoltà tecnologiche, ma hanno maggiore flessibilità rispetto al combustibile e possono raggiungere rendimenti più elevati; inoltre, l'alta temperatura del calore residuo consente l'integrazione in cicli di tipo combinato, permettendo di arrivare a rendimenti complessivi del 60-65 %.
Invece, riguardo alla classificazione per elettrolita si hanno: elettroliti polimerici (PEFC), alcalini (AFC), ad acido fosforico (PAFC), a carbonati fusi (MCFC), ad ossidi solidi (SOFC).
Nella tabella seguente viene riportata una schematizzazione dei vari tipi di celle con le loro caratteristiche principali.
Tabella 2.1 - classificazione delle celle a combustibile e loro principali caratteristiche [13] Infine, è molto importante sottolineare che le AFC, le PEFC, le PAFC, a causa della loro intolleranza al monossido di carbonio necessitano il trattamento esterno del combustibile.
2.3.2 Celle a combustibile ad elettrolita polimerico
Le PEFC dalla metà degli anni ottanta sono oggetto di crescente attenzione per applicazioni nella trazione elettrica, ma ultimamente si stanno diffondendo anche nell’ambito della generazione e cogenerazione distribuita presso utenze residenziali: gli impianti, come quelli analizzati in questa tesi ne sono un esempio.
Le celle PEFC (polymer electrolyte fuel cell), più conosciute come celle con membrana polimerica a scambio protonico (PEM: proton exchange membrane), sono classificabili come celle a bassa temperatura (80°C). Il cuore di queste celle è la membrana ad elettrolita polimerico, che le distingue e le caratterizza rispetto alle altre famiglie di celle a combustibile.
Gli elettrodi sono costituiti di carbone cosparso di materiale catalitico, generalmente platino, necessario ad aumentare le velocità delle reazioni, penalizzate dalla bassa temperatura di funzionamento. Proprio il catalizzatore è il componente della cella più intollerante alle impurità legate all’idrogeno di alimentazione: anche piccole quantità di monossido di carbonio risulterebbero velenose; per questo, necessitano o di alimentazione diretta ad idrogeno, o di una sezione di trattamento del combustibile in ingresso.
Nelle PEFC il combustibile e l’ossidante sono idrogeno ed ossigeno; questi, come visto nei precedenti paragrafi, pervengono agli elettrodi allo stato gassoso, secondo due circuiti separati.
Quando l’idrogeno viene a contatto con il catalizzatore (il platino) presente sull’anodo si ionizza in due ioni H+, in questo processo si ha il rilascio di elettroni secondo la reazione : − ++ → H e H 4 4 2 2
La membrana scambiatrice permette il "passaggio" degli ioni H+ e lo impedisce invece agli elettroni. I protoni si spostano quindi attraverso la membrana verso il catodo.
Contemporaneamente l’ossigeno viene portato al catodo, dove si ricombina con gli elettroni provenienti dal circuito esterno e gli ioni idrogeno che sono transitati attraverso la membrana.
Si ha, quindi, la seguente reazione:
O H e
H
O2+4 ++4 − →2 2
Il processo chimico complessivo risulta:
( ) ( ) 2 ( ) 2, 2, 1 2 g g l H + O →H O
L’acqua prodotta viene espulsa al catodo insieme all’eccesso di aria.
La gestione dell’acqua, tuttavia, è un problema di non facile soluzione in una cella PEFC. La membrana deve sempre rimanere umida per consentire una buona conduttività ionica, infatti una disidratazione della membrana ne provocherebbe il distacco dagli elettrodi. Inoltre, per questo stesso motivo la temperatura di funzionamento deve essere tenuta costante intorno agli 80°C attraverso un sistema di raffreddamento.
Nei prossimi paragrafi si approfondiranno alcuni aspetti costruttivi delle PEFC e le loro caratteristiche termodinamiche ed elettrochimiche.
2.3.3.a Elettrolita
Normalmente un elettrolita non è altro che una sostanza che si dissocia in ioni positivi e negativi in presenza di acqua, permettendo inoltre che la soluzione conduca elettricità. Nelle PEM fuel cell l'elettrolita è un polimero, che è chiamato più comunemente membrana.
L’aspetto della membrana varia a seconda del tipo considerato, ma la più diffusa è il NafionTM, prodotto dalla DuPont.
Il NafionTM ha uno spessore che va dai 50 ai 175 micron (un foglio di carta ha lo
spessore di 50 micron). Poiché la membrana deve essere mantenuta umida, alla fine assume un aspetto simile a quello di una pellicola di plastica bagnata.
Le caratteristiche della membrana polimerica sono le seguenti:
- assorbe facilmente l'acqua, e soltanto gli ioni positivi si possono muovere, mentre quelli negativi sono saldamente legati alla struttura;
- avendo una struttura che si basa sul Teflon, è relativamente stabile;
- nonostante sia molto sottile, non permette il passaggio dei gas, mantenendo ossigeno e idrogeno separati tra loro. Questo è fondamentale per l'efficienza delle operazioni;
- la membrana è conduttrice di ioni, ma non di elettroni, in questo modo essi sono obbligati a passare per un circuito esterno, generando una corrente.
Quest’ultima caratteristica può essere spiegata analizzando la struttura chimica della molecola del NafionTM.
In essa vi sono tre regioni caratteristiche:
1-Un sequenza di molecole di -CF2-CF-CF2 legate tra loro, come nel TeflonTM.
2-Una catena -O-CF2-CF-O-CF2-CF2, che collega le due regioni.
3-Un gruppo di ioni SO3-H+.
Gli ioni SO3- sono permanentemente attaccati alla struttura e
non si possono spostare, ma consentono agli ioni H+ di potersi spostare all'interno della membrana quando questa viene idratata. Grazie a questo meccanismo la membrana risulta essere un’ottima conduttrice di ioni idrogeno, che migrano all’interno della pila dall’anodo verso il catodo in un’unica direzione, senza tuttavia permettere il passaggio di elettroni. Non va dimenticato che, oltre i 100°C, nascono problemi dovuti alla disidratazione della membrana, per cui è necessario lavorare a diverse condizioni di pressione. Una soluzione a questo problema può essere quello di raffreddare la cella.
2.3.3.b Elettrodi
I processi fisici ed elettrochimici che avvengono sugli elettrodi sono molto complessi.
Le reazioni che hanno luogo, riduzione dell’ossigeno e ossidazione dell’idrogeno, avvengono, nel caso di basse temperature (in questo caso circa 80°C), a velocità ridotte, per cui è necessario aumentarle con l’ausilio di catalizzatori come il platino: il fenomeno che principalmente rallenta la reazione è la riduzione dell'ossigeno al
catodo derivante da temperature così basse e, quindi, solo grazie al platino si catalizza l'acquisto degli elettroni,
Il catalizzatore prende parte alla trasformazione chimica combinandosi con i reagenti e dando origine a complessi intermedi che successivamente si decompongono formando prodotti di reazione e restituendo il catalizzatore inalterato.
Per esempio, all’anodo, l’idrogeno gassoso (H2) si lega al platino formando un complesso attivato caratterizzato da legami atomici abbastanza deboli, tali da
consentire una più facile dissociazione in ioni idrogeno ed elettroni. Le reazioni che intercorrono sono: H Pt Pt H2 +2 →2 − − + + + → −H Pt H e Pt 2 2 2 2
In pratica il platino agisce riducendo l’energia di attivazione necessaria alla reazione di dissociazione dell’idrogeno. Discorsi analoghi possono essere fatti per l’ossigeno. Il ruolo del platino è
fondamentale ma, essendo molto costoso, si
è cercato di aumentare il più possibile la superficie di adsorbimento. Uno degli espedienti affinato col tempo è stato quello di aumentare la superficie di contatto fra idrogeno e
catalizzatore costruendo elettrodi di carbone porosi cosparsi di una piccola quantità di platino (0.2-0.4 mg /cm2): la struttura porosa permette la diffusione del gas dentro l'elettrodo; nonostante la massa del platino sia stata ridotta, l'idrogeno può comunque venire assorbito da una superficie molto grande, diminuendo così i costi: basti pensare che nelle prime fuel cell sviluppate dalla NASA negli anni '60 venivano usati 4 mg di platino per cm2, mentre oggi si è arrivati sotto i 0,5 mg/cm2.
2.3.3.c Assemblaggio stack
La differenza di potenziale che si raccoglie ai capi di una PEM è di 0.7-0.8 Volt, con correnti comprese fra 300 e 800 mA/cm2; in genere,
però, si richiedono voltaggi superiori, per cui le celle vengono montate in serie, tramite dei piatti bipolari, in modo a formare delle pile o ‘stack’.
Inoltre, più pile possono essere assemblate per ottenere generatori della taglia desiderata.
Il complesso membrana-elettrodi, però, non è sufficiente, da solo, ad assicurare il funzionamento ottimale del sistema: occorrono degli elementi ausiliari che rendano possibile la distribuzione di
combustibile e comburente, nonché l’evacuazione della corrente prodotta.
A tale scopo vengono utilizzate le piastre bipolari che, mentre da un lato servono da collettori dei gas (idrogeno e ossigeno-aria) agli elettrodi, dall’altra sono conduttori elettrici e quindi consentono agli elettroni prodotti all’anodo di fluire attraverso il circuito esterno e di rientrare nella pila dalla parte del catodo.
A questo punto la pila è completa; un insieme di elementi così costituiti vengono assemblati in serie ed agli estremi vengono poste due piastre terminali che vengono poi connesse al circuito esterno.
2.3.3.d Termodinamica delle celle ad elettrolita polimerico
Una cella a combustibile ad elettrolita polimerico si basa, come tutte le Fuel Cell, sul fenomeno chimico dell’ossidoriduzione.
Una reazione di ossido-riduzione spontanea si realizza attraverso il passaggio di elettroni da una specie chimica all’altra; se questi elettroni, anziché trasferirsi
direttamente alla specie che viene ridotta, sono costretti ad attraversare un conduttore metallico esterno, allora produrranno una corrente elettrica.
In tal modo la variazione di energia associata alla reazione chimica, cioè la variazione di energia tra lo stato iniziale dei reagenti (idrogeno e ossigeno gassosi) e quello finale (acqua), viene trasformata in elettricità.
Per valutare l’entità di tale energia e quindi il lavoro ottenibile, si prende in considerazione l’energia libera di Gibbs [14,15].
Tramite la cella si trasforma la variazione di energia libera (negativa se la reazione è spontanea) in lavoro elettrico. Quindi:
G nFE
Lut = rev=−∆ ,
dove: n è il numero di moli equivalenti di elettroni coinvolti nella reazione globale (il numero di moli di elettroni per moli di idrogeno nelle PEM è, quindi, 2), F è la costante di Faraday (96.487 C/moli), Erev è la f.e.m. e ∆G è la variazione di energia
libera. Ricordando che: S T H G=∆ − ∆ ∆ .
Alla pressione di una atmosfera e con concentrazioni unitarie dei reagenti, per una PEM alimentata ad idrogeno e ossigeno che produce acqua in forma liquida, imponendo la condizione di reversibilità, otteniamo:
(
)
mol J molK J K mol J S T H G 285800 298 163.2 =−237200 − ⋅ − − = ∆ − ∆ = ∆ . Quindi: V mol C mol J Erev 1.229 96487 2 237200 = ⋅ − − = .La Erev (in seguito Eo) così calcolata rappresentala tensione massima ottenibile dalla
cella, tuttavia questa è solo un valore teorico, valido quando non si ha alcun carico, ossia per una corrente nulla.
Quando è presente una circolazione di corrente insorgono dei fenomeni di polarizzazione, che inducono un aumento del calore prodotto, determinando delle perdite e, conseguentemente, una diminuzione dell’energia elettrica ottenibile.
Inoltre, quando le concentrazioni e le pressioni non sono quelle standard, la Erev si
modifica secondo la legge di Nernst:
[ ] [ ]
⋅ ⋅ − = 2 2 1 ln 2 F H O RT E E oGli effetti della temperatura e della pressione, invece, possono essere analizzati considerando la variazione dell’energia libera di Gibbs al variare dei medesimi parametri: F n S T E P ∆ = ∂ ∂ e F n V P E T ∆ − = ∂ ∂
dove n è sempre il numero di moli equivalenti di elettroni coinvolti nella reazione globale (2 nelle PEM ad idrogeno ed ossigeno) e V il volume.
Poiché l’entropia nella reazione fra idrogeno ed ossigeno è negativa, il potenziale reversibile di cella decresce all’aumentare di temperatura di circa 0.84 mV/°C (considerando come prodotto l’acqua liquida).
Per la stessa reazione la variazione di volume è negativa, quindi un aumento di pressione comporta un aumento del potenziale reversibile di cella.
Un aumento di temperatura migliora pertanto la performance della cella poiché ne aumenta la velocità di reazione, riduce la polarizzazione ohmica migliorando la conducibilità dell’elettrolita, accresce i fenomeni di trasporto e la tolleranza alle impurità.
L’alta temperatura tuttavia causa problemi di corrosione, di degradazione degli elettrodi e perdite nell’elettrolita dovute all’evaporazione.
Anche un aumento di pressione ha effetti positivi, poiché aumenta i fenomeni di trasporto, la solubilità dei gas nell’elettrolita ed, inoltre, riduce le perdite nell’elettrolita dovute all’evaporazione.
Tuttavia, l’alta pressione crea problemi ai materiali costituenti la cella, che richiedono un maggiore controllo sulle pressioni differenziali.
Attraverso le leggi di Faraday, che asseriscono che la massa di una sostanza prodotta o consumata ad un elettrodo è proporzionale alla quantità di carica elettrica che ha
attraversato la cella, e che masse equivalenti di sostanze diverse vengono prodotte o consumate ad un elettrodo dal passaggio di una quantità definita di carica elettrica attraverso la cella, si può ricavare facilmente la relazione che lega la corrente alla quantità di idrogeno consumata:
⋅ = = mol C F s C A I s mol FH 2 2 ,
dove F è la portata molare di idrogeno, I la corrente, F la costante di Faraday H2
(96.487 C/mol), mentre il 2 al denominatore del secondo membro è dovuto al fatto che nella reazione di riduzione da ogni mole di idrogeno se ne sviluppano 2 di elettroni.
2.3.3.e Caratteristica elettrica di una PEM
Nel paragrafo precedente si è visto che la Erev è solo un valore teorico, in quanto ogni
cella si caratterizza, a seconda della propria composizione e struttura, di determinati andamenti della tensione in funzione della densità di corrente.
Le cadute di tensione in una PEMFC sono dovute ai seguenti fenomeni:
1. cinetica interfacciale catodica limitata, che determina alte cadute di tensione prevalentemente nelle regioni a bassa densità di corrente, sia con catodo ad aria che ad ossigeno;
2. conduttività protonica limitata nello strato catalizzatore e nella membrana
elettrolitica; nel caso di catodo ad ossigeno le cadute ohmiche all’interno della membrana costituiscono la maggior frazione di cadute misurate nel range di correnti di interesse;
3. cinetica interfacciale anodica, che determina una caduta di tensione lineare con la densità di corrente a causa dell’elevato scambio di densità di corrente per l’elettro-ossidazione dell’idrogeno; tuttavia, queste cadute risultano molto piccole se confrontate con le altre;
4. trasporto di massa catodico limitato, particolarmente nel caso di catodo ad aria, che determina una rapida diminuzione della tensione di cella con la densità di corrente; questa limitazione di diffusione porta a effetti pseudo resistivi per moderate densità di corrente e l’apparizione di correnti limite per alte densità di corrente;
5. “inondazione” catodica, quando l’acqua prodotta dalla reazione catodica non è
rimossa efficacemente dalla cella; conseguentemente l’eccesso di acqua liquida porta ad uno scarso trasporto di ossigeno attraverso l’elettrodo; questo fenomeno, con celle ottimizzate, avviene tipicamente in catodi ad ossigeno per densità di corrente molto elevate, che non possono essere raggiunte se il catodo è alimentato ad aria.
Si evince immediatamente che le cadute maggiori sono dovute a fenomeni legati al catodo o alla membrana, anche se quest’ultima nelle versioni più sviluppate, risultando più sottile, garantisce resistenze non elevate neanche ad alte densità di corrente [17].
La cinetica del catodo è ben descritta dall’equazione di Buthler-Volmer, che mostra, sotto l’ipotesi di trascurabilità delle perdite anodiche, come la corrente della reazione elettrochimica, oltre che dalla concentrazione dei reagenti, dipende dalla differenza di potenziale tra catalizzatore ed elettrolita:
1 1 1 b o r o o H p j j A e p H η + Γ + = ⋅ ⋅ ⋅ ⋅ − oC ce o cella ohm E E V R j η = − ∆φ = − − ⋅
dove jR è la corrente di reazione, jo la corrente di scambio, Ar la superficie effettiva
di platino per unità di superficie geometrica, p1 la pressione parziale dell’ossigeno,
p1o la pressione parziale dell’ossigeno in assenza di corrente, [H+]o la concentrazione
protonica a vuoto, [H+] la concentrazione protonica, η la sovratensione catodica, b la pendenza di Tafel, EoC il potenziale catodico, ∆φce la differenza di potenziale
catalizzatore-elettrolita, Eo la tensione a circuito aperto, Vcella la tensione di
funzionamento della cella, Rohm la resistenza ohmica interna, j densità di corrente
di cella.
Più in generale, si può affermare che in una cella PEM vi sono tre diversi fenomeni di polarizzazione:
Polarizzazione di attivazione: affinché una reazione abbia luogo, occorre che essa superi una soglia energetica chiamata energia di attivazione. Questa polarizzazione rappresenta il potenziale da superare affinché le reazioni abbiano luogo alla velocità voluta.
Quindi tale polarizzazione è legata alla velocità delle reazioni chimiche. Nel caso di reazioni elettrochimiche:
mV
act =50÷100
η .
La sua valutazione è ottenibile tramite l’equazione di Tafel:
i i F n RT o act α ln η = ,
dove α è il coefficiente di trasferimento di carica e i è la densità di corrente 0
di scambio.
Polarizzazione ohmica: questo tipo di polarizzazione rappresenta la caduta di tensione dovuta alle perdite ohmiche. Tali perdite sono dovute alla resistenza opposta al flusso degli elettroni dal materiale degli elettrodi e al flusso degli ioni dall’elettrolita.
Poiché le maggiori perdite si hanno a causa della resistenza dell’elettrolita, esse possono essere ridotte avvicinando i due elettrodi, ossia riducendo lo spessore dell’elettrolita.
Le perdite per polarizzazione ohmica possono essere espresse dalla seguente equazione:
R i
ohm=
η ,
dove i è la corrente che scorre attraverso la cella, e R è la resistenza totale della cella.
Polarizzazione di concentrazione: questo tipo di polarizzazione è legata ai fenomeni di trasporto di massa che inibiscono la reazione agli elettrodi, ossia si manifestano quando la velocità di alimentazione dei reagenti e/o la velocità di rimozione dei prodotti di reazione è più bassa di quella corrispondente alla densità di corrente i a cui sta funzionando la cella. La polarizzazione di concentrazione è espressa dall’equazione:
− = L conc i i F n RT 1 ln η ,
dove iL è la corrente limite che si raggiunge quando i gas di alimentazione hanno una concentrazione troppo bassa dei reagenti.
Le polarizzazioni sopra indicate possono interessare sia l’anodo che il catodo quindi, poiché le polarizzazioni agiscono sempre nel senso di aumentare il potenziale dell’elettrodo dove avviene la reazione di ossidazione (anodo) e di abbassare il potenziale dell’elettrodo dove avviene la reazione di riduzione (catodo), si ottiene:
anodo anodo anodo E V = +η e catodo catodo catodo E V = −η ,
doveηanodo e ηcatodo rappresentano la somma delle polarizzazioni di concentrazione ed attivazione agenti rispettivamente su anodo e catodo.
Il potenziale di cella può quindi essere espresso: .
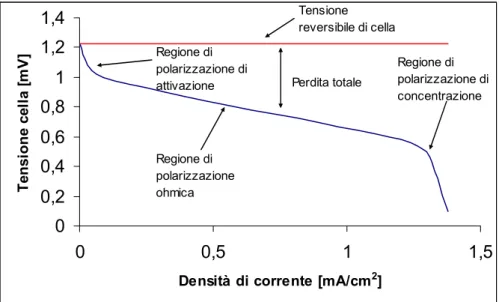
Si osserva perciò un allontanamento dalla condizione ideale di funzionamento, come si può anche osservare dal grafico seguente. In tale figura è, inoltre, riportata una tipica curva tensione-densità di corrente, nella quale sono indicate le zone ove i vari tipi di polarizzazione sono preminenti.
0 0,2 0,4 0,6 0,8 1 1,2 1,4 0 0,5 1 1,5
Densità di corrente [mA/cm2]
Te ns ione c el la [ m V ] Regione di polarizzazione ohmica Perdita totale Regione di polarizzazione di concentrazione Regione di polarizzazione di attivazione Tensione reversibile di cella
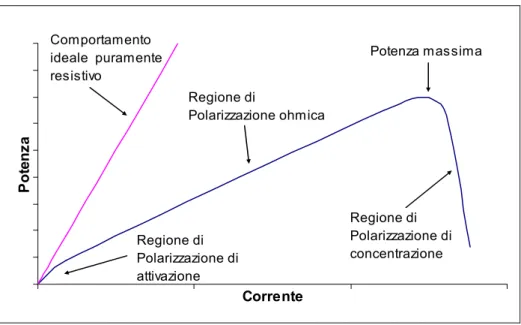
Figura 2.6 – Curva caratteristica tensione/densità di corrente in una cella a combustibile PEM In base alla curva tensione corrente è possibile ricavare il valore della potenza elettrica, come mostrato nella figura seguente. Tuttavia con tali sistemi solitamente si lavora nella parte centrale della caratteristica tensione- corrente, ossia nella parte in
act ohm conc anodo catodo cella V V R i E V = − − ⋅ = −η −η −η
cui la cella ha un comportamento di tipo resistivo (lineare). Sostituendo alla tensione
Er, il suo valore approssimato avremo:
I R E
E = r − ⋅ .
La potenza elettrica disponibile sarà data da: 2 I R I E Pelettrica = r ⋅ − ⋅ .
Da questa si possono calcolare sia il valore della potenza massima, sia le condizioni di tensione e corrente per le quali questa si ottiene:
R E P r MAX elettrica 4 2 , = , con R E I r 2 = e 2 r E E= .
In pratica, la massima potenza si ha per un valore di tensione pari alla metà della tensione a vuoto. Corrente Po te n za Potenza massima Regione di Polarizzazione ohmica Regione di Polarizzazione di attivazione Regione di Polarizzazione di concentrazione Comportamento ideale puramente resistivo
Figura 2.7 - Andamento della potenza in una cella a combustibile PEM
Anche il rendimento elettrochimico risente del fatto che la cella a carico presenta una minore d.d.p., dovuta ai fenomeni di polarizzazione che aumentano con il crescere della corrente.
Il rendimento elettrochimico, anche detto di tensione, definito come il rapporto fra la tensione a vuoto e quella a carico, è:
rev V E V = η .
Il rendimento complessivo di una PEM e, più in generale, di tutte le Fuel Cell è dato dal rapporto fra l’energia elettrica in uscita e l’energia sprigionata dalla reazione chimica: questo implica che in esso sono contenuti i contributi dovuti al rendimento termodinamico, a quello di tensione, sopra menzionato, ed a quello di utilizzo del combustibile: C V T cella η η η η = ⋅ ⋅ .
Il rendimento termodinamico è dato, nell’ipotesi di trasformare tutta l’energia elettrochimica in energia elettrica, dal rapporto fra la variazione di energia libera e la variazione di entalpia: H G T ∆ ∆ = η .
Il valore di questo rendimento dipende dalle reazioni che intervengono all’interno della cella, nonché dalla temperatura considerata; nel caso ideale in cui idrogeno puro reagisca con ossigeno puro in condizioni standard (25 °C, 1 atm), si ha un rendimento dell’83 %. Questo valore diminuisce in seguito ad un aumento di temperatura, attestandosi attorno al 78 % a 100 °C: ciò è dovuto all’aumento di entropia.
Il coefficiente di utilizzo del combustibile rappresenta il rapporto fra la quantità totale dei reagenti introdotti nel sistema e quella dei prodotti della reazione. In pratica, esso risulta essere il rapporto fra la corrente che la cella realmente eroga (Icons) e la corrente che essa erogherebbe se ci fosse una conversione elettrochimica
completa, (Im). Quindi: m cons c I I = η ,
F dt dn F dt dn I e H m ⋅ ⋅ = ⋅ = 2 2
in cui ne è il numero di moli equivalenti di elettroni coinvolti nella reazione globale,
2
H
n è il numero di moli di idrogeno di alimentazione, I la corrente, F la costante di
Faraday (96.487 C/mol). I sarà: F dt dn F dt dn I cons H cons e ⋅ ⋅ = ⋅ = 2 2
2.3.4 Modulo di trattamento del combustibile
La sezione di conversione del combustibile primario, indicata comunemente con l’accezione inglese Fuel Processing, ha lo scopo di convertire un combustibile (liquido, gassoso o solido) commercialmente disponibile, in un gas adatto per il funzionamento delle celle. Nei paragrafi precedenti si è potuto constatare che le celle necessitano di essere alimentate con gas ricchi di idrogeno e che, a seconda della filiera tecnologica prescelta, occorre in alcuni casi, come nei sistemi PEFC, una notevole purezza dell’idrogeno in ingresso alla cella. Questo comporta due alternative: o un’alimentazione diretta ad idrogeno, prodotto con processi industriali (vedere Appendice B), o l’utilizzo di una sezione di conversione del combustibile che, partendo da combustibili di facile approvvigionamento e capillare distribuzione sul territorio nazionale, come per esempio il metano, permetta la produzione di idrogeno direttamente nell’impianto. Quest’ultima soluzione ha il vantaggio di non avere bisogno di strutture di stoccaggio, trasporto e di distribuzione dell’idrogeno, per i quali occorrerebbero onerosi investimenti; inoltre, consente l’ottimizzazione degli scambi termici e si presta con semplici accorgimenti alla cogenerazione.
Le proprietà richieste ai sistemi di conversione del combustibile sono: alta efficienza termica, elevata produzione di idrogeno (oppure idrogeno e CO, ad esempio nelle SOFC), compattezza, leggerezza e tempi di risposta rapidi (nel caso delle applicazioni stazionarie queste ultime caratteristiche hanno un’importanza minore, mentre sono fondamentali per gli impieghi negli autoveicoli).
Nel caso di celle ad ossidi solidi (SOFC) ed a carbonati fusi (MCFC) non sono richieste unità di conversione e rimozione del monossido di carbonio e la fase di reforming del combustibile può avvenire anche internamente alla cella.
Per le PAFC, invece, sono normalmente sufficienti le unità di conversione del CO e non è richiesta quella di rimozione catalitica selettiva di CO. Le PEFC, infine, necessitano di tutte le unità a causa della loro bassissima tolleranza al monossido di carbonio.
In generale, la configurazione dell’unità di conversione del combustibile è strettamente legata al combustibile in ingresso, tuttavia sono in corso ricerche finalizzate alla produzione di sistemi flessibili, in grado di convertire combustibili diversi. Ulteriori attività di ricerca e sviluppo di sistemi di fuel processing sono volte al raggiungimento di migliori caratteristiche del gas in uscita, alla capacità di convertire gli idrocarburi liquidi pesanti ed alla riduzione delle dimensioni e del peso dei dispositivi.
Di seguito si riportano le tipiche fasi che s’incontrano nella conversione di combustibili idrocarburici (cioè formati di idrogeno e carbonio, come il metano) per sistemi PEFC, che sono le celle che richiedono il processo più lungo:
1. Lavaggio del combustibile grezzo:
rimozione dei solfuri, alogenuri e ammoniaca per prevenire l’avvelenamento dei catalizzatori presenti nel fuel processor e nella cella.
2. Conversione del combustibile grezzo:
conversione dell’idrocarburo in un gas ricco di idrogeno attraverso processi come ad esempio lo steam reforming, l’ossidazione parziale (POX), l’autothermal reforming, ecc.
3. Condizionamento del gas riformato:
– conversione del CO e dell’acqua presenti nel gas riformato in idrogeno ed anidride carbonica, per mezzo della reazione di sostituzione gas – acqua (reazione di shifting, solitamente a due stadu);
– ossidazione selettiva per ridurre il monossido di carbonio a pochi ppm; – rimozione dell’acqua per condensazione.
Nella figura seguente sono riportate le fasi principali della sezione di conversione del gas naturale di un sistema cogenerativo con celle ad elettrolita polimerico (PEM) alimentato a metano; lo stesso sarà oggetto dei prossimi paragrafi.
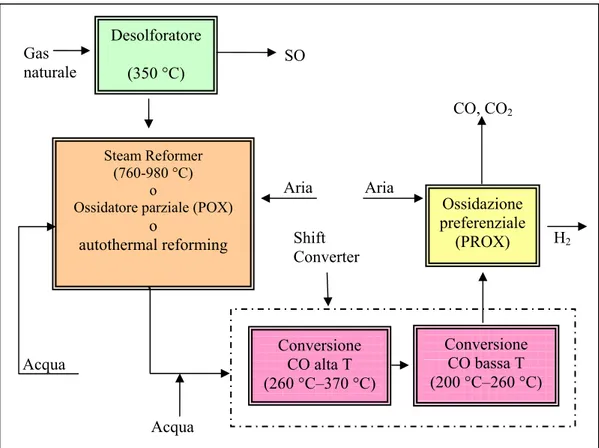
Figura 2.8 - Unità di fuel processing gas naturale: fasi principali e tipiche temperature di funzionamento
2.3.5 Tecnologie di conversione del gas naturale
Il presente paragrafo è dedicato all’approfondimento dei processi di conversione del combustibile necessari per alimentare sistemi basati su celle PEM con gas naturale che, come anticipato precedentemente necessitano della versione più completa di fuel processing: lavaggio e conversione del combustibile, rimozione del monossido di carbonio.
2.3.5.a Lavaggio del gas naturale
Il gas naturale contiene odoranti a base di solfuri, allo scopo di identificare facilmente eventuali perdite. Tali solfuri sono un veleno per alcuni materiali interni alle celle a combustibile e devono essere rimossi utilizzando sistemi di pretrattamento con letti catalitici ad ossido di zinco e, se necessario, idrodesulforizzatori. Infatti, gli ossidi di zinco sono capaci di rimuovere il mercaptano e i disolfuri, ma per la rimozione di alcuni odoranti commerciali è necessaria la presenza dell’idrodesulforizzatore, che permette di convertirli tutti in acido solfidrico (H2S), prima del letto catalitico.
L’idrogeno richiesto per il funzionamento di questo sistema è ottenuto facendo ricircolare una piccola quantità di combustibile già riformato.
H2
Steam Reformer (760-980 °C)
o
Ossidatore parziale (POX)
o autothermal reforming CO, CO2 Acqua Conversione CO alta T (260 °C–370 °C) Desolforatore (350 °C) SO Gas naturale Ossidazione preferenziale (PROX) Conversione CO bassa T (200 °C–260 °C) Shift Converter Acqua Aria Aria
Il corretto funzionamento del reattore ad ossidi di zinco si ottiene a temperature comprese tra 350 e 400°C.
2.3.5.b Conversione del gas naturale
Le principali tecniche di conversione del gas naturale in idrogeno e monossido di carbonio utilizzate in impianti a fuel cell per applicazioni stazionarie per usi residenziali sono essenzialmente tre: lo Steam Reforming, l’Ossidazione Parziale (POX) e l’Autothermal Reforming.
2.3.5.c Steam Reforming
Il processo di steam reforming (SR) è il più utilizzato per ottenere idrogeno da un idrocarburo: basti pensare che con il reforming industriale del metano attualmente viene prodotto il 48% del fabbisogno mondiale di idrogeno, circa 240 miliardi di metri cubi all’anno (vedere Appendice B).
Anche negli impianti a fuel cell per applicazioni stazionarie per utenze residenziali, la conversione del gas naturale in H2 e CO è ottenuta nella maggior parte dei casi con
un piccolo “steam reforming reactor”. Questo dispositivo può essere usato anche con altri idrocarburi leggeri, come propano o butano e con la nafta. In quest’ultimo caso è necessario l’uso di appositi catalizzatori.
Il processo di steam reforming è, tra i processi per la conversione del metano, quello che consente di ottenere le percentuali più alte di idrogeno nel combustibile riformato.
La reazione principale che ha luogo per il metano è la seguente:
2 2
4 H O CO 3H
CH + = +
che, nel caso di conversione di idrocarburi leggeri, diventa:
2 2 2 3 m n H nCO O nH H Cn m + + = +
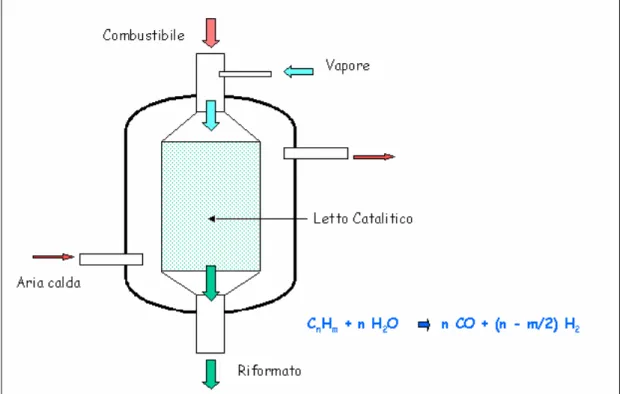
Figura 2.9 - Schema tipico di reformer di piccola taglia La reazione di steam reforming è altamente endotermica (
mol kJ H298.15 =206.1
∆ ) ed il
relativo equilibrio è fortemente spostato verso sinistra a bassa temperatura ( mol kJ G298.15 =142.3 ∆ e 25 15 . 298 10 − ≈
K ); per questi motivi il reforming del metano viene condotto a temperature comprese tra i 750 e i 1000°C (ai quali corrispondono coefficienti di conversione del gas di circa il 95%) ed in presenza di catalizzatori, solitamente sali di nichel supportati da ossido di alluminio (come ad esempio Ni/MgAl2O4). Il calore necessario alla reazione può essere ottenuto mediante la
combustione di metano miscelato all’idrogeno residuo in uscita alla cella a combustibile. L’efficienza di conversione, quindi, dipende fortemente dalle dispersioni termiche del sistema stesso.
Più nello specifico, gli step principali del processo sono i seguenti:
– Il gas naturale viene compresso a pressioni di qualche atmosfera adatte al funzionamento dello stack di fuel cell (efficienza isoentropica di circa 0.7).
– Una volta compresso, il metano viene miscelato al vapore d’acqua, l’altro reagente della reazione di reforming: questo deve essere in notevole eccesso rispetto al gas naturale, in quanto bassi rapporti vapore-metano causerebbero la formazione di carbonio durante il reforming; l’eccesso di vapore, inoltre,
consente alla miscela di raggiungere un buon livello di temperatura prima dell’ingresso nel reattore, favorendone la reazione.
– La miscela vapore-metano reagisce nel reattore grazie al calore fornitogli dall’esterno ed al contributo dei catalizzatori che aumentano sensibilmente la velocità di conversione: le reazioni che potrebbero avere luogo tra i reagenti coinvolti nel processo di steam reforming sono oltre 11, come da tabella seguente:
Reazioni
∆H298,15molkJ CH4+H2O↔CO+3H2 206,1 CO+H2O↔CO2+H2 -41,15 CH4+2H2O↔CO2+4H2 165,0 CH4+CO2↔2CO+2H2 247,3 CH4+3CO2↔4CO+2H2O 330,0 CH4↔C+2H2 74,8 2CO↔C+CO2 -173,3 CO+H2↔C+2H2O -131,3 CO2+2H2↔C+2H2O -90,13 CH4+2CO↔3C+2H2O -187,6 CH4+CO2↔2C+2H2O -15,3Tabella 2.2 - Possibili reazioni nel reattore di steam reforming di metano [18]
Proprio per minimizzare la formazione di carbonio, si fa in modo che il rapporto vapore-metano sia superiore almeno a 2; in questa maniera le reazioni predominanti rimangono:
CH4+H2O↔CO+3H2
e
CO+H2O↔CO2+H2 .
Grazie agli effetti del catalizzatore, però, possiamo considerare che la reazione che caratterizza principalmente il processo di steam reforming è:
L’efficienza di conversione energetica totale del processo è circa il 65%: l'enorme quantità d'energia richiesta per il funzionamento degli impianti incide molto su tale valore.
2.3.5.d Ossidazione parziale
I combustibili gassosi possono essere convertiti in H2 e CO anche attraverso la loro
ossidazione parziale (POX), anche se la percentuale di idrogeno ottenuta è inferiore a quella ottenuta con lo steam reforming (nel caso del metano come combustibile di partenza, l’idrogeno ottenuto è inferiore del 33% se non si considera la fase di abbattimento del CO e, del 25% se la si considera); tuttavia questo tipo di conversione ha tempi di avviamento più bassi, quindi maggiore capacità di rispondere in tempi brevi a variazioni di carico ed, inoltre, permette di utilizzare un numero maggiore di combustibili. Per questo, l’ossidazione parziale è normalmente utilizzata per combustibili liquidi, che non sono adatti allo steam reforming.
Nell’ossidazione parziale il combustibile dopo essere stato vaporizzato, è inviato nel reattore di POX nel quale il combustibile reagisce con l’ossigeno.
La reazione che avviene è esotermica (vi è quindi un’inevitabile perdita di energia) e nel caso del metano è la seguente:
2 2 2 1 4 O CO 2H CH + ↔ +
Il processo di ossidazione parziale, caratterizzato da temperature che possono superare i 1400°C, può essere migliorato utilizzando dei catalizzatori (CPOX) che consentono temperature inferiori (anche al di sotto di 870 °C).
2.3.5.e Autothermal reforming
Accoppiando la reazione di ossidazione parziale e quella di steam reforming nello stesso reattore, in modo che la quantità di energia generata dalla prima reazione sia uguale a quella assorbita dalla reazione endotermica, si ottiene la reazione di autothermal reforming. Quest’ultimo approccio permette di ottenere sistemi particolarmente compatti, anche se molto sofisticati, che possono essere appropriati per impieghi nell’autotrazione. Per quanto riguarda l’efficienza di conversione, l’autothermal reforming è intermedio tra i due metodi presentati in precedenza.
2.3.5.f Conversione del monossido di carbonio
Mentre le SOFC e le MCFC non presentano problemi di tolleranza verso il CO, anzi lo utilizzano come combustibile, nelle PAFC e nelle PEFC l’assorbimento di CO da parte dei materiali catalitici all’interno della cella causa una veloce degenerazione delle prestazioni della stessa. In particolare, le PAFC tollerano livelli di CO di circa lo 0.5% in volume, mentre le PEFC necessitano di valori molto più bassi.
Queste ultime necessitano, quindi, di una unità di conversione del monossido di carbonio.
La fase di conversione del CO (shifiting) viene solitamente suddivisa in una fase ad alta temperatura (260°C - 370°C) che permette alte velocità di reazione, e in una a bassa temperatura (200°C – 260°C), caratterizzata da alti fattori di conversione (con un solo stadio è possibile convertire tra l’80 ed il 95% del monossido di carbonio). La reazione di shifting che avviene in tali reattori catalitici è la seguente:
2 2
2O CO H
H
CO+ ↔ + .
Essendo tale reazione moderatamente esotermica (circa 60 kJ/mol di CO), i sistemi a più stadi possono essere ottimizzati usando scambiatori di calore opportunamente disposti tra gli stessi. La pressione non ha, in questo caso, effetto sulla cinetica delle reazioni.
Nelle celle PEFC, essendo tollerata una presenza di CO inferiore a 10 ppm, è necessario un ulteriore stadio di abbattimento del CO; questo viene realizzato con un ossidatore selettivo (PROX).
Nel PROX possono avvenire due reazioni diverse:
2 2 2 1 CO O CO + → e O H O H2 2 2 2 1 → + .
Il prevalere dell’una o dell’altra reazione dipenderà dal catalizzatore e quindi dalla quantità di ossigeno richiesta.
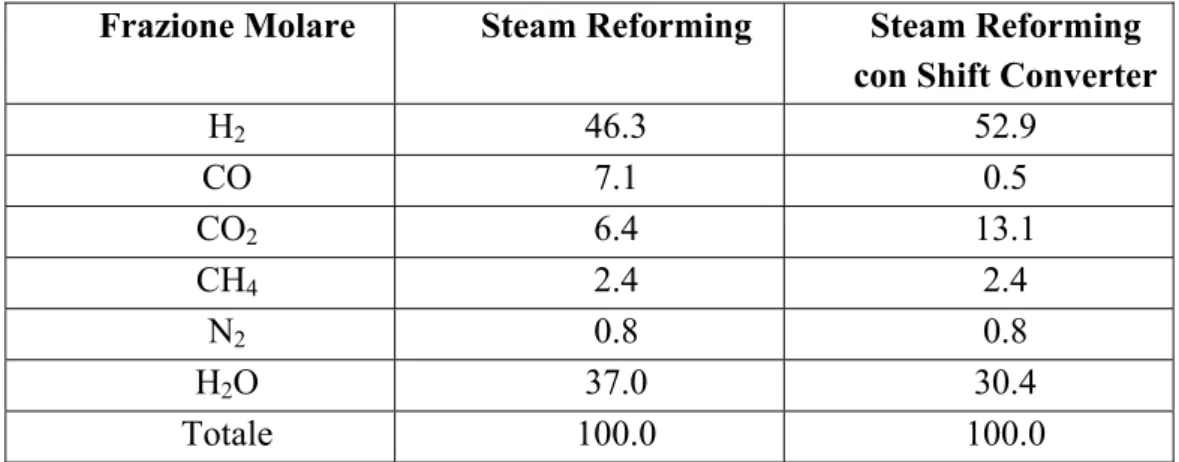
Nella tabella seguente sono riportati i valori tipici della composizione del gas naturale dopo il processo di conversione; i valori si riferiscono all’uscita dello steam reforming e dello shift converter.
Frazione Molare Steam Reforming Steam Reforming
con Shift Converter
H2 46.3 52.9 CO 7.1 0.5 CO2 6.4 13.1 CH4 2.4 2.4 N2 0.8 0.8 H2O 37.0 30.4 Totale 100.0 100.0 Tabella 2.3 - Tipica composizione del gas all’uscita dello steam reforming e dello shift converter
[12]
2.4 Sezione di condizionamento della potenza
Nella sezione di condizionamento della potenza si converte la corrente continua generata dallo stack (pila composta da più celle in serie) in corrente alternata alla tensione e alla frequenza desiderate.
Generalmente questo apparato è composto da un convertitore dc/dc (un chopper), un set di batterie ed un inverter.
Figura 2.10 - Tipica sezione di condizionamento della potenza di impianti generativi a Fuel Cell Il chopper, collegato a valle dello stack, serve ad innalzare la tensione ed a fare da attuatore del sistema di controllo: agendo sul duty ratio si possono governare i flussi di potenza tra la pila, le batterie tampone ed il carico. Questo permette, quindi, di
imporre al sistema di accumulo dinamiche di variazione della corrente compatibili con le costanti di tempo dominanti nel sistema fuel processing – stack.
Il set di batterie serve a coprire i picchi di potenza richiesta ed a garantire risposte rapide nei transitori.
Attraverso l’inverter si converte la corrente da continua in alternata, alla frequenza desiderata; con questo, inoltre, si possono controllare il fattore di potenza e, quindi, i flussi di potenza attiva e reattiva.
2.5 Caratteristiche principali dei sistemi di generazione a
celle a combustibile
Nel presente paragrafo vengono riassunti i principali pregi dei sistemi di generazione a celle a combustibile, cercando di mettere in luce i motivi che stanno conducendo al loro crescente sviluppo.
Rendimento: I rendimenti elettrici degli impianti alimentati direttamente ad
idrogeno sono dati dal prodotto del rendimento di cella per quello della sezione di condizionamento della potenza (η =ηcella ⋅ηconvertitori): avendo i convertitori un rendimento molto elevato, l’efficienza complessiva di questi impianti è legata soprattutto al tipo di celle utilizzate.
Gli impianti che prevedono la sezione di conversione del combustibile, hanno rendimenti molto più bassi, in quanto si ha l’influenza dell’efficienza del modulo di fuel processing: η =ηcella⋅ηconvertitori⋅ηF.P
Entrambi i casi, però, presentano un rendimento praticamente indipendente dalla taglia, diversamente dai sistemi convenzionali la cui efficienza diminuisce al decrescere della taglia.
Bisogna evidenziare, inoltre, che il rendimento rimane pressoché costante anche al variare del carico elettrico alimentato, in un intervallo che va dal 30 al 100%.
Impatto ambientale: Tali tecnologie presentano un ridotto impatto ambientale
dovuto a bassissime emissioni inquinanti anche in assenza di specifici sistemi di controllo degli esausti (le emissioni sono nulle se il combustibile primario utilizzato è l’idrogeno).
Le emissioni acustiche sono minime per l’assenza di importanti organi in movimento (ad esclusione dei sistemi di pompaggio e ricircolo dei gas).
Gestione operativa: Garantiscono una buona affidabilità e bassa manutenzione grazie alla mancanza di parti in movimento: i componenti più critici per quanto concerne la durata media di vita risultano essere le celle, anche se la ricerca in questo ambito sta avendo buoni risultati.
Diversificazione del combustibile: La flessibilità nella scelta del combustibile da utilizzare è grande: a seconda della filiera tecnologica utilizzata, si possono impiegare idrogeno (auspicabile), gas naturale, biogas, gas di discarica, gas da carbone, metanolo e altri combustibili fossili opportunamente trattati.
Possibilità di cogenerazione: Il calore espulso può essere utilizzato a scopi
cogenerativi con modalità differenti a seconda della temperatura disponibile. Si potrà, quindi, avere vapore o acqua calda da utilizzare, ad esempio, per il riscaldamento, il condizionamento, o per usi sanitari.
Modularità: I sistemi a celle a combustibile sono disponibili con taglie di potenze molto variabili, permettendo quindi la realizzazione di impianti capaci di soddisfare molteplici esigenze d’applicazione.
E’ possibile, inoltre, adeguare l’impianto nel tempo, qualora si verifichi una crescita della domanda, operando così investimenti graduati negli anni.
Il basso impatto ambientale permette oltretutto una maggiore versatilità nella scelta dei siti di istallazione, comprese le zone densamente abitate e con ristretti vincoli di tutela del territorio.
Continuità: Hanno la capacità di offrire alti rendimenti ed un’elevata "power
quality" (potenza di qualità) sotto il profilo della continuità, disponibilità, possibilità di regolazione locale della potenza attiva e reattiva, pronta risposta alle variazioni di carico: gli impianti alimentati ad idrogeno puro rispondono, infatti, abbastanza rapidamente ai transitori, mentre quelli con il sistema di trattamento del combustibile, più lenti dinamicamente, vengono dotati di un sistema di accumulo, generalmente elettrico (batterie), che garantisce comunque un ottimale andamento nei confronti della flessibilità del carico.
L’unità di condizionamento della potenza (inverter) può essere utilizzata per il controllo indipendentemente della potenza attiva e reattiva. Il controllo del fattore di potenza, della tensione di linea e della frequenza permettono di ridurre le perdite di trasmissione e consentono una notevole capacità di rifasamento.


![Tabella 2.1 - classificazione delle celle a combustibile e loro principali caratteristiche [13] Infine, è molto importante sottolineare che le AFC, le PEFC, le PAFC, a causa della loro intolleranza al monossido di carbonio necessitano il trattamento este](https://thumb-eu.123doks.com/thumbv2/123dokorg/5671201.71977/9.892.149.764.154.1029/classificazione-combustibile-caratteristiche-importante-sottolineare-intolleranza-necessitano-trattamento.webp)
![Tabella 2.2 - Possibili reazioni nel reattore di steam reforming di metano [18]](https://thumb-eu.123doks.com/thumbv2/123dokorg/5671201.71977/28.892.179.735.339.757/tabella-possibili-reazioni-reattore-steam-reforming-metano.webp)