1
I METALLI PESANTI
I metalli sono elementi chimici solidi a temperatura ambiente, eccezion fatta per il mercurio, componenti naturali delle acque e dei sedimenti, molti di loro indispensabili per le attività vitali e considerati inquinanti se il loro livello eccede quello naturale. In condizioni naturali i fiumi provvedono al maggior contributo di metalli nell'ambiente marino, anche se una buona parte, proveniente per lo più dalle attività vulcaniche e dai fumi industriali, è trasportata attraverso l'atmosfera. Di notevole interesse per la loro temuta tossicità sono i cosiddetti metalli pesanti, i quali sono poco soggetti ai processo di decomposizione microbica e a degradazione fotochimica e permangono, quindi, nel suolo. Negli ultimi decenni i flussi litosfera-biosfera, litosfera-atmosfera, atmosfera-biosfera relativi a diversi metalli pesanti quali Pb, Cd, è cresciuto superando abbondantemente quello naturale (Salomon e Förstner, 1984). Le cause principali dell’alterazione di questi flussi bio-geochimici sono imputabili alla crescente domanda di prodotti contenenti metalli pesanti utilizzati nelle attività industriali e nelle moderne tecniche agrarie, al conseguente incremento dell’attività mineraria, siderurgica e della produzione e dello stoccaggio dei relativi rifiuti. I metalli pesanti presenti nel suolo o nei sedimenti possono esistere come differenti specie chimiche. In situazioni di scarso inquinamento questi metalli si trovano principalmente sotto forma di silicati e minerali primari, e costituiscono specie relativamente immobili. In zone suscettibili di inquinamento i metalli in tracce sono generalmente presenti in altre forme, più disponibili.
1.1
Generalità e mobilità dei metalli pesanti nell’ambiente
Vanno sotto il nome di metalli pesanti (heavy metals, cosi chiamati per l'alta densità) una serie di elementi (con numero atomico superiore a 20) appartenenti in massima parte al cosiddetto gruppo degli elementi di transizione, ai quali vengono normalmente aggiunti altri elementi che, pur non appartenendo a tale gruppo, posseggono proprietà chimiche e fisiche molto simili.Le principali proprietà che accomunano questi elementi sono: • una densità superiore ai 5,0 g/cm3;
• si comportano in genere come cationi;
• presentano una bassa solubilità dei loro idrati; • hanno una spiccata attitudine a formare complessi;
• hanno una grande affinità per i solfuri, nei quali tendono a concentrarsi; • hanno diversi stati di ossidazione a seconda delle condizioni di pH ed Eh.
Ad esclusione di Fe e Al vengono anche detti elementi in traccia (< 0.1% nei più comuni suoli e rocce) e le loro concentrazioni nei suoli, nei sedimenti e nelle rocce sono solitamente di parti per milione o per miliardo (ppm, ppb). Generalmente vengono considerati metalli pesanti Ag, Ba, Cd, Co, Cr, Mn, Hg, Mo, Ni, Pb, Cu, Sn, Tl, Ti, V, Zn, alcuni metalloidi, con proprietà simili a quelle dei metalli pesanti, quali As, Sb, Bi ed Se (Salomon e Förstner , 1984). Tra questi, gli elementi che determinano più spesso fenomeni d’inquinamento sono: As, Hg, Tl, Cd, Co, Cr, Cu, Mn, Mo, Ni, Pb, Sn, Zn e Se (Salomon e Förstner, 1984).
La maggior parte dei metalli pesanti appartiene alla categoria definita da Goldschmidt1 dei calcofili1, cioè di quegli elementi che hanno una spiccata affinità per i legami semimetallici tipici
dei solfuri.
Alcuni metalli pesanti appartengono alla categoria di micronutrienti o microelementi in quanto risultano essenziali alla nutrizione e alla crescita di piante ed animali (Tabella 1.1), manifestandosi dannosi per l’organismo se presenti in concentrazioni troppo basse e nocivi solo nel caso in cui le loro concentrazioni superino delle soglie che sono variabili da elemento ad elemento e da
1 Classificazione geochimica di Goldschmidt: siderofili: aventi affinità per i legami metallici tipici delle leghe; calcofili:
aventi spiccata affinità per i legami semimetallici tipici dei solfuri; litofili: caratterizzati dall’affinità per i legami ionici tipici dei silicati e degli ossidi; atmofili: aventi bassa affinità per i precedenti legami e pertanto accumulati nell’atmosfera (He, Ne, Ar).
organismo ad organismo. Altri metalli pesanti non svolgono alcun ruolo nello sviluppo di biomassa, e la loro presenza è considerata sempre potenzialmente tossica.
Tabella 1.1 Metalli essenziali per il funzionamento ottimale degli organi e metalli non essenziali (modificata da De Vivo 2004).
Metalli pesanti micronutrienti essenziali (alcuni mg o
µm al giorno)
As, Co, Cr, Cu, Fe, Mn, Mo, Se, V, Zn
Metalli pesanti non
essenziali Be, Cd, Hg, Ni, Pb, Sb, Sn, Ti
Queste specie chimiche possono esistere allo stato elementare o come ioni liberi o ancora come parte di molecole più complesse. Allo stato elementare o metallico di norma nessun metallo è tossico, in quanto insolubile. Numerosi processi chimici e biochimici sono in grado di trasformare però un elemento in ione, che invece hanno attività biologiche. Gli elementi di transizione presentano diversi stati di ossidazione con conseguente diversità di forme chimiche. Lo stesso elemento quindi può essere presente come catione solubile (con una o più cariche positive) non combinato o come anione solubile (con una o più cariche negative) combinato con l’ossigeno; può trovarsi combinato con ossidi e idrossidi insolubili o in composti con silicio, insolubili, o ancora in composti col carbonio, idrosolubili o liposolubili.
A seconda quindi della speciazione2 dell'elemento, ovvero della distribuzione tra diverse forme e
specie, dipenderà il comportamento, la reattività e l'assimilabilità da parte degli esseri viventi. La forma o la specie chimica sotto cui un elemento è disponibile è molto importante dal punto di vista degli effetti biologici di quell'elemento.
La solubilità, la mobilizzazione, la precipitazione e deposizione, l’adsorbimento dei metalli pesanti è attuata da diversi vettori fisici, chimici e biologici. Il pH e il potenziale redox, prima di tutti, la temperatura, le proprietà superficiali dei solidi, l’abbondanza e speciazione dei liganti e dei principali anioni e cationi, la presenza o assenza di sostanza organica particellare e/o disciolta, sono i processi che da soli, ma spesso in combinazione tra di loro e con quelli batterici, determinano quali specie chimiche dei metalli sono disponibili e le loro variazioni durante
2Speciazione fisica : distribuzione di un metallo tra forme solubili, colloidali o sottoforma di particolato.
Speciazione chimica: distribuzione tra varie distinte specie chimiche in soluzione, comprendendo sia la distinzione tra metallo complessato e metallo libero, ma anche tra i diversi stati di ossidazione. La somma delle concentrazioni delle varie forme dà la concentrazione totale.
l’interazione con un ambiente (De Vivo et alii, 2004). La mobilità dei metalli pesanti in un ambiente, cioè la capacità di permanere in soluzione nelle acque dopo essere stato da queste disciolto, può essere influenzata anche dall’eterogeneità tessiturale dei suoli/sedimenti (es. la dimensione dei granuli), dalla composizione della matrice dei suoli/sedimenti (come la mineralogia e il contenuto di materia organica), dall’interazione dei fluidi o particelle con le acque (De Vivo et alii, 2004).
La disponibilità dei cationi (ad esempio Cd, Pb, Hg) è generalmente maggiore in acque acide piuttosto che in quelle alcaline. Bassi valori di pH favoriscono la dissoluzione di fasi minerarie e la presenza in soluzione di ioni liberi semplici molto più facilmente assorbibili da parte degli organismi rispetto agli ioni complessi. I metalli in forma anionica (tipo il Molibdeno come MoO42-) risultano più
disponibili in condizioni alcaline.
Secondo Goldschmidt a seconda del potenziale ionico (numero atomico Z/raggio atomico r) si può dedurre la mobilità dei metalli in soluzioni acquose. Gli elementi come Pb, Hg, Cd, Cu, Co, Fe, Zn (Fig. 1.1) che hanno un basso potenziale ionico si ritrovano come elementi solubili, mentre altri metalli pesanti che hanno alto potenziale ionico come Mo, As, Cr, Se e V si rinvengono come complessi anionici insolubili (De Vivo et alii, 2004). I cationi ad alta valenza tendono ad essere molto più adsorbiti, su ossidi di ferro e manganese, su argille e materiale organico, rispetto agli anioni o ai cationi a bassa valenza (Salomon e Förstner, 1984). Gran parte dei metalli potenzialmente tossici si concentrano in ambienti caratterizzati da condizioni riducenti e formano complessi stabili con i radicali sulfurici, amminici, fosforici e carbossilici della sostanza organica ed hanno quindi un’elevata tendenza a combinarsi stabilmente con i siti più reattivi dei composti chimici costituenti la materia vivente (De Vivo et alii 2004).
Fig 1.1 Mobilità degli elementi chimici negli ambienti superficiali in funzione della carica e del raggio ionico. I metalli pesanti una volta immessi nell’ambiente tendono a permanervi, secondo diversi fattori d’accumulo (da De Vivo et alii 2004).
1.2
I metalli nei sedimenti
I sedimenti sono un importante vettore per i metalli in traccia nel ciclo idrogeologico, in quanto processi biologici e chimico fisici ne determinano un accumulo in queste particelle, che per lo più finiscono poi in mare, trasportati dalle acque fluviali, con la conseguenza che lo studio delle concentrazioni in questa fase del sistema marino riveste un’importanza notevole. I metalli non sono necessariamente fissati in modo permanente nei sedimenti, ma possono essere messi in circolo da agenti biologici e chimici e ritornare nella colonna d’acqua. Esaminando solo la parte più superficiale del sedimento, per uno spessore di qualche centimetro, è possibile effettuare un‘indagine sulla vita recente del sedimento. Questa procedura fornisce informazioni sullo stato d’inquinamento "attuale" del sedimento. Va puntualizzato che specie tossiche anche molto diluite nella fase acquosa, a contatto con il sedimento possono accumularsi progressivamente nello stesso, raggiungendo concentrazioni che non di rado superano di due o tre ordini di grandezza, o anche più, quelle che si osservano nelle acque sovrastanti. Nel corso degli anni i metalli pesanti continuano ad accumularsi nei sedimenti, soprattutto se nelle vicinanze è presente una fonte naturale o antropica.
Nel materiale solido di suoli e sedimenti, i valori di concentrazione dei metalli sono molto superiori rispetto a quelli nelle acque interstiziali e delle acque correnti, e risultano "trattenuti" dal particolato solido in vario modo (1) adsorbiti su ossidi metallici idrati e minerali argillosi, (2) complessati (chelati) dalla materia organica, (3) dispersi nel reticolo cristallino di minerali principali primari e secondari, e (4) inclusi in resti biologici ed in composti inorganici amorfi.
I sedimenti più grossolani (sabbia e ghiaia) si depositano più vicini alle spiagge e conservano le caratteristiche chimiche delle rocce da cui si sono originati. La mineralogia dei sedimenti grossolani in generale consiste principalmente di quarzo, accompagnato da feldspato ed in qualche caso da carbonato di calcio, molto spesso di origine biogenica (Salomon e Forstener, 1984).
I sedimenti fini consistono prevalentemente di minerali argillosi, materia organica, ossidi e idrossidi di Fe e Mn e particelle fini di quarzo, carbonati e feldspati. Hanno caratteristiche chimiche simili a quelle che ci si aspetta da un detrito residuale ma possono anche adsorbire metalli (De Vivo et alii, 2004). La forma e la taglia dei sedimenti fini è diversificata. Sono particelle elettricamente cariche, la loro carica dipende dalla forza ionica (responsabile delle loro caratteristiche di coesione) e dallo strato superficiale. I minerali argillosi e gli ossidi/idrossidi di ferro e manganese (amorfi o cristallini), sono le fasi più reattive nell’ambiente acquoso per quanto riguarda l’assorbimento di ioni metallici e complessi anionici a causa della loro carica superficiale (De Vivo et alii, 2004). L’assorbimento è un processo che facilita l’accumulo riducendo sensibilmente la mobilità degli elementi adsorbiti; un forte arricchimento in metalli pesanti da parte dei sedimenti argillosi e della
materia colloidale si registra nei sedimenti in sospensione, nei sedimenti depositati e di conseguenza nelle rocce e nei minerali derivanti dalla loro litificazione, quali argilliti e ossidi di manganese (De Vivo et alii, 2004).
La materia organica gioca un ruolo importante nel trasporto dei metalli, in quanto è in grado di legare i metalli in traccia e prendere parte al processo di diagenesi dopo la deposizione (Salomon e Forstener, 1984).
1.3
Fonti antropiche dei metalli pesanti
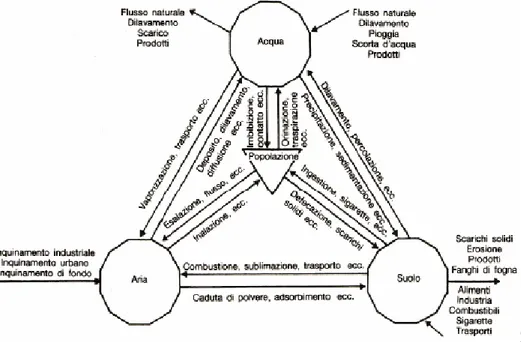
La presenza dei metalli pesanti nell’ambiente marino e fluviale, nel suolo e nei sedimenti non costituisce una novità, trattandosi di sostanze pur sempre rinvenibili in natura per alterazione delle rocce. Da diversi decenni però, la loro concentrazione e la loro progressiva dispersione nell'ambiente è aumentata notevolmente, soprattutto in alcune aree in corrispondenza di grandi agglomerati urbani ed insediamenti industriali. Le più importanti fonti d’immissione (Fig. 1.2) dei metalli pesanti nell’ambiente marino sono gli sversamenti fluviali, depositi atmosferici ed apporti della geosfera (per esempio attraverso meccanismi d’erosione).
Fig. 1.2 Flusso dei metalli nell’ambiente (da Floccia et alii, 2003)
Da molte migliaia di anni l’uomo ha innescato un bisogno via via crescente nei flussi di approvvigionamento degli elementi in traccia; l’attività estrattiva è stata la causa prima della dispersione nell’ambiente superficiale di elementi che erano inizialmente concentrati negli spazi molto limitati dei giacimenti minerari; molti di questi (quelli sepolti) non erano per giunta sottoposti in precedenza all’azione dell’erosione e alterazione superficiale. Questa dispersione avviene sia nella fase della estrazione mineraria e della lavorazione metallurgica, come pure e soprattutto nella fase di uso e rottamazione finale di tutti i manufatti prodotti. Anche la produzione energetica gioca un ruolo importantissimo nel disperdere elementi in traccia sulla superficie della Terra. Le emissioni derivanti dalla combustione di petrolio e carbone nelle centrali elettriche a combustibile fossile, nei complessi industriali come le fonderie, o prodotte dal consumo di combustibili per il riscaldamento domestico e dei mezzi di trasporto (liberazione di piombo tetraetile e in parte di cadmio) rilasciano nell'atmosfera grandi quantità di metalli potenzialmente
tossici. In funzione della loro volatilità i metalli pesanti entrano nell'atmosfera e vengono trasportati per adsorbimento o assorbimento su materiale particolato e deposti per precipitazione sia sulla terra ferma che nell'idrosfera in funzione della direzione delle correnti d'aria.
La dispersione dei metalli pesanti nei corsi d'acqua, negli stagni, nei laghi, nei mari e negli oceani avviene per lo più attraverso i rifiuti liquidi rappresentati dalle acque utilizzate durante il ciclo produttivo degli stabilimenti industriali. Una parte del carico dei metalli pesanti è trasportato in un ambiente sedimentario in soluzione, parte in sospensione sotto forma di sedimenti (organici ed inorganici), parte come sedimenti di fondo. I metalli trasportati nelle prime due modalità sono più disponibili e più facilmente mobilizzati nella catena alimentare rispetto a quelli contenuti nei sedimenti di fondo o superficiali (De Vivo et alii 2004).
Un’altra fonte di dispersione di questi inquinanti nella biosfera è rappresentata dai rifiuti solidi industriali quali il letame dalla zootecnia, la cenere di carbone dagli impianti che generano elettricità e dalle fonderie, gli sterili delle attività minerarie; i rifiuti solidi domestici quali batterie elettriche (contenenti Ni, Cd e Zn) e delle autovetture (contenenti piombo), varie apparecchiature elettriche di uso comune, pneumatici, automobili abbandonate. I rifiuti solidi della zootecnia (il letame) spesso usati come fertilizzanti possono determinare un'elevata concentrazione di metalli potenzialmente tossici nei suoli dai quali possono essere successivamente trasferiti nelle colture e quindi negli animali superiori. Il Co, il Cu e lo Zn sono contenuti, anche in notevoli quantità, nelle deiezioni degli animali, che, assimilandone soltanto percentuali molto basse, fanno sì che le loro feci e le loro urine ne risultino molto arricchite. I problemi ambientali legati all’impiego delle deiezioni animali nascono, poiché, soprattutto nelle aziende ad indirizzo zootecnico e cerealicolo-zootecnico, vengono ridistribuiti su aree limitate o limitatissime per lunghi periodi di tempo. Stagionali apporti in Cu, Hg, Mn, Pb, As, Sn e Zn sono causati inoltre dall’uso di pesticidi di varia natura (Adriano, 1986). I fertilizzanti vengono ottenuti dalla lavorazione di rocce fosfatiche (le Fosforiti) che contengono quantità variabili di As, Cd, Pb, Bi e Zn (Adriano, 1986).
Sotto il profilo degli effetti sull’ambiente e sulla salute queste dispersioni provocate dall’uomo implicano anche significative trasformazioni nell’aumento della mobilità geochimica e della biodisponibilità degli elementi considerati. I cicli biogeochimici degli elementi in traccia sono stati quindi profondamente sconvolti dalle attività umane, con incrementi anche di ordini decimali nei flussi che si verificavano tra ed all’interno delle diverse sfere geochimiche in condizioni indisturbate.
1.4
Problemi di tossicità dei metalli pesanti
I percorsi attraverso i quali i metalli pesanti potenzialmente tossici rilasciati nell'ambiente da sorgenti naturali e da attività antropiche posso essere accessibili agli organismi viventi, sono principalmente tre: respirazione, assunzione tramite acqua e assunzione tramite l'ingestione di cibo. Raramente possono essere assorbiti attraverso la pelle. Ovviamente l'esposizione degli organismi ai metalli pesanti dipende dal loro habitat. Per esempio i filtratori e gli organismi planctonici assumono i metalli pesanti allo stato disciolto o particolato; i detritivori e la meiofauna, ingeriscono particelle di sedimento e l'acqua interstiziale con i metalli che vi sono associati.
La tossicità e la pericolosità dei metalli pesanti non è semplicemente legata alla loro presenza nell’ambiente ed al loro possibile contatto con gli organismi viventi, ma soprattutto alla forma chimica in cui essi sono presenti quando vengono a trovarsi in queste situazioni. Gli studi sulla varietà di forme chimiche presentate da uno stesso metallo sono particolarmente importanti per la valutazione della sua biodisponibilità e della sua tossicità. Per biodisponibilità s'intende la frazione di metallo rapportata al totale presente nell'ambiente, che si rende disponibile per gli organismi cioè che entra nella catena alimentare. Allo stato elementare nessun metallo è in grado di penetrare nelle cellule; la forma chimica più generalmente diffusibile è quella ionica o di composti organometallici; un composto solubile in genere, è più disponibile di uno poco solubile o insolubile. Le forme cationiche sono potenzialmente più pericolose dal punto vista ambientale sia per la loro maggiore possibilità di diffusione nell’ambiente, che per la maggiore capacità di essere assimilate dagli organismi viventi. I gruppi cationici presentano alta affinità per lo zolfo nel gruppo –SH degli enzimi cellulari, e in generale delle proteine, presenti in alcune reazioni metaboliche fondamentali nel corpo umano. Il complesso metallo-zolfo inibisce il normale funzionamento dell'enzima comportando danni metabolici e strutturali alle cellule degli organismi viventi. Per alcuni elementi la tossicità può dipendere dal suo stato di ossidazione un esempio tra tutti è quello del cromo esavalente molto più tossico della sua forma trivalente.
Molti metalli pesanti presentano il fenomeno del bioaccumulo e biomagnificazione, cioè l'aumento progressivo della concentrazione dell’inquinante all’interno di un organismo man mano che si sale di livello trofico e quindi lungo la catena alimentare, per cui i predatori che si inseriscono ai vari livelli della piramide alimentare sono soggetti ad accumulare le sostanze tossiche in una quantità sempre maggiore quanto più alto è il livello che essi occupano. Un esempio è dato dalla catastrofe ambientale accaduta a Minamata, una cittadina del Giappone, dove molte persone sono morte a causa di un'intossicazione da mercurio, dovuta all'abbondante ingestione di pesce inquinato, che veniva pescato nella baia su cui si affaccia la città. Per vari
decenni una industria del luogo ha riversato in questa baia tonnellate di mercurio che hanno avvelenato i pesci e, di conseguenza, le persone che se ne nutrivano.
L’avvelenamento da metalli pesanti può essere acuto o cronico. Viene detto acuto quando l’organismo riceve una dose elevata del veleno e ne subisce immediatamente i danni relativi. In questi casi sono state segnalate perdita di peso della massa muscolare, del peso corporeo, insufficienze epatiche e renali, necrosi al tessuto epiteliale, al sistema arterioso, ed a quello nervoso, follia, demenza e morte del soggetto.
L’avvelenamento cronico è invece più subdolo, consiste nel progressivo accumulo nell’organismo di piccole dosi dell’agente tossico, ciascuna delle quali, da sola, non è in grado di provocare i sintomi dell’avvelenamento acuto. Tra le patologie determinate dall’esposizione cronica a basse dosi, vi sono l’alterazione del patrimonio genetico, l’aumento dell’incidenza delle malformazioni fetali, l’aumento degli aborti, l’aumento della mortalità infantile, uno scarso sviluppo fisico e cognitivo nell’età dello sviluppo, l’aumento dell’incidenza e della durata delle malattie del sistema respiratorio e delle allergie, insufficienze renali, arteriosclerosi, l’aumento dell’incidenza di mutazioni, tumori e cancri.
L’azione neurotossica e la capacità di ridurre il quoziente intellettivo è stata riconosciuta a Hg, Pb ed Cd, ma potrebbe essere causata anche dall’esposizione cronica a basse dosi a tutti quegli elementi calcofili che, come Pb, Cd, Cu, Zn, Ni, Co, As, Bi, Sb e Hg, hanno un’elevata tendenza a formare complessi organometallici stabili con i gruppi fosforici dei fosfolipidi di cui sono ricche le cellule nervose. Il Cr, Be, As, V, Cu, Ni, sono genotossici, causano cioè mutazioni nel DNA che favoriscono l’insorgenza di tumori e cancro. Il Pb e Cd sono anch’essi cancerogeni; questi elementi aumentano l’incidenza di tumori e cancri indirettamente, in quanto diminuiscono l’efficienza con cui il sistema immunitario ripara le ingiurie chimiche registrate dal DNA.
I metalli vengono eliminati principalmente per via renale, come il mercurio e il cadmio, oppure con la bile, come l'arsenico, l'alluminio e il manganese e ritrovarsi quindi nelle feci. In piccola quantità possono essere eliminati per via respiratoria o cutanea (ma si possono ritrovare nei capelli). Alcuni metalli possono passare nel latte materno.
Alcuni metalli pesanti si possono accumulare nei tessuti adiposi ed esplicare la loro azione patogena in periodi più o meno dilazionati secondo le attività metaboliche, come ad esempio la necessità da parte dell’organismo di utilizzare i grassi accumulati: l’effetto di questi composti si manifesta con maggiore incidenza quando l’animale utilizza come fonte di energia le riserve di grasso cellulari.
1.5
Riferimenti Normativi
La normativa in materia ambientale è un settore del diritto piuttosto recente, in quanto solo a partire dalla fine degli anni ’70, a causa della progressiva crescita della pressione antropica sul Pianeta, iniziano a cambiare gli atteggiamenti delle politiche europee e internazionali in campo ambientale: emerse quindi sempre più l’esigenza di tutelare l’ambiente e di contrastare e limitare l’inquinamento. Il continuo aumento dell’industrializzazione e della urbanizzazione lungo le coste, l’espansione dei traffici marittimi, l’inquinamento delle acque e dell'aria, lo sfruttamento irrazionale delle risorse, hanno fatto apparire in tutta la sua evidenza il progressivo degrado dell’ambiente marino e quindi la necessità di tutelare questa grande risorsa. La Conferenza di Stoccolma (1972) sancisce che “L’uomo è portatore di una solenne responsabilità per la protezione e il miglioramento dell’ambiente per le generazioni future”. Nel 1976, il Consiglio Intergovernativo del Programma Ambientale delle Nazioni Unite (UNEP) redasse la Convenzione di Barcellona (Convenzione per la protezione dell'ambiente marino e la regione costiera del Mediterraneo) al fine di creare lo strumento giuridico necessario all’attuazione del Piano d’azione del Mediterraneo per la tutela dall’inquinamento (MAP). Nel 1995, il piano è stato approvato definitivamente e nel 1996 è stato redatto il Protocollo relativo alle Aree Specialmente Protette e alla Diversità Biologica nel Mediterraneo (ASPIM). Attraverso la Decisione 1999/800/CE, la Comunità Europea ha ufficializzato la sua adesione e partecipazione alla Convenzione di Barcellona e di conseguenza sono state emanate in ambito comunitario, nazionale e regionale diverse leggi volte alla protezione ed al monitoraggio della qualità dell’ambiente marino.
La Legge n° 319 del 10/05/76 “Norme per la tutela delle acque dall'inquinamento”, la cosi detta Legge Merli, è stata la prima normativa in Italia nel settore della tutela delle acque. Il difetto di fondo di questa legge consisteva nel criterio degli “standard” delle sostanze inquinanti negli scarichi idrici, i quali non prendevano in considerazione né lo stato complessivo del corpo idrico recettore, la sua portata e qualità, né la portata e la qualità dello scarico stesso.
Con la Legge n° 979 del 1982 “Disposizioni per la difesa del mare”, l’Italia si dota, per la prima volta, di uno strumento giuridico che definisce le competenze per il monitoraggio e il controllo della qualità del mare. Questa legge affida al Ministero dell’Ambiente e della Tutela del Territorio il compito istituzionale della difesa del mare, vista non solo come tutela dell'ambiente marino e difesa del mare e delle coste dall'inquinamento, ma altresì come promozione e valorizzazione delle risorse marine. Essa prevede: piani di pronto intervento; programmi di monitoraggio marino; istituzione di Riserve Marine.
A partire dall'11 maggio del 1999 entra in vigore il Decreto Legislativo n°152 “Disposizioni sulla tutela delle acque dall’inquinamento” (in seguito aggiornato dalla Legge 258/2000, recepimento della Direttiva 91/271/CEE concernente il trattamento delle acque reflue urbane e della Direttiva 91/676/CEE relativa alla protezione delle acque provocato dai nitrati provenienti da fonti agricole) che si inserisce sull’impianto normativo esistente senza abrogarlo, ma rinnovandolo e integrandolo. Il Decreto Legislativo rappresenta, ad oggi, la normativa nazionale che definisce il regime della tutela delle acque dall’inquinamento. Uno degli elementi di novità introdotti da questa normativa è il concetto di una politica ambientale volta al perseguimento e/o al mantenimento di prefissati obiettivi di qualità dell’ambiente marino costiero, in accordo con gli attuali orientamenti comunitari (Direttiva quadro in materia di tutela delle acque 2000/60/CE, che prevede la riduzione e la graduale eliminazione dell’inquinamento provocato dallo scarico, emissioni e rilascio di sostanze pericolose), non limitandosi al semplice monitoraggio costiero ma studiando la qualità ambientale di aree con realtà critiche (zone fortemente antropizzate, con scarichi industriali, urbani…) individuandone le sorgenti di inquinamento e istituendovi piani d’intervento e risanamento. L'inquinamento idrico viene quindi definito dalla presente normativa come "lo scarico effettuato direttamente o indirettamente dall'uomo nell'ambiente idrico di sostanze o di energia le cui conseguenze siano tali da mettere in pericolo la salute umana, nuocere alle risorse viventi e al sistema ecologico idrico, compromettere le attrattive o ostacolare altri usi legittimi delle acque". Questa norma prevede l'analisi delle tre matrici ambientale quali acqua, sedimento e biota fissando per ognuna i parametri di base da analizzare, la modalità, la frequenza, al fine di poter calcolare l’indice trofico TRIX che serve a definire lo stato di qualità delle acque marino costiere. In particolare l’analisi dei sedimenti è volta a definire le concentrazioni di metalli pesanti bioaccumulabili, idrocarburi policiclici aromatici (IPA), composti organostannici, composti organoclorurati.
Ai sensi dell'articolo 3, comma 4, del D.Lgs. 152 è stato emanato, in attuazione delle direttive europee 76/464/CE e 2000/60/CE in materia, il D.M. 6 novembre 2003, n. 367 “Regolamento concernente la fissazione di standard di qualità nell'ambiente acquatico per le sostanze pericolose”. Per garantire la tutela delle acque interne superficiali e delle acque marino-costiere dall'inquinamento provocato dalle sostanze pericolose immesse nell'ambiente idrico da fonti puntuali e diffuse, il DM Ambiente 367 (emanato anche per dare esecuzione alla sentenza Ue del 1° ottobre 1998 con la quale l’Italia era stata condannata per la mancata trasposizione della direttiva 76/464/CE sulla protezione dell’ecosistema dalle sostanze pericolose) incide direttamente sul provvedimento madre, D.Lgs 152/1999, modificandone la parte tecnica (contenuta negli allegati) al fine di rendere funzionali i nuovi parametri di qualità ambientale. I nuovi criteri qualitativi stabiliti dal Ministero dell'Ambiente con il DM 367 dovranno essere rispettati in tutte le acque interne superficiali, marino-costiere, ed a specifica destinazione funzionale (acque
dolci superficiali destinate alla produzione di acqua potabile; destinate alla balneazione; dolci che richiedono protezione e miglioramento per essere idonee alla vita dei pesci, acque destinate alla vita dei molluschi). I nuovi parametri per la protezione delle acque sono contenuti nell’allegato A del DM e dovranno essere rispettati secondo un preciso calendario entro il 31 dicembre 2008 dovrà essere raggiunto un obiettivo intermedio di buono stato chimico delle acque; entro il 31 dicembre 2015 si dovrà aspirare ad un livello più alto di protezione dell’ecosistema (Tabella 1.2). Aspetto importante è che le concentrazioni delle sostanze nelle acque superficiali individuate con la lettera "PP" nell'allegato A devono tendere ai valori del fondo naturale per le sostanze presenti in natura e, per le sostanze sintetiche antropogeniche. I valori del fondo naturale costituiscono la soglia di partenza da cui poter stabilire eventuali arricchimenti. Nelle acque in cui e' dimostrata scientificamente la presenza di metalli in concentrazioni di background naturali superiori ai limiti fissati in tabella, tali livelli di fondo costituiranno gli standard da rispettare. Gli standard fissati dall'allegato A sono finalizzati a garantire a breve termine la salute umana e a lungo termine la tutela dell'ecosistema acquatico.
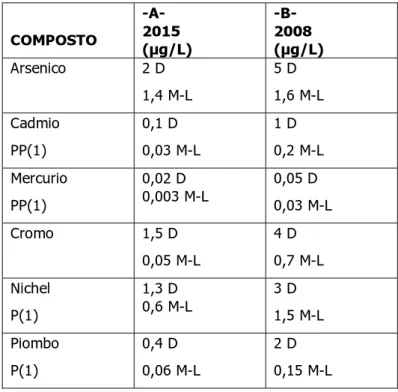
Tabella 1.2 Standard di qualità delle acque; valori limite del contenuto di metalli pesanti nelle acque fissati dal DM n° 367/2003, estratti dalla Tabella 1 dell’Allegato A.
(1) Le sostanze contraddistinte dalla lettera P e PP sono, rispettivamente, le sostanze prioritarie e quelle pericolose prioritarie individuate ai sensi della decisione n. 2455/2001/CE del Parlamento europeo e del Consiglio del 20 novembre 2001.
(2) D= acque dolci superficiali; M= acque marine; L= lagune
COMPOSTO -A- 2015 (µg/L) -B- 2008 (µg/L) Arsenico 2 D 1,4 M-L 5 D 1,6 M-L Cadmio PP(1) 0,1 D 0,03 M-L 1 D 0,2 M-L Mercurio PP(1) 0,02 D 0,003 M-L 0,05 D 0,03 M-L Cromo 1,5 D 0,05 M-L 4 D 0,7 M-L Nichel P(1) 1,3 D 0,6 M-L 3 D 1,5 M-L Piombo P(1) 0,4 D 0,06 M-L 2 D 0,15 M-L
Per quanto riguarda i sedimenti, matrice di particolare interesse per il presente lavoro, in Tabella 1.3 sono riportati i valori limite fissati dal decreto. Le concentrazioni rilevate nei sedimenti ricadenti in regioni geochimiche che presentano livelli di fondo superiori a quelli riportati in Tabella 1.3, sono sostituiti dalle concentrazioni del fondo naturale.
Tabella 1.3 Valori limite fissati dal DM n° 367/2003. Estratta dalla tabella 2 dell’Allegato A “standard di qualità dei sedimenti di acque marino-costiere, lagune e stagni costieri”. Concentrazioni espresse in mg/Kg di sedimento secco (s.s).
(1) Le sostanze contraddistinte dalla lettera P e PP sono, rispettivamente, le sostanze prioritarie e quelle pericolose prioritarie individuate ai sensi della decisione n. 2455/2001/CE del Parlamento europeo e del Consiglio del 20 novembre 2001.
(2) Per il cromo VI il valore di riferimento provvisorio è di 5 mg/kg. (1) PARAMETRI CONCENTRAZIONI METALLI mg/Kg s.s PP Arsenico 12 Cadmio 0,3 Cromo totale (2) 50 PP Mercurio 0,3 P Nichel 30 P Piombo 30 ORGANO METALLI µg/Kg s.s PP Tributilstagno 5
Saranno le Regioni ad individuare le sostanze pericolose da controllare in funzione della loro potenziale presenza. Il controllo dovrà essere esteso anche alle sostanze non espressamente previste dal DM 367/2003 qualora ne sia accertata la presenza nei corpi idrici.