CAP.1 INTRODUZIONE
1.1 Generalità
L’inquinamento delle acque costituisce oggi più che mai un problema crescente con diversi effetti e conseguenze sull’ambiente, sullo stato di salute dell’uomo e sulla sua qualità di vita. Non si tratta solo dell'inquinamento legato agli incidenti delle petroliere, agli sversamenti in mare di petrolio o alle attività illegali di scarico in mare dei fusti di rifiuti. Secondo le statistiche, solo il 12 per cento dell'inquinamento marino è imputabile ai trasporti marittimi, mentre il 44 per cento delle sostanze inquinanti arriva dalla terraferma e il 33 per cento dall'atmosfera, dato che contribuisce sensibilmente alla contaminazione dei corpi idrici, specialmente in vicinanza di impianti a combustione. Inoltre, fenomeni naturali come gli stessi processi “diagenetici” (trasformazioni chimiche, fisiche e biologiche subite da un sedimento dalla deposizione fino alla formazione di rocce consolidate) possono modulare la concentrazione effettiva di composti chimici potenzialmente inquinanti. Altrettanto importanti per l’ambiente acquatico sono anche altri tipi di inquinamento, come quello termico, dovuto ad esempio agli scarichi a temperature elevate delle centrali termoelettriche, quello acustico e gli eventi talvolta imponenti di eutrofizzazione (Bolognesi e Venier, 2004). Per quanto siano questi gli aspetti più visibili del problema, l'inquinamento dei mari dipende in gran parte da altre fonti, come gli scarichi urbani e industriali, la dispersione in acqua dei pesticidi e dei composti chimici usati nell'agricoltura, gli scarti delle lavorazioni minerarie, i rifiuti radioattivi. Le acque di scarico urbane e industriali infatti, contengono i residui delle numerose sostanze utilizzate dall’uomo per l’alimentazione, per le attività quotidiane e per i processi produttivi, sostanze che alterano la qualità dei
corpi idrici che le ricevono, producendo il fenomeno noto con il nome di inquinamento delle acque. Si distinguono tre livelli di inquinamento. Esiste innanzitutto una modifica di qualità delle acque collegata a cause naturali insopprimibili; l’acqua piovana infatti, a contatto col suolo assume in soluzione e in sospensione sostanze di origine minerale e biologica, molte delle quali, incluse nella categoria dei contaminanti, producono il cosiddetto inquinamento naturale, normalmente contenuto entro limiti tali da non costituire un problema per l’ambiente.
Un livello di inquinamento immediatamente superiore è quello che corrisponde all’apporto di sostanze dall’esterno, per cause non naturali, in quantità non superiori alla capacità di autodepurazione dell’acqua recipiente. Quest’ultima può avvalersi infatti di processi di ossidazione biochimica, grazie all’intervento di microrganismi demolitori che, utilizzando l’ossigeno disciolto, attaccano le sostanze organiche, trasformandole in prodotti minerali semplici come acqua, anidride carbonica, solfati, ecc. Un’altra difesa del corpo idrico può essere costituita dalla diluizione. Sia attraverso la biodegradazione che attraverso la diluizione, le concentrazioni delle sostanze possono essere mantenute entro livelli tollerabili. Quando l’apporto di sostanze inquinanti supera le capacità assimilatrici del corpo recipiente, o quando sostanze tossiche inibiscono l’azione mineralizzatrice dei microrganismi, si raggiunge il terzo e più grave livello di inquinamento, in corrispondenza del quale si manifestano con evidenza gli effetti negativi. Materiali galleggianti, come olii, grassi e schiume, materiali sospesi e sostanze coloranti modificano l’aspetto dell’acqua e ne ostacolano l’aerazione. Le sostanze organiche consumano l’ossigeno del corpo idrico, deprimendo la sopravvivenza di protozoi e pesci; alcune sostanze esercitano azione tossica di diversa gravità nei confronti di organismi animali e vegetali; elementi nutritivi come azoto e fosforo determinano crescite abnormi di vegetazione, soprattutto alghe. Ne risulta una profonda compromissione delle caratteristiche dei corpi idrici.
La compromissione dell’ecosistema è in realtà il risultato finale di una sommatoria di eventi, difficilmente identificabili singolarmente, che agiscono in modo cumulativo e sinergico in associazione al continuo utilizzo di risorse naturali (Bolognesi e Venier, 2004).
L’ecotossicologia si pone l'obiettivo di valutare gli effetti acuti e/o cronici di vari composti chimici e fisici sugli organismi viventi, considerati ai diversi livelli trofici dell'ecosistema. Questa disciplina valuta fenomeni di trasporto abiotico (volatizzazione, solubilizzazione, assorbimento, etc.) e biotico (catena alimentare). I fenomeni di trasporto e le relazioni trofiche ampliano molto la scala spaziale e temporale dell'inquinamento, per questo motivo ritroviamo inquinanti nell'acqua anche in zone non soggette ad inquinamento antropico diretto. Infatti la circolazione, la diffusione e l’accumulo selettivo dei contaminanti nei diversi comparti ambientali fanno sì che molti di essi si ritrovino anche in regioni remote come l’Artide o l’Antartide, anche se la loro concentrazione è più rilevante in aree particolari come ad esempio nel Mar Mediterraneo, bacino semichiuso e interessato da un intenso traffico marittimo, dove gli inquinanti si accumulano e persistono maggiormente.
La quantificazione del potenziale tossico di un inquinante per l'ambiente e per i sistemi acquatici in particolare è un'operazione essenziale nel processo di valutazione del rischio conseguente alla sua immissione (Mearelli, 2007).
1.2 Sedimenti
Il sedimento è una matrice ambientale composta da detriti, particelle organiche ed inorganiche ed è relativamente eterogeneo per quanto riguarda le sue caratteristiche fisiche, chimiche e biologiche.
La classificazione dei sedimenti è molto complessa. Ne esistono diverse, in base alla composizione, alla tessitura dei sedimenti, alla genesi e ai meccanismi deposizionali. La classificazione base è la seguente, che si riferisce fondamentalmente alla genesi e alla composizione dei sedimenti:
Sedimenti clastici, costituiti da frammenti derivati da sedimenti più antichi e rocce
erose; questi frammenti o particelle si dicono clasti. Tipici sedimenti clastici sono ghiaie, sabbie, silt, argille (e i loro corrispondenti litificati: conglomerati, arenarie, siltiti, argilliti). Questi sedimenti si classificano generalmente in base alle dimensioni dei clasti (granulometria). I sedimenti clastici sono di tipo diverso, a seconda della composizione originaria delle rocce smantellate (terrigena, carbonatica etc.).
Sedimenti chimici, a loro volta suddivisibili in:
Sedimenti carbonatici: costituiti prevalentemente da carbonati di calcio e magnesio, precipitati direttamente dalle acque o derivati da resti di organismi viventi (come ad esempio coralli, molluschi etc.). Si tratta principalmente di calcari, dolomie, che possono essere anche mescolati in parte con sedimenti clastici di natura terrigena (calcari argillosi e marne, calcari arenacei).
Sedimenti evaporitici: derivati dalla precipitazione diretta dei sali contenuti nelle acque (sia marine che lacustri), di solito in condizioni di clima arido, con assenza di
precipitazioni ed elevata temperatura. Tipici sedimenti di questo tipo sono i cloruri (ad esempio il sale o salgemma), i solfati (gesso, anidrite) e in parte i carbonati.
Sedimenti silicei: composti prevalentemente da silice amorfa idrata (opale). Sono sedimenti di natura bioclastica, cioè composti dai resti di organismi a scheletro o guscio siliceo (diatomee, radiolari, spugne silicee...), dai quali prendono spesso il nome; radiolariti, diatomiti, spongoliti, ma anche termini derivati dalla tradizione come ad esempio tripoli, farina fossile, diaspri.
Sedimenti ferro-manganesiferi: derivati da precipitazione chimica o biochimica. Abbastanza frequenti in sedimenti paleozoici e archeozoici (siderite, ankerite, ferro-ooliti).
Sedimenti alluminiferi: provengono dalla degradazione chimica in situ delle argille accumulatesi localmente in seguito alla dissoluzione di carbonati (lateriti e bauxiti).
Sedimenti fosfatici: costituiti da fosfato di calcio, prevalentemente di origine biochimica o organica (scheletri e parti dure di alcuni tipi di organismi e resti di deiezioni organiche, come i depositi di guano).
Sedimenti carboniosi: di origine organica, per riduzione di resti vegetali continentali (carbone, antracite, torba). Questo tipo di sedimenti caratterizza il periodo Carbonifero (o Carbonico), che prende nome dagli estesi giacimenti di carbon fossile di quell'età, ma è in realtà diffuso in tutta la storia della Terra.
Sedimenti bituminosi: sono di origine organica come i precedenti, ma da resti di organismi vegetali planctonici o di organismi animali. Questi sedimenti costituiscono le più importanti rocce madri (source rocks) degli idrocarburi liquidi (petrolio) e gassosi. Si tratta di depositi in genere associati a peliti e in generale a sedimenti argillosi
depostisi in bacini lacustri o marini, in condizioni di scarsa circolazione e stratificazione delle masse d'acqua, con stagnazione e scarsa ossigenazione al fondo (Casati, 1996).
È importante considerare, oltre agli input diretti dovuti a scarichi industriali, civili ed agricoli, le vie indirette o secondarie di contaminazione. Una volta giunti in acqua, i contaminanti tendono ad adsorbirsi parzialmente al particolato sospeso, mentre una frazione significativa resta disciolta. Ad ogni modo, gran parte dei contaminanti, dopo un periodo di tempo più o meno lungo, tendono a depositarsi ed accumularsi nel sedimento, che rappresenta quindi il luogo di raccolta e la sorgente della maggior parte del carico inquinante in ogni ecosistema acquatico.
I sedimenti possono accumulare, ad esempio, metalli in concentrazioni 10 volte superiori rispetto alla sovrastante colonna d’acqua, costituendo un’importante sorgente di contaminazione e rischio per gli organismi viventi. In particolare le aree marine, costiere, gli estuari, sono costantemente soggette all’introduzione di inquinanti naturali ed antropogenici.
Le specie bentoniche ed epibentoniche sono quelle maggiormente esposte ai contaminanti che provengono dai sedimenti, a quelli che sono adsorbiti alle particelle sedimentarie, come pure a quelli che sono disciolti nell’acqua interstiziale. Gli organismi pelagici sono esposti ai contaminanti legati al sedimento, tramite la catena trofica e/o dopo la rimobilizzazione dei contaminanti nell’acqua di mare. La contaminazione della colonna d’acqua avviene per diffusione e per risospensione dei sedimenti, mediante fattori naturali come la bioturbazione, le tempeste, il moto ondoso e l’azione delle maree, e mediante le attività umane come le operazioni di dragaggio (Geffard et al., 2007).
Sebbene i sedimenti possano contenere concentrazioni relativamente alte di composti tossici, questi non necessariamente determinano effetti dannosi sugli organismi marini.
Il destino dei contaminanti in un sistema acqua-sedimento dipende fortemente dalla capacità adsorbente del sedimento, che ne influenza la biodisponibilità e la tossicità. In particolare, i sedimenti a granulometria fine tendono ad accumulare i contaminanti, agendo come un importante serbatoio in grado di ridurre la potenziale tossicità dei contaminanti per gli organismi acquatici. Le concentrazioni chimiche misurate in campioni ambientali non sono degli accurati indicatori dei loro effetti biologici ed ecologici perché l’elemento chimico può essere biologicamente disponibile in un range che va dallo 0 al 100% della totale concentrazione; le risposte degli organismi viventi, esposti agli elementi tossici, dimostrano l’effettiva biodisponibilità di tali elementi. Il disturbo del sedimento porta a cambiamenti nelle proprietà chimiche del sedimento (Eggleton e Thomas, 2004). Cambiamenti sia nel potenziale redox che nel pH possono accelerare il desorbimento, la separazione, la degradazione batterica e l’ossidazione dei composti organici. Questi processi sono sia sedimento-specifici che composto-specifici. Condizioni di flusso più turbolente, associate a diluvi stagionali o tempeste, possono esporre i sedimenti anossici a condizioni ossigeniche. Anche il biodisturbo, dovuto alle attività degli animali bentonici (alimentazione, movimento e costruzione di tane) può inoltre introdurre acqua ricca di ossigeno nei più profondi sedimenti anossici (Eggleton e Thomas, 2004).
Lo strato di sedimento ossico spesso si estende per soli 2-5 mm al di sotto dell’interfaccia sedimento-acqua. Le ricerche hanno mostrato che gli ossidi e gli idrossidi di Fe e Mn, insieme alla materia organica sono importanti siti di legame per i metalli nei sedimenti ossici e che la formazione di solfuri domina nei sedimenti anossici (Eggleton e Thomas, 2004). Nei sedimenti anossici la presenza di solfuri (prodotti da batteri anaerobi) determina la formazione di complessi stabili Me-S che precipitano e rimangono stabilmente nel sedimento.
Durante i processi di rimobilizzazione, la risospensione dei sedimenti anossici nelle acque ossigenate determina l’ossidazione dei solfuri, che probabilmente rappresenta la maggiore sorgente di metalli in queste acque.
È impossibile campionare sedimenti senza alterarne la struttura e le caratteristiche chimico-fisiche in quanto il processo di rimozione è distruttivo di per sé. Campionamento, essiccazione, congelamento e conservazione al freddo influenzano la biodisponibilità dei contaminanti. Il tempo di conservazione dei sedimenti può variare da pochi giorni ad un anno e la refrigerazione dopo l’arrivo nei laboratori è generalmente effettuata a 4 °C. Si ritiene che i sedimenti non dovrebbero essere congelati ma mantenuti a 4 °C sotto vuoto o in atmosfera con N2 per non più di due
settimane prima del saggio. Il congelamento sembra essere implicato nell’aumento della perdita di carbonio organico solubile che potrebbe influenzare, in una certa misura, il comportamento dei contaminanti organici (Miniero et al., 2005).
Cambiamenti temporali significativi nella tossicità di campioni di sedimento contenenti metalli sono stati osservati in sedimenti conservati. Anche la biodisponibilità dei contaminanti organici cambia con il progredire del tempo di conservazione (Miniero et al., 2005).
Per gli studi ecotossicologici sui sedimenti, esistono varie modalità di preparazione dei campioni da analizzare:
- sedimento tal quale; - acqua interstiziale;
- estratto di sedimento (con solventi polari e non polari); - elutriato;
L’utilizzo delle differenti metodiche di preparazione dei campioni dipende dalla sostanza contaminante che si vuole rilevare e studiare (Lib e Ahlf, 1996; Chen e White, 2004; Nendza, 2001).
1.3 Elutriati
L’elutriato, o fase acquosa estraibile, è una matrice ambientale in grado di replicare i fenomeni di mobilizzazione del sedimento e di predire il rilascio dei contaminanti dal sedimento verso la colonna d’acqua. Questo tipo di preparazione è stato sviluppato inizialmente per la valutazione dei potenziali effetti di trasferimento del materiale dragato in mare aperto ed ora è applicato alla valutazione della qualità del sedimento in situ (Beiras et al., 2001; Lazorchak et al., 2003).
Mentre per le acque marino costiere questo approccio è oramai consolidato e ben definito nell’ambito di programmi previsti dalle Regioni e dal Ministero dell’Ambinte, per le acque dolci, solo in questi ultimi anni si stanno proponendo approcci simili che prevedono l’utilizzo dell’elutriato. L’importanza di questa metodica applicata anche per lo studio di acque dolci, deriva dal fatto che con l’elutriato è possibile verificare sia la quota idrosolubile dei microinquinanti aventi affinità per il sedimento, sia la loro potenziale rimobilizzazione nel corso dei frequenti eventi di piena (Leoni et al., 2008).
La procedura di elutriazione consiste in una vigorosa agitazione di una quantità determinata di sedimento, con una quantità nota di acqua di mare, così da permettere il rilascio degli inquinanti adsorbiti. Le analisi dei campioni di elutriato forniscono informazioni sui costituenti solubili in acqua che potrebbero essere rilasciati dal sedimento nella colonna d’acqua.
Sono stati proposti diversi metodi per la preparazione di elutriati. Le principali differenze consistono nel rapporto sedimento/acqua, nelle tecniche di agitazione del sedimento, nel tempo (che può variare da 30 min a 24 h), nella temperatura e nelle tecniche di centrifugazione del sopranatante. Il rapporto 1:4 è la proporzione più comunemente impiegata. Inoltre, si discute sulla possibilità di utilizzare il peso secco o
fresco nella proporzione sedimento/acqua. Sono stati condotti, fino ad ora, limitati studi per mettere in luce la migliore procedura capace di stimolare in modo naturale il fenomeno di risospensione del sedimento o per rendere gli inquinanti più biodisponibili. Il rapporto solido/soluzione influenza l’assorbimento della sostanza nel sistema test e non dovrebbe essere sottovalutato quando si effettuano estrazioni dei sedimenti come la preparazione degli elutriati.
Usando rapporti diversi per la preparazione di elutriati è stato visto che non sempre il rapporto 1:4 ha una maggiore capacità discriminatoria nel rivelare la tossicità del sedimento. Una possibile spiegazione al fatto che si osserva una maggiore tossicità negli elutriati con rapporto 1:20 e 1:50 è che volumi maggiori di acqua potrebbero facilitare il passaggio di sostanze tossiche dalla fase solida a quella liquida, rendendo più disponibili i contaminanti per il biota. D’altra parte, eccessivi volumi d’acqua potrebbero produrre effetti di diluizione, impedendo la valutazione della tossicità del sedimento, come presumibilmente avviene nel caso di un rapporto 1:200 (Arizzi Novelli et al., 2006).
Daniels et al. (1989) suggeriscono che il rapporto 1:4, piuttosto che 1:10 e 1:20, è il miglior modo di rendere biodisponibili i contaminanti. Al contrario, Da Ros et al. (1997) riportano che il rapporto 1:50 fornisce informazioni migliori sulla tossicità del sedimento rispetto alle proporzioni 1:5 e 1:200 e che, in accordo con le analisi chimiche, non c’è una diretta proporzionalità tra la risposta biologica ed il volume di sedimento.
Dopo l’agitazione del sedimento nel rapporto e per il tempo prescelto la fase acquosa viene separata dai sedimenti per centrifugazione e successiva filtrazione del sopranatante con filtri da 0,45 µm. La naturale presenza dei metalli nell’ambiente complica la stima della potenziale contaminazione del sedimento; la granulometria è probabilmente il più importante fattore che controlla le concentrazioni dei metalli nel
sedimento (Mucha et al., 2004). Bisogna inoltre tener presente che gli stessi fattori considerati importanti nel controllo delle risposte ecotossicologiche dei saggi classici, come l’alimentazione degli organismi e le condizioni chimico-fisiche, risultano altrettanto importanti nei saggi di tossicità con sedimenti e matrici assimilabili (Miniero et al., 2005).
Malgrado tutte queste incertezze, l’ESTT (Elutriate Sediment Toxicity Test) è considerato il miglior metodo per stimare la quantità di contaminanti che si scambiano tra il sedimento e la fase acquosa durante il dragaggio (Mucha et al., 2004).
Alcuni studi hanno dimostrato che gli elutriati sono molto più ricchi, rispetto all’acqua di mare, di metalli pesanti e ligandi organici capaci di legare fortemente i metalli pesanti. A questo proposito sono interessanti i risultati ottenuti da Mucha et al. (2003). Questi autori hanno utilizzato l’ESTT per confrontare la sensibilità di tre specie (Phaeodactylum tricornutum, Dunaliella minuta e Emiliania huxleyi) esposte a due elutriati di sedimenti estuarini, seguendo la crescita microalgale e la speciazione chimica dei metalli (uptake dei metalli pesanti e rilascio di essudati cellulari). I risultati hanno dimostrato che la quantità di ligandi organici presenti nei sedimenti influenza notevolmente la tossicità dei metalli pesanti, che può risultare ridotta quando prevale il sequestro extracellulare degli ioni metallici, o aumentata per la formazione di complessi metallo-ligando che aumentano la biodisponibilità dei metalli stessi.
L’interpretazione dei dati sperimentali è complessa a causa dei molti e variabili parametri implicati, la concentrazione di differenti metalli pesanti presenti nel mezzo e la rispettiva speciazione, che dipende dalla concentrazione dei rispettivi ligandi organici come pure dalla costante di stabilità del complesso che si è formato (Mucha et al., 2003).
E’ noto che la quantità di informazioni ricavabili da un test condotto su un estratto acquoso sia limitata, in parte a causa del metodo di estrazione che permette, per
definizione, principalmente il rilascio di contaminanti solubili in acqua, ed in parte a causa della manipolazione stessa del campione che ne altera la chimica (Geffard et al., 2007).
I test di tossicità hanno mostrato che la biodisponibilità dei metalli pesanti può dipendere da diversi parametri, come il carbonio organico disciolto o la materia particolata sospesa nell’elutriato, differenze nella granulometria delle particelle che costituiscono la maggior parte del sedimento, la presenza di altre sostanze chimiche che possono inibire o stimolare l’uptake, fattori esterni come la temperatura che influenza il grado di reazioni chimiche e biologiche e l’interfaccia biologica. La biodisponibilità dipende anche da caratteristiche proprie dell’organismo, come la diversa capacità di metabolizzare i contaminanti ( Eggleton e Thomas, 2004).
Uno dei migliori metodi per valutare la biodisponibilità dei contaminanti associati al sedimento è osservare il loro accumulo negli organismi (Geffard et al., 2003).
Mediante l’ESTT è possibile mettere in evidenza biomarker specifici che possono essere usati, insieme alla determinazione delle concentrazioni interne dei contaminanti, per valutare l’effetto subletale dei metalli (Geffard et al., 2006), oppure quello di sostanze organiche come gli idrocarburi ciclici aromatici (Geffard et al., 2003).
1.4 Area di studio
In questo paragrafo verranno presi in considerazione i vari aspetti dei fiumi, Arno, Morto e Serchio, che con i loro apporti influenzano notevolmente l’area geografica presa in esame per questo lavoro. Si tratta di comprendere i movimenti dei sedimenti trasportati dai corsi d'acqua, lungo la costa, ampliando il raggio di osservazione fino all’entroterra e ai bacini alimentatori, direttamente connessi con il litorale oggetto di
studio e con la pressione antropica insistente sia sulla costa che sui bacini stessi. Cercare di capire come i sedimenti vengono poi ridistribuiti dalle correnti lungo la costa e alle diverse profondità, ci aiuta a definire la distribuzione spaziale e le potenziali zone di accumulo di sedimenti arricchiti in metalli pesanti potenzialmente tossici.
Il bacino idrografico più rappresentativo della Regione Toscana, con un'estensione di circa 8.200Km2 (bacino imbrifero) e una lunghezza dell'asta principale di 241 Km, è quello del Fiume Arno. Il fiume ha origine sul versante meridionale del Monte Falterona, (a quota 1.385 m sul livello del mare), Appennino tosco-romagnolo, all'interno della Provincia fiorentina. Nella Provincia di Arezzo, dopo circa 60 Km dalla sorgente, si congiunge con il Canale Maestro della Chiana (tributario di sinistra). Presso San Giovanni Valdarno rientra in provincia di Firenze, percorre il Valdarno Superiore in direzione Sud-Est-Nord-Ovest sino a Pontassieve dove confluisce con la Sieve (principale affluente destro) e prosegue il suo corso piegando verso Ovest. Dopo Pontedera l'Arno corre verso la foce. Superata Pisa, attraversando un'ampia pianura costiera formata da secoli di alluvioni del fiume e da dune recenti con cordoni sabbiosi paralleli alla linea di costa, dopo 12 Km sbocca nel Mar Tirreno a Marina di Pisa con una foce a delta (Fig. 1.1). La Pianura pisana, può essere definita come una “pianura intermontana” originatasi da sprofondamenti all'interno della Catena Paleoappenninica. Essa è per la gran parte compresa nel Bacino Pisano Versiliese, fossa tettonica compresa tra il Monte Pisano e le Alpi Apuane ad Est e dalla Dorsale della Meloria-Maestra (sommersa dal mare) ad Ovest. Verso Sud i Monti Livornesi e quelli di Casciana Terme chiudono il bacino (Della Rocca et al., 1987).
Fig 1.1: particolare della foce dell’Arno.
Il bacino del fiume Arno comprende, nella parte terminale pisana, oltre al bacino idrografico definito in senso strettamente geografico, anche la zona racchiusa tra il Fiume Morto, a Nord, e lo Scolmatore, a Sud, inclusa l'area di bonifica di Coltano-Stagno ed il bacino del torrente Tora che viene fatto confluire nello Scolmatore, arrivando cosi ad occupare una superficie totale di 9.116 Km2 (Autorità di bacino del fiume Arno, 2007). Il territorio del bacino interessa la Regione Toscana (98,4%) e la Regione Umbria (1,6%) con le province di Arezzo, Firenze, Pistoia, Prato, Pisa e, marginalmente, Siena, Lucca, Livorno e Perugia. I principali affluenti sono: nella parte destra la Sieve, il Bisenzio, l'Ombrone, la Pescia; in quella sinistra il Canale Maestro della Chiana, il Greve, la Pesa, l'Elsa, l'Usciana e l'Era.
Presso la stazione di S. Giovanni alla Vena (Servizio Idrografico e Mareografico Regionale), località del comune di Vicopisano (PI) ad Est della città di Pisa, posta a circa 25 km di distanza dalla foce dell’Arno vengono rilevati i dati relativi ai parametri idrologici: portate medie di 90m³/sec (1931), portata minima 2,2 m³/sec (1931), portata massima 2.290 m³/sec (04/11/1966) (Autorità di Bacino del Fiume Arno, 2007). Pur essendo lontana dalla foce, questa località viene considerata per valutare la portata a
chiusura di bacino, poiché da questo punto in poi il corso dell’Arno è considerato pensile, cioè è situato ad un livello più elevato del territorio che attraversa e non può, ovviamente, ricevere altri apporti (Regione Toscana 2001).
Una grande parte del materiale apportato dall'Arno e trasportato verso nord, deriva probabilmente dall'erosione della foce nel lato settentrionale; a questi materiali si aggiungono i sedimenti derivanti dal Serchio (Gandolfi e Paganelli, 1975). Un ulteriore elemento di criticità di questa zona è il fenomeno della tendenza all’insabbiamento della foce. La corrente del fiume infatti, se si escludono i periodi di piena, non è in grado di contrastare fenomeni di innalzamento dei fondali in prossimità della foce stessa, che arrivano anche a profondità inferiori a 2 m.
Il bacino idrografico del fiume Serchio con i sui 1408 Km2, quasi tutti compresi all’interno della Provincia di Lucca, ed una lunghezza complessiva dell'asta fluviale pari a 102 Km circa, rappresenta per estensione il terzo bacino della Regione Toscana, dopo l'Arno e l’Ombrone (Autorità di Bacino del Fiume Serchio, 2007). Il Serchio ha origine dal Monte Romecchia (zona appenninica a 1007 m di quota) in Alta Garfagnana, anche se non è possibile individuare una vera sorgente, in quanto il fiume nasce da una fitta ragnatela di sorgenti e di infiltrazioni subalvee nessuna di importanza tale da poter essere identificata come la “sorgente madre”: soltanto oltre Piazza al Serchio, si forma veramente il fiume segnando con il suo corso, la naturale divisione tettonica fra il massiccio delle Apuane e la catena degli Appennini. Dopo la confluenza con la Lima (il suo maggiore affluente di sinistra proveniente dai monti dell’Abetone) il Serchio si rivela alla Pianura di Lucca. Dalla Piana di Lucca in poi il fiume scorre in un alveo artificiale e pensile fino alla foce, attraverso opere idrauliche fino a raggiungere l'attuale corso (Autorità di Bacino del Fiume Serchio, 2007). Giunge quindi nella Pianura di Pisa dirigendosi verso il Mar Tirreno, attraversando il sistema di dune costiere e deviando il
proprio corso verso Nord-Ovest all’interno della macchia di Migliarino-S.Rossore (Provincia di Pisa). Questa deviazione è verosimilmente imputabile all'azione continua delle correnti di deriva litoranea, agenti prevalentemente verso nord, che fanno ulteriormente deviare il corso del fiume nel tratto terminale (Fig. 1.2) prima di sfociare in mare (Autorità di Bacino del Fiume Serchio, 2007).
Fig. 1.2: Foce fiume Serchio
In relazione alle sorgenti antropiche, cioè all’insieme di rifiuti derivanti dalle principali attività umane, i carichi inquinanti si possono differenziare in: popolazione civile; attività industriali; attività zootecniche; attività agricola. Nella fattispecie le fonti dei metalli pesanti sono costituite prevalentemente dagli scarichi di industrie tessili, conciarie e galvaniche (Laterza, 2008) e da diversi prodotti di uso agricolo che vengono sversati in mare attraverso le vie fluviali.
Con 166 Comuni ricadenti nel bacino (Aut. B. F. Arno, 2007) ed una popolazione di 2.200.000 abitanti (ISTAT 1991) nel bacino dell’Arno si concentra il maggior carico inquinante dell’intera regione, circa il 60% del totale che assomma a oltre 12.000.000 di
Ab.Eq8. Tale carico deriva in gran parte dai due sottobacini della piana Firenze-Prato-Pistoia e dell’Usciana. Nonostante i miglioramenti a seguito degli interventi depurativi realizzati principalmente nelle aree del tessile (Prato) e del cuoio (Santa Croce sull’Arno), la qualità delle acque di questo corso d’acqua è sostanzialmente pessima: l'inquinamento aumenta passando dalla sorgente ai suoi tratti intermedi verso la foce. La maggior parte dell’inquinamento di origine agricolo-zootecnica è concentrato nella Val di Chiana. La quasi totale mancanza di impianti depurativi fa sì che il carico fortemente inquinante di prodotti fitosanitari e fertilizzanti, dovuto a queste attività venga diffuso quasi totalmente nell’ambiente. La Chiana raccoglie anche gli scarichi del versante aretino dell’Arno, di forte impatto sull’ambiente fluviale, in quanto provenienti dalle industrie galvaniche collegate all’attività orafa. Attraverso il Bisenzio e l’Ombrone, confluiscono in Arno gli scarichi sia civili che industriali (derivanti dal comprensorio del tessile) dell’area pratese. Il Bisenzio riceve anche le acque del Canale Macinante che veicola parte degli scarichi civili non depurati dell'area metropolitana di Firenze. L’Ombrone è interessato anche dall'apporto inquinante della provincia di Pistoia, in cui è fiorente l'attività vivaistica ed il conseguente uso di pesticidi e fitofarmaci. Nel bacino dell’Arno scaricano anche le 29 cartiere della Valdinievole nel pistoiese. Il territorio al confine tra Pisa e Firenze è interessato dalle attività industriale del comprensorio del cuoio che insiste sul Canale Usciana (collegato allo Scolmatore) e che, allo stato attuale, viene interamente trattato (Quaderno 1, Aut. B. F. Arno, 1993). Lungo il fiume Era sono presenti una ventina di insediamenti con lavorazioni galvanotecniche, lavorazioni secondarie del vetro e del marmo e metalmeccaniche (Piaggio ed il suo indotto), oltre ad una notevole presenza di attività zootecniche ed agricole. Gli studi geochimici condotti da Dinelli et al. (2005) sui sedimenti dell’Arno e sui suoi affluenti hanno dimostrato marcate anomalie nella concentrazioni di metalli pesanti (Ni, Cr, Cu, Pb, Zn), non riscontrate lungo l’asta principale del fiume.
Nel bacino del Serchio il carico inquinante complessivo (civile, industriale, agricolo, zootecnico, etc.) può essere stimato pari a 770.000 Ab.Eq., di cui 270.000 (ISTAT 1991) sono costituiti dalla popolazione residente. Sul bacino gravitano numerose attività produttive, in prevalenza cartiere, per lo più dotate di impianti di depurazione, che si concentrano soprattutto nella Media Valle del Serchio e nella piana di Lucca. Nella Garfagnana e nella Media Valle del Serchio vi è la presenza di due grossi insediamenti industriali uno metallurgico (caratterizzata da notevoli apporti inorganici) e l'altro adibito all'estrazione del tannino. In questa zona sono presenti vari insediamenti di dimensioni artigianali e medie di tipologia eterogenea: lavorazione del marmo, lavorazioni artistiche di metalli, tessile, oggettistica, officine meccaniche, aziende agricole, fonderie. Nella Piana di Lucca e nella parte costiera del bacino vi è la presenza di impianti di depurazione consortili, a cui sono allacciati, oltre agli scarichi di tipo civile, anche una discreta parte degli scarichi da attività produttiva (Aut. B. F. Serchio 1995).
Nel territorio del Comune di Lucca e del Comune di Capannori sono presenti due aree ad alta concentrazione industriale in cui sono situate quattro cartiere ed altre attività di varia tipo come aziende galvaniche. In tutto il bacino sono presenti attività artigianali e agricole. Il fiume Serchio riceve direttamente o indirettamente, tramite gli affluenti, gli scarichi dei reflui urbani della Garfagnana e della MediaValle. I reflui urbani di Lucca e della Piana, vanno a confluire rispettivamente nel canale Ozzeri, nel Rio Frizzone e nell’Emissario del Bientina. La qualità delle acque del fiume risente ovviamente delle caratteristiche del territorio attraversato: nella provincia di Lucca la qualità risulta buona (per l’elevata piovosità) mentre nel tratto più a monte, maggiormente antropizzato (territorio pisano), vi è un peggioramento man mano che ci si avvicina alla foce (Regione Toscana 2001-2004).
Il Fiume Morto è un antico corso d'acqua che ha inizio nel territorio del comune di Calci e riveste un'importanza rilevante sia dal punto di vista ambientale e paesaggistico, sia per la funzione idraulica che svolge nella pianura settentrionale pisana. Questo corso d'acqua caratterizza in modo particolare la Tenuta di San Rossore (Fig. 1.3), delimitando il confine tra i Comuni di Pisa e San Giuliano Terme. Il suo valore naturalistico si esprime con alcune peculiarità floro-faunistiche che qui trovano il loro habitat naturale. Nella sua parte finale il Fiume Morto Vecchio si introduce nel sistema dunale costiero che è una delle zone più ricche di biodiversità della Tenuta e dell'intero Parco di Migliarino, San Rossore, Massaciuccoli.
Fig. 1.3: Fiume Morto a San Rossore
Il territorio di Pisa è separato in due grandi zone: - la zona di Pisa a nord dell’Arno;
- la zona di Pisa a sud dell’Arno, che recapita le proprie acque nel canale dei Navicelli. In minima parte Pisa scola in Arno attraverso il fosso Demaniale del Mulino.
Nell’ultimo trentennio il bacino del fosso Ozeretto (sub-bacino del fiume Morto) ha subito un consistente aumento di portata affluente, derivante dallo sviluppo urbanistico delle zone di Cisanello, Pisanova e delle zone confinanti del Comune di San Giuliano Terme. Tale incremento di portata affluente, non è tuttavia coinciso con un corrispondente adeguamento della rete idraulica principale costituita dall’insieme dei canali ricettori della fognatura urbana (fosso Sei Comuni, fosso Marmigliaio, Fosso Ozeretto), che risulta sottodimensionata in relazione ai maggiori apporti urbani. In conclusione, il Fiume Morto raccoglie numerosi piccoli affluenti, tra cui i fossi e i canali di bonifica. Sversa in mare scarichi domestici urbani, acque irrigue ricche di composti organici ed inorganici, presenti nei fertilizzanti e nei pesticidi, nonché scarichi di officine meccaniche e di piccole aziende agricole.
1.5 Tossicità
La tossicologia ambientale è definita come l’identificazione e quantificazione dei danni prodotti sui sistemi biologici a diverso livello di organizzazione, in seguito all’esposizione ai contaminanti ambientali (Mearelli, 2007; Debus, 2004).
Si parla infatti di inquinamento di un sistema ambientale in presenza di un effetto tossico, misurabile come danno, a carico di un sistema biologico, che influisce sulle attività biochimiche, sulle cellule e sui tessuti. Inoltre il danno può interessare l’intero organismo, fino ad arrivare ad alterazioni di popolazione e della comunità biologica (Fossi, 2000).
La tossicità di una sostanza è una caratteristica sia qualitativa, in quanto l'azione tossica dipende dall'interazione della struttura molecolare con le molecole biologiche, che
quantitativa, in quanto l'azione tossica si manifesta solo quando si superano determinati livelli di concentrazione nell'ambiente o in alcuni organi dell'organismo. Due misure fondamentali sono l'esposizione, cioè la quantità di sostanza disponibile ad entrare nell'organismo, e la dose, cioè la quantità di sostanza che effettivamente entra nell'organismo. Dalla misurazione della concentrazione del composto tossico e dalla durata dell’esposizione, si può ricavare la LC50, (concentrazione letale mediana) che corrisponde alla concentrazione che provoca la morte del 50% degli organismi utilizzati dopo periodi di tempo specifici (es.,48, 96 ore).
E’ molto importante, quando si parla di tossicologia ambientale, distinguere la tossicità di una sostanza dalla sua pericolosità. Infatti un composto può essere molto tossico, perché una piccola quantità è in grado di danneggiare un sistema biologico, ma può essere poco pericoloso perché la probabilità che i due soggetti (tossico-sistema biologico) vengano in contatto è trascurabile. Al contrario una sostanza può essere poco tossica ma molto pericolosa, come ad esempio il ruolo dei nutrienti nei processi di eutrofizzazione, che possono interessare un intero ecosistema (Mearelli, 2007).
Si parla di tossicità acuta per risposte che si manifestano in tempi relativamente brevi, e di tossicità cronica per risposte che si rendono palesi dopo tempi prolungati.
Effetto e risposta in ecotossicologia possono essere definiti come segue:
- l’effetto indica il tipo di danno, ovvero la funzione biologica compromessa (come la sopravvivenza, la motilità, la velocità di crescita);
- la risposta è la quantificazione dell’effetto, e viene generalmente espressa come % di incidenza in una certa popolazione (ad esempio un certo numero di animali da esperimento).
L’esplicarsi dell’effetto tossico di una sostanza chimica è funzione di diversi fattori che dipendono dalle caratteristiche intrinseche della sostanza in esame, dalle caratteristiche del sistema biologico esposto, sia a livello di individuo che a livello superiore di
organizzazione (popolazione, comunità, ecosistema), nonché da fattori ambientali che possono alterare l’attività della sostanza (Marangi, 2007).
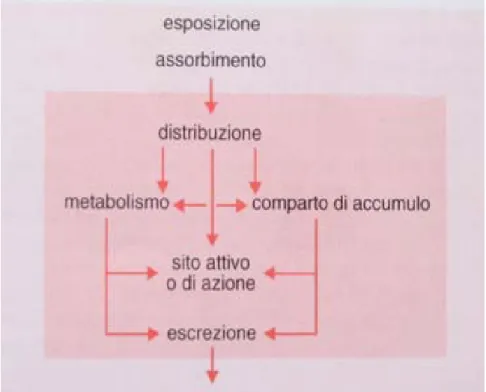
In figura 1.4 è illustrato lo schema del destino di un composto chimico in un sistema biologico. Con quest’ultimo termine si intende sia una singola cellula che strutture più complesse quali un animale o una pianta.
Figura 1.4: Schema generale del destino di un composto chimico in un sistema biologico (singola cellula o intero organismo).
Il modello rappresentato, seppure molto semplificato, identifica i processi più importanti da un punto di vista tossicologico, la cui interazione produce o meno l’effetto tossico, ovvero l’ingresso, la distribuzione, l’accumulo, il metabolismo e l’escrezione di una sostanza tossica.
Di norma si può assumere che esista un livello di soglia al di sotto del quale una sostanza non produce nessun effetto negativo. Basti pensare a sostanze naturali come alcuni metalli pesanti che esplicano un ruolo di micronutrienti, la cui assenza potrebbe
addirittura provocare fenomeni di carenza. Superata tale soglia si entra in una fase nella quale l’organismo mette in funzione i suoi meccanismi di difesa e di detossificazione. Finché questi meccanismi sono sufficienti a contrastare l’azione della sostanza si potrà verificare un maggior dispendio energetico da parte dell’organismo ma non si manifesterà nessun effetto negativo. L’esposizione a sostanze tossiche, in questa fase, può essere messa in evidenza per mezzo di metodi di diagnosi precoce come i “biomarcatori”.
Quando i meccanismi di difesa non sono più sufficienti a compensare l’azione tossica, si verifica l’effetto che dà origine inizialmente a manifestazioni croniche e, a dosi più elevate, a fenomeni di tipo acuto.
Per i contaminanti genotossici si possono allestire dei saggi in vitro utilizzando campioni ambientali in modo da rilevare il danno genetico indotto dopo l’esposizione in organismi sentinella. Evidenze di questo tipo sono un segnale di allarme per le possibili conseguenze a lungo termine, definite dall’instaurarsi di cambiamenti nelle popolazioni, nelle specie e nelle comunità degli organismi esposti (Bolognesi e Venier, 2004).
1.6 Biomarcatori
Negli ultimi anni è sorta l’esigenza di affiancare ai comuni metodi di indagine strumentale altre metodologie di tipo biologico, che osservano le variazioni delle popolazioni animali e vegetali, senza perdere di vista che la diversità biotica – intesa come prodotto delle interazioni fra evoluzione biologica e variazione dei parametri ambientali – non dipende solo dagli inquinanti. Le analisi chimiche caratterizzano i livelli di contaminanti del mezzo (acqua o sedimento), ma sono inadeguate a stimare la qualità biologica di una zona che si sta studiando. Solo i sistemi viventi sono capaci di integrare i vari effetti dei contaminanti che sono realmente biodisponibili (Geffard et al., 2007). Tale metodica va sotto il nome di "Biomonitoraggio". Si basa sulla regolare e sistematica valutazione delle condizioni dell’ambiente mediante un insieme di procedure che utilizzano specie animali o vegetali per misurare l’impatto degli agenti inquinanti nell’ambiente. Si tratta di organismi viventi "sensibili”, in grado cioè di fungere da indicatori del degrado della qualità ambientale dovuto all'inquinamento. In molti paesi il biomonitoraggio ambientale è ormai diventato una prassi costante e riconosciuta anche a livello istituzionale. Quando i contaminanti non sono letali, oppure non agiscono perché si trovano in forma insolubile, si accumulano e permangono in particolari organismi, che pertanto vengono utilizzati come biocampionatori. Attraverso questi organismi è possibile ottenere anche dati diretti, qualitativi e quantitativi, su specifici contaminanti. Essi si comportano infatti come delle vere e proprie" centraline naturali" di rilevamento: essi sono capaci di accumulare e trattenere al loro interno elevate concentrazioni di inquinanti persistenti, come ad esempio metalli pesanti, senza subire danni a breve-medio termine.
Tutti questi sistemi biologici, in condizioni di stress ambientali, generano quindi risposte identificabili come cambiamenti a livello morfo-funzionale, cellulare,
biochimico e molecolare. Si è, dunque, pensato di utilizzare le risposte che un organismo bioindicatore genera nei confronti degli insulti chimici ambientali, come possibili strumenti diagnostici e di prognosi di salute ambientale: nascono così i biomarcatori(Fossi, 2000).
Il biomarcatore si definisce come: “quella variazione biochimica, cellulare, fisiologica o comportamentale, che può essere misurata in un tessuto, in un fluido biologico o a livello dell’intero organismo (individuo o popolazione) la quale fornisce l’evidenza di un’esposizione e/o un effetto ad uno o più composti inquinanti” (Depledge, 1994).
I biomarcatori possono essere suddivisi in tre classi:
- biomarcatore d’esposizione: è la risposta di un organismo che indica la presenza di uno o più composti xenobiotici o dei loro metabolici. Consente di stimare o confermare l’esposizione di individui ad una particolare sostanza, fornendo un legame tra esposizione esterna e dose interna. Non fornisce però indicazioni dei reali effetti tossicologici sull’organismo.
- biomarcatore d’effetto: è una modificazione biochimica, fisiologica o cellulare misurabile in un tessuto o in un fluido corporeo, associata ad un possibile o effettivo stato di malattia. Sono utilizzati per evidenziare effetti dovuti all’esposizione e all’assorbimento di una sostanza chimica.
- biomarcatore di suscettibilità: si riferisce all’innata o acquisita capacità di un organismo a rispondere ad una specifica sostanza xenobiotica.
In base alla loro specificità di risposta nei confronti di composti inquinanti, i biomarcatori possono essere specifici o generali:
- specifici: rappresentano l’insieme di risposte molecolari e biochimiche che si manifestano in seguito all’esposizione ad una specifica classe di contaminanti ( es. induzione delle metallotioneine da parte di metalli pesanti).
- generali: sono risposte dell’organismo a livello molecolare, cellulare e fisiologico che non possono essere ricondotte ad uno specifico contaminante, ma rappresentano uno stato generale di stress dall’organismo come ad esempio danni al DNA (La Rocca, 2004).
I parametri di danno genetico più comunemente utilizzati negli studi di monitoraggio ambientale sono riferibili ad alterazioni molecolari come addotti al DNA, lesioni ossidative e rotture della doppia elica, formazione di micronuclei e aberrazioni cromosomiche (Bolognesi e Venier, 2004).
La misura degli addotti di DNA rappresenta un indice dinamico della dose al bersaglio di composti chimici DNA-reattivi. Per mezzo di tecniche come l’elettroforesi, utilizzate ad esempio nel Test “della cometa”, è possibile analizzare eventuali rotture del DNA, utilizzando in diversi sistemi cellulari. Il Test del “micronucleo” è un test che consente di valutare eventuali errori nell’interfase della meiosi. E’ un test di facile applicazione ed è stato proposto come biomarcatore rapido e a basso costo della contaminazione da agenti genotossici. Per quanto riguarda l’utilizzo dei biomarcatori per lo studio sulle aberrazioni cromosomiche, che riguardano rotture o riarrangiamenti cromosomici, esistono delle limitazioni dovute al ristretto numero di tessuti e/o specie da applicare negli studi di laboratorio (Bolognesi e Venier, 2004).
Il biomonitoraggio mediante biomarcatori presenta diversi vantaggi:
- precocità della risposta;
- rileva l’effetto sinergico degli inquinanti;
- rileva l’inquinamento anche quando la causa è scomparsa.
Tuttavia esistono anche dei limiti al loro impiego, dovuti principalmente all’influenza che le condizioni chimico-fisiche ambientali esercitano sui vari organismi sentinella (Sartor, 2006).
L’idea di utilizzare i biomarcatori nel settore delle indagini tossicologiche è nata negli anni settanta con ricerche in ambiente marino e negli ultimi decenni ha trovato applicazione in tutte le problematiche ambientali.
1.7 Metalli pesanti
I metalli sono elementi chimici presenti come componenti naturali delle acque e dei sedimenti e molti di loro sono indispensabili per le attività vitali. Di notevole interesse a causa della loro tossicità, sono i metalli pesanti, elementi con una densità maggiore di 5 g cm-3 (Zenk, 1985). Essi sono scarsamente soggetti ai processi di decomposizione microbica e di degradazione fotochimica e quindi permangono nel suolo.
I metalli pesanti una volta immessi nell’ambiente tendono a permanervi, secondo diversi fattori d’accumulo. Da diversi decenni, la loro concentrazione è aumentata notevolmente in alcune aree, soprattutto in corrispondenza di grandi agglomerati urbani ed insediamenti industriali. Le più importanti fonti di immissione dei metalli pesanti nell’ambiente marino sono gli sversamenti fluviali, depositi atmosferici ed apporti della geosfera (per esempio attraverso meccanismi d’erosione).
I metalli pesanti comprendono sia elementi essenziali richiesti nei processi biologici, sia metalli non essenziali o con funzioni biologiche sconosciute. Essi vengono anche definiti come metalli “traccia”, perché in condizioni fisiologiche sono presenti negli organismi in quantità limitata.
Sono divisi in due classi: Zn, Cu, Fe, Mn, Mg e Co, che a basse concentrazioni si comportano come micronutrienti essenziali per la vita (presenti in proteine, come fattori di trascrizione, come enzimi, catalizzatori, cofattori etc…), e sono tossici solamente a concentrazioni elevate.
La seconda classe include Cd, Hg, Cr e Pb, i quali non sembrano esplicare alcuna funzione biologica e risultano tossici, e a volte letali anche a basse concentrazioni. I metalli pesanti come il Cu, Zn, Cd, Co e il Hg, non sono biodegradabili, né possono essere metabolizzati in prodotti meno dannosi. La detossificazione da parte degli organismi avviene attraverso il legame con agenti chelanti, come le metallotioneine , in grado di bloccare il metallo formando complessi stabili e idrosolubili, più facilmente eliminabili. Un altro meccanismo di detossificazione prevede il loro deposito in forma insolubile nei granuli intracellulari (La Rocca, 2004).
Negli ultimi decenni i flussi litosfera-biosfera, litosfera-atmosfera, atmosfera-biosfera, relativi a diversi metalli pesanti come il Pb e il Cd, sono aumentati superando abbondantemente quello naturale (Salomon, 1984). Le cause principali sono da attribuire alla crescente domanda di prodotti contenenti questi elementi utilizzati nelle lavorazioni industriali, in agricoltura, nelle attività minerarie, siderurgica, nella produzione e nello stoccaggio dei relativi rifiuti. I metalli pesanti presenti nel suolo o nei sedimenti possono esistere come specie chimiche diverse. In condizioni di scarso inquinamento, si trovano principalmente sotto forma di silicati e minerali primari
pressoché immobili. Nelle zone soggette ad inquinamento, i metalli in tracce sono pesenti in altre forme mobili e quindi più disponibili.
Processi biologici e chimico fisici determinano un accumulo dei metalli pesanti nel sedimento, con la conseguenza che lo studio delle concentrazioni in questa fase del sistema marino riveste un’importanza notevole (Buccolieri et al., 2005; Bertolotto et al., 2005). È possibile esaminare solo la parte più superficiale del sedimento, per uno spessore di qualche centimetro, in modo da effettuare un’indagine sulla vita recente del sedimento. Questa procedura fornisce informazioni sullo stato d’inquinamento "attuale" del sedimento.
Per effetto di attività antropiche, la concentrazione di metalli pesanti può aumentare di vari ordini di grandezza e, direttamente o attraverso la catena alimentare, i metalli possono accumularsi nei tessuti degli organismi viventi. Gli organismi fotosintetici sono i principali punti d’ingresso dei metalli nella catena alimentare. La presenza di elementi metallici nei sistemi acquatici, in quantità che superano le concentrazioni naturali, può incidere negativamente non solo sulle singole specie ma anche sull’equilibrio ecologico dell’intera catena trofica.
Nella matrice acquosa questi metalli si trovano sotto forma di ioni metallici e/o legati al particolato organico ed inorganico. La composizione chimica e le caratteristiche idrologiche della colonna d’acqua, insieme alla concentrazione di materia organica disciolta e di ossigeno, influenzano la speciazione dei metalli, la loro biodisponibilità (intesa come tendenza di una sostanza ad essere assorbita) ed il loro eventuale bioaccumulo. I metalli in ambiente acquatico si possono trovare in forma solubile (cioè non sono trattenuti da filtri di 0,45 µm di porosità) oppure legati a particelle (in questo caso sono trattenuti da filtri di 0,45 µm) (figura 1.5). Tra le forme solubili si trovano metalli in forma di ione idratato e spesso, si trovano complessati con vari composti: - possono formare ossidi e questi essere idratati;
- possono essere complessati con molecole organiche, come piccoli amminoacidi; - possono essere complessati con composti inorganici di vario tipo (solfuri, cloruri,…); - possono essere complessati con molecole più grandi, come acidi umici e fulvici, polimeri molto eterogenei che hanno una spiccata attitudine a complessare i metalli (Twiss et al., 2000).
Fig 1.5: Gli ioni metallici tendono ad adsorbirsi alle particelle del sedimento e formano complessi solubili con i ligandi.
La distribuzione dei metalli solubili nella colonna d’acqua, in base alla tendenza che hanno nel formare dei complessi con il materiale particellato, può essere semplificata come segue:
- la loro concentrazione rimane costante con la profondità (i metalli conservativi). Essi presentano una bassa reattività ossia una scarsa tendenza a legarsi al particellato e quindi tendono a perdurare in forma solubile e a ripartirsi uniformemente in tutta la colonna d’acqua: si comportano come i componenti principali dell’acqua di mare.
- con l’incremento della profondità la concentrazione della forma solubile aumenta: un caso interessante è quello di metalli che hanno un comportamento simile ai macronutrienti (N e P). Il fosforo e l’azoto nella colonna d’acqua presentano delle concentrazioni più basse nella zona fotica perché vengono assunti dal fitoplancton; in profondità le concentrazioni sono più alte in seguito alla mineralizzazione del plancton che precipitando viene degradato dai batteri: NO3- ed PO43- sono nuovamente
disponibili nella colonna d’acqua in forma solubile. Metalli come il Cd hanno un identico comportamento. La colonna d’acqua nella zona superficiale è povera di Cd ma sotto i 1000 m si arricchisce di questo elemento le cui concentrazioni, da questa profondità, rimangono costanti. La ragione di tale distribuzione sta nel fatto che questo elemento ha un’alta affinità col materiale particellato di origine biologica: il fitoplancton (soprattutto in presenza di un bloom algale) assimila in modo cospicuo il Cd, così come fa con i macronutrienti, e ha una spiccata attitudine a tenerlo legato (Morelli, et al., 2008). In pratica il Cd viene sequestrato all’acqua ed entra a far parte delle cellule. Questo comportamento simile a quello dei macronutrienti determina il fatto che il Cd sia più disponibile nelle zone di “upwelling”, ovvero dove c’è una risalita delle acque profonde.
- con l’aumento della profondità la concentrazione della forma solubile diminuisce: il Pb, per esempio, mostra un’attitudine ad essere più concentrato nella zona superficiale, quindi più vicino alla sorgente di apporto, quali l’atmosfera ed il suolo, questo perchè ha alta affinità per il materiale particellato.
La biodisponibilità di un metallo è data principalmente dalla sua attività come ione libero, piuttosto che dalla sua concentrazione totale o dei suoi specifici complessi organici.
Inoltre, in ambiente marino l’interazione tra comunità biologiche e metalli in tracce è reciproca, cioè non solo questi ultimi influenzano il biota ma a sua volta il biota può influenzare la composizione chimica del pool dei metalli, generando così un meccanismo di feed-back.
1.8 GENOTOSSICITA’ E CANCEROGENICITA’ DEI
METALLI PESANTI
L’interazione dei metalli pesanti cancerogeni con gli organismi viventi è un problema molto complesso.
Diversi metalli pesanti, tra i quali ad esempio Arsenico, Cromo, Cadmio e Piombo, sono classificati come cancerogeni per l’uomo dalla International Agency For Research On Cancer (I.A.R.C.).
Il meccanismo di cancerogenesi di alcuni di essi è stato recentemente descritto da Beyersmann e Hartwig (2008).
Secondo questi autori, la genotossicità dei metalli pesanti è causata da meccanismi indiretti. Considerando le diverse proprietà chimico-fisiche dei composti metallici, emergono tre meccanismi predominanti:
- l’interferenza con la regolazione del potenziale redox cellulare e l’induzione di stress ossidativo, che possono causare danno ossidativi al DNA;
- l’inibizione dei sistemi di riparazione del DNA, che determina instabilità gnomica ed accumulo di mutazioni;
- la deregolazione dei segnali di proliferazione cellulare e/o l’inattivazione dei segnali di controllo della crescita cellulare quali i geni “soppressori tumorali” (Beyermann e Hartwig, 2008).
1.8.1 Cadmio
Il cadmio, metallo dotato di elevati effetti tossici, non possiede alcun particolare ruolo fisiologico, ed associa un accumulo preferenziale nei tessuti molli ad un’emivita prolungata in rapporto alla sua scarsa eliminazione dall’organismo.
Dagli studi condotti è emerso che il metallo è presente nel suolo a concentrazioni variabili da 0.15 a 0.50 ppm, mentre nelle acque marine la sua concentrazione media ammonta a 0.3 ppb (Venugopal e Luckey, 1978).
Questo elemento trova applicazioni in molteplici settori, spaziando dalla produzione di batterie alcaline, di leghe, di pigmenti, all’impiego in agricoltura, essendo un componente principale dei fertilizzanti fosfatici. E’ inoltre utilizzato nella fabbricazione di plastiche viniliche e largamente impiegato nei processi di cadmiatura.
Gli usi industriali, insieme all’incenerimento dei rifiuti e alla combustione di gasolio, sono una delle principali fonti di inquinamento da Cd, che di conseguenza, si trova in maggior quantità in aree industrializzate (1-50 ng/m3 ) rispetto ad aree rurali (0,1-6 ng/ m3).
Il Cd metallico è molto reattivo, ossidandosi lentamente già a temperatura ambiente, e quasi tutti i suoi composti sono solubili in acqua, causando il rischio costante di rilascio accidentale nell’ambiente durante il suo impiego nel settore industriale.
Diversi studi testimoniano come il cadmio interferisca con le attività del calcio attraverso un suo rilascio dai siti di deposito intracellulare ed un aumento dei livelli di inositol-fosfatasi, probabilmente a seguito di un’interazione con un recettore di membrana (Smith et al., 1989; Chen e Smith, 1992). Inoltre, il cadmio può sostituirsi al calcio nel legame alla calmodulina ed essendo quest’ultima una proteina preposta alla regolazione di numerosi processi dipendenti, ciò si traduce in un’azione calcio-agonista da parte del metallo, con conseguente attivazione o inibizione, in funzione della sua concentrazione, degli enzimi calmodulino-sensibili, quali la fosfodiesterasi e l’adenosin-trifosfatasi Ca/Mg dipendente (Akerman et al., 1985; Richard et al., 1985). Questo metallo, inducendo l’attività della eme-ossigenasi, porta ad un conseguente incremento nella degradazione dell’eme, che a sua volta è responsabile di una riduzione dell’attività dell’ossidasi a funzione mista e del contenuto di citocromo P450.
L’esposizione al cadmio comporta infine un aumento nella formazione di radicali superossido, che hanno dimostrato di indurre rotture del singolo filamento di DNA e perossidazione lipidica in vitro e nei tessuti “target” (Amoruso et al., 1982; Ochi et al., 1983; Wahba e Waalkes, 1990).
Nel corso degli anni sono stati effettuati test sul lievito S. cerevisiae, che si è dimostrato particolarmente adatto per la determinazione dell’attività genotossica di matrici complesse, derivanti dall’industrializzazione e dallo sviluppo di nuove sostanze chimiche (Schmitt, Gellert et al., 2005). Brennan e Schiestl (1996) hanno dimostrato che il Cd induce uno stress ossidativo nel lievito S. cerevisiae, che può essere responsabile dell’attività di ricombinazione genica. E’ stato inoltre riscontrato un elevato potenziale citotossico del Cd che limita notevolmente la crescita cellulare del lievito, in seguito al bioassorbimento di questo elemento (Dostalek et al., 2004).
Il cadmio può, in ceppi batterici, essere un potente agente mutageno e genotossico (Ferm e Layton, 1981). Gli studi effettuati in questo senso hanno messo in evidenza una
positività ai test di mutagenesi eseguiti con ceppi di Salmonella ed alterazioni nel numero di cromosomi, evidenti già dopo 12 ore, a seguito di trattamenti per via sottocutanea condotti nel topo con concentrazioni di Cd pari a 3-6 ppm e in criceti con concentrazioni di 1.5-3 ppm, (Ferm e Layton, 1981). Sono stati osservati anche eventi di reversione in V. visceri tramite il test Mutatox della bioluminescenza (Scarpato, 2004). Inoltre, dalla sperimentazione su organismi vegetali come L. sativum sono stati registrati diversi effetti fitotossici, quali la diminuzione della germinazione e della lunghezza radicale (Kusza et al., 2006). Studi effettuati su V. faba hanno rilevato danni fitotossici simili ai precedenti ed in aggiunta sono stati valutati eventuali effetti citotossici, presenti già a basse concentrazioni di Cd, e la misura delle fitochelatine prodotte, per analizzare i meccanismi di induzione molecolare (Beraud e Ferard, 2006).
Nelle cellule di mammifero sono state infine rilevate rotture nella singola elica di DNA, provocate dal cadmio (Coogan et al., 1992).
Il Cd è stato classificato come cancerogeno per l’uomo dalla International Agency For Research Of Cancer (IARC).
I principali effetti dovuti all’esposizione a questo metallo sono: disturbi al sistema nervoso centrale, disturbi a livello olfattivo, osteomalacia, disfunzioni del fegato e anemia.
Nell’uomo l’esposizione al Cd è associata a cancro della prostata e del fegato.
Il meccanismo d’azione è ancora sconosciuto, ma l’interazione del metallo, sia diretta che indiretta, con il DNA è stata evidenziata con l’ausilio di test su topi maschi, effettuati tramite inalazioni di Cd dai quali è risultato un danneggiamento del DNA (Valverde et al., 2001). A livello cellulare, l’azione indiretta del cadmio genera specie reattive dell’ossigeno (ROS) e danni al DNA. Inoltre modula l’espressione genica e la trasduzione del segnale e riduce l’attività delle proteine coinvolte nella difesa dello stato ridotto della cellula (Bertin e Averbeck, 2006).
E’ interessante il fatto che il Cd non è direttamente genotossico in alcuni sistemi cellulari. A concentrazioni molto basse (1 μM) si è rivelato mutageno nel lievito, tramite l’inibizione dei meccanismi di soppressione della mutazione, piuttosto che mediante un danno diretto sul DNA (Bertin e Averbeck, 2006).
Test in vitro su colture cellulari di mammifero hanno evidenziato che i composti del cadmio provocano rotture nella doppia elica del DNA, mutazioni geniche ed aberrazioni cromosomiche, mentre composti solubili del Cd saggiati tramite test sui batteri si sono rilevati non mutageni (Hartwig, 2008). Poiché i sali di Cd non causano danni su estratti cellulari o su DNA isolato dalle cellule (Valverde et al., 2001), la genotossicità può essere spiegata mediante meccanismi indiretti come:
- produzione di specie reattive dell’ossigeno (ROS); - inibizione dei sistemi di riparazione del DNA;
- deregolazione della proliferazione cellulare (Beyersmann e Hartwig, 2008; Waisberg et al., 2003).
Un’assunzione del metallo da parte degli organismi viventi può essere influenzata da numerosi i fattori sia fisici che chimici: fra questi ricordiamo soprattutto la possibilità di adsorbimento e di rilascio da parte di componenti del terreno, il suo pH, il potenziale redox, la struttura chimica, ecc. (Eisler, 1985).
In ambiente acquatico i fenomeni di adsorbimento e di conseguente concentrazione del Cadmio nei fondali sembrano strettamente legati alla natura dei fondali stessi (Gardiner, 1974).
La quantità di cadmio disciolto in forma ionica altamente biodisponibile sembra essere influenzato positivamente dalla quantità di ossigeno disciolto: una condizione di anaerobiosi riduce infatti tali livelli e determina un aumento della frazione legata alle particelle sospese, non biodisponibile (Eisler, 1985).
Un certo ruolo nell’incrementare i livelli e la biodisponibilità di cadmio nelle acque e nei suoli, può averlo anche il rilascio delle quantità di metallo accumulate nel tempo dalle macrofite, che avviene dopo la loro morte (Eisler, 1985). La biomagnificazione del cadmio è più importante nei livelli inferiori delle catene trofiche (Ferard et al., 1983). Gli organismi marini, generalmente, poiché vivono in acque più dure, presentano una maggior resistenza rispetto agli organismi d’acqua dolce: sintomi di tossicità, infatti, compaiono per valori pari a 1.2-50 ppb di Cd per i primi e a 4-470 ppt per i secondi (Wayland, 2000).
Wayland riporta una concentrazione renale di 100 ppm come valore soglia di tossicità per le specie marine, che scende a 30 ppm per i mammiferi, anch’essi resistenti al metallo. Nelle specie acquatiche, a seguito di esposizione cronica al cadmio, si osserva una ridotta crescita e inibizione della riproduzione. Nell’edredone poi si sono individuate correlazioni tra i livelli di corticosterone (ormone coinvolto con la risposta allo stress e nel metabolismo intermedio) e quelli di cadmio, suggerendo un certo ruolo del metallo nel metabolismo e nell’accumulo del glucosio e del glicogeno.
1.8.2 Piombo
Il piombo è un elemento che può agire come veleno interferendo con svariati sistemi metabolici, in particolar modo nelle forme di intossicazione ad andamento cronico e come agente mutageno, cancerogeno e teratogeno, mentre non esiste alcuna segnalazione, reperibile in letteratura, che ne indichi un ruolo fisiologico (Eisler, 1988). Le concentrazioni medie di piombo presenti nella crosta terrestre sono piuttosto basse, pari a 15-16 mg/kg e il piombo si rinviene in numerosi minerali, come la galena (PbS), che rappresenta la fonte primaria di piombo allo stato naturale, l’angelesite (PbSO4) e la
cerusite (PbCO3) (EPA, 1980). Il piombo è pressoché ubiquitario ed è utilizzato in una grande varietà di prodotti (Ensley, 2003). In ambito industriale il metallo e i suoi composti trovano impiego nella produzione di batterie in leghe con antimonio, stagno e rame, nell’allestimento di pigmenti per vernici e per l’industria ceramica; ancora è utilizzato nelle attività di smaltamento dei metalli, mentre è stato abbandonato il suo impiego come insetticida (arseniato di piombo), nella produzione delle plastiche (borato di piombo) e nella fusione dei caratteri di stampa. Il suo uso come piombo tetraetile e tetraetile, quale antidetonante nelle benzine può essere ricordato, tra gli altri, come fonte di inquinamento ambientale, anche se oggigiorno questa va rivestendo importanza sempre minore in ragione di una sua ridotta presenza nei carburanti (Beretta, 1994; Eisler, 1988).
Il piombo lega fortemente i gruppi tiolici (SH), fosforici (PO4) e carbossilici (COOH) di numerosi ligandi di natura proteica ed in particolare degli enzimi presenti nei globuli rossi, con conseguenti alterazioni funzionali e strutturali. Il legame alle proteine eritrocitarie comporta infatti un aumento di fragilità osmotica dei globuli, in seguito ad un’alterata permeabilità di membrana e al blocco dell’ATPasi Na/K; ciò induce a decrementi delle dimensioni globulari, per perdita di potassio ed acqua (Lessler e Walters, 1973; Venugopal e Luckey, 1978). L’azione inibente l’attività di enzimi interessati alla sintesi dell’eme, quali la deidratasi dell’acido δ-aminolevulinico (ALAD), la coproporfirinogeno decarbossilasi e la ferrochelatasi (eme sintetasi), che caratterizzano rispettivamente la trasformazione dell’acido δ-aminolevulinico in porfobilinogeno, del coproporfirinogeno in protoporfirina e di quest’ultima in eme, rinforza l’influenza espletata dal piombo sulla crasi ematica. L’accumulo plasmatico di acido δ-aminolevulinico e di coproporfirina, con conseguente loro escrezione urinaria, nonché l’incremento del contenuto eritrocitario di protoporfirina sono le conseguenze di questa attività (Waldron, 1966; Skerfving, 1988). Un decremento a carico dell’attività
della ALAD, che può risultare anche del 90%, associato ad una stimolazione della sintetasi dell’acido δ-aminolevulinico, con conseguente suo incremento plasmatico, rappresentano un rilievo caratteristico in corso di intossicazione (Kao e Forbes, 1973). A livello del sistema nervoso, il piombo risulta in grado, di inibire la funzione colinergica, inducendo così scompensi nella trasmissione neuronale degli impulsi (Rossow et al., 1987).
Gli studi condotti da Markovac e Goldstein (1988) hanno dimostrato che il metallo è in grado di sostituirsi al calcio nell’attivazione della proteinchinasi C; gli studi condotti su soggetti umani delineano una riduzione delle concentrazioni di eme, responsabile di un’inibizione della triptofano pirrolasi, con conseguente aumento dei livelli di triptofano, serotonina e acido 5-idrossiindolacetico, il che spiega la neurotossicità del metallo (Goyer, 1996).
Gli studi effettuati sul ratto, evidenziano come una presenza di acetato basico di piombo nella loro dieta induca l’insorgere di neoplasie maligne renali in questa specie, così come iniezioni per via parenterale di solfato di piombo insolubile esitino nella comparsa di adenomi e carcinomi dello stesso organo (Silbergeld et al., 2000).
L’induzione da piombo dell’adenocarcinoma renale nei ratti e nei topi dipende dalla dose e non è stata osservata a livelli inferiori a quelli che causano nefrotossicità (EPA, 1980).
L’ipotesi formulata da Silbergeld et al. nel 2000, prevede che il piombo provochi un danno diretto al DNA o agisca inibendo la sintesi o la riparazione dello stesso. Inoltre il piombo potrebbe, sempre secondo gli stessi autori, reagire con l’ossigeno causando danni ossidativi al DNA. Dati recenti indicano che il piombo potrebbe sostituirsi allo zinco in molte proteine che fungono da regolatori trascrizionali e provocare un’alterazione dell’espressione genica (Merendi, 2005).
La manifestazione clinica della tossicità del piombo è denominata “saturnismo” ed è conosciuta sin dall’antichità, il che giustifica la presenza di molti studi sull’effetto del metallo a danno della salute umana (Lampugnani, 2004).
Nell’ambiente si rilevano concentrazioni di piombo molto più elevate nei sedimenti (47 mg/kg), nel suolo (16 mg/kg) e nelle acque interstiziali dei primi (36 µg/kg) rispetto a quelle riscontrabili nell’atmosfera e nelle acque libere, per cui i sedimenti devono essere riguardati come i più importanti depositi ambientali (Eisler, 1988).
Nelle acque, il metallo può pervenire a seguito del dilavamento dei suoli o delle piante, oltre che per un inquinamento diretto, e può rapidamente precipitare sotto forma di carbonati o idrossidi e come chelati con anioni diversi. Quando la corrente dell’acqua è lenta, l’entità di questo metallo raggiunge valori superiori, mentre un flusso elevato comporta un aumento di concentrazioni del metallo nel particolato o in forma libera (Benes et al., 1985; White e Driscoll, 1985).
Il rilascio del metallo dai sedimenti è favorito da un’acidità delle acque e dalla loro composizione ionica , mentre una temperatura elevata, un pH basso e una presenza di attività microbiche agevolano la sua organicazione (Chau et al., 1980, May e McKinney, 1981; Demayo et al., 1982).
In ambiente acquatico, pur in assenza di fenomeni di biomagnificazione, i livelli maggiori di piombo si riscontrano nelle alghe e negli organismi bentonici (Schmitt et al., 1984).
Sono stati effettuati diversi studi riguardanti il bioassorbimento di metalli pesanti, utilizzando come modello il lievito Saccharomyces cerevisiae. Nel lavoro di Wang e Chen (2006), è mostrato come questo eucariote sia in grado di rimuovere in varia misura tramite bioassorbimento, in condizioni di pH e temperatura idonee, diversi metalli, tra i quali il piombo da soluzioni acquose. Grazie alle sue caratteristiche