Capitolo 2
Epidemiologia della meningite meningococcica
La meningite è l'infiammazione di una delle tre membrane che ricoprono il cervello e il midollo spinale, ed è causata da infezioni da parte di corpi esterni quali batteri o virus, da agenti chimici, o ancora da condizioni patologiche come emorragie o carcinomi.
La forma di meningite più diffusa è quella di origine batterica, provocata per la quasi totalità dei casi da tre specie: Neisseria meningitidis, Haemophilus influenzae e Streptococcus pneumoniae; di queste, Neisseria meningitidis (detta anche meningococco) è la più comune, ed è inoltre l'unica a causare focolai epidemici su larga scala (ma sviluppi recenti fanno temere un ruolo in futuro anche per Streptococcus Pneumoniae [1] ); per questo motivo la meningite menigococcica sarà il focus del presente studio.
Secondo i dati dell'Organizzazione Mondiale della Sanità [2], si contano globalmente circa 170.000 morti all'anno per infezione meningococcica in tutto il mondo, con una mortalità attorno al 10% dei casi nei paesi ricchi, in presenza delle più avanzate tecniche terapeutiche, ed in genere più alto nei paesi poveri. Tra i sopravvissuti, fino al 20% soffre di sequele invalidanti, come sordità, amputazione degli arti, epilessia o ritardi mentali.
2.1 Cenni storici
Le prime descrizioni di casi clinici simili a malattie meningococciche risalgono al sedicesimo secolo, ma una dissertazione di carattere scientifico fu proposta solo nel 1805 da Vieusseux, relativamente ad un'epidemia avvenuta nei pressi di Ginevra, che causò 33 morti. La prima descrizione del microrganismo fu data da due patologi italiani, Marchiafava e Celli, nel 1884, che individuarono il batterio in campioni di liquido cerebrospinale; l'isolamento del patogeno è invece attribuito ad Anton Weichselbaum, nel 1887. Già nel 1890 si osservano casi di portatori asintomatici di Neisseria meningitidis.
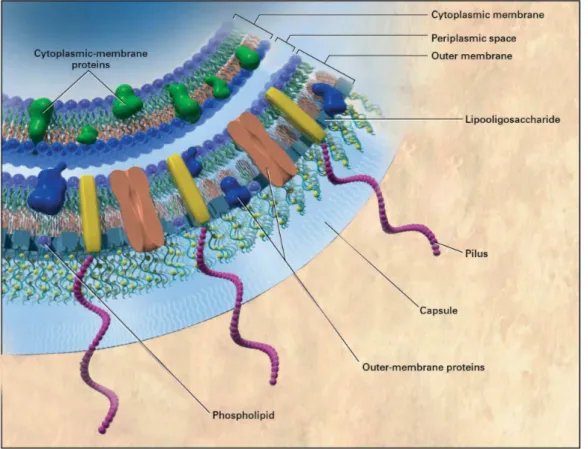
2.2 Microbiologia
Neisseria meningitidis (v. figura 2.1) è un diplococco Gram-negativo, la cui membrana citoplasmatica è rivestita da uno strato di peptidoglicani, che la separano dalla membrana esterna; quest'ultima può essere ricoperta da una capsula polisaccaridica che costituisce il principale fattore di virulenza batterica, in quanto ostacola i meccanismi di fagocitosi da parte delle difese immunitarie dell'organismo che lo ospita. I meningococchi non rivestiti da tale parete sono incapaci di sopravvivere in seguito ad invasione nell'organismo e dunque di indurre malattie.
Il batterio vive esclusivamente nelle cavità nasofaringee di individui umani e può essere trasmesso tramite il contatto diretto con secrezioni salivari o respiratorie, che possono anche essere
nebulizzate nelle goccioline di saliva espulse tramite starnuti o colpi di tosse e trasmesse fino ad una distanza di un metro; per questo motivo la trasmissione batterica è maggiormente favorita durante le stagioni influenzali. Non esistono serbatoi animali o ambientali per questi batteri, eccetto oggetti inanimati quali utensili per cibo e bevande, sigarette, ed altri oggetti che possono venire a contatto con la saliva di un infetto. La sopravvivenza del batterio all'esterno dell'individuo è fortemente prolungata dalla presenza della capsula polisaccaridica, che pertanto favorisce la trasmissione, oltre che la virulenza. A parità di temperatura, l'aria secca presenta generalmente una maggiore concentrazione batterica rispetto a quella umida [3], ed è ragionevole ipotizzare che ciò valga anche per Neisseria meningitidis, sebbene ciò non sia stato provato nel caso specifico. Una volta entrato nelle cavità nasofaringee dell'individuo ospitante, il batterio aderisce alla mucosa epiteliale per mezzo di ciglia e di altre proteine presenti sulla membrana esterna del batterio. A questo punto la capsula tende a regredire a causa di processi biochimici, scatenati dalle prime fasi dell'adesione, che rendono transitoriamente meno intensa la sintesi dei polisaccaridi capsulari; la capsula infatti ostacola la stabilizzazione del processo di adesione alla mucosa faringea, ed i meningococchi per cui la regressione avviene in misura minore sono estremamente più trasmissibili: essendo meno stretto il legame con il tessuto epiteliale dell'individuo ospitante, diventa più probabile il distacco di alcuni batteri, che finiscono nella saliva dell'ospite per essere trasmessi.
Dopo l'adesione, dei recettori batterici specifici si legano ad alcune proteine del tessuto epiteliale, le transferrine e le lactoferrine, da cui assorbono il ferro, elemento essenziale per la proliferazione del meningococco. Il batterio può eludere per un certo tempo le difese immunitarie locali del tratto respiratorio grazie ad un enzima proteasi che distrugge le immunoglobuline A, gli anticorpi maggiormente presenti nelle secrezioni del cavo oro-nasale. In questo modo riesce a colonizzare il nasofaringe e a rimanerci anche per alcuni mesi. La produzione di tale proteasi è notevolmente più alta nei ceppi maggiormente invasivi [4].
Nella maggior parte dei casi il meningococco si limita a colonizzare le cavità nasofaringee dell'individuo ospitante, ma in qualche caso può penetrare nel tessuto endoteliale ed infine nel sangue, secondo meccanismi ancora non del tutto chiariti. L'organismo umano è in grado di
sviluppare autonomamente una risposta anticorpale specifica nel giro di una settimana a partire dall'inizio dell'invasione nel flusso sanguigno, ma la proliferazione del batterio in tale ambiente è solitamente molto più rapida: pertanto solo la presenza precedente all'infezione di anticorpi specifici nel sangue può arrestarne la progressione. In uno studio di Goldschneider et al. (1969) [5] è stata misurata l'attività battericida del siero contro i meningococchi dei gruppi A, B e C, e calcolata la percentuale di persone considerate protette da attacchi meningococcici per le varie fasce di età (ovvero quelle per cui l'attività battericida del siero era superiore a una certa soglia). Il risultato di questo studio mostrò una netta correlazione inversa tra la percentuale di persone considerate protette e il tasso di attacco della malattia in ciascuna fascia di età. Uno studio simile è stato condotto recentemente nel Regno Unito [6] su un numero di campioni più ampio, confermando sostanzialmente le conclusioni di Goldschneider, sebbene con percentuali di protezione per i giovani e gli adulti sensibilmente più basse. Tale differenza è probabilmente legata alle diverse condizioni epidemiologiche della popolazione campione (gran parte dei soggetti adulti nello studio di Goldschneider erano reclute in un dormitorio militare) e all'ampiezza del campione statistico (meno di 20 campioni per alcune fasce di età nel lavoro del 1969).
In assenza dell'attività battericida pregressa al contatto con i meningococchi, che conferisce un'immunità sostanziale, la malattia può progredire in diverse forme, di cui le più comuni sono l'aumento esponenziale del numero di menigococci nel circolo sanguigno (sepsi meningococcica o
meningococcemia), e l'invasione delle meningi (meningite meningococcica); in particolare la
meningococcemia ha un tasso di mortalità del 17% dei casi anche nonostante la somministrazione di antibiotici, mentre la meningite si aggira su valori del 3% [7]. Nei paesi poveri, in cui l'assistenza medica è spesso meno disponibile e meno tempestiva, tali percentuali possono raggiungere valori superiori al 70%. Come detto, la presenza della capsula per il batterio che è penetrato nel circolo sanguigno è indispensabile per la sua sopravvivenza, a causa dell'azione protettiva contro gli attacchi dei macrofagi e dei neutrofili presenti nel sangue. L'attivazione e disattivazione dell'espressione della capsula da parte del batterio è il meccanismo attraverso il quale esso riesce ad eludere le difese immunitarie umane; tali attivazioni e disattivazioni sono legati a meccanismi molecolari che agiscono a livello di espressione genica.
Gli istanti iniziali del contatto tra il batterio e l'individuo da colonizzare sono probabilmente quelli in cui hanno luogo i fenomeni microbiologici responsabili dell'equilibrio tra colonizzazione e trasmissibilità e tra la sopravvivenza del batterio alle condizioni ambientali e l'induzione della malattia nel paziente, che per il batterio rappresenta un vicolo cieco dal punto di vista evoluzonistico; per questo motivo ci si riferisce al meningococco e ad altri batteri con interazioni simili con il termine di patogeni accidentali. Alcuni dei fattori ambientali che influenzano maggiormente tali interazioni iniziali sono la risposta immunitaria locale della mucosa, la presenza di altri batteri e le condizioni atmosferiche e di inquinamento.
2.3 Stato di portatore asintomatico
La sola colonizzazione delle cavità oro-nasali senza il manifestarsi esplicito di alcuna sindrome viene definita con il termine di stato di portatore asintomatico o carriage; poiché questa condizione è la più comune nelle infezioni da meningococco, si dice che Neisseria meningitidis è un organismo
commensale dell'uomo; il carriage coinvolge una proporzione della popolazione variabile tra il 2 e il
25%, con una media generalmente tra il 5 e il 10% ed una distribuzione per fasce di età maggiormente concentrata sugli adolescenti e i giovani (24-37%) [4], in piccola parte sui bambini (che invece sono colonizzati principalmente da Neisseria lactamica), mentre è molto rara negli adulti. Tale distribuzione comunque è dipendente dalle condizioni climatiche, dallo status socioeconomico dell'individuo, dal periodo epidemico o endemico, e dai ceppi batterici predominanti nell'area.
Oltre il 90% dei ceppi meningococcici isolati nelle mucose dei portatori asintomatici non è patogenico in quanto privo della capsula polisaccaridica. Poichè molte delle persone che sviluppano malattie meningococciche non sono state a contatto con altri pazienti (i casi di questo tipo, detti
casi secondari, costituiscono globalmente il 1-3% dei casi totali) [8, 9], si ipotizza che i portatori
asintomatici siano i responsabili principali della diffusione dell'infezione.
Il trasporto nasofaringeo può innescare una risposta anticorpale nel giro di poche settimane e può funzionare come evento immunizzante [4, 5], proteggendo dall'invasione del circolo sanguigno da parte di quel ceppo e di ceppi con caratteristiche antigeniche simili, ma solo in parte dall'ulteriore trasporto di meningococchi.
Si è evidenziato un rapido aumento nei tassi di carriage nei dormitori studenteschi e militari, particolarmente tra le matricole e le reclute, che non hanno ancora avuto modo di sviluppare un'immunità; alti tassi di trasporto si evidenziano inoltre in altre condizioni di affollamento, come in ambito domestico o durante pellegrinaggi religiosi, e tra i contatti stretti degli individui che manifestano una sindrome meningococcica.
Lo stato di trasporto può durare diversi mesi in modo continuativo (mediamente il 25% dei casi), ma può anche scomparire rapidamente nel giro di poche settimane (35%) o essere passeggero e poco frequente (40%). Anche la durata media del trasporto è influenzata pesantemente dal ceppo in questione [10]. Una minore durata media implica generalmente una maggiore incidenza nel trasporto [3].
In uno studio del carriage in periodo endemico, condotto su famiglie non esposte a casi clinici di infezione meningococcica, i ceppi trasportati erano per l'88% capsulati, e molti di essi del gruppo B. La durata media del carriage è stata di 9,6 mesi, ma con una distribuzione a coda molto lunga verso tempi molto più alti (nel 38% dei casi il trasporto è durato oltre 16 mesi). Il 18% degli individui è stato portatore asintomatico almeno una volta nel corso dei 32 mesi dello studio, facendo pensare ad un basso tasso di trasmissione rispetto alla media degli altri patogeni. In queste condizioni una persona suscettibile avrebbe avuto oltre il 50% di possibilità di non assumere lo stato di portatore asintomatico, anche se esposto continuamente a contatti domestici per un periodo di 5 anni. [11]
Gli individui a massimo rischio di manifestare la malattia sono quelli che non hanno sperimentato il carriage, sia perchè non hanno avuto l'occasione di immunizzarsi, sia perchè non sono note a priori le loro capacità di resistere all'invasione da parte di batteri di un ceppo patogenico. L'invasione generalmente avviene poche ore dopo la colonizzazione da parte del ceppo invasivo.
L'ingresso del meningococco nel circolo sanguigno è probabilmente molto più frequente di quanto rivelino i casi di meningite e sepsi, ma spesso le difese immunitarie riescono a sopraffare il batterio prima che si scateni un qualsiasi sintomo di malattia, che si sviluppa pertanto in maniera occulta. D'altra parte, la rilevazione del carriage mediante tampone nasofaringeo ha una sensitività molto bassa (attorno al 50%), è poco standardizzata, molto costosa e richiede tempi relativamente lunghi; tuttavia, alcuni studi testimoniano un accordo attorno al 93% tra due tamponi eseguiti in successione. [12]
2.4 Le fasi dell'infezione ed i determinanti
Lo schema seguente, proposto da Schwartz, Broome e Moore [3], riassume i passaggi necessari per arrivare allo stato di portatore asintomatico o per contrarre la malattia. Per ciascun passaggio, si possono individuare dei determinanti di particolare rilevanza.
Nella prima fase (esposizione) l'individuo entra a contatto con un meningococco; i fattori che influenzano la probabilità che ciò accada comprendono: la fascia di età di appartenenza dell'individuo, lo stato socioeconomico del contesto in cui vive, il periodo epidemico o endemico della malattia, le condizioni atmosferiche quali l'umidità dell'aria.
Nella seconda fase (trasmissione) si ha l'adesione del meningococco all'organismo dell'individuo in questione; tale evento dipende dalla concentrazione batterica nell'aria (che a sua volta dipende dall'affollamento dell'ambiente, dall'umidità o dalla presenza di un infetto o di un portatore asintomatico in ambito domestico), dalla presenza nell'individuo di altre infezioni del tratto respiratorio.
Lo sviluppo dell'infezione verso uno stato patologico o un carriage è influenzato dallo stato immunitario e nutrizionale e dalla predisposizione genetica dell'individuo, dalla stagione, dalle condizioni di inquinamento ambientale e dalla presenza di altri agenti co-infettanti del tratto respiratorio. In particolare, condizioni climatiche avverse e un'infezione concorrente nell'orofaringe possono generare micro-lesioni sulla mucosa e deprimere le difese immunitarie delle vie respiratorie, preparando la strada all'invasione meningococcica. Il contatto in ambito domestico (e più in generale in tutte le condizioni di affollamento) non agisce soltanto sull'aumento dei tassi di trasporto, che sono tre volte più alti della media, ma anche e soprattutto sui tassi di attacco della malattia, che risultano da 500 a 800 volte più alti [11]. Ciò potrebbe essere in parte legato alla patogenicità riconosciuta dei ceppi batterici trasmessi, ma molti studiosi [3, 6, 13] ipotizzano che la trasmissione di alcuni cofattori infettivi (come i batteri influenzali), anch'essa facilitata in tali condizioni, possa giocare un ruolo importante in questo incremento anomalo. Altre ipotesi considerano la comune predisposizione genetica all'insorgere della malattia (ad esempio la deficienza congenita di fattori biochimici necessari all'attività battericida del siero); in effetti, possono esistere alterazioni di origine genetica a vari livelli del processo di risposta dell'individuo agli attacchi da meningococchi, alcune delle quali sono anche piuttosto diffuse nella popolazione umana; questa variabilità contribuisce notevolmente alla diversità delle risposte individuali al trasporto e all'infezione da Neisseria meningitidis [14].
In tutti e tre i processi hanno un ruolo fondamentale le caratteristiche del ceppo menigococcico, in particolare rispetto alla trasmissibilità (l'attitudine a diffondersi in un gran numero di ospiti, che è legata sia alla capacità di sopravvivere all'esterno per lunghi periodi, sia alla capacità di aderire alle mucose nasofaringee) e alla virulenza (cioè l'attitudine ad invadere fluidi biologici normalmente sterili, come il sangue o il liquido cerebrospinale) [15].
2.5 Immunità
I neonati fino ad un'età di circa 6 mesi sono generalmente protetti dagli attacchi di meningococchi grazie alle difese immunitarie ereditate dalla madre durante la gravidanza e l'allattamento. Dopo questo periodo iniziale si ha un'immunodepressione fisiologica, che rende i bambini dai 6 ai 18 mesi particolarmente esposti alle infezioni batteriche, e quindi anche al meningococco; in effetti
Suscettibile
Esposto
Infetto
Portatore
Malato
E sp o si zi o n e T ra sm is si o n e C ar ri ag e / m al at ti al'incidenza globale per questa fascia di età ha un picco molto netto; dopo i 2 anni, il trasporto di meningococchi non patogeni o di altri batteri simili (come Neisseria lactamica) induce la produzione di anticorpi specifici, ma che risultano efficaci anche nei confronti di alcuni meningococchi patogeni aventi gli stessi antigeni; dati sperimentali mostrano una bassissima percentuale di batteri patogeni nel carriage da parte dei bambini, ed alte percentuali dell'innocuo Neisseria lactamica. Il trasporto di ceppi batterici ogni volta diversi induce un'immunità sempre più forte ed ampia nei confronti dei vari ceppi batterici, rendendo praticamente immuni la maggior parte degli adulti. L'immunità perdura per un certo lasso di tempo, anche alcuni mesi dopo che il batterio che l'ha causata è stato eliminato dagli anticorpi dell'individuo, e generalmente protegge dallo sviluppo della malattia, e solo in parte minore da un ulteriore carriage. La frazione di individui che sviluppano effettivamente un'immunità in seguito a trasporto è alta: 92% per i batteri omologhi e 87% per quelli eterologhi [5]; circa i 2/3 dei trasportatori asintomatici di Neisseria lactamica sviluppano contestualmente un'immunità aspecifica verso Neisseria meningitidis dei gruppi A, B e C [12], probabilmente a causa del fatto che i due batteri hanno in comune degli antigeni. All'inizio dell'età adulta, coincidente con una diminuzione nella prevalenza del carriage e della malattia, la percentuale di individui immuni è stata stimata attorno al 67% per il gruppo A e all'86% per il gruppo B [11].
Il tempo necessario per sviluppare l'immunità è inferiore alle due settimane dall'inizio del trasporto. La protezione comunque non è totale, in quanto gli anticorpi battericidi del siero possono essere bloccati dalle immunoglobuline stimolate da altri ceppi menigococcici o da altri batteri, respiratori o intestinali; in effetti, sono stati documentati casi di individui considerati immuni che hanno in realtà sviluppato la malattia [11]. Secondo il modello di Coen, Cartwright e Stuart [12], il trasporto di Neisseria lactamica inibirebbe anche un trasporto successivo di meningococchi.
Durante l'adolescenza e i primi anni dell'età adulta (15-24 anni) si rivela un picco nell'incidenza delle malattie meningococciche, più basso rispetto a quello della prima infanzia, e che è attribuito all'aumentata attività sociale e all'affollamento di dormitori studenteschi e militari; questa ipotesi sarebbe corroborata anche dalle elevate percentuali di carriage. Un'ulteriore spiegazione andrebbe cercata nel blocco dell'attivita battericida da parte del siero, che sarebbe causata in questo caso da batteri intestinali comuni in questa fascia di età. E' comunque da considerare che ad una aumentata incidenza delle infezioni meningococciche corrispondono in questa fascia dei tassi di trasporto notevolmente maggiori rispetto alla media: è possibile che il primo fenomeno sia una conseguenza del secondo; la causa dell'aumentato trasporto andrebbe ricercata, secondo Coen, Cartwright e Stuart [12], nella perdita dell'immunità guadagnata negli anni precedenti attraverso il trasporto di Neisseria lactamica. Sulla base di dati provenienti da Regno Unito e Stati Uniti, è stata rilevato un tasso di mortalità molto più alto per questa fascia di età rispetto alle altre, particolarmente per le infezioni causate dal gruppo C [14].
Un terzo del totale dei casi avviene sugli adulti, spesso in corrispondenza di condizioni immunodepresse come mieloma, leucemia, malattie renali, alcolismo, splenectomia [10].
2.6 Classificazioni e meccanismi di espressione e mutazione genica
La classificazione tradizionale dei meningococchi si basa sulla tipizzazione serologica, e cioè sulle caratteristiche antigeniche della capsula polisaccaridica che identificano il serogruppo di appartenenza; secondo questo criterio possono essere raggruppati soltanto i meningococchi potenzialmente patogenici, in 13 serogruppi principali: A, B, C, D, 29E, H, I, K, L, W-135, X, Y, and Z. Classificazioni ulteriori si basano sulle proteine presenti nella membrana esterna (outer membrane proteins, OMPs), che identificano il serotipo e il serosottotipo, e sui lipooligosaccaridi (LOS), le tossine responsabili dell'infiammazione che identificano l'immunotipo. La designazione di un ceppo avviene dunque secondo il codice Serogruppo:Serotipo:Serosottotipo:Immunotipo.
Questa classificazione rende impossibile tenere conto delle variazioni di un meningococco da un tipo all'altro, in quanto, come abbiamo visto, sia le caratteristiche della capsula che quelle delle OMPs possono dipendere dalle condizioni ambientali e dall'attivazione o meno in un certo istante dei meccanismi genetici di phase switching e slip-strand mispairing, attraverso i quali i meningococchi possono riuscire ad evitare una risposta immunitaria specifica [16]. Un batterio può quindi, con una certa probabilità, passare da un serogruppo, un serotipo, un serosottotipo o un immunotipo all'altro nel corso della sua vita; può diventare non classificabile nel caso in cui regredisca l'espressione della capsula, come avviene per la maggior parte dei batteri che colonizzano la faringe, o viceversa diventare patogenico a partire da uno stato privo di capsula. Sono stati rilevati cambiamenti nella struttura della capsula dal gruppo B ai gruppi C e W-135 in seguito a una campagna di vaccinazione in Repubblica Ceca [17]: questo mostra in modo chiaro come i meccanismi di phase switching rappresentino il tentativo da parte del batterio di adattarsi alle condizioni ambientali.
Nel caso della Neisseria meningitidis, la frequenza con cui varia l'espressione delle OMPs e dei LOS è molto alta (10-2 – 10-4 / cellula / generazione [10]).
I meccanismi genetici alla base di queste variazioni possono avere a che fare con l'inserzione o la delezione di nucleotidi nella sequenza, che sfasano le terne codoniche rendendole ora capaci, ora incapaci di codificare i polisaccaridi della capsula, gli organuli incaricati del loro trasporto extracellulre, le OMPs o i LOS. Durante lo stato di portatore asintomatico, può anche accadere che un batterio assorba nel proprio genoma tratti di DNA esogeno proveniente dalla lisi di un altro patogeno di specie o ceppo diverso presente nelle vie respiratorie superiori [4]: questo fenomeno, detto trasferimento genetico orizzontale, induce caratteristiche nuove nel batterio modificato e può causare l'insorgenza di nuovi ceppi invasivi, se il nuovo genoma risulta particolarmente adatto alle condizioni ambientali relative all'ospite e alla popolazione umana in cui dovrà diffondersi. La presenza di un gran numero di geni suscettibili di variazioni di fase ad alta probabilità, unita alla capacità di accogliere patrimonio genetico di altri batteri rendono il genoma del meningococco particolarmente variabile, e dunque adattabile all'ambiente, e causano l'impressionante variabilità antigenica che costituisce un grande ostacolo alla piena comprensione (e al controllo) del patogeno.
Un'alternativa alla sero-classificazione affermatasi recentemente si basa sulle tecniche di elettroforesi (electrophoretic typing, ET) o sequenziamento genetico (sequence typing, ST), che permettono di distinguere i batteri non in base al fenotipo espresso, ma in base al patrimonio genetico, che presentando dei tratti invarianti permette di individuare una parentela genetica tra i ceppi: in questo modo è possibile tenere traccia dell'epidemiologia della meningite a livello globale e dei cambiamenti di ceppo da parte di un 'lineage' invasivo. Inoltre, questa metodica permette di classificare anche i batteri privi di capsula. I batteri rilevati in ogni parte del mondo nei portatori asintomatici presentano genotipi estremamente diversi tra loro, ma quelli rilevati nel liquido cerebrospinale di pazienti ammalatisi di meningite o sepsi manifestano una forte parentela genetica [18]; inoltre solo una proporzione molto bassa dei batteri isolati nei portatori asintomatici appartiene alle classi ET dei batteri invasivi (principalmente ET-15 ed ET-37). Ciò significa che la virulenza dei vari meningococchi è connaturata al patrimonio genetico del batterio. Alcuni studi [5, 18] hanno evidenziato che un certo numero di classi genetiche relative a meningococchi iper-invasivi riescono a persistere nel tempo nonostante l'alta patogenicità rappresenti un notevole svantaggio evoluzionistico per la popolazione batterica; ciò fa supporre che all'aumentata virulenza debba necessariamente corrispondere un aumentata trasmissibilità che compensi tale svantaggio, ovvero che la prima sia una conseguenza accidentale ma strettamente correlata alle mutazioni che favoriscono la seconda [15].
Le ricombinazioni e le mutazioni genetiche tra i diversi ceppi meningococcici possono in alcuni casi diffondersi e fissarsi nella popolazione batterica, introducendo una certa differenziazione a livello genico; nonostante ciò, si rileva una notevole uniformità nel DNA dei batteri responsabili delle epidemie, che potrebbe essere determinata da “colli di bottiglia evoluzionistici” [13]: si
tratterebbe di condizioni ambientali a livello dell'organismo ospitante talmente selettive da permettere la sopravvivenza e la proliferazione solo a quei meningococchi che posseggono caratteristiche fenotipiche particolarmente adatte (e quindi con un patrimonio genetico altrettanto selezionato).
Lo studio dell'evoluzione della diversità genetica potrebbe fornire informazioni molto importanti sulla storia epidemiologica del patogeno, qualora si riuscisse a discriminare il contributo dei fattori ambientali e quello dei fenomeni di innovazione genetica (come le mutazioni e le ricombinazioni).
2.7 Epidemiologia
La maggior parte dei casi di meningite avviene in modo sporadico e mostra quindi un pattern endemico, ma spesso si registrano focolai epidemici anche piuttosto estesi. Nei paesi ricchi, si parla di epidemia quando vengono riscontrati almeno tre casi primari nell'arco di tre mesi in una comunità, con un tasso di infettività di almeno 10 casi ogni 100.000 persone [7]; in generale, comunque, le definizioni di condizioni epidemiche variano fortemente a seconda del contesto geografico specifico.
Il maggior numero dei casi di meningite a livello mondiale è concentrato nella cosiddetta “fascia (o cintura) della meningite”, che coinvolge tutta la zona sub-sahariana dal Senegal all'Etiopia, per una popolazione complessiva di 300 milioni di persone; ci sono alcuni indizi che mostrano un accenno di estensione della fascia verso sud in alcuni altri paesi africani (Kenya, Congo) a partire dalla fine degli anni '80 [19]. In questa fascia iper-endemica si verificano da almeno un secolo epidemie di meningite [14] con tassi di attacco particolarmente elevati. La fascia della meningite presenta caratteristiche climatiche e sociali particolari che favoriscono la trasmissione della malattia. Nella stagione secca che va da gennaio a giugno, la presenza dell'Harmattan, il vento sabbioso proveniente dal deserto del Sahara, favorisce le infezioni del tratto naso-faringeo, deprimendo le difese immunitarie locali dell'individuo e facilitando la penetrazione dei meningococchi attraverso le microlesioni della faringe. Inoltre, la presenza di nuclei familiari sovraffollati, e la partecipazione a pellegrinaggi e a mercati regionali aumenta il numero dei contatti e dunque la frazione di portatori asintomatici dei batteri.
I serogruppi A, B, C, W-135 e Y rappresentano oltre il 90% dei casi di meningite meningococcica nel mondo [8], e gli ultimi due hanno registrato un notevole aumento negli ultimi 10 anni.
Il gruppo A è la causa più comune di infezione in Asia e in Africa, dove è generalmente endemico; in Africa causa nelle stagioni più secche e calde ondate di epidemie monoclonali massicce con un periodo di 7-14 anni, in particolare a carico del sottogruppo III, responsabile anche di due pandemie (dalla fine degli anni '60 a metà degli anni '70 e dal 1987 a metà degli anni '90). Nei paesi ricchi i casi dovuti al gruppo A sono sempre molto limitati, anche in seguito a ripetute importazioni di ceppi patogeni; in ogni caso, quando esso causa epidemie in questi paesi, esse sono sempre concentrate nelle fasce più povere della popolazione [3].
Il gruppo B è riconosciuto come la causa principale di meningite sporadica nei paesi ricchi ed è responsabile della maggior parte dei casi relativi a bambini di età inferiore ad un anno, anche a causa della mancanza di un vaccino efficace. Ha causato negli ultimi 20 anni epidemie sia in questi continenti che in Oceania e Sud America, con tassi di attacco tra i 10 e i 50 per 100.000 persone, cioè circa 10 volte meno che quelle relative al gruppo A e C. Contrariamente alle epidemie causate da ceppi del gruppo A, quelle relative al gruppo B non mostrano un aumento nella prevalenza di trasportatori asintomatici.
Il gruppo C causa epidemie prevalentemente in Africa, mentre è responsabile di casi sporadici nei paesi ricchi; dagli anni '80 si è rilevato in molti paesi europei un aumento nella percentuale di casi legate a questo gruppo, principalmente a causa del lineage corrispondente alla classe ET-15, uno dei più invasivi del complesso ET-37.
Il gruppo Y è in forte espansione negli Stati Uniti, dove da una frazione del 2% dei casi tra il 1989 e il 1991 è salito al 37% nel periodo 1997-2002 [7].
Il gruppo W-135 ha causato epidemie particolarmente violente negli ultimi 10 anni nell'Africa sub-sahariana (particolarmente in Burkina Faso) e in Arabia Saudita, tra i pellegrini musulmani per La Mecca (Hajj), in conseguenza delle quali si sono registrati casi anche in Europa e Stati Uniti. Gli ultimi dati suggeriscono che l'importanza di questo serogruppo sembra essersi ridimensionata notevolmente [20].
Le epidemie di meningite mostrano una distribuzione geografica irregolare e un andamento spiccatamente stagionale, qualsiasi sia il serogruppo; la stagionalità è correlata con le condizioni climatiche e sociali: nella fascia della meningite, i focolai iniziano nella stagione secca e finiscono con le prime piogge; nelle zone temperate, il picco dei casi endemici si ha in inverno e primavera, in corrispondenza delle epidemie influenzali e dell'assembramento di bambini e adolescenti nelle scuole. Il carriage di meningococchi presenta invece una relativa omogeneità nella distribuzione geografica, e una scarsa correlazione con l'andamento stagionale; inoltre, gli outbreak di meningite avvengono non necessariamente nei periodi ad alta prevalenza di trasporto, ma in quelli con alti tassi di incidenza. Queste considerazioni evidenziano una relazione non semplice tra l'esposizione al patogeno e lo sviluppo della malattia; cioè, il numero di casi clinici non è banalmente una proporzione dei casi di trasporto.
Un indicatore dell'innesco di un'epidemia può essere dato dallo spostamento verso l'alto dell'età media dei casi clinici registrati: all'inizio delle epidemie i casi nella fascia di età tra i 5 e i 19 anni sono tendenzialmente più frequenti che in condizioni endemiche [11].
Le ragioni alla base dello scoppio di epidemie sono ancora poco chiarite: un ceppo batterico responsabile di un'epidemia può essere presente nella popolazione anche da diversi anni, dando luogo solo a casi sporadici [3].
Seguendo la suddivisione di Schwartz et al. [3], si possono individuare dei fattori permissivi, cioè necessari ma non sufficienti, e dei fattori scatenanti.
Tra i fattori permissivi si annoverano:
la riduzione progressiva dell'immunità di gruppo della popolazione verso un certo ceppo
patogenico, dovuta alla scomparsa naturale degli anticorpi specifici in assenza di ulteriori attacchi da parte del batterio; questo calo di immunità crea delle sacche di suscettibili che favorisce la nuova diffusione del ceppo;
condizioni climatiche e stagionali appropriate;
scarse condizioni socio-economiche (affollamento, mancanza di igiene) in una popolazione
o in alcuni suoi sottogruppi;
la presenza di un ceppo patogenico nella popolazione.
Sotto queste condizioni, un'epidemia può essere scatenata da una delle seguenti condizioni:
l'introduzione nella popolazione di un nuovo ceppo maggiormente patogenico, per
importazione dall'esterno (tramite immigrazione o viaggi, come probabilmente è avvenuto nelle epidemie successive ai pellegrinaggi alla Mecca) o per mutazione genica;
la presenza di microrganismi infettanti diversi dal meningococco: è stata infatti dimostrata
una correlazione netta tra l'incidenza di meningite e quella di altre malattie del tratto respiratorio; questi co-fattori sarebbero responsabili sia dell'aumentata trasmissibilità, sia della immunodepressione locale e generale dell'individuo e favorirebbero quindi l'insorgere della malattia. Non è escluso un meccanismo simile per microrganismi intestinali, oltre che per quelli delle vie respiratorie;
condizioni climatiche eccezionali, come stagioni particolarmente secche, o caratterizzate
da frequenti tempeste di sabbia nei paesi poveri, o inverni particolarmente rigidi nei paesi ricchi, entrambi causa di una maggiore suscettibilità della popolazione a causa della riduzione delle difese immunitarie o della maggiore frequenza di microlesioni del nasofaringe.
Si riscontra una differenza tra i casi endemici europei e nordamericani, caratterizzati da una certa diversità genetica nei batteri patogenici, e le epidemie della fascia subsahariana, dominate volta per volta da un solo clone [13]. Studiando la distribuzione clonale delle epidemie della fascia della meningite dagli anni '60 ad oggi, si evidenzia una netta predominanza monoclonale per ciascuna delle ondate epidemiche, con la sostituzione a volte totale, a volte parziale e temporanea del vecchio clone con uno nuovo nei periodi di transizione tra le ondate [13].
In uno studio su circa 500 reclute, Goldschneider et al. [21] hanno dimostrato come l'incidenza della malattia risulti così bassa rispetto al numero di potenziali suscettibili (giovani che non hanno sviluppato l'immunità al ceppo invasivo durante la pubertà) perchè in effetti pochi (13) dei 54 suscettibili iniziali sono venuti in contatto con il batterio, e di questi 5 hanno sviluppato la malattia: l'1% rispetto al totale, il 10% dei suscettibili, ma il 38.5% di quelli che sono venuti in contatto con il batterio.
2.8 Controllo
Le strategie di controllo che possono essere attivate nei confronti della meningite hanno a che fare con la gestione dei casi clinici, la riduzione dei tassi di trasporto, e l'immunizzazione della popolazione tramite vaccinazione.
La gestione dei casi clinici riguarda la riduzione dei casi secondari, dovuti alla colonizzazione dei contatti più stretti del paziente da parte del meningococco: tali individui hanno un rischio di contrarre la malattia di almeno due ordini di grandezza maggiore rispetto al resto della popolazione, e mostrano un maggiore trasporto del batterio patogenico rispetto alla media. I casi secondari possono essere prevenuti attraverso una chemoprofilassi antibiotica basata su penicillina o farmaci analoghi.
La chemoprofilassi potrebbe essere utilizzata per ridurre il trasporto nasofaringeo, che come detto è responsabile dei casi endemici ed epidemici, ma è impossibile da realizzare praticamente, viste le alte percentuali di portatori asintomatici tra i bambini, gli adolescenti e i giovani; il suo utilizzo potrebbe anzi essere deleterio, causando l'insorgenza di resistenze del batterio ai farmaci che lo neutralizzano. Tuttavia, la chemoprofilassi viene utilizzata con successo nell'ambito di piccole comunità chiuse (come scuole, dormitori studenteschi e militari).
E' stata proposta [22] anche una strategia di controllo che prevede la chemoprofilassi selettiva dei trasportatori asintomatici del ceppo patogenico, individuati attraverso tecniche molecolari ad alta sensibilità; riducendo drasticamente ed in modo mirato la diffusione dei batteri invasivi, si prevede di evitare fino al 75% dei casi endemici e lo scoppio di focolai epidemici.
La strategia che sembra più promettente per il controllo della meningite è quella dell'immunoprofilassi, grazie anche agli ottimi risultati ottenuti dalle campagne di vaccinazione contro l'Haemophilus influenzae b, che ha indotto anche una riduzione considerevole nei tassi di carriage tra i bambini. Confortanti sono i risultati di una campagna di vaccinazione contro il serogruppo C della Neisseria meningitidis condotta recentemente nel Regno Unito [23, 24], che ha indotto una notevole immunità di gruppo attraverso una riduzione nel carriage del 66%.
Tuttavia, non sono a disposizione ancora vaccini efficaci per il serogruppo B, la cui capsula polisaccaridica è molto poco immunogenica, e i vaccini tetravalenti contro i gruppi A, C, W-135 ed Y sono troppo costosi (3,50 $ la dose [25]) e prodotti in quantità troppo basse per le epidemie che coinvolgono la fascia meningitica subsahariana. In questi casi, la strategia raccomandata dall'OMS è un'aumentata sorveglianza per la segnalazione di epidemie, e l'uso di campagne di vaccinazione localizzate e di chemoprofilassi diffusa.
Studi condotti sull'efficacia economica di diverse ipotesi di campagne di vaccinazione negli Stati Uniti hanno comunque indicato costi elevati (121.000 $) per ciascun anno di vita equivalente salvato [26].
La vaccinazione si è mostrata poco efficace nella prevenzione di focolai epidemici conseguenti a grandi raduni di persone proveniente da diversi paesi, come quelli legati ai pellegrinaggi alla Mecca: il vaccino protegge infatti solo dalla malattia e non dal trasporto [10], e pertanto la trasmissione del batterio patogeno nella popolazione di origine (totalmente suscettibile al nuovo ceppo) dei pellegrini continua a causare outbreaks considerevoli.
Una certa attenzione andrebbe riservata, secondo quanto proposto da Coen et al. [12], all'impatto delle vaccinazioni sul trasporto di Neisseria lactamica, visto il ruolo fondamentale che essa svolge nel naturale sviluppo dell'immunità di gruppo per una popolazione; inoltre, bisogna seguire attentamente l'effetto selettivo che tali vaccinazioni hanno nel rendere comparativamente più adatto un serogruppo rispetto ad un altro, e cioè nello spostamento del serogruppo dominante indotto dalle vaccinazioni [17].
Riferimenti bibliografici:
[1] Yaro S., Lourd M., Traoré Y., Njanpop-Lafourcade B. M., Sawadogo A., Sangare L., Hien A., Ouedraogo M. S., Sanou O., Parent du Chatelet I., Koeck J. L., Gessner B. D. (2006) Epidemiological and Molecular Characteristics of a Highly Lethal Pneumococcal Meningitis Epidemic in Burkina Faso. Clinical Infectious Diseases, 43, 693–700.
[2] www.who.int/vaccine_research/diseases/meningitis/en
[3] Schwartz B., Moore P., Broome C. V. (1989) Global Epidemiology of Meningococcal Disease. Clinical Microbiology Reviews, 2, p. S118-S124.
[4] Yazdankhah S. P., Caugant D. A. (2004) Neisseria meningitidis: an overview of the carriage state. Journal of Medical Microbiology, 53, 821–832.
[5] Goldschneider I., Gotschlich E. C., Artenstein M.S. (1969) Human immunity to the meningococcus. II. Development of natural antibodies. J. Exp. Med., 129, 1327-1348. [6] Trotter C., Borrow R., Andrews N., Miller E. (2003) Seroprevalence of meningococcal
serogroup C bactericidal antibody in England and Wales in the pre-vaccination era.
Vaccine, 21, 1094-1098.
[7] New Jersey Department of Health and Senior Services (2003) Communicable Disease Service Manual. Meningococcal Infection, Invasive (Neisseria meningitidis).
[8] World Health Organization (2002) Meningococcal vaccines: polysaccharide and polysaccharide conjugate vaccines. WHO position paper. Weekly Epidemiological
Record, 40, 331-339.
[9] Baltimore, R. S. (2006) Recent trends in meningococcal epidemiology and current vaccine recommendations. Curr Opin Pediatr, 18, 58–63.
[10] Tzeng Y. L., Stephens D. S., (2000) Epidemiology and pathogenesis of Neisseria meningitidis. Microbes and Infection, 2, 687−700.
[11] Apicella M. A. Neisseria meningitidis. In Infectious Diseases and Their Etiologic Agents, 2498-2508.
[12] Coen P. G., Cartwright K., Stuart J. (2000) Mathematical modelling of infection and disease due to Neisseria meningitidis and Neisseria lactamica. International Journal of
Epidemiology 29, 180–188.
[13] Achtman M. (1995)Epidemic spread and antigenic variabilitv of Neisseria meningitidis.
Trends in microbiology, 3, 186-192.
[14] Granoff D. M., Feavers I. M., Borrow R. (2004) Meningococcal Vaccines, in Plotkin S. A.,
Vaccines, Orenstein WA, 4 ed.;34:956-987.
[15] Taha M. K., Deghmane A. E., Antignac A., Zarantonelli M. L., Larribe M., Alonso J. M. (2002) The duality of virulence and transmissibility in Neisseria meningitidis. Trends in
[16] Van Deuren M., Brandtzaeg P., Van der Meer J. W. M. (2000) Update on Meningococcal Disease with Emphasis on Pathogenesis and Clinical Management. Clinical
Microbiology Reviews, 13, 144–166.
[17] Taha M. K., Bichier E., Perrocheau A., Alonso J. M. (2001) Circumvention of Herd Immunity during an Outbreak of Meningococcal Disease Could Be Correlated to Escape Mutation in the porA Gene of Neisseria meningitidis. Infection and Immunity, 69, 1971– 1973.
[18] Jolley K. A., Wilson D. J., Kriz P., Mcvean G., Maiden M. C. J. (2004) The Influence of Mutation, Recombination, Population History, and Selection on Patterns of Genetic Diversity in Neisseria meningitidis. Molecular Biology and Evolution, 22, 1-8.
[19] World Health Organization Emerging and other Communicable Diseases, Surveillance and Control (1998) Control of epidemic meningococcal disease. WHO practical guidelines. 2nd edition. WHO/EMC/BAC/98.3.
[20] Traoré Y., Njanpop-Lafourcade B. M., Adjogble K. L. S., Lourd M., Yaro S., Nacro B., Drabo A., Parent du Chatelet I., Mueller J. E., Taha M. K., Borrow R., Nicolas P., Alonso J. M., Gessner B. D. (2006) The Rise and Fall of Epidemic Neisseria meningitidis Serogroup W135 Meningitis in Burkina Faso, 2002–2005. Clinical Infectious Diseases,
43, 817–22.
[21] Goldschneider I., Gotschlich E. C., Artenstein M.S. (1969) Human immunity to the meningococcus. I. Role of humoral antibodies. J. Exp. Med., 129, 1307-1326.
[22] Stephens D. S. (1999) Uncloaking the meningococcus: dynamics of carriage and disease.
The Lancet, 353, 941-942.
[23] Trotter C. L., Gay N. J., Edmunds W. J. (2005) Dynamic Models of Meningococcal Carriage, Disease, and the Impact of Serogroup C Conjugate Vaccination. American
Journal of Epidemiology, 162, 89-100.
[24] Trotter C. L., Edmunds W. J. (2006) Reassessing the Cost-Effectiveness of Meningococcal Serogroup C Conjugate (MCC) Vaccines Using a Transmission Dynamic Model. Med
Decis Making, 26, 38–47.
[25] Decosas J., Koama J. B. T. (2002) Chronicle of an outbreak foretold: meningococcal meningitis W135 in Burkina Faso. The Lancet Infectious Diseases, 2, 763-765.
[26] Kimmel, S. R. (2005) Prevention of Meningococcal Disease. American Family Physician,
72, 2049-2056.
[27] http://www.who.int/mediacentre/factsheets/fs141/en/print.html
[28] Ancel L. W., Levin B. R., Richardson A.R., Stojiljkovic I. Two-tiered evolution of
Neisseria Meningitis: How within-host ecology and between-host epidemiology expedite
phase shifting.
[29] Ancel Meyers L., Levin B. R., Richardson A. R., Stojiljkovic I. (2002) Epidemiology, hypermutation, within-host evolution and the virulence of Neisseria meningitidis. Proc.
R. Soc. Lond., 270, 1667–1677.
[30] Association of Clinical Pathologists (1989) Investigation of meningococcal disease. Broadsheet 121.
[31] Cartwright K. A. V., Ala'Aldeen D. A. A (1997) Neisseria meningitidis: Clinical Aspects.
Journal of Infection, 34, 15-19.
[32] De Wals P., Trottier P., Pépin J. (2006) Relative efficacy of different immunization schedules for the prevention of serogroup C meningococcal disease: A model-based evaluation. Vaccine, 24, 3500–3504.
[33] Diaz P. S. (1999) The epidemiology and control of invasive meningococcal disease.
Concise Reviews of Pediatric Infectious Diseases, 18, 633-634.
[34] Frank S. A., Jeffrey J. S. (2001) The probability of severe disease in zoonotic and commensal infections. Proc. R. Soc. Lond., 268, 53-60.
[35] Guinea F., Jansen V. A. A., Stollenwerk N. (2006) Statistics of infections with diversity in the pathogenicity. [Preprint submitted to Elsevier Science]
[36] Manchanda V., Gupta S., Bhalla P. (2006) Meningococcal disease: History, epidemiology, pathogenesis, clinical manifestations, diagnosis, antimicrobial susceptibility and prevention. Indian Journal of Medical Microbiology, 24, 7-19.
[37] Martcheva M., Crispino-O’Connell G. (2003) The transmission of meningococcal infection: a mathematical study. J. Math. Anal. Appl., 283, 251–275.
[38] McEllistrem M. C., Kolano J. A., Pass M. A., Caugant D. A., Mendelsohn A. B., Fonseca Pacheco A. G., Shutt K. A., Razeq J., Harrison L. H. (2004) Correlating Epidemiologic Trends with the Genotypes Causing Meningococcal Disease, Maryland. Emerging
Infectious Diseases, 10, 451-456.
[39] Pourbohloul B., Ancel Meyers L., Skowronski D. M., Krajden M., Patrick D. M., Brunham R. C. (2005) Modeling Control Strategies of Respiratory Pathogens. Emerging Infectious
Diseases, 11, 1249-1256.
[40] Robinson K., Neal K. R., Howard C., Stockton J., Atkinson K., Scarth E., Moran J., Robins A., Todd I., Kaczmarski E., Gray S., Muscat I., Slack R., Ala’Aldeen D. A. A. (2002) Characterization of Humoral and Cellular Immune Responses Elicited by Meningococcal Carriage. Infection and Immunity, 70, 1301–1309.
[41] Saunders N. J., Moxon E. R., Gravenor M. B. (2003) Mutation rates: estimating phase variation rates when fitness differences are present and their impact on population structure. Microbiology, 149, 485–495.
[42] Stollenwerk N., Maiden M. C. J., Jansen V. A. A. (2004) Diversity in pathogenicity can cause outbreaks of meningococcal disease. PNAS, 101, 10229-10234.
[43] Williams C. J., Willocks L. J., Lake I. R, Hunter P. R. (2004) Geographic correlation between deprivation and risk of meningococcal disease: an ecological study. BMC
Public Health, 4, 30-40.
[44] Woods C. W., Armstrong G., Sackey S. O., Tetteh C., Bugri S., Perkins B. A., Rosenstein N. E. (2000) Emergency vaccination against epidemic meningitis in Ghana: implications for the control of meningococcal disease in West Africa. The Lancet, 355, 30-33.
[45] World Health Organization (2006) Meningococcal disease, African meningitis belt, epidemic season 2006. Weekly Epidemiological Record, 13, 119-120.
[46] World Health Organization Department of Immunization, Vaccines and Biologicals (2006) Report of the Informal Consultation on Meningococcal Carriage Studies in Africa. WHO/IVB/06.06.