INTRODUZIONE
IL CANCRO DEL COLON-RETTO
Epidemiologia e fattori di rischio
Il carcinoma del colon-retto, ovvero quella neoplasia che prende origine istologicamente dalla mucosa colica, rappresenta la quasi totalità (98%) dei tumori maligni del colon-retto; altri tumori, ravvisabili a livello del grosso intestino, sono i tumori connettivali e i carcinoidi che, al contrario del precedente, hanno un incidenza molto bassa.
Attualmente il carcinoma colon-rettale risulta essere una tra le patologie più frequenti nei paesi industrializzati rappresentando la seconda causa di morte per tumore in Italia con circa 18000 morti l’anno.
L’incidenza grezza in Italia è di 30-50 nuovi casi all’anno per 100.000 abitanti; i tassi più alti si registrano nell’Italia centrosettentrionale, quelli più bassi nel meridione.
La malattia colpisce uomini e donne in ugual frequenza, sebbene i tumori del retto mostrino una maggiore prevalenza nel sesso maschile (2:1)1; è
inoltre molto frequente in Europa occidentale, in Australia, Nuova Zelanda e negli U.S.A dove ogni anno sono diagnosticati più di 150000 nuovi casi e circa 60000 decessi.2
Al contrario paesi meno sviluppati quali Sud America, Africa e Asia presentano un’incidenza ridotta.
Tali differenze sono probabilmente ascrivibili a fattori di tipo ambientale come dimostrato in popolazioni emigrate da paesi meno sviluppati a paesi ad alta incidenza che, già dopo una generazione, acquisiscono l’incidenza del paese ospite.
I fattori di rischio chiamati in causa sono prevalentemente di tipo alimentare come l’elevato consumo di grassi e il ridotto apporto di fibre.
Il tumore colon rettale è principalmente una malattia dell’età avanzata e rappresenta una delle più importanti cause di morbilità e mortalità nel paziente anziano4.
L’età è il più importante fattore di rischio per questa patologia5.
L’incidenza di questa neoplasia raddoppia ogni decade dai 40 agli 80 anni con picco di incidenza tra 60 e 70 anni
Oltre il 90% di tutti i tumori colorettali si verifica nella popolazione di età superiore ai 50 anni e ben il 50% circa si verifica negli over 706; al
contrario risulta piuttosto raro in soggetti sotto i 50 anni nei quali il riscontro di questa neoplasia deve far sospettare la presenza di una colite ulcerosa sottostante, di una poliposi familiare o di una sindrome familiare non associata a poliposi (HNPCC).
È probabile che questo incremento progressivo dopo i 40 anni di età sia legato non soltanto ai processi di invecchiamento, ma anche al prolungato contatto con alcune sostanze cancerogene che richiedono lunghi periodi o numerosi contatti per sviluppare processi di cancerogenesi.
Il progressivo invecchiamento della popolazione a cui stiamo assistendo determinerà quindi una maggior incidenza di neoplasie colon-rettali7,8 che
si presenteranno sempre più spesso accompagnate da comorbidità croniche o severe quali malattie cardiovascolari, BPCO, ipertensione e diabete9.
Esiste inoltre una particolare distribuzione topografica di questa neoplasia, infatti, nei paesi ad elevata incidenza che, come detto, coincidono con quelli maggiormente sviluppati, le sedi più colpite sono il retto e il sigma mentre nei paesi a bassa incidenza sono più frequentemente coinvolti cieco e colon ascendente.
Tuttavia è possibile riscontrare negli ultimi anni un aumento dell’incidenza anche dei tumori delle sezioni destre soprattutto negli anziani.3
E’ discusso se la localizzazione del tumore possa rappresentare un fattore prognostico nelle neoplasie del colon retto.
O.H.Sjo et al., in uno studio prospettico su 627 pazienti con cancro del colon, eseguito tra il 1993 e il 200010 hanno riscontrato una ridotta
sopravvivenza per quei pazienti con localizzazione del tumore nel colon discendente, nel traverso e nella flessura splenica.
Questo risultato deriva da numerosi fattori come una più alta proporzione di tumori non resecabili e di resezioni R1 e R2.
Tuttavia, anche dopo una resezione R0, i tumori del colon discendente, del traverso o della flessura splenica hanno comunque una prognosi peggiore. Questo perché tali neoplasie richiedono più frequentemente interventi in regime d’urgenza che, nello stesso studio di Sjo e in numerosi altri studi11-16, risultano associati ad una ridotta sopravvivenza.
La peggiore prognosi per i tumori delle sezioni sinistre può essere inoltre ricercata nella maggior prevalenza, in queste localizzazioni, di tumori da instabilità cromosomica piuttosto che da instabilità dei microsatelliti; quest’ultimi, molto più rappresentati nelle sezioni destre (20% contro 1%)18, hanno infatti una prognosi migliore17 indipendentemente dallo
stadio o da altre variabili clinico-patologiche.
Anche altri studi hanno riportato una prognosi peggiore per i tumori delle sezioni sinistre.19
Questo potrebbe avere un ruolo nel definire l’importanza in termini di morbilità e mortalità che la neoplasia colon-rettale riveste nei paesi industrializzati dove le sedi più colpite sono retto e sigma.
COMPLICANZE DEL CANCRO DEL COLON-RETTO
EPIDEMIOLOGIALa percentuale dei pazienti in cui l’esordio clinico del tumore colon rettale risulta dovuto ad una complicanza acuta varia in letteratura dall’11% al 43%20.
La zona in cui un tumore del colon si presenta più frequentemente con una complicanza è il colon sinistro (20%) mentre sono estremamente rare le complicanze dovute a neoplasie rettali21,22.
La complicanza in assoluto più frequente risulta essere l’occlusione la cui incidenza riportata spazia tra l’8% e il 29%21,23-24 rappresentando ben
l’85%25,26 delle emergenze coliche.
La seconda complicanza più frequente è invece la perforazione che, in letteratura, ha un range di incidenza compreso tra 1,2% e 10%27-35.
Tale perforazione può avvenire tramite due diverse modalità:
1) nella sede del tumore stesso per necrosi tumorale
2) nel tratto prossimale del colon per diastasi secondaria all’ostruzione causata dal tumore
Tra queste, quella conseguente alla necrosi del tumore è la più frequente avendo un’incidenza del 65%, mentre quella dovuta a perforazione diastasica 28 avviene solo nel 35% dei casi.
La complicanza meno frequente è invece l’emorragia.
Occlusione
L’occlusione è la complicanza più frequente nei pazienti affetti da carcinoma del colon.
Tale evenienza è molto più frequente per i tumori localizzati nelle sezioni sinistre del colon dove il calibro intestinale è minore, le feci sono più solide e i tumori tendono a presentarsi come anulari infiltranti dando, frequentemente, anche stenosi ad anello.
Nello studio di Phillips RKS et al. condotto su 713 pazienti con occlusione da carcinoma del colon la sede più frequente di tumori occludenti risulta essere l’angolo splenico (49%) seguito dal colon traverso (23%)36.
Anche Yee Man Lee et al. hanno condotto uno studio retrospettivo su 243 pazienti sottoposti a chirurgia d’urgenza per carcinoma del colon ostruente tra il 1989 e il 1997 al Queen Mary Hospital di Hong Kong; in questo studio la localizzazione più frequente del tumore è risultata invece il sigma (32%), con ben il 56% dei tumori ostruenti localizzati nella porzione del colon situato distalmente alla flessura splenica (non compresa)37.
Risulta invece poco frequente l’occlusione da tumore del retto in tutti questi studi.
La ridotta frequenza delle occlusioni del retto è probabilmente da ricercare nella precocità dei sintomi locali che portano più rapidamente alla diagnosi37.
Contrariamente ai tumori del colon sinistro, i tumori del colon destro, presentandosi principalmente in forma vegetante e avendo a disposizione un calibro maggiore ed una minore consistenza del contenuto intestinale, tendono a dare raramente e solo tardivamente segni di ostruzione, a meno che non venga coinvolta precocemente la valvola ileocecale.
In ragione di ciò solo il 22% circa delle occlusioni intestinali da carcinoma colon-rettale sono dovute ad un tumore del colon destro.
La patologia neoplastica è la causa principale di occlusione meccanica del colon (75% a carico di colon discendente-sigma) e precede le altre cause “benigne” di occlusione quali la malattia diverticolare (70% nel sigma e 30% nel cieco), il laparocele complicato, la sindrome aderenziale, l’invaginazione intestinale e i fecalomi.
Perforazione
La perforazione del colon è una complicanza rara ma temibile della neoplasia colon rettale.
Nonostante la sua bassa incidenza è la seconda causa di peritonite di origine colica dopo la diverticolite acuta perforata38.
La perforazione può avvenire nel sito della neoplasia a causa della necrosi tumorale oppure, più raramente (circa il 35% dei casi), nel tratto posto prossimalmente ad essa, secondariamente all’occlusione intestinale e alla distensione diastasica del colon.
La perforazione diastasica avviene principalmente a livello del cieco; seguono per incidenza trasverso e sigma.
Emorragia
In letteratura la frequenza relativa della neoplasia colon-rettale come causa di emorragia digestiva inferiore, rimane costantemente vicina al 6%.39-41
FISIOPATOLOGIA DEL CANCRO DEL COLON-RETTO COMPLICATO
Occlusione
L’ occlusione intestinale si trasforma in una situazione di emergenza passando da 6 momenti patogenetici fondamentali che si alimentano a vicenda instaurando un circolo vizioso arrestabile solo con la decompressione del viscere.
Tali momenti sono
1. Alterazioni idroelettrolitiche 2. Alterazione dei gas
3. Alterazione della flora microbica 4. Alterazioni circolatorie
5. Compromissione della funzione di barriera della parete.
6. Alterazione della peristalsi
- alterazioni idroelettrolitiche
A monte dell’ostruzione si verifica inevitabilmente un accumulo di liquidi dovuto, non soltanto ai liquidi ingeriti, alla saliva deglutita e alle secrezioni gastriche e bilio-pancreatiche, ma anche a modificazioni del flusso idroelettrolitico attraverso la parete intestinale.
Difatti, a causa della carica osmotica del contenuto fecale che si accumula a monte della stenosi e della compromissione della funzione di barriera della mucosa intestinale, si ha prima una riduzione del normale flusso di sodio e di liquidi dal lume intestinale alla circolazione e, successivamente, una vera e propria inversione di tale flusso con sequestro di liquidi nell’intestino.
Ciò comporta un’ulteriore distensione intestinale con valori pressori intraluminali che passano dai normali 2-4 cm H2O a 8-10 cm H2O raggiungendo i 30-60 cm H2O al momento della peristalsi. Inoltre, la sottrazione di circa 7-10 litri di liquidi nelle 24 ore con l’associato sequestro di elettroliti fisiologicamente presenti nei succhi intestinali, comporta un grave stato di disidratazione ipocloremica e ipopotassiemica evolvente verso l’alcalosi metabolica con emoconcentrazione, insufficienza renale e shock ipovolemico.
Tale condizione, agli inizi del secolo scorso (prima che Hertwell e Huguet nel 1921 cominciassero a correggere lo squilibrio idro-elettrolitico in questi pazienti), si rendeva responsabile della quasi totalità delle morti per occlusione intestinale.
Il persistere della condizione occlusiva comporta anche il passaggio di liquidi dapprima nell’interstizio della parete intestinale ed in seguito in cavità peritoneale per trasudazione.
- alterazione dei gas
Nelle fasi precoci dell’occlusione il gas contenuto nel lume intestinale è costituito prevalentemente da aria ingerita (70-80%) che, essendo composta principalmente di azoto, gas il cui assorbimento intestinale è pressoché nullo, contribuisce, assieme ai liquidi e al materiale fecale, a provocare la distensione intestinale.
Successivamente, a causa della crescita e della fermentazione batterica, il volume di gas nel lume intestinale aumenta ulteriormente.
- alterazione della flora microbica
Nel colon è fisiologicamente presente un’elevata carica batterica al punto che oltre un terzo del peso delle feci essiccate risulta costituito da batteri. Quasi il 99% dei batteri presenti fisiologicamente sono anaerobi non sporigeni quali Bacteroides, Eubacteria e Bifidobacteria (anaerobi:aerobi > 100:1).
La condizione di occlusione e la relativa stasi di feci e liquidi producono un terreno di coltura ideale per la crescita batterica, soprattutto di anaerobi. La maggior parte dei ricercatori ritiene che la carica batterica, per quanto aumentata, non rivesta un ruolo sicuramente patologico nell’occlusione intestinale finché la parete intestinale è integra.
– alterazioni circolatorie
Nell’ostruzione il flusso ematico nella mucosa del tratto prossimale all’occlusione si riduce per effetto della compressione da dilatazione del viscere42.
Risulta aumentato, invece, il flusso ematico a livello della componente muscolare, verosimilmente come conseguenza dell’ipertrofia secondaria alle ripetute contrazioni.
Sembra pertanto che, durante l´occlusione intestinale, esista una perfusione preferenziale della muscolare rispetto alla mucosa, con danno ischemico che si realizza principalmente a livello di quest’ultima. Per questo, al tavolo operatorio, l’intestino può apparire perfettamente integro alla sola ispezione.
- alterazioni della funzione di parete
La distensione e la compromissione vascolare comportano un’alterazione della funzione di barriera della mucosa intestinale con gravi conseguenze come l’inversione del flusso idroelettrolitico transparietale (con aggravamento della disidratazione e della distensione stessa) e la traslocazione batterica attraverso la parete intestinale.
Con “traslocazione batterica” si intende il passaggio dei batteri o dei loro prodotti tossici attraverso la parete del colon complice il sopravvento della aumentata concentrazione batterica intestinale sulla difesa dell’ospite.
In condizioni fisiologiche la parete intestinale impedisce l’assorbimento batterico, sia grazie a caratteristiche fisiche delle cellule epiteliali e delle giunzioni strette poste tra esse, sia grazie ad un efficiente difesa immunologica data da secrezione di IgA e presenza di linfociti, macrofagi e linfonodi all’interno della stessa parete colica.
Studi eseguiti sul topo hanno dimostrato come la traslocazione batterica ai linfonodi mesenterici avvenga circa 6 ore dopo la legatura dell’intestino con diffusione agli organi addominali nel giro di 24-48 ore43.
In modelli animali è stato visto che il primum movens di questa traslocazione è probabilmente il passaggio di endotossina sia attraverso le cellule epiteliali che per via paracellulare.
Sebbene questa endotossina venga solitamente fagocitata dai macrofagi e trasportata ai linfonodi regionali, quando si trova in elevata concentrazione secondariamente alla elevata carica batterica nell’intestino occluso, una certa quantità di essa riesce ad evitare tale meccanismo di difesa raggiungendo autonomamente le stazioni linfonodali e il cavo peritoneale. Da qui promuoverebbe l’ulteriore traslocazione batterica con distruzione delle “tight Junctions” cellulari44
I batteri, superata la barriera parietale, vanno a localizzarsi nei linfonodi mesenterici, come dimostrato da Sagar et al. che riscontrarono una coltura
positiva dei linfonodi mesenterici in circa il 40% dei pazienti con occlusione intestinale contro il 7,3% dei pazienti senza occlusione44.
Dai linfonodi mesenterici, i batteri, possono poi rendersi protagonisti di complicanze settiche post operatorie come dimostrato dalla più alta incidenza di queste in pazienti con colture linfonodali positive.
E’ bene comunque puntualizzare che, la traslocazione batterica ai linfonodi, non rappresenta un evento necessario e sufficiente per lo sviluppo di complicanze settiche in quanto la maggior parte dei pazienti in cui è dimostrabile non sviluppa complicanze.
Sebbene i batteri anaerobi siano di gran lunga più rappresentati, il fenomeno della traslocazione sembra interessare prevalentemente gli aerobi, tanto che il batterio più frequentemente isolato nei linfonodi di pazienti occlusi è l’E.Coli.
Tuttavia lo stesso studio di Sagar ha sottolineato che, tale prevalenza, può dipendere, almeno in parte, dalla maggiore facilità di coltura di questo batterio44.
E’ stato inoltre evidenziato come più l’occlusione si presenti distalmente più le colture linfonodali risultino positive agli anaerobi.
- alterazioni della peristalsi
Le alterazioni della peristalsi sono state ben documentate nell’uomo ed in altri animali come scimmie e maiali.
Si può apprezzare, anche già con l’auscultazione, come il tratto di intestino a monte della stenosi tenti tramite un ipermotilità, peraltro disordinata e tumultuosa, di vincere l’ostacolato transito intestinale nelle fasi iniziali di un occlusione.
Difatti la distensione radiale rappresenta lo stimolo più importante all’attività propulsiva del colon in quanto, stimolando i neuroni presenti nel plesso mioenterico e sottomucoso, genera un riflesso intrinseco ascendente eccitatorio e uno discendente inibitorio che comportano, contemporaneamente, la contrazione sul versante orale e il rilasciamento sul versante anale del muscolo circolare.
In seguito la peristalsi si fa meno frequente fino a scomparire per esaurimento funzionale.
Perforazione
La perforazione può avvenire secondo le due modalità già viste: la necrosi tumorale (circa il 65% dei casi) e la perforazione diastasica (nel rimanente 35% dei casi).
Gli effetti di questa complicanza sono strettamente legati all’ estensione e al tipo di peritonite che ne deriva.
- Perforazione da necrosi del tumore
In questo caso la perforazione si verifica perché la crescita del tumore non è accompagnata ad un’adeguata vascolarizzazione, perciò si ha ischemia e necrosi della massa neoplastica.
La sede maggiormente coinvolta dalla perforazione secondaria a necrosi del tumore è il sigma22,27,33,34,45-47
La peritonite che ne consegue, seppur grave, si presenta in genere localizzata e purulenta per la maggiore consistenza e disidratazione delle feci che ne ostacolano la diffusione a tutto il peritoneo.
Si ha, dunque, un miglior controllo delle complicanze settiche acute che si traduce in una mortalità decisamente inferiore rispetto alle perforazioni diastasiche.
- Perforazione diastasica secondaria all’occlusione
La perforazione diastatica, invece, è molto più grave, in quanto produce una peritonite diffusa e fecaloide (stadi III e IV di Hinchey) che porta la maggior parte dei pazienti a morte entro 48 ore dall’ammissione o a sviluppare complicanze settiche nel post operatorio27,48.
E’ sempre associata alla continenza della valvola ileo cecale che, impedendo il reflusso di materiale fecale nel tenue, comporta una occlusione ad ansa chiusa con grande distensione del colon, sofferenza dei vasi sottili intramurali posti sul margine antimesenterico e conseguente necrosi di parete.
La zona più colpita da perforazione diastasica è il cieco dove il raggio è maggiore e la tensione di parete raggiunge valori più elevati per la legge di LaPlace (T=p x R); questo spiega l’entità della contaminazione peritoneale, considerato che il contenuto fecale del colon prossimale è caratteristicamente più liquido.
La pressione di rottura del cieco è compresa tra 70 e 100 mmHg corrispondente ad una dilatazione di 9-12 cm
Emorragia
Il sanguinamento, sia esso microscopico o macroscopico, è uno degli eventi più frequenti nella patologia neoplastica intestinale. Spesso è il sintomo che porta il paziente a rivolgersi al medico e un quadro di
anemizzazione cronica in un paziente anziano deve sempre far sospettare un tumore del colon destro.
Tuttavia è molto raro che tale sanguinamento sia di entità tale da determinare un quadro di shock emorragico e rappresentare un’emergenza.
DIAGNOSI
In regime d’urgenza, ogni atto diagnostico, dovrebbe essere guidato da uno specifico quesito clinico.
La diagnosi di occlusione o perforazione è, pertanto, prevalentemente clinica e l’imaging è limitato quasi esclusivamente all’utilizzo di una sola Rx diretta dell’addome.
Ulteriori indagini diagnostiche sono semmai necessarie ad accertare l’origine neoplastica di queste complicanze.
OCCLUSIONE
clinica
I sintomi tipici dell’occlusione intestinale sono dolore, distensione addominale, chiusura dell’alvo a feci e gas e vomito.
L’entità del quadro clinico varia, comunque, in relazione a vari fattori come la rapidità di insorgenza dell’occlusione, il grado di ostruzione, la competenza della valvola ileo cecale ecc.
L’occlusione intestinale, di per se, non produce una situazione di peritonite: solitamente, il paziente, riferisce un alternarsi di periodi di relativo benessere con attacchi parossistici caratterizzati da dolore colico crampiforme, sordo, di modesta intensità e mal localizzabile, in
concomitanza dei quali, riesce persino ad udire i borborigmi del proprio intestino.
Nei pazienti anziani tale dolore può addirittura essere assente.
L’instaurarsi di una condizione di addome acuto di tipo peritonitico con dolore intenso continuo, diffuso a tutti i quadranti e reazione di difesa della parete addominale, deve immediatamente far sospettare una perforazione od uno strangolamento.
La distensione intestinale è solitamente molto accentuata, soprattutto se l’occlusione è a livello del colon distale e la valvola ileo-cecale è continente. Il rischio, in quest’ultima eventualità, è la perforazione diastasica del colon.
L’incontinenza della valvola ileocecale comporta invece uno svuotamento del contenuto colico nel piccolo intestino, con obiettività che assume anche le caratteristiche di un’occlusione del piccolo intestino rendendo difficoltosa la diagnosi differenziale.
Il vomito, che solitamente aggrava le alterazioni idroelettrolitiche nelle occlusioni del piccolo intestino, nelle occlusioni del colon è meno frequente e diviene sempre più raro quanto più distale è l’ostruzione.
E’ frequente il riscontro anamnestico di un recente cambiamento delle abitudini intestinali, cosa che riflette il progressivo stenosarsi del lume intestinale fino all’occlusione completa.
Spesso viene riportata una stipsi progressivamente ingravescente nei giorni immediatamente precedenti all’occlusione completa; non è raro, tuttavia, che il paziente riferisca la comparsa anche di diarrea. Tale reperto può dipendere dal fatto che, in condizioni di subocclusione, solo la componente liquida delle feci riesca a valicare la stenosi o che, l’iperperistalsi che si instaura a monte, sia in grado, almeno in parte, di vincere la resistenza della neoplasia ostruente.
Infine può essere riferita la presenza di sangue nelle feci delle ultime evacuazioni.
L’esame obiettivo trova impiego in tutte e 4 le sue applicazioni fondamentali: ispezione, palpazione, percussione, auscultazione. Ad esse sarebbe buona norma associare un esplorazione rettale.
All’ispezione l’addome si presenta disteso e può capitare, ad esempio per le occlusioni distali a valvola ileo-cecale continente, di riconoscere sulla parete addominale la cornice colica lievemente sporgente, soprattutto all’altezza del trasverso.
Alla palpazione l’addome è trattabile; il riscontro di reazione di difesa parietale, specie se accompagnata da dolore intenso e febbre, è espressione
di una peritonite sottostante solitamente dovuta ad una perforazione o ad uno strangolamento.
Possono essere rilevate delle masse dovute alla neoplasia stessa o all’elevata distensione del cieco.
Alla percussione si reperirà timpanismo diffuso mentre, all’auscultazione, sarà possibile, soprattutto nelle fasi iniziali, avvertire il timbro metallico delle numerose peristalsi a monte della stenosi e il segno del guazzamento. Nelle fasi tardive, in seguito all’esaurimento funzionale, il reperto auscultatorio può ricalcare quello di un ileo adinamico presentando silenzio peristaltico.
Il rilevamento di una tachicardia, invece, è segno di ipovolemia causata dell’elevato stato di disidratazione del paziente.
L’esplorazione rettale, infine, è di grande aiuto per evidenziare la totale assenza di feci o la presenza di sangue in ampolla rettale.
esami di laboratorio
L’esame del sangue può evidenziare una emoconcentrazione secondaria allo stato di disidratazione, un iperazotemia e, eventualmente, una modesta leucocitosi per la transmigrazione batterica. L’emogasanalisi, invece, può evidenziare lo stato di alcalosi metabolica
indagini di imaging
L’esame diretto dell’addome è l’unica metodica di imaging che permette di rispondere al quesito clinico di occlusione intestinale in tempi sufficientemente brevi da non mettere a repentaglio la vita del paziente. Tramite questa metodica è possibile, oltre che confermare la diagnosi, individuare la sede dell’occlusione, stabilire il grado dell’occlusione e valutare la continenza della valvola ileo-cecale tramite segni radiografici indiretti.
Il segno principe dell’occlusione intestinale è la presenza dei livelli idro-aerei evidenziabili in ortostatismo, espressione della stasi del contenuto intestinale e della dilatazione.
La disposizione di questi ultimi può essere d’aiuto per localizzare il sito della stenosi, difatti le occlusioni dell’intestino tenue, presentano principalmente una distribuzione dei livelli “a scalinata” mentre, le occlusioni del colon, presentano una distribuzione molto più disordinata. La distensione del solo intestino crasso è indicativo di valvola ileo-cecale continente nel contesto di un ileo meccanico.
Al contrario la distensione sia del piccolo che del grande intestino rende difficile la diagnosi differenziale tra un ileo meccanico del colon con valvola incontinente ed un ileo paralitico.
PERFORAZIONE
clinica
La perforazione del colon si manifesta con un quadro di addome acuto peritonitico il cui sintomo fondamentale è il dolore addominale acuto. Il dolore, in questo caso, è acuto, severo, continuo, ad insorgenza improvvisa ed esacerbato dagli atti inspiratori e dal movimento. Anche se tende a diffondersi a tutto l’addome, generalmente, il dolore è più circoscritto rispetto a quello dovuto ad un quadro occlusivo e rispecchia nella sua localizzazione il sito di perforazione.
Una perforazione della flessura epatica darà, quindi, un dolore localizzato in ipocondrio destro; una perforazione della flessura splenica lo darà in ipocondrio sinistro mentre una perforazione del sigma lo darà in fossa iliaca sinistra.
Le peritoniti diffuse e fecali quali quelle secondarie a perforazione diastasica del cieco, invece, danno un dolore addominale diffuso.
La peritonite determina una febbre di tipo settico a cui si associa una leucocitosi agli esami ematochimici.
Altri sintomi descritti sono: perdita di peso, massa palpabile e feci sanguinolente30.
Possono essere presenti vomito, singhiozzo e raramente diarrea (diarrea peritonitica).
All’esame obiettivo l’addome si presenta con reazione di difesa parietale che, come il dolore, tende ad essere inizialmente circoscritta alle zone corrispondenti alla sede primitiva della perforazione per poi generalizzarsi ed intensificarsi fino al cosiddetto addome ligneo. L’addome si presenta inoltre estremamente dolorabile alla palpazione ed il segno di Blumberg è positivo.
Alla percussione si ha la scomparsa dell’aia di ottusità epatica e splenica per l’interporsi tra gli organi e la parete addominale di aria libera proveniente dallo stesso viscere perforato o prodotta dai germi aerogeni. All’auscultazione si reperta silenzio sepolcrale per l’ileo paralitico secondario alla peritonite.
diagnostica per immagini
Come per l’occlusione, la metodica di studio più efficace, è lo studio radiografico dell’addome in bianco.
In questo caso, il segno più importante, è la presenza di aria libera in addome, valutabile sull’Rx con la presenza di una falce aerea sottodiaframmatica.
Può essere utile anche un esame ecografico per individuare raccolte in peritoneo.
La TC presenta tempi di esecuzione più lunghi e, anche se può rendersi necessaria per dimostrare minime raccolte d’aria, trova rare applicazioni nella perforazione.
In conclusione solo la laparotomia d’urgenza può dare la certezza di perforazione.
EMORRAGIA
clinica
Il paziente con emorragia acuta si presenta pallido, ipoteso, con evidente agitazione psicomotoria e tachicardia. Lo shock ipovolemico si ha quando le perdite ematiche si avvicinano al 40% del volume ematico; tale evenienza deve essere evitata con un immediato ripristino di una volemia adeguata.
Quando, invece, le perdite ematiche raggiungono una percentuale del 20% si può riscontrare un calo della pressione arteriosa di 10 mmHg nel passaggio dal clinostatismo all’ortostatismo.
Per tale motivo è sempre opportuno misurare la pressione in entrambe queste posizioni.
esami di laboratorio
L’ematocrito ha scarso significato nel contesto di un emorragia acuta in quanto vengono persi sia cellule ematiche che plasma perciò l’emoglobina risulta poco o niente alterata.
La caduta si verifica infatti ben circa 72 ore dopo, quando i liquidi del compartimento extracellulare passano in circolo per ripristinare la volemia.
diagnostica strumentale
La diagnostica strumentale, nel caso dell’emorragia digestiva inferiore come complicanza del tumore del colon, è fortemente limitata.
La prima cosa da fare, è accertare l’origine bassa dell’emorragia mediante l’utilizzo di una rettoscopia, utile anche per escludere lesioni a carico dell’ampolla rettale o una rettocolite ulcerosa. E’ importante poi escludere un’emorragia superiore tramite sondino naso-gastrico.
Se il paziente è instabile perché l’emorragia è massiva e persistente, una angiografia immediata può essere diagnostica.
E’ invece più utile una scintigrafia dinamica qualora il sanguinamento persistesse senza dare rilevanza clinica.
Altre procedure endoscopiche sono pressochè inutili se l’entità del sanguinamento è imponente. L’utilizzo di una colonscopia dovrebbe essere limitato a quei casi di sanguinamento attivo ma non massivo o solo quando non è possibile fare un’angiografia o una scintigrafia o quando questi
esami si siano rivelati inconcludenti. La colonscopia deve comunque essere eseguita o subito dopo l’inizio o all’arresto dell’emorragia53
Se l’emorragia non si arresta, i suddetti esami risultano inconcludenti o il reintegro volemico mediante emotrasfusioni non porta a stabilizzare il paziente, l’unica soluzione è la laparotomia d’urgenza che funge così da strumento diagnostico e terapeutico.
CRITERI DI RESEZIONE ONCOLOGICA DEL CANCRO DEL COLON RETTO
Le attuali linee guida per un adeguata resezione oncologica del tumore colon rettale comprendono:
1) Estensione della resezione dell’intestino comprensiva della neoplasia
stessa con 5 - 10 cm di intestino sano sia prossimalmente che distalmente alla neoplasia.
2) Linfadenectomia con rimozione di almeno 12-15 linfonodi 3) Resezione en bloc di tutte le strutture aderenti alla neoplasia
Secondo l’ American Association of Colon and Rectal Surgeons questi 3 punti raggiungono un livello di evidenza di classe II e devono essere considerati risultati di raccomandazione (rispettivamente grado B, A e B)49.
5-10 cm di intestino su entrambi i lati del tumore costituiscono il volume minimo di resezione viscerale necessario per asportare i linfonodi pericolici e paracolici (lungo l'arcata marginale) e ridurre le recidive anastomotiche50. Anche il livello della sezione del peduncolo vascolare
condiziona il volume della linfoadenectomia; il peduncolo vascolare principale dovrebbe essere legato e sezionato all’origine per la rimozione dei linfonodi apicali50.
Se il tumore è equidistante dai due peduncoli vascolari principali, entrambi dovrebbero essere sezionati all'origine.
La sopravvivenza aumenta in funzione sia del numero totale di linfonodi asportati che di quelli negativi51,52.
La rimozione di tutti i linfonodi metastatici permette di definire una resezione come R0.
I linfonodi asportati devono essere almeno 12-15 e risultare negativi per avere un grado elevato di certezza (>90%) che la malattia sia N0.
La gestione standard del tumore primitivo del colon-retto potenzialmente curabile in elezione deve seguire tali linee guida.
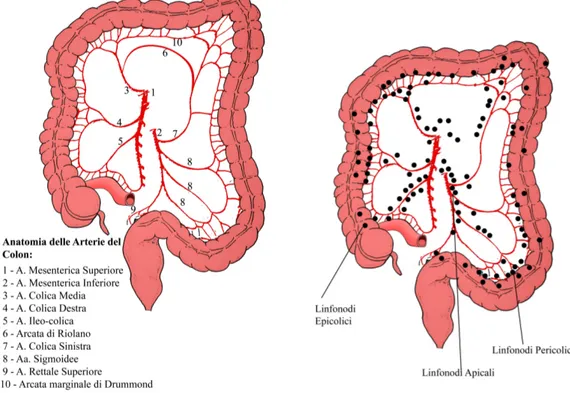
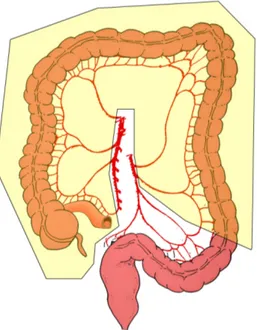
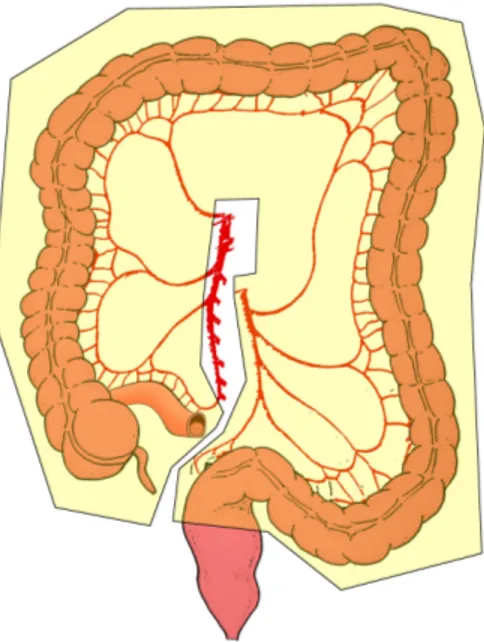
Fig. 1: a) Anatomia delle arterie del colon
La perfetta adesione a queste raccomandazioni può invece risultare difficoltosa e deficitaria in condizioni di urgenza dove le attenzioni principali del chirurgo tendono ad essere rivolte al controllo della complicanza che, più concretamente, minaccia la vita del paziente.
Questo può avere un impatto notevole sulla sopravvivenza a lungo termine.
Lo scopo di questa tesi è di valutare se la colectomia d’urgenza per i tumori primitivi del colon retto complicati può essere eseguita aderendo alle suddette linee guida
CHIRURGIA D’URGENZA DELLE
COMPLICANZE NEOPLASTICHE COLON
RETTALI
Il trattamento chirurgico delle complicanze acute della neoplasia colon-rettale varia in base al tipo di complicanza, alle condizioni generali e all’età del paziente, alla localizzazione e allo stadio del tumore.
Nel corso degli anni l’atteggiamento della chirurgia d’urgenza nei confronti delle complicanze del tumore colon-rettale è divenuto sempre più aggressivo e radicale11,21,22,27,54.
Tuttavia è ancora discusso se sia possibile applicare le linee guida per un adeguata resezione oncologica anche in regime d’urgenza, situazione che pone numerose problematiche sia per la condizione critica del paziente, sia per la difficoltà di manipolazione del colon complicato, sia per la severità della contaminazione/infezione peritoneale.
OCCLUSIONE
Occlusione da tumori delle sezioni destre
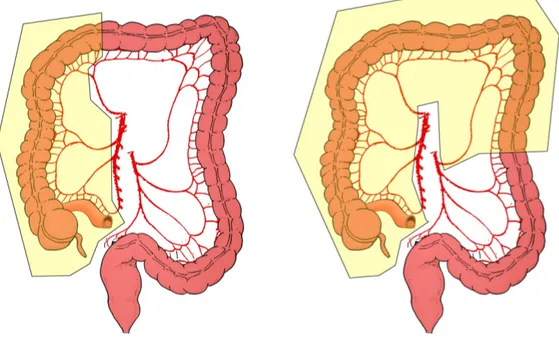
Per i tumori ostruttivi del cieco, del colon ascendente e della flessura epatica è quasi sempre indicata l’emicolectomia destra, più o meno estesa, con anastomosi ileo-trasverso-colica primaria55,56.
Questa procedura implica la rimozione dell’intestino a partire da 4-6 cm prossimalmente alla valvola ileo-cecale fino alla porzione di trasverso irrorata dalla branca destra dell’arteria medio-colica.
L’anastomosi viene quindi perfezionata tra l’ileo terminale ed il colon trasverso.
Fig. 2: a) Emicolectomia Destra b)Emicolectomia Destra Estesa
In caso di peritonite stercoracea, quale quella secondaria a perforazione diastasica del colon, è opportuno far seguire all’emicolectomia destra un ileostomia terminale con affondamento del trasverso (o una fistola mucosa distale) con il ripristino della continuità intestinale in un secondo tempo. L’emicolectomia destra (eventualmente estesa) è la procedura di scelta anche per quei tumori localizzati nel colon trasverso prossimalmente alla flessura splenica36; ad essa segue l’anastomosi tra ileo terminale e colon
discendente prossimale oppure il confezionamento di ileostomia terminale con affondamento del moncone distale e ricongiungimento in un secondo tempo.
Il Large Bowel Cancer Project ha riportato per questo tipo di intervento, eseguito per le occlusioni delle sezioni destre del colon da cancro colo-rettale, un tasso di deiscenza anastomotica non significativamente diverso dagli interventi eseguiti in elezione (6% vs 10% ; p=ns)
Tale procedura deve essere preceduta da una decompressione intraoperatoria nei casi di notevole distensione intestinale per rendere l’intestino più maneggevole e interrompere il circolo vizioso fisiopatologico conseguente alla distensione.
La decompressione può essere eseguita a livello del colon trasverso o del cieco. Nel primo caso viene introdotto obliquamente un ago di grosso calibro (12-gauge) attraverso una delle 3 tenie; nel secondo caso invece
viene eseguita tramite ileostomia nel cieco mediante un catetere a palloncino.
Per i tumori non resecabili si può invece procedere eseguendo un bypass dell’ostruzione praticando un anastomosi latero-laterale tra l’ileo ed un segmento colico a valle della stenosi.
Occlusioni da tumori delle sezioni sinistre
La terapia chirurgica dei tumori ostruenti del colon sinistro è più complessa e non tutti gli autori concordano su una procedura chirurgica standard.
I tipi d’approccio sono tre:
- l’intervento in tre tempi, oramai da considerarsi appartenente ad un background storico per l’elevato numero di interventi e le possibili
complicanze associate ad ognuno di essi. - l’intervento a due tempi
- l’intervento in un tempo che negli ultimi anni è stato sempre più preferito
Gli interventi a più tempi sono fondamentalmente caratterizzati dal confezionamento di una colostomia temporanea utile per rimuovere lo stato d’urgenza provocato dall’occlusione e per ridurre il rischio di deiscenza anastomotica.
La colostomia temporanea è inoltre necessaria in caso di emodinamica insufficiente, tendenza all’emorragia nel cirrotico o tumori rettali molto bassi.
- Approccio a tre tempi
L’approccio a 3 tempi si compone di 3 diversi momenti: un primo intervento decompressivo in cui viene perfezionata una stomia (cecostomia o trasversostomia), un secondo intervento di resezione del segmento di intestino contenente la neoplasia ed infine un terzo intervento di chiusura della stomia e di ripristino della continuità intestinale.
Questo approccio tuttavia presenta un elevato tasso di mortalità e morbilità per l’elevato numero di intervento chirurgici a cui il paziente deve essere sottoposto58 e tassi di sopravvivenza a 5 anni molto bassi che spaziano dal
10 al 16%59-61
Più ragionevole anche se riservata a casi estremamente selezionati sembrerebbe l’approccio a due tempi.
- Approccio a due tempi
Tra le varie metodiche di approccio a due tempi quella più importante è l’intervento di Hartmann frequentemente utilizzata nelle occlusioni e nelle perforazioni del sigma e della giunzione retto sigma.
L’intervento di Hartmann è caratterizzato da una prima resezione del sigma con confezionamento di colostomia terminale e affondamento del moncone rettale, seguita poi, circa tre mesi dopo, da un intervento di ricanalizzazione oggi reso più agevole da suturatrici meccaniche come lo stapler.
Altre tipologie di intervento a due tempi sono la resezione a doppia colostomia e la resezione-anastomosi con colostomia di protezione entrambe seguite da un secondo intervento di chiusura della stomia.
I vantaggi di queste procedure comprendono l’immediata resezione dell’ostruzione e il mancato confezionamento dell’anastomosi con conseguente minor tempo di ospedalizzazione.
Tuttavia queste procedure si fermano spesso al primo intervento come riportato in alcuni studi nei quali la procedura di Hartmann viene associata ad un elevato tasso di colostomia permanente (circa 70%)62-65 sia a causa
delle aderenze formatesi in seguito al primo intervento resettivo sia perchè molti dei pazienti rifiutano un secondo intervento.
Inoltre non sono rare le complicanze associate alla successiva rianastomosi come sottolineato da uno studio di Porter et al. dove l’incidenza di queste è risultata prossima al 25% in tutti i pazienti sottoposti ad intervento di Hartmann per neoplasia o diverticolite66.
L’Hartmann rimane comunque una valida opzione terapeutica per tutti i casi in cui siano presenti fattori di rischio per la deiscenza anastomotica come perforazione, precario stato nutrizionale e immunosoppressione oppure nei casi di malattia neoplastica avanzata (metastasi epatiche diffuse, carcinosi peritoneale).
- Approccio ad un tempo
L’approccio ad un tempo, caratterizzato da resezione e confezionamento di anastomosi nel contesto dello stesso intervento chirurgico, è, secondo alcuni autori, attualmente la scelta più indicata presentando morbilità e mortalità sovrapponibili a quelle cumulative dell’approccio a più tempi. Questa metodica riduce notevolmente la degenza ospedaliera totale, limitata, almeno potenzialmente, ad un unico ricovero e soprattutto elimina il confezionamento di stomia67, poco accettata dai pazienti per il forte
disagio che comporta68, di difficile gestione soprattutto per il paziente
geriatrico e spesso soggetta a complicanze (34%)69 come infezioni cutanee,
I risultati negativi ottenuti all’inizio del ventesimo secolo con la resezione-anastomosi immediata36 hanno negativamente influenzato l’atteggiamento
chirurgico nei confronti di questa tecnica per molti decenni. L’introduzione di opportune procedure per limitare l’overload fecale, quale il lavaggio intraoperatorio del colon, ne hanno permesso l’utilizzo mantenendo livelli di rischio accettabili, cambiando così notevolmente le attenzioni dei chirurghi nei confronti della resezione ad un tempo.
La presenza di contenuto fecale nel colon, a causa della mancata preparazione intestinale, infatti, sembra essere la causa principale di deiscenza anastomotica come dimostrato da studi eseguiti su modelli animali70,71.
Altri autori ritengono che anche la contaminazione fecale del peritoneo giochi un ruolo importante nella deiscenza dell’anastomosi, tuttavia Irvin e Goligher in uno studio retrospettivo non hanno trovato alcuna relazione tra la sepsi peritoneale e questa complicanza72.
Il motivo per cui la mancanza di un’adeguata preparazione intestinale comporti un maggior rischio di deiscenza può essere ricercato sia in una componente meccanica esercitata dalle feci sull’anastomosi (soprattutto nelle fasi precoci di guarigione) sia in una componente infettiva in quanto le feci, determinando l’infezione della ferita, provocano a tale livello alterazioni di sintesi e di metabolismo del collagene73,74.
Tale motivo ha probabilmente indotto Dudley et al. a modificare un preesistente procedimento descritto da Muir addirittura nel 1968 introducendo il lavaggio intraoperatorio75,76.
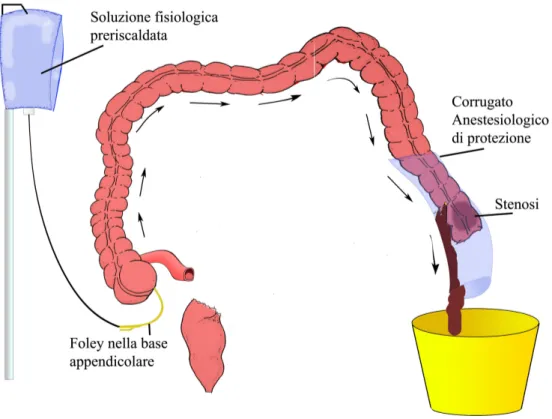
Il lavaggio intraoperatorio, necessariamente preceduto da un ampia mobilizzazione dell’intestino in corrispondenza della sede dell’ostruzione e di un lungo segmento soprastante, consiste nel far transitare nel colon a monte dell’ostruzione una gran quantità di soluzione fisiologica scaldata a 37°C fatta entrare nel lume ciecale attraverso una Foley di grosse
di-Fig. 3: Schematizzazione del lavaggio intraoperatorio:
L’immagine si riferisce in particolare all’ intervento eseguito su L.T. di anni 82 sottoposto a sigmoidectomia per occlusione intestinale.
mensioni inserita nella base d’impianto dell’appendice (precedentemente asportata) o nell’ultima ansa ileale previo confezionamento di una borsa di tabacco.
Il colon, chiuso mediante una suturatrice meccanica immediatamente sotto la stenosi, viene mobilizzato e dislocato esternamente al campo operatorio dopo esser stato opportunamente protetto da un involucro sterile.
La fisiologica immessa nel colon viene quindi fatta uscire attraverso un apertura realizzata prossimalmente alla stenosi.
Le feci vengono così lavate efficacemente dal flusso di fisiologica (aiutato dal massaggio dell’operatore) e raccolte in un contenitore comunicante con l’estremità distale dell’ involucro che avvolge il colon.
In pochi minuti sarà possibile notare la fuoriuscita di liquido di lavaggio limpido; l’intestino recupera il suo fisiologico colorito roseo divenendo così idoneo per il completamento della resezione ed il perfezionamento dell’anastomosi tra i due monconi77.
La mortalità della resezione/anastomosi con lavaggio intraoperatorio è riportata in letteratura con percentuali che spaziano dall’8%78 al 17%79.
Khosraviani et al.80 hanno riportato in uno studio retrospettivo i risultati
ottenuti dall’intervento di Hartmann su 72 pazienti presentatisi al Royal Victoria Hospital e al City Hospital di Belfast tra il 1980 e il 1998 con neoplasia colo-rettale. Questi autori hanno concluso che l’intervento ad un
tempo con lavaggio intraoperatorio dovrebbe essere preferito all’Hartmann nelle occlusioni coliche; secondo gli stessi autori l’Hartmann determinerebbe morbilità e mortalità significative legate all’età e alle condizioni generali del paziente pur rappresentando una possibile opzione in caso di grave infezione o cospicua dilatazione dell’intestino prossimale.
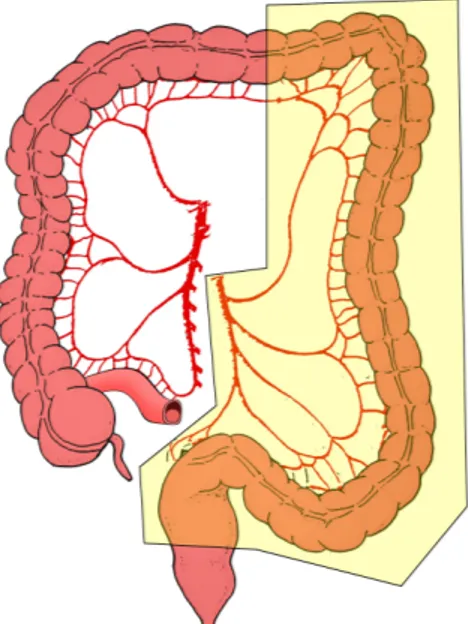
L’intervento designato per quelle lesioni localizzate in flessura splenica o nel colon discendente è l’emicolectomia sinistra che però può essere eseguita solo in caso di buone condizioni dell’intestino prossimale all’occlusione, altrimenti si rende necessaria una colectomia subtotale con ileo sigmoido anastomosi o con ileo retto anastomosi.
L’emicolectomia sinistra comprende la resezione del colon dalla metà distale del trasverso fino alla giunzione retto sigma.
La colectomia subtotale invece include, alle suddette sezioni, anche il cieco e la metà prossimale del trasverso con confezionamento di anastomosi ileo sigmoidea.
Questo tipo di approccio ottiene, in un solo intervento, la risoluzione della condizione di ostruzione e la resezione del tumore asportando un colon dilatato e pieno di feci con lesioni ischemiche e lesioni della sierosa a livello del cieco.
Inoltre assicura il ripristino della continuità intestinale mediante una sicura anastomosi ileo colica e rimuove eventuali lesioni sincrone localizzate a monte della stenosi.
I tassi di mortalità operativa sono paragonabili a quelli della chirurgia elettiva81.
La colectomia subtotale risulta particolarmente utile per le occlusioni intestinali acute da carcinoma resecabile con massiva distensione, dubbia vitalità del colon prossimale o alta probabilità di lesioni ischemiche a monte della stenosi82.
Gli interventi chirurgici ad un tempo per le neoplasie ostruenti del sigma sono la sigmoidectomia con lavaggio colico intraoperatorio e colo-retto-anastomosi oppure la colectomia totale con ileo retto colo-retto-anastomosi.
La colectomia totale si rende necessaria nelle occlusioni da neoplasie della giunzione retto-sigma, nelle neoplasie delle sezioni sinistre con contemporanea sofferenza del colon prossimale o del cieco dovuta ad una neoplasia concomitante, ad un ischemia da distensione o a perforazione diastasica oppure negli individui affetti da cancro colon-rettale ereditario non polipoide83.
Sia la colectomia totale che quella subtotale, sebbene molte volte siano necessarie, comportano un deterioramento non trascurabile della qualità di vita.
Difatti, a causa della perdita di capacità d’assorbimento del colon, queste procedure determinano una frequenza evacuativa elevata, soprattutto nel
post-operatorio, con complicanze significative secondarie alla diarrea cronica.
Tale effetto si manifesta principalmente in pazienti di età avanzata in cui questa procedura deve essere applicata per la frequente la gangrena delle sezioni a monte della stenosi84 spesso secondaria ad una diagnosi tardiva o
all’insufficienza vascolare che accompagna i pazienti geriatrici.
La diarrea può risultare ancora più imponente se il paziente presenta disturbi sfinteriali o non possiede una buona funzionalità del pavimento pelvico85.
I pazienti al di sotto di 60 anni riescono generalmente a tollerare questo tipo di intervento sviluppando un graduale adattamento della mucosa del piccolo intestino, un graduale incremento dell’assorbimento di liquidi ed
un’accettabile frequenza di evacuazione compresa tra una e tre volte al giorno.
In ragione di ciò la colectomia subtotale con ISA e la colectomia totale con IRA rappresentano una valida opzione terapeutica nei pazienti giovani. Inoltre, poiché lo sviluppo di una neoplasia intestinale è comunque un fattore di rischio per lo sviluppo di ulteriori tumori del colon, quest’intervento assume anche una funzione profilattica nei giovani che, considerata l’aspettativa di vita, possono sviluppare in futuro una neoplasia metacrona.
Alcuni autori ritengono che questo non debba comunque diventare un pretesto per l’utilizzo di una colectomia subtotale o totale81,82,86, interventi
che dovrebbero essere utilizzati solo quando non è possibile utilizzare altri interventi più conservativi.
Anche le neoplasie sincrone in assenza di occlusione intestinale non dovrebbero, per quanto possibile, essere trattate con queste procedure81,87.
PERFORAZIONE
La perforazione deve essere trattata con urgenza non appena completato l’iter diagnostico minimo indispensabile per arrivare alla diagnosi di peritonite in atto.
E’ necessario dunque provvedere immediatamente alla resezione del segmento perforato per rimuovere il focolaio settico.
Al momento attuale la strategia più accettata per le perforazioni del colon sinistro è la procedura di Hartmann (resezione e colostomia)88.
Tuttavia il trattamento chirurgico delle perforazioni varia in base a tre parametri fondamentali:
- la modalità di perforazione (diastasica o per necrosi)
- l’entità della peritonite, peraltro strettamente collegata al punto precedente
- la sede della perforazione
L’attuale tendenza al trattamento aggressivo con resezione immediata ha determinato una importante riduzione del tasso di mortalità nel tumore perforato che fortunatamente può essere resecato nel 79-87% dei casi. Viceversa la perforazione diastasica, a causa delle precarie condizioni generali del paziente, pone enormi problemi all’utilizzo di una chirurgia maggiore e deve pertanto essere spesso trattata con una chirurgia minimale con conseguenti tassi di mortalità elevati (75%)49,89
Alla resezione è importante far seguire una adeguata toilette peritoneale comprensiva di aspirazione del contenuto peritoneale, rimozione di coaguli e del materiale fibrinoso e lavaggio con abbondante soluzione fisiologica (fino a 10 litri per le peritoniti generalizzate).
Questa procedura è necessaria sia per ridurre drasticamente la carica batterica intraperitoneale mediante la rimozione del materiale altamente infetto d’origine colica sia per rimuovere il sangue e i depositi di fibrina che potrebbero generare ascessi e aderenze viscerali.
EMORRAGIA
Il trattamento chirurgico si basa sulla resezione del segmento contenente la neoplasia sanguinante.
L’approccio può essere ad un tempo con ricostruzione anastomotica immediata se il paziente non è in condizioni di instabilità emodinamica, altrimenti la continuità intestinale verrà ripristinata con un intervento successivo.
ANALISI DELLA CASISTICA
MATERIALI E METODI
Presso l’unità operativa di Chirurgia generale e d’urgenza dell’Ospedale Santa Chiara di Pisa, nel periodo compreso tra l’1 Gennaio 2006 e il 30 Aprile 2008, sono stati sottoposti a resezione chirurgica per carcinoma primitivo del colon e del retto intraperitoneale 159 pazienti non selezionati.
Sono stati esclusi da questo studio i pazienti in cui non è stato possibile eseguire una resezione (Interventi palliativi quali Stomie e By-pass), i pazienti con neoplasia colorettale non adenocarcinoma e gli adenomi non cancerizzati.
Di ogni paziente sono state registrate le variabili indipendenti quali età, sesso, ASA score, sede della lesione, stadio della malattia, presenza di metastasi epatiche, peritoneali e d’organo, esordio complicato.
Sono quindi state prese in considerazione le outcomes riguardanti il rispetto dei criteri oncologici di resezione come lunghezza del pezzo operatorio, lunghezza del margine libero distale, numero di linfonodi rimossi e resezione en bloc.
Inoltre sono state valutate anche outcomes chirurgiche di tipo generale quali l’insorgenza di complicanze, la mortalità post-operatoria (intesa come mortalità entro 30 giorni dall’intervento o mortalità durante lo stesso ricovero se esso superava i 30 giorni), la degenza post-operatoria e l’eventuale confezionamento di anastomosi immediata o di stomia di protezione.
Utilizzando queste variabili è stato costruito un database allo scopo di eseguire una valutazione prospettica dei risultati.
I pazienti sono stati quindi divisi in due gruppi a seconda della modalità di presentazione della neoplasia colo-rettale (urgenza o elezione)
30 pazienti (18,87%) compongono il gruppo A e sono stati trattati in regime d’urgenza a causa di una complicanza acuta della neoplasia colorettale. Questi comprendono 21 occlusioni (70%) e 9 perforazioni (30%). Nessun caso di emorragia si è presentato alla nostra osservazione nel periodo considerato.
Il Gruppo B include invece 129 pazienti sottoposti a colectomia in elezione.
I due gruppi sono stati analizzati tramite opportune funzioni statistiche: per le variabili parametriche continue e discrete sono state calcolate le medie in ogni gruppo e confrontate tra loro mediante il Test t di Student; le
variabili non parametriche, invece, sono state espresse in forma di percentuale e confrontate tra loro mediante il test del Chi quadro oppure mediante il Fisher Exact Test nel caso di variabili dicotomiche.
Sono stati ritenuti statisticamente significativi i risultati con p<0.05.
RISULTATI
Dei 159 pazienti presentatisi alla nostra osservazione 75 erano femmine e 84 maschi, l’età media 70,76 anni con estremi 35 e 99 anni.
Nel nostro studio, l’età media è risultata effettivamente maggiore nelle urgenze (73,4 vs 70,1) tuttavia non in modo significativo (p=0,17).
Non è stata inoltre rilevata alcuna differenza tra i due gruppi per quanto riguarda la distribuzione dei sessi (p=ns).
I pazienti sottoposti a chirurgia d’urgenza per tumore colorettale complicato presentano delle condizioni mediche preoperatorie maggiormente compromesse come dimostra la maggior prevalenza di asa III/IV nel gruppo A (56,7% vs 31,0%; p=0,011).
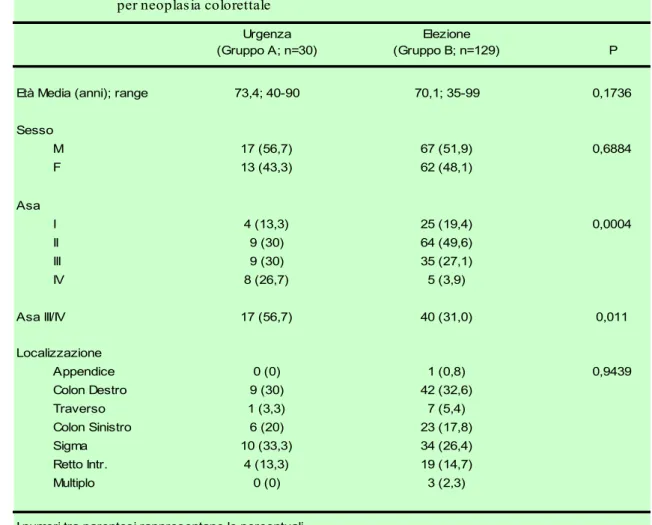
Tabella 1. Caratteristiche generali di n=159 pazienti sottoposti a resezione
per neoplasia colorettale
Urgenza Elezione
(Gruppo A; n=30) (Gruppo B; n=129) P
Età Media (anni); range 73,4; 40-90 70,1; 35-99 0,1736
Sesso M 17 (56,7) 67 (51,9) 0,6884 F 13 (43,3) 62 (48,1) Asa I 4 (13,3) 25 (19,4) 0,0004 II 9 (30) 64 (49,6) III 9 (30) 35 (27,1) IV 8 (26,7) 5 (3,9) Asa III/IV 17 (56,7) 40 (31,0) 0,011 Localizzazione Appendice 0 (0) 1 (0,8) 0,9439 Colon Destro 9 (30) 42 (32,6) Traverso 1 (3,3) 7 (5,4) Colon Sinistro 6 (20) 23 (17,8) Sigma 10 (33,3) 34 (26,4) Retto Intr. 4 (13,3) 19 (14,7) Multiplo 0 (0) 3 (2,3)
I numeri tra parentesi rappresentano le percentuali
I due gruppi non appaiono significativamente diversi dal punto di vista della localizzazione della neoplasia. La sede più colpita dal tumore del colon complicato è risultata il sigma ove vi sono localizzati circa un terzo dei casi; in elezione la zona più colpita è invece il colon destro. E’ comunque evidente che, considerando insieme colon sinistro, sigma e retto intraperitoneale, le sezioni sinistre sono decisamente più colpite delle destre in entrambi i gruppi.
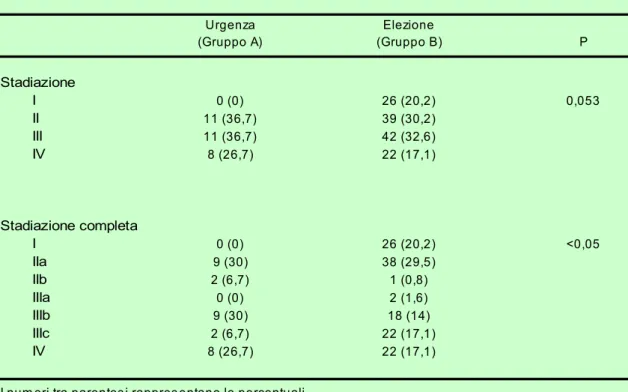
Sebbene non venga raggiunta nel nostro studio la significatività statistica (p=0,053) si può comunque notare una tendenza alla differenza nella stadiazione tra il gruppo A ed il gruppo B che diviene significativa se si considerano anche i sotto stadi.
La differenza tra i due gruppi sembra essere dovuta alla totale assenza di tumori in stadio I nel gruppo A (0% vs 20,15%; p=0,004).
E’ inoltre presente una maggior prevalenza nelle urgenze di tumori in stadio III/IV (63,33% vs 49,61%; p=0,22).
Tabella 2. Stadiazione della neoplasia di n=159 pazienti
Urgenza Elezione (Gruppo A) (Gruppo B) P Stadiazione I 0 (0) 26 (20,2) 0,053 II 11 (36,7) 39 (30,2) III 11 (36,7) 42 (32,6) IV 8 (26,7) 22 (17,1) Stadiazione completa I 0 (0) 26 (20,2) <0,05 IIa 9 (30) 38 (29,5) IIb 2 (6,7) 1 (0,8) IIIa 0 (0) 2 (1,6) IIIb 9 (30) 18 (14) IIIc 2 (6,7) 22 (17,1) IV 8 (26,7) 22 (17,1)
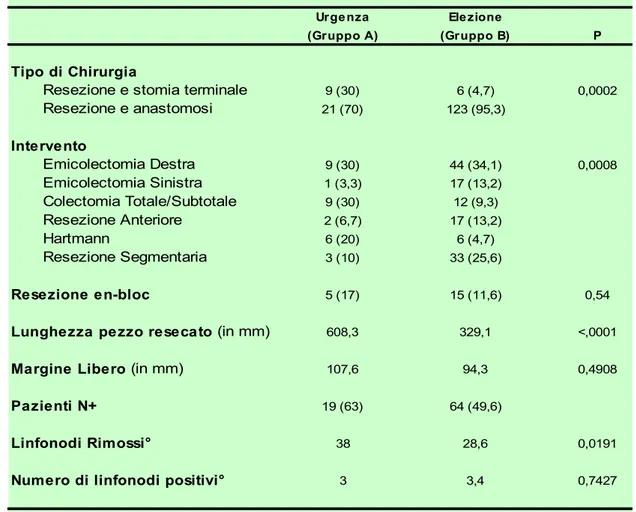
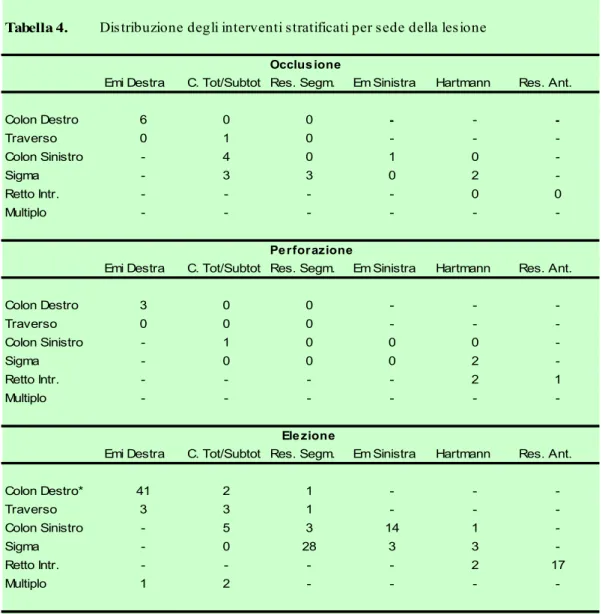
La resezione en bloc è stata eseguita in 5 casi nel gruppo A ed in 15 nel gruppo B con percentuali non diverse dal punto di vista statistico (p=0,54). I due gruppi differiscono invece in modo significativo per quanto riguarda il tipo di intervento eseguito. Tale differenza è attribuibile al diverso approccio chirurgico rivolto alle lesioni localizzate a sinistra in quanto, come si può vedere nella tabella 4, i tumori localizzati a destra sono stati trattati in entrambi i gruppi quasi esclusivamente con un emicolectomia destra più o meno estesa (100% nel gruppo A vs 93,02% nel gruppo B).
Tabella 3. Caratteristiche degli interventi eseguiti sui due gruppi in esame
Urgenza Elezione
(Gruppo A) (Gruppo B) P
Tipo di Chirurgia
Resezione e stomia terminale 9 (30) 6 (4,7) 0,0002
Resezione e anastomosi 21 (70) 123 (95,3) Intervento Emicolectomia Destra 9 (30) 44 (34,1) 0,0008 Emicolectomia Sinistra 1 (3,3) 17 (13,2) Colectomia Totale/Subtotale 9 (30) 12 (9,3) Resezione Anteriore 2 (6,7) 17 (13,2) Hartmann 6 (20) 6 (4,7) Resezione Segmentaria 3 (10) 33 (25,6) Resezione en-bloc 5 (17) 15 (11,6) 0,54
Lunghezza pezzo resecato (in mm) 608,3 329,1 <,0001
Margine Libero (in mm) 107,6 94,3 0,4908
Pazienti N+ 19 (63) 64 (49,6)
Linfonodi Rimossi° 38 28,6 0,0191
Numero di linfonodi positivi° 3 3,4 0,7427
Tabella 4. Distribuzione degli interventi stratificati per sede della lesione
Occlus ione
Emi Destra C. Tot/Subtot Res. Segm. Em Sinistra Hartmann Res. Ant.
Colon Destro 6 0 0 - - -Traverso 0 1 0 - - -Colon Sinistro - 4 0 1 0 -Sigma - 3 3 0 2 -Retto Intr. - - - - 0 0 Multiplo - - - -Perforazione
Emi Destra C. Tot/Subtot Res. Segm. Em Sinistra Hartmann Res. Ant.
Colon Destro 3 0 0 - - -Traverso 0 0 0 - - -Colon Sinistro - 1 0 0 0 -Sigma - 0 0 0 2 -Retto Intr. - - - - 2 1 Multiplo - - - -Ele zione
Emi Destra C. Tot/Subtot Res. Segm. Em Sinistra Hartmann Res. Ant.
Colon Destro* 41 2 1 - - -Traverso 3 3 1 - - -Colon Sinistro - 5 3 14 1 -Sigma - 0 28 3 3 -Retto Intr. - - - - 2 17 Multiplo 1 2 - - - -* Inclusa n=1 appendice
Gli interventi più utilizzati per i tumori delle sezioni sinistre sono stati invece l’emicolectomia sinistra (colon sinistro), la sigmoidectomia (sigma) e la resezione anteriore (retto intraperitoneale) in elezione, mentre in urgenza sono state impiegate prevalentemente la colectomia subtotale o totale (colon sinistro e sigma) e l’Hartmann (retto intraperitoneale).
decisive in tal senso le condizioni locali, le condizioni generali del paziente e lo stadio della malattia tumorale. L’anastomosi immediata è stata possibile nella quasi totalità dei casi sottoposti a intervento resettivo in elezione mentre, nelle urgenze, la possibilità di ristabilire la continuità intestinale è risultata significativamente ridotta (70% vs 95,35%; p=0,0002). Il 30% dei casi in cui è stata confezionata una stomia terminale nel gruppo A comprende 6 pazienti nei quali è stato necessario eseguire l’intervento di Hartmann, 2 pazienti trattati con colectomia subtotale ed uno trattato con emicolectomia destra.
La lunghezza del pezzo operatorio è maggiore per il gruppo delle urgenze (608,3 vs 329,1; p<0,0001) compatibilmente con una maggiore prevalenza di interventi maggiormente demolitivi.
Al contrario, i due gruppi non differiscono significativamente nella lunghezza media del margine libero distale (107,6 vs 94,3; p=0,49).
Il numero di linfonodi rimossi, invece, risulta significativamente maggiore nel gruppo delle urgenze.
Tabella 5. Morbidità, Mortalità e Ricovero post operatorio nei due gruppi Urgenza Elezione (Gruppo A) (Gruppo B) P Morbidità 7 (23,3) 15 (11,6) 0,1374 Mortalità 4 (13,3) 2 (1,5) 0,012 Ricovero P.o. 10,5 8,7 0,0836
Infine, dai dati in nostro possesso, è possibile riscontrare nel gruppo delle urgenze una maggiore mortalità (13,33% vs 1,55%; p=0,012) ed una tendenza ad una maggior morbilità (23,33% vs 11,63%; p=0,14) e ad una degenza più lunga (10,5 vs 8,7; p=0,0836)(Tabella 5).
La brevità longitudinale dello studio impedisce di esprimere qualsiasi giudizio riguardo l’outcome oncologico dei pazienti trattati.
DISCUSSIONE
Nonostante le campagne di screening, l’esordio complicato della neoplasia colorettale, rimane un evenienza relativamente frequente.
Nel nostro studio il 18,9% dei tumori operati ha esordito con una complicanza acuta, rientrando nel range proposto in altre pubblicazioni di letteratura medica22.
Numerosi studi hanno spesso sottolineato l’associazione tra l’esordio complicato della neoplasia colo-rettale e l’età avanzata dei pazienti; il 18% dei pazienti anziani, infatti, si presenta con una complicanza acuta contro l’11% dei non anziani90,91.
Il nostro studio ricalca tale tendenza: su 42 pazienti di età inferiore a 65 anni affetti da tumore colo-rettale solo 5 (11,9%) hanno avuto un esordio complicato contro i 25 riscontrabili nei 117 over-65 (21,4%).
L’età media del gruppo delle urgenze risulta effettivamente maggiore rispetto a quella del gruppo in elezione sebbene non venga raggiunta la significatività statistica.
In accordo con i dati epidemiologici redatti in altri studi 21-23,25,26 la
70%) seguita dalla perforazione (9 casi; 30%); nessun caso di emorragia intestinale è giunto alla nostra attenzione nel periodo considerato compatibilmente con la ridotta incidenza descritta per questa complicanza.
Anche la maggior prevalenza di tumori occludenti nelle sezioni sinistre del colon descritta in letteratura37 viene confermata: su 21 casi di tumore
colon-rettale occludente, 14 (quasi il 67%) sono localizzati nelle sezioni sinistre del colon e tra questi 8 (38%) nel sigma, 5 (24%) nel colon discendente e 1 (5%) nel retto intraperitoneale.
Nonostante negli ultimi anni sia cresciuta l’attenzione della chirurgia nei confronti di un trattamento più aggressivo nella cura del cancro colo-rettale complicato non è ancora del tutto chiaro se i criteri di resezione oncologica siano rispettati in condizione di urgenza.
Difatti il chirurgo spesso viene condizionato dalla condizione critica del paziente, dalla difficoltà di un intervento che prevede la manipolazione e la mobilizzazione di un grande segmento di intestino disteso e dalla severità della contaminazione peritoneale, motivo per cui frequentemente viene messa in secondo piano, anche inconsciamente, la radicalità oncologica a favore della risoluzione della complicanza che più concretamente mette a repentaglio la vita del paziente a breve termine.
Facendo riferimento, in proposito, alle linee guida presentate, riteniamo opportuno discutere in dettaglio i criteri per una resezione colica oncologicamente corretta:
1) Margine libero
Le attuali linee guida consigliano di lasciare dai 5 ai 10 cm di intestino sano su entrambi i lati del tumore con lo scopo di rimuovere tutti i linfonodi epicolici e paracolici ed evitare ripetizioni anastomotiche.
La lunghezza del pezzo resecato e la linfadenectomia risultano dunque strettamente associati e risulta difficoltoso valutare indipendentemente l’impatto di questi margini sulla sopravvivenza e sulle ricadute.
Comunque, come si può vedere in tabella 3, la situazione di urgenza non ha rappresentato, nel nostro studio, una condizione critica per ottenere un adeguato margine libero distale.
La lunghezza media del margine libero nel gruppo A è infatti 9,42 cm, valore non statisticamente lontano dai 10,7 cm ottenuti in elezione (p=0,49) e comunque di assoluta “sicurezza” oncologica.
Non sono stati trovati residui microscopici in nessuno dei margini distali resecati.
2) Linfadenectomia
Come avviene in tutto l’organismo umano i vasi linfatici ed i linfonodi del colon seguono il decorso delle arterie. Esistono 4 categorie di linfonodi:
1) Epicolici: localizzati sulla parete del colon
2) Paracolici: localizzati presso l’arcata di Drummond 3) Intermedi: posti sul decorso dei principali vasi arteriosi 4) Apicali: alla radice degli stessi vasi arteriosi principali
I tumori localizzati a livello del cieco e del colon discendente hanno un'unica via di diffusione linfatica che segue, rispettivamente, l’arteria ileo-colica e l’arteria colica sinistra.
I tumori del colon ascendente e della flessura epatica possono avere una diffusione linfatica bidirezionale lungo l’arteria colica destra e l’arteria medio-colica; raramente possono diffondere anche ai linfonodi gastroepiploici destri.
Una diffusione bidirezionale è riscontrabile anche per i tumori della flessura splenica che possono diffondere lungo l’arteria colica sinistra e lungo l’arteria medio-colica mentre i tumori del sigma possono avere diffusione linfonodale lungo l’arteria colica sinistra e l’arteria rettale superiore oltre a diffondere lungo le arterie sigmoidee92.
La linfadenectomia svolge un ruolo fondamentale sia dal punto di vista terapeutico, in quanto la rimozione di tutti i linfonodi metastatici permette