6
1. INTRODUZIONE ALLA DGP
La storia dell’umanità si realizza, in particolare nel campo della scienza, secondo fasi caratterizzate da lunghi periodi di calma e tranquillità, in cui si assiste ad un lento avanzare della ricerca, le quali si alternano ad altre fasi di forte fermento e proliferazione di scoperte scientifiche. Con il passare del tempo l’evoluzione scientifica e tecnologica ha portato ad un cambiamento nelle società, passando da una società rurale dove erano presenti molti figli ad una post-industriale nella quale le famiglie hanno uno o nessun figlio. Oggi il nucleo familiare è passato in secondo piano rispetto al raggiungimento del successo in ambito lavorativo dei singoli componenti contribuendo così ad avere sempre più genitori vecchi e con conseguenti problemi di fertilità.
Di conseguenza per permettere alle coppie con problemi di fertilità di avere un figlio, la scienza è intervenuta per risolvere tali problemi. Ciò è stato possibile grazie alle ricerche di P. Edwards (embriologo) e P. Steptoe (ginecologo) che hanno portato alla scoperta delle tecniche di fecondazione in vitro, ricreando un ambiente “artificiale” dove poter far incontrare i gameti fuori dal corpo umano e dopo l’avvenuta fecondazione con il trasferimento in utero dell’embrione dare inizio alla gravidanza.
Nel 1978 per la prima volta sono state applicate le tecniche di fecondazione in vitro che hanno portato alla nascita in Gran Bretagna di una bambina, Louise Brown (Steptoe e Edwards, 1978). Questa nascita ha rappresentato il punto di partenza di una nuova era nel settore della medicina della procreazione umana, infatti, da questo momento in poi le tecniche di fecondazione assistita hanno subito una straordinaria evoluzione e diffusione.
Contemporaneamente al diffondersi delle prime applicazioni della fecondazione in vitro in campo clinico, nel campo della ricerca sperimentale venivano messe a punto nuove e rivoluzionarie tecniche di manipolazione del materiale genetico: nasceva cosi un nuovo settore applicativo della biologia, l’ingegneria genetica, risultato dell’interazione di metodologie della genetica e della biologia molecolare.
L’ingegneria genetica ha favorito uno sviluppo tecnologico di portata inattesa, il quale, a sua volta, ha accelerato il progredire delle conoscenze nel settore della ricerca di base. La collaborazione tra scienza e tecnologia ha così reso possibile la messa in atto di una vera e propria ricostruzione biotecnologica della procreazione umana.
7
Sono passati solo trentadue anni e attualmente in tutto il mondo sono 4 milioni i bambini nati grazie alla fecondazione in vitro che rappresenta una via per trattare l’infertilità, ossia una condizione che secondo le stime più recenti colpisce 15 coppie su 100.
Insieme al desiderio di avere un figlio è nata anche l’esigenza di conoscere lo status genetico del futuro bambino. La maggior parte dei neonati nasce sana. Tuttavia, ogni donna, a qualsiasi età, presenta un minimo rischio di avere un bambino con alterazioni fisiche o psichiche. Alcune di queste sono dovute ad anomalie cromosomiche. Per questo fine si è potenziata la ricerca al fine di mettere a punto delle tecniche di analisi per individuare gli eventuali feti con questo tipo di alterazioni. Una di queste tecniche è la diagnosi prenatale che ha significativamente inciso sul comportamento di molte coppie a rischio di avere figli con malattie ereditarie o con anomalie congenite, consentendo agli stessi di poter avere informazioni sulla presenza o meno di una determinata patologia in modo di essere coscienti della situazione per poter effettuare la scelta in proposito ritenuta più opportuna.
La Diagnosi Prenatale si è sviluppata verso la fine degli anni ’60 e coinvolge due soggetti che sono la madre e il feto, non è priva di rischi e quindi necessita di un’attenta valutazione.
La Diagnosi Prenatale attualmente si avvale sia di tecniche non invasive che invasive.
Le tecniche non invasive sono rappresentate dall’ecografia e dai test di screening. L’esame ecografico, visti i milioni di esami eseguiti, è stato accertato essere una tecnica esente da rischi sia per la madre che per il feto.
Le tecniche di diagnostica invasiva sono, invece, la villocentesi, l’amniocentesi, la cordocentesi che però presentano sia rischi materni che fetali.
I rischi materni sono le complicanze infettive e il possibile aborto, i rischi fetali per quanto riguarda l’amniocentesi e la villocentesi sono dell’1% di andare incontro ad aborto nel caso della villocentesi, e dell'1-0,5% nel caso dell'amniocentesi, una complicanza che mediamente avviene nei giorni immediatamente successivi all'esame. Altri possibili rischi sono la rottura prematura delle membrane o il parto prematuro (Tabor A et al 1986).
Gli studi attuali nei centri di eccellenza mostrano comunque che l'incidenza di abortività spontanea, natimortalità, e mortalità neonatale non sono statisticamente
8
differenti nei gruppi sottoposti ad amniocentesi rispetto a chi non la esegue (Eddleman KA et al 2006).
Tuttavia oggi, grazie al costante miglioramento tecnologico, queste tecniche di diagnosi prenatale rappresentano le procedure d’uso più comuni per la diagnosi di anomalie genetiche a livello fetale. Nel caso in cui venga individuato un feto malato, i genitori che vi fanno ricorso avranno come alternativa la scelta di proseguire la gravidanza o l’interruzione terapeutica.
I dati statistici, infatti, dimostrano che molte coppie a rischio genetico sono costrette ad affrontare ripetute interruzioni di gravidanza prima di poter avere un bambino sano.
L’evoluzione delle tecniche di fertilizzazione in vitro (IVF), della genetica molecolare e la possibilità di ottenere cellule gametiche ed embrionali utilizzabili per la diagnosi di patologie genetiche hanno determinato un ampliamento delle prospettive applicative delle tecniche di diagnosi prenatale, consentendo, così di trasferire la diagnosi dalla fase “post-impianto” a quella “pre-impianto”.
La Diagnosi Genetica Preimpianto (DGP) rappresenta quindi una nuova metodologia, complementare alle tecniche di diagnosi prenatale, per quelle coppie soggette al rischio di trasmettere una malattia genetica ai loro figli.
La prima applicazione della DGP risale al 1968 quando Gardner e Edwards prelevarono tramite biopsia una piccola porzione del trofoectoderma di una blastocisti di coniglio, tramite la quale identificarono il sesso degli embrioni, impiantati successivamente in una femmine adottiva. La prole che nacque da questa femmina risultò del sesso che era stato identificato (Edwards & Gardner, 1967; Gardner & Edwards, 1968). Visto il successo di tale lavoro Steptoe e collaboratori pensarono di sperimentare la medesima tecnica su blastocisti umane che purtroppo non ebbe lo stesso esito positivo (Steptoe et al., 1971).
Nel frattempo la ricerca non si è fermata e nel 1988 Edwards & Hollands suggerirono che l’identificazione del sesso dello spermatozoo sarebbe stato sicuramente più facile da poter prevedere ma che allo stesso tempo una cellula embrionale sarebbe stata molto più rappresentativa del genoma cellulare, in quanto avrebbe garantito un contenuto informazionale maggiore rispetto ad una cellula aploide.
I medesimi autori ipotizzarono che solamente tramite metodi non invasivi fosse possibile dissolvere la zona pellucida, in modo poi da poter disaggregare l'embrione, per separare le cellule l’una dall’altra e poterle mettere in coltura al fine di effettuare la
9
diagnosi e nel frattempo conservare l'embrione in un mezzo artificiale prima di essere trasferito (Edwards and Hollands 1988).
Alla fine degli anni ’80 sono stati quindi suggeriti differenti approcci al fine di eseguire con successo una biopsia embrionale. Proprio in questo periodo iniziarono anche le prime sperimentazioni su embrioni umani svolte da Braude e Johnson all’Università di Cambridge in collaborazione con Monk (Holding & Monk, 1989) (Braude et al., 1989).
Nel 1990 Holding e Monk utilizzarono la tecnica di PCR su ovociti umani al fine di ricercare la presenza della mutazione falciforme nel gene della beta globina. Gli stessi autori insieme ad altri collaboratori furono anche i primi a dimostrare che era possibile diagnosticare malattie genetiche anche mediante analisi del globulo polare espulso durante la meiosi da un ovulo non fecondato, evitando così la sperimentazione su embrioni umani (Monk & Holding, 1990).
La prima applicazione clinica della DGP risale alla fine degli anni 80 quando in Inghilterra è nata la prima bambina da una coppia a rischio di trasmettere ai propri discendenti patologie legate al sesso (Handyside et al., 1989; 1990; 1992). Da quel momento sono stati fatti molti progressi sia per la determinazione del sesso dell'embrione (per le malattie legate al sesso) che per la diagnosi di specifiche mutazioni a carico di un singolo gene. Da un punto di vista tecnico infatti è indispensabile che la sequenza del DNA mutato sia conosciuta e la mutazione evidenziabile con le tecnologie a disposizione. La conoscenza della mutazione è un requisito fondamentale per potersi sottoporre a questo tipo di analisi. Risulta quindi di estrema importanza effettuare un’accurata analisi genealogica per individuare eventuali patologie genetiche.
Sebbene l'esperienza clinica sia limitata e la tecnica per molti versi ancora sperimentale, la DGP è ora chiaramente affermata come opzione per la riproduzione di coppie ad alto rischio genetico (Braude P et al, 2002) (Wells D. et al, 2001).
Recentemente, il campo d’applicazione della DGP è stato ampliato a particolari categorie di pazienti infertili o subfertili, il cui fallimento riproduttivo e ritenuto dipendere da anomalie cromosomiche (recessive, dominanti o X-linked) dell’embrione
(Verlinsky et al., 2004; Altarescu et al., 2008a, b). La possibilità di disporre di una diagnosi e di selezionare gli embrioni geneticamente o cromosomicamente normali prima dell’impianto rappresenta indubbiamente un’importante opzione per le coppie ad elevato rischio genetico, che può essere noto sia perché esistono in famiglia più casi di
10
anomalia, sia perché la nascita di uno o due bambini portatori di malattia genetica ha permesso di rilevarne la trasmissione (Munne’ et al., 2002).
Le patologie genetiche che possono colpire l’embrione sono:
malattie legate al cromosoma X per le quali le donne sono portatrici e che trasmettono a metà della discendenza (è il caso per esempio dell’emofilia). La DGP permette sia di indagare il sesso dell’embrione consentendo di trasferire solo quelli di sesso femminile, sia di rilevare il gene responsabile della malattia, consentendo perciò di trasferire sia embrioni di sesso femminile, sia embrioni di sesso maschile indenni alla malattia.
malattie portate dai cromosomi autosomici, sia a trasmissione dominante (un solo gene proveniente da uno solo dei membri della coppia è sufficiente a trasmettere la malattia), sia a trasmissione recessiva (la malattia si trasmette solo se il bambino riceve il gene della malattia da entrambi genitori, che sono portatori sani.)
aneuploidie che comportano variazioni nel numero modale dei cromosomi, per esempio le trisomie, monosomie, ecc.
L’analisi genetica su singola cellula è una tecnica molto complessa, che richiede una notevole esperienza professionale e l’impiego di tecnologie strumentali avanzate. Dal punto di vista procedurale, la DGP è totalmente differente dalla diagnosi genetica prenatale. Infatti, dai prelievi dei tessuti fetali si estrae una notevole quantità di DNA, sufficiente per diversi test. Inoltre, in caso vi sia un dubbio diagnostico è possibile ripetere il test, poiché vi sono minori restrizioni temporali.
Nella diagnosi preimpianto, invece, il materiale su cui viene eseguito l’esame genetico è rappresentato da una singola cellula (e quindi una sola copia di DNA), inoltre, i tempi sono molto ristretti, in quanto l’esame deve essere completato in tempo utile entro il 5° giorno per il trasferimento. Come è facilmente comprensibile, ciò incide
11
notevolmente sulla scelta della strategia operativa da seguire, che deve essere rapida, precisa e deve fornire risultati in tempi estremamente rapidi. In generale, sia che venga eseguita su embrioni sia che venga eseguita su Globuli Polari.
La Diagnosi Genetica Preimpianto da un punto di vista tecnico ha un’attendibilità diagnostica variabile, ma sicuramente inferiore rispetto alle procedure tradizionali di diagnosi prenatale. Infatti, le coppie che si sottopongono a questo tipo di procedura devono poi sottoporsi, successivamente, anche a villocentesi o amniocentesi per confermare il risultato della diagnosi preimpianto ( Renwick P et al 2007), (Basille C et al 2009).
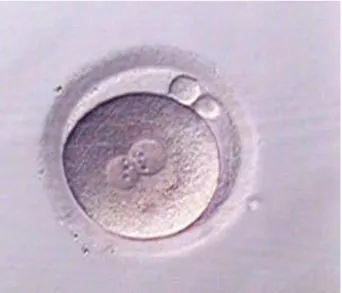
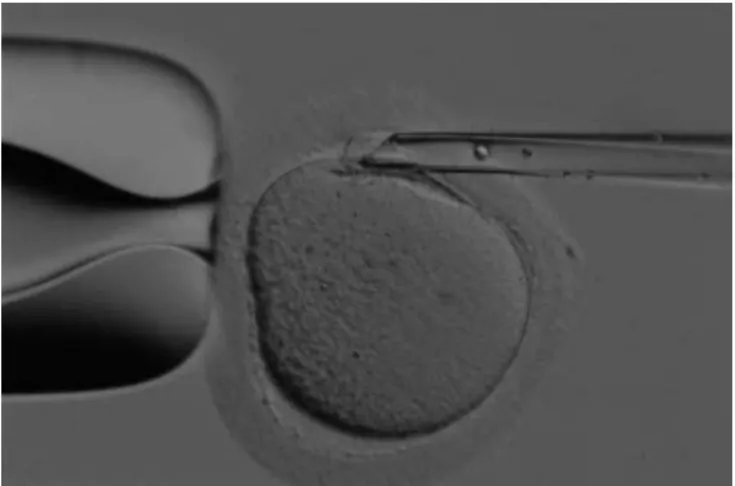
Le cellule da sottoporre ad analisi genetica possono essere ottenute sia dall’ovocita, attraverso il prelievo dei globuli polari (GP) (figura 1), che dall’embrione, mediante l’analisi dei blastomeri allo stadio di segmentazione o di blastocisti.
Figura 1 Ovocita con i due globuli polari.
(Da Preimplantation Genetic Diagnosis. Second Edition 2009, Edited by Joyce C. Harper).
La diagnosi genetica preimpianto viene realizzata attraverso la tecnica della PCR che permette di ottenere una quantità di DNA idonea, a partire dalla minima quantità presente in una singola cellula (6pg = 1 copia di DNA). I prodotti della PCR sono analizzati mediante tecniche molecolari dirette (ricerca della/e mutazione causale di malattia) o indirette (analisi di polimorfismi del DNA associati al locus malattia) (Tomi D et al 2005).
Tale tecnica non è esente da errori che nella maggior parte dei casi sono di tipo diagnostico dovuti principalmente a tre fattori: la contaminazione del DNA della cellula in esame con DNA estraneo; il fallimento della PCR; il fenomeno dell’ADO (Allele
12
Drop Out, cioè perdita di un allele) che consiste nell’amplificazione casuale di uno solo dei due alleli con conseguente errata genotipizzazione dell’embrione. Per ridurre il rischio di errore è necessario effettuare contemporaneamente al test diagnostico un monitoraggio del rischio di contaminazione e di ADO attraverso l’analisi di polimorfismi del DNA (ESHRE, 2005).
1.1. La diagnosi preimpianto in Italia dopo l’approvazione della legge 40/2004
In Italia la legge 40 del 19 febbraio 2004 regola la materia della Procreazione Medicalmente Assistita (PMA). L’articolo 1 della legge recita che “è consentito il ricorso alla procreazione medicalmente assistita per favorire la soluzione dei problemi derivanti dalla sterilità o infertilità umana”. Nel testo delle Linee Guida alla legge, emesse il 21 luglio 2004 e modificate con Decreto 11 Aprile 2008, vengono precisati i significati di sterilità e infertilità, condizioni che restano comunque indispensabili per accedere alle procedure di PMA. L’accesso alla DGP nelle coppie a rischio per malattie genetiche è, pertanto, limitato a una minoranza di queste che presenta accertati problemi di infertilità (Benagiano et al., 2004).
Inoltre la legge in questione limita a 3 il numero di ovociti che possono essere fertilizzati durante ciascun ciclo di IVF ed obbliga il trasferimento simultaneo in utero di tutti e tre i possibili embrioni. E’ importante specificare che se fino a qualche anno fa il limite di 3 ovociti da poter fertilizzare si poneva come ostacolo alla possibilità di ottenere una gravidanza, oggi però grazie al progresso scientifico e tecnologico è sempre più chiaro che un solo ovocita da fertilizzare in vitro e successivamente impiantare possa essere sufficiente per la riuscita di un ciclo di procreazione medicalmente assistita (PMA) ( A. Tiitinen et al, 2001). Risulta quindi importante considerare che quasi mai scienza e diritto seguono la stessa evoluzione, piuttosto capita che, nel momento in cui le norme sono approvate da un sistema giuridico, sono già superate dalle scoperte scientifiche e dai nuovi bisogni.
Inoltre la legge in questione vieta la crioconservazione di zigoti ed embrioni, mentre permette quella degli ovociti.
Va comunque detto che la legge in questione nel corso dell’ultimo triennio ha subito varie revisioni, vari Tribunali infatti in diverse sedi hanno disposto interventi
13
che consentivano a coppie portatrici di gravi malattie genetiche che avevano presentato ricorso, di accedere alle tecniche di DGP e/o di rifiutare l’impianto di embrioni risultati affetti. A seguito di tali sentenze nel 2008 è stata apportata una modifica alle LG /DM 11.04.2008) che ha di fatto cancellato la disposizione contenuta nelle Linee Guida del 21.07.2004 che consentiva la sola indagine osservazionale negli embrioni prima dell’impianto in utero.
Inoltre nel 2009 altri due interventi, uno della Corte Costituzionale ed uno del Tribunale di Bologna hanno introdotto importanti dubbi sulla liceità e applicabilità della legge 40. La Corte Costituzionale ha dichiarato l’illegittimità costituzionale della disposizione che imponeva limiti numerici sia alla produzione di embrioni che al loro reimpianto. Pertanto la nuova formulazione della legge prevede che “Le tecniche di produzione degli embrioni, tenuto conto dell’evoluzione tecnico-scientifica e di quanto previsto dall’articolo 7, comma 3, non devono creare un numero di embrioni superiore a quello strettamente necessario”. La diagnosi genetica sarebbe dunque possibile nel caso in cui sia rivolta a dare informazioni alla coppia infertile sullo stato di salute degli embrioni anche se continua a sancire il principio del divieto di crioconservazione.
Tuttavia, le conclusioni raggiunte dalla Corte impongono di “introdurre una deroga al principio generale di divieto di crioconservazione”. Embrioni diagnosticati come non sani possono essere crioconservati e non trasferiti, almeno fino al momento in cui si possa effettuare una terapia sugli stessi, a salvaguardia della salute del feto e della madre.
Ulteriori passi in avanti sono stati fatti nel luglio 2009 quando il Tribunale di Bologna ha depositato un’ordinanza che oltre a ribadire la liceità della diagnosi preimpianto riconosce per la prima volta alla coppia non sterile, che abbia avuto un figlio affetto da grave malattia genetica, l’accesso a tale procedura.
Da quanto su esposto si evince che tutti i pronunciamenti dei Tribunali interpellati sono favorevoli alla rimozione dei divieti che gravano sulle procedure di DGP rivolta a gravi patologie genetiche. Infine la sentenza del Tribunale di Bologna pone dubbi sulla liceità della preclusione alle coppie fertile dell’accesso alla PMA e quindi alla DGP. Tuttavia ad oggi in Italia l’accesso alla diagnosi genetica rimane possibile solo per le coppie con problemi di infertilità.
Alle coppie italiane fertili ma portatrici di patologie geniche dunque rimangono al momento queste possibilità:
14
decidere di non avere figli,
ricorrere all’adozione di un bambino,
il concepimento naturale, sottoponendosi successivamente a diagnosi prenatale, mediante villocentesi o amniocentesi, affrontando eventualmente la scelta dolorosa di un'interruzione volontaria della gravidanza, nel caso in cui si individuasse un feto affetto da una specifica malattia,
non eseguire nessun tipo di diagnosi ed avere comunque figli, anche se risulteranno affetti da una grave patologia genetica,
oppure il cosiddetto "turismo procreativo", cercando cioè di ottenere un trattamento sanitario mediante diagnosi preimpianto all'estero, presso centri di fecondazione assistita ubicati in Paesi con legislazioni meno restrittive, affrontando quindi ingenti spese e notevoli disagi.
Un'altra possibilità da non sottovalutare sarebbe quella di restare nel proprio paese e ricorrere alla cosiddetta Diagnosi Genetica Pre-Concepimento, una nuova procedura che mira a selezionare gli ovociti (e non gli embrioni) in cui sia assente l’anomalia genetica materna mediante l’analisi dei globuli polari.
I globuli polari sono piccole cellule che contengono quasi esclusivamente materiale genomico e che vengono espulsi dal precursore della cellula uovo, allo scopo di dimezzare il proprio corredo cromosomico senza perdere componenti citoplasmatiche.
Il processo di dimezzamento del numero di cromosomi, cioè il passaggio da cellula diploide (due copie di ciascun cromosoma) ad aploide (una copia di ciascun cromosoma), avviene tramite la meiosi, processo fondamentale anche per l'aumento della variabilità genetica. La meiosi consta di due divisioni successive che nel caso degli spermatozoi danno origine a quattro gameti morfologicamente identici con quattro assetti genici diversi.
Nel caso del gamete femminile, la meiosi porta alla formazione di una grande cellula uovo e di tre cellule molto più piccole, i globuli polari appunto. Addirittura, nell'uomo e nella maggior parte dei vertebrati, il primo globulo polare emesso non si divide più e quindi il bilancio globale è di due soli globuli polari per ogni cellula uovo.
15
A differenza della diagnosi preimpianto, che comporta l’esclusione di quegli embrioni che all’analisi genetica risultano affetti dalla specifica patologia genetica di cui la coppia e’ portatrice, con la diagnosi pre-concepimento, invece, si esclude a priori la possibilità di produrre embrioni con anomalie genetiche.
Va sottolineato anche che questa tecnica può, inoltre, dare una speranza a molte coppie che non possono affrontare queste spese per recarsi all’estero, a causa delle limitate disponibilità economiche. Quindi l’opzione della diagnosi sull’ovocita fornirebbe alle coppie italiane l’opportunità di ottenere un accesso gratuito alle tecniche di PMA, i cui costi e quelli dei relativi farmaci sarebbero a carico del Sistema Sanitario Nazionale.
E’ auspicabile che, una volta rimosso il principale ostacolo etico (cioè il test genetico sugli embrioni) che ha determinato una forte contrapposizione tra le due opposte visioni della tutela dell’embrione, i legislatori italiani possano pervenire ad un accordo condiviso che permetterà di rimuovere il divieto di accesso alle tecniche di PMA alle coppie fertili, ma a rischio di trasmettere una malattia genetica alla prole, permettendo alle stesse anche il ricorso alla Diagnosi Genetica Pre-Concepimento.
1.2. L’alternativa alla diagnosi preimpianto dopo l’approvazione della legge 40/04: l’analisi genetica dell’ovocita (Diagnosi Genetica Pre-Concepimento)
La Diagnosi Genetica Pre-Concepimento di per sè non e’ una novità. Tale metodica e’ stata impiegata per la prima volta nel 1990 da un gruppo di ricercatori statunitensi (Verlinsky et al., 1990), prevedendo inizialmente l’analisi del 1° Globulo Polare (GP), basandosi sul fatto che, in assenza del crossing-over (che comporta lo scambio di materiale genetico fra i cromosomi omologhi dei genitori al momento in cui si appaiono durante la meiosi) il 1°GP è omozigote per l’allele non contenuto nell’oocita. Se invece il crossing-over c’è stato, l’analisi del 1°GP non è più utile per predire il genotipo dell’oocita che in questo caso è eterozigote per il gene anormale. Poiché la frequenza del crossing-over varia con la distanza tra i loci e il centromero e può essere anche il 50% per i geni telomerici, l’analisi del solo 1°GP è di valore limitato ed è stata introdotta anche l’analisi del 2°GP che viene fatta in sequenza con quella del primo globulo (Verlinsky et al., 1997), al fine di aumentare l’efficacia
16
della metodica. I suddetti ricercatori, non essendo vincolati da alcuna restrizione normativa, hanno però impiegato un protocollo che prevedeva l’analisi dei globuli polari (1°GP o 1°GP+2°GP) dopo la fecondazione.
Tale scelta, tuttavia, era obbligata a causa del lungo tempo necessario per il completamento della procedura diagnostica (circa 16 h)e non compatibile con i tempi massimi di fertilizzazione degli ovociti, che solitamente devono essere fecondati entro 6 h dal loro prelievo. Il nome di tale procedura e’ stato, quindi, in seguito modificato in “diagnosi genetica pre-zigotica o pre-embrionica” (Kuliev et al., 2001, 2006), proprio perché la diagnosi genetica interviene dopo la fertilizzazione dell’ovocita e prima della formazione dello zigote (che avviene al momento della singamia, circa 18 ore dopo la fecondazione).
I protocolli di diagnosi genetica pre-zigotica, tuttavia, non sono idonei per essere applicati nel nostro Paese perché se la ICSI (Microiniezione Intraovocitaria dello Spermatozoo) viene effettuata prima di conoscere il risultato dell’esame genetico del globulo polare, la legge 40 che impedisce la selezione a fini eugenetici e cioè non consente di selezionare gli embrioni affetti da malattie genetiche, obbligherebbe il trasferimento in utero di tutti i possibili embrioni prodotti, rendendo quindi la diagnosi genetica inutile. L’unica procedura che rientra nei limiti imposti dalla citata legge, e’ la Diagnosi Genetica Pre-Concepimento, eseguendo l’analisi genetica del solo primo globulo polare (1°GP), prima della fertilizzazione dell’ovocita.
Il 1°GP, espulso dall’ovocita nella fase finale della sua maturazione, contiene un assetto genetico che è speculare a quello presente nell’ovocita stesso. L’analisi di questa piccola cellula, che non ha alcun ruolo biologico (si potrebbe definire come una piccola cellula accessoria) e degenera dopo alcune ore, fornisce importanti informazioni sullo status genetico dell’ovocita e può essere considerata una valida alternativa alla diagnosi genetica preimpianto effettuata sugli embrioni.
Il 1°GP, infatti, può essere rimosso con una biopsia ed utilizzato per selezionare quegli ovociti che, all’analisi genetica, non presentino una determinata mutazione genica materna. Poiché il 1°GP possiede un assetto genetico speculare a quello dell’ovocita, se il 1°GP presenta la mutazione materna ne consegue che l’ovocita risulterà privo della mutazione (e quindi normale). Viceversa, se il 1°GP non presenta la mutazione materna, sarà l’ovocita a contenere quella mutazione.
17
Solo gli ovociti normali (cioè senza la mutazione materna) saranno poi fecondati con gli spermatozoi paterni mediante ICSI. In tal caso, gli embrioni ottenuti potranno essere, al massimo, portatori della malattia (se lo spermatozoo conteneva la mutazione paterna), ma non saranno mai affetti dalla specifica malattia.
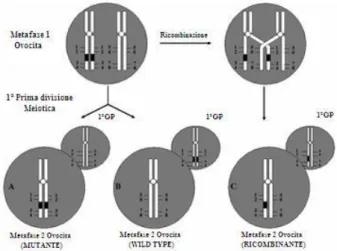
L’analisi genetica del 1°GP può essere complicata da fenomeni di ricombinazione (scambio di porzioni cromosomiche “crossing over”), che avvengono regolarmente tra cromosomi omologhi durante la prima divisione meiotica.
Se la ricombinazione coinvolge la regione cromosomica contenente il gene causa della malattia genetica, il primo globulo polare potrebbe portare sia la copia normale del gene sia la copia contenente la mutazione materna. In tal caso la diagnosi genetica sul 1°GP risulterà non informativa e l’ovocita da cui esso proviene non potrà essere considerato utile per la fertilizzazione (figura 2).
Figura 2 Schema della Diagnosi Genetica Pre-Concepimento mediante analisi del primo globulo polare (1°GP) (modificato da Orizzonti FC Ottobre 2009).
Il fenomeno della ricombinazione attraverso crossing over ha una frequenza variabile che dipende dalla localizzazione cromosomica del gene in esame e può interessare sino al 50-60% degli ovociti, rendendo inutilizzabile ai fini diagnostici più della metà di questi. Inoltre non tutti gli ovociti producono un globulo polare di qualità utile per essere analizzato. Per queste ragioni, affinché l’indagine abbia successo, si rende necessario sottoporre la donna ad un trattamento di stimolazione ovarica importante che consenta di ottenere un numero molto elevato di ovociti.
In analogia con quanto avviene per l’analisi genetica su blastomeri l’accuratezza diagnostica dell’analisi del 1°GP è limitata dal rischio di ADO (Allele
18
Drop Out) e di contaminazione. Altro limite associato alla diagnosi su 1°GP è la difficoltà di eseguire l’intera procedura (isolamento del 1° GP e analisi genetica) nei tempi richiesti per evitare l’invecchiamento dell’ovocita (4-6 ore dal prelievo).Per questo motivo, l’applicazione della tecnica segue uno schema articolato che richiede una stretta coordinazione tra due diverse equipe, il team del laboratorio di PMA e quello del laboratorio di genetica molecolare. L’attività’ di questi due gruppi di professionisti consente di ottenere i risultati entro 6 ore dal prelievo degli ovociti.
Un ulteriore limite è che l’analisi sul 1° GP non permette di effettuare la diagnosi di malattie genetiche a trasmissione autosomica dominante di origine paterna in quanto la procedura prevede solo l’analisi del patrimonio genetico di origine materna. Per tutte le ragioni precedentemente esposte, tale procedura non è utilizzata singolarmente ma sempre accompagnata dallo studio del 2°GP, così come anche chiaramente esposto nelle Linee Guida emesse dalla Società Europea di Riproduzione Umana ed Embriologia (ESHRE).
Il 2° GP viene espulso alcune ore dopo la fecondazione, passando, pertanto, ad una fase postconcezionale. In Europa questo approccio diagnostico è poco usato (è adottato in Germania, per ragioni legislative, e in Svizzera), mentre è utilizzato negli Stati Uniti sin dal 1990 (Strom CM et al , 2000).
Va infine detto che la maggior parte delle legislazioni europee in materia di DGP è abbastanza permissiva, sebbene nei vari paesi vi sia una particolare attenzione riguardo ai problemi etici posti dagli straordinari progressi della ricerca nel campo della medicina riproduttiva. Le soluzioni adottate sono sempre il frutto del compromesso tra le varie opinioni sull’argomento.
Ovunque la riflessione bioetica ha spesso messo l’accento piuttosto sui rischi che sui benefici della ricerca nell’intento di evitare derive considerate pericolose. Ciò nonostante il panorama europeo dal punto di vista normativo appare piuttosto favorevole all’applicabilità’ di questa procedura, sebbene con i dovuti limiti e controlli.
La maggior parte dei Paesi europei hanno adottato un approccio liberale, soprattutto in Belgio, Finlandia, Portogallo e Spagna. In Grecia, Danimarca, Francia, Olanda e Gran Bretagna, invece, un’Authority agisce in qualità di organo consultivo e di controllo, fornendo autorizzazioni o licenze specifiche all’uso delle tecniche di DGP. Esiste poi un gruppo di paesi, quali Norvegia, Svezia, Germania, Svizzera, e Austria, in cui esiste una forte influenza di gruppi conservatori che hanno optato per
19
un approccio più restrittivo. Solo in Germania e Svizzera la DGP è vietata. Anche in questi paesi vi è in corso un forte dibattito sull’argomento. In Svizzera, in particolare, una commissione parlamentare ha dato mandato al Governo di esaminare la possibilità di rimuovere la proibizione della Diagnosi Genetica Preimpianto.
L’Italia si trova in una situazione simile alla Germania, ma più limitativa. Infatti, secondo la legge tedesca è possibile selezionare geneticamente gli ovociti fecondati, mediante analisi del primo e secondo globulo polare, prima che avvenga la singamia (circa 18 ore dopo la fertilizzazione), e congelare gli ovociti fecondati prima di tale stadio. La legge italiana, invece, non consente ciò, lasciando perciò aperta soltanto la strada dell’analisi genetica del primo globulo polare, prima della fertilizzazione dell’ovocita (Diagnosi Genetica Pre-Concepimento) con i limiti dovuti all’impossibilità di analizzare anche il secondo globulo polare.
I vantaggi della Diagnosi Genetica Pre-Concepimento sono:
L’analisi è effettuata su materiale extra-embrionario, che non ha alcun ruolo biologico. La biopsia del 1GP non incide sullo sviluppo dell’embrione, mantenendo inalterate le relative percentuali di impianto. Inoltre, se l’analisi del 1GP risulta inconclusiva è possibile ripetere l’analisi usando un blastomero.
La diagnosi genetica viene quindi eseguita sull’ovocita e l’embrione non viene manipolato. Ciò previene la perdita di embrioni e consente di superare i problemi etici che hanno determinato il divieto della diagnosi preimpianto.
Il tasso di ADO (Allele Drop Out) risulta essere significativamente minore nel globulo polare rispetto al blastomero(Verlinsky Y et al 2002),( Verlinsky I et al, 2005).
L’ADO (Allele Drop Out = perdita di un allele ) si verifica quando si ha l’amplificazione di uno solo dei due alleli e quindi di una sola delle due copie del gene in esame. Se questo fenomeno si verifica, una delle mutazioni ricercate potrebbe non evidenziarsi. E’ quindi possibile che un ovocita sia erroneamente diagnosticato come affetto dalla specifica malattia genetica investigata, e quindi non sottoposto ad ICSI ; oppure che un ovocita sia erroneamente diagnosticato come
20
sano, e quindi sottoposto ad ICSI. Tale fenomeno dipende essenzialmente dal tipo di cellula analizzata (Rechitsky et al. 1998), dal gene testato (Dreesen et al. 1996), dalle condizioni di lisi (Levinson et al. 1992; Gitlin et al. 1996), e dalle condizioni di PCR (Ray et al. 1996). Per evitare comunque che si verifichino diagnosi errate a causa dell’ADO, i laboratori qualificati che effettuano diagnosi preimpianto impiegano degli accorgimenti tecnici (studio dei marcatori genetici STR tramite multiplex PCR con cinque marcatori invece che due (Findlay et al. 1998), analisi di linkage mediante marcatori STR associati al gene studiato) in modo da ridurre al minimo il rischio di ottenere una diagnosi errata, rischio che comunque è sempre esistente, anche se in percentuale molto bassa. Inoltre è stato anche visto che eseguire la multiplex PCR seguita dalla nested PCR sembra aumentare la precisione dell’analisi sul globulo polare. Anche l’analisi del materiale genetico del primo e del secondo globulo polare sembrano aumentare l’accuratezza della diagnosi (Strom et al. 1998). I limiti invece della Diagnosi Genetica Pre-Concepimento sono:
L’analisi consente di ottenere solo informazioni relative ad anomalie di origine materna, ed e quindi inapplicabile in caso di malattie genetiche autosomiche dominanti di origine paterna.
L’elevata incidenza di ricombinazione comporta l’inefficienza della metodica in circa il 50%-60% degli ovociti, riducendo quindi il numero di ovociti privi di mutazione genica disponibili per essere fertilizzati. Su questi ovociti solo l’analisi del secondo globulo polare potrebbe escludere con certezza la malattia.
Una bassa risposta alla stimolazione ovarica incide sul numero di ovociti disponibili per l’analisi genetica. Una buona riserva ovarica, quindi, è un requisito indispensabile per il successo della procedura.
L’analisi non consente di effettuare la tipizzazione dell’HLA in fase preimpianto, procedura recentemente impiegata da coppie con un figlio affetto da una malattia genetica, per la cui cura è necessario effettuare un trapianto di cellule staminali da un soggetto compatibile. In questi casi la diagnosi genetica preimpianto su blastomeri rappresenta una strategia che consente di individuare e
21
trasferire embrioni che saranno, contemporaneamente, privi di mutazioni e HLA-compatibili con il figlio malato. Alla nascita del bambino, le cellule staminali presenti nel cordone ombelicale del nascituro potranno essere prelevate e trapiantate nel figlio malato della coppia per consentirne la guarigione.
HLA è la sigla di Human Leucocyte Antigens (antigeni umani leucocitari), detto anche sistema di istocompatibilità, composto da molecole che si trovano sulla superficie cellulare e che si comportano come antigeni: venute a contatto con il sistema immunitario di un individuo diverso, sono riconosciute come estranee e suscitano una risposta immune. Come appare evidente, il sistema HLA è alla base del rigetto dei trapianti: se il tessuto trapiantato in un soggetto non è HLA-compatibile (ossia le cellule che lo compongono non hanno gli stessi antigeni HLA del ricevente), il trapianto viene riconosciuto come estraneo e rigettato. Per questo motivo, prima di eseguire un trapianto, è necessario accertare che donatore e ricevente siano HLA-compatibili mediante tipizzazione tissutale.
1.3. L’ICSI (MICROINIEZIONE INTRAOVOCITARIA DELLO SPERMATOZOO)
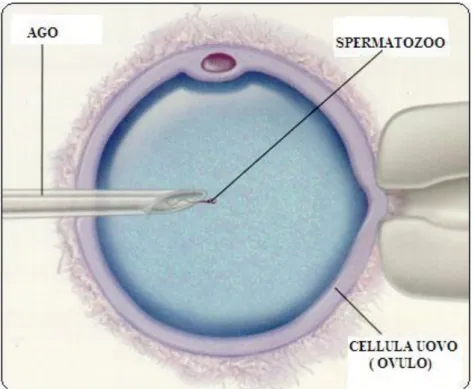
L’ICSI è una tecnica che comporta la microiniezione di un singolo spermatozoo in un ovocita maturo allo scopo di ottenerne la fertilizzazione ed evitare il possibile inquinamento associato alla permanenza di altri spermatozoi adesi alla zona pellucida dell'ovulo (Liebaers I et al, 1998). Tale evenienza può essere fonte di errore diagnostico nel caso di diagnosi genetica su singola cellula .Nel caso della Diagnosi Genetica Pre-Concepimento la ICSI (figura 3) sarà effettuata solo dopo aver ottenuto gli esiti dell’esame genetico, presupponendo che si abbia la possibilità di impiegare un protocollo diagnostico che venga completato prima che intervenga la degenerazione in vitro degli ovociti (Van Steirteghem AC et al, 2003). Infatti, per effettuare l’analisi genetica del 1°GP, prima della fertilizzazione dell’ovocita, vi e’ un limitato spazio temporale, che ad oggi ne ha precluso una applicazione di routine.
22
Figura 3 tecnica ICSI (modificata da Centro Ricerca Medicina della Riproduzione)
Per permettere la maturazione degli ovociti la donna si deve sottoporre ad una stimolazione della crescita follicolare con delle medicine (gonadotropine) e quindi alla aspirazione dei follicoli per via ecografica per ottenere più ovociti maturi da iniettare.
Gli ovociti vengono iniettati utilizzando delle sofisticate apparecchiature che comprendono l’utilizzo di un microscopio a forte ingrandimento, dei microaghi ed un micromanipolatore.
E’ raccomanda la fecondazione in vitro con l’ICSI:
a tutte le coppie con un’infertilità dovuta ad un fattore maschile medio/severo, quindi con una concentrazione spermatica inferiore a 10 milioni di spermatozoi ed una motilità progressiva inferiore al 25%.
a tutte le coppie che hanno avuto un ciclo precedente di FIVET (Fertilizzazione In Vitro con Embryo Transfer) con fallita fertilizzazione o con un tasso di fertilizzazione inferiore al 25%.
23
1.4. L’ovogenesi
L'ovogenesi è il processo di produzione delle cellule uovo femminili. Essa avviene nelle ovaie e si ripete con andamento ciclico (ciclo mestruale) per tutta la durata della fase di fertilità della femmina, che ha inizio con il menarca (la prima mestruazione) e termina con la menopausa.
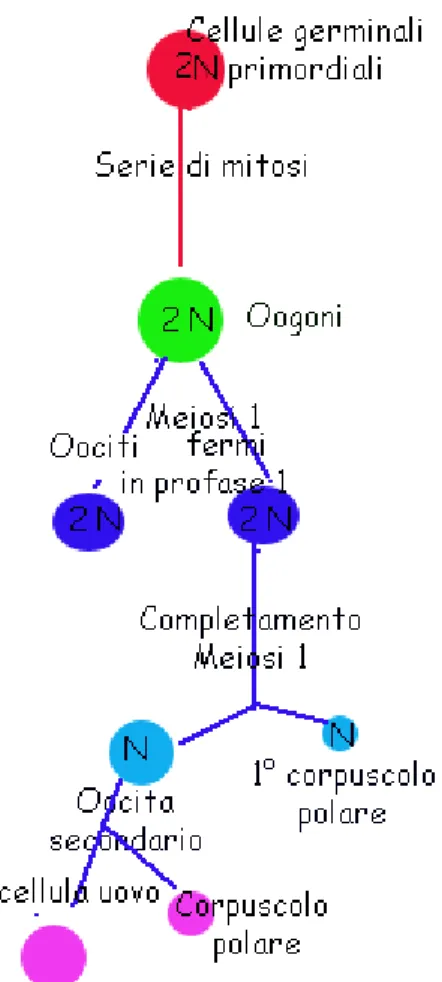
Nell'ovogenesi, inizialmente, una cellula chiamata oogonio si divide per mitosi, dando origine a un oocita primario. Questo va incontro ad una meiosi: la meiosi I, di carattere riduzionale, genera due cellule aploidi, l’oocita secondario e il globulo polare primario (1°GP), che contiene un complemento di 23 cromosomi bivalenti materni. Questa struttura può essere rimossa dalla cellula uovo e utilizzata per eseguire il test genetico; la meiosi II, equazionale, divide l'oocita secondario in una cellula uovo e un secondo globulo polare.
Il ciclo mestruale è una sequenza di cambiamenti fisiologici periodici che ha luogo nella femmina e ha come fine ultimo la maturazione di una cellula uovo e la preparazione di un tessuto adatto al suo impianto. Tale processo è correlato alla produzione ciclica di ormoni e al suo mantenimento concorrono diverse strutture strettamente collegate tra loro. La durata è di 28 giorni e l’ovogenesi avviene una sola volta , dopodiché, se non viene fecondato, l'ovulo è espulso con la mestruazione.
Finché non avviene la fecondazione da parte dello spermatozoo, l'oocita primario svolge solo la meiosi I; quando avviene la fecondazione, l'oocita secondario e il corpuscolo polare svolgono la meiosi II.
Nella vita, una donna produce approssimativamente dai 400 ai 500 ovociti maturi (figura 4).
24
Figura 4 maturazione dell'oocita e formazione del 1° globulo polare ( da www.anism.it)
1.5. Biopsia del globulo polare
Il primo globulo polare non è richiesto per il successo della fertilizzazione o per il normale sviluppo embrionale. Il secondo globulo polare , anche se è un prodotto della fecondazione, non risulta utile per il successivo sviluppo embrionale (Kaplan et al., 1995). Così la rimozione del primo o del secondo globulo polare, o di entrambi, ai fini della diagnosi genetica non dovrebbe avere alcun effetto nocivo sull’embrione in via di sviluppo.
Il primo e il secondo globulo polare possono essere sottoposti a biopsia simultanea o sequenziale. La biopsia del primo globulo polare può avvenire immediatamente dopo il prelievo di ovociti a condizione che l'ovocita sia entrato in metafase II e sia stato completamente estruso il primo globulo polare, senza residui di fibre del fuso.
25
Il secondo globulo polare è già presente tre ore dopo la fecondazione, tuttavia, è collegato alla ovocita da un ponte citoplasmatico contenente i resti del fuso mitotico durante le prime ore di estrusione del globulo polare.
La biopsia simultanea può essere fatta solo durante una finestra di tempo di circa 6-14 ore dopo la fecondazione, successivamente, il primo globulo polare inizia a degenerare e questo può portare a successivi errori diagnostici (Munné et al., 1995).Il recupero del globulo polare per poterlo analizzare prevede due fasi: l’apertura della zona pellucida (ZP) e la successiva rimozione del globulo polare.
I primi tentativi di apertura della zona pellucida umana risalgono alla fine degli anni ’80 inizio anni ’90, quando venne applicata al fine di aiutare la fecondazione degli ovociti umani o al fine di aiutare il processo di schiusa dell'embrione. Questo è stato un piccolo passo verso la rimozione del materiale cellulare da embrioni così da poter consentire la DGP.
La rimozione dei globuli polari richiede l'accesso allo spazio perivitellino attraverso un’apertura da fare nella zona pellucida (ZP) e per questo sono stati proposti 3 diversi metodi: meccanici (partial zona dissection o zona drilling); chimici (usando soluzioni di acido tyroideo); o con la più recente introdotta tecnica laser.
Apertura meccanica
L’apertura meccanica della zona per il recupero del globulo polare è applicata clinicamente, anche se in modo molto minore rispetto gli altri due metodi di apertura della ZP. La dissezione parziale della zona consiste nel fare un taglio nella ZP per mezzo di una micropipetta smussata (12-15 micron di diametro).In questo caso l'ovocita è tenuto in modo che il globulo polare sia in posizione delle ore 12. La micropipetta smussata è passata attraverso la ZP e nello spazio perivitellino tangenzialmente verso il globulo polare. Fatto ciò il globulo polare può poi essere aspirato nella pipetta (Figura 5).
26
Figura 5: biopsia del globulo polare utilizzando una micropipetta smussata (Da Preimplantation Genetic Diagnosis. Second Edition 2009, Edited by Joyce C. Harper).
Se il globulo polare è ancora attaccato all’ooplasma, si può tenere ancora in incubazione per consentire il completamento del ciclo cellulare e la completa estrusione del globulo stesso ( Montag et al., 2006).
Un'altra tecnica efficace di biopsia è stata elaborata da Cieslak et al. (1999). Questo approccio è basato sulla dissezione tridimensionale della zona pellucida.
L'ovocita viene appoggiato al capillare Holding e, utilizzando un ago tagliente,si fa una fessura nei pressi della zona dove si trovano i globuli polari. Dopo aver girato gli ovociti di 90 gradi, viene eseguita una seconda fessura attraverso un’incisione trasversale permettendo così l'accesso ai globuli polari.
Il metodo meccanico risulta sicuro e semplice, e ha il vantaggio di proteggere l'embrione, dal momento che il lembo creato nella zona si chiude dopo la rimozione effettuata con la pipetta. Ciò è in contraddizione con la procedura chimica di apertura della ZP, che invece crea un buco vero e proprio,come di seguito illustrato.
Apertura chimica
La perforazione di tipo chimico (zona drilling) viene effettuata usando soluzioni di acido tyroideo (pH 2.3).Questo approccio rimane quello maggiormente usato per analizzare gli ovociti in quanto è una soluzione più economica rispetto alle sofisticate tecniche laser.
La zona drilling tramite l’uso dell’acido tiroideo crea nella ZP un’apertura rotonda la cui dimensione non è sempre facile da controllare, visto che lo strato esterno della zona è facilmente dissolvibile, mentre lo strato interno invece può
27
variare notevolmente nella sua suscettibilità alla dissoluzione con la soluzione di acido tiroideo.
Apertura tramite laser
Nella riproduzione assistita, il laser è stato inizialmente utilizzato per aiutare la fecondazione in caso di grave infertilità maschile. Un approccio è stato quello di praticare un piccolo foro nella ZP, che consentiva ad un paio di spermatozoi di poter accedere allo spazio perivitellino e fondersi con l'oolemma (Liow et al., 1996).
Recentemente, lo sviluppo di un sistema laser a diodo di 1,48 micron ha avuto un impatto importante sulle tecniche di fecondazione assistita (Rink et al., 1994, 1996; Montag et al., 1999). L'idea di usare questo sistema laser per la biopsia del globulo polare era stato proposto già nel 1997 (al Montag et al., 1997). In generale, la dimensione dell’apertura del foro è di solito nel range di 18-25 micron, ma la grandezza del foro può essere facilmente regolata aumentando o diminuendo il tempo di irraggiamento. Va detto che i fori ottenuti con laser sono più precisi di quelli ottenuti con una soluzione di acido tiroideo.
In questa tecnica si può inserire direttamente il capillare nella zona di apertura e per ciò non necessita di aghi taglienti per l’aspirazioni. Questo consente quindi l’utilizzo di aghi smussanti riducendo notevolmente in questo modo il rischio di danneggiare il globulo polare o l'ovocita rimanente. La procedura risulta quindi accurata, riproducibile e sicura e riduce anche il numero di cellule che non possono essere diagnosticate in modo affidabile a causa dei problemi tecnici durante la procedura di biopsia (Montag et al., 2002).
Un altro vantaggio è che il laser drilling e la successiva biopsia può essere effettuata senza cambiare la piastra di coltura o i capillari contrariamente a quello che si doveva fare nella perforazione della zona con uso di una soluzione di acido tyroideo. Questo può aiutare a prevenire la contaminazione dei campioni da diagnosticare con tecniche sensibili come la PCR.
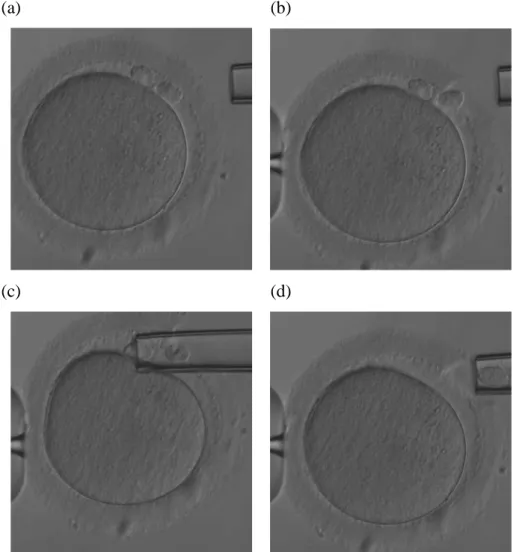
La biopsia laser assistita del globulo polare è effettuata nel miglior modo quando l’ovocita si trova attaccato al capillare Holding e il primo globulo polare è in posizione ore 12, mentre il secondo globulo polare si trova accanto al primo sullo stesso piano focale. Un'apertura di 18-25 micron viene fatta in posizione ore 2-3 e spingendo il capillare da biopsia nello spazio perivitellino entrambi i globuli polari possono essere rimossi contemporaneamente (Figura 6).
28
(a) (b)
(c) (d)
Figura 6 : Biopsia simultanea del primo e del secondo globulo polare
(Da Preimplantation Genetic Diagnosis. Second Edition 2009, Edited by Joyce C. Harper).
Di solito il secondo globulo polare è collegato all'ovocita da un ponte citoplasmatico, che è molto fermo subito dopo la formazione del globulo polare stesso, ma diventa meno consistente, con il tempo. Il posizionamento del secondo globulo polare accanto al capillare di aspirazione consente di spingere il secondo globulo polare molto più a sinistra, verso il capillare holding, e questo movimento di stiramento di solito è sufficiente a rompere il ponte citoplasmatico tra il secondo globulo polare e l'ovocita. A causa dell'utilizzo di capillari smussati anche la manipolazione in diretta vicinanza dell’oolemma non danneggia l'ovocita.