Capitolo 1
L’idrogeno
1.1 Introduzione
L’idrogeno è senza dubbio l’elemento più comune sulla Terra e nell’Universo ma sfortunatamente non lo si trova allo stato puro. È quindi necessario estrarlo dalle molecole che lo contengono, come ad esempio l’acqua (ne contiene circa il 12% in peso), il carbone (4÷6%), il gas naturale (25%) e le benzine (circa il 12%) mediante opportuni procedimenti chimici ed utilizzando una fonte di energia esterna: proprio per questo motivo l’idrogeno deve essere considerato un vettore energetico piuttosto che una fonte energetica primaria. Nel settore dei trasporti è considerato l’alternativa futura agli attuali combustibili fossili: nel breve periodo utilizzato direttamente in motori a combustione interna e nel periodo medio lungo adottato per produrre energia elettrica mediante le fuel cells potrà contribuire ad un riduzione sostanziale dell’inquinamento locale (centri cittadini). L’idrogeno infatti, essendo un combustibile privo di carbonio, non inquina: se usato in sistemi a combustione produce emissioni composte soltanto da vapore acqueo e ossidi da azoto (questi ultimi abbattibili con tecnologie note), mentre se prodotto con sistemi elettrochimici (celle a combustibile) produce solo vapore acqueo.
Nonostante gli indiscutibili vantaggi ottenibili impiegando l’idrogeno, esistono ancora molte problematiche da risolvere riguardanti le tecnologie dell’intero ciclo di vita del prodotto, in modo particolare le fasi inerenti la sua produzione, il trasporto, lo stoccaggio e l’utilizzo. Altri problemi riguardano gli assai elevati costi di produzione e di immagazzinamento, mentre per uno sviluppo di larga scala occorre prima risolvere il problema dell’infrastruttura distributiva. Benché la produzione, lo stoccaggio ed il trasporto di idrogeno siano attualmente utilizzate nel settore chimico e petrolchimico, tali tecnologie sono ancora troppo costose per un vasto impiego nel settore energetico. Oltre a questi problemi, ce ne sono altri molto importanti: è esplosivo, facilmente infiammabile ed estremamente permeabile (la sua piccola molecola
“fugge” attraverso buona parte dei materiali di uso comune). Confrontandolo con il gas naturale non si può dire che è più pericoloso, ma le caratteristiche di pericolosità sono differenti. Altro problema è quello normativo, perché essendo una nuova proposta energetica su larga scala, non esistono direttive che lo regolamentano e che stabiliscono criteri di sicurezza. Infine, per quanto riguarda i tempi, incideranno le scelte politiche e la mentalità della società, la quale si dovrebbe abituare all’uso di un combustibile non convenzionale.
1.2 Caratteristiche chimico-fisiche dell’idrogeno e sue proprietà
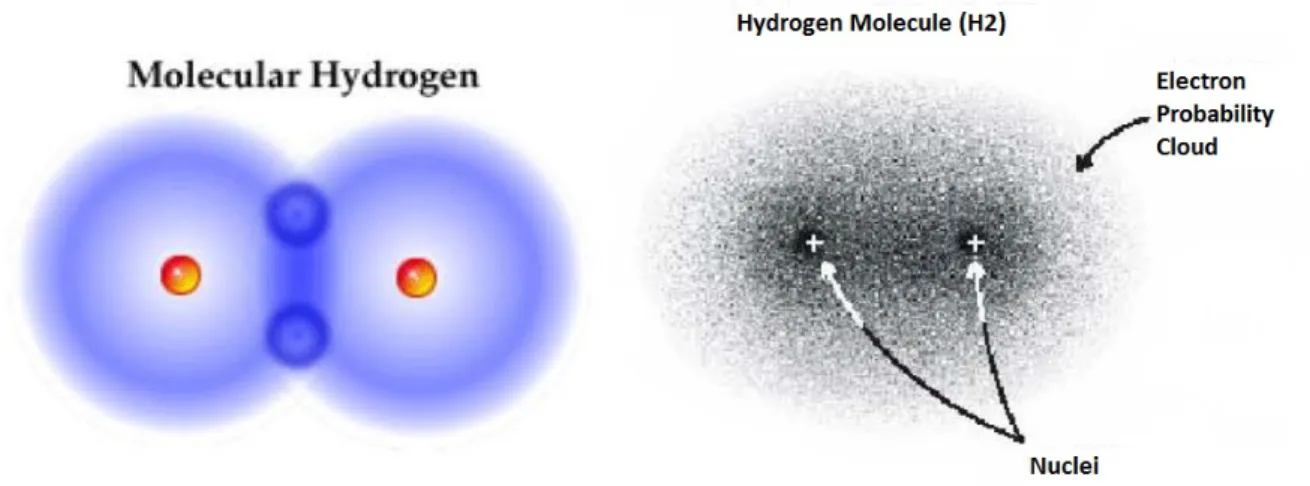
L’idrogeno è l’elemento chimico con simbolo H e numero atomico 1, appartenente al gruppo 1 (o 1A) della tavola periodica ed è l’elemento più semplice di tutti. E’ un gas molto reattivo, incolore inodore e insapore. Non si trova allo stato libero nell’atmosfera perché è 14,4 volte più leggero dell’aria e quindi si disperde nello spazio siderale; ha peso atomico di 1,007. Come molti elementi gassosi, l’idrogeno è biatomico, ma ad alte temperature si dissocia in atomi liberi.
Figura 1.1: Molecola dell’idrogeno
L’atomo dell’idrogeno si può visualizzare come un denso nucleo centrale con un solo elettrone orbitante in una “nuvola di probabilità”:
Ha punto di ebollizione e di fusione più bassi di ogni altra sostanza, fatta eccezione per l’elio: il punto di solidificazione è a -259°C (14 K), mentre quello di liquefazione è a -253°C (20 K); il punto di ebollizione può essere aumentato solo fino a -240°C con una pressione di almeno 13 bar: può quindi essere conservato o come gas in pressione o come liquido criogenico. Alla temperatura di 0°C e alla pressione di 1 atm, si presenta allo stato gassoso con densità 0.089
L’idrogeno è un elemento poco denso sia come gas che come liquido; la differenza di volume fra l’idrogeno gassoso e quello liquido può essere misurata con il “rapporto di espansione” fra il volume in cui viene conservato e quello dello stesso a temperature e pressione ambiente. Il rapporto di espansione per l’idrogeno liquido è pari a 1:848.
Figura 1.2: Rapporto di espansione dell’idrogeno
Le tabelle che seguono sintetizzano le principali proprietà dell’idrogeno:
Tabella 1.1: Proprietà dell’idrogeno
L’idrogeno è facilmente infiammabile, ossia richiede una bassa energia di innesco, pertanto piccole fughe di idrogeno possono costituire un pericolo di incendi o esplosioni.
L’alto contenuto energetico dell’idrogeno fa si che la sua potenza esplosiva sia pari a circa 2,5 volte quella di un generico idrocarburo: l’esplosione dell’idrogeno è quindi assai più
distruttiva, anche se la sua durata è inversamente proporzionale all’energia liberata; in conseguenza di ciò le fiamme liberate si estinguono prima di quelle degli idrocarburi.
1.3 Metodi di produzione dell’idrogeno
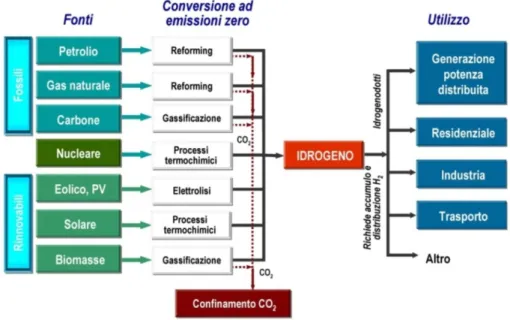
Le principali tecnologie di produzione dell’idrogeno sono: • Elettrolisi dell’acqua;
• Steam reforming del metano; • Gassificazione del carbone; • Da fonte nucleare;
Da notare che il processo di reforming è anche quello più economico, ma purtroppo non risolve il problema delle emissioni di gas inquinanti (come scarto ha grandi quantità di CO2) e
del consumo dei combustibili fossili; l’elettrolisi invece usa acqua (che è una fonte rinnovabile) ed è di per sé non inquinante ma richiede grossi quantitativi di energia elettrica, la quale può essere ottenuta, senza inquinare, da fonti di energia rinnovabili. Il problema allora è quello dei costi, per non parlare poi delle problematiche relative al trasporto, stoccaggio e sicurezza.
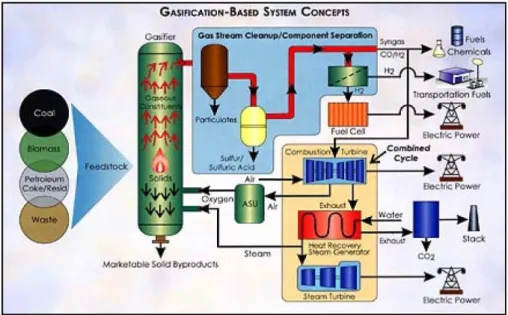
I sistemi principali attualmente in uso per la produzione e il consumo di idrogeno possono essere riassunti nel seguente schema:
Adesso andiamo a vedere brevemente come vengono svolti i principali processi di produzione dell’idrogeno elencati in precedenza.
1.3.1 Elettrolisi dell’acqua
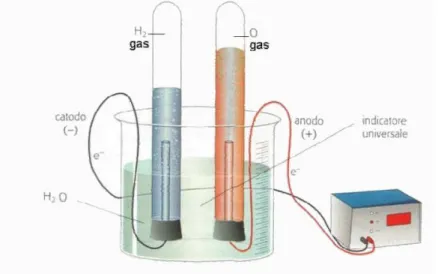
L’elettrolisi è il modo più semplice di produzione dell’idrogeno; la corrente entra nella cella elettrolitica tramite un elettrodo caricato negativamente (catodo), attraversa l’acqua e va via attraverso l’elettrodo caricato positivamente (anodo). La differenza di potenziale che si instaura tra i due elettrodi è in grado di scindere la molecola d’acqua; in pratica avviene la seguente reazione:
H2O + energia elettrica → H2 + ଵଶ O2
L’idrogeno e l’ossigeno così separati confluiscono rispettivamente verso il catodo e verso l’anodo, ed entrambi sono allo stato gassoso (vedi figura 1.4).
Il tasso di produzione dell’idrogeno è legato alla densità di corrente (rapporto tra la corrente elettrica e l’area di passaggio), ma in generale, maggiore è la densità di corrente, maggiore è il voltaggio richiesto e quindi il consumo di potenza aumenta a parità di idrogeno prodotto.
Figura 1.4: Tipica cella elettrolitica
La quantità minima di acqua d’alimentazione per un elettrolizzatore è di 1 litro per 1 Nm3 di idrogeno e per farlo occorrono circa 5 kWh di energia elettrica.
Figura 1.5: Rendimenti del processo di elettrolisi
Considerato che il potere calorifico dell’idrogeno è pari a 3 kWh/Nm3, risulta evidente come il processo non sia conveniente per la produzione di idrogeno come combustibile, in quanto il contenuto energetico del gas prodotto è inferiore alla quantità di energia elettrica consumata. Causa i costi di produzione troppo elevati questa tecnica non viene usata su larga scala, bensì per piccole produzioni e solo quando è richiesto idrogeno con elevato grado di purezza (non è questo il caso dei motori a combustione interna).
1.3.2 Steam reforming del metano
Il reforming del metano (SMR) è una tecnica consolidata mediante la quale si produce la stragrande maggioranza dell’idrogeno utilizzato nel mondo. Gli impianti, di notevoli dimensioni (come visibile nella figura sottostante), consentono di ottenere oltre 100 tonnellate (milioni di m3) al giorno.
Il vantaggio di questi sistemi è che utilizzano combustibili fossili molto diffusi (metano, metanolo, benzina e ammoniaca) e a basso costo; questo, unitamente al fatto di poter contare su grossi volumi di produzione, rende il costo di produzione dell’idrogeno compatibile con le esigenze di mercato; di contro, c’è il fatto che l’utilizzo di combustibili fossili comporta necessariamente un certo inquinamento.
Un altro problema è quello che l’idrogeno prodotto con questo sistema non è puro, ma contiene altri componenti che vanno eliminati tramite opportuni trattamenti che complicano notevolmente il processo e l’impianto. Proprio per questo viene usato il metano perché è quello che contiene meno impurezze.
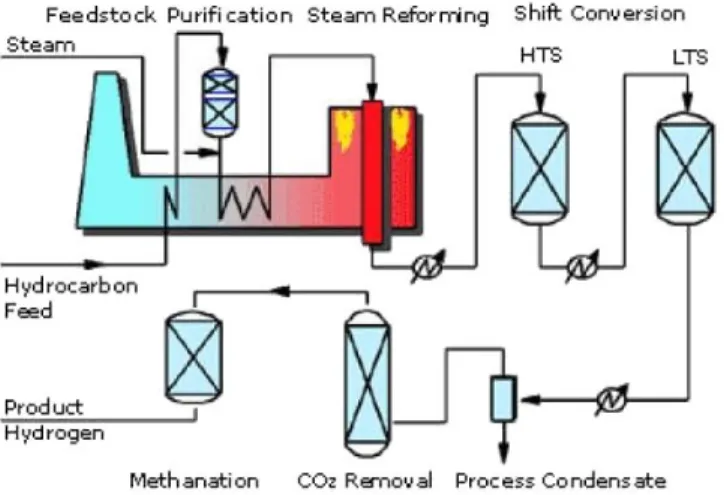
Lo SMR prevede la reazione di metano e vapore d’acqua in presenza di catalizzatori: il gas naturale, compresso ad una pressione di 25÷30 bar e con temperatura di circa 800 °C, viene introdotto nel reattore di steam-reforming dopo essere stato depurato dagli eventuali composti solforati, la cui presenza determinerebbe l’avvelenamento dei catalizzatori a basi di Nichel, utilizzati per la reazione.
Il prodotto finale è una miscela gassosa al 77% di H2 e CO2 (19%), contenente anche tracce di
CO (1%), H2O e CH4 (3%), che deve essere purificata in funzione dell’utilizzo finale tramite
assorbimento chimico assorbiment o PSA (Pressure Swing Absorption, utilizzato nell’industria per separare una miscela di gas nei suoi vari componenti).
Uno schema rappresentante il processo di reforming è illustrato nella figura seguente:
Figura 1.7: Schema del processo di Steam reforming
Il costo del gas naturale incide fortemente sul prezzo finale dell’idrogeno che costituisce il 52%÷68% del costo totale per impianti di grosse dimensioni e circa del 40% per impianti di
piccole dimensioni. I costi dello SMR sono notevolmente inferiori a quelli dell’elettrolisi e competitivi con quelli delle altre tecnologie.
Il principale svantaggio nell’impiego di questo processo produttivo è legato alla non rinnovabilità della materia prima, in quanto il metano, pur essendo presente in natura in quantità maggiori rispetto al petrolio, è comunque un combustibile fossile.
Lo steam reforming è ormai una tecnologia consolidata e comporta inoltre un ridotto impatto ambientale, con emissioni di inquinanti modeste. Del resto, gli impianti attualmente esistenti si limitano alla produzione di idrogeno per uso diretto e per la produzione di particolari composti chimici come l’ammoniaca e il metanolo.
1.3.3 Gassificazione del carbone
La gassificazione del carbone è una delle più vecchie tecniche di utilizzo di questo combustibile fossile e continua a svolgere un’importante ruolo nella produzione di energia, grazie al fatto che le risorse di carbone sono abbondanti e facilmente reperibili in tutte le parti del mondo.
Figura 1.8: Schema di riferimento per il processo di gassificazione del carbone
Il processo di gassificazione del carbone consiste nella parziale ossidazione non catalitica del carbone per dare un combustibile gassoso, formato principalmente da idrogeno, monossido di carbonio e metano; perché questo avvenga è necessario seguire una serie di stadi e trasformazioni diverse.
1. Nel primo stadio, la gassificazione porta alla termo-decomposizione del carbone e alla produzione di una miscela contenente, in varie proporzioni, monossido e biossido di carbonio, idrogeno, acqua, metano, solfuro di idrogeno, azoto e composti idrocarburici. Generalmente viene nominato “syngas” la miscela di gas ottenuta dalla termo-decomposizione del carbone a temperature superiori di 500 °C in assenza di ossigeno; ciò che si ottiene è appunto una miscela, ma abbiamo anche una fase liquida ed un residuo solido. La frazione liquida viene rimossa tramite condensazione, in modo da lasciare allo stato aeriforme il monossido di carbonio, l’idrogeno e l’anidride carbonica. La frazione solida viene invece recuperata, e tramite complicati processi di purificazione, si riesce ad ottenere un altro tipo di combustibile.
2. Nel secondo stadio si ha la gassificazione del residuo solido ottenuto, che rappresenta, in qualche modo, il cuore del carbone impiegato.
Il principale componente dei sistemi di gassificazione è rappresentato dal gassificatore (o reattore), all’interno del quale il carbone viene convertito in combustibile gassoso a seguito della reazione con vapore in pressione.
Il processo prevede l’uso di vapore acqueo ed aria per ossidare parzialmente il carbone secondo la seguente reazione :
C + H2O → CO + H2
Con altro vapore a 500 °C e un catalizzatore a base di ossidi di ferro si può ottenere idrogeno anche dall’ossido di carbonio:
CO + H2O → CO2 + H2
Allora il processo si gassificazione del carbone si basa sulla reazione: CO + 2H2O → CO2 + 2H2
Le caratteristiche dei prodotti, in termini di quantità, qualità e composizione, dipendono strettamente dalle condizioni di lavoro utilizzate (temperatura, compresa tra 400 °C fino a oltre 1200 °C, pressione, che può arrivare a 20÷50 bar nel caso di sistemi pressurizzati, ecc…), dal tipo di tecnologia utilizzata e dalla tipologia di carbone impiegato.
L’uso dell’ossigeno al posto dell’aria comporta un significativo abbassamento delle portate di syngas da trattare, in quanto non è presente l’azoto che diluisce i prodotti gassosi. L’ossigeno però deve essere prodotto, e allora viene ricavato dalla compressione dell’aria con la conseguenza dell’amplificazione degli impianti e di una richiesta maggiore di energia, quindi con costi maggiori. L’uso del metano genera meno problemi in quanto la sua quantità è molto più piccola rispetto a quella dell’azoto e fa risultare meno marcato l’effetto della diluizione.
Per questa tecnologia di estrazione dell’idrogeno, il costo della materia prima raggiunge quasi il 25% del prezzo dell’idrogeno prodotto; altri costi da sostenere sono il costo del capitale, la manutenzione dell’impianto e lo smaltimento dei rifiuti solidi. Escludendo l’elettrolisi, rispetto alle altre tecnologie, i costi sono leggermente più elevati.
1.3.4 Processi da fonte nucleare
Le centrali nucleari alle quali ci si riferisce per una produzione a basso costo dell’idrogeno sono quelle definite di IV generazione, anche se già oggi, gli impianti odierni (la maggior parte sono di II generazione realizzati negli anni ‘80) consentono di produrre idrogeno elettrolitico a basso costo nei periodi di calo della domanda nella rete elettrica.
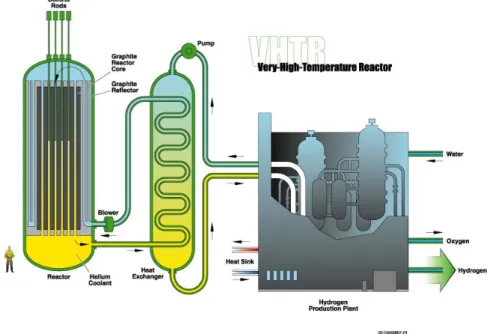
Gli impianti di IV generazione sono basati su una nuova tipologia di reattori nucleare a fissione che, pur essendo da decenni allo studio, non si sono ancora concretizzati in impianti utilizzabili diffusamente e in sicurezza. Saranno disponibili commercialmente fra alcune decine di anni (2030-2040), difficilmente nel 2020. Uno delle nuove tipologie di reattori nucleari è il reattore a temperatura molto alta, noto in inglese con la sigla VHTR, acronimo diVery High Temperature Reactor.
Figura 1.9: Schema del reattore VHTR
Questo design di reattore prevede una temperatura del complesso di circa 1000°C. Le alte temperature raggiunte permettono applicazioni chimiche secondarie del calore ottenuto, sia
Iodio. L’idrogeno verrebbe prodotto in modo diretto, per via termica, senza disperdere l’energia termo-nucleare nelle varie conversioni termo-meccaniche ed elettriche. Un beneficio collaterale dei reattori nucleari che producono sia elettricità che idrogeno e che si può scegliere rapidamente di produrre una delle due. Ad esempio l’impianto potrebbe produrre elettricità di giorno ed idrogeno di notte, compensando così la variazione della domanda. Quindi, in definitiva, si può concludere che la visione di un sistema energetico basato sull’idrogeno è strettamente correlata alla disponibilità di energia elettrica a basso costo e di origine non fossile, ottenuta quindi per via nucleare.
1.4 Stoccaggio
Uno dei motivi che hanno frenato la diffusione dell’idrogeno è la difficoltà di trasporto, sia per la bassa densità energetica, sia perché esplosivo, infiammabile ed estremamente volatile. Il metodo più sfruttato è quello dell’uso di bombole ad alta pressione, capaci di contenere l’idrogeno gassoso a pressioni di 200÷350 bar; grazie alla tecnologia di adesso, le classiche bombole industriali di acciaio possono essere sostituite con bombole di alluminio a doppia parete con il vantaggio di essere molto più leggere; la liquefazione dell’idrogeno non è la soluzione più conveniente dal punto di vista energetico.
In linea generale i rischi associati all’uso dell’idrogeno sono di tipo fisiologico (può provocare congelamento, difficoltà respiratorie e asfissia), di tipi fisico (può provocare il guasto nei componenti e il loro infragilimento) e di tipo chimico (a seguito di ignizioni si incendia). Per poter rispondere ed essere preparati ad eventuali problematiche, occorre un’ottima gestione della sicurezza (con la particolarità in più della pericolosità del trasporto su strada) con adeguati presidi antincendio, formazione e informazione del personale addetto, definizione delle procedure per le manutenzioni, permessi di lavoro, ecc. Oltre a questo sono necessarie anche le caratteristiche di ubicazione dell’impianto, come l’accessibilità, l’isolamento e le distanze di sicurezza; molto importanti anche le caratteristiche costruttive dell’impiantistica.
L’idrogeno viene stoccato in serbatoi a bordo del veicolo il quale può essere utilizzato direttamente come combustibile per il motore a combustione interna, oppure può essere impiegato come elemento di alimentazione delle fuel cells destinate alla produzione di energia elettrica necessaria per la trazione, generata da motori elettrici.
1.4.1 Stoccaggio dell’idrogeno gassoso
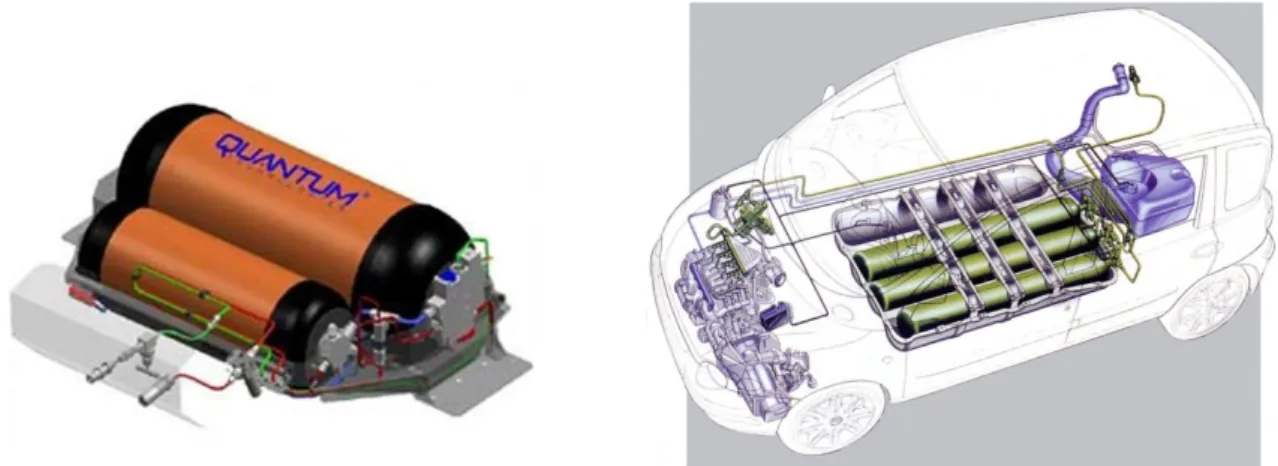
L’idrogeno in forma gassosa può essere immagazzinato in apposite bombole di acciaio ad una pressione di 200÷350 bar (20÷35 MPa), attraverso adeguati compressori. Per contenere il gas a pressioni ancora più elevate sono usate bombole in grafite/fibra di carbonio che possono arrivare a contenere l’idrogeno compresso anche fino a 700 bar; il problema è che non in tutti i Paesi è consentito trasportare a bordo di veicoli bombole con pressioni così elevate. Queste bombole possono essere alloggiate, nel caso della trazione, direttamente a bordo dei veicoli come mostrato in figura 1.10.
La pericolosità è simile a quella del metano; l’idrogeno a contatto con l’aria forma miscele esplosive che possono scoppiare, ma a differenza del metano, grazie alla maggior leggerezza, l’idrogeno si disperde prima diminuendo il rischio di concentrazione critica.
Figura 1.10: Esempio di bombole per idrogeno gassoso e loro applicazione
1.4.2 Stoccaggio dell’idrogeno liquido
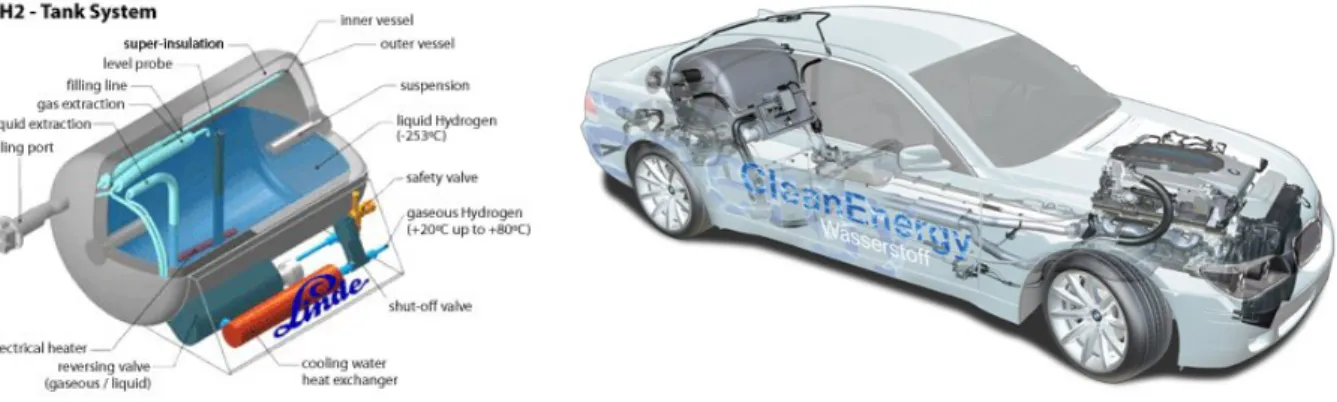
L’idrogeno liquido, stoccato a bordo del veicolo in serbatoi alla temperatura di circa -253°C, ha una maggiore densità di energia per unità di volume rispetto allo stoccaggio gassoso. Al momento dell’utilizzo viene quindi vaporizzato e distribuito in forma gassosa.
Il processo di liquefazione dell’idrogeno è molto oneroso dal punto di vista energetico ma consente di avere un prodotto con più elevata densità energetica (con la riduzione dei costi di trasporto e con aumento della capacità stoccabile). Questo sistema però comporta un elevato dispendio di energia: circa il 30% dell’energia dell’idrogeno è necessaria per il suo raffreddamento. Dato che l’idrogeno è immagazzinato ad una temperatura che corrisponde al suo punto di ebollizione, qualsiasi passaggio di calore attraverso il liquido causa
trasmissione di calore dalla parete esterna al liquido, per cui sono costituiti da un doppio rivestimento nel cui interno è presente un vuoto d’aria per impedire il passaggio di calore per conduzione o convezione. Un importante vantaggio derivante dalla scarsa reattività chimica dell’idrogeno a bassa temperatura è l’eliminazione del problema dell’infragilimento dei metalli, che otteniamo invece nel caso di idrogeno compresso.
La maggior parte dei contenitori di idrogeno liquido hanno forma sferica perché quest’ultima ha la più bassa superficie per il trasferimento di calore per unità di volume; inoltre al crescere del diametro dei contenitori, il volume aumenta più velocemente della superficie esterna, per cui i contenitori più grandi, in proporzione, provocano minori perdite per trasferimento di calore. I contenitori cilindrici, invece, sono preferibili per la loro facilità ed economicità di costruzione.
Anche l’idrogeno liquido può essere sfruttato per il rifornimento dei veicoli, ma bisogna considerare i notevoli rischi legati ad esso come la perdita di carburante e lo spazio ristretto a disposizione dei parcheggi.
Figura 1.11: Esempio di bombole per idrogeno liquido e loro applicazione
1.4.3 Stoccaggio in nanotubi di carbonio
La tecnologia dei nanotubi di carbonio (struttura derivata dalla terza forma allotropica del carbonio inorganico), è ancora in fase di studio ma risulta molto adatta ai mezzi di trasporto; consiste nell’adozione di “nanotubi” di carbonio i quali hanno la capacità di assorbire idrogeno in maniera significativa a pressioni di qualche decina di bar se portati a temperatura inferiore a -150°C. Questi piccoli tubi hanno un diametro di 1÷1,5 nm e sono costituiti da un foglio di grafite avvolto a formare proprio un tubo; avvolgendo più fogli concentrici si fanno dei nanotubi a parete multipla e se invece si sovrappongono molti fogli da 50÷100 nm di lato si fabbricano le “nanofibre”. In base a come si usano questi fogli si ottengono varie configurazioni della struttura, come è visibile dalla figura seguente:
Figura 1.12: Esempi di strutture di nanotubi
Una minor quantità di idrogeno può essere immagazzinata anche se usati a temperatura ambiente, facendone così il loro miglior pregio; attualmente non viene ancora sfruttato commercialmente proprio perché la ricerca è ancora ai primi passi.
1.4.4 Problematiche
Gli eventi che possono creare problemi per lo stoccaggio di idrogeno e su cui bisogna focalizzare l’attenzione sono il cedimento dei vari componenti, come i serbatoi, le valvole, le tubazione, ecc., e il coinvolgimento in eventuali incidenti esterni; particolare importanza avranno quindi la scelta dei componenti, la manutenzione, i test periodici e l’isolamento della zona di stoccaggio dal resto dell’impianto. Le considerazioni sono circa le stesse sia per l’idrogeno liquido che gassoso.