64
CAPITOLO 3
PARTE SPERIMENTALE
Materiale vegetale
Le radici di Scorzonera judaica Eig. sono state raccolte presso Dab’A, Giordania, nell’aprile 2009.
Un campione di materiale vegetale (voucher n. Jo-It 2009/1) è stato depositato presso l’Al-Zaytoonah, University of Jordan, Amman, Giordania.
Estrazione
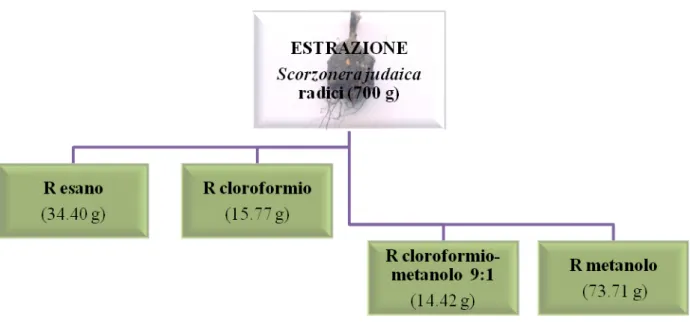
Il materiale vegetale (700 g) è stato sottoposto ad essiccazione all’aria, macinazione e successiva estrazione a temperatura ambiente con solventi a polarità crescente: n-esano, cloroformio, cloroformio– metanolo (9:1) e metanolo (Fig. 3.1).
La droga è stata estratta attraverso macerazione statica con ciascun solvente ogni 48 h per circa 3 settimane, durante le quali il solvente stesso è stato rinnovato di frequente (3 × 2 L).
Gli estratti ottenuti ad ogni cambio di solvente sono stati evaporati a pressione ridotta e a temperatura inferiore a 40 °C; ad estrazione finita si sono ottenute le seguenti rese: • RE • R estratto n-esanico (34.40 g) C • R estratto cloroformico (15.77 g) CM • R
estratto cloroformio – metanolo (14.42 g) M estratto metanolico (73.71 g)
65
Fig. 3.1 Diagramma della procedura di estrazione di Scorzonera judaica Eig.
Dagli studi fitochimici condotti sul genere presenti in letteratura e da un’analisi preliminare degli estratti attraverso cromatografia su strato sottile (TLC), sono stati scelti come obiettivo di studio nell’ordine, l’estratto cloroformio–metanolo, l’estratto cloroformico e l’estratto metanolico.
Studio dell’estratto cloroformio – metanolo (9:1)
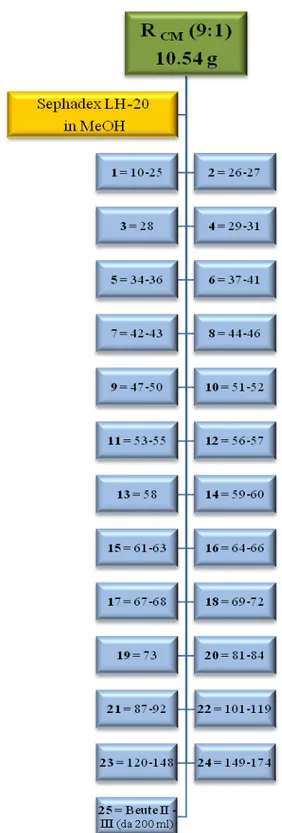
L’estratto cloroformio–metanolo (10.54 g di 14.42 g) è stato sciolto in circa 30 ml di metanolo e sottoposto a centrifugazione. Il sovranatante è stato caricato su colonna Sephadex LH-20 (i.d.= 5 cm, V = 19.6 ml/cm) eluendo con metanolo con un flusso di 0.8 ml/min. Le 174 frazioni raccolte, di circa 15 ml ciascuna, oltre a due di lavaggio da 200 ml, sono state sottoposte a TLC (Thin Layer Chromatography) su gel di silice 60 F254, usando come eluenti BAW (n-butanolo–acido acetico–acqua, 60:15:25) e CMW (cloroformio–metanolo– acqua, 80:18:2), e identificate utilizzando il solfato di cerio come reattivo spray.
66
Le 176 frazioni sono state successivamente riunite in 25 frazioni principali (1-25) in base alle somiglianze cromatografiche evidenziate attraverso TLC (Fig. 3.2). Alcune frazioni prive di evidenti macchie cromatografiche sono state eliminate.
67
Analisi della frazione R
CMLa frazione 11 (1.491g) è stata ripartita per mezzo di un imbuto separatore in una porzione n-butanolica, R
11:
BuOH, e in una acquosa, RH2O
• Attenuazione = 16x
, in modo tale da eliminare la componente zuccherina disciolta in quest’ultima fase. Il residuo butanolico così ottenuto (89.2 mg) è stato sciolto in circa 900 μl di metanolo puro per HPLC e centrifugato. Il sovranatante è stato sottoposto a cromatografia su colonna HPLC μ-Bondapak RP-18 eluendo con metanolo–acqua (2:3), utilizzando le seguenti condizioni:
• Eluente = MeOH:H2 • Iniettata = 100 μl
O (2:3)
• Numero di iniettate = 7
• Velocità di flusso = 2.0 ml/min
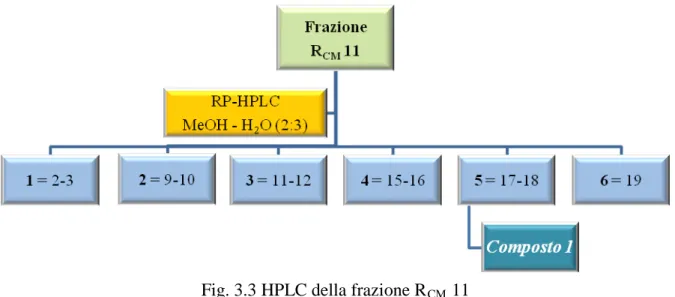
Le 27 frazioni raccolte sono state sottoposte a TLC su lastra di silice usando come eluente una miscela CMW (cloroformio–metanolo–acqua 80:18:2) e solfato di cerio come reattivo spray. Le frazioni, in base alle uguaglianze cromatografiche, sono state successivamente riunite in 6 frazioni principali (1-6) (Fig. 3.3).
68
La frazione 115 sottoposta a TLC, utilizzando solfato di cerio come reattivo spray, si è presentata come un’unica macchia di colore brunastro e pertanto è stata studiata ulteriormente; attraverso analisi spettroscopiche si è arrivati all’identificazione del composto 1 come 4β-[(β-D
-glucopiranosil)-idrossi]-pinoresinolo (4.3 mg; tR=12 min).
I dati chimico-fisici del composto 1 sono i seguenti:
Composto 1: solido amorfo brunastro; [α]25d = +26° (c 0.1, MeOH); ¹H- e ¹³C-NMR vedi tab. 2.9, capitolo 2; ESI-MS m/z 559 [M+Na]+, 379 [M+Na−180]+, 580 [M−H+HCOOH]−.
Analisi della frazione R
CMLa frazione 13+14 (314.9 mg) è stata sciolta in circa 3 ml di metanolo puro per HPLC e centrifugata. Il sovranatante è stato sottoposto a cromatografia su colonna HPLC μ-Bondapak RP-18 eluendo con metanolo–acqua (2:3), utilizzando le seguenti condizioni:
13+14:
• Attenuazione = 16x • Eluente = MeOH:H2 • Iniettata = 100 μl O (2:3) • Numero di iniettate = 13• Velocità di flusso = 2.0 ml/min
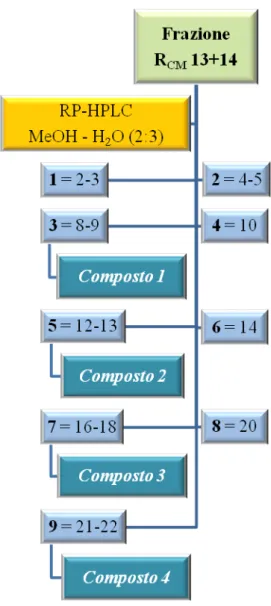
Le 23 frazioni raccolte sono state sottoposte a TLC su lastra di silice usando come eluente una miscela CMW (cloroformio–metanolo–acqua 80:18:2) e solfato di cerio come reattivo spray. Le frazioni, in base alle uguaglianze cromatografiche, sono state successivamente riunite in 9 frazioni principali (1-9) (Fig. 3.4).
69
Fig. 3.4 HPLC della frazione RCM 13+14
Le frazioni 13+143, 13+145, 13+147 e 13+149 sottoposte a TLC, utilizzando solfato di cerio come reattivo spray, si sono presentate come un’unica macchia di colore brunastro e pertanto sono state studiate ulteriormente; attraverso analisi spettroscopiche si è arrivati all’identificazione rispettivamente del composto 1 come 4β-[(β-D-glucopiranosil)-idrossi]-pinoresinolo (2.7 mg; tR=12 min), precedentemente isolato dalla frazione RCM 11, del composto 2 come idrangenolo-8-O-β-D-glucopiranoside (1.4 mg; tR=15 min), del composto 3 come idrangenolo 4’-O-β-D-apiofuranosil-(1→6)-β-D-glucopiranoside (3.2 mg;
70
tR=23 min) e del composto 4 come idrangenolo-4’-O- α-L-rhamnopiranosil-(1→3)-β-D-glucopiranoside (5.4 mg, tR=30 min).
I dati chimico-fisici dei composti 2-4 sono i seguenti:
Composto 2: solido amorfo bruno; ¹H- e ¹³C-NMR vedi tab. 2.1, capitolo 2;
ESI-MS m/z 441 [M+Na]+, 423 [M+Na−18]+, 279 [M+Na−162]+, 417 [M−H]−, 255 [M−H−162]−
Composto 3: solido amorfo bruno; ¹H- e ¹³C-NMR vedi tab. 2.2, capitolo 2;
ESI-MS m/z 573 [M+Na] .
+
, 555 [M+Na−18]+, 423 [M+Na−18−132]+, 261 [M+Na−18−132−162]+
Composto 4: solido amorfo brunastro; [α]
.
25
d = −46° (c 0.1 MeOH); ¹H- e ¹³C-NMR vedi tab. 2.3, capitolo 2; ESI-MS m/z 563 [M−H]−, 587 [M+Na]+, 569 [M+Na−18]+, 441 [M+Na−146]+.
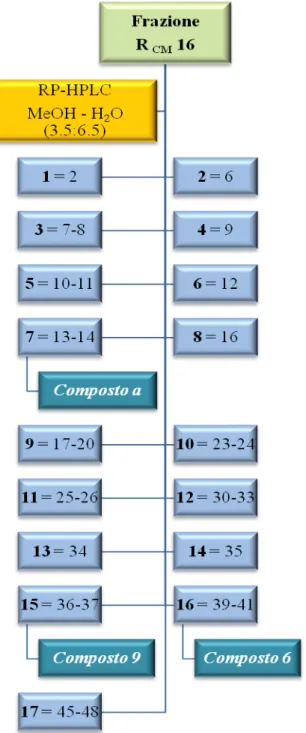
Analisi della frazione R
CMLa frazione 16 (123 mg) è stata sciolta in circa 1.2 ml di metanolo puro per HPLC e centrifugata. Il sovranatante è stato sottoposto a cromatografia su colonna HPLC μ-Bondapak RP-18 eluendo con metanolo–acqua (3.5:6.5), utilizzando le seguenti condizioni:
16:
• Attenuazione = 16x • Eluente = MeOH:H2 • Iniettata = 100 μl O (3.5:6.5) • Numero di iniettate = 1071
Le 49 frazioni raccolte sono state sottoposte a TLC su lastra di silice usando come eluente una miscela CMW (cloroformio–metanolo–acqua 80:18:2) e solfato di cerio come reattivo spray. Le frazioni, in base alle uguaglianze cromatografiche, sono state successivamente riunite in 17 frazioni principali (1-17) (Fig. 3.5).
72
Le frazioni 167, 1615 e 1616 sottoposte a TLC, utilizzando solfato di cerio come reattivo spray, si sono presentate come un’unica macchia di colore brunastro e pertanto sono state studiate ulteriormente; attraverso analisi spettroscopiche si è arrivati all’identificazione del composto 6 (1616) come acido caffeico metil estere (9.3 mg; tR=35 min) e del composto 9 (1615) come 4α-idrossipinoresinolo o 9α-idrossipinoresinolo (0.8 mg; tR=30 min), mentre la frazione 167 contiene il composto a (3 mg; tR=13 min) ancora in fase di caratterizzazione.
I dati chimico-fisici dei composti 6 e 9 sono i seguenti:
Composto 6: solido amorfo bruno; ¹H- e ¹³C-NMR vedi tab. 2.8, capitolo 2.
ESI-MS m/z 193 [M−H]−
Composto 9: solido amorfo brunastro; ¹H- e ¹³C-NMR vedi tab. 2.10, capitolo 2.
ESI-MS m/z 373 [M−H] .
−.
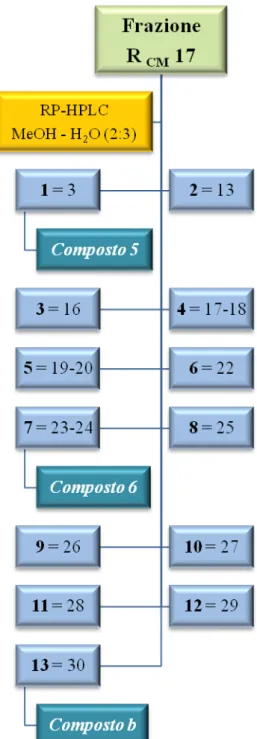
Analisi della frazione R
CMLa frazione 17 (71.8 mg) è stata sciolta in circa 720 μl di metanolo puro per HPLC e centrifugata. Il sovranatante è stato sottoposto a cromatografia su colonna HPLC μ-Bondapak RP-18 eluendo con metanolo–acqua (2:3), utilizzando le seguenti condizioni:
17:
• Attenuazione = 16x • Eluente = MeOH:H2 • Iniettata = 100 μl O (2:3) • Numero di iniettate = 773
Le 33 frazioni raccolte sono state sottoposte a TLC su lastra di silice usando come eluente una miscela CMW (cloroformio–metanolo–acqua 80:18:2) e solfato di cerio come reattivo spray. Le frazioni, in base alle uguaglianze cromatografiche, sono state successivamente riunite in 13 frazioni principali (1-13) (Fig. 3.6).
74
Le frazioni 171, 177 e 1713 sottoposte a TLC, utilizzando solfato di cerio come reattivo spray, si sono presentate come un’unica macchia di colore brunastro e pertanto sono state studiate ulteriormente; attraverso analisi spettroscopiche si è arrivati all’identificazione rispettivamente del composto 5 come acido 3,4-didrossi-benzoico o acido protocatecuico (1.2 mg; tR=5 min), del composto 6 come acido caffeico metil estere (1.3 mg; tR=23 min), precedentemente isolato dalla frazione RCM 16, mentre la frazione 1713 contiene il composto b ancora in fase di caratterizzazione (1.4 mg, tR=23 min).
I dati chimico-fisici del composto 5 sono i seguenti:
Composto 5: solido amorfo bruno; ¹H- e ¹³C-NMR vedi tab. 2.7, capitolo 2.
ESI-MS m/z 153 [M−H]−.
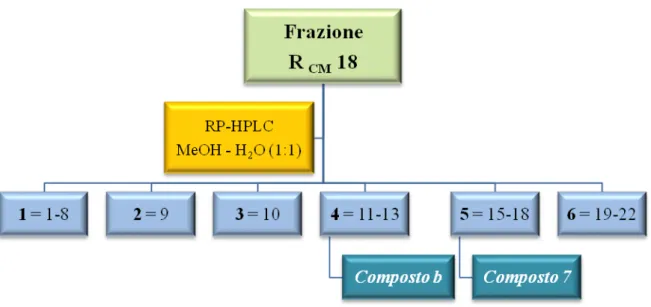
Analisi della frazione R
CMLa frazione 18 (82.9 mg) è stata sciolta in circa 900 μl di metanolo puro per HPLC e centrifugata. Il sovranatante è stato sottoposto a cromatografia su colonna HPLC μ-Bondapak RP-18 eluendo con metanolo–acqua (1:1), utilizzando le seguenti condizioni:
18:
• Attenuazione = 16x • Eluente = MeOH:H2 • Iniettata = 100 μl O (1:1) • Numero di iniettate = 575
Le 22 frazioni raccolte sono state sottoposte a TLC su lastra di silice usando come eluente una miscela CMW (cloroformio–metanolo–acqua 80:18:2) e solfato di cerio come reattivo spray. Le frazioni, in base alle uguaglianze cromatografiche, sono state successivamente riunite in 6 frazioni principali (1-6) (Fig. 3.7).
Fig. 3.7 HPLC della frazione RCM 18
Le frazioni 184 e 185 sottoposte a TLC, utilizzando solfato di cerio come reattivo spray, si sono presentate come un’unica macchia di colore brunastro e pertanto sono state studiate ulteriormente; attraverso analisi spettroscopiche si è arrivati all’identificazione del composto 7 come idrangenolo (9.1 mg; tR=24 min), mentre la frazione 185 è il composto b precedentemente isolato dalla frazione RCM 17 (2.7 mg; tR=14 min).
76
I dati chimico-fisici del composto 7 sono i seguenti:
Composto 7: solido amorfo bruno; ¹H- e ¹³C-NMR vedi tab. 2.4, capitolo 2.
ESI-MS m/z 257 [M+H]+, 239 [M+H−18 ]+, 211 [M+H−18−28 ]+, 255 [M−H ]−, 211 [M−H−44]−.
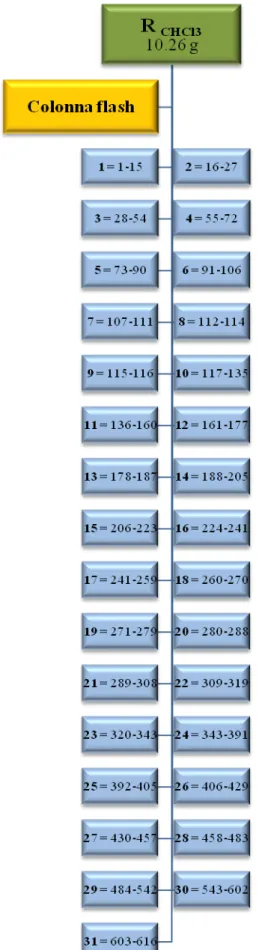
Studio dell’estratto cloroformico
Una parte di estratto cloroformico RC (10.26 g), dopo essere stato disciolto nella minima quantità di una miscela esano:cloroformio 7:3, è stato centrifugato. Il sovranatante è stato sottoposto a cromatografia flash, realizzata attraverso una colonna di silice (9 x 25 cm) con flusso approssimativo di 25 ml/min. Sono state raccolte frazioni di circa 70 ml, utilizzando come fase mobile eluenti a polarità crescente, come indicato nella Tab 3.1:
Eluente Frazioni raccolte
Esano : CHCl3 7 : 3 1-188 Esano : CHCl3 1 : 1 189-240 CHCl3 241-377 CHCl3 : MeOH 99 : 1 378-429 CHCl3 : MeOH 98 : 2 430-457 CHCl3 : MeOH 97 : 3 458-498 CHCl3 : MeOH 95 : 5 499-543 CHCl3 : MeOH 9 : 1 544-613 MeOH Lavaggio
77
Le 616 frazioni ottenute sono state successivamente riunite in 31 frazioni principali (Fig. 3.8) sulla base delle caratteristiche cromatografiche evidenziate attraverso TLC (Thin Layer Chromatography) su gel di silice 60 F254 , utilizzando come fase mobile CHCl3 e miscele esano:CHCl3 3:2 e 2:3, CHCl3:MeOH 98:2 , 95:5 e 9:1 e come reattivo spray il solfato di cerio. Alcune frazioni prive di evidenti macchie cromatografiche sono state eliminate.
78
79
Analisi della frazione R
CLa frazione 21 (338.2 mg) è stata sciolta in circa 4 ml di una miscela MeOH:H
21:
2O 4:1 e centrifugata. Il sovranatante è stato portato a secco, pesato (65.1 mg) e disciolto in 700 μl di una miscela MeOH:H2O 6.5:3.5 e nuovamente centrifugato. Il sovranatante è stato sottoposto a cromatografia su colonna HPLC
μ-Bondapak RP-18 eluendo con MeOH:H2
• Attenuazione = 16x O 6.5:3.5, utilizzando le seguenti condizioni: • Eluente = MeOH:H2 • Iniettata = 100 μl O (6.5:3.5) • Numero di iniettate = 7
• Velocità di flusso = 2.0 ml/min
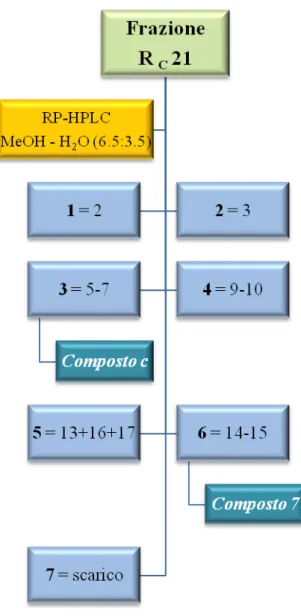
Le 18 frazioni raccolte sono state sottoposte a TLC su lastra di silice usando come eluente una miscela cloroformio–metanolo 98:2 e solfato di cerio come reattivo spray. Le frazioni, in base alle uguaglianze cromatografiche, sono state successivamente riunite in 7 frazioni principali (1-7) (Fig. 3.9).
80
Fig. 3.9 HPLC della frazione RC 21
Le frazioni 213 e 215+6 sottoposte a TLC utilizzando solfato di cerio come reattivo spray, si sono presentate come un’unica macchia di colore brunastro e pertanto sono state studiate ulteriormente; attraverso analisi spettroscopiche si è arrivati all’identificazione del composto 7 come idrangenolo (12.7 mg; tR=11 min), precedentemente isolato anche dall’estratto cloroformio-metanolo (RCM 18), mentre la frazione 213 è il composto c (2.2 mg; tR=7 min) ancora in fase di caratterizzazione.
81
Analisi della frazione R
CLa frazione 24 (273.3 mg) è stata sciolta in circa 4 ml di una miscela MeOH:H
24:
2O 4:1 e centrifugata. Il sovranatante è stato portato a secco, pesato (72.9 mg) e disciolto in 750 μl di una miscela MeOH:H2O 5.5:4.5 e nuovamente centrifugato. Il sovranatante è stato sottoposto a cromatografia su colonna HPLC μ-Bondapak RP-18 eluendo con MeOH:H2O 5.5:4.5, utilizzando le seguenti condizioni: • Attenuazione = 16x • Eluente = MeOH:H2 • Iniettata = 100 μl O (5.5:4.5) • Numero di iniettate = 7
• Velocità di flusso = 2.0 ml/min
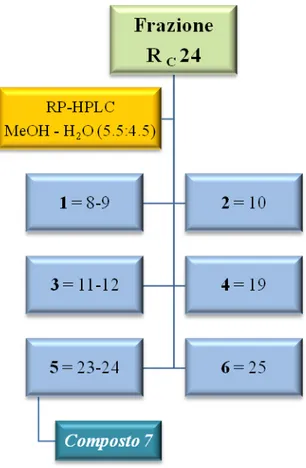
Le 25 frazioni raccolte sono state sottoposte a TLC su lastra di silice usando come eluente una miscela cloroformio–metanolo 98:2 e solfato di cerio come reattivo spray. Le frazioni, in base alle uguaglianze cromatografiche, sono state successivamente riunite in 6 frazioni principali (1-6) (Fig. 3.10).
82
Fig. 3.10 HPLC della frazione RC 24
La frazione 245 sottoposta a TLC, utilizzando solfato di cerio come reattivo spray, si è presentata come un’unica macchia di colore brunastro e pertanto è stata sottoposta ad analisi spettroscopiche che hanno portato all’identificazione del composto 7 come idrangenolo (5.7 mg; tR=20 min), precedentemente isolato anche dall’estratto RCM (RCM 18) e dalla frazione RC 21.
83
Analisi della frazione R
CLa frazione 26 (210.7 mg) è stata sciolta in circa 4 ml di MeOH puro e centrifugata. Il sovranatante è stato portato a secco, pesato (49.6 mg) e disciolto in 500 μl di una miscela MeOH:H
26:
2O 5.5:4.5 e nuovamente centrifugato. Il sovranatante è stato sottoposto a cromatografia su colonna HPLC μ-Bondapak RP-18 eluendo con MeOH:H2
• Attenuazione = 16x
O 5.5:4.5, utilizzando le seguenti condizioni:
• Eluente = MeOH:H2
• Iniettata = 100 μl
O (5.5:4.5)
• Numero di iniettate = 5
• Velocità di flusso = 2.0 ml/min
Le 26 frazioni raccolte sono state sottoposte a TLC su lastra di silice usando come eluente una miscela cloroformio–metanolo 98:2 e solfato di cerio come reattivo spray. Le frazioni, in base alle uguaglianze cromatografiche, sono state successivamente riunite in un’unica frazione (Fig. 3.11).
84
La frazione 265 sottoposta a TLC, utilizzando solfato di cerio come reattivo spray, si è presentata come un’unica macchia di colore brunastro e pertanto è stata studiata ulteriormente; attraverso analisi spettroscopiche si è arrivati
all’identificazione del composto 8 come 8-metossi-idrangenolo o
scorzotomentosin (1 mg; tR
I dati chimico-fisici del composto 8 sono i seguenti: =13 min).
Composto 8: solido amorfo biancastro; ¹H- e ¹³C-NMR vedi tab. 2.5, capitolo 2.
ESI-MS m/z 269 [M−H]−.
Analisi della frazione R
CLa frazione 28 (316.8 mg) è stata sciolta in circa 4 ml di MeOH puro e centrifugata. Il sovranatante è stato portato a secco, pesato (41.6 mg) e disciolto in 500 μl di una miscela MeOH:H
28:
2O 4:1 e nuovamente centrifugato. Il sovranatante è stato sottoposto a cromatografia su colonna HPLC μ-Bondapak RP-18 eluendo con MeOH:H2O 1:1, utilizzando le seguenti condizioni:
• Attenuazione = 16x
• Eluente = MeOH:H2
• Iniettata = 100 μl
O (1:1)
• Numero di iniettate = 5
• Velocità di flusso = 2.0 ml/min
Le 22 frazioni raccolte sono state sottoposte a TLC su lastra di silice usando come eluente una miscela cloroformio–metanolo 95:5 e solfato di cerio come reattivo spray. Le frazioni, in base alle uguaglianze cromatografiche, sono state successivamente riunite in 6 frazioni principali (Fig. 3.12).
85
Fig. 3.12 HPLC della frazione RC 28
La frazione 282 sottoposta a TLC, utilizzando solfato di cerio come reattivo spray, si è presentata come un’unica macchia di colore brunastro e pertanto è stata studiata ulteriormente; attraverso analisi spettroscopiche si è arrivati all’identificazione del composto 9 come 4α-idrossipinoresinolo o 9α-idrossipinoresinolo (3.4 mg; tR=10 min), precedentemente isolato anche dall’estratto RCM (RCM 16).
86
Studio dell’estratto metanolico
L’estratto metanolico (73.71 g) è stato ripartito, per mezzo di un imbuto separatore, in una porzione n-butanolica (4.53 g), e in una acquosa (69.18 g), in modo da eliminare la porzione zuccherina che si trova disciolta in quest’ultima fase.
Il residuo butanolico (4.53 g), ottenuto dopo evaporazione completa del solvente a temperatura ambiente, è stato sciolto in circa 10 ml di metanolo e centrifugato. Il sovranatante è stato caricato su colonna Sephadex LH-20 (i.d. = 3 cm) eluendo con metanolo con un flusso di 0.8 ml/min. Le 126 frazioni raccolte, di circa 15 ml ciascuna, sono state sottoposte a TLC (Thin Layer Chromatography) su gel di silice 60 F254
Alcune frazioni prive di evidenti macchie cromatografiche sono state eliminate. , usando come eluenti BAW (n-butanolo–acido acetico– acqua, 60:15:25) e CMW (cloroformio–metanolo–acqua, 80:18:2), e identificate utilizzando il solfato di cerio come reattivo spray. Le 126 frazioni sono state successivamente riunite in 20 frazioni principali (1-20) in base alle somiglianze cromatografiche (Fig. 3.13).
87
88
Analisi della frazione R
BuOHLa frazione 10 (99.2 mg) è stata sciolta in circa 1 ml di una miscela MeOH:H
10:
2O 2:3 e centrifugata. Il sovranatante è stato sottoposto a cromatografia su colonna HPLC μ-Bondapak RP-18 eluendo con metanolo–acqua (2:3), utilizzando le seguenti condizioni: • Attenuazione = 16x • Eluente = MeOH:H2 • Iniettata = 100 μl O (2:3) • Numero di iniettate = 9
• Velocità di flusso = 2.0 ml/min
Le 39 frazioni raccolte sono state sottoposte a TLC su lastra di silice usando come eluente una miscela BAW (n-butanolo–acido acetico–acqua, 60:15:25) e solfato di cerio come reattivo spray. Le frazioni, in base alle uguaglianze cromatografiche, sono state successivamente riunite in 5 frazioni principali (1- 5) (Fig. 3.14).
89
Fig. 3.14 HPLC della frazione RBuOH 10
Le frazioni 102, 103 e 104 sottoposte a TLC, utilizzando solfato di cerio come reattivo spray, si sono presentate come un’unica macchia di colore brunastro e pertanto sono state studiate ulteriormente; attraverso analisi spettroscopiche si è arrivati all’identificazione del composto 3 (frazione 102) come idrangenolo 4’-O-β-D-apiofuranosil-(1→6)-β-D-glucopiranoside (10.5 mg; tR= 26 min), del
composto 4 (frazione 104) come idrangenolo-4’-O- α-L-ramnopiranosil-(1→3)-β-D-glucopiranoside (17.8 mg; tR= 32 min), entrambi precedentemente isolati anche dall’estratto RCM (RCM 13+14), mentre la frazione 103 contiene il composto d (0.8 mg; tR= 30 min) ancora in fase di caratterizzazione.
90
Analisi della frazione R
BuOHLa frazione 11 (136.6 mg) è stata sciolta in circa 1.4 ml una miscela MeOH:H
11:
2O 4:6 e centrifugata. Il sovranatante è stato sottoposto a cromatografia su colonna HPLC μ-Bondapak RP-18 eluendo con metanolo–acqua (2:3), utilizzando le seguenti condizioni:
• Attenuazione = 16x
• Eluente = MeOH:H2
• Iniettata = 100 μl
O (2:3)
• Numero di iniettate = 13
• Velocità di flusso = 2.0 ml/min
Le 39 frazioni raccolte sono state sottoposte a TLC su lastra di silice usando come eluente una miscela BAW (n-butanolo–acido acetico–acqua, 60:15:25) e solfato di cerio come reattivo spray. Le frazioni, in base alle uguaglianze cromatografiche, sono state successivamente riunite in 23 frazioni principali (1- 23) (Fig. 3.15).
91
92
Le frazioni 1116, 1117+18 e 1121 sottoposte a TLC, utilizzando solfato di cerio come reattivo spray, si sono presentate come un’unica macchia di colore brunastro e pertanto sono state studiate ulteriormente; attraverso analisi spettroscopiche si è arrivati rispettivamente all’identificazione del composto 2 come hydrangenolo-8-O-β-D-glucopiranoside (1.9 mg; tR= 17 min), del composto 3 come idrangenolo 4’-O-β-D-apiofuranosil-(1→6)-β-D
-glucopiranoside (8.7 mg; tR= 26 min), entrambi precedentemente isolati dalla frazione RCM13+14, e del composto 10 come idrangenolo 4’-O-β-D -glucopiranoside (3.5 mg; tR= 30 min).
I dati chimico-fisici del composto 10 sono i seguenti:
Composto 10: solido amorfo bruno; ¹H- e ¹³C-NMR vedi tab. 2.6, capitolo 2;
ESI-MS m/z 441 [M+Na]+, 423 [M+Na−18]+, 279 [M+Na−162]+ , 417 [M−H]−, 255 [M−H−162]− .