1.2 I recettori dell’adenosina
Le funzioni fisiologiche dell’adenosina sono dovute alla sua interazione con specifici recettori, classificati e caratterizzati in base alla loro struttura molecolare e alle loro azioni farmacologiche.
Tutti i recettori per l’adenosina sono recettori accoppiati a proteine G. La prima evidenza farmacologica dell’esistenza di recettori adenosinici si è avuta solo nel 1965, quando Gubareff e Seator provarono che le azioni dell’adenosina nel tessuto miocardico potevano essere contrastate da specifici antagonisti, quali le metil-xantine. [1]
Nel 1978 Burnstock propose l’esistenza di almeno due tipi di recettori per le purine, denominati P1 e P2.[1,2] Questa distinzione era basata sull’ordine di potenza con cui i vari nucleotidi e nucleosidi sono attivi: P1 identifica la famiglia di recettori maggiormente sensibili all’adenosina, mentre i recettori P2 sono preferenzialmente attivati da ATP e ADP.
Un’ulteriore differenziazione tra recettori P1 e P2 è basata sulla diversa sensibilità agli antagonisti di tipo xantinico: [3,4] i recettori P1 sono inibiti competitivamente da sostanze xantiniche quali caffeina, teofillina e teobromina, totalmente inattive sui recettori P2. Ciascuna delle due famiglie comprende diversi sottotipi recettoriali identificabili in base al profilo farmacologico, al meccanismo di trasduzione del segnale e alla struttura molecolare.
In seguito è stata accertata l’esistenza di due sottotipi recettoriali P1 extracellulari in grado di modulate differentemente l’attività dell’adenilato ciclasi. In un primo momento sono stati classificati come Ri e Rs, , dove R indica la necessità di avere la porzione di ribosio intatta e “i”ed “s” indicano che l’attivazione recettoriale porta rispettivamente all’inibizione o alla stimolazione dell’adenilato ciclasi. In seguito tali sottotipi sono stati chiamati da Val Calker A1 e A2.[1]
Attualmente sono stati definiti dal punto di vista farmacologico, strutturale e funzionale, quattro sottotipi del recettore P1: A1, A2A, A2B, A3.[1] Ognuno di questi
sottotipi recettoriali è stato clonato in numerosi mammiferi, incluso l’uomo. I sottotipi A1, A2A,A2B sono stati scoperti e inizialmente classificati col metodo
espressione di ciascuno di questi sottotipi ha fornito conferme strutturali e funzionali della loro classificazione originale come distinti sottotipi recettoriali adenosinici. Al contrario, il sottotipo A3 è stato individuato attraverso studi di
biologia molecolare, ai quali si sono aggiunti successivamente studi farmacologici classici.
1.2.1 Struttura molecolare e meccanismo di trasduzione dei
recettori adenosinici
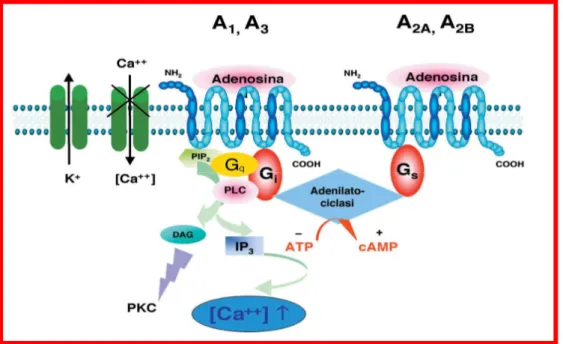
I recettori adenosinici (Fig. 1.2.2.1) appartengono alla superfamiglia dei recettori 7- TMS: si tratta di proteine integrali di membrana caratterizzate da sette segmenti transmembranali, da un sito extracellulare (porzione N-terminale) che riconosce il ligando e da un sito intracellulare (porzione C-terminale) che riconosce una proteina legante il GTP (guanosina trifosfato) o proteina G.[1] Le proteine G comprendono un’ampia famiglia di proteine costituite da tre subunità (α, β, γ) che si differenziano per la tipologia di subunità α (Gs, Gi, Gq, etc), in grado di attivare una particolare via di trasduzione del segnale intracellulare. I sette domini transmembrana, organizzati in strutture ad α-elica, sono costituiti ciascuno da 22-26 amminoacidi idrofobici e sono connessi tra loro da tre loop citoplasmatici e tre extracellulari. Questi ultimi contengono residui cisteinici capaci di formare ponti disolfuro, in grado di modificare notevolmente la conformazione del recettore. L’estremità N-terminale presenta i siti di glicosilazione, importanti nella formazione del legame farmaco-recettore. (Fig.1.2.1).
Generalmente le sequenze aminoacidiche dei recettori accoppiati a proteine G mostrano nel complesso un’elevata omologia (85-95%) per lo stesso sottotipo recettoriale nelle diverse specie, soprattutto nelle regioni trans membrana. Fa eccezione il recettore A3 che mostra un’omolgia nella sequenza primaria tra
uomo, ratto o pecora.
Le proteine G sono proteine con struttura eterotrimerica, costituite da tre sub unità dette α (di 40-45 KDa), ß (di 37 KDa) e γ (di 8-10 KDa). Le subunità α delle proteine G possiedono la capacità di legare i nucleotidi guanilici, in particolare il GTP e successivamente di idrolizzarlo grazie ad un’attività GTPasica intrinseca. In assenza di stimolazione, la subunità α legata al GDP (guanosin trifosfato), si trova associata al dimero ßγ, a formare un trimero inattivo. In seguito al legame dell’agonista al recettore avviene un cambiamento conformazionale della proteina che induce il rilascio del GDP da parte della subunità α, che diventa affine per il GTP, dissociandosi dal dimero ßγ. La subunità attiva α-GTP interagisce con proteine effettrici, determinando l’attivazione o l’inibizione di enzimi intracellulari che svolgono un ruolo importante della produzione del secondo messaggero.
La proteina effettrice è rappresentata dall’Adenilato Ciclasi, enzima di membrana deputato alla trasformazione dell’ATP in AMP-3’-5’ ciclico (cAMP), secondo messaggero che in molti sistemi di trasduzione svolge il ruolo di secondo messaggero. Il cAMP solitamente attiva preteine chinasi le quali a loro volta fosforilano altre proteine, attivando così una cascata di reazioni che portano alla risposta finale della stimolazione recettoriale.
I recettoro adenosinici, in base ai sistemi di trasduzione, si possono così classificare:
- i recettori A1 sono solitamente accoppiati a una proteina Gi, con
conseguente inibizione dell’ enzima adenilato ciclasi e diminuzione dell’AMPc intracellulare; in alcuni casi l’accoppiamento avviene anche con la Gk e la Gq, che modulano diversi effetti a livello dei canali del
potassio, del calcio e della fosfolipasi C. Quest’ultima è una fosfodiesterasi che idrolizza il fosfatidilinositolo 4,5 difosfato, dando origine a inositolo trifosfato (IP3) e diacilglicerolo (DAG).[6] IP3 provoca
liberazione intracellulare di calcio dai depositi causando contrazione della muscolatura liscia e degradazione di glicogeno; DAG attiva la proteina chinasi C aumentandone l’affinità per il calcio e rendendola attiva a livelli fisiologici dello ione; si è vista anche attivazione di diversi canali del K+
(muscolari cardiaci e neuronali) attraverso l’accoppiamento con proteine G appartenenti alla famiglia delle Go che ne aumentano la conduttanza; - i recettori A2A e A2B sono prevalentemente accoppiati a una proteina Gs che
porta ad un aumento della concentrazione intracellulare del cAMP;
- i recettori A3 sono accoppiati alle proteine Gi e Gq che mediano l’inibizione
dell’ adenilato ciclasi e la stimolazione della fosfolipasi C e dei canali del calcio. Il sito di legame per il ligando è costituito da una tasca formata dal riarrangiamento tridimensionale delle sette α-eliche transmembranarie. In particolare, si è scoperto che le porzioni recettoriali maggiormente coinvolte nel legame con il ligando sono i primi quattro segmenti transmembranali, mentre la porzione deputata a mantenere l’accoppiamento con la proteina G è quella N-terminale del terzo loop intracellulare. Il segmento intracellulare del recettore è deputato all’interazione con una proteina G diversa a seconda del sottotipo recettoriale.
1.2.2 Localizzazione dei recettori adenosinici
Recettori adenosinici A
1I recettori adenosinici A1 sono stati purificati, clonati e sequenziati in differenti
specie animali (uomo compreso) e l’omologia tra le diverse specie è dell’87-92%, nonostante siano state evidenziate leggere differenze nell’accoppiamento con le proteine G e una distribuzione tissutale specie-dipendente. Questo sottotipo recettoriale è ubiquitariamente distribuito ed è espresso in particolar modo all’interno del SNC sia pre- che post- sinapticamente. Alti livelli sono espressi nella corteccia cerebrale, nell’ippocampo, nel cervelletto, nel talamo, nel sistema limbico, nei gangli della base, nella colonna vertebrale, ma anche negli astrociti, nella microglia, e negli oligodendrociti, sebbene con densità minore. A livello perifericosi trova nel tessuto adiposo; livelli intermedi si evidenziano nel muscolo scheletrico,nel fegato, nei reni, nelle ghiandole salivari, nell’esofago, nel colon, negli occhi, nei nodi senoatriale e atrioventricolare del cuore,
nell’antro e nei testicoli; livelli ancora più bassi neipolmoni, nei ventricoli e nel pancreas. Le principali funzioni fisiologiche mediate dal recettore A1 sono
riportate nella tabella 1.2.1. [1,27]
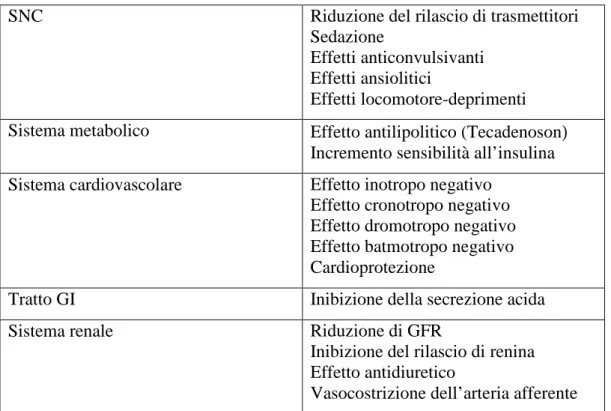
Tabella 1.2.1. Funzioni mediate dal recettore A1.
SNC Riduzione del rilascio di trasmettitori
Sedazione
Effetti anticonvulsivanti Effetti ansiolitici
Effetti locomotore-deprimenti Sistema metabolico Effetto antilipolitico (Tecadenoson)
Incremento sensibilità all’insulina Sistema cardiovascolare Effetto inotropo negativo
Effetto cronotropo negativo Effetto dromotropo negativo Effetto batmotropo negativo Cardioprotezione
Tratto GI Inibizione della secrezione acida
Sistema renale Riduzione di GFR
Inibizione del rilascio di renina Effetto antidiuretico
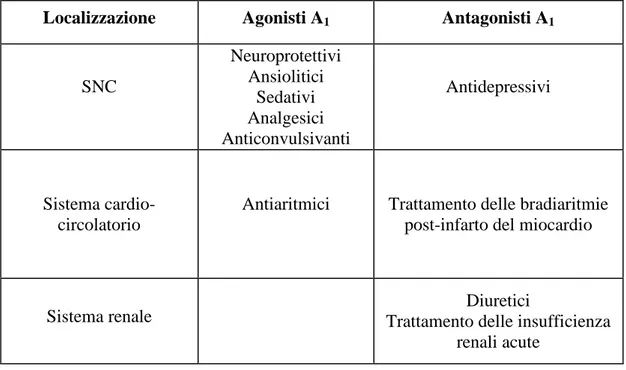
Le potenziali applicazioni terapeutiche dei vari ligandi (agonisti e antagonisti) del recettore A1 sono riportate nella tabella 1.2.2.
Localizzazione Agonisti A1 Antagonisti A1
SNC Neuroprotettivi Ansiolitici Sedativi Analgesici Anticonvulsivanti Antidepressivi Sistema cardio-circolatorio
Antiaritmici Trattamento delle bradiaritmie post-infarto del miocardio
Sistema renale Trattamento delle insufficienza Diuretici renali acute
Tabella 1.2.2. Principali applicazioni terapeutiche dei ligandi A1.
Recettori adenosinici A
2AIl gene codificante per il recettore umano A2A è localizzato nel cromosoma 22, ed
evidenzia un’omologia dell’82,9% con i recettori A2A del ratto. I recettori A2A
sono presenti, a livello centrale, nelle aree ricche di dopamina quali striato , nucleo caudato, il putamen (gangli della base), nucleo accumbens, tubercolo olfattivo e nelle cellule di Purkinjie del cervelletto; a livello periferico sono abbondanti nelle cellule endoteliali della muscolatura liscia vascolare, in piastrine, linfociti, monociti, macrofagi, neutrofili, basofili, eosinofili, mastociti, polmoni, cuore, vescica e tessuti immunitari.Nei neuroni spinali intermedi dello striato i recettori A2A sono in stretta associazione con i recettori dopaminergici D2.
Studi biochimici, anatomichi e comportamentali evidenziano che i recettori A2A
interagiscono, sia con modalità diretta che indiretta, con diversi sistemi neurotrasmettitoriali, quali dopaminergici, GABAergici, colinergici e glutammatergici, sia nei gangli basali che in altre strutture cerebrali. I recettori A2A modulano la neurotrasmissione eccitatoria in diverse regioni del cervello:
l’affinità della dopamina per i recettori D2.[1,27] Le principali funzioni fisiologiche
mediate dal recettore A2A sono riportate in tabella 1.2.3.
SNC Regolazione sensoriale nei gangli basali
Stimolazione attività nervo sensoriale Sinergismo di inibizione D2
Sistema immunitario Inibizione attività leucociti e polimorfonucleati
Inibizione rilascio citochine
pro-infiammatorie (TNFα, IL-6, IL-8 e IL-12) Aumento rilascio citochine anti-infiammatorie (IL-10)
Sistema cardiovascolare Inibizione aggregazione piastrinica Vasodilatazione
Peggioramento danno da ischemia
Tabella 1.2.3. Funzioni mediate dal recettore A2A.
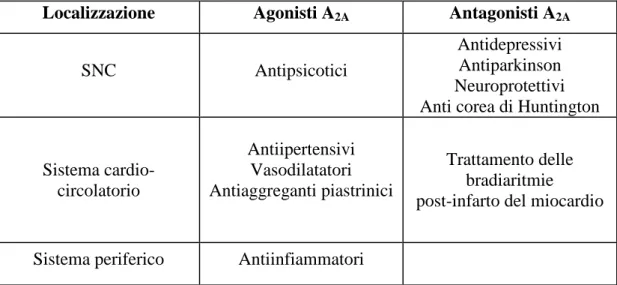
Le principali applicazioni terapeutiche dei lagandi (agonisti e antagonisti) A2A
sono riportati nella tabella 1.2.4.
Localizzazione Agonisti A2A Antagonisti A2A
SNC Antipsicotici
Antidepressivi Antiparkinson Neuroprotettivi Anti corea di Huntington
Sistema cardio-circolatorio Antiipertensivi Vasodilatatori Antiaggreganti piastrinici Trattamento delle bradiaritmie post-infarto del miocardio
Sistema periferico Antiinfiammatori
Recettori adenosinici A
2BInizialmente si pensava che l’espressione del recettore A2B fosse ristretta a organi
quali vescica, intestino, polmone, epididimo, vasi deferenti, colonna vertebrale e cervello, ma successivamente sono stati localizzati anche in fibroblasti,vari letti vascolari, cellule ematopoietiche, mastociti, cellule del miocardio, cellule muscolaried endotelio. A causa della mancanza di potenti radioligandi con specifica selettività, la determinazione quantitativa della distribuzione tissutale dei recettori adenosinici A2B non è possibile; perciò le informazioni presenti in
letteratura sono basate su dati riferiti ai livelli di mRNA (usando Northern blot analysis si determina direttamente l’mRNA) che si assumono come corrispondenti all’espressione della proteina. Molti articoli attribuiscono ai recettori A2B effetti cardiovascolari in quanto una loro attivazione può
controllare: proliferazione fibroblastica, ripristino cardiaco, patologie quali ipertensione o infarto miocardico. Le principali funzioni fisiologiche mediate dal recettore A2B sono riportate in tabella 1.2.5.[1]
SNC Inibizione trasmissione nervosa
Aumento sintesi IL-6 negli astrociti Sistema cardiovascolare Aumento secrezione cloruri nel lume
intestinale Sistema gastro-intestinale Vasodilatazione
Controllo proliferazione fibroblastica e ripristino cardiaco
Mastociti Ruolo in processi infiammatori tra cui l’asma
Tabella 1.2.5. Ruolo mediato dal recettore A2B.
Recettori A3
Questo sottotipo recettoriale è presente con elevata densità in polmoni, fegato e cellule del sistema immunitario quali neutrofili, eosinofili e linfociti T; livelli più bassi si ritrovano in cervello,cuore, testicoli e molti altri tessuti, ma soprattutto in maggior quantità nella microglia e negli astrociti.
Le principali funzioni fisiologiche mediate dal recettore A3 sono riportate nella
tabella 1.2.6. [1]
SNC Neuroprotezione
Attività sedativo-ipnotiche, anticonvulsivanti ed anti-ansia Inibizione dell’esocitosi presinaptica Sistema cardiovascolare Effetto anticoagulante
Ipotensione
Sistema immunitario Protezione cellulare (basse dosi) Effetto pro-apoptotico (alte dosi)
Tabella 1.2.6. Azioni mediate dal recettore A3.
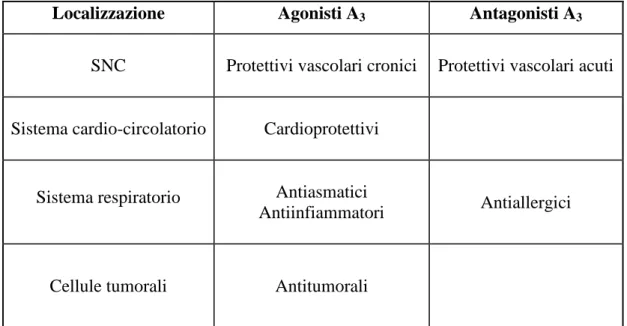
Le principali applicazioni terapeutiche dei ligandi (agonisti e antagonisti) del recettore A3 sono riportate nella tabella 1.2.7.
Localizzazione Agonisti A3 Antagonisti A3
SNC Protettivi vascolari cronici Protettivi vascolari acuti
Sistema cardio-circolatorio Cardioprotettivi
Sistema respiratorio Antiasmatici
Antiinfiammatori Antiallergici
Cellule tumorali Antitumorali
La localizzazione dei diversi sottotipi recettoriali e i loro meccanismi di traduzione sono riassunti in tabella 1.2.8. [1]
Tabella 1.2.8. Localizzazione e meccanismo di trasduzione
RECETTORE A1 RECETTORE
A2A
RECETTORE A2B
RECETTORE A3 DISTRIBUZIONE SNC: corteccia, ippocampo,
cervelletto, talamo Tessuti periferici: cuore, rene, tessuto adiposo bianco, stomaco,fegato,milza,vescica vaso deferente, neutrofili, polmoni, macrofagi. SNC: nucleo accumbens, striato, tubercolo olfattorio Tessuti periferici: cellule endoteliali della muscol. liscia vascolare, piastrine, linfociti, neutrofili, eosinofili, monociti, macrofagi, mastociti, basofili, cuore, polmoni, fegato. Rivelato in bassa quantità in ogni cellula studiata; presente in maggiore abbondanza nel tratto gastrointestinale e vescica Specie dipendente: Ratto: testicolo>>polmone, rene, cuore>cervello Uomo: polmoni, fegato, placenta>>cervello, aorta, reni> cuore Capra:polmoni, milza>cervello, testicoli Meccanismo Di Trasduzione Accoppiati a Proteine G: Gi, Go
Adenilato ciclasi: ↓cAMP Fosfolipasi C: ↑ Ca++ Canali Ionici: ↑ K+ ↓ Ca++ Accoppiati a Proteine G: Gs Adenilato ciclasi: ↑ cAMP Accoppiati a Proteine G: Gs, Gq Adenilato ciclasi: ↑ cAMP Fosfolipasi C: ↑ Ca++ Accoppiati a Proteine G: Gi, Gq Adenilato ciclasi: ↓ cAMP Fosfolipasi C: ↑ Ca++ ↑ IP3