1
INDICE
Riassunto
3
1. Introduzione
5
1.1 Idrope immune 6 1.1.1 Premesse 6 1.1.2 Patogenesi e Fisiopatologia 7 1.1.3 Clinica 8 1.1.4 Screening e Diagnosi 9 1.1.5 Trattamento 12 1.1.6 Prognosi 13 1.1.7 Immunoprofilassi 141.2 Idrope non immune 16
1.2.1 Premesse 16 1.2.2 Fisiopatologia 16 1.2.3 Etiologia 17 1.2.4 Diagnosi 25 1.2.5 Terapia 28 1.2.6 Prognosi 33 1.3 Mirror Syndrome 35
2. Materiali e metodi
37
3. Risultati
41
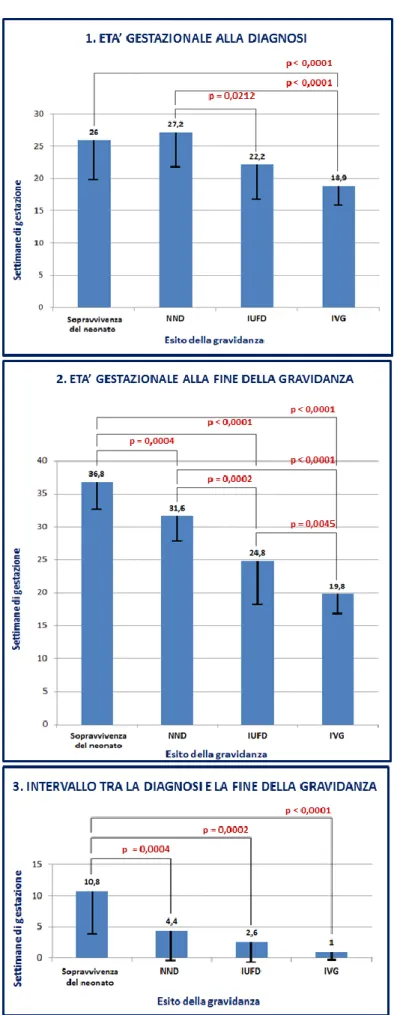
3.1 Evoluzione nel tempo 41
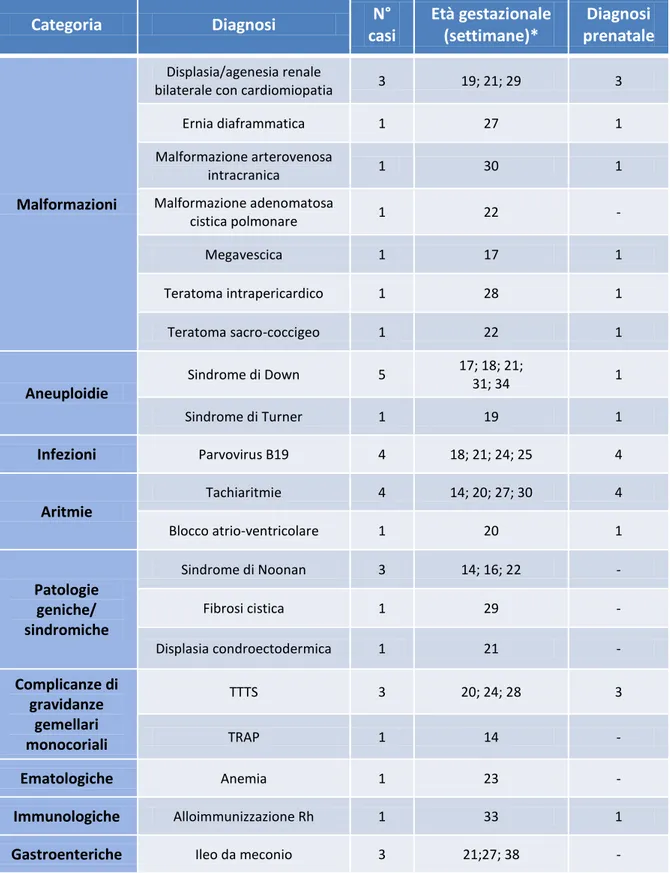
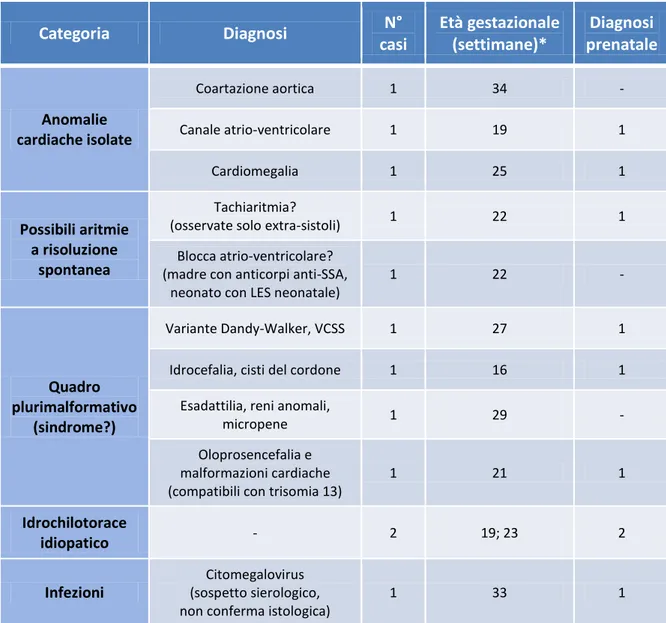
3.2 Etiologia della patologia fetale 43
3.3 Reperto ecografico di igroma cistico 45
3.4 Esito della gravidanza 45
3.4.1 Storia naturale (esclusi i casi di IVG) 45 3.4.2 Esito delle gravidanze diagnosticate ad un’età gestazionale in cui l’IVG poteva essere richiesta dalle pazienti 46
2
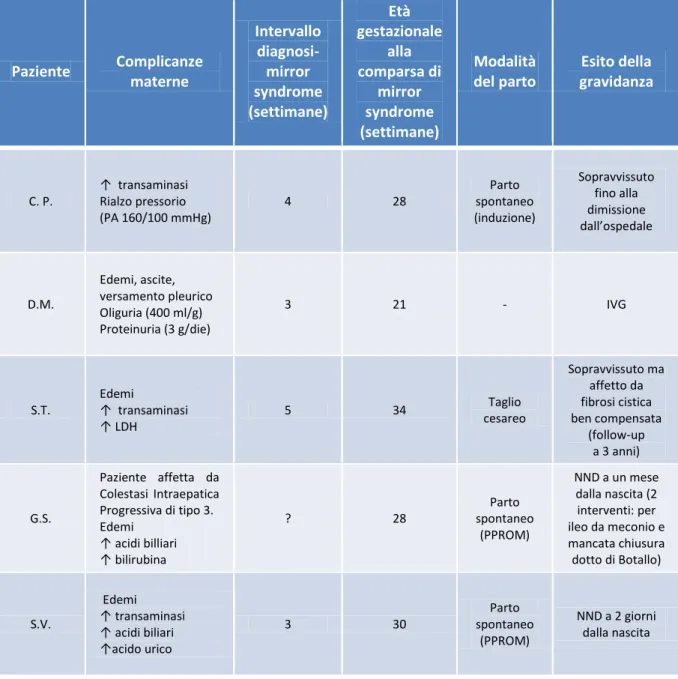
3.6 Complicanze materne 49
4. Discussione
51
4.1 Prognosi 51
4.2 Etiologia e storia naturale 52
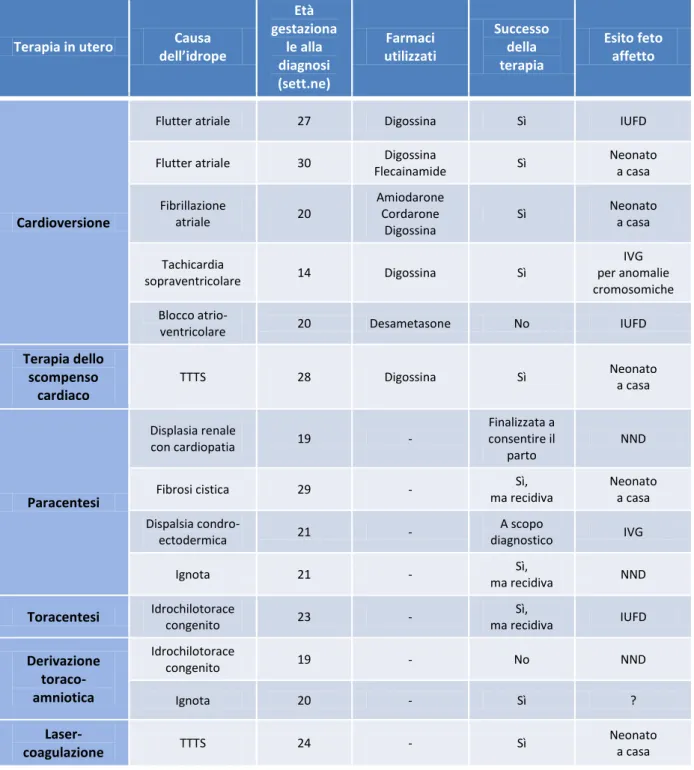
4.3 Richiesta di IVG 57 4.4 Interventi in utero 58 4.5 Complicanze materne 60
Bibliografia
61
Tabelle
67
Figure
73
Ringraziamenti
84
3
Riassunto
I versamenti nelle cavità sierose e l’edema dei tessuti molli del feto che, quando associati, si definiscono idrope, possono riconoscere cause diverse, con prevalenza variabile a seconda della popolazione e del periodo storico considerato.
Scopo del presente lavoro è stato identificare le cause e l’evoluzione dei versamenti nelle cavità sierose diagnosticati in utero in un unico Centro di ecografia ostetrica di II livello.
Si tratta di uno studio retrospettivo che include tutti i feti esaminati durante gli ultimi 30 anni, per un totale di 78 casi.
Soltanto un feto presentava idrope da alloimmunizzazione anti-D. Le cause più frequenti erano le malformazioni (n=9), le anomalie cromosomiche (n=6), le aritmie (n=5), le forme sindromiche (n=5), le complicanze di gravidanze gemellari monocoriali (n=4), e le infezioni da Parvovirus B19 (n=4). In 12 casi era stata identificata una causa probabile, ma non certa. Fra i casi che avevano completato l’intero iter diagnostico, soltanto 7 (9%) non avevano raggiunto una diagnosi etiologica.
L’esito della gravidanza era la morte perinatale nel 37,9% dei casi, la sopravvivenza del neonato almeno fino alla dimissione dall’ospedale nel 30,3% e l’interruzione volontaria di gravidanza nel 31,8% dei casi con follow-up completo.
In 20 su 21 casi di interruzione volontaria di gravidanza, la prognosi fetale era estremamente severa, per la gravità delle malformazioni fetali associate o per l’entità dell’idrope, associato in un caso a una grave mirror syndrome.
Fra i 20 neonati sopravvissuti, 18 non avevano reliquati; fra questi, uno è stato operato dopo la nascita, mentre in 4 casi sono stati necessari trattamenti in utero. Un neonato è sopravvissuto affetto da fibrosi cistica e uno da sindrome di Down.
Il rischio di morte perinatale era legato, oltre che alla presenza di malformazioni sicuramente letali (agenesia/displasia renale bilaterale), anche alla presenza di igroma cistico, di versamenti multipli o alla bassa età gestazionale alla diagnosi.
La mirror syndrome, così denominata perché rispecchia nella madre molte delle caratteristiche dell’idrope fetale, è una complicanza materna grave e potenzialmente letale, che si è presentata in questa casistica nel 10% delle gravidanze non interrotte per altri motivi.
4
In conclusione, nonostante che i versamenti nelle cavità sierose del feto, con o senza idrope, abbiano spesso una prognosi infausta e possano costituire un rischio anche per la salute materna, è possibile in quasi un terzo dei casi che si risolvano senza reliquati. E’ quindi fondamentale cercare di identificarne le cause e valutare la possibilità o la necessità della loro correzione in utero.
5
1. Introduzione
Per idrope fetale si intende un eccessivo accumulo di liquido nel compartimento extra-vascolare e nelle cavità sierose, con sviluppo di ascite, idrotorace e versamento pericardico. Negli stati più avanzati può arrivare fino allo stato anasarcatico, definito come un aumento generalizzato dello spessore cutaneo al di sopra di 5 mm.
Per parlare di idrope è necessario che l’edema sottocutaneo sia associato al versamento in almeno una della cavità sierose.
Non costituisce una vera e propria identità nosologica, ma piuttosto una descrizione morfologica che implica la presenza di un problema sottostante e, indipendentemente dalla causa, riflette sempre un grave disturbo del bilancio idrico dell’organismo.
Da un punto di vista etiologico si distinguono tradizionalmente due forme: la forma immunologica e quella non immunologica. Grazie soprattutto all’introduzione nella pratica clinica dell'immunoprofilassi anti-D, le forme immunologiche si sono sensibilmente ridotte, e i casi che giungono all’osservazione medica sono soprattutto forme non immunologiche.
6
1.1 Idrope immune
1.1.1 PremesseIl meccanismo patogenetico dell’idrope immune è l’emolisi da alloimmunizzazione Rh, determinata da anticorpi IgG anti-Rh prodotti dalla madre Rh-negativa in risposta a uno stimolo antigenico Rh, che si realizza per emorragie feto-materne durante la gravidanza o durante il parto. Altri casi di alloimmunizzazione sono dovuti all’incontro con i cosiddetti antigeni irregolari (Kell, Kidd, Duffy), che avviene perlopiù in caso di trasfusione di sangue incompatibile, soprattutto quando il sangue viene testato solo per gli antigeni Rh e AB0 (Di Tommaso, 2002).
Il sistema Rh comprende gli antigeni c, C, D, e ed E. Sono chiamati Rh-positivi gli individui che possiedono l’antigene D, mentre chi non lo possiede è Rh-negativo. L’alloimmunizzazione verso l’antigene D, dato il suo maggiore potere antigenico rispetto agli altri antigeni, rappresenta la causa principale di malattia emolitica del feto e del neonato. La pratica ormai diffusa dell’immunoprofilassi anti-D ha portato a una grande riduzione nella frequenza di alloimmunizzazione materna verso l’antigene D, con ridotta incidenza della malattia emolitica. La sensibilizzazione verso gli antigeni non-D continua a verificarsi per l’assenza di una profilassi specifica nella pratica clinica, e l’incidenza di malattia emolitica correlata a tali antigeni è ancora stabile o in aumento; nei paesi occidentali, dove l’immunoprofilassi anti-D viene effettuata sistematicamente, risulta maggiore l’alloimmunizzazione verso gli antigeni non-D rispetto a quella verso l’antigene D (Egbor e coll., 2012).
L’incidenza di incompatibilità Rh varia secondo l'etnia: circa il 15% dei caucasici sono Rh-negativi, mentre sono Rh-negativi solo il 5-8% degli afro-americani e l’1-2% dei nativi americani e degli asiatici. Perciò una donna di razza caucasica Rh-negativa, se anche il partner è caucasico, ha l’85% di probabilità che quest’ultimo sia Rh-positivo, di cui il 60% è eterozigote e il 40% è omozigote (ACOG Practice Bullettin, 2006).
Nel caso di alloimmunizzazione Rh di solito la sensibilizzazione della donna avviene in occasione di una prima gravidanza incompatibile (madre negativa, feto Rh-positivo) al momento del parto o più raramente nel corso della gravidanza stessa, ma il bambino nasce sano perché gli anticorpi non vengono prodotti in tempo e in quantità sufficiente a provocare un’emolisi massiva. La malattia emolitica si manifesta invece
7
nelle successive gravidanze Rh-incompatibili, quando a età gestazionali variabili vengono prodotte grandi quantità di anticorpi IgG anti-Rh che attraversano la placenta e aumentano rapidamente, anche se la quantità di eritrociti che ha fornito lo stimolo è molto piccola (Pescetto e coll., 2009).
La sensibilizzazione verso gli antigeni eritrocitari può essere influenzata da diversi fattori. Il rischio di alloimmunizzazione è maggiore in caso di frequenti emorragie feto-materne e grandi quantità di eritrociti che passano dal circolo fetale a quello materno. Anche il gruppo AB0 influenza l’alloimmunizzazione: in caso di compatibilità materno-fetale del sistema AB0 il rischio è del 16% (in assenza di immunoprofilassi anti-D), mentre se c’è incompatibilità si riduce a 1,5-2%; infatti, la presenza di anticorpi anti-A e anti-B materni determina la distruzione delle emazie fetali AB0-incompatibili prima che possano esercitare un efficace stimolo antigenico mediante il loro antigene del sistema Rh. Sono stati descritti anche casi di alloimmunizzazione Rh senza nessuna esposizione materna a globuli rossi Rh-positivi, forse riconducibili a precedenti perdite fetali non riconosciute clinicamente (Egbor e coll., 2012). Il rischio di sensibilizzazione materna è invece maggiore in caso di traumi addominali (incidenti stradali, manovre di Kristeller e di Credé, ecc...), placenta previa, distacco intempestivo di placenta, gestosi, ipertensione, vasculopatia diabetica placentare, gravidanza multipla, secondamento manuale, taglio cesareo. Nelle sopracitate condizioni, infatti, c’è sia una maggiore frequenza di emorragie feto-materne, sia una maggiore quantità di sangue che passa dal feto alla madre (Pescetto e coll., 2009).
1.1.2 Patogenesi e Fisiopatologia
Nelle ultime settimane di gravidanza, durante il parto e soprattutto durante il secondamento avviene il passaggio nel circolo materno di una quantità in genere molto piccola di sangue fetale, reso possibile da soluzioni di continuo nei vasi fetali e nel tessuto coriale, con invasione dello spazio intervilloso da parte del sangue fetale e sua mescolanza con quello materno (Pescetto e coll., 2009). Solo l’1-2% dei casi di alloimmunizzazione Rh sono dovuti a emorragie feto-placentari durante la gravidanza, che hanno una prevalenza del 7% nel primo trimestre, del 16% nel secondo e del 29% nel terzo (ACOG Practice Bulletin, 2006).
E’ stato riportato in letteratura che anche un volume molto piccolo di sangue fetale, pari a 0,1 ml, può causare alloimmunizzazione se ha accesso al circolo materno (Egbor e
8
coll., 2012); in caso di feto Rh-positivo e madre Rh-negativa si avrà una risposta immunologica primaria, con comparsa di anticorpi anti-D nel circolo materno dopo lo stimolo antigenico (Pescetto e coll., 2009). In realtà il volume di sangue necessario a causare alloimmunizzazione varia da paziente a paziente, probabilmente in relazione alla capacità immunogenica degli eritrociti fetali Rh-positivi e alla risposta immune delle madre (ACOG Practice Bulletin, 2006).
Quando la madre Rh-negativa già immunizzata è sottoposta a un nuovo stimolo antigenico in occasione di una gravidanza con feto Rh-positivo, ha una risposta anticorpale più rapida e intensa di quella primaria, con grande produzione di IgG anti-D che attraversano con facilità la placenta e interagiscono con i globuli rossi fetali portatori dell’antigene. Ne deriva un’emolisi importante e un’aumentata liberazione in circolo dei prodotti del catabolismo dell’emoglobina, soprattutto bilirubina, che viene facilmente eliminata attraverso la placenta e non si accumula nell’organismo fetale. Prima della nascita il danno al feto è dovuto soprattutto all’anemia e alle sue conseguenze, tra cui: anossia cronica con rischio di insufficienza cardiaca; stimolazione dell’emopoiesi midollare e extramidollare; danno epatico da anossia e focolai emopoietici a livello del fegato con conseguente disprotidemia; comparsa di edemi diffusi e versamenti nelle cavità sierose dovuti all’insufficienza cardiaca e alla disprotidemia. Dopo il parto al pericolo dell’anemia si aggiunge quello, forse maggiore, dell’iperbilirubinemia, considerando che il fegato del neonato presenta una notevole immaturità enzimatica e quindi un'insufficiente funzione di glicuronoconiugazione della bilirubina (Pescetto e coll., 2009).
1.1.3 Clinica
Nel feto il quadro clinico con cui si presenta la malattia emolitica è l’idrope feto-placentare, caratterizzato da edema sottocutaneo diffuso, spesso associato a versamenti nelle cavità pleurica e peritoneale; sono presenti anche epatomegalia, splenomegalia, iperplasia midollare, focolai di eritropoiesi extramidollare (epatica, splenica e renale), eritroblastosi, trombocitopenia; la placenta è voluminosa e appare pallida e imbibita di liquido.
L’idrope compare quando l’emoglobina fetale è almeno 7 g/dl inferiore rispetto al valore di riferimento per l’età gestazionale (Egbor e coll., 2012). La gravità delle lesioni dipende dal grado di anemia fetale.
9
Nel neonato, che non ha ancora sviluppato un sistema enzimatico adeguato, si aggiunge il problema dell’accumulo di bilirubina non coniugata nell’organismo. Ne deriva un quadro di ittero neonatale, che dopo un periodo più o meno prolungato di iperbilirubinemia intensa può evolvere in ittero nucleare, con deposito di bilirubina nei nuclei della base; ne consegue un quadro di encefalopatia bilirubinica con gravi sequele neurologiche e mentali nei neonati che riescono a sopravvivere.
Una forma clinica più rara è l’anemia congenita del neonato, dove la patogenesi è riconducibile a un’inibizione o a un esaurimento dei tessuti eritropoietici. Alla nascita l’anemia è modesta o assente e il neonato non è itterico; dalla seconda settimana di vita si ha un progressivo calo della concentrazione di emoglobina che può condurre a una forte anemizzazione se non si interviene con opportune misure terapeutiche. La mortalità è bassa e il decesso in genere avviene per complicanze intercorrenti (Pescetto e coll., 2009).
1.1.4 Screening e Diagnosi
Lo screening si basa sulla determinazione del gruppo sanguigno e sulla ricerca di anticorpi anti-D nel siero materno già alla prima visita, la cui presenza indica che è avvenuta l’immunizzazione; se sono assenti si ripetono controlli ogni 4-6 settimane, se presenti, i controlli saranno più frequenti (Pescetto e coll. 2009), con una periodicità diversa a seconda del titolo anticorpale. In caso di positività, la ricerca degli anticorpi va ripetuta nel tempo perché le variazioni del titolo anticorpale danno una misura indiretta del rischio fetale (Whittle, 1996). L’esame migliore per la ricerca di anticorpi nel sangue materno è il test di Coombs indiretto, che permette anche la titolazione anticorpale. In Europa il titolo anticorpale è definito critico in base agli standard internazionali (Egbor e coll., 2012). Valori compresi tra 1:8 e 1:32 sono considerati critici, ossia associati a un rischio significativo di eritroblastosi e idrope fetale; è importante riferirsi sempre allo stesso laboratorio, poiché si devono seguire le variazioni del titolo anticorpale nel tempo (ACOG Practice Bulletin, 2006). Non vi è corrispondenza esatta tra entità del danno fetale e titolo degli anticorpi materni, e attualmente la titolazione serve soprattutto per decidere quando ricorrere a ulteriori indagini (Pescetto e coll., 2009). Nelle gravidanze successive, il miglior indicatore della gravità della malattia è il titolo anticorpale al quale il feto precedente aveva sviluppato
10
la malattia emolitica; nella gravidanza seguente c’è generalmente un rischio maggiore e un’età gestazionale più precoce di comparsa della malattia (Egbor e coll., 2012).
In caso di alloimmunizzazione Rh è importante la determinazione degli antigeni eritrocitari paterni. Se il padre è negativo non c’è alcun pericolo, mentre se è Rh-positivo occorre sapere se è omozigote o eterozigote. Se il padre è omozigote tutti i figli saranno Rh-positivi, mentre se è eterozigote saranno Rh-positivi nel 50% dei casi. Il genotipo del padre può essere determinato mediante indagini genetiche (ACOG Practice Bulletin, 2006).
La determinazione del tipo di Rh fetale è opportuna quando il genotipo del padre è eterozigote o sconosciuto (ACOG Practice Bulletin, 2006). Una possibile metodica è l’analisi del DNA fetale mediante PCR (Lipitz e coll., 1998); il DNA fetale può essere ottenuto da cellule trofoblastiche prelevate tramite villocentesi o ritrovate nel fluido del canale cervicale, amniociti prelevati tramite amniocentesi, eritroblasti nucleati fetali recuperati nel sangue materno (Pescetto e coll., 2009). Tra queste metodiche la migliore in base al rapporto rischio/beneficio sembra essere l’analisi mediante PCR del DNA degli amniociti, con una sensibilità del 98,7% e una specificità del 100%; il prelievo di cellule tramite villocentesi è infatti a maggior rischio di emorragia feto-placentare (ACOG Practice Bulletin, 2006). Una tecnica emergente è l’analisi del DNA fetale libero presente nel sangue materno; molti studi hanno recentemente dimostrato la sua accuratezza diagnostica nel determinare il gruppo sanguigno del feto (RCOG Guideline, 2011). Il problema è che solo pochi laboratori sono in grado di offrire questo servizio. Se il feto è Rh-negativo, non vi è alcun pericolo e non sono necessari provvedimenti particolari; se invece il feto è Rh-positivo, occorre un attento monitoraggio ecografico per valutare accrescimento ed eventuale comparsa di idrope, e Doppler-velocimetrico per valutare l’eventuale anemia fetale.
Con la Doppler-velocimetria è possibile la misurazione del picco di velocità sistolica dell’arteria cerebrale media (MCA-PSV) del feto. In caso di anemia fetale avremo un aumento della gittata cardiaca e una riduzione della viscosità del sangue con aumento della sua velocità; inoltre la risposta cerebrale all’anemia, che rappresenta un insulto ipossico, sarà un aumento compensatorio del flusso ematico. Per queste ragioni MCA-PSV sarà aumentato. Si utilizza l’arteria cerebrale media come vaso preferenziale per valutare l’anemia perché risponde rapidamente all’ipossiemia, data la grande
11
dipendenza dall’ossigeno dei tessuti cerebrali fetali, e perché è semplice da testare, dato il suo decorso parallelo al fascio degli ultrasuoni sul piano utilizzato per la misurazione del DBP (diametro biparietale); è preferibile fare la misurazione subito dopo l’origine del vaso dalla carotide interna (Mari e coll, 2005). La misurazione va ripetuta più volte, e il valore massimo ottenuto deve essere confrontato con la mediana riferita all’età gestazionale del feto.
Un valore pari o superiore a 1,5 multipli della mediana (MoMs) è suggestivo di anemia moderata o severa, con una sensibilità del 100% e una specificità dell’88%. L’unica limitazione è l’alto tasso di falsi positivi dopo la trentaquattresima settimana di età gestazionale (ACOG Practice Bulletin, 2006). L’esame Doppler-velocimetrico è utile dalla diciottesima settimana di gestazione e deve essere ripetuto ogni 1-2 settimane a seconda del caso specifico (Egbor e coll., 2012).
Prima dell'introduzione nella pratica clinica della metodica sopra descritta, veniva utilizzata l’analisi spettrofotometrica del liquido amniotico. Consiste nella valutazione della concentrazione di bilirubina, che si correla col grado di emolisi, misurando la variazione di densità ottica a una lunghezza d’onda di 450 nm; ha però accuratezza e sensibilità minori nel predire l’anemia fetale e la necessità di trasfusioni. Considerando anche l’invasività dell’amniocentesi e i rischi associati, si preferisce quindi l’uso della Doppler-flussimetria nel monitoraggio di gravidanze con alloimmunizzazione Rh (Oepkes e coll., 2006).
La cordocentesi ecoguidata è un’indagine diretta sul sangue fetale ed è l’unica che può confermare l’anemia; offre inoltre la possibilità di trasfusione intrauterina nei feti con ematocrito inferiore al 30%. La procedura è associata a severe complicanze quali emorragia feto-materna, perdita fetale (1-2%), distacco di placenta, distress fetale e amnionite (Egbor e coll., 2012); per questo è riservata solo a pazienti con un esame Doppler suggestivo di anemia (Harkness e Spinnato, 2004), ed è considerata troppo invasiva per essere utilizzata come screening (Oepkes e coll., 2006).
Per definire un feto anemico in base al valore di MCA-PSV si utilizza un cut-off di 1.5 MoMs. Se il valore è leggermente sotto il cut-off, è opportuno ripetere la misurazione 2-3 giorni dopo, e se il valore continua a crescere si può ricorrere a indagini invasive, mentre se rimane lo stesso o diminuisce si preferisce un atteggiamento attendistico e si
12
ripete l’esame a distanza di una settimana. Questo approccio sembra ridurre il tasso dei falsi positivi anche dopo la trentacinquesima settimana di gestazione (Mari, 2009). 1.1.5 Trattamento
La trasfusione endouterina è un sussidio da usare in casi gravi selezionati, allo scopo di far raggiungere al feto un’età gestazionale sufficiente per l’induzione del parto pretermine. Inizialmente le trasfusioni erano un presidio terapeutico da attuare solo in epoca neonatale, oggi si può ricorrere invece al trattamento in utero.
Consiste nell’infusione di globuli rossi Rh-negativi nel circolo sanguigno del feto in modo che non possano essere distrutti dagli anticorpi anti-D di origine materna, migliorando così lo stato di anemia fetale. L’infusione può essere fatta tramite funicolocentesi, ossia puntura dei vasi del funicolo (preferibilmente la vena), o procedura endoperitoneale, ossia immissione in cavità addominale dei globuli rossi, che sono riassorbiti dal sistema linfatico e poi riversati nel circolo ematico; entrambe le tecniche sono eseguite sotto guida ecografica. La modalità di trasfusione più utilizzata è l’infusione endovascolare (Grab e coll., 1999), mentre le indicazioni alla trasfusione endoperitoneale sono limitate ai pochissimi casi in cui l’accesso ai vasi ombelicali è difficoltoso ed è presente ascite.
Esistono diverse formule per calcolare la quantità di sangue da trasfondere; di solito si considerano il volume di sangue fetale, l’ematocrito (Hct) fetale di partenza, l’ematocrito desiderato e l’ematocrito delle cellule trasfuse. Una possibile formula è: Volume trasfuso = [Volume di sangue fetale x (Hct desiderato – Hct iniziale)] / [Hct del sangue trasfuso – Hct desiderato]. Il volume di sangue fetale è stimato in base all’età gestazionale e alla stima del peso fetale, mentre l’ematocrito desiderato dipende dell’età gestazionale (Harkness e Spinnato, 2004).
Si decide di iniziare le trasfusioni in base al grado di anemia fetale valutato con la Doppler-flussimetria dell’arteria cerebrale media e in base all’ematocrito del sangue fetale: valori di MCA-PSV pari a 1,29-1,50 MoMs rispetto all’età gestazionale possono richiedere una valutazione diretta del sangue fetale (Imbar e coll., 2006).
Di solito la terapia trasfusionale non viene iniziata prima dalla diciannovesima settimana di età gestazionale; con ripetute trasfusioni si riesce ad arrivare a età gestazionali avanzate anche in caso di grave alloimmunizzazione, ma considerando l’alta invasività della procedura (rischio di morte fetale del 3-9%) e il grande progresso
13
della neonatologia negli ultimi anni, sembra preferibile limitarsi ad un’età gestazionale minore da stabilire caso per caso, anche con l’aiuto del neonatologo (Pescetto e coll., 2009).
E’ possibile che si ritenga opportuna l’induzione di parto pretermine. Nei casi di lieve emolisi di solito si induce il parto a 37-38 settimane di età gestazionale, mentre nei casi gravi che richiedono interventi invasivi multipli è preferibile fare l’ultima trasfusione a 30-32 settimane di gestazione e indurre il parto a 32-34 settimane. Alcuni autori raccomandano invece le trasfusioni fino alla trentaseiesima settimana di gestazione (ACOG Practice Bulletin, 2006).
Infine, in caso di malattia emolitica del neonato, un possibile intervento terapeutico è la ex sanguino-trasfusione, che è però compito del neonatologo (Pescetto e coll., 2009).
1.1.6 Prognosi
Prima dell’introduzione del trattamento fetale o neonatale, la mortalità perinatale da malattia emolitica era del 40-50%. L’introduzione nel 1945 delle trasfusioni neonatali portò a una riduzione del 50% della mortalità. Con il trattamento del feto in utero c’è stato un ulteriore miglioramento, con sopravvivenza del 50% dei feti idropici e del 78% dei non idropici in caso di trasfusioni intraperitoneali, dell’82% dei feti idropici e del 90% dei non idropici in caso di trasfusioni endovascolari (Moise, 1993).
Il tasso di sopravvivenza fetale ha raggiunto valori di 80-85% nei casi gravemente compromessi, con una sopravvivenza del 94% in assenza di idrope e del 74% in presenza di idrope. I neonati affetti possono richiedere immediate trasfusioni, poiché gli anticorpi passati nel circolo fetale attraverso la placenta persistono anche dopo la nascita; talvolta possono richiedere trasfusioni a lungo, con necessità di uno stretto monitoraggio nei primi mesi di vita. Alcuni autori giustificano la necessità di trasfusioni prolungate dopo la nascita con la soppressione del midollo osseo dovuta alle trasfusioni in utero.
Non sono state osservate differenze nello sviluppo neurologico tra i feti affetti e quelli sani, ma sembra che in caso di alloimmunizzazione sia aumentato il rischio di sordità neurosensoriale, forse associata agli alti livelli si bilirubina (Harkness e Spinnato, 2004).
14
1.1.7 Immunoprofilassi
L’adozione sistematica dell’immunoprofilassi anti-D permette di evitare che la madre si immunizzi verso gli antigeni dei globuli rossi fetali in caso di incompatibilità Rh. Circa lo 0,27% di madri suscettibili continuano a sensibilizzarsi per mancata attinenza al protocollo, mentre persistono casi di alloimmunizzazione spontanea nonostante immunoprofilassi correttamente praticata (Egbor e coll., 2012).
Consiste nella somministrazione di IgG specifiche anti-D alla madre Rh negativa, non precedentemente immunizzata verso l’antigene D, che è entrata in contatto con globuli rossi del feto Rh-positivo in occasione del parto. L’efficacia sembra essere migliore se la profilassi viene fatta entro 72 ore dal parto e se la quantità delle immunoglobuline somministrate è proporzionale alla massa eritrocitaria incompatibile passata nel circolo materno. Lo stesso discorso può essere fatto in caso di aborto. E’ importante che il processo di immunizzazione non sia ancora iniziato, altrimenti la profilassi risulta inutile (Pescetto e coll., 2009).
Dopo la nascita è opportuno fare un prelievo di sangue dal cordone per identificare il gruppo sanguigno fetale e un eventuale prelievo di sangue materno per il test di Kleihauer, utile per quantificare il sanguinamento; se il neonato è Rh-positivo occorre procedere con l’immunoprofilassi anti-D, se invece è Rh-negativo non ce n’è bisogno (Egbor coll., 2012).
Il test Kleihauer è raccomandato nel Regno Unito, in Francia, in Canada, in Irlanda e negli Stati Uniti; in molti paesi europei non viene praticato, considerando che il 99% delle donne ha una trasfusione feto-materna inferiore ai 4 ml in occasione del parto. Il prelievo di sangue materno deve esser fatto entro 2 ore dal parto e il razionale del test è quello di individuare donne che hanno avuto un’emorragia maggiore rispetto allo standard generale, e che quindi hanno bisogno di una dose aggiuntiva di IgG anti-D; una dose di 500 UI (100 microgrammi) di IgG anti-D, somministrata per via intramuscolare, è necessaria a neutralizzare un’emorragia fino a 4 ml, mentre per ogni millilitro in eccesso occorrono altri 125 microgrammi di IgG. La dose somministrata dopo il parto varia a seconda del paese: negli USA la dose standard è 1500 UI (300 microgrammi), 500-600 UI (100-120 microgrammi) in Canada e 1000-1250 UI (200-250 microgrammi) in molti paesi europei eccetto Regno Unito, Irlanda e Francia (RCOG Guideline, 2011).
15
E’ stato anche proposto di praticare sistematicamente l’immunoprofilassi anti-D in tutte le gestanti Rh-negative non precedentemente immunizzate con feto Rh-positivo tra la ventottesima e la trentaquattresima settimana di gestazione, come già viene fatto in alcuni paesi (tra cui il Regno Unito), garantendo una protezione verso piccole emorragie feto-materne che possono verificarsi in assenza di specifici eventi che favoriscano la sensibilizzazione. Viene chiamata profilassi anti-D prenatale, ed è stata introdotta per la persistenza dell’1-2% di donne sensibilizzate nonostante l’immunoprofilassi dopo il parto (Egbor e coll., 2012).
Ci sono casi particolari a rischio di emorragia fetoplacentare in cui può essere indicato fare l’immunoprofilassi durante la gravidanza: metrorragie (minaccia d’aborto, placenta previa, distacco intempestivo di placenta normalmente inserita), amniocentesi, villocentesi, traumi addominali.
In ogni caso è opportuno controllare il titolo di anticorpi anti-D sei mesi dopo l’immunoprofilassi; se dopo tale intervallo gli anticorpi sono sempre presenti si tratta di immunizzazione attiva, e non di persistenza degli anticorpi anti-D usati per l’immunoprofilassi (Pescetto e coll., 2009).
16
1.2 Idrope non immune
1.2.1 PremesseLa quasi completa scomparsa della malattia emolitica da incompatibilità Rh spiega perché i casi di idrope fetale che giungono oggi all’osservazione medica sono dovuti perlopiù a cause non immunologiche.
I casi di idrope fetale non immune rappresentano fino al 90% di tutti i casi di idrope descritti in letteratura (Bellini e Hennekam, 2012).
Prima della diffusione dell’ecografia ostetrica, l’idrope era un problema esclusivamente neonatale, poiché veniva riconosciuto solo dopo il parto; oggi l’ecografia permette non solo di fare diagnosi prenatale, ma anche di monitorare l’evoluzione dell’idrope durante la gravidanza.
Secondo Bellini e coll. (2009), l’idrope non immune è un reperto aspecifico da considerare come lo stadio finale di una grande varietà di disordini. Infatti, mentre per la forma immune l’eziopatogenesi è conosciuta, per le forme non immuni le cause possibili sono molte e non sempre giustificano un chiaro meccanismo fisiopatologico. L’identificazione dell’eziologia è però importante perché correlata al counselling, alla prognosi e al follow-up. I casi in cui non si riesce a identificare una causa sono definiti idiopatici. In realtà sarebbe opportuno valutare se è stata condotta una completa indagine diagnostica prenatale (ecografia, ecocardiografia, studi sierologici, determinazione del cariotipo) e postnatale (esami radiografici, autopsia e studi sierologici), poiché classificare come idiopatici i casi in cui l’indagine è stata incompleta può dare una falsa idea della capacità diagnostica (Moreno e coll., 2013). 1.2.2 Fisiopatologia
Tutti i casi di idrope fetale non immune sono riconducibili ad alterazioni dell’equilibrio di Starling, che esprime la relazione tra le pressioni capillare e interstiziale, o alla riduzione dalla capacità di drenaggio linfatico.
Equilibrio di Starling. Il passaggio dei fluidi dal compartimento vascolare a quello interstiziale è regolato dalla legge di Starling, che illustra il ruolo delle pressioni idrostatica e oncotica nello spostamento dei liquidi attraverso la parete capillare:
17
dove J è il movimento netto dei fluidi tra i due compartimenti per unità di area endoteliale, Kf è il coefficiente di filtrazione, il cui valore è direttamente proporzionale alla permeabilità capillare, Pc è la pressione idrostatica capillare, Pi è la pressione idrostatica interstiziale, σ è il coefficiente di riflessione, πc è la pressione oncotica capillare e πi è la pressione oncotica interstiziale. Poiché nel processo angiogenetico i vasi neoformati hanno un sottile glicocalice, la loro permeabilità è maggiore; è per questo che qualsiasi condizione che altera l’equilibrio di Starling nel feto può esitare in idrope fetale. Inoltre la compliance dello spazio interstiziale fetale è circa 10 volte superiore rispetto a quella dell’adulto; questo provoca un considerevole accumulo di fluidi con aumento minimo della pressione idrostatica interstiziale. Se la filtrazione capillare è maggiore della capacità di drenaggio linfatico, lo spazio interstiziale del feto si espande con edema progressivo ed eventuale idrope.
Drenaggio linfatico. Nell’embrione i vasi linfatici iniziano a formarsi intorno alla sesta settimana di gestazione, dopo che il sistema cardio-vascolare si è stabilizzato. Il sistema linfatico scarica attraverso il dotto linfatico nel circolo venoso, a livello della giunzione tra le vene giugulare e succlavia. Il drenaggio linfatico fetale risente molto della pressione venosa centrale; mentre un suo piccolo aumento è ben tollerato dall’adulto, nel feto provoca una drammatica riduzione del flusso linfatico con alto rischio di sviluppare idrope (Bellini e Hennekam, 2012).
1.2.3 Etiologia
Poiché le possibili cause alla base dell’idrope sono molteplici, possono essere raggruppate in grandi categorie eziologiche.
Le cause ematologiche sono tutte riconducibili a una condizione di grave anemia fetale che può derivare da un difetto di sintesi dei globuli rossi (alfa-talassemia),
dall’emolisi (deficit di glucosio-6-fosfato deidrogenasi) o da una perdita ematica (emorragia fetomaterna cronica, trasfusione tra gemelli) (Di Tommaso, 2002).
L’anemia determina una condizione di ipossia in cui il sangue viene shiftato dai reni agli organi nobili, quali cervello, cuore e surreni; ne deriva danno renale tubulare con riduzione della produzione di urina, e ipotensione renale con attivazione del sistema renina-angiotensina. Il feto svilupperà oliguria ed eventuale idrope conseguente all’incapacità di eliminare l’eccesso di fluido attraverso il circolo placentare, le cui resistenze sono aumentate dall’azione vasocostrittrice dell’angiotensina. In realtà
18
sembra che possa svilupparsi idrope anche in assenza di danno renale. Un altro possibile meccanismo, ma di minor importanza, è il danno ischemico del fegato fetale, con ridotta produzione di albumina e quindi pressione oncotica capillare diminuita, che può contribuire a determinare idrope (Bellini e Hennekam, 2012).
Tra le forme di talassemia, l’alfa-1-talassemia è quella responsabile di idrope non immune. E’ diffusa soprattutto nelle aree dove la malaria è ancora endemica, e nel Sud-Est Asiatico è la causa più comune di idrope fetale (dal 60 al 90% dei casi). Sono stati riportati casi di idrope da alfa-1-talassemia anche a Cipro, in Grecia, in Sardegna e in Turchia. Nella forma omozigote sono assenti entrambe le copie dei geni per le catena alfa e l’emoglobina è rappresentata quasi esclusivamente dall’emoglobina di Bart, costituita da quattro catene gamma, che ha un’alta affinità per l’ossigeno e lo rilascia ai tessuti in quantità insufficiente; inoltre determina un accorciamento della vita media degli eritrociti e un’eritropoiesi meno efficace. Gli eritrociti in circolo sono ipocromici e nel sangue periferico si trovano molti eritroblasti nucleati a causa dello stress eritropoietico; sono presenti focolai di eritropoiesi extramidollare, con eventuale epatosplenomegalia (Chui e Waye, 1998). Il feto è dunque affetto da severa anemia, ipossia e insufficienza cardiaca, e può sviluppare un quadro di idrope, di solito molto grave, che esita spesso in morte intrauterina nel terzo trimestre di gravidanza o in morte neonatale precoce (Joshi e coll., 2004). L’anemia e l’ipossia possono dare placentomegalia visibile all’ecografia. Alla nascita i bambini sono pallidi ed edematosi, talvolta con anasarca, anche se non tutti i neonati affetti da talassemia sono idropici; spesso ci sono segni di scompenso cardiaco, quali cardiomegalia, versamento pericardico, versamento pleurico e ascite, e la placenta è di dimensioni superiori alla norma (Chui e Waye, 1998). Altre forme di alfa-talassemia meno gravi sono caratterizzate dalla delezione di una sola delle quattro copie del gene della catena alfa, di solito asintomatica, di due copie (tratto alfa-talassemico), caratterizzata da microcitosi o anemia lieve, o di tre copie (malattia da emoglobina H). In quest’ultimo caso abbiamo un importante squilibrio tra la produzione di catene alfa e beta, con formazione sia di emoglobina H, costituita da quattro catene beta, sia di emoglobina di Bart; come la forma omozigote, anche la malattia da emoglobina H può essere associata a idrope fetale, ma con minor frequenza (Steiner e Gallagher, 2007).
19
La deficienza di glucosio-6-fosfato deidrogenasi è una malattia genetica legata al cromosoma X caratterizzata da un deficit di produzione di glutatione ridotto, che normalmente esercita un’azione protettiva antiossidante verso le membrane degli eritrociti; in assenza di glutatione ridotto le membrane risultano maggiormente suscettibili agli agenti ossidanti, che ne provocano la rottura con emolisi conseguente. L’emolisi può verificarsi spontaneamente o in risposta all’ingestione materna di agenti ossidanti. Sono stati riportati rari casi di severa emolisi intrauterina e idrope fetale seguenti l’ingestione materna di agenti ossidanti (Steiner e Gallagher, 2007).
Infine si può avere idrope da perdita ematica cronica dovuta a emorragia feto-materna oppure a una sindrome da trasfusione tra gemelli (TTTS, Twin-to-Twin Transfusion Syndrome), che complica circa il 15% delle gravidanze gemellari monocoriali ed è associata a un alto rischio di mortalità. E’ un disturbo secondario alla presenza di anastomosi vascolari anomale nell’ambito della placenta, tali da determinare uno squilibrio emodinamico che favorisce un gemello (ricevente) a discapito dell’altro (donatore). Di solito è il gemello ricevente che sviluppa idrope come conseguenza del sovraccarico di circolo dovuto all’ipervolemia, mentre è più raro, ma comunque possibile, che si formino versamenti nel gemello donatore anemico (Di Tommaso, 2002; Chalouhi e coll., 2011).
Le cause cardiache si distinguono in anomalie del sistema di conduzione e anomalie strutturali.
Tra le anomalie funzionali abbiamo sia tachiaritmie, come le tachicardia sopraventricolare, il flutter atriale e la fibrillazione atriale, che bradiaritmie, come il blocco atrio-ventricolare (BAV) completo o parziale.
La presenza di idrope in feti con tachiaritmia correla con una prognosi peggiore; il tasso di mortalità è infatti pari al 35% nel feto idropico e allo 0-4% nel feto non idropico. Il rischio di idrope aumenta se l’aritmia compare a un’età gestazionale precoce e se è continua, prolungata e ad alta frequenza cardiaca; questo non esclude che disturbi del ritmo intermittenti possano portare a idrope (Jaeggi e coll., 2011).
Nella patogenesi del blocco atrio-ventricolare possono essere coinvolti autoanticorpi materni antinucleo (anti-SSA), che attraversano la placenta e influenzano il sistema di conduzione del feto. Esistono due ipotesi patogenetiche: la prima si basa su un processo infiammatorio scatenato dall’interazione tra gli anticorpi anti-SSA e specifici antigeni
20
espressi nel sistema di conduzione fetale (teoria infiammatoria), la seconda sull’interazione elettrofisiologica degli anticorpi con la conduzione cardiaca (teoria elettrofisiologica). In realtà entrambi i meccanismi possono concorrere a determinare la patologia; modelli animali ed esperimenti in vitro suggeriscono che gli anticorpi provocano prima un’alterazione della conduzione elettrica e successivamente una reazione infiammatoria immunomediata, con fibrosi e calcificazione del nodo atrio-ventricolare e conseguente blocco completo. Il blocco atrio-atrio-ventricolare congenito si sviluppa nell’1-5% di gravidanze in cui la madre ha anticorpi anti-SSA, tipicamente tra la diciottesima e la ventiquattresima settimana di gestazione (Miyoshi e coll., 2012; Ambrosi e coll., 2012).
Le anomalie strutturali cardiache che possono associarsi a idrope sono molteplici; tra le più comuni abbiamo trasposizione dei grossi vasi, difetti del setto, canale atrioventricolare e tetralogia di Fallot. Anche alcune anomalie valvolari possono portare a idrope da scompenso cardiaco, come atresie valvolari, displasie valvolari e anomalia di Ebstein. Altre condizioni che possono essere associate all’idrope sono tumori cardiaci, chiusura prematura del forame ovale o del dotto di Botallo e cardiomiopatie (Santo e coll., 2011).
I più comuni tumori cardiaci durante la vita fetale sono rabdomioma, fibroma e teratoma intrapericardico. Rabdomioma e fibroma si localizzano nel ventricolo e sono associati rispettivamente a sclerosi tuberosa e calcificazioni miocardiche; il rabdomioma può causare ostruzione valvolare. Il teratoma intrapericardico è raro e di solito appare come una massa disomogenea al di fuori delle cavità cardiache; può raggiungere dimensioni maggiori di quelle cardiache e la sua rapida crescita, rispetto al piccolo spazio a disposizione, può portare a compressione del cuore e dei grossi vasi, con idrope conseguente. All’ecografia prenatale il teratoma può apparire sia ipoecogeno, sia iperecogeno; al color-Doppler si osserva che è una lesione scarsamente vascolarizzata (Czernik e coll., 2006).
La prematura chiusura del dotto arterioso di Botallo è una condizione rara; l’assunzione da parte della madre di inibitori delle prostaglandine, come i FANS, o di polifenoli è associata a un aumentato rischio di chiusura prematura del dotto, anche se sono stati descritti casi di chiusura prematura idiopatica. Clinicamente può dare insufficienza cardiaca destra, idrope fetale, ipertensione polmonare persistente e morte del feto; la
21
presentazione clinica dipende dalla durata e dalla severità dell’ostruzione al flusso (Babaoglu e coll., 2013).
I casi di idrope fetale da causa cardiogena con ostruzione all’efflusso dalle camere sinistre del cuore potrebbero essere ipoteticamente dovuti a edema polmonare linfatico secondario a ipertensione atriale sinistra. Nel feto il drenaggio linfatico è il maggior determinante dell’equilibrio dei liquidi nell’organismo. C’è una maggiore differenza rispetto all’adulto tra pressione idrostatica e pressione oncotica all’interno del circolo capillare, ed è quindi favorito il passaggio di fluidi dal compartimento intravascolare a quello interstiziale; inoltre il flusso linfatico fetale è più sensibile all’aumento di pressione venosa centrale, con arresto del drenaggio linfatico già a valori di pressione venosa centrale pari a 15 mmHg, rispetto ai 25-30 mmHg dell’adulto. In caso di ostacolo all’efflusso dal cuore di sinistra, il passaggio di sangue attraverso il forame ovale può decomprimere l’atrio sinistro, prevenendo così l’aumento della pressione atriale di sinistra e la sua trasmissione al circolo polmonare. Alcuni feti in cui c’è un’ostruzione all’efflusso dal cuore di sinistra, sviluppano comunque un’alta pressione telediastolica ventricolare e un’alta pressione atriale, che si trasmettono al circolo polmonare a al cuore di destra, creando i presupposti dell’idrope cardiogenico. (Williams e Kleinman, 2008).
Cause cromosomiche di idrope fetale possono essere la sindrome di Turner, la triploidia, la trisomia 21, la trisomia 18, la trisomia 13, la delezione del braccio corto del cromosoma 13, il cromosoma 11 anomalo, i mosaicismi.
Le cause polmonari provocano idrope ostacolando il ritorno venoso al cuore attraverso compressione della vena cava e/o compressione cardiaca oppure per effetto dell’aumentata pressione intratoracica. Tra le malattie polmonari che possono portare a idrope fetale abbiamo: malformazione adenomatosa cistica, lesioni occupanti spazio di origine polmonare o mediastinica, idrochilotorace congenito idiopatico, ernia diaframmatica.
La malformazione adenomatosa cistica (CAM) polmonare deriva da un difetto di sviluppo dei bronchioli terminali, che assumono un’evoluzione in senso cistico; ne deriva la presenza, nell’ambito del parenchima polmonare, di formazioni cistiche di varia dimensione. L’incidenza oscilla tra 1/25000 e 1/35000 nati vivi. Secondo il diametro delle cisti, si distinguono due forme di adenomatosi: microcistica e
22
macrocistica. La forma microcistica tende e regredire dalla ventiseiesima alla ventottesima settimana di gestazione, mentre quella macrocistica in genere tende a crescere per l’accumulo progressivo di liquido all’interno delle cisti. Le lesioni di grandi dimensioni possono causare ipoplasia polmonare per la compressione esercitata sul parenchima, e idrope fetale come risultato dello spostamento del mediastino e della compressione sulla vena cava e sul cuore (Schrey e coll., 2012).
Il sequestro polmonare è una lesione occupante spazio costituita da una massa di tessuto polmonare che non comunica con l’albero bronchiale, la cui irrorazione è fornita da un vaso anomalo proveniente dal circolo sistemico (di solito un ramo dell’aorta discendente); è visibile all’ecografia come un’area iperecogena. Nella patogenesi dell’idrope può ostacolare il ritorno venoso oppure determinare, secondo una fisiopatologia poco chiara, versamento pleurico, che a sua volta è responsabile dello sviluppo di idrope (Salomon e coll., 2003).
L’idrochilotorace congenito idiopatico è una rara condizione che ha un’incidenza di circa 1/12000 gravidanze; il suo decorso clinico è variabile, ma la coesistenza di idrope o ipoplasia polmonare, l’interessamento bilaterale e l’assenza di trattamento correlano con una prognosi peggiore. Anche se la patogenesi non è chiara, esistono comunque due ipotesi: quella infiammatoria, secondo cui i numerosi linfociti nel versamento pleurico deriverebbero da un processo infiammatorio, e quella genetica, secondo cui alla base ci sarebbero mutazioni geniche responsabili di un alterato drenaggio linfatico a livello polmonare (Yang e coll., 2012).
E’ opportuno ricordare le possibili cause renali (malformazioni renali; tumori; disordini ureterali, della vescica e dell’uretra; sindrome di Prune-Belly) e gastroenteriche (peritonite da meconio; atresia duodenale; diverticolo duodenale; atresia digiuno-ileale; volvolo; ano imperforato) (Bellini e coll., 2009).
Tra le cause infettive sono comprese l’infezione intrauterina da Citomegalovirus, Parvovirus B19, Treponema pallidum, Toxoplasma gondii, Listeria monocytogenes, Herpes simplex, Leptospira.
I meccanismi fisiopatologici sono diversi: anemia emolitica (da Citomegalovirus e Parvovirus B19), perdita di proteine dal letto capillare per alterazione della parete vascolare, infezione epatica con compromissione della sintesi proteica, miocardite (Di Tommaso, 2002).
23
La prima associazione tra Parvovirus B19 e idrope è stata riportata nel 1984, quando veniva dimostrata la presenza di IgM anti-B19 in alcuni feti idropici (Xu e coll., 2003). La ricerca del DNA del Parvovirus B19 tramite ibridazione in situ su tessuti autoptici di feti affetti da idrope apparentemente idiopatico, individuò il Parvovirus B19 come una causa relativamente frequente di idrope fetale (Porter e coll., 1988). Studi simili con conclusioni analoghe sono stati effettuati ricercando il DNA del Parvovirus B19 tramite PCR nei tessuti fetali o placentari (Jordan, 1996).
Un fattore di rischio per l’infezione materna è lo stretto contatto con i bambini; inoltre l’infezione ha un tipico andamento stagionale, con maggior incidenza in primavera e in inverno. Mentre nell’adulto l’infezione da Parvovirus B19 è generalmente blanda, nel feto, che non ha un sistema immune competente, può portare ad aborto spontaneo nel primo trimestre, anemia aplastica, idrope e morte in utero; il feto sviluppa anemia perché il virus ha una predilezione per le cellule ad alto tasso replicativo, come i globuli rossi in fase maturativa. In una donna gravida infetta da Parvovirus B19 occorre iniziare un attento monitoraggio ecografico del feto per valutare l’eventuale comparsa di idrope; i controlli ecografici seriati dovrebbero essere fatti settimanalmente, e in caso di comparsa di idrope o MCA-PSV superiore a 1,50 MoMs può essere proposta la cordocentesi per confermare o meno l’anemia e, eventualmente, fare una trasfusione di sangue al feto (Beigi e coll., 2008; Xu e coll. 2003).
Le cause metaboliche sono rappresentate principalmente dalle malattie da accumulo lisosomiale, che provocano visceromegalia con ostruzione secondaria al ritorno venoso. In alcuni casi l’idrope può essere legato anche all’anemia, dovuta sia all’ipersplenismo sia alla riduzione del processo di eritropoiesi, entrambi riconducibili al coinvolgimento del sistema reticolo-endoteliale da parte della malattia; altri possibili meccanismi alla base dell’idrope sono lo scompenso cardiaco, la disfunzione epatica e l’ipoproteinemia (Whybra e coll., 2012).
Le malattie da accumulo descritte come possibili cause di idrope fetale sono quattordici, tra cui malattia di Gaucher, malattia di Niemann-Pick, ganglioisidosi di tipo I, mucopolisaccaridosi di tipo I e VII, mucolipidosi di tipo II/III, deficit di beta-galattosidasi, galattosialidosi, deficit multiplo di solfatasi (Gort e coll., 2012).
24
Sono state descritte, oltre ai disordini metabolici, altre malattie ereditarie associate a idrope fetale: sindrome di Noonan; acondroplasia; sindrome di Pena Shoiler; sindrome dello pterigo multiplo (Di Tommaso, 2002).
Altre possibili cause sono le malformazioni arterovenose cerebrali (MAV), il teratoma sacrococcigeo e il corioangioma placentare, caratterizzate da shunt arterovenoso che può esitare in scompenso cardiaco ad alta portata con idrope conseguente.
Le malformazioni arterovenose cerebrali, più facilmente visibili ecograficamente nel terzo trimestre, coinvolgono quasi sempre la vena di Galeno. Sono aneurismi dove l’arteria e la vena sono direttamente connesse, senza l’interposizione dei capillari; ne deriva un importante shunt artero-venoso sistemico con cardiomegalia da sovraccarico di circolo. Può esitare in scompenso cardiaco ad alta gittata se l’eccesso di flusso va oltre la capacità fetale fisiologica di shunt destro-sinistro attraverso il forame ovale. La diagnosi prenatale si basa sull’identificazione del flusso sanguigno all’interno della lesione grazie all’utilizzo del color-Doppler; l’uso del power Doppler tridimensionale permette inoltre la ricostruzione dell’architettura del vaso (Rios e coll., 2012). Durante la vita fetale la placenta può proteggere il feto; se lo shunt è cospicuo e la placenta è troppo piccola per contenere il volume di sangue, si possono però sviluppare cardiomegalia, idrope e danni cerebrali. I danni cerebrali dipendono dal volume di sangue che passa attraverso la comunicazione arterovenosa senza irrorare il parenchima (“furto di sangue”), portando a ischemia cerebrale. La prognosi dei feti e dei neonati affetti è infausta, con morbilità e mortalità elevate. I bambini con malformazione arterovenosa in assenza di danni cerebrali alla nascita possono beneficiare dell’embolizzazione intra-arteriosa, con chiusura della comunicazione anomala tra arteria e vena (Henrich e coll, 2003).
Il teratoma sacrococcigeo è il tumore congenito più comune. Le dimensioni del tumore sono variabili e possono aumentare considerevolmente con l’età gestazionale, con rischio maggiore di idrope fetale (Brace e coll., 2000). Anche se la maggior parte dei teratomi sacrococcigei sono benigni, sono associati a un’elevata morbilità e mortalità, per lo sviluppo di scompenso cardiaco congestizio e idrope nel feto (Rios e coll., 2012). L’idrope da scompenso può esser dovuto, oltre che allo shunt arterovenoso per comunicazioni vascolari anomale nell’ambito del tumore, anche a emorragia o sequestro di sangue all’interno della lesione (Kamata e coll., 2001).
25
Il corioangioma placentare è il tumore placentare più comune, con una prevalenza stimata dell’1%. Perlopiù è una lesione singola, benigna, di piccole dimensioni e capsulata, corrispondente dal punto di vista istologico a un amartoma o a un emangioma. I corioangiomi di piccole dimensioni tendono a rimanere asintomatici e non vanno incontro a complicazioni nel corso della gravidanza; i corioangiomi giganti (diametro superiore a 4-5 cm) sono più rari, con una prevalenza variabile da 1/9000 a 1/50000 gravidanza, e sono più spesso diagnosticati ecograficamente in epoca prenatale ed associati a complicanze. Il feto può infatti sviluppare un circolo iperdinamico dovuto a comunicazioni artero-venose anomale nell’ambito del tumore, con conseguente cardiomegalia, scompenso cardiaco e idrope (Zanardini e coll., 2010; Garcia Diaz e coll., 2012).
Le malformazioni arterovenose, il teratoma sacrococcigeo e il corioangioma placentare sono condizioni ad alta gittata cardiaca, e richiedono un maggiore lavoro miocardico che può evolvere in scompenso e idrope, con alto rischio di morte fetale. Una valutazione dello stato cardiovascolare del feto può essere data dal Cardiovascular Profile Score (CVPS), calcolato considerando più variabili: presenza di idrope, alterazioni del Doppler venoso o arterioso, cardiomegalia, rigurgito valvolare atrio-ventricolare e scompenso cardiaco. E’ stato dimostrato che, in feti con scompenso ad alta portata, il CVPS è inversamente proporzionale alla gittata cardiaca; quindi un aumento della gittata corrisponde a una riduzione del benessere cardiovascolare fetale. Il CVPS potrebbe essere utile nell’identificazione dei feti più a rischio, e quindi nelle scelta dei casi da sottoporre a terapia (Statile e coll., 2013).
1.2.4 Diagnosi
La diagnosi di idrope o versamenti isolati è essenzialmente ecografica. Per l’inquadramento etiopatogenetico è invece necessario un approccio integrato che comprende test sierologici materni e fetali ed eventuali tecniche invasive.
L’idrope non immune si può presentare con polidramnios e ridotta percezione dei movimenti fetali, con successiva valutazione ecografica che permette di fare la diagnosi con certezza; spesso però la diagnosi viene fatta occasionalmente durante i controlli ecografici di routine o eseguiti per altre indicazioni.
Dopo la diagnosi di idrope, la prima cosa da fare è escludere un’eventuale alloimmunizzazione mediante test di Coombs indiretto; se il test è negativo si parla di
26
idrope non immune e si inizia una ricerca sistematica della possibile causa. All’ecografia possiamo visualizzare più alterazioni: edema sottocutaneo, ascite, idrotorace, versamento pericardico.
Segni accessori che possono accompagnare l’idrope sono polidramnios e spessore placentare superiore a 6 cm. Il polidramnios si associa spesso all’idrope, e ogni volta che viene riscontrato è opportuno un attento esame ecografico delle cavità sierose per escludere un incipiente idrope fetale. Allo stesso modo, in caso di idrope è doveroso valutare con attenzione la quantità di liquido amniotico e misurare la falda amniotica massima.
L’esame ecografico è fondamentale non solo per la diagnosi, ma anche per monitorare l’idrope nel tempo, valutandone la progressione o meno; in alcuni casi può anche individuare le anomalie anatomiche alla base della patologia. E’ quindi opportuno un esame attento e sistematico di tutti i distretti fetali.
La valutazione della testa inizia con la conferma dell’integrità del cranio; si devono poi escludere difetti del tubo neurale, quali anencefalia ed encefalocele, e displasie scheletriche. E’ opportuno osservare attentamente lo scalpo fetale, une delle sedi dove è più facile riconoscere l’edema sottocutaneo. Si passa poi a valutare le strutture interne tra cui la linea mediana, che deve essere normalmente posizionata, perché se deviata può suggerire la presenza di un’emorragia fetale intracranica. L’esame della faccia può dare indizi su eventuali anomalie cromosomiche, come la labiopalatoschisi per la trisomia 13, e displasie scheletriche, come la depressione del ponte nasale e le bozze frontali per l’acondroplasia (Di Tommaso, 2002).
E’ opportuno ricercare eventuali malformazioni arterovenose cerebrali, anche con l’aiuto del Doppler. Ecograficamente la malformazione aneurismatica della vena di Galeno si vede come una struttura ipoecogena lineare, localizzata al centro della parte posteriore del terzo ventricolo; se il Doppler mostra un flusso ad alta velocità conferma la diagnosi (Rodesch e coll., 1994).
Considerando che in gran parte dei casi l’idrope non immune ha alla base una causa cardiogena, l’ecocardiografia fetale è un esame diagnostico molto importante. Il cuore deve essere studiato sia dal punto di vista strutturale, valutando il setto, le valvole, la dimensione delle camere, le connessioni con i grossi vasi, ecc.., sia dal punto di vista funzionale, valutandone il ritmo con l’uso del Doppler. L’esame ecografico del cuore
27
prevede anche la visualizzazione dell’eventuale versamento pericardico, che appare come un’area anecogena intorno al muscolo cardiaco, e la misurazione del suo spessore; di solito il versamento è modesto e associato a grave scompenso cardiaco fetale.
L’esame del torace è volto alla valutazione della presenza di idrotorace monolaterale o bilaterale, visibile come un’area anecogena tra il parenchima polmonare e la parete toracica, e alla misurazione del suo spessore. Se il versamento è molto voluminoso può associarsi a ipoplasia polmonare, che, se presente, è di solito la causa di morte dei neonati affetti da idrope non immune. Inoltre l’ecografia può essere utile nell’individuazione di possibili cause come una lesione occupante spazio, cistica o solida, o un’ernia diaframmatica. Un versamento pleurico, soprattutto se unilaterale e isolato e senza altra apparente eziologia, può essere indicativo di idrochilotorace congenito idiopatico. Per valutare possibili displasie scheletriche, è opportuno osservare le coste e la forma della cavità toracica.
Nell’addome va valutata la presenza di ascite fetale, che appare come una zona circonferenziale anecogena lungo il contorno della cavità addominale in una scansione trasversa, oppure come raccolta fluida libera intraddominale; da un punto di vista dimensionale la circonferenza addominale (CA) sarà maggiore rispetto ai valori di riferimento per età gestazionale. Inoltre vanno osservati tutti gli organi addominali, soprattutto tratto gastroenterico e reni, alla ricerca di eventuali cause.
E’ importante l’esame dello scheletro per valutare la presenza o meno di displasie scheletriche; l’esame comprende la biometria e la valutazione delle ossa lunghe in termini di forma e mineralizzazione. In caso di sospetta displasia scheletrica possono risultare utili l’anamnesi familiare e le indagini genetiche.
Infine va valutata la placenta, che può essere ingrossata a causa dell’edema e presentare talvolta alterazioni responsabili dell’idrope stesso, tra cui il corioangioma (Di Tommaso, 2002).
La Doppler-flussimetria dell’arteria cerebrale media è un’indagine importante per valutare la presenza di anemia fetale, e rappresenta una valida alternativa alla funicolocentesi, che ci informa fedelmente sullo stato ematologico fetale ma è una tecnica invasiva non priva di rischi. L’esame Doppler è invece facilmente ripetibile, quindi utile anche per il monitoraggio, e privo di rischi per il feto.
28
La diagnostica materna è utile soprattutto nell’identificazione di infezioni congenite e di emorragie feto-materne. La diagnosi di infezione richiede la valutazione sierologica dello stato anticorpale materno verso agenti infettivi specifici, tra cui Parvovirus B19, Citomegalovirus, Toxoplasma gondii, Treponema pallidum. Test infettivologici diversi vanno riservati a casi specifici dove c’è un ragionevole sospetto che un particolare agente infettivo sia coinvolto. L’elettroforesi dell’emoglobina su siero materno permette inoltre di valutare se la madre è alfa-talassemica (Di Tommaso, 2002).
La diagnostica fetale invasiva mediante amniocentesi e cordocentesi può essere utile nella diagnosi di malattie cromosomiche e di infezioni fetali, nella diagnosi di alfa-talassemia e di malattie da accumulo lisosomiale. Le indagini sono indirizzate verso una ricerca specifica sulla base dell’anamnesi e dei reperti ecografici.
L’amniocentesi, che consiste nel prelievo di liquido amniotico, può essere utile per stabilire il cariotipo ed eventualmente per la diagnosi di infezioni batteriche mediante esame colturale e virali mediante PCR.
Per indagare la presenza di malattie da accumulo è richiesta una grande quantità di amniociti; le indagini si basano sulla valutazione dell’attività enzimatica nella coltura delle cellule amniotiche e dei glicosaminoglicani nel sopranatante del liquido amniotico (Gort e coll., 2012).
La cordocentesi permette invece di ottenere un campione di sangue fetale, ma il suo utilizzo è limitato dalla sua alta invasività; permette l’identificazione di forme anomale di emoglobina attraverso l’elettroforesi, il dosaggio delle IgM specifiche dopo la ventesima settimana di età gestazionale, la ricerca virale tramite PCR a ogni epoca gestazionale, la valutazione della funzione epatica (Di Tommaso, 2002).
1.2.5 Terapia
La possibile scelta terapeutica dipende strettamente dall’eziologia e va quindi individualizzata a seconda del caso specifico.
Se la causa dell’idrope è l’anemia, qualunque sia la patogenesi, la scelta terapeutica migliore è la trasfusione di sangue al feto.
Nell’anemia da Parvovirus B19 le trasfusioni intrauterine riducono la mortalità e la morbilità (Nagel e coll., 2007). Il rischio di morte fetale sembra infatti più alto in caso di atteggiamento attendistico piuttosto che nei feti sottoposti a trasfusione; il tempo per la risoluzione dell’idrope è circa 4 settimane (Xu e coll., 2003). Tuttavia, nei bambini
29
che sopravvivono dopo la terapia trasfusionale, può verificarsi un alterato sviluppo neurologico; poiché lo sviluppo neurologico non sembra chiaramente correlato al grado di anemia, è stato ipotizzato che l’infezione fetale da Parvovirus B19 possa indurre un danno al sistema nervoso centrale (Nagel e coll., 2007). Inoltre sono riportati in letteratura casi di emorragia cerebellare 1-3 settimane dopo la trasfusione, forse riconducibili al cambiamento emodinamico con danno emorragico da riperfusione e lesione dei sottili capillari della matrice germinale cerebellare; un’altra possibile spiegazione è l’infezione diretta del cervelletto da parte del virus (Glenn e coll., 2007). E’ opportuno ricordare che in alcuni casi di anemia da Parvovirus B19, se il feto non è acidemico e se sono presenti i reticolociti, l’anemia può risolversi spontaneamente e la terapia trasfusionale può non essere necessaria (Di Tommaso, 2002).
Le trasfusioni non sembrano essere efficaci in caso di anemia da carenza di glucosio-6-fosfato deidrogenasi, per la quale attualmente non esiste un trattamento specifico; data l’eccezionalità dei casi, non è possibile neanche suggerire una condotta terapeutica basata sull’esperienza (Di Tommaso, 2002).
In caso di tachiaritmie, la terapia si basa sulla somministrazione di farmaci antiaritmici sia per via transplacentare, sia direttamente al feto. Ad oggi i principali farmaci utilizzati per la cardioversione in utero sono digossina, flecainide, sotalolo. Secondo Jaeggi e coll. (2011), la flecainide e la digossina sono più efficaci rispetto al sotalolo nella cardioversione della tachiaritmia sopraventricolare e del flutter atriale. Al contrario, secondo l’esperienza di Van der Heijden e coll. (2013), la terapia di prima linea con sotalolo è efficace nella cardioversione di feti idropici, anche se è stata esaminata una minor percentuale di feti tachiaritmici con idrope rispetto allo studio precedente.
Le tachicardia sopraventricolare risulta più facilmente controllabile dalla terapia transplacentare rispetto al flutter atriale, mentre la presenza di idrope sembra correlare con una minor risposta al tentativo di cardioversione (Jaeggi e coll., 2011).
Per le bradiaritmie fetali, invece, i tentativi di terapia farmacologica con simpaticomimetici somministrati attraverso la madre non hanno dato grandi risultati; questo è riconducibile alla loro azione sul nodo del seno, e non sul ritmo ventricolare. Possono essere somministrati cortisonici fluorinati sia per trattare che per prevenire lo sviluppo di blocco atrio-ventricolare nel feto di madre con anticorpi anti-SSA; la loro
30
azione immunosoppressiva sembra infatti ridurre il processo infiammatorio immunomediato a carico del sistema di conduzione cardiaco fetale. L’utilizzo degli steroidi è però controverso a causa dei potenziali effetti collaterali nella madre e nel feto, tra cui restrizione della crescita fetale e oligoidramnios, entrambi dose-dipendenti; si raccomanda quindi un’assunzione limitata a un periodo inferiore a dieci settimane (Miyoshi e coll., 2011; Breur e coll., 2004).
La paracentesi e la toracentesi ecoguidate possono essere eseguite in caso di ascite e idrotorace.
L’uso della paracentesi è limitato a poche situazioni e non è risolutivo, visto che l’ascite tende a riaccumularsi rapidamente; può essere indicata ad esempio immediatamente prima del parto in elezione di un feto ascitico, per decomprimere l’addome fetale e permettere sia un parto per via vaginale sia l’espansione polmonare del neonato.
In caso di idrotorace un intervento alternativo alla toracentesi è il posizionamento di uno shunt toraco-amniotico, soprattutto se il versamento si ripresenta dopo il drenaggio. La toracentesi e la derivazione toraco-amniotica si fanno soprattutto nei casi di idrochilotorace congenito idiopatico; oltre a favorire la regressione dell’idrope e il miglioramento delle condizioni emodinamiche, sono utili nella prevenzione dell’ipoplasia polmonare, migliorando la sopravvivenza del bambino.
Sembra che la toracentesi sia la prima procedura da fare per il trattamento dell’idrotorace isolato, mentre lo shunt toraco-amniotico dovrebbe essere riservato ai casi che richiedono toracentesi ripetute, ossia i casi che non si risolvono dopo due toracentesi (Aguirre e coll., 1995). Poiché solo pochi casi di versamento pleurico si risolvono dopo toracentesi intrauterina, il drenaggio toraco-amniotico a lungo termine sembra essere una terapia più appropriata; sono state però descritte alcune complicanze della procedura, tra cui migrazione o ostruzione dello shunt, sanguinamenti fetali, rottura prematura delle membrane, travaglio prematuro e corioamnionite (Rustico e coll., 2007).
Talvolta il drenaggio può essere difficile, soprattutto quando lo spessore della cute edematosa o la posizione del feto o della placenta ostacolano la procedura; un’alternativa può essere l’iniezione intrapleurica di OK-432, una preparazione liofilizzata, inattivata e avirulenta di un ceppo di Streptococcus pyogenes di gruppo A. E’ una tecnica a cui non si ricorre di routine, ma solo in casi particolari dove la prognosi