Curriculum:
SCIENZE MEDICHE VETERINARIA
Valutazione emodinamica con eco-doppler della vena porta in cani sani prima e dopo sedazione o anestesia.
Tesi di:
Dott.ssa Paola Mantineo
Tutor: Ch.mo Prof. Massimo De Majo
Ciclo XXVIII
UNIVERSITA’ DEGLI STUDI DI MESSINA DIPARTIMENTO DI SCIENZE VETERINARIE
Dottorato di Ricerca in Scienze Veterinarie Coordinatrice: Prof. Adriana Ferlazzo
A mio figlio A Massimiliano Ai miei genitori A mio fratello
“Non ti arrendere mai. Di solito è l’ultima chiave del mazzo quella che apre la porta.” P.Coelho
INDICE
Capitolo 1 : Introduzione………pag.3 Capitolo2 : Anatomia………...pag.5 Capitolo 3: Circolazione epatica………...pag.6 Capitolo 4: Ipertensione portale………pag.8 Capitolo 5 : Shunt portosistemici………..pag.15 Capitolo 6: Ultrasonografia………pag.20 Capitolo 7: Radiografia con contrasto……….pag.29 Capitolo 8: Scintigrafia………...pag.31 Capitolo 9: Angio-TC………..pag.33 Capitolo 10: Risonanza Magnetica………..pag.35 Capitolo 11: Materiali e metodi……….pag.37 Capitolo 12: Risultati………..pag.40 Bibliografia………..pag.43
INTRODUZIONE
La valutazione ecografica attraverso il doppler del flusso portale è utile nel diagnosticare anomalie vascolari nel cane.
Attraverso la rilevazione di alterata velocità o flusso
portale,cambiamenti del diametro della vena porta e del rapporto porta-aorta, si possono diagnosticare shunt portosistemici e patologie croniche o congenite che causano ipertensione portale (1); da ciò si evince l’importanza basilare di conoscere questi parametri nei soggetti sani.
In questo studio focalizzeremo l’attenzione sui parametri del flusso portale, discostandoci dai classici piani di scansione ecografica
(2),misurando il doppler della branca destra della vena porta affinchè il fascio di ultrasuoni sia più parallelo al flusso di sangue e l’angolo di insonazione sia ancora più basso (3).
I cani vengono valutati prima e dopo la somministrazione di sedativi e/o anestetici per valutare le possibili variazioni emodinamiche dei farmaci utilizzati,visto che studi precedenti hanno dimostrato diminuzioni del
flusso portale sotto isofluorano o alotano mentre il Propofol sembra non avere effetti emodinamici su di esso (4,5).
CAPITOLO 2
ANATOMIA
Il fegato è l’organo più grande all’interno dell’addome, è connesso all’apparato digerente al quale invia il prodotto della sua attività esocrina (la bile) attraverso il dotto escretore, il coledoco.
La bile interviene nei processi digestivi favorendo l’emulsione e
l’assorbimento dei grassi, ma elimina anche molte sostanze tossiche che il fegato provvede a sottrarre dal sangue.
Il fegato interviene in molte tappe del metabolismo intermedio, elabora proteine e fattori che agiscono nella regolazione dell’eritropoiesi e nella coagulazione del sangue.
Il parenchima è costituito da unità morfofunzionalei:i lobuli. Essi sono separati da tessuto interlobare. In più punti il connettivo è meglio
rappresentato e costituisce uno spazio portale nel quale sono accolte le ultime diramazioni dell’arteria epatica e della vena porta, i dotti biliari e linfatici e sottili branche nervose.
Nel lobulo epatico un sottile stroma reticolare accoglie gli epatociti, tra di essi passano i capillari sinusoidali caratterizzati da pori che facilitano gli scambi tra il sangue e le cellule epatiche (6).
CAPITOLO 3
CIRCOLAZIONE EPATICA
Il fegato riceve circa il 25% della gittata cardiaca (7). Un terzo di questo sangue proviene dall’arteria epatica, due terzi dalla vena porta.
Il flusso arterioso epatico è influenzato dai cambiamenti delle resistenze vascolari, quello portale è un flusso a bassa pressione regolato dalle resistenze vascolari dei vasi tributari della porta che provengono dallo stomaco, intestino, milza e pancreas.
I due sistemi vascolari riescono comunque a mantenere costante la quantità di sangue che arriva al fegato : quando aumenta il flusso di uno, l’altro diminuisce attraverso un fenomeno chiamato “hepatic buffer response” (8).
Il sangue proveniente da questi due distretti principali entra nel lobulo epatico a livello della triade portale e viene convogliato nel sinusoide epatico.
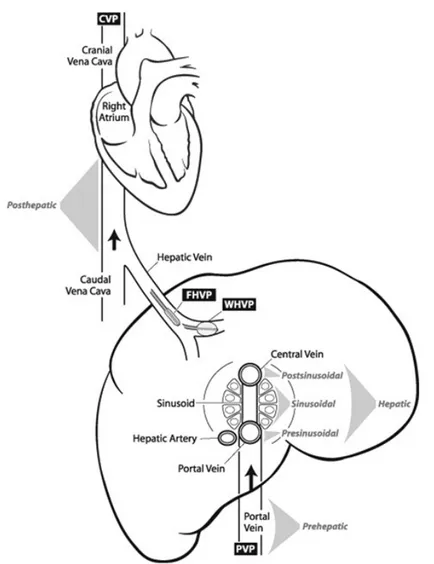
Le cellule sinusoidali hanno delle fenestrature ampie e mancano di membrana basale(“leaky”). Dopo esser passato attraverso il tessuto epatico il sangue viene drenato all’ interno della vena epatica centrale che attraverso le vene epatiche sbocca nella vena cava caudale e torna in atrio destro(9).
FIG. 1: Rappresentazione del sinusoide epatico.
IPERTENSIONE PORTALE
L’ipertensione portale è un aumento patologico del gradiente di pressione venosa portale tra la vena porta e la cava(10).
La misurazione della pressione portale può essere eseguita con metodo diretto o indiretto.
In veterinaria viene cateterizzata la vena porta o sue tributarie ed inserito un manometro o un trasduttore di pressione. Le pressioni medie ottenute sono di 5,98 +/- 1,99 mmHg.(11).
In medicina umana viene maggiormente utilizzato un metodo indiretto con inserimento di un catetere con pallone a livello della vena epatica, la pressione di quest’ ultima è equivalente alla pressione sinusoidale che approssima la pressione portale(12).
Nei soggetti normali la pressione portale rimane stabile nonostante i cambi di flusso grazie alla risposta adattativa dei sinusoidi e dei vasi intraepatici. Infatti un aumento del flusso portale stimola le cellule endoteliali sinusoidali a produrre ossido nitrico che dilata i vasi intraepatici per accogliere un maggiore volume di sangue(13).
Piccole alterazioni fisiologiche della pressione portale possono essere legate all’ esercizio, all’ alimentazione, all’ anestesia (14,4,5).
L’ipertensione portale viene classificata in base alla localizzazione anatomica in preepatica, epatica e postepatica.
La prima è causata da un aumento delle resistenze vascolari associato a ostruzione vasale (fibrosi congenita, trombosi, neoplasia) o
compressione(15).
L’ipertensione portale intraepatica è causata da un aumento di resistenze a livello dei vasi microscopici portali all’interno del parenchima epatico. Istologicamente l’ipertensione epatica viene classificata in presinusoidale, sinusoidale e postsinusoidale.
L’ipertensione presinusoidale è legata a un aumento di resistenze nelle vene tributarie terminali portali. Nel cane è causata dall’ipoplasia
portale primaria, dalla fibrosi epatica primaria, da patologie cistiche dei dotti biliari intraepatici (come la malattia di Cairoli), e, raramente, in corso di infestazioni di trematodi (a causa della formazione di
granulomi infiammatori a livello dei vasi portali) (16,17).
L’ipertensione sinusoidale è legata a patologie epatiche croniche. Con la fibrosi epatica si ha una grave alterazione dell’architettura degli epatociti con ostruzione meccanica dei piccoli vasi intraepatici (18).
L’ipertensione intraepatica post-sinusoidale è associata a un danno dell’endotelio sinusoidale e degli epatociti nella regione centrolobulare che porta a fibrosi della vena terminale. In medicina veterinaria è di solito una condizione di natura idiopatica.
L’ipertensione portale post epatica nasce invece dall’ostruzione di grosse vene epatiche, della cava o dell’atrio di destra in caso di insufficienza cardiaca destra, pericarditi, ipertensione polmonare.
FIG. 2 :Rappresentazione schematica della classificazione anatomica dell’ipertensione portale(9).
L’ipertensione portale causata da lesioni vascolari stenotiche pre epatiche o postepatiche è causata da un aumento delle resistenze vascolari al flusso secondo la legge di Ohm. Un fatto scatenante è l’ostruzione meccanica causata da alterazioni nelle strutture epatiche ( fibrosi, capillarizzazione dei sinusoidi, presenza di microtrombi nella vasi intraepatici, formazione di noduli rigenerativi).
Nelle patologie epatiche la produzione dei mediatori dell’infiammazione e lo stress ossidativo causa una disfunzione a livello delle cellule
endoteliali sinusoidali che porta ad un’aumentata produzione ed una maggiore sensibilità ai vasocostrittori e una minore escrezione di vasodilatatori portando alterata distensione dei sinusoidi (9).
Clinicamente l’ipertensione portale può causare ascite. L’aumento di pressione veicola i fluidi al di fuori dello spazio vascolare, verso lo spazio interstiziale. Con il peggioramento della patologia epatica il volume ascitico aumenta anche perché si associa l’ipoalbunemia. La presenza di ascite è un fattore prognostico negativo nei cani con patologie epatiche croniche (19).
Un’altra conseguenza dell’aumento del gradiente pressorio portale è la formazione di shunt portosistemici acquisiti
.Si ristabiliscono connessioni vascolari embrionali tra la vena porta e la vena cava.
Tutte le tipologie di ipertensione portale possono portare alla
formazione di shunt acquisiti, tranne l’ ipertensione portale postepatica in cui non è presente una differenza di gradiente pressorio tra la
Gli shunt sono classificati in base alla sede anatomica. Nei piccoli animali la maggior parte sono connessioni tra la porta e la vena cava craniale. Nel cane si possono formare shunt dalla vena splenica che formano anastomosi con vene gonadali e sfociano nella vena cava caudale. Si possono poi formare piccoli vasi collaterali classificati a seconda della localizzazione in gastrofrenici, gastrici, omentali, varici coliche, gastrico sinistro.
I gatti tendono a formare shunt tra la vena gastrica sinistra e le vene frenico addominali e tra la vena colica destra e la vena gonadica sinistra.
L’encefalopatia epatica è una delle conseguenze dell’ipertensione portale. A causa della presenza degli shunt acquisiti le tossine e i prodotti della digestione by-passano il fegato entrano, senza essere metabolizzati, nella circolazione sistemica e raggiungono il cervello attraversando la barriera ematoencefalica. Questo causa lo sviluppo di sintomi neurologici soprattutto a livello del telencefalo con possibili alterazioni del comportamento, letargia, movimenti compulsivi, cecità, movimenti di maneggio, e a volte convulsioni.
La patogenesi dell’encefalopatia epatica non è ancora del tutto chiara, potrebbe essere dovuta alle aumentate concentrazioni di ammoniaca che agisce come neurotossina, ad alterazione dei neurotrasmettitori
aminoacidici, ad aumentate concentrazioni di sostanze endogene benzodiazepino-simili (20).
CAPITOLO 5
SHUNT PORTOSISTEMICI
Gli shunt portosistemici sono anomalie vascolari che deviano il sangue dal circolo portale alla circolazione sistemica, by-passando il fegato (21).
Gli shunt possono essere congeniti o acquisiti.
Abbiamo già visto che a causa di ipertensione portale cronica, si possono formare degli shunt acquisiti: multipli vasi tortuosi di solito localizzati vicino i reni.
Gli shunt congeniti sono vasi (solitamente singoli) che mettono in comunicazione la vena porta con la circolazione venosa sistemica (attraverso la vena cava o azigos).Sono il frutto della pervietà di comunicazioni fetali che non si vengono a chiudere con la nascita. Quando il sangue by-passa il fegato, vengono a dimiuire quei prodotti tropici come insulina e glucagone molto importanti per il fisiologico funzionamento degli epatociti; ne consegue uno sviluppo epatico scarso, una diminuita produzione di proteine, una disfunzione a livello
reticoloendoteliale, un metabolismo alterato di grassi e proteine fino ad atrofia e insufficienza epatica.
La gravità della sintomatologia negli animali con shunt portosistemici dipende dall’origine e dal volume di sangue che by-passa il fegato. Gli shunt portosistemici congeniti si possono localizzare all’esterno o all’interno del fegato.
Gli shunt extraepatici di solito originano dal tronco portale principale o dalle branche gastro-splenica o gastro-duodenale. Questi di solito sfociano nella vena cava caudale o nell’azygos, ma possono anche unirsi alle vene epatiche, vene renali, vena frenico-addominale, vena intratoracica o nella vena caudale intratoracica (22). Alcuni di questi (porto-azygos e portofrenici) causano nei soggetti interessati una
sintomatologia più lieve,forse a causa della compressione intermittente del diaframma.
Gli shunt intraepatici possono essere classificati a seconda della posizione in sinistri-, centrali- o destro-divisionali.
I sinistro-divisionali sono compatibili con la pervietà del dotto venoso, connessione fetale tra la porta e la cava caudale che si chiude dopo la nascita.
Cani con shunt intraepatici hanno una sintomatologia più grave che si manifesta ad un’ età più precoce, perché il volume di sangue che passa attraverso lo shunt è maggiore (23).
Approssimativamente il 25%-33% degli shunt sono intraepatici, il 66-75% extraepatici. Questi ultimi sono presenti soprattutto in cani di razze grandi (Irish Wolfhound, Retrievers, Pastore australiano), gli
extraepatici sono più comuni in razze piccole (Yorkshire terrier, Havanese, Maltese, Barboncino, Schnauzer nano)(24,25,26). Vista la tendenza di alcune razze, è stata ipotizzata una
predisposizione genetica alla presentazione degli shunt portosistemici. E’ stata vista una componente ereditaria negli Irish Wolfhounds, nei Cairn Terriers e negli Yorkshire Terriers. In questi ultimi ci sarebbe una componente multifattoriale come la penetranza incompleta e la
variabilità dell’espressione dei geni.
Nei Cairn Terriers è presente un’espressione genetica autosomica con variabilità di espressione comparabile con la displasia microvascolare. Nei levrieri irlandesi è stata trovata un’ereditarietà nella presentazione degli shunt intraepatici divisionali sinistri (27,28).
Di solito gli shunt congeniti vengono diagnosticati in animali molto giovani (1-2 anni di età), con anamnesi di crescita ritardata, piccola statura, difficoltà a prendere peso, comportamenti bizzarri. Alcuni cani
hanno una storia di ematuria, pollachiuria, stranguria o ostruzione urinaria (20%-53%).
La sintomatologia coinvolge 3 sistemi principali: il sistema nervoso centrale, l’apparato gastroenterico e l’apparato urinario.
I sintomi sono vari: letargia, scialorrea, confusione, atassia, demenza che si presentano spesso subito dopo i pasti. Sono spesso presenti diarrea, vomito, anoressia. La sintomatologia a carico dell’apparato urinario è legata alla diminuita conversione di ammoniaca in urea e di acido urico in allantoina, di conseguenza ci sarà una maggiore
escrezione renale di queste sostanze e la formazione di calcoli di urato di ammonio che causano spesso cistite (29).
Nella diagnosi vengono utilizzati come test di laboratorio i valori degli acidi biliari pre e post-prandiali: questi vengono sintetizzati nel fegato dal colesterolo, coniugati e raccolti nella cistifellea e dopo il pasto vengono secreti all’interno del duodeno intervenendo nell’ emulsione dei grassi e nel metabolismo e assorbimento dei lipidi. In alcuni studi è stata dimostrata una sensibilità del 100% nella diagnosi di shunt
portosistemici quando è presente un aumento degli acidi biliari postprandiali (30) anche se in caso di sospetti falsi negativi, è stato fatto un test di tolleranza dell’ammoniaca che ha dato sempre risultati anomali negli animali con shunt. Questo test ha delle limitazioni: la
minuti dal prelievo di sangue, ne consegue uno scarso utilizzo nella pratica ambulatoriale.
Il trattamento per queste anomalie vascolari è chirurgico attraverso una legatura dello shunt , o l’utilizzo di coil introdotti dalla giugulare per via interventistica.
CAPITOLO 6
ULTRASONOGRAFIA
L’ecografia è la metodica di più facile utilizzo per la diagnosi di anomalie vascolari epatiche vista semplicità di esecuzione e la non invasività.
Viene eseguito uno studio in B-mode e il doppler della vena porta. Il quadro ecografico in corso di shunt portosistemico congenito è
costituito da un fegato dalle dimensioni diminuite, reni dalle dimensioni aumentate, presenza di uroliti vescicali.
Si riesce spesso ad isolare lo shunt,anche grazie all’utilizzo del color doppler e a riconoscere cambiamenti di velocità del flusso portale, turbolenze a livello della vena cava.
L’esame ecografico può essere a volte compromesso da un fegato molto piccolo e dalla presenza di gas a livello intestinale.
L’ecografia è piu’ utile nel riconoscimento degli shunt intraepatici
rispetto a quelli extraepatici, poiché la presenza del parenchima epatico rende più favorevole l’identificazione dei vasi coinvolti.
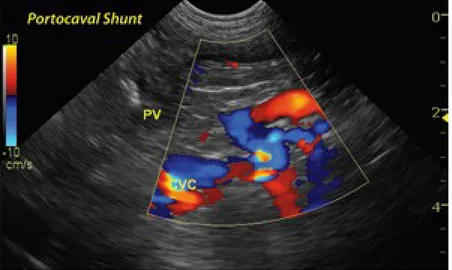
FIG 3: Cane di razza piccola con shunt portosistemico
extraepatico(splenocavale).La deviazione verticale del vaso rappresenta lo shunt localizzato all’entrata della vena splenica nella vena porta ma è deviato
FIG 4 : origine dello shunt con flusso dalla vena porta alla vena gastroduodenale.
E’ stato stilato da Szatmari un protocollo per l’ecografia del sistema portale nel cane con 7 piani di scansione ben definiti (2).
Il primo richiede il cane posizionato in decubito laterale sinistro, approcciando a livello di uno spazio intercostale caudale: una volta visualizzato il fegato, cranialmente al rene destro, si possono
individuare la vena porta, l’aorta e la vena cava in sezione trasversale. La vena cava può apparire più schiacciata.
FIG5 (2)
Il secondo piano di scansione permette di vedere l’inizio della branca destra della porta, angolando cranialmente la sonda.
FIG 6 (2)
Il terzo permette di studiare le possibili connessioni tra vena cava e vena porta : dalla scansione precedente si porta la sonda caudalmente visualizzando in un’unica immagine questi due vasi, a livello dell’origine dell’arteria mesenterica.
Nella quarta e nella quinta scansione viene visualizzata la vena porta e l’origine della branca destra e sinistra attraverso un approccio laterale ( dall’ultima costola la sonda viene inclinata cranialmente) o xifoideo.
FIG 7 (2)
Gli ultimi due piani vengono effettuati con l’animale in decubito laterale destro.
Nel sesto la sonda viene posizionata longitudinalmente dietro l’ultima costola sinistra:si dovrebbe isolare la vena porta a livello dell’ilo
epatico. Questa scansione è utile per individuare shunt congeniti extraepatici che originano dalla vena gastrica destra.
L’ultima scansione prevede un’immagine longitudinale della cava con la sonda posizionata ventralmente alle vertebre costali,caudalmente il rene sinistro: si individuerà l’entrata della vena renale nella cava.
Attraverso il primo piano di scansione vengono misurati in B-mode i diametri di vena porta, cava e aorta a livello dell’ilo epatico.
In alcuni tipi di shunt porto-cavali la dimensione della vena porta può essere indicativa della diagnosi:in animali con shunt extraepatici porto cavali essa è più piccola rispetto agli animali con displasia epatica microvascolare o normali, ha invece un diamentro maggiore nei cani con shunt intraepatico (31).
Si considera nella norma un rapporto vena porta:aorta (PV:aorta) da 0,7 a 1,25 . In animali con rapporto uguale o inferiore a 0,65 sono stati riscontrati shunt porto-cavali extraepatici o ipertensione portale
idiopatica non cirrotica (ipoplasia della vena porta) (8).
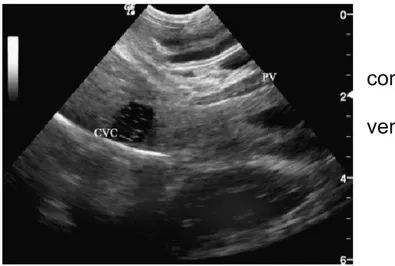
E’ stato utilizzato lo studio ecografico con microbolle, che può essere d’ausilio per il riconoscimento di shunt o la valutazione post- chirurgica di essi.Attraverso l’iniezione transplenica di soluzione salina agitata semplice o mista a sangue autologo eparinizzato si segue il percorso delle microbolle attraverso vena porta, vena cava caudale e atrio destro (32,33).
Fig. 8. Cane con shunt
(PV) e la vena cava caudale (CVC) vengono visualizzate con le microbolle all’interno.(32,33)
D’importanza fondamentale è lo studio doppler della porta.Viene
misurata la velocità di essa usando una scansione intercostale destra o xifoidea, viene isolata la vena a livello dell’ilo epatico attraverso una scansione longitudinale , il trasduttore viene diretto cranialmente per raggiungere un angolo d’incidenza minore di 60°.
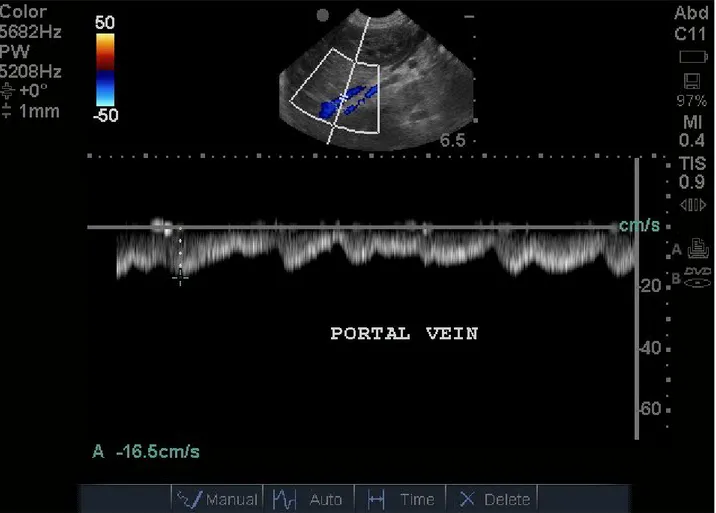
La velocità del flusso (PBFV portal blood flow velocity) della vena porta è lenta e quasi uniforme con piccole oscillazioni dovute al movimento respiratorio del diaframma ( la velocità aumenta durante l’ espirazione e viceversa diminuisce durante l’inspirazione).
La PBFV media in cani sani è da 10 a 25 cm/sec con variabilità legate al peso (16,95+- 5,79 cm/sec in cani fino a 10 Kg; 16,98+- 3,04 cm/sec in cani tra 10,1 e 20 Kg; 17,39+-4,77 cm/sec in cani di peso uguale o superiore a 20,1 Kg (3).
FIG 9: Flusso portale normale.
La PBFV media nei gatti è tra 9,7 cm/sec a 18,1 cm/sec (34 ,31). Il flusso portale medio (PBF)viene misurato moltiplicando l’area della sezione trasversa (cm2 ) della vena porta per la PBFV (cm/sec)media
dividendo per il peso corporeo(Kg), esso aumenta dopo il pasto mentre l’esercizio fisico può diminuire il flusso della porta.
Il PBF è stato riportato essere, in quattro studi di 31+-9ml/min/kg, 40,9+- 13 ml/min/kg , 33,8+-1,2 ml/min/kg,51,7+-20,55 ml/min/kg in cani che pesano fino a 10 Kg (35,36,37 ); 38,28+-8,15 ml/min/kg in
cani che pesano tra 10,1 e 20Kg e 32,19+-13,23 ml/min/Kg in cani di peso superiore ai 20 Kg .
L’indice di congestione della vena porta (CI) è una misura della resistenza vascolare che può aumentare in caso di cirrosi o
ipertensione portale. Essa si determina dividendo l’area della sezione trasversa della vena porta (cm2) per la media della velocità del flusso
ematico (cm/sec) (38).In cani sani il CI è di 0,04+-0,015 cm/sec (35). In caso di shunt portosistemici intraepatici il 70% dei soggetti mostra un aumento della PBFV e pattern anomali di flusso. In caso di shunt
extraepatici, se il flusso è misurato tra l’origine dello shunt e l’ingresso della vena gastroduodenale, è stato riscontrato un flusso ridotto o invertito. Il flusso epatofugale è causato dal sangue che scorre dalla vena gastroduodenale verso lo shunt. Se invece misuriamo la velocità caudalmente allo shunt, il flusso portale sarà aumentato.
In caso di ipertensione portale idiopatica, cirrosi e fibrosi epatica, si ha una riduzione di PBFV e PBF e un aumento del CI.
La PBFV media in 10 cani con cirrosi epatica indotta sperimentalmente era molto ridotta (9,2 cm/sec) cosi come il PBF medio 17,2 ml/min/kg; il CI risultava invece di 0,06+-0,018cm x sec (37,35).
Spesso l’ecografia non basta per una corretta localizzazione degli shunt e ,soprattutto prima della chiusura chirurgica vengono usati altri
CAPITOLO 7 RADIOGRAFIA CON CONTRASTO
La portografia è il metodo ottimale per la localizzazione e la morfologia degli shunt.
Questa tecnica prevede l’utilizzo di un mezzo di contrasto e lo studio vascolare attraverso un fluoroscopio. Nella portografia mesenterica viene iniettato mezzo di contrasto in una vena digiunale isolata tramite laparotomia.
FIG 10: esempio di portografia mesenterica. La prima foto mostra una norma opacificazione della vena porta. La seconda uno shunt
extraepatico congenito. La terza foto mostra shunt extraepatici acquisiti. (39)
In alternativa attraverso l’arteria femorale si inserisce un catetere fino alla arteria mesenterica craniale dove viene iniettato il mezzo di
contrasto che dopo aver passato i vasi intestinali arriva alla vena porta. Questo metodo è meno utilizzato perché è necessaria la fluoroscopia per un lasso maggiore di tempo,.
Un’altra metodica, che non prevede un approccio chirurgico, è la splenografia percutanea ecoguidata con la quale però gli shunt extraepatici non vengono visualizzati se la comunicazione tra vena porta e cava è posta più caudalmente rispetto alla vena splenica. (39,40).
CAPITOLO 8 SCINTIGRAFIA
La scintigrafia è un esame non invasivo nel quale un radioisotopo viene a distribuirsi selettivamente in un organo e viene rilevato attraverso una camera gamma . L’immagine che si ottiene rappresenta più che la struttura, la funzionalità dell’organo.
Per la portoscintigrafia un materiale radioattivo (Tecnezio pertecnetato) viene inserito tramite il retto nel colon e passa attraverso le vene
coliche nella circolazione portale (39).
Una tecnica alternativa è l’iniezione dell’isotopo (99MTCO
4) in una vena
splenica per via ecoguidata (41).
In un paziente normale la vena porta e il fegato vengono visualizzati dopo 10-14 secondi dall’immissione del tecnezio e poi passano altri 8-14 secondi perché passi dai sinusoidi alle vene epatiche,vena cava e cuore.
Se è presente uno shunt, l’isotopo by-passa il fegato ed arriva direttamente al cuore. In questo caso viene calcolata la frazione di shunt per studiare la quantità di sangue che by-passa il fegato (40). Con la scintigrafia non abbiamo d’altro canto, informazioni riguardo la morfologia dei vasi animali, la localizzazione e il numero di essi.
FIG 11: Scintigrafia
transplenica in un cane sano. Il radioisotopo è attivo nella milza e nel fegato, manca attività nel cuore.
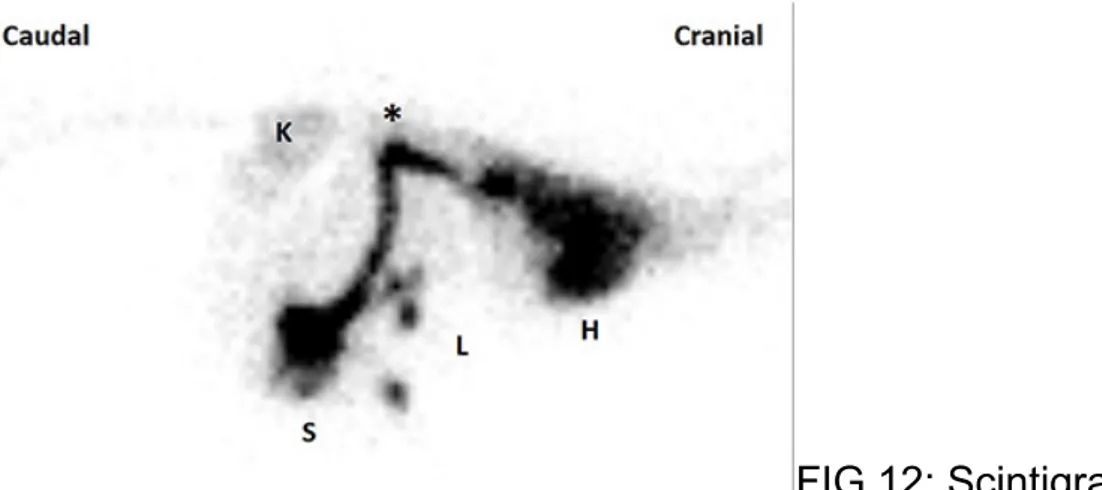
FIG 12: Scintigrafia
transplenica in un cane con PSS. Il radioisotopo dalla milza passa poi dorsalmente e cranialmente per arrivare direttamente al cuore.(42)
CAPITOLO 9 ANGIO-TC
L’angio-TC è considerato il gold standard per a valutazione del sistema portale in medicina umana (43). Anche se con l’angiografia si riescono ad ottenere buone immagini, la TC è meno invasiva e di più semplice ad attuarsi.
La dual-phase TC da informazioni più complete rispetto a una single-phase TC: permette acquisizioni dell’addome in sezione trasversa prima nella fase arteriosa e poi portale, consentendo di separare i due distretti.
L’interpretazione di queste immagini è coadiuvata da moderni programmi che consentono ricostruzioni tridimensionali.
FIG 13: AngioTC della sezione trasversale dell’addome di uno shunt extraepatico porto-azygos a livello dello stomaco, cranialmente
all’origine dello shunt nella vena porta. Un vaso aberrante è
visualizzato medialmente allo stomaco e ventralmente rispetto all’aorta. Aorta(ao), azygos (Az) , Shunt ( *), vena porta (p) , vena cava caudale (47).
CAPITOLO 10
RISONANZA MAGNETICA
La risonanza magnetica è una procedura largamente utilizzata in medicina umana e veterinaria .
In particolare l’angio-Rm permette di utilizzare meno mezzo di contrasto rispetto l’angio tc e non vengono utilizzate radiazioni ionizzanti.
Esistono tre tecniche: time-of-flight Mra; risonanza magnetica con contrasto di fare e risonanza magnetica con ecocontrasto
(44).Quest’ultima si è rilevata essere la migliore per lo studio della vena porta e per la visualizzazione degli shunt (45).
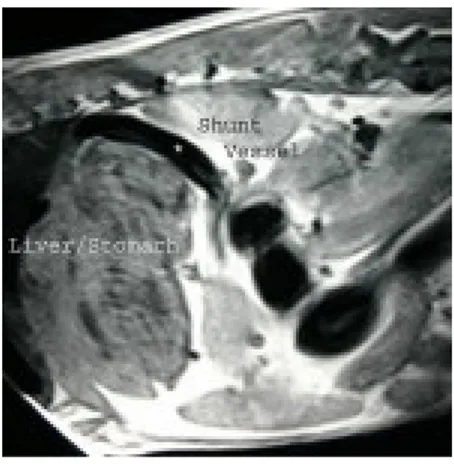
FIG 14: immagine trasversa di un soggetto con shunt portocavale con
dilatazione post shunt.
FIG 15: Immagine sagittale di uno shunt che passa dorsalmente allo stomaco e si inserisce nella vena porta cranialmente al diaframma.
CAPITOLO 11 MATERIALI E METODI
In questo studio sono stati inclusi 16 cani di diverse razze, peso, età e sesso, reclutati presso l’Ospedale Veterinario didattico della facoltà di medicina veterinaria di Messina e l’ambulatorio “Jasper” di Palermo. Gli animali sono stati considerati soggetti sani in base a visita clinica, esami ematologici e biochimici.
L’esame ecografico è stato effettuato da due operatori (dott.ssa Paola Mantineo, prof. Massimo De Maio) con l’utilizzo di due macchine: Esaote 30gold e MyLab 40 Vet.
E’ stata utilizzata una sonda microconvex da 5-8 MHz.
I pazienti sottoposti a un digiuno di almeno 12 ore, vengono sottoposti alla somministrazione di farmaci anestetici e/o sedativi per fini
diagnostici e/o chirurgici. Nella stessa sede si effettuano due ecografie per soggetto: la prima all’arrivo in clinica e l’altra in
sedazione/anestesia.
I soggetti sono divisi in due gruppi in base ai protocolli farmacologici utilizzati:
Gruppo A: Acepromazina (PrequillanR, Fatro): 0,5 mg/kg, Propofol
(PropovetR, Ecuphar): 4mg/kg IV
Vengono eseguite due scansioni ecografiche per ogni ecografia per ciascun animale.
La prima scansione viene eseguita con il soggetto in decubito laterale sinistro, la sonda posizionata a livello dell’ultimo spazio intercostale e, una volta visualizzato il rene destro, ci si sposta cranialmente fino a individuare, a livello dell’ilo epatico, la vena porta e la vena cava in sezione trasversale (2).
La seconda scansione viene effettuata spostando la sonda
cranialmente e angolandola per ottenere un’immagine longitudinale della branca destra della vena porta. Si otterrà tramite il color Doppler un flusso in avvicinamento. Con questa tecnica si raggiungerà un angolo di insonazione minore, essenziale per l’accuratezza della misurazione della velocità portale (3).
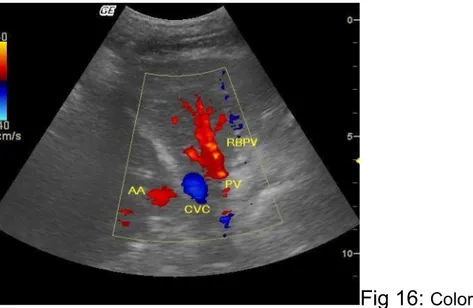
Fig 16: Color doppler della branca destra della vena porta. Si nota il flusso di colore rosso in avvicinamento.PV:vena
Una limitazione all’esame doppler è stata lo stato dispnoico o di agitazione di alcuni soggetti.
I dati presi in considerazione sono:
a) il diametro trasversale della vena porta, b) l’area calcolata con la formula:
A=(D)
2
× π 4
A=area vena porta; D=diametro vena porta
c) la velocità media portale (velocità massima x 0,57), d) l’indice di congestione: CI (cms)= A (cm 2 ) Vmedia(cm/s)
min cm/¿× A(cm2)
¿
Vmedia¿
PBFV =¿
PBFV: volume portale; W=peso corporeo.
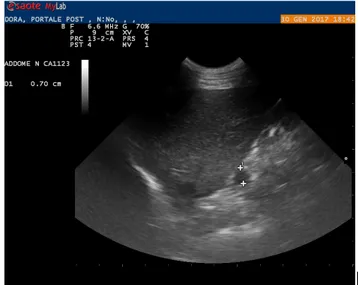
Fig. 17: Misurazione del diametro portale a livello dell’ilo epatico .
CAPITOLO 12 RISULTATI
I dati sono stati analizzati attraverso il software STATA, mediante F-test. I cani presi in considerazione erano per lo più soggetti giovani e di sesso femminile: nel Gruppo A, 10 soggetti al di sotto dei 3 anni e uno di sei anni,
I parametri studiati sono risultati essere molto simili prima e dopo l’anestesia. Tabella 1 Gruppo A Diametro porta (cm) Area porta (cm2) Vel media (cm/sec) CI (cmsec) PBFV (ml/min/kg) Pre 0.72 0.16 0.45 0.16 12.12 2.99 0.03 0.01 31.80 12.57 Post 0.70 0.15 0.40 0.16 12.17 3.46 0.03 0.01 27.72 11.48 Tabella2 Gruppo B Diametro porta (cm) Area porta (cm2) Vel media (cm/sec) CI (cmsec) PBFV (ml/min/kg) Pre 0.84 0.08 0.50 0.12 11.11 2.98 0.046 0.20 25.82 8.56 Post 0.79 0.22 0.47 0.27 10.26 3.58 0.04 0.01 20.36 8.77
Tab. 1-2 : descrizione delle medie (± SD) delle variabili ottenute tramite ecografia e doppler della vena porta, prima e dopo la somministrazione dei farmaci. Gruppo A: Acepromazina + Propofol. Groppo B : Tiletamina-Zolazepam.
Il propofol è un anestestico con azione rapida e breve durata, utilizzato per la fase di induzione anestesiologica. Studi precedenti hanno indagato gli effetti emodinamici del Propofol: è stata documentata una diminuzione della pressione arteriosa, un aumento della frequenza cardiaca e del flusso coronarico, ma nessuno effetto è stato dimostrato a livello della vena porta durante i 20 minuti di anestesia (5).
Non sono presenti studi riguardo la sua associazione con Acepromazina. Quest’ultimo farmaco, somministrato da solo ha una spiccata azione
ipotensiva (vasodilatazione periferica), che determina una diminuzione del postcarico.
La sedazione con tiletamina-zolazepam comporta un aumento significativo della frequenza e della gittata cardiaca. Subito dopo la sua
somministrazione determina inoltre un aumento della pressione arteriosa, che poi torna ai valori basali, e un aumento delle resistenze periferiche.
Non sono stati trovati lavori riguardo gli effetti di questo farmaco a livello del sistema portale (46).
Con questo studio possiamo ipotizzare che questi due protocolli non causano alterazioni emodinamiche a livello del flusso portale, ma visto il numero ristretto di soggetti presi in considerazione, quanto detto andrebbe confermato su un maggior numero di casi.
BIBLIOGRAFIA
1. D.Pennick “Atlas of small animal ultrasonography”.
2. Szatmari V et al “Standard planes for examination of the portal system in
dogs”JAVMA 2004.
3. Sartor R. et al.”Hemodynamic evaluation of the right portal vein in
4. Frink EJ et al. “ The effects of sevoflurane,halothane,enflurane, and
isoflurane on hepatic blood flow and oxygenation in chronically instrumented greyhound dogs” Anestesiology 1992.
5. Wouters PF et al.” Hemodynamic changes during induction of anesthesia
with elotanolone and propofol in dogs.”Anesth Analg 1995.
6. G.V. Pelagalli, V.Botte Anatomia veterinaria sistematica e comparata. 7. Lautt Conceptual review of the hepatic vascular bed. Hepatology 1987. 8. C.B.Lamb doppler measurement of hepatic arterial flow in dogs:
technique and preliminary findings.1999.
9. S.Buob Portal Hypertension:Pathophysiology,Diagnosis and
Treatment.2011.
10. N.Toubia “ Portale Hypertension and variceal Hemorrage” Med Clin 2008.
11. Schmidt s et al. “ Indirect and direct determination of portal vein
pressure in normal and abnormal dogs and normal cats” Vet Rad 1980.
12. Bosch j et al “ The clinical use of HVPG measurement in chronic liver disease” Nat rev Gastroenterol Hepatol 2009.
13. Bosch j et al “ Hepatic endothelian dysfunction and abnormal angiogenesis: new target in the treatment of portal hypertension” J Hepatol 2010.
14. Fisher AJ et al. “Doppler sonography of the portal vein and hepatic artery:measurement of a prandial effect in healthy subjects” Radiology 1998.
15. Saztmari “Portal hypertension in a dog due to circumscribed fibrosis of the wall of the extrahepatic portal vein” The Veterinary Record 2011.
16. James F. “ Ascites due to pre-sinusoidal portal hypertension in dogs : a restrospective analysis of 17 cases” Aust Vet 2008 .
17. Brown DL “ congenital hepatic fibrosis in 5 dogs”Vet Pat 2010.
18. Iwakiri y et al “ The hyperdinamic circulation of chronic liver
disease: from patient to the molecule” Hepatology.
19. Raffan E “ Ascites is a negative prognostic indicator in chronic hepatitis in dogs “ J Vet Intern Med 2009.
20. G.Gandini “Encefalopatia epatica secondaria a shunt portosistemico congenito nel cane :aspetti clinici,neurologici, laboratoristici e postoperatori in 17 casi” veterinaria 1999.
21. Tobias KM “ Portosystemic shunts and other hepatic vascular anomalies “ Textbook of small animal surgery 2003.
23. Howe Lm “Diagnosis and treating portosystemic shunts in dogs and cats” Vet Med 2002.
24. Winkler JT “Portosystemic shunts: diagnosis,prognosis and treatmente of 64 cases” J Am Anim Hosp Assoc 2003
25. Berent A “ Porotsystemic shunts and portal venous hypoplasia. Standards of Care “ Emergency and Critical Care Medicine 2007. 26. Mathews KG “Vascular Liver Diseases “ Textbook of veterinary
internal medicine 2005. 27. Meyer et al 1995.
28. Kerr and van Doorn 1999.
29. D.Paepe “Portosystemic shunts in dogs and cats: definition, epidemiology and clinical signs of congenital portosystemic shunts” 2007.
30. Center SA et al. “ Evaluation of twelve-hour preprandial and two hour postprandial serun bile acid concentrations for diagnosis of
hepatobiliary disease in dogs” Jam Vet Med 1991.
31. Marc-andè D’anjou et al. “ Ultrasonographic diagnosis of
portosystemic shunting in dogs and cats” Vet Rad & Ultrasound 2004. 32. Gomez-ochoa P et al “ Ultrasonographic apperance of the
intravascular transit of agitated saline in normal dogs following ultrasound guided percutaneous splenic injection.” Vet Radiology
33. Gomez-Ochoa P et al. “ Use of transsplenic injection of agitated saline and heparinized blood for the ultrasonographic diagnosis of macroscopic portosystemic shunts in dogs “ Vet Radiology Ultrasound 2011.
34. Lamb CR et al. “ Ultrasonography of portoyistemic shunts in dogs and cats” Vet Clin North Am Small Anim Pract 1998.
35. Nyland et al. “Evaluation of experimentally induced canine hepatic cirrhosis using duplex Doppler ultrasound” Vet Radiol 1990.
36. Lamb CR et al. “ Comparision of 3 methods for calculating portal blood flow velocity in dogs using duplex-doppler ultrasonography” VetRadiol Ultrasound 1994.
37. Mwanza T et al. “ ULtrasonographic evaluation of portal vein hemodynamics in experimentaly bile duct ligated dogs” Jpn J Vet Res 1998.
38. F.Moriyasu “ Congestion index of the portal vein”AJR 1986. 39. Lamb CR et al. “ Diagnostic imaging of dog with suspected
portosystemic shunt” 2002.
40. AC Berent. “ Portosystemic vascular anomalies” Vet Clin Small Anim 39 2009.
41. Morandi F. et al. “Use of 99MTCO
4 transplenic portal scintigraphy for dagnosis of portosystemic shunts in 28 dogs” Vet Radiol Ultrasound 2005.
42. Tsai S. “Imaging of congenital shunt”.
43. Henseler KP et al. “Three-dimensional CT angiography of spontaneous portosystemic shunts” Radiographics 2001.
44. I.Foltin et al “Magnetic resonance angiography: a comparision of techniques and applications in dogs and humans” Tierartzl Prax 2008. 45. A.Bruehschwein “Contrast enhanced magnetic resonance
angiography for diagnosis of portosystemic shunts in 10 dogs” Vet Radiol & Ultrasound 2010.
46. Helliyer P. “Cardiorespiratory effects of the intravenous administration of tiletamine-zolazepam to dogs” Ver Surg 1989.
47.
M.Laitinen “Novel Technique of Multislice CT Angiography for Diagnosis of Portosystemic Shunts in Sedated Dogs”Open Journal of Veterinary Medicine, 2013.