Colture cellulari
Cellule che si moltiplicano “in vitro” per una o più generazioni, utilizzate nella ricerca come modello sperimentale in innumerevoli tipi di esperimenti.
Sono utilizzate per analizzare l'effetto di farmaci e verificare tossicità, mutagenicità e cancerogenicità delle sostanze. Vengono inoltre utilizzate come modello in cui studiare effetto dell'espressione di particolari geni.
Vantaggi:
! Controllo condizioni ambientali ! plasticità dei modelli
! Caratterizzazione ed omogeneità ! Economicità e rapidità risposta ! Riduzione sperimentazione in vivo
Svantaggi:
• Perdita di funzioni organo-specifiche e di alcune attività enzimatiche
• Accelerazione del ciclo cellulare • Alterazioni morfologiche e delle proprietà antigeniche
Colture a termine (Colture Primarie)
La coltura da espianti viene definita coltura a termine
per indicare che le cellule isolate da qualsiasi tessuto
animale sono in grado di compiere un
numero finito di
divisioni
cellulari in vitro per poi andare incontro a
degenerazione e morte.
Colture continue (Linee Cellulari)
Sono cellule in cui mutazioni spontanee o indotte hanno
annullato il programma genetico della senescenza.
Possono essere coltivate in vitro per un tempo indefinito
TIPO DI
PREPARAZIONE SISTEMI INTATTI D’ORGANO COLTURE PRIMARIE COLTURE CELLULARI LINEE
Alterazioni rispetto
alla situazione in vivo 0 ++ +++ ++++
Livello organizzazione tissutale ++++ ++++ + 0 riproducibilità ++++ ++++ + ++++ accessibilità + ++ +++ ++++ Manipolazioni genetiche + + + +++ Alterazioni genetiche per mutazione o selezione + + Da + a ++++ Controllo ambientale + ++ ++++ ++++
Colture cellulari
ADERENTI
SEMI-ADERENTI SOSPENSIONE
L’adesione è un fenomeno attivo che richiede l’interazione dei recettori di membrana, le integrine, con le proteine adesive, quali la fibronectina, adsorbite sulla piastra di coltura.
Colture cellulari: tipologie
cellule fusiformi fibroblasti cellule poligonali
Colture di cellule aderenti
Le cellule aderenti vengono poste in piastra o in fiasca e crescono fino ad occupare l’intera superficie disponibile.
Piastra da 6cm di diametro: 25 cm2
Piastra da 10cm di diametro: 55cm2
Fiasche piccole: 25 cm2
Fiasche grandi: 75cm2
Le piastre per colture cellulari aderenti sono in polistirene ma sono trattate per renderle idrofile e cariche negativamente. In tal modo il polistirene lega stabilmente la fibronectina e la vitronectina presenti nel siero che permettono l’adesione di diversi tipi di cellule.
Dove trovare le linee cellulari:
• Produzione in laboratorio
• Banche cellule
– American Tissue Culture Centre (USA) (www.atcc.org)
– European Collection of Cell Culture (www.hpacultures.org.uk)
– National Cell Culture Center (USA) (www.nccc.com)
– German Collection of Microorganism and Cell Culture (www.dsmz.de)
– IZS Centro Substrati Cellulari (www.bs.izs.it)
– IST Servizio Biotecnologie (www.biotech.ist.unige.it)
Fabbisogni nutrizionali/ambientali
• Terreni
• Reagenti
• Siero
• pH
• Temperatura
• Umidità relativa
• O
2
, %CO
2
Terreni di coltura più usati
• Eagle’s Basal Medium (BME, EMEM)
• Minimum Essential Medium (MEM)
• Dulbecco’s Modified Eagle’s Medium (DMEM)
• Nutrient Mixture F-10 (HAM’s F-10) e Nutrient
Mixture F-12 (HAM’s F-12)
• DMEM/HAM’s F-12
• Medium 199
• NCTC Medium
• RPMI 1630 Medium
• RPMI 1640 Medium
Questi terreni differiscono tra loro per il contenuto in
a.a. e sali e per la concentrazione di glucosio
Terreni: composizione
Amminoacidi
Arginina Cistina Glutammina Istidina Isoleucina Leucina Lisina Metionina Fenilalanina Treonina Triptofano Tirosina ValinaVitamine
Biotina Colina Folato Nicotinammide Pantotenato Piridossale Tiamina RiboflavinaSali
NaCl KCl NaH2PO4 NaHCO3 CaCl2 MgCl2Vari
Glucosio Rosso Fenolo Penicillina Streptomicina Siero NEAA Sodio Piruvato MEM Glutammina• Formulazione aspecifica di fattori di crescita • Sostegno alla crescita per molti tipi cellulari • Aumenta la capacità tampone
• Protegge dai danni meccanici • Facilita l’adesione
Siero
Bovino (FBS, FCS, NCS)Cavallo (DHS)
Prima del suo utilizzo, il siero viene disattivato in stufa a 56°C per 30’ allo scopo di eliminare il Sistema del Complemento, che potrebbe interferire con la crescita delle cellule.
I terreni sono provvisti dell’indicatore rosso fenolo
7.3
6.8-7.0
> 7.6
pH
Il colore viola indica che le cellule non sono metabolicamente attive o che la regolazione della CO2 è errata.
Terreni: indicatore
Con il proliferare delle cellule il terreno tenderà al giallo a causa dell’acidificazione prodotta dalla CO2 proveniente dal metabolismo cellulare.
L’equilibrio di dissociazione del sistema tampone HCO3-/H
2CO3 è descritto dalla
legge d’azione di massa, espressa come equazione di Henderson-Hasselbach, nella quale l’H2CO3 è inserito sotto forma di pCO2 moltiplicata per un coefficiente di solubilità della CO2 in H2O (si ottiene un dato in mEq/L)
HCO
3-0.0301 pCO
2pH = 6.1 + log
CO
2+ H
2O
H
2CO
3HCO
3-+ H
+CO
2
e pH
La pressione parziale di CO2 usata nella coltura delle cellule corrisponde alla pCO2 misurata all’interno dei tessuti (35-45 mmHg). In questo modo l’incubatore riproduce rigorosamente le naturali condizioni di sviluppo delle cellule.
Zavizion et al., 1996 Doubling Time, h
33°C 37°C 39
BME-UV1 cells 52-54 22-24 36-38
Crescita e Temperatura
Le cellule possono sopportare l’ipotermia (sono conservate congelate) ma la loro attività metabolica è notevolmente disturbata.
Non possono sopportare l’ipertermia (anche piccoli aumenti di temperatura per brevi periodi possono far morire le cellule).
Una temperatura di 43°C per pochi minuti provoca la morte per apoptosi.
L’umidità relativa RH è un parametro che è portato ad un livello elevato (RH >98%) senza necessariamente essere
controllato. L’energia fornita
dall’incubatore serve sia a mantenere la temperatura che ad evaporare l’acqua dall’apposito vassoio per portare il livello di umidità relativa alla giusta percentuale.
L’obiettivo è di limitare l’evaporazione dell’acqua contenuta nei terreni di coltura per non provocare un aumento della pressione osmotica.
Disidratazione del terreno di coltura: ogni punto corrisponde ad una apertura della porta
dell’incubatore
Miniaturizzazione supporti di crescita e RH
Piastra a 96 pozzetti: disidratazione del terreno di coltura dopo 72 h (% di
Colture di cellule aderenti
Le cellule aderenti vengono poste in piastra e crescono
fino ad occupare l’intera superficie disponibile
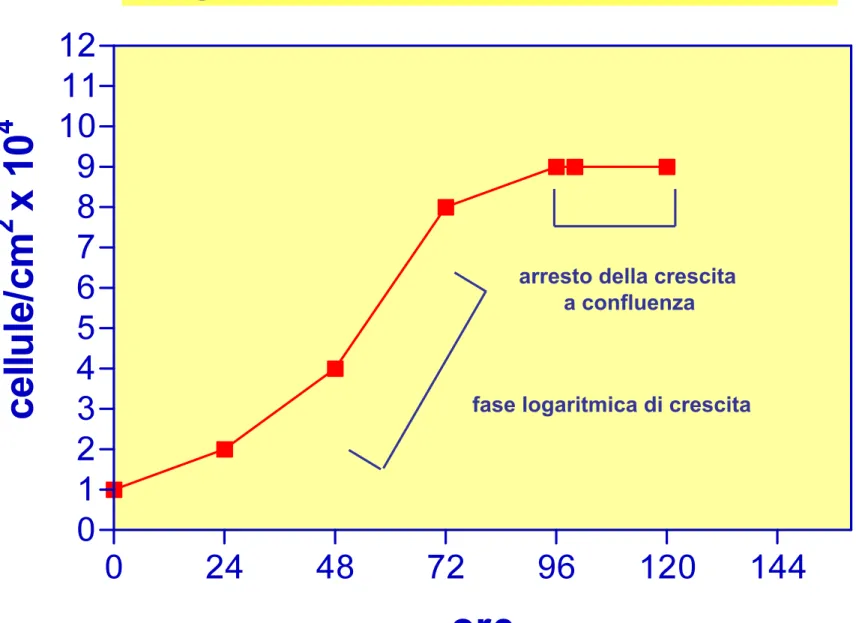
Coltura confluente
A confluenza la crescita si arresta e le cellule devono essere
trasferite in nuove piastre
72h 48 h
Diagramma di crescita cellulare in vitro
arresto della crescita a confluenza
Subcolture Routine
conteggio 37°C, 5% CO2, 100% umidità, 3-5 giorni esperimento Tripsina 0.05% EDTA 0.53 nM congelamento scongelamento seminaPrevenzione della contaminazione
Sono possibili differenti tipi di contaminazione
I principali tipi di contaminanti microbici :
Batteri e funghi Micoplasma
Virus
La contaminazione può avvenire: Errore dell’operatore
Terreni contaminati
Cappa a flusso laminare non funzionante Incubatore contaminato
Precauzioni per la prevenzione delle contaminazioni:
1) I terreni e le soluzioni che si usano devono essere tutti sterili
2) Aggiungere penicillina-streptomicina per scongiurare il pericolo di contaminazioni da batteri; anfotericina B (se non tossica per le cellule) contro i miceti.
3) Destinare il laboratorio solo alle colture cellulari 4) Operare sempre sotto cappa a flusso laminare
5) Utilizzare solo materiale sterile (di vetro o di plastica) 6) Utilizzare sempre pipettatori elettrici
7) Pulire bene la cappa a inizio e fine lavoro
8) Controllare periodicamente i filtri della cappa
9) Mantenere con attenzione ben pulito l’incubatore a 37°C
Il laboratorio per le colture cellulari
incubatore cappa
centrifuga
Test di vitalità cellulare e Citotossicità
La citotossicità è la proprietà di una sostanza di produrre a
livello cellulare un qualche effetto tossico che si manifesta
sottoforma di deviazioni dalla normale morfologia e
funzionalità cellulare. I test di citotossicità rappresentano
un “metodo di valutazione“ dei danni biologici provocati
dalle sostanze.
Test più diffusi:
Trypan Blue
MTT
Test di vitalità cellulare
Saggio con il Trypan Blue
Il Blu Tripano è un colorante utilizzato nel test di determinazione della vitalità cellulare. Questo colorante permette di discriminare tra le cellule vitali e quelle morte in quanto è assunto solo dalle cellule morte.
A= media delle cellule vive B= media delle cellule morte C= fattore di diluizione
D= fattore di conversione in ml Concentrazione cellule vive= A*C*D Concentrazione cellule morte=B*C*D
Volume della conta = 0,1x 1 mm2=0,1 mm3
Fattore di conversione= 104
Punti cruciali
" Un’adeguata accuratezza della misura si ottiene contando almeno
100 cellule
" Il Trypan blue è tossico ed è un potenziale cancerogeno
" Le cellule devono essere ben distinte e uniformemente distribuite " Evitare la presenza di bolle e detriti
" Non riempire eccessivamente la camera
" Se le cellule sono poche, operare una nuova centrifugazione e
risospendere in meno terrreno
MTT
(giallo)
Formazano
(azzurro)
Il saggio MTT è un saggio colorimetrico standard per la misurazione dell'attività degli enzimi che riducono l‘MTT (bromuro di 3-[4,5-dimetiltiazol-2-il]-2,5-difenil tetrazolio) a formazano, conferendo alla
sostanza un colore blu/violaceo. L'enzima mitocondriale succinato deidrogenasi (reduttasi), è attivo infatti soltanto nelle cellule vive e la sua funzione consiste nel tagliare l'anello di tetrazolio dell‘ MTT (sostanza di colore giallo) con la formazione, di conseguenza, di formazano (blu).
Tale reazione è valutata e misurata mediante la lettura spettrofotometrica del campione, alla lunghezza d'onda di 570 nm. Ciò accade prevalentemente nei mitocondri; questo saggio può essere utilizzato per determinare la citotossicità di farmaci o altri tipi di sostanze chimicamente attive e potenzialmente tossiche.
Un test di citotossicità sfrutta una reazione che normalmente avviene all’interno delle cellule. L’enzima Lattato Deidrogenasi (LDH) è un enzima
Saggio di Citotossicità
LDH
LDH
normalmente presente nel citoplasma delle cellule e catalizza la reazione di trasformazione del lattato in piruvato.
In seguito ad un danno alla parete cellulare l’enzima LDH dal citoplasma si riversa all’esterno della cellula, e nel caso di cellule in vitro, nel mezzo di coltura.
Il test di citotossicità accoppia alla reazione dell’enzima Lattato Deidrogenasi una reazione contraria dove il substrato è un composto profluorescente (la Resazurina) che viene trasformato dall’enzima Diaphorase in un composto fluorescente (la Resorufina).
Eccitato a 560 nm
Emissione a 590 nm
Trasfezione
DNA
TRASFEZIONE
Non virale
INFEZIONE
virale
Transiente Stabile
Linee ingegnerizzate:
Linee transfettate con un gene di interesse(es. espressione di particolari recettori, modificazione di vie metaboliche, ecc)
Trasfezione
Transiente:
Si usa per saggi a breve termine o quando non è possibile ottenere cloni
stabili
Stabile:
si usa quando si devono fare esperimenti di lunga durata, quando si vuole maggiore
riproducibilità o quando l’efficienza di trasfezione in transiente è troppo bassa.
HBS 2X DNA + CaCl2 Coprecipitato DNA/Fosfato di Calcio
Principali metodiche di trasfezione di cellule di mammifero
Il coprecipitato
si deposita sulle cellule e viene fagocitato
Il DNA entra nel nucleo e il gene estraneo viene
espresso
1) Precipitazione con Fosfato di Calcio
! NO attrezzature particolari ! Reagenti facilmente
disponibili e a basso costo ! OK diversi tipi cellulari ! OK trasfezioni stabili
2) Lipofezione 3) Elettroporazione
Per staccare le cellule dal fondo si utilizza una soluzione di
EDTA e tripsina
EDTA
= chela il Ca
++ed il Mg
++indispensabili per l’adesione
Tripsina
= degrada le proteine della matrice che
mantengono le cellule aderenti.
Le cellule staccate devono essere riseminate in numero
adeguato: non crescono in modo efficiente e vanno incontro
Conteggio
Camera di Burker
1 mm
Crioconservazione delle colture cellulari
Banca Cellulare
Indicazioni generali:• Congelamento lento (pochi gradi al minuto)
• Scongelamento rapido (subito a 37 °C)
• Vitalità superiore al 90%
• Cellule in fase di crescita logaritmica
• Alta percentuale di siero (>20%)
• Criopreservante: DMSO (10%) o glicerolo
• Conservazione a T < -135°C (vapori di azoto, o azoto liquido)