CAPITOLO VI
TERAPIA DELLE TENITI
Come già precedentemente detto, le lesioni a livello delle strutture teno-legamentose degli arti sono frequenti tra i cavalli atleti e spesso comportano il ritiro dell’animale dall’attività sportiva, visti i lunghi tempi di guarigione, la frequenza con cui si manifestano recidive, e la difficoltà oggettiva dell’animale a tornare ai livelli agonistici precedenti.
La tendinite, infatti, provoca una permanente alterazione della composizione molecolare e delle proprietà biomeccaniche del tendine. Inoltre, le strutture teno-legamentose hanno un processo riparativo lungo, vista l’elevata percentuale di collagene e il ridotto numero di cellule. Se l’equilibrio fra la degradazione della matrice vecchia o danneggiata e la produzione di quella nuova viene a mancare, si avrà l’accumulo di aree di lesione all’interno del tendine, che potrà facilmente esitare in una lesione tendinea (Dahlgren, 2005).
Negli anni sono stati sviluppati molti protocolli terapeutici, ma non tutti di comprovata efficacia. In generale si ricorda che la scelta del tipo di terapia è influenzata da diversi fattori, tra i quali la gravità della lesione, l’età, la razza, il tipo di lavoro che il cavallo svolge e, non ultimo, il suo valore economico. Nello scegliere il protocollo terapeutico adatto ad ogni caso si deve ricordare che gli obiettivi sono quelli di diminuire la risposta infiammatoria locale, ridurre al minimo la formazione di tessuto cicatriziale e aderenze fibrose che compromettono la funzionalità tendinea, promuovere la riparazione della normale struttura del tendine, riempiendo l’area della lesione con fibroblasti che producono collagene e che maturano fino a sviluppare una adeguata elasticità e resistenza alla trazione. Ogni schema terapeutico si deve necessariamente adattare alla fase di riparazione che si rinviene nel tessuto interessato da lesione.
Nella riparazione del tendine si possono infatti distinguere tre fasi:
- fase traumatica: comprende il periodo che va dal trauma a circa 30 giorni dopo. È caratterizzata da una risposta infiammatoria intensa con edema, emorragia, sono presenti calore e dolore alla palpazione;
- fasi di guarigione acuta: vanno all’incirca dal giorno 30 al giorno 120 post-trauma. Sono caratterizzate dalla formazione di nuove catene collagene (prevalentemente di tipo III) che vanno a sostituire le fibre lese, il tessuto necrotico ed emorragico;
- fase di guarigione cronica: si protrae dal giorno 120 in poi, fino ad arrivare anche ad un anno dal trauma. In questa fase si ha la formazione di tessuto cicatriziale.
Per capire quali sono le scelte terapeutiche in caso di lesioni teno-legamentose si deve porre l’attenzione sui processi che avvengono durante la riparazione tendinea. La guarigione del tendine inizia con la reazione flogistica caratterizzata da una produzione, proporzionale all’ampiezza della lesione e alla gravità del trauma, di fibrina e di cellule infiammatorie. La risposta infiammatoria del tessuto leso ha un ruolo importante nel processo di guarigione delle strutture teno-legamentose, stimolando la fibroplasia che permette la formazione di tessuto di granulazione e la deposizione di nuovo collagene. La risposta infiammatoria, però, esercita anche effetti negativi sui tessuti circostanti, sulle fibre collagene e sulla matrice del tendine che spiegano i tentativi terapeutici volti alla sua riduzione (Henninger, 1994).
Altra componente fondamentale del processo di guarigione è rappresentata dalla neo-vascolarizzazione della zona colpita a partire dai capillari peri-tendinei. Attraverso i nuovi vasi arrivano ossigeno, e sostanze nutritive, essenziali per la sopravvivenza cellulare e la produzione di nuovo tessuto, e cellule infiammatorie (neutrofili e macrofagi), fondamentali per la rimozione dei detriti nel sito della lesione mediante fagocitosi. Allo stesso tempo, però, è necessario ridurre al minimo emorragia ed edema in quanto provocano la separazione dei fasci collagene, prolungano la fase acuta di guarigione e promuovono la formazione di tessuto cicatriziale.
Durante la fase di guarigione acuta, i fibroblasti dello strato peri-tendineo e dell’endotenonio migrano verso la zona lacerata e infiammata; il loro allineamento prima, e quello delle fibre da essi sintetizzati in un secondo tempo, dipende dalla disposizione della fibrina che si è depositata a livello della lesione (Woo, 1999).
Il processo di guarigione comporta la formazione di tessuto cicatriziale, composto prevalentemente da collagene di tipo III che conferisce stabilità e resistenza meccanica al sito della lesione mediante formazione di legami crociati. Il collagene di tipo I si ritrova solo successivamente alla fase acuta della riparazione.
Quindi, durante i primi 6 mesi circa dal trauma, possiamo rinvenire prevalentemente collagene di tipo III e scarse fibre lasse di collagene di tipo I. Nei mesi successivi il tipo di collagene che prevale è quello di tipo I, rappresentato da fibrille ordinate linearmente, grazie al progressivo rimodellamento a cui viene sottoposto il tendine. È comunque possibile ritrovare quantità anomale di collagene tipo III, fibre collagene di piccolo diametro e aree prive di tessuto anche fino a 14 mesi dopo il trauma. Nella guarigione dei tendini, quindi, sono di fondamentale importanza sia i fattori estrinseci, rappresentati da fibroblasti e capillari di origine peri-tendinea, che quelli intrinseci, costituiti dalle cellule dell’endotenio che possono agire come fibroblasti attivi (Manske, 1984).
Da questo si deduce come la prevalenza del processo di riparazione intrinseca, rispetto a quello estrinseco, potrebbe portare ad una minore incidenza di aderenze peritendinee.
Proprio basandosi su questa teoria vengono ricercate nuove tecniche terapeutiche che stimolino la rigenerazione del tendine e riducano la formazione di tessuto di cicatriziale. I protocolli terapeutici convenzionali, invece, hanno solo effetti marginali sulla riparazione delle lesioni teno-legamentose e il fattore che influenza maggiormente la prognosi è la gravità della lesione iniziale (Dowling, 2000).
In generale, si può dire che i trattamenti medici e chirurgici abitualmente usati, hanno l’intento di bloccare l’infiammazione, prevenire ulteriori danni all’interno del tendine, diminuire la tensioni e aumentare la vascolarizzazione a livello della core
6.1 Terapia fisica delle teniti
La terapia fisica può essere usata soprattutto nella fase acuta delle tenite dove la riduzione del processo infiammatorio è indicato per limitare l’azione degenerativa sulla matrice tendinea degli enzimi proteolitici liberati durante la flogosi (Dowling, 2000).
Secondo i protocolli terapeutici maggiormente in uso per il trattamento delle lesioni teno-legamentose, appena diagnosticata la tenite, il cavallo dovrebbe essere messo a riposo in box per 2-4 settimane. Questo periodo, che coincide con la risoluzione della fase traumatica e con l’inizio della fase di guarigione acuta, ha la funzione di evitare l’allargamento della lesione e l’alterazione delle fibre in via di formazione (Henninger, 1994).
Durante il periodo di riposo la lesione dovrebbe essere monitorizzata ecograficamente di frequente per valutarne l’evoluzione, visto che il confino dell’animale in box permette comunque un certo grado di carico sull’arto che facilita il corretto allineamento delle fibre tendinee (Spinabella, 2002).
Altro accorgimento fondamentale durante le prime fasi post trauma è l’utilizzo della idroterapia fredda. È una pratica terapeutica importante durante la fase infiammatoria acuta e iperacuta, che aiuta ad alleviare il dolore, previene la formazione di edema e la tumefazione dei tessuti, riducendo la permeabilità vasale e di conseguenza la migrazione di fluidi, proteine e mediatori dell’infiammazione all’interno della zona lesa. Questo trattamento può essere fatto usando docciature fredde o tramite l’applicazione di ghiaccio direttamente sull’arto, mediante bendaggio compressivo che, aumentando la pressione dei fluidi interstiziali, riduce la loro perdita dai vasi (Mcilwraith, 1990). Nella maggior parte dei protocolli reperibili in letteratura le applicazioni devono durare circa 20 minuti, in modo da contrastare la vasodilatazione da vaso-paralisi, ed essere ripetute più volte al giorno, soprattutto nelle prime 24- 48 ore dopo il trauma (Spinabella, 2002 ).
Sia durante la fase infiammatoria che durante quella di guarigione acuta viene raccomandato un programma di esercizio controllato. Questo promuove la circolazione, facilita il drenaggio linfatico, incrementa il riassorbimento di eventuali raccolte ematiche ed essudative, è particolarmente indicato per la riabilitazione di lesioni tendinee poiché un leggero carico sulla struttura facilita l’allineamento delle
La mobilizzazione passiva controllata dell’arto interessato e quindi la leggera tensione del tendine lesionato, può influenzare positivamente il processo di riparazione intrinseca del tendine, l’orientamento delle fibrille e probabilmente anche evitare la formazione di aderenze, favorendo la separazione fra le strutture tendinee in via di riparazione dal circostante strato paratendineo o dalla guaina tendinea. Si deve però stare attenti a non esagerare, perché una tensione eccessiva può compromettere la guarigione. Il programma di esercizio controllato deve essere deciso in base ad una serie di valutazioni, le più importanti delle quali sono il grado della lesione inizialmente presente nel tendine e i progressi che periodicamente si possono apprezzare (Ketchum, 1979).
Dopo un primo periodo di riposo in box, è necessario procedere alla riabilitazione graduale dell’animale, in modo da evitare che un esercizio troppo intenso e/o precoce possa compromettere la guarigione. Per i primi giorni possiamo passeggiare il cavallo per circa 10 minuti due volte al giorno, fino ad arrivare gradualmente a 20 minuti due volte al giorno in circa 20 giorni. Dopo circa due mesi dal trauma si procede a una valutazione ecografica della lesione. Se non è evidente alcun miglioramento si continua a far passeggiare il cavallo fino ad arrivare gradualmente a 1 ora due volte al giorno, oppure, in caso di risultato positivo, l’animale può essere sellato e montato, partendo da 10 minuti due volte al giorno, fino ad arrivare a 30 minuti. Il movimento al trotto può essere iniziato solo quando, all’esame ecografico, si nota un allineamento delle fibre tendinee e l’ecogenicità della lesione è aumentata rispetto alla valutazione iniziale. Anche in questa fase di riabilitazione si deve procedere gradualmente, iniziando con 5 minuti fino ad arrivare a 15 minuti due volte al giorno per circa 2-3 mesi. Solo dopo questo intervallo di tempo, se l’ecografia conferma la guarigione, possiamo iniziare a sottoporre il cavallo a qualche minuto di canter, preceduto da circa 20 minuti di trotto (Gillis, 1997). È chiaro che le varie fasi dell’esercizio controllato dipendono strettamente dai miglioramenti che si osservano ecograficamente nella struttura del tendine, quindi se i miglioramenti non ci sono le varie fasi di allenamento vanno tutte ritardate, in modo da incrementare il carico sull’arto solo quando la trama fibrillare diviene abbastanza resistente (Dowling, 2000).
L’esercizio controllato può essere associato e/o sostituito, specialmente per le prime fasi della riabilitazione dal nuoto, che permette al cavallo di mantenere una
nell’arto nel momento in cui lo zoccolo prende contatto con il terreno (Spinabella, 2002).
Valido ausilio terapeutico per le teniti sono le ferrature correttive che accompagneranno il cavallo sia per il periodo di riposo che durante quello di riabilitazione. Le ferrature correttive sono volte a:
- ridurre la tensione interna al tendine, evitando il peggioramento della lesione e promuovendola fase di riparazione iniziale;
- indurre un progressivo allungamento della struttura tendinea per aumentare la deformabilità del tessuto cicatriziale e quindi ridurre l’incidenza delle recidive. Per favorire la riduzione della tensione a carico del tendine flessore superficiale si tende a sollevare la punta dello zoccolo, inducendo l’estensione dell’articolazione interfalangea distale o si applicano i ferri con i talloni prolungati per fornire un sostegno, ad esempio con un ferro con traversa a uovo (Stashak, 1990).
Per ridurre la tensione a carico del tendine flessore superficiale e del suo legamento accessorio, invece, si elevano i talloni usando, per esempio, ferri a cuneo con spessore graduale, che provocano la flessione dell’articolazione interfalangea distale. Il sollevamento dei talloni fa sì che ci sia una maggiore tensione a carico del legamento sospensore e del tendine flessore superficiale delle falangi (Lochner, 1980).
Altri tentativi per la terapia delle teniti sono stati fatti usando gli ultrasuoni. Sono onde sonore a frequenza elevata che producono una vibrazione meccanica e permettono lo sviluppo di calore nei tessuti sui quali sono applicate. Il calore viene usato nella terapia della fase traumatica delle teniti nel tentativo di determinare il riassorbimento di tumefazioni causate da sangue o da siero, favorendo la vasodilatazione e la migrazione di fagociti nella zona, aumentando la concentrazione di ossigeno nel tessuto, il metabolismo delle cellule e il flusso linfatico locale (Stashak, 1990).
Anche la laser terapia sembra dare risultati positivi nel trattamento delle lesioni tendinee. Si basa sul concetto che l’emissione di una luce costante, in un range specifico di energia, penetra nei tessuti stimolando direttamente il metabolismo cellulare e il rilascio di sostanze che intensificano la fase infiammatoria e riparativa del processo di guarigione. Si pensa possa stimolare la sintesi delle proteine, il flusso di sangue, la rigenerazione linfatica e la riduzione del dolore, l’aumento
(Henninger, 1994). Anche la terapia elettromagnetica può influenzare il potenziale piezoelettrico dei tessuti e incrementare il metabolismo cellulare. Gli effetti biologici attribuiti alla stimolazione elettrica includono la riduzione del dolore, l’incremento del flusso sanguigno, la dissoluzione dell’edema, l’aumento della migrazione delle cellule e una maggiore concentrazione di prolina e idrossiprolina che indica un aumento dell’attività cellulare e della sintesi di collagene. Bassi livelli di corrente hanno dimostrato di promuovere l’orientamento longitudinale di cellule, fibrina e collagene. La stimolazione elettromagnetica aumenta la maturità istologica, la resistenza tensile e il contenuto in collagene nei legamenti collaterali del coniglio in via di riparazione. A fronte del processo riparativo è stata segnalata la possibilità di metaplasia fibro-condrale (Spinabella, 2002).
6.2 Terapia farmacologia
Poiché la terapia fisica, pur essendo un valido ausilio per la guarigione del tendine, non è sufficiente alla completa remissione del processo patologico, è possibile ricorrere alla somministrazione di farmaci, soprattutto durante la flogosi acuta. Durante la fase traumatica possiamo usare, per esempio, il Dimetil Sulfossido (DMSO), che si trova in commercio in soluzione al 70% o al 90% o come gel. È una sostanza comunemente utilizzata come antinfiammatorio-antiedemigeno in quanto inibisce la sintesi di prostaglandine e l’aggregazione piastrinica e stimola la diuresi per via osmotica, eliminando così i radicali liberi che si sviluppano durante il processo infiammatorio; il DMSO ha anche un’attività batteriostatica ed inibente la dissoluzione del collagene (Stashak, 1990).
Il DMSO favorisce il passaggio trans-cutaneo dei farmaci a cui viene associato, per cui viene spesso utilizzato come veicolo per l’applicazione locale di corticoidi. L’uso del DMSO può avere effetti negativi evidenti soprattutto nel caso in cui venga usato in formulazione pura e quotidianamente; può provocare infiammazione cutanea transitoria e diminuisce il carico di rottura medio dei tendini, favorendone la lacerazione spontanea in cavalli da corsa (Albrechtsen, 1982; Grant 1992).
Altri farmaci somministrabili durante la fase traumatica sono i FANS (Farmaci antinfiammatori non steroidei) tra cui i più utilizzati sono i seguenti principi attivi: Fenilbutazone, Flunixin meglumine, Naprossene. I FANS hanno effetto antinfiammatorio, antipiretico e analgesico, in quanto inibiscono la ciclossigenasi e
sulle prostaglandine già formate, c’è un tempo di latenza tra la somministrazione e la manifestazione dell’effetto farmacologico (Stashak, 1990). Hanno solitamente un tempo di emivita breve (circa 4-5 ore), anche se il loro effetto clinico può durare per più di 24 ore dopo una sola somministrazione o fino a tre giorni dopo la sospensione del ciclo di trattamento. Tra i possibili effetti collaterali ricordiamo soprattutto le ulcere gastrointestinali,e più raramente la necrosi delle papille renali, l’ipoproteinemia, le alterazioni ematologiche (Booth, 1999).
Altri protocolli terapeutici proposti per il trattamento delle lesioni teno-legamentose prevedono l’uso di corticosteroidi, farmaci antinfiammatori potenti che possono essere somministrati per via sistemica o locale, soprattutto nella fase traumatica. Essi riducono l’infiammazione, l’edema e la formazione di aderenze, poiché stabilizzano le membrane lisosomiali, inibiscono la liberazione di prostaglandine e collagenasi con conseguente diminuzione della permeabilità capillare, formazione di edema, deposizione di fibrina e diapedesi di cellule infiammatorie nel sito di flogosi (Stashak, 1990).
Pur non trascurando i molti effetti positivi si deve necessariamente ricordare l’ampia gamma di effetti collaterali. Tra quelli più importanti ricordiamo la soppressione della risposta immunitaria, l’effetto vasocostrittore, che può esitare nello sviluppo di laminite, e la ritenzione di sodio per la loro azione mineralcorticoide. Inibiscono inoltre la fibroplasia, la sintesi di nuovo collagene e di glicosaminoglicani che sono fondamentali per il processo di riparazione tendineo. Proprio per questo non dovrebbero essere somministrati nel sito della lesione, in quanto è frequente la necrosi delle fibre collagene, la morte dei fibrociti e la calcificazione distrofica nel punto di inoculazione che comporta una diminuita resistenza; questo effetto negativo può protrarsi anche fino ad un anno dalla somministrazione (Kapetanos, 1982).
Durante i primi 5-7 giorni dal trauma, all’interno della lesione tendinea compare una elevata concentrazione di molecole di ialuronato di sodio, probabilmente associato al processo di proliferazione e di migrazione di cellule mesenchimali indifferenziate (Henninger, 1994). Dopo l’incremento iniziale, la molecola viene degradata dalla ialuronidasi in frazioni disaccaridiche con peso molecolare minore, probabilmente promuovendo la differenziazione delle cellule mesenchiamali in fibroblasti che sintetizzano il collagene e l’angiogenesi (Spinabella 2002).
In uno studio sperimentale in alcuni soggetti è stata creata una lesione tendinea mediante l’inoculazione di collagenasi, quindi un gruppo di cavalli è stato utilizzato come controllo, mentre un altro è stato sottoposto a somministrazione intra-lesionale di ialuronato di sodio; dopo eutanasia, sono stati eseguiti esami istologici da ogni lesione, sia dei soggetti trattati che da quelli di controllo. Gli esami istologici hanno evidenziato l’infiltrazione di tessuto fibro-vascolare sia intra-tendineo che nell’epitenonio; nel gruppo dei trattati però l’infiltrazione è minore rispetto al gruppo di controllo ed il tessuto è meglio organizzato (Gaughan, 1991). Sempre in uno studio sperimentale, nel gruppo di cavalli sottoposti a trattamento è stato inoculato acido ialuronico nella guaina tendinea periferica alla lesione collagenasi-indotta, quindi sono stati eseguiti esami istologici a otto settimane dall’inoculazione. L’istologia mostra un processo riparativo migliore nei soggetti trattati con acido ialuronico rispetto al gruppo di controllo (Spurlock, 1989).
Sebbene l’acido ialuronico riduca la formazione di aderenze, confrontando soggetti trattati e di controllo utilizzati in uno studio sperimentale, l’Autore non ha osservato un miglioramento della lesione all’esame ecografico, all’esame istologico, né per quanto riguarda le proprietà biomeccaniche del tessuto di riparazione (Foland, 1992).
I Glicosaminoglicani Polifosfati (PSGAG), complessi polisaccardici solforati che hanno una struttura molto simile al condroitin solfato. I PSGAG sono coinvolti nella maturazione delle fibre collagene, inoltre inibiscono gli enzimi lisosomiali, prevenendo la degradazione delle fibre sane e dei proteoglicani; sembra inoltre che possano aumentare la velocità di sintesi dei glicosaminoglicani, dell’acido ialuronico e stimolare i tenociti alla produzione di collagene (Dowling, 2000). La somministrazione intra-lesionale dei PSGAG sembra dare i risultati migliori; con questo trattamento molti soggetti tornano in attività anche se è comunque possibile un certa percentuale di recidive (Marr, 1993).
Inoculazioni intra-lesionali di Beta-Aminoproprionitrile (BAPN), inibitore della lisil-ossidasi, permettono un rapido miglioramento della lesione dal punto di vista ecografico. La probabile azione del BAPN è quella di diminuire il numero dei legami crociati immaturi nel tessuto di riparazione e di promuovere una più rapida organizzazione longitudinale delle fibre collagene all’interno del tendine. Dopo il periodo iniziale di deposizione rapida di collagene, si giunge ad un equilibrio fra la
funzionale del tessuto di riparazione. La proprietà del BAPN di ridurre la formazione dei legami crociati nelle prime fasi di organizzazione del tessuto sembrerebbe rendere il nuovo collagene più suscettibile alla degradazione enzimatica, provocando una riduzione della resistenza tensile e ritardando tutto il processo di guarigione (Spinabella, 2002).
Studi sperimentali hanno evidenziato anche possibili effetti collaterali, quali la riduzione della produzione di proteine e della sintesi del collagene, con conseguentemente rallentamento o addirittura blocco del processo di guarigione. L’utilizzo di questo farmaco, quindi, deve essere cauto ed associato ad un accurato programma di esercizio per evitare serie conseguenze (Dahlgren, 2002).
In letteratura è riportato anche l’utilizzo di vescicanti. Queste sostanze, applicate localmente, producono vescicazione ed infiammazione della cute e dei tessuti molli sottostanti.
Di solito vengono applicati qualora il processo di guarigione tardi a concludersi e hanno la funzione di stimolare la riacutizzazione di un processo infiammatorio che si era cronicizzato.
Esistono tre tipi di vescicanti:
- tinture vescicanti: (es. Reduceine) vengono applicati come i tonificante, miscele di sostanze usate dopo ogni seduta di allenamento, ma sono più forti;
- vescicanti in pasta: (es ioduro rosso di mercurio) più irritanti delle tinture e rimangono a contatto della cute per periodi prolungati;
- vescicanti interni: (es iodio di Mc Kay) vengono iniettati direttamente nei tessuti molli per aumentare la risposta infiammatoria, aumentare l’iperemia e provocare la formazione di tessuto cicatriziale.
I vescicanti dovrebbero essere applicati usando particolari cautele come tosare il pelo della parte e soprattutto applicare vasellina in pomata tutt’attorno alla zona dove è stato applicato il vescicante cosicché esso scorra e non agisca sui tessuti circostanti.
Dopo il trattamento i cavalli andrebbero tenuti a riposo per almeno 2-4 settimane se è stato usato un vescicante esterno, e almeno 4-6 settimane se ne è stato usato uno interno. I risultati che si ottengono sono comunque discutibili, poiché il miglioramento sembra essere legato principalmente al periodo di riposo e inoltre sono possibili effetti collaterali come la necrosi cutanea (Stashak, 1990). L’uso dei
6.3 Trattamento chirurgico
Le lesioni teno-legamentose croniche o resistenti alla terapia possono essere trattate con la chirurgia.
La focatura o cauterizzazione terapeutica è un metodo revulsivo molto energico che ha la funzione di riacutizzare il processo infiammatorio nel caso in cui sia presente una flogosi subacuta o cronica, nella speranza di rendere più rapida la guarigione. Prevede l’applicazione circoscritta di alte temperature sui tessuti da trattare al fine di causarne la distruzione.
Il risultato finale è comunque la formazione di tessuto cicatriziale scarsamente vascolarizzato (Stashak, 1990). Secondo McIlrwaith (1990) la focatura, invece, non influenza la guarigione tendinea ma protegge l’animale da recidive grazie alla formazione di ispessimenti cicatriziali cutanei che agiscono come un supporto per il tendine flessore superficiale del dito.
La cauterizzazione può essere fatta con diversi strumenti:
- Cauterio ad etere: questo strumento provoca un rumore fastidioso e, quando sprigiona la fiamma, provoca uno scoppio che disturba il cavallo
- Cauteri manuali: sono costruiti in modo che la punta sia sorretta da una parte di ferro allargata. Il calore nel ferro riscalda la punta. Questo cauterio viene generalmente arroventato mediante un saldatore
- Cauteri elettrici: è il metodo migliore per la cauterizzazione terapeutica. Sono strumenti silenziosi e portatili
La tecnica di focatura può essere a punta o a strisce: con la prima si interviene a profondità diverse nei tessuti, arrivando ai tendini ed alle ossa, mentre con la seconda non si supera il tessuto cutaneo.
La parte che deve essere cauterizzata viene tosata e la superficie cutanea viene sfregata con antisettico ed acqua. La focatura può essere eseguita sul soggetto in stazione quadrupedale previa sedazione e anestesia locale, oppure in anestesia generale. Si effettuano una serie di focature a distanza di 9-12 mm l’una dall’altra. Sebbene la tecnica di focatura permetta di accelerare la guarigione di un processo infiammatorio cronico, estremamente importante è comunque il periodo di riposo di circa 4- 6 mesi (Stashak, 1990).
Il Tendon splitting è un intervento chirurgico che veniva usato nelle teniti croniche per promuovere la riacutizzazione del processo infiammatorio, quindi la neovascolarizzazione e la crescita di fibroblasti lungo la linea di incisione in modo da facilitare la soluzione delle cicatrici e favorire il ripristino di una funzionalità tendinea normale. Oggi si preferisce utilizzare questa pratica nella fase acuta del processo infiammatorio, in particolare nelle teniti con immagine ecografica di core
lesion, soprattutto dove l’ematoma ostacola la rivascolarizzazione e la successiva
guarigione del tessuto tendineo, per favorire la fuoriuscita dei liquidi dalla lesione. Il tendon splitting, infatti, promuovendo la neovascolarizzazione, facilita la risoluzione della raccolta ematica e riduce i rischi della formazione di una cicatrice non vascolarizzata.
La tecnica viene eseguita su soggetti in anestesia generale e in decubito laterale. Esistono diverse varianti anche se generalmente si effettua un’incisione della cute e del peritenonio in corrispondenza della faccia volare dello stinco (in caso di tenite del tendine flessore superficiale) o lateralmente (nel caso di lesione del tendine flessore profondo e sospensore del nodello) esponendo il tendine. Il tendine può essere aggredito con una incisione longitudinale, in modo da asportare una parte del tessuto tendineo danneggiato o, più spesso, mediante incisioni multiple, distanti 2-3 cm l’una dall’altra, effettuate con un bisturi a doppia lama (Stashak, 1990) seguite dalla sutura della cute.
Successivamente è stata sviluppata una tecnica percutanea a ventaglio al fine di diminuire le aderenze pritendinee (Asheim, 1967) e ridurre notevolmente la breccia cutanea necessaria. Questa tecnica prevedeva di inserire, più volte a distanza di 2- 3 cm l’uno dall’altra, un bisturi a doppia lama attraverso la cute, muovendo il bisturi, una volta inserito nel tendine, dal basso in alto per ampliare l’incisione.
Con il tendon splitting dovremmo riuscire ad evitare la formazione di una cicatrice avascolare, promuovendo una riparazione ottimale del tendine.
I risultati post-operatori sono comunque contraddittori; alcuni autori (Asheim, 1964; Henninger, 1993) ha dimostrato un buon processo riparativo, mentre Stromberg (1974) non ha evidenziato esiti positivi.
La desmotomia della briglia radiale è una tecnica chirurgica che prende in considerazione tutta l’unità funzionale tendinea, cercando di preservare l’elasticità della struttura, piuttosto che aumentarne la resistenza. Vista la sua localizzazione
carico dalla porzione tendinea del muscolo flessore delle falangi alla parte distale del radio, durante la fase di supporto del peso, prevenendo il sovraccarico e l’eventuale rottura sia del muscolo che del tendine. Quando tensioni e pressioni elevate sono applicate a un tendine in via di guarigione, la possibilità di una recidiva è elevata, vista la diminuzione del limite elastico dell’intera unità funzionale. Utilizzando la totale lunghezza dell’unità muscolo tendinea, come avviene dopo la desmotomia, il limite elastico dell’unità funzionale dovrebbe essere aumentato e la possibilità di avere delle recidive ridotta (Hogan, 1995).
La desmotomia della briglia radiale viene effettuata con il soggetto in anestesia generale, posto in decubito laterale, con l’arto interessato a contatto con il letto operatorio.
La briglia radiale è raggiunta sulla parte mediale dell’avambraccio, a livello della castagnetta. Viene praticata un’incisione cranialmente alla vena cefalica, che viene retratta caudalmente per esporre la guaina tendinea del muscolo flessore radiale del carpo. La briglia radiale viene localizzata mediante palpazione, quindi viene incisa per tutta la sua lunghezza, stando attenti a non recidere l’arteria nutritiva del tendine flessore superficiale delle falangi. Distalmente, se è possibile si cerca di conservare il limite prossimale del canale del carpo (Watkins, 1995).
Dopo l’intervento, si applicano bendaggi compressivi in modo da ridurre la formazione di una raccolta sierosa. I soggetti devono essere tenuti a completo riposo in box per circa 2 settimane, iniziando un programma di riabilitazione con passeggiate alla mano. Dopo 4 mesi dall’intervento si mettono i cavalli in paddock per almeno 1 mese, in modo da permettere il rimodellamento del tessuto cicatriziale. A questo punto si consiglia di procedere con un controllo ecografico in modo da poter monitorare il processo di guarigione. Se viene evidenziato un soddisfacente quadro ecografico con fibre ben allineate, allora il soggetto può essere di nuovo sottoposto ad allenamento, procedendo naturalmente per gradi e con frequenti ecografie di controllo. La desmotomia della briglia radiale sembra dare buoni risultati permettendo al cavallo il ritorno all’attività sportiva, riducendo anche i rischi di recidiva (Watkins, 1995)
Un’altra opzione chirurgica per il trattamento delle teniti è la desmotomia del legamento anulare. Viene solitamente usata per evitare che i tendini infiammati ed edematosi, possano subire un danno ulteriore causato dalla compressione dovuta al
Questo intervento può essere eseguito con il soggetto in stazione quadrupedale, previa sedazione e desensibilizzazione della zona di intervento o in anestesia generale e in decubito laterale con l’arto colpito rivolto verso l’alto. Si pratica una incisione di 4-8 cm parallelamente e caudalmente alle strutture neuro-vascolari latero-palmari, sulla superficie abassiali dell’osso sesamoideo laterale. Si possono così incidere le dense fibre del legamento anulare, che forma il margine abassiale della guaina tendinea digitale. Quest’ultima ed il legamento non vengono suturati, si provvede solo a suturare il sottocute e la cute. Questo tipo di intervento è molto utile nel caso in cui la patologia si limiti ad una reazione infiammatoria notevole, con minime lesioni interne, che possono risolversi mediante riposo ed antinfiammatori, senza la necessità di intervenire direttamene nella struttura tendinea. In presenza di teniti gravi o di fenomeni aderenziali diffusi, la prognosi è più riservata, anche se l’intervento di desmotomia del legamento anulare ha di per sé una buona prognosi, con cavalli che recuperano la funzionalità entro 4 mesi dall’intervento (Spinabella, 2002).
Un’altra possibilità chirurgica per il trattamento delle teniti è quella che si basa sugli impianti di fibre flessibili di carbonio, come sostitutivi del tessuto tendineo. Questo materiale induce, infatti, la formazione di un tessuto cicatriziale, che per la struttura istologica, si avvicina molto alla struttura originale del tendine (Hannas, 1995). Il carbonio è un materiale adatto per gli impianti per via della sua purezza, biocompatibilità e flessibilità (McIlwraith, 1990). L’attenzione dei ricercatori si è indirizzata soprattutto alla grafite, sostanza in cui i piani paralleli di carbonio possono scivolare l’uno sull’altro senza perdere adesione. Questa struttura è sufficientemente elastica, quindi il carbonio sotto forma di grafite, costituisce un materiale molto resistente pur non presentando un alto peso specifico.
Le fibre di carbonio forniscono un’impalcatura per la crescita dei fibroblasti e la formazione di fibre collagene, istologicamente simile a quello di tipo I tipico del tendine maturo, allineate alle fibre di carbonio, incoraggiando una crescita organizzata del tessuto cicatriziale, che permette una graduale eliminazione dell’innesto (Watkins, 1995; McIlrwaith, 1990).
Per il loro impianto viene praticata un’incisione sulla cute a livello della regione media del terzo metacarpo, esponendo il paratenonio del tendine flessore superficiale delle falangi. Le fibre di carbonio vengono inserite attraverso
L’utilizzo di questo tipo di impianto dovrebbe essere ulteriormente approfondito visto che Valdez (1980) ha riportato buoni risultati, tra le quali una maggiore elasticità del tendine, mentre altri autori (Brown e Pool, 1983) non trovarono nel loro studio alcuna prova del fatto che le fibre di carbonio agissero come un’impalcatura favorendo la disposizione longitudinale delle fibre collagene nella formazione della cicatrice.
6.4 Nuovi protocolli terapeutici
Poiché le terapie descritte nei capitoli precedenti portano comunque la formazione di tessuto cicatriziale all’interno della struttura tendinea lesa, riducendo il ripristino dell’elasticità tendinea, altri protocolli terapeutici sono stati studiati al fine di avere la risoluzione della lesione tendinea, ma senza la formazione di tessuto cicatriziale. L’attenzione è stata indirizzata verso i fattori di crescita. La cascata di eventi che dal trauma portano alla guarigione del tessuto tendineo, sembra essere mediata da fattori di crescita peptidici, rappresentati da grandi polipeptidi e glicoproteine, secrete da vari tipi di cellule presenti sia nei tessuti che nel sangue, e che regolano il metabolismo cellulare. I fattori di crescita aumentano il processo riparativo di tendini e legamenti stimolando la sintesi di matrice extracellulare tendinea, che promuove la proliferazione e la differenziazione cellulare e stimola lo sviluppo della vascolarizzazione (Dahlgren, 2005).
I fattori di crescita sono molti e ognuno presenta delle proprie peculiarità.
L’IGF-I (Insuline Growth factor I) è sintetizzato dai fibroblasti dell’endotenonio e favorisce la proliferazione, la migrazione e la differenziazione cellulare agendo come un messaggero (Nixon, 2008). Nel cavallo, le iniezioni di IGF-I direttamente nelle lesioni tendinee hanno avuto effetto positivo sulla guarigione (Dahlgren, 2002), accentuando il ripristino della trama delle fibre tendinee e migliorando le caratteristiche meccaniche del tendine. Gli studi effettuati in vitro hanno infatti dimostrato che la molecola, aumentando il metabolismo intrinseco dei tenociti, esercita effetti sulla proliferazione delle cellule tendinee e sulla sintesi del collagene all’interno del tendine, che sembra essere prevalentemente di tipo I, a differenza di quanto avviene in natura, dove il tipo di collagene che predomina nelle prime fasi dopo una lesione è il tipo III. Si deduce quindi che l’IGF-I può avere un ruolo nel trattamento delle teniti (Murphy, 1997). Visto il limitato tempo di emivita delle
associazione con cellule staminali mesenchimali (CSM) MSC: che ha dimostrato vantaggi nel miglioramento dell’architettura durante prove a breve termine condotte in vitro (Nixon, 2008).
Il TGF-β1 (Transforming growth factor
β
1) sembra avere la funzione di aumentarela produzione di COMP (Cartilage Oligomeric Matrix Protein) e la replicazione cellulare all’interno del tendine. L’uso di un solo fattore di crescita non è comunque sufficiente per permettere un’ottimale rigenerazione della lesione, quindi sarebbe opportuno procedere all’uso di un insieme di fattori di crescita in modo da favorire una rigenerazione di tutte le componenti tendinee (Dowling, 2000).
Recentemente si è posta particolare attenzione anche all’uso di plasma ricco di piastrine (PRP) come terapia per le lesioni tendinee. Il plasma arricchito è una fonte concentrata di PDGF (Platelet Derived Growth Factor) e TGFβ (Transforming
growth factor
β
), di cui le piastrine sono ricche, ed apporta molti altri fattori dicrescita come il EGF (Epidermal Growth Factor) e il PDAF, trombossano e fibronectina/vitronectina. Il PDGF e il TGF β svolgono un ruolo primario nel reclutamento dei progenitori del tessuto connettivo, stimolando la formazione della matrice e migliorando la velocità di guarigione del tendine. La concentrazione di PDGF e TGF β sono significativamente più alti nel plasma arricchito rispetto all’aspirato midollare, al sangue intero ed al plasma povero di piastrine. Inoltre il PRP contiene anche l’IGF-I in percentuale simile a quella del plasma non concentrato. Il PRP è quindi un metodo economico e facile da ottenere ed è una fonte di fattori di crescita autologhi e frazioni ricche di cellule. Trova applicazione nel trattamento di estese ferite cutanee e di malattie ortopediche, principalmente per la riparazione di tendini e legamenti, nonché per il ripristino delle superfici cartilaginee. Il concetto di base prevede l’utilizzo di sangue prelevato in acido- citrato- destrosio (ACD) come anticoagulante, seguito dalla separazione in centrifuga. Per consentire l’iniezione del prodotto ricco di piastrine è necessaria la prova ecografica dell’esistenza di una lesione a core. A seconda delle dimensioni si usano da 4-7 ml di plasma ricco di piastrine, ma in caso di le lesioni tendinee più piccole possono essere sufficienti 1-2 ml. Il PRP può essere usato anche come veicolo per il trattamento più aggressivo dei casi di tendinite, al fine di apportare cellule staminali di derivazione midollare coltivate ed arricchite (Nixon, 2008).
Negli ultimi anni sempre maggiore attenzione è stata rivolta all’uso delle cellule staminali (CSM) visto il loro potenziale impiego nella medicina rigenerativa e nell’ingegneria tissutale e quindi anche nel trattamento delle lesioni teno-legamentose del cavallo. Queste cellule sono state isolate dal midollo osseo, dal periostio, dal tessuto trabecolare e adiposo, dal muscolo scheletrico e dai denti decidui. Le CSM hanno il vantaggio di autoreplicarsi e differenziarsi in diverse linee cellulari tra cui gli osteoblasti, i condrociti, i mioblasti, gli adipociti e i fibrociti. Altro fattore degno di nota è che esprimono i markers tipici delle cellule endoteliali, neuronali e miocardiche. Lo stimolo per la differenziazione delle CSM in tenociti è ancora sconosciuto ma recenti ricerche suggeriscono che sia necessaria una combinazione tra tensione all’interno del tessuto, fattori di crescita e il contatto con cellule e matrice del tendine (Smith, 2004)
Una fonte di CSM è costituita dal midollo osseo aspirato dalle sternebre o dalla cresta iliaca, facilmente accessibili nel cavallo e con una bassa incidenza di complicazioni.
L’uso di aspirato midollare, contenente elevate concentrazioni di TGFβ e PDGF, si è diffuso primariamente per la desmite sospensoria cronica degli equini. In questo caso l’aspirato midollare conteneva un basso numero di cellule staminali, ampiamente diluite dal notevole volume di sangue midollare. In uno studio sperimentale, l’Autore ha conseguito un buon successo con l’uso di midollo osseo aspirato dalle sternebre e iniettato direttamente all’interno delle lesioni tendinee e legamentose (Herthel, 2001).
I potenziali effetti benefici di questa terapia sono due: 1) le CSM, iniettate nell’area danneggiata, possono differenziarsi in fibroblasti tendinei o legamentosi maturi, sotto l’influenza di segnali provenienti dal tessuto, e produrre la matrice adeguata per la riparazione; 2) il midollo osseo contiene alte concentrazioni di fattori di crescita (Dahlgren, 2005).
Con questa tecnica si osservano più rapidamente il ritorno all’efficienza funzionale del tendine e la guarigione, il miglioramento ecografico, la riduzione dell’incidenza di recidive rispetto a quanto avviene nei trattamenti conservativi. Uno studio eseguito su 100 cavalli affetti da lesioni tendinee, trattati con l’iniezione di midollo osseo autologo, mostra che l’84% dei soggetti torna ad un buon livello di esercizio fisico in 6 mesi dopo il trattamento. Questi risultati sono veramente favorevoli se
conservativamente (Smith, 2003). È stato ipotizzato che le cellule staminali mesenchimali pluripotenti, i fattori di crescita contenuti nel midollo osseo e la fibrina della matrice potrebbero essere la ragione per il precoce e maggiore miglioramento della risoluzione clinica della lesione (Rosenbrock, 2004).
L’inoculazione di notevoli volumi di midollo osseo (30-50 ml) all’interno della struttura teno-legamentosa potrebbe però distruggere le fibre ancora intatte; inoltre il midollo può contenere piccolissimi frammenti di osso e cellule adipose, elementi negativi ai fini della guarigione perché potrebbero provocare la calcificazione del tendine o comunque l’alterazione della struttura in cui vengono inserite. Infine, l’alta concentrazione di TGF β nel fluido aspirato potrebbe esitare in una eccessiva formazione di tessuto cicatriziale non elastico, indesiderabile nella guarigione del (Dalhgren, 2005).
L’aspirato midollare può anche essere centrifugato e concentrato per ottenere il così detto MOC (Midollo osseo concentrato). Questa tecnica prevede la separazione del midollo osseo eparinizzato e la concentrazione delle cellule staminali e dei piccoli leucociti, usando un sistema basato sul peso specifico (Harvest Technology), ispirato allo stesso principio utilizzato per ricavare il PRP. Il MOC offre una fonte di cellule immediate (dette patient-side) per il trattamento della desmite e della tendinite. Questa tecnica prevede di prelevare il midollo osseo dalle sternebre o dalla cresta iliaca. Il midollo viene raccolto in una siringa eparinizzata e viene successivamente centrifugato al fine di concentrare le cellule staminali in esso presenti e i piccoli leucociti di densità simile. Ciò che si ricava viene poi impiantato sotto guida ecografica nella lesione tendinea. Studi in vitro hanno dimostrato che l’utilizzo di cellule staminali può essere utile anche nel trattamento della desmite del legamento sospensore, con un successo superiore rispetto all’utilizzo di PRP (Nixon, 2008).
L’espansione della popolazione delle cellule staminali raccolte con l’aspirato midollare è stata utilizzata come mezzo per incrementare il numero degli elementi disponibili per l’inoculazione. Secondo i dati riportati in letteratura sono necessarie 3-4 settimane di coltura per ottenere 20-30 milioni di CSM da un aspirato midollare di 120 ml comportando un significativo ritardo nella terapia. Le cellule sono solitamente sospese in un supernatante di midollo osseo che può essere sostituito con un mix di fattori di crescita e impiantato sotto guida ecografica nelle core lesion
Alcuni autori riportano che l’impianto di cellule staminali dovrebbe essere effettuato entro il secondo mese dalla lesione, perché già al terzo mese dal trauma nel sito di lesione si rinviene tessuto fibroso talvolta anche abbondante e che potrebbe ridurre l’efficacia del trattamento. Quindi è necessario intervenire nel momento in cui la fase infiammatoria si riduce e nel sito di lesione il tessuto di granulazione ha formato il supporto per l’impianto di cellule staminali, ma prima che si sia formato tessuto fibroso. Secondo gli stessi autori l’uso iniziale di steroidi potrebbe essere appropriato per velocizzare la risoluzione dell’infiammazione rallentando contemporaneamente la fibrosi (Smith, 2004).
Le CSM possono essere impiegate da sole o unitamente a biomateriali di supporto nel caso in cui siano impiegate in lesioni molto vaste. L’uso di 10-20 milioni di CSM in coltura miscelate a PRP o aspirato midollare sembrerebbe la soluzione più promettente da un punto di vista tecnico (Nixon, 2008).
Le cellule staminali si possono ricavare anche dalla selezione di tessuto adiposo concentrato (cellule nucleate di derivazione adiposa) per centrifugazione. Il tessuto adiposo di cavalli adulti contiene una popolazione considerevole di cellule staminali mesenchimali facilmente reperibili. Il tessuto adiposo, oltre a contenere CSM, presenta anche altri elementi nucleati e proteine attive per la guarigione dei tessuti. Inoltre l’uso di cellule staminali adulte di derivazione adiposa eviterebbe la risposta immunitaria e permetterebbe un inizio più precoce del trattamento rispetto all’utilizzo delle cellule mesenchimali da aspirato midollare. Il tessuto adiposo viene raccolto effettuando un’incisione di cute e sottocute dall’area glutea caudo-dorsale. In quest’area è presente tessuto adiposo, che viene prelevato. Si procede poi alla sutura della piccola incisione. Dal tessuto adiposo si isolano le cellule nucleate, una porzione delle quale sono CSM. Dopo l’isolamento, le cellule staminali vengono sospese in soluzione sterile PBS e impiantate dopo circa 24 ore nel tendine o nel legamento lesionato sotto guida ecografica. Questa nuova terapia è promettente se applicata nella fase iniziale del processo riparativo. Il controllo ecografico permette di evidenziare il miglioramento della percentuale della COMP e della densità, oltre che l’allineamento delle fibre tendinee (Dahlgren, 2005).
Alcuni studi molto recenti ipotizzano che le CSM di derivazione midollare diminuiscono nel numero e nella loro capacità proliferativa e differenziativa in vitro con l’aumentare dell’età del donatore e del numero di passaggi in coltura.
Si è reso quindi necessario lo studio di una nuova fonte di cellule staminali ricavate dalla matrice del cordone ombelicale. Questa fonte è da preferire a quella midollare vista la semplicità e la non invasività del prelievo, il basso costo, il maggior numero di cellule isolabili, l’immaturità delle cellule neonatali e quindi la maggiore capacità proliferativa e differenziativa. Questa tecnica necessita ancora di ulteriori studi e approfondimenti e presenta come limite maggiore quello di dover istituire una banca di cellule staminali mesenchimali per la specie equina (Consiglio, 2008).
MATERIALI E METODI
Casi clinici
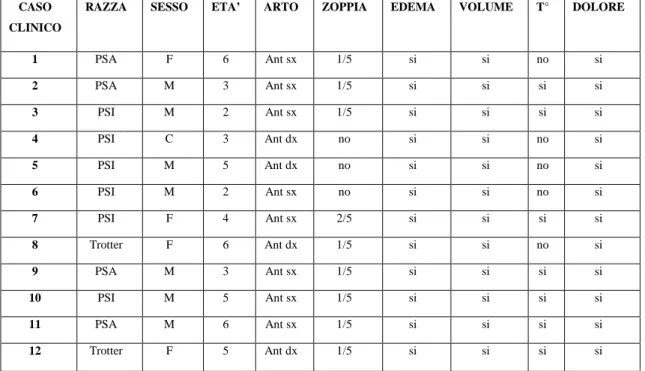
In questo studio sono stati inclusi 12 cavalli a cui era stata diagnosticata una lesione a livello del tendine flessore superficiale delle falangi. I soggetti erano 7 maschi, 4 femmine e 1 castrone.
Per quanto riguarda la razza, il gruppo era costituito da 6 Purosangue Inglesi, 4 Purosangue Arabi, 2 Trottatori.
L’età era compresa tra 2 e 6 anni, con una media di 4,2 anni.
In relazione all’attitudine del soggetto, 2 cavalli erano impiegati per trekking, 1 cavallo nell’endurance, 7 cavalli in corse al galoppo in piano, 2 soggetti in corse al trotto.
Per quanto riguarda l’intensità di allenamento al momento dell’insorgenza dei sintomi, 10 cavalli erano sottoposti ad allenamento di intensità media (senza cioè portare il soggetto alla massima prestazione possibile) e 2 soggetti erano allenati con livello di attività medio-basso.
La frequenza di allenamento era trisettimanale in 2 soggetti, giornaliera in 10. Quattro cavalli presentavano la lesione del tendine flessore superficiale all’anteriore destro, mentre 8 all’ anteriore sinistro.
Prelievo di midollo osseo
I cavalli sono stati sottoposti a una sedazione con 0,5 mg/Kg di xilazina (Megaxilor).
Il midollo osseo è stato prelevato dalle sternebre. Dopo aver provveduto alla preparazione dell’area con la rasatura del pelo e una prima rapida disinfezione della cute, mediante esame ecografico sono state individuate le sternebre, scegliendo quella da cui prelevare il midollo osseo.
Si effettua una desensibilizzazione locale profonda mediante la somministrazione di 5 ml di lidocaina (Lidocaina al 2%) e la preparazione chirurgica della cute in corrispondenza dell’area destinata al prelievo. L’operatore, con tecnica asettica, incide la cute con una lama di bisturi n 11 per favorire la successiva introduzione dell’ago da biopsia.
L’ago da biopsia di tipo Jamshidi (11 gauge 10 cm), sterile, viene introdotto per 4- 6 cm (da decidere in base alla mole del cavallo) prima di arrivare a contatto con il corpo della sternebra; per superare la corticale è necessario applicare una certa pressione sull’ago. Il raggiungimento della midollare della sternebra è in genere segnalato dalla diminuzione di resistenza alla penetrazione dell’ago.
A questo punto si sfila il mandrino dall’ago e, con una siringa da 20 ml, in cui precedentemente è stata inserita 1 ml di eparina (Clarisco 12500 UI/ml ), si aspira il midollo.
Normalmente si effettua un secondo aspirato da una sternebra contigua introducendo un secondo ago da biopsia Jamshidi (11 gauge 10 cm) attraverso la stessa incisione cutanea.
In genere vengono prelevati 40 ml di midollo osseo. Dopo l’estrazione dell’ago si sutura l’incisione cutanea con filo riassorbibile Vicryl n. 1 o con filo non riassorbibile.
La parte viene coperta con garza sterile sulla quale deve essere applicata una certa pressione per favorire l’emostasi.
Le siringhe da 20 ml contenenti il midollo vengono poi agitate delicatamente in modo da distribuire l’eparina presente in tutto il campione, impedendo la coagulazione del sangue midollare. Il materiale viene trasferito quanto prima in laboratorio, mantenendolo a temperatura ambiente.
Preparazione in laboratorio di midollo osseo autologo concentrato
Il midollo osseo prelevato ed eparinizzato viene portato in laboratorio. Qui subisce una serie di procedimenti finalizzati a ricavare le cellule mononucleate (CMN) da trapiantare direttamente nella lesione. Il midollo osseo è diluito con uno stesso volume di Soluzione Salina Bilanciata di Hank (HBSS: Hank’s balanced salt
solution) (GIBCO, Grand Island NY USA). Dopo la diluizione viene poi inserito
in una provetta contenente Lymphoprep (AXIS- SHIELD, Oslo), liquido separatore, e centrifugato a 400 g per 20 minuti al fine di isolare le cellule mononucleate (CMN). Le CMN vengono raccolte all’interfaccia tra il siero e il liquido separatore e successivamente lavate 2 volte con HBSS. Le cellule mononucleate, isolate dal resto dei componenti del midollo osseo, vengono sospese in 1,5 ml di siero autologo. Si deve avere l’accortezza di muovere delicatamente la
provetta contenente le cellule mononucleate in modo da evitare che queste aderiscano alla parete.
A questo punto, 2 h dopo l’inizio della preparazione in laboratorio, il midollo osseo autologo concentrato è pronto per il trapianto.
Isolamento delle cellule staminali, coltivazione ed espansione in vitro
Il midollo osseo, giunto in laboratorio, è sottoposto alla stessa procedura usata per la produzione di midollo osseo autologo concentrato. Viene quindi diluito con uno stesso volume di Soluzione salina bilanciata di Hank (HBSS) (GIBCO, Grand Island NY USA). Dopo la diluizione si inserisce in una provetta contenente Lymphoprep (AXIS- SHIELD, Oslo) e si centrifuga a 400 g per 20 minuti separando le cellule mononucleate (MNC), che vengono raccolte all’interfaccia tra il siero e il liquido separatore e successivamente lavate 2 volte con HBSS.
A differenza di quanto avviene per il midollo osseo autologo concentrato le cellule sono seminate in fiasche da coltura T- 150 (CORNING) contenenti 20 ml di DMEM-LG (Mezzo di Eagle modificato da Dulbecco con glucosio) cui erano stati aggiunti:
- 10% di SBF (Siero bovino fetale) - 2 mM di L-glutamina
- 100 µg/ml di gentamicina - 100 µg/ml di amfotericina B
Sia i medium che i supplementi sono prodotti della GIBCO.
Le piastre usate per la coltura hanno due diverse densità cellulari: 4 x 105/cm2 e 8 x 105 /cm2. Vengono mantenute in termostato a 37° C e il medium della coltura viene rimosso dopo le prime 48 h, per eliminare le cellule che non hanno ancora aderito alla parete della piastra.
Il giorno 15 si aggiunge 0,25% di tripsina/ EDTA (GIBCO) a temperatura ambiente, lasciandola agire per 1- 2 minuti, in modo da staccare le cellule dal fondo della piastra permettendo l’espansione della coltura primaria.
Successivamente si procede a due lavaggi con HBSS, in modo da raggiungere una densità cellulare di 104 cellule/ cm2. Quando le colture raggiungono una confluenza dell’80-90%, le cellule staminali (CSM) vengono staccate dal fondo della piastra tramite digestione tripsinica, lavate 2 volte con HBSS e sospese in 1,5 ml di siero autologo ottenuto dalla centrifugazione di un campione di sangue prelevato al
paziente qualche ora prima. In caso di impossibilità nel reperire precedentemente il siero autologo si usa un siero commerciale.
A questo punto le cellule sono pronte per essere iniettate nella lesione. Prima della spedizione si procede alla conta del campione per sapere quante cellule vengono iniettate nella lesione.
Dal momento in cui escono dal laboratorio fino al momento in cui non vengono trapiantate le cellule vanno tenute in costante movimento in modo da evitare che aderiscano alle pareti del contenitore in cui si trovano.
Trapianto di cellule staminali coltivate e del midollo osseo autologo concentrato nella lesione tendinea
Per trapiantare le cellule staminali e il midollo osseo autologo concentrato direttamente nella lesione si procede con la preparazione dell’arto del cavallo e la regione metacarpale palmare viene sottoposta a tricotomia. Si esegue un esame ecografico di controllo prima di procedere al trapianto.
Una volta controllata la lesione, si esegue un’ anestesia loco regionale della parte usando 6 ml circa di lidocaina (Lidocaina 2%); la regione viene quindi sottoposta a proporzione chirurgica.
La sonda dell’ecografo viene inserita in una guaina o in un guanto sterile.
Per ottenere un’immagine ecografica migliore è necessario usare un gel, anch’esso sterile, in modo da diminuire la presenza di artefatti, riducendo la quantità di aria presente tra la sonda e la cute. Il siero contenente le MSC viene aspirato in una siringa da 5 ml munita di ago da 14 gauge.
Una volta individuato la lesione con la sonda, si procede, sotto controllo ecografico, all’iniezione delle cellule direttamente al suo interno. L’arto viene poi fasciato con cotone garzato e fasce elastiche (Vetrap ) applicando una leggera pressione. Tale fasciatura viene mantenuta per 48 h dopodiché si consiglia al proprietario di sostituirla con fasce da riposo.
Programma di riabilitazione
I soggetti impiantati con cellule staminali e midollo osseo autologo concentrato hanno svolto un periodo di riabilitazione, successivo all’impianto, basato sull’ esercizio fisico controllato.
È stato consigliato al proprietario di tenere l’animale in box, a riposo assoluto, per 2 settimane. Successivamente si doveva procedere conducendo l’animale al passo per 5 minuti due volte al giorno per 2 settimane. Passato questo lasso di tempo si è consigliato di incrementare la durata dell’allenamento di 5’ a settimana per i successivi 3 mesi.
A questo punto l’animale poteva essere sottoposto a una leggera attività fisica da incrementare progressivamente.
In media, è stato necessario un periodo di riabilitazione di circa 6 mesi dal trapianto. È importante far presente al proprietario che ogni animale reagisce in modo diverso al trattamento e quindi l’esercizio fisico e il programma di riabilitazione deve essere regolato in base ai risultati e seguito scrupolosamente onde evitare di vanificare la buona riuscita dell’impianto.
Controlli ecografici
Si consiglia al proprietario di effettuare i controlli ecografici mensilmente per i primi 6 mesi dall’impianto, da ripetere poi a 8 e 12 mesi, sia nel caso di utilizzo di cellule staminali che di midollo osseo concentrato. I controlli frequenti sono necessari per ridurre i rischi di recidiva, per modulare l’allenamento riabilitativo a seconda della risposta del soggetto, e quindi monitorare il buon esito della terapia. Nelle ecografie di controllo si deve valutare la presenza di lesioni, la loro dimensione e localizzazione, nonché l’ecogenicità del tessuto tendineo. Si ricorda che ecograficamente il processo di guarigione risulta completato in modo soddisfacente quando la lesione non è più rilevabile, l’area acquista nuovamente un’ecogenicità omogenea, in scansione longitudinale è possibile evidenziare le fibre collagene allineate e non si visualizzano aree iperecogene, segno di deposizione di fibre non elastiche e cicatriziali.
CASI CLINICI CON TRAPIANTO DI CELLULE STAMINALI COLTIVATE
CASO CLINICO 1 Razza: Purosangue arabo Sesso: F
Età: 6 anni
Attività: Trekking
Frequenza di allenamento: trisettimanale Livello di attività: medio
Arto interessato:Anteriore sinistro
Quadro clinico: zoppia di primo grado, edema, aumento di spessore, temperatura nella norma e dolore alla palpazione
Esame ecografico: si evidenzia una core lesion a livello del TFS, rappresentata da un’area ipoecogena a margini sfumati. Si ha aumento di volume del tendine.
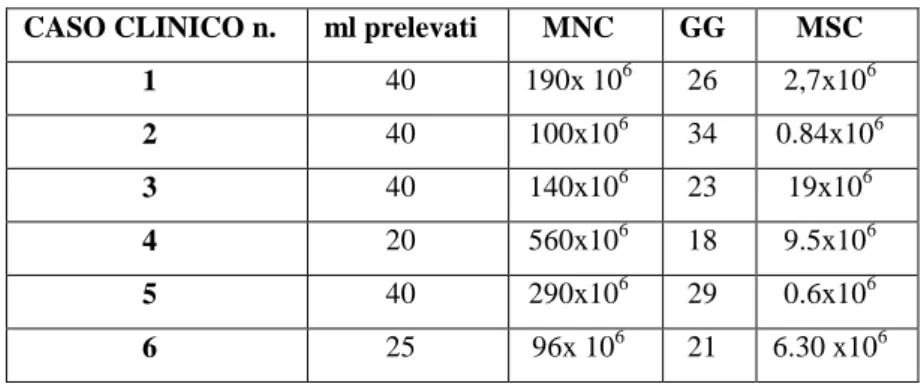
Data prelievo midollo osseo: 2 dicembre 2005 Quantità di midollo prelevato 40 ml
Quantità MSC: 190x 106
Data Impianto MSC: 28 dicembre 2005 Quantità MSC impiantate: 2.70 x 106
Scansione trasversale arto anteriore sinistro. Ecografia a D0. Microlesione a carico del TFS
Scansione longitudinale. Ecografia a 46 giorni dall’impianto. Il diametro della lesione a carico del TFS si è leggermente ridotto passando da 6,6 mm a 5,2 mm. Nella lesione si notano numerose fibre collagene che si sono disposte in modo allineato e parallelo
Scansione trasversale. Ecografia a 46 giorni dall’impianto. La lesione non è più riconoscibile anche se si può notare un’area leggermente ipoecogena a livello del TFS.
Scansione trasversale. Ecografia a 82 giorni dall’impianto. La lesione è scomparsa quasi completamente. L’ecogenicità dell’area lesa è simile a quella che si evidenzia al livello del tendine sano.
FOLLOW UP
Dopo circa 3 mesi dall’impianto si è potuto evidenziare una notevole riduzione dell’edema; ecograficamente la lesione si era ridotta, mostrando un allineamento delle fibre in sezione longitudinale.
Durante una passeggiata, dopo l’ultima ecografia di controllo, si è verificato un incidente che ha portato alla comparsa di una recidiva.
CASO CLINICO 2 Razza: Purosangue Arabo Sesso: M
Età: 3 anni
Attività: endurance Livello di attività: medio
Frequenza di allenamento: quotidiana Arto interessato: Anteriore sinistro
Quadro clinico: zoppia di primo grado, edema, aumento di volume e temperatura, dolore alla palpazione
Esame ecografico: core lesion al TFS. L’area si presenta ipoecogena a margini sfumati. Vi possiamo distinguere fibre ancora parzialmente allineate ed integre. Il tendine si presenta aumentato di volume.
Data prelievo di midollo osseo: 15 luglio 2005 Quantità midollo prelevato 40 ml
Quantità di MNC: 100 x 106
Data Impianto MSC : 5 agosto 2005 Quantità MSC impiantate: 0.84 x 106
Scansione trasversale. Ecografia a D0. Lesione ipoecogena di 3,3 mm sul TFS.
Scansione trasversale. Ecografia a 6 mesi dal trattamento. La lesione del TFS si è ridotta (da 3,3 mm a 1,9mm). È ancora ipoecogena.
FOLLOW UP
Scansione trasversale. Dopo inoculazione di cellule staminali e 6 mesi di riposo la lesione si è ridotta (1,9 mm), ma è comunque presente. Il soggetto è stato tenuto a riposo per altri 6 mesi. Non si è potuto reperire notizie dopo tale periodo.
CASO CLINICO 3 Razza: PSI
Sesso: M Età: 2 anni
Attività: corse al galoppo in piano Livello di attività: medio
Frequenza di allenamento: quotidiano Arto interessato: Anteriore sinistro
Quadro clinico: zoppia di primo grado, edema, aumento di volume e temperatura, dolore alla palpazione
Esame ecografico: è evidente una core lesion omogeneamente ipoecogena al TFS, con margini sfumati. Il tendine si presenta aumentato di volume.
Data prelievo di midollo osseo: 2 novembre 2005 Quantità midollo prelevato 40 ml
Quantità di MSC: 140 x 106
Data Impianto MSC : 25 novembre 2005 Quantità MSC impiantate: 19 x 106
Scansione trasversale. Ecografia a D0. Lesione a carico del TFS di 2,7 mm sul terzo prossimale. Si nota l’anecogenicità dell’area colpita.
Scansione trasversale. Ecografia a D0. Lesione a carico del TFS di 4,4 mm sul terzo medio del tendine. Si nota l’anecogenicità omogenea dell’area colpita.
Scansione trasversale. Ecografia a D1. La lesione del TFS si è modificata e l’ecogenicità è aumentata.
Scansione longitudinale. Ecografia a 39 giorni dall’impianto. La lesione è ancora presente, ma all’interno si notano le nuove fibre che si stanno allineando e che stanno riempiendo l’area di lesione.
Scansione trasversale. Ecografia a 39 giorni. La lesione si è ridotta di dimensioni (1,9 mm).
FOLLOW UP
Dopo un lungo periodo di riposo il cavallo ha ripreso il regolare allenamento, non mostrando segni di zoppia né edema a livello del tendine. Ecograficamente si nota diminuzione della lesione e allineamento delle fibre in sezione longitudinale. Non si hanno ulteriori notizie sul decorso post impianto di cellule staminali coltivate.
CASO CLINICO 4 Razza: Purosangue Inglese Sesso: castrone
Età: 3 anni
Attività: corse al galoppo in piano Livello di attività: medio
Frequenza di allenamento: quotidiano Arto interessato: anteriore destro
Quadro clinico: edema, aumento di volume, dolore alla palpazione. Non si rilevano zoppia e aumento della temperatura
Esame ecografico: presenza di lesione a carico della porzione palmare del TFS. L’area ipoecogena ha margini netti e il tendine si presenta aumentato di volume Data prelievo di midollo osseo: 25 novembre 2005
Quantità midollo prelevato: 20 ml Quantità MNC 560 x 106
Data Impianto CS: 13 dicembre 2005 Quantità MSC impiantate: 9,5 x 106
Scansione longitudinale del tendine a D0. Si ha diminuzione dell’ecogenicità prevalentemente nella porzione palmare del tendine. Con lesione di 6,3 mm
Scansione trasversale. Ecografia a D0. Lesione di 2,7 mm ipoecogena prevalentemente nella porzione palmare del tendine
Scansione longitudinale. Ecografia a D1. Si evidenzia un’area nettamente ipoecogena che interessa quasi lo spessore completo del TFS
Scansione longitudinale. Ecografia a 84 giorni dall’impianto di cellule staminali. È possibile evidenziare un miglioramento nell’ecogenicità della lesione, presenta fibre collagene allineate e quasi conformi a quelle del tendine sano
Scansione trasversale. Ecografia a 84 giorni dall’impianto di cellule staminali. La lesione è stata quasi completamente sostituita da un’area leggermente ipoecogena rispetto a quella normalmente evidenziabile in un tendine privo di lesioni.
FOLLOW UP
il cavallo è tornato in attività, cambiando tipo di competizione, passando a gare di trekking (disciplina molto impegnativa visto che alcuni percorsi si svolgono su tragitti di 60 Km). Non si sono avuti segni di zoppia e l’arto non si presenta né edematoso né ingrossato.
CASO CLINICO 5 Razza: Purosangue Inglese Sesso: M
Età: 5 anni
Attività: corse al galoppo in piano Livello di attività: medio
Frequenza di allenamento: quotidiano Arto interessato: anteriore dx
Quadro clinico: edema, aumento di spessore, dolore alla palpazione. Non si rilevano zoppia e aumento della temperatura
Esame ecografico: evidenzia una core lesion a livello del TFS, a margini sfumati e ipoecogena. Il tendine si presenta aumentato di volume.
Data prelievo midollo osseo: 9 gennaio 2006 Quantità midollo prelevato: 40 ml
Quantità MNC: 290 x 106
Data Impianto CS: 8 febbraio 2006 Quantità MSC impiantate: 0,60 x 10 106
Scansione longitudinale del tendine a D0. Si evidenzia una diminuzione dell’ecogenicità nello spessore del TFS. La lesione è di 3,5 mm
Scansione trasversale a D0. Si evidenzia una presenza di una core lesion a carico del TFS. L’area lesionata non presenta contorni netti, anche se al suo interno rimangono fibre che sembrano ancora intatte
Scansione trasversale nel giorno del prelievo. Il diametro della lesione a carico del SDFT è di 2,7 mm
Scansione longitudinale a D1. All’interno della lesione si possono notare nuove fibre collagene allineate
Scansione trasversale a D1. Non si evidenziano grosse differenze rispetto all’ecografia effettuata il giorno del prelievo di midollo osseo
Scansione longitudinale a 6 mesi dall’impianto. La lesione si è ridotta di dimensioni, passando dai 7,6 mm iniziali a 4,7 mm. Presenta anche un aumento dell’ecogenicità dovuto ad un incremento del numero di fibre che si presentano allineate in senso longitudinale
Scansione trasversale a 6 mesi dall’impianto. La core lesion non si è ridotta di dimensioni, ma l’ecogenicità è migliorata.
FOLLOW UP
A sei mesi dall’impianto di cellule staminali all’interno della core lesion del tendine TFS si è potuto osservare un miglioramento sia per quanto riguarda le dimensioni della lesione che l’ecogenicità, presentando, soprattutto in sezione longitudinale, un buon allineamento delle fibre collagene. La zoppia e l’edema sono completamente scomparsi; il soggetto è sottoposto ad un regime di esercizio controllato, nel tentativo di ridurre i rischi di recidiva o aggravamento della lesione. A oggi non è stato possibile reperire ulteriori informazioni sulle condizioni del cavallo.