INDICE
PROLOGO 2
UNITA’ 1 UNITA’ 1 UNITA’ 1
UNITA’ 1 REVISIONE DELLA LETTREVISIONE DELLA LETTREVISIONE DELLA LETTREVISIONE DELLA LETTERATURAERATURAERATURA ERATURA 4 1.1 UN APPROCCIO BASATO SUL PAZIENTE PER LO STUDIO DELLA MEMORIA DI
RICONOSCIMENTO VISIVO 5
1.1.1 LA MEMORIA DI RICONOSCIMENTO VISIVO 6
1.1.2 IL MORBO D’ALZHEIMER 8
1.1.3 LA SINDROME DI KORSAKOFF E L’AMNESIA MEDIOTEMPORALE 11
1.1.4 FAMILIARITÀ E RECOLLECTION 14
1.1.5 IL RICONOSCIMENTO VISIVO È UN PROCESSO PERCETTIVO 18
1.1.6 L’AGNOSIA VISIVA 19
1.1.7 C’È UNA PARTE DI PRIMING NEL RICONOSCIMENTO VISIVO? 20
1.2 ANATOMIA E FISIOLOGIA DELLA CORTECCIA PERIRINALE 22
1.2.1 ANATOMIA E CITOARCHITETTURA 22
1.2.2 MECCANISMI NEURALI CANDIDATI 23
1.2.3 LA PLASTICITÀ SINAPTICA PERIRINALE 27
1.2.4 SUGGERIMENTI COMPUTAZIONALI 28
1.2.5 MECCANISMI MOLECOLARI DELLA PLASTICITÀ PERIRINALE 31
1.2.6 EVIDENZE COMPORTAMENTALI 36
UNITA’ 2 UNITA’ 2 UNITA’ 2
UNITA’ 2 GLI ESPERI GLI ESPERI GLI ESPERI GLI ESPERIMENTIMENTIMENTI MENTI 39
2.1 UNA QUESTIONE DI METODO 40
2.2 MATERIALI E METODI 46
2.2.1 ANIMALI 46
2.2.2 COMPORTAMENTO 46
2.2.3 ELETTROFISIOLOGIA 47
2.3 RISULTATI 50
2.3.1 L’OVERTRAINING DETERMINA UNA BUONA MEMORIA DI RICONOSCIMENTO A 2 ORE 50
2.3.2 LA PAIRED PULSES LOW FREQUENCY STIMULATION INDUCE UN LTD NMDA-DIPENDENTE 51
2.3.3 L’APPRENDIMENTO VISIVO INDUCE UN INDEBOLIMENTO DELLA FORZA DELLE CONNESSIONI PERIRINALI
ORIZZONTALI 52
2.3.4 LA MEMORIA DI RICONOSCIMENTO VISIVO È SOSTENUTA DA CAMBIAMENTI COMPLEMENTARI DI LTD ED LTP
PERIRINALI 53
2.4 DISCUSSIONE 55
PROLOGO
William James ha dipinto i sensi del bambino come assaliti all’inizio da una “poderosa, roboante confusione”. AD un certo momento un ordine s’impone. “Toh guarda”, l’infante descrittoci da James osserva senza parole, “una cosa sta
cosando di nuovo!”.
Noi adulti, sofisticati come siamo, riteniamo perfettamente sensata la questione se l’euro che abbiamo in tasca in questo momento sia una delle monete affatto simili che stavano nella stessa tasca una settimana fa, per quanto poco interessati possiamo essere alla risposta. Ma la domanda si collega ad una teoria sulla continuità della forma e del movimento dei corpi fra due osservazioni non consecutive; riduciamo il flusso sbalorditivo degli eventi osservabili a sistema e semplicità, in senso comparativo, interpolando una storia o una traiettoria intermedia non vista fra le nostre osservazioni non consecutive di quello che scegliamo di considerare lo stesso oggetto, o la medesima sostanza. Correggiamo ripetutamente le nostre reificazioni e reidentificazioni, cercando di costruire il più semplice e il più pigro dei mondi possibili: il più semplice e il più pigro, in pratica, rispetto alle nostre osservazioni. La tacita massima cui facciamo riferimento è la legge di minima azione, una legge che non scopriamo nella natura, ma, piuttosto, alla natura imponiamo inconsciamente.
Questa tesi sarà un incontro fra simili suggestioni e le neuroscienze, prova a fornire delle basi neurobiologiche alla regola fin qui appresa: nel riconoscimento visivo di un oggetto il silenzio può essere d’oro. Proverò a
convincervi, sulla base d’esperimenti con protocolli comportamentali ed elettrofisiologici mai descritti prima, che la memorizzazione visiva di un oggetto si basa su una depressione a lungo termine e attività-dipendente delle risposte sinaptiche lungo le connessioni orizzontali della corteccia peririnale, una regione cerebrale ritenuta indispensabile per il nostro senso di familiarità durante il riconoscimento visivo. La tesi è dunque organizzata
in 6 sezioni riunite in due unità maggiori: nella sezione 1.1 vi descriverò un campionario delle attuali ipotesi sul funzionamento della memoria di riconoscimento visivo e lo farò adottando quell’approccio che ha fornito il primo metodo d’indagine in ciò che sarebbe diventato il campo delle neuroscienze: lo studio dei disturbi neurologici e della fisiopatologia cerebrale umana; nella sezione 1.2 sorvoleremo l’attuale paesaggio delle ipotesi sui meccanismi neurofisiologici che sono alla base della memoria di riconoscimento visivo: vi descriverò la corteccia peririnale, avrete una rassegna dei principali esperimenti effettuati dalla comunità scientifica per studiare i meccanismi neurali e molecolari che permettono la comparsa di questo senso e cercheremo di prendere qualche spunto dai modelli neurocomputazionali della memoria di riconoscimento visivo; nelle sezione 2.1 e 2.2 andremo al nucleo di questo lavoro. V’illustrerò le nuove tecniche d’overtraining e LTD attività-dipendente che ho messo a punto e gli esperimenti che ho condotto presso l’Istituto di Neuroscienze del C.N.R. di Pisa per tentare di dirimere la controversa questione sul rapporto tra la plasticità sinaptica della corteccia peririnale e la plasticità comportamentale che avviene grazie alla memoria di riconoscimento visivo; nella sezione 2.3 discuterò i risultati dei miei esperimenti e proverò ad aprirmi e ad aprirvi nuove e più efficaci possibilità di ricerca su come il nostro cervello ci semplifica la vita nel nostro vario e mutevole mondo
visivo e su cosa succede, quando non riusciamo più a sentire che “una cosa sta
cosando di nuovo”.
Come sempre accade, le idee non nascono in isolamento, quindi, se alla sua conclusione questo viaggio vi sarà apparso convincente, è solo per un lavoro di squadra fatto con i miei maestri che hanno messo a mia disposizione con generosità la loro competenza su questi temi e sulle tecniche. Il mio profondo ringraziamento va dunque a Nicoletta Berardi, Tommaso Pizzorusso e Lamberto Maffei. Grazie anche a Marcello Brunelli e a per le critiche e i preziosi suggerimenti che mi hanno dato leggendo il manoscritto. Inoltre, confesso che questo lavoro avrebbe visto la luce più tardi senza l’aiuto d’Andrea Angelucci, Roberto de Pasquale, Chiara Braschi e Carlo Orsini. Ringrazio anche i miei familiari, Paola e i miei amici per l’incoraggiamento. La responsabilità degli errori, ovviamente, rimane tutta mia.
UNITA’ 1
UNITA’ 1
UNITA’ 1
UNITA’ 1
Revisione del
Revisione del
Revisione del
1.1 UN APPROCCIO BASATO SUL PAZIENTE PER
LO STUDIO DELLA MEMORIA DI
RICONOSCIMENTO VISIVO
Ho conosciuto un paziente con amnesia anterograda durante una lezione del tirocinio di neurologia al V anno di Medicina. Ero con altri cinque studenti, il professore ed un suo assistente nell’edificio di Clinica Medica I dell’ospedale universitario “Santa Chiara” di Pisa. Il docente ci condusse a lato del letto del paziente, ci presentò e poi cominciò a conversare con lui.
“Da quanto sei qui?”
“Oh, da una settimana più o meno.” “Mmm … e perché? Cosa è successo?”
“Ho un problema ai denti. Ma tra un paio di giorni esco, devo andare ad aiutare mio padre al mercato.”
In realtà, il professore ci aveva spiegato prima della visita, che il paziente entrava e usciva dalla clinica da circa undici anni. Aveva cinquattasette anni ed era stato alcolista per una ventina d’anni. L’ultima volta, era stato ricoverato per un serio problema di malnutrizione. Suo padre era morto diversi anni prima. Il professore mostrò al paziente una cartella e gli chiese se l’avesse già vista prima. L’uomo la guardò e disse, “No, non mi pare.” Il professore volse lo sguardo verso l’assistente e disse, “Lui lo conosci, no?” Il paziente si sollevò su di un gomito, lo osservò e poi tese la mano, “No, non credo. Piacere dottore.” L’assistente gli strinse la mano e si presentarono.
“La settimana scorsa abbiamo visto queste fotografie.” disse il professore aprendo la cartella. Il paziente vi guardò dentro con una smorfia dubbiosa, ma rispose educatamente, “Beh, se lo dice lei …” Il professore estrasse le prime due fotografie, due automobili diverse e le mostrò all’uomo una di fianco all’altra. “Ti ricordi quale di queste due abbiamo visto l’altra settimana?”
“Nessuna”
“Va bene” insistette il professore “indicami allora quella che almeno ti sembra di aver … forse… già visto.” Il paziente indicò senza guardare quella sulla destra. L’assistente annotò qualcosa sul suo palmare. Il professore mostrò altre due foto, due alberi diversi.
“Quale di questi due ti ricordi?” gli chiese.
L’uomo posò l’indice su quello di sinistra, in silenzio. Dopo avergliene mostrate altre diciotto paia, il professore disse, “Ok, abbiamo finito. Grazie. Ah, senti … lo conosci … qui … il dottore?” Il paziente gurdò il professore, seguì il gesto della sua mano e fissò l’assistente. Si mise a sedere sul letto e gli strinse la mano presentandosi. Quando lasciammo la corsia, chiesi all’assistente come era andato il test. “E’ bravo, ne ha indovinate tredici.”
Le esperienze ci cambiano; gli incontri con il nostro ambiente alterano il nostro comportamento e modificano il nostro sistema nervoso. Quanto impariamo riflette i cambiamenti della struttura e delle connessioni dei neuroni nei nostri cervelli. Così, dopo che abbiamo fatto un’esperienza che ci ha lasciato dei ricordi, i nostri
cervelli non sono più quelli di prima. Per molti anni i neuroscienziati hanno tentato di localizzare ed identificare questi cambiamenti provocati dall’esperienza. All’inizio del secolo scorso, la ricerca delle basi neurali della memoria era lenta. Sebbene i cambiamenti individuali dei singoli neuroni sembrino semplici, il cervello consiste di molti miliardi di essi connessi fra loro secondo una topologia non ancora chiarita. Negli ultimi anni, però, tanti sforzi hanno cominciato a pagare.
1.1.1 La memoria di riconoscimento visivo
Il tipo più semplice d’apprendimento si ha quando impariamo a riconoscere stimoli visivi che abbiamo incontrato in precedenza. Considerate ad esempio come impariamo a riconoscere un particolare oggetto. Le informazioni riguardo agli elementi dello stimolo sono passate dalla retina alla corteccia visiva dove è effettuata una prima analisi delle caratteristiche più semplici. I risultati di queste analisi sono spediti alle regioni adiacenti della corteccia associativa nel lobo occipitale e poi ad altre aree del lobo temporale In qualche modo, riconosciamo queste configurazioni d’attività neurale come simili a quelle che abbiamo prodotto, quando abbiamo visto lo stesso oggetto nelle occasioni precedenti. Gran parte del cervello dei mammiferi è dedicata all’analisi degli stimoli sensoriali. Affinché un animale sia in grado di associare ad un dato stimolo un’adeguata risposta comportamentale, le connessioni fra il sistema percettivo e quello motorio devono essere rafforzate oppure indebolite.
Nei mammiferi che possiedono cervelli grandi e complessi gli stimoli visivi sono analizzati dalla corteccia visiva associativa. Molti ricercatori hanno studiato il ruolo delle regioni della corteccia visiva associativa nel cervello della scimmia. La corteccia visiva primaria riceve proiezioni dirette dal nucleo genicolato laterale del talamo e manda assoni alla corteccia prestriata. Questa regione manda a sua volta degli assoni alla corteccia temporale inferiore.
Molti esperimenti hanno dimostrato che i neuroni della corteccia temporale inferiore diventano attivi, quando all’animale sono mostrati stimoli tridimensionali. Alcuni di questi neuroni possono rispondere in maniera specifica a stimoli quali un viso o una mano. Presumibilmente, le caratteristiche recettive di questi neuroni sono state acquisite con l’esperienza. La fig. 1 mostra la risposta di un neurone che risponde meglio ad una vista di profilo della faccia di un’altra scimmia. Altri neuroni possono rispondere a viste frontali della stessa faccia.
Figura 1 Risposte ai volti della corteccia inferotemporale.Gli istogrammi mostrano la risposta di un neurone della corteccia inferotemporale di una scimmia a diverse prospettive della testa di una scimmia. Le barre orizzontali sotto ciascun istogramma indicano quando lo stimolo era presente.
Gli studi di lesione hanno confermato questi dati elettrofisiologici. Le scimmie che hanno lesioni bilaterali dei lobi temporali, hanno difficoltà a percepire stimoli visivi complessi; si dice che queste scimmie hanno una cecità psichica. Esse possono muoversi nel loro ambiente e possono vedere abbastanza bene da riuscire a prendere un oggetto. Hanno grandi difficoltà, però, a riconoscere cosa hanno preso. Possono prelevare degli oggetti da una scatola che contiene oggetti commestibili ed oggetti non commestibili, li portano alla bocca e mangiano ciò che è cibo, scartando i pezzi non commestibili. Se sono innanzi ad oggetti che spaventerebbero una scimmia normale, un serpente ad esempio, non hanno paura. Possiamo fare un semplice test di riconoscimento visivo con le scimmie: il
delayed not matching-to-sample task (fig. 2).
Figura 2 Delayed not matching to sample test. Una scimmia prima sposta un oggetto
campione per ottenere una ricompensa in cibo. Dopo un ritardo, due oggetti sono mostrati, e la memoria di riconoscimento è esaminata portando l’animale a scegliere l’oggetto che non combacia col modello.
Mostriamo un piccolo oggetto tridimensionale (il sample) prelevato da una gran raccolta d’oggetti messa insieme all’occorrenza. La scimmia sposta l’oggetto per scoprire e mangiare una nocciolina posta sotto l’oggetto. Dopo dieci secondi, mostriamo alla scimmia due oggetti: uno è come quello di prima, l’altro è nuovo. Se la scimmia sposta l’oggetto nuovo, troverà un’altra nocciolina, ma se sposta quello vecchio non trova niente. Per ogni prova possiamo usare un oggetto diverso. Questo compito è molto semplice e le scimmie lo imparano in pochi giorni. Se dopo questo addestramento rimovessimo alla scimmia entrambe le cortecce temporali inferiori, essa avrebbe bisogno di millecinquecento prove prima di riapprendere il compito e in ogni modo continuerebbero a sbagliare più del dieci per cento delle volte. Possiamo fare un ulteriore prova con queste povere scimmie: aspettare più di dieci secondi prima di presentare loro la scelta. I risultati che osserveremmo sarebbero disastrosi. Se fosse un uomo, un medico direbbe di avere a che fare con un caso d’amnesia anterograda. Il morbo d’Alzheimer n’è un esempio.
1.1.2 Il morbo d’Alzheimer
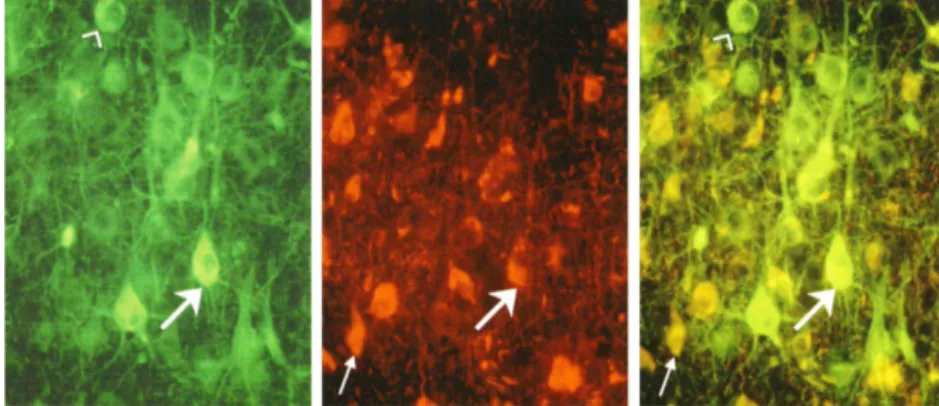
La malattia d’Alzheimer è una forma di demenza di cui tutti hanno sentito parlare. Da un punto di vista patognomico essa è strettamente correlata con il numero e con la distribuzione di quelli che oggi sono comunemente noti come grovigli neurofibrillari, le “pietre tombali” dei neuroni morti o morenti (fig. 3 e 5).
Figura 3 Neuroni di un paziente con Alzheimer. I neuroni normali contengono
neurofilamenti neuronali ma nessun groviglio neurofibrillare. (a) Tessuto cerebrale colorato con un metodo che rende verdi fluorescenti i neurofilamenti neuronali, mostrando così i neuroni sani. (b) La stessa regione cerebrale colorata per evidenziare la presenza di tau nei grovigli neurofibrillari, rivelata dalla fluorescenza rossa. (c) Sovrapposizione delle immagini a e b. Il neurone indicato dalla punta di freccia contiene neurofilamenti, ma non grovigli, per tanto è sano. Il neurone indicato dalla freccia grande ha i neurofilamenti, ma inizia anche a mostrare un accumulo di tau e quindi è malato. Il neurone indicato dalla freccia piccola in b e c è morto, poiché non contiene alcun neurofilamento. Il groviglio restante è la pietra tombale di un neurone ucciso dall’Alzheimer.
Infatti, come ha ipotizzato agli inizi del novecento Alzheimer, è molto probabile che la formazione dei grovigli nella corteccia cerebrale sia la causa dei sintomi della malattia. La microscopia elettronica indica che i principali elementi dei grovigli sono dei filamenti ad elica accoppiati, lunghe proteine fibrose intrecciate insieme come i trefoli di una fune. Oggi si sa che questi filamenti consistono nella proteina tau associata ai microtubuli. La tau normalmente funziona come un ponte tra i microtubuli dell’assone, assicurandone il decorso rettilineo e reciprocamente parallelo. Nella malattia d’Alzheimer, la tau si distacca dai microtubuli e si accumula nel soma. Questa alterazione del citoscheletro causa l’avvizzimento degli assoni, impedendo così il normale flusso d’informazioni nei neuroni colpiti. Cosa determina i cambiamenti della tau? L’attenzione è concentrata su un’altra proteina che si accumula nel cervello dei pazienti chiamata amiloide. L’amiloide si forma per un cattivo processamento da parte delle secretasi della proteina precorritrice dell’amiloide (APP) dovuto ad una mutazione dell’APP oppure delle preseniline PS1 e PS2 (fig. 4).
Figura 4 Vie di processamento della proteina precorritrice dell’amiloide.
Le prime cellule a morire sono molto probabilmente quelle del complesso prosencefalico basale, un nucleo a proiezione diffusa che utilizza come neurotrasmettitore l’acetilcolina, e quelle della corteccia peririnale. Nel prossimo capitolo vedrete che l’acetilcolina e la corteccia peririnale sono molto importanti nella plasticità sinaptica alla base della memoria di riconoscimento visivo.
Figura 5 Atrofia da Alzheimer.(a) A sinistra c’è la vista laterale di un cervello malato,
mentre a destra c’è il cervello sano. Notate come i solchi temporali e parietali sono particolarmente larghi indicando una degenerazione della neocorteccia nell’Alzheimer (b) A sinistra c’è un neurone piramidale di un cervello sano, mentre a destra è raffigurata la progressiva riduzione di ramificazioni e spine di una cellula isolata da un cervello malato.
Molta della ricerca psicologica sull’Alzheimer si è concentrata sull’obiettivo di discriminare il morbo dal normale invecchiamento e da altre condizioni, come la depressione, con cui spesso sono confusi i primi stadi della malattia. Solo di recente, si è cominciato a cercare di capire i meccanismi sottostanti il declino neurocognitivo del malato d’Alzheimer; molti cercano, per esempio, di capire se i
β α γ
Amyloid precursor protein (APP)
ββββ-secretasi taglio BACE ApoE
Via della β-secretasi 10% sAPP-β C99 Aββββ γ γγγγ-secretasi taglio Presenilin complex Aββββ40/Aββββ42 Neprilysina IDE β α γ
Amyloid precursor protein (APP)
α αα α-secretasi taglio TACE sAPP-α Neuroprotezione Adesione cellulare C83 Via della αααα-secretasi
deficit mnemonici del morbo siano dovuti a problemi d’acquisizione, consolidamento o recupero dei ricordi. La malattia d’Alzheimer è una demenza che produce gravi disturbi in molte aree cognitive, dalla percezione visiva al
problem solving. A causa di questa pluralità di deficit, la letteratura è molto
frammentaria nonostante alcuni studiosi sospettano che sotto ci sia un unico problema localizzato nel sistema esecutivo centrale del paziente, il sistema che risolve i conflitti di programmazione e orchestra le operazioni di processi concomitanti. A parte i gravi problemi d’attenzione quando le fonti d’informazioni sono molte e i deficit semantici che sollevano grandi controversie nella comunità scientifica, il disturbo cognitivo unanimemente riconosciuto in questa malattia è la perdita di memoria. La memoria a breve termine è vista come un deposito temporaneo a capacità limitata delle informazioni di cui si ha consapevolezza, mentre la memoria a lungo termine è vista come un deposito permanente a capacità illimitata. I pazienti d’Alzheimer hanno senza dubbi un deficit della memoria a lungo termine perché non possono tenere a mente una quantità sostanziale di nuove informazioni per più di pochi minuti, soprattutto se sono distratti da altri compiti cognitivi. Perfino se gli stimoli sono ripetuti più e più volte o se si forniscono indizi durante i test, la loro performance è scadente. La memoria a breve termine è invece a posto, anche se non completamente. Se gli diamo una lista di parole da ricordare, il paziente ne ricorda solo le ultime. Si ritiene che il problema maggiore per questi pazienti sia la fase d’acquisizione delle memorie. Fattori che facilitano la memorizzazione, come la familiarità di una parola o la conoscenza semantica e contestuale di uno stimolo, sono inutili. Quanto al consolidamento, se si riesce ad equalizzare il livello iniziale d’apprendimento fra pazienti ed individui sani, la velocità con cui vanno perse le informazioni è paragonabile fra i due gruppi. L’effetto della malattia sul richiamo delle memorie è molto difficile da testare a causa della gravità del problema d’acquisizione. Un modo per dimostrare che un deficit di richiamo contribuisce ai deficit mnemonici sarebbe quello di mostrare che i problemi diminuiscono, quando la difficoltà del richiamo è minimizzata dando per esempio degli indizi. Ma come ho già detto, gli indizi in questo caso non bastano.
E’ degno di nota il fatto che la maggiorparte dei pazienti d’Alzheimer comincia a presentare un difetto della memoria di riconoscimento visivo nei test di delayed
matched to sample prima che la malattia sia conclamata (Barbeau et al 2004). Qui
c’è un punto chiave della mia discussione: il deficit è probabilmente da imputare al danno della corteccia peririnale che comincia ad apparire prima che il soggetto diventi demente.
La memoria retrograda remota sembra invece abbastanza risparmiata anche se il gradiente temporale non è uguale a quello di un individuo sano.
Per quanto riguarda la memoria implicita, il dibattito fra gli studiosi è ancora molto acceso. La maggiorparte degli studi sono basati sul word stem test: si presenta al soggetto una lista di parole per qualche minuto e più tardi gli si presentano solo le lettere iniziali chiedendogli di completare le lettere con la prima parola che gli viene in mente. L’esperienza precedente del soggetto con le parole stimolo si evidenzia in un aumento della probabilità che egli completi le lettere mancanti formando la parola che ha visto prima. In alcuni studi i pazienti d’Alzheimer hanno ottenuto dei punteggi scarsi, ma altri ricercatori sostengono che i pazienti mostrano una buona memoria implicita, quando sono messi nelle migliori condizioni per affrontare l’acquisizione degli stimoli. In ogni caso, questa distinzione fra memoria implicita ed esplicita suscita molto interesse perché
ricorda molto i disturbi presenti nelle amnesie organiche come la sindrome di Korsakoff.
1.1.3 La sindrome di Korsakoff e l’amnesia mediotemporale
Nel 1889 Sergei Korsakoff, un medico russo, descrisse per primo un grave deficit mnemonico provocato da un danno cerebrale, e il disordine prese il suo nome. Il sintomo più espressivo della sindrome di Korsakoff è una grave amnesia anterograda; il paziente non riesce a formare nuove memorie nonostante possa ancora ricordare quelle acquisite prima della malattia. La sindrome di Korsakoff insorge il più delle volte negli alcolisti cronici a causa di una deficienza di vitamina B1. Siccome gli alcolisti ricavano molte calorie dall’alcol che bevono, disolito mangiano pochissimo così che il loro introito di vitamine è scarso. Sembra inoltre che l’alcol interferisca con l’assorbimento della vitamina B1 e la
conseguente deficienza provoca un danno cerebrale particolarmente evidente nel talamo dorsomediale e nei corpi mamilliari. Queste non sono le uniche aree del cervello che provocano l’amnesia anterograda.
Scoville e Milner riportarono nel 1957 che il danneggiamento bilaterale del lobo temporale mediale - una struttura che comprende l’ippocampo, la corteccia entorinale, la corteccia peririnale e la corteccia paraippocampale- produce un deficit di memoria nell’uomo apparentemente simile alla sindrome di Korsakoff. Fino allora erano già state effettuate altre asportazioni chirurgiche monolaterali di lobi temporali mediali per migliorare le condizioni di pazienti affetti da gravi forme d’epilessia medio-temporale resistente ai farmaci. Ma fu solo l’operazione su H.M. che provocò l’amnesia anterograda nel paziente. Gli studi successivi post
mortem su altri casi simili effettuati da Milner e Squire risolsero il mistero. I
pazienti che avevano avuto la stessa storia clinica di H.M. avevano già un danno all’altra corteccia temporale mediale, quella non asportata.
Il caso di H.M. è stato studiato in maniera accurata perché il suo deficit è relativamente puro. Le sue abilità intellettuali e la sua memoria verbale immediata sembrano normali. Il paziente può ripetere sette numeri in ordine crescente e cinque numeri in ordine decrescente, è in grado di sostenere una conversazione, ripetere una frase e compiere semplici calcoli aritmetici a mente. Ha un’amnesia parziale per gli eventi che precedono l’operazione di due anni, ma è capace di ricordare benissimo cose avvenute molti anni prima. H.M. non mostrò alcun cambiamento della personalità dopo l’operazione ed è rimasto un uomo educato. Dal giorno della sua operazione, quando aveva ventisette anni, non è più stato in grado, tuttavia, di ricordare niente di nuovo. Non riesce a ricordare i nomi delle persone che ha incontrato dopo l’operazione e se si allontana da casa non sa più ritrovare la strada del ritorno perché dopo l’operazione, i suoi familiari hanno cambiato casa. H.M. è consapevole della sua malattia e spesso dice cose come questa:
Ogni giorno è unico, qualunque gioia abbia avuto, e qualsiasi tristezza abbia avuto … Proprio ora, ho un dubbio. Ho fatto o detto qualcosa di sbagliato? Vede, in questo momento tutto mi sembra chiaro, ma cosa è successo poco fa? E’ questo che mi preoccupa. E’ come risvegliarsi da un sogno; semplicemente non mi ricordo niente.
H.M. è capace di ricordarsi poche informazioni verbali fin tanto che non è distratto; ripetendo con le labbra continuamente può tenere a mente una cosa anche a lungo. Ma se smette di ripetere, se si distrae un attimo, se ne dimentica. Si dimentica perfino che fino a poco fa stava ripetendo tra se e se qualcosa. Svolge di buon grado i compiti ripetitivi: siccome dimentica subito tutto, non si annoia facilmente. Può leggere all’infinito la stessa rivista e ridere per la stessa barzelletta trovandola nuova e divertente ogni volta. Trascorre tipicamente il suo tempo risolvendo cruciverba e guardando la televisione. Milner ne concluse che la struttura rimossa non contenesse memorie a lungo termine né memorie verbali; ciò che è stato danneggiato è la capacità di convertire le memorie immediate in memorie a lungo termine.
Il deficit di H.M. è drammatico e allo stesso tempo straordinario. Il suo problema di memoria non si estende a tutte le capacità d’apprendimento. H.M. mostra ancora una buona memoria percettiva secondo Milner. Nella fig. 6 ci sono delle coppie d’oggetti prese da un test per la capacità di riconoscere disegni incompleti; notate come i disegni siano man mano più completi.
Figura 6 Esempio di disegni incompleti.
Ai pazienti viene dapprima mostrata la versione meno completa di ciascuno dei venti oggetti. Se non riconoscono la figura, gliene mostrano di volta in volta una un poco più completa finché non la riconoscono. Un’ora dopo si rifà il test partendo dalla prima versione. H.M. dopo un’ora mostrò un notevole miglioramento che durò per altri quattro mesi. Innegabilmente, non era la memoria a lungo termine tout court che H.M. aveva perso. E nonostante ciò, H.M. negò sempre a Brenda Milner di aver già visto quei disegni; in un certo senso, aveva perso il senso di familiarità con essi.
H.M. impara bene a copiare disegni visti attraverso uno specchio e non ha difficoltà ad apprendere nuove strategie per giochi anche relativamente difficili come la Torre di Hanoi a cinque anelli che richiede una precisa configurazione di almeno ventuno mosse. Eppure ogni volta si sorprende di esserne in grado.
Da questi esempi potete capire come i pazienti come H.M. non hanno problemi nelle performance, ma solo nella loro capacità di parlarne. Non riescono ad
affermare che ricordano di aver già visto un oggetto o di aver già svolto un
determinato esercizio anche se lo sanno fare. Qual è la differenza fra imparare a fornire una determinata risposta ad un dato stimolo ed essere in grado di ricordare un’esperienza? Disegnare un oggetto visto attraverso uno specchio, per quanto difficile possa essere, è diverso dal descrivere l’apparato e l’occasione in cui si è avuto a che fare con esso. Quando una persona normale impara ad eseguire un esercizio, apprende molto più di un particolare comportamento. La persona ne memorizza gli stimoli associati: quando è avvenuto l’addestramento, chi era presente, com’era la stanza, come si sentiva in quel momento e così via. Quando la persona rivede l’apparato, l’atto percettivo può evocare molte risposte. La persona potrà dire quando l’ha visto e chi c’era quella volta nella stanza.
Al contrario, le memorie di una persona con amnesia anterograda sono ristrette al particolare compito che ha imparato. Quando rivede l’apparato non ricorda automaticamente quando l’ha già visto e tutte le altre cose inerenti. Per qualche motivo, non ricorda il contesto in cui ha imparato il compito. Larry Squire ha chiamato questi due tipi di memoria conoscenza procedurale e conoscenza
dichiarativa rifacendosi ad una distinzione già fatta anni prima dal filosofo
Gilbert Ryle (fig. 7).
Figura 7 Tassonomia dei sistemi di memoria dei mammiferi. Questo schema elenca
le strutture cerebrali e le connessioni che sono ritenute di maggiore importanza per la memoria dichiarativa e per quella non dichiarativa.
I pazienti con amnesia anterograda sembra che abbiano perso la memoria dichiarativa perchè non sono più in grado di integrare le nuove esperienze in un tutto coeso che possano ricordare e descrivere. Rimane un dubbio: si tratta di un problema di connessione fra i vari aspetti contestuali di una particolare situazione
EMOZIONI: amigdala, ippocampo, cervelletto M. SCHELETRICO: cervelletto MEMORIA A LUNGO TERMINE MEMORIA DICHIARATIVA (O ESPLICITA) MEMORIA NON DICHIARATIVA (O IMPLICITA) MEMORIA EPISODICA MEMORIA SEMANTICA PRIMING MEMORIA PROCEDURALE CONDIZIONAMENTO CLASSICO APPRENDIMENTO ASSOCIATIVO APPRENDIMENTO NON ASSOCIATIVO (ABITUAZIONE, SENSIBILIZZAZIONE) CONDIZIONAMENTO OPERANTE Lobo temporale mediale, ippocampo, neocorteccia
Neocorteccia
Gangli basali, cervelletto, corteccia
Riflessi
Circuiti cortico-striatali
o piuttosto è un problema di percezione olistica del complesso stimolo esperito?Il senso di questa domanda diverrà forse più chiaro alla fine di questo capitolo.
1.1.4 Familiarità e recollection
Immaginate di stare una sera sul vostro divano a guardare svogliatamente la televisione; parte la pubblicità e decidete di fare un rapido cambio di canale, così capitate sulla scena di un film in cui una ragazza dai capelli rossi mostra un vestito azzurro con una rosa sul fianco ad un bambino sdraiato sotto le coperte. Dopo una frazione di secondo possono succedere due cose che riguardano il rapporto tra voi e quel film: quelle immagini non vi dicono niente oppure pensate che quel film l’avete gia visto, ma non ricordate ancora quale sia. E’ molto probabile che nella decina di secondi successivi a quel pensiero vi torni tutto alla mente e vi diciate in silenzio “Ma certo, si tratta di “Fanny e Alexander”… di Bergman… qui deve essere ancora il primo dei cinque capitoli… era un film dove tutto poteva succedere… il colore è particolare… sarà dell’81 … no, è dell’82… l’ho visto quattro o cinque anni fa… ero con Emmanuele… all’Arsenale… terzo spettacolo … ero molto stanco quella sera e c’era un fastidioso ronzio in sala… ora me lo rivedo”. A quanto pare, sembra che nella sequenza temporale appena descritta si siano attivati in successione due diversi meccanismi mnemonici. Il primo è una discriminazione di familiarità ( io so di aver già visto quella scena, ma non ricordo né dove né quando, nulla del contesto) e il secondo è un vero e proprio ricordarsi l’episodio in cui ho visto il film in passato (recollection) (fig.
8).
Figura 8 Le due componenti della memoria di riconoscimento
Tenete presente che, in realtà, la successione dei due meccanismi avviene spesso in maniera molto più rapida tanto da esaurirsi nel giro di un secondo. Se ci applicassero degli elettrodi sullo scalpo e ci mostrassero una fotografia che abbiamo già visto ventiquattro ore prima quello che vedremmo sarebbe molto probabilmente simile a quanto illustrato nella fig. 9. Dopo circa 400 ms dalla
MEMORIA DI RICONOSCIMENTO
FAMILIARITÀ RECOLLECTION
IPPOCAMPO PERIRINALE
presentazione della fotografia comparirebbe un potenziale evocato (ERP) negativo nella regione medio frontale associato alla familiarità; dopo circa altri 100 ms comparirebbe un ERP positivo nella regione parietale associato alla
recollection. Se l’ERP parietale non compare state certi che direte, sbagliando,
che quella fotografia non l’avete mai vista (Curran 2004).
Figura 9 ERP associati alla familiarità e alla recollection. (a) ERP mediofrontale
associato alla familiarità. (b) ERP parietale associato alla recollection. In questo studio, la familiarità era evidente sia per gli stimoli studiati attentamente (Deep hit) sia per quelli visti disattentamente (Shallow hit), mentre la recollection era più pronunciata solo per gli stimoli studiati attentamente.
Questa differenza qualitativa fra i due ERP deve suggerirvi che i due processi mnemonici dipendono da due regioni cerebrali diverse. Eppure, ancora oggi, c’è un infiammato dibattito sulla questione. Un’ipotesi parsimoniosa vorrebbe, infatti, che, sulla base delle evidenze raccolte dai casi di H.M. e d’altri pazienti con lesioni al lobo mediotemporale, familiarità e recollection dipendono dalla stessa struttura (Squire 1994, Squire e Zola 1998). Le interpretazioni sul caso di H.M. le abbiamo già studiate nei paragrafi precedenti. Dedichiamo ora la nostra attenzione alle ragioni di coloro che, piuttosto, sostengono una separazione anatomo-funzionale tra familiarità e recollection (Eichenbaum et al. 2007). Partiamo dall’anatomia. Si è affermato che il lobo temporale mediale comprende l’ippocampo, la corteccia entorinale, quella peririnale e quelle paraippocampali. La maggiorparte degli input neocorticali alle cortecce paraippocampali vengono da aree che processano informazioni polimodali di carattere spaziale (where), mentre molte delle afferenze neocorticali alla corteccia peririnale provengono da aree associative unimodali che elaborano le informazioni su com’è fatto lo stimolo (what). Le vie del what e del where convergono nell’ippocampo passando attraverso la corteccia entorinale dove, tuttavia, sono ancora separate. Dopo averle congiunte ed elaborate, l’ippocampo rimanda indietro le informazioni lungo l’entorinale, la peririnale e le regioni paraippocampali alla neocorteccia. (fig. 10)
Figura 10 La peririnale nella via del what. (a) Vista laterale (sinistra) e mediale (destra)
della corteccia cerebrale del macaco. La vista laterale mostra la localizzazione e l’estensione del via del what (blu) e alcune delle connessioni fra le regioni corticali che ne fanno parte (frecce). La vista mediale mostra la localizzazione e l’estensione della corteccia peririnale. Abbreviazioni: ls, solco laterale; sts, solco temporale superiore; V1-V4, TEO e TE, aree visive corticali. (b) Il diagramma mostra alcune connessioni della corteccia peririnale. Le frecce doppie indicano connessioni reciproche.
Data una simile organizzazione, è possibile ipotizzare che la recollection avvenga nell’ippocampo, mentre la familiarità abbia luogo nella corteccia peririnale. In effetti, ci sono soggetti che hanno avuto un attacco ischemico transitorio (TIA) focalizzato nel solo ippocampo senza nessun’atrofia nelle restanti regioni del lobo medio temporale. Questi pazienti presentano disturbi di
recollection, ma non di familiarità (Mayes et al. 2002; Turriziani et al 2004;
Holdstock et al 2005). I lettori più attenti potranno suggerire, a questo punto, di utilizzare le tecniche d’imaging funzionale per dirimere la questione in modo definitivo. Come vedremo, il loro suggerimento non è del tutto fuoristrada, a patto che si tengano in conto i palesi limiti che questi metodi d’indagine mostrano per il momento.
Prima di tutto, è poco probabile che un qualsiasi processo di riconoscimento sia puramente ascrivibile alla familiarità o alla recollection. Per far fronte a questo problema, alcuni ricercatori molto astuti hanno deciso di utilizzare le curve di
receiving operating characteristic ( ROC ) in studi di correlazione ( per un
approfondimento sulle ROC e più in generale sull’uso della teoria della detezione dei segnali in psicofisica vedi Stanislaw e Todorov 1999 ). Le misure della memoria di riconoscimento descrivono la discriminabilità come una funzione composta di un hit rate, la probabilità di confermare un oggetto vecchio come vecchio, e di un false alarm rate, la probabilità di confermare in modo scorretto un oggetto nuovo come vecchio. Ogni singola misura d’entrambi i rate determina
un punto sullo spazio ROC. Supponete di avere un esperimento in cui il soggetto classifica ogni prova di riconoscimento su una scala da 1 a 6, dove 6 corrisponde alla certezza da parte del soggetto di aver già visto l’oggetto che gli è stato mostrato. Potete calcolare un hit rate e un false alarm rate per ognuno dei 5 criteri. L’approccio è quello di confrontare la forma di una ROC normale con quella prodotta da un paziente con danno ippocampale ( Yonelinas et al 2002). Queste ROC sono tipicamente curvilinee, ma differiscono nel fatto che la curva prodotta dai controlli è asimmetrica, mentre quella dei pazienti è simmetrica (fig.
11).
Figura 11 Curve ROC ipotetiche simmetriche e asimmetriche. Il grado d’asimmetria
evidente in una ROC è quantificato di solito dalla pendenza (slope) ottenuta fittando il modello di Yoselinas ai dati. Una slope di 1 denota una ROC simmetrica, mentre una ROC inferiore a 1 denota una ROC asimmetrica.
Questi dati sono stati interpretati alla luce di un modello di detezione a doppio processo (Yonelinas 1998), secondo il quale il grado d’asimmetria in una ROC riflette direttamente quanto del processo di recollection contribuisce al giudizio di riconoscimento. Di conseguenza, una ROC simmetrica dice che il riconoscimento è basato solo sulla familiarità, mentre una ROC asimmetrica implica anche l’uso della recollection. La scoperta che le curve prodotte dai pazienti ippocampali sono simmetriche suggerisce che l’ippocampo è coinvolto nella recollection.
Il secondo problema nasce dal fatto che le strutture presenti all’interno del lobo medio temporale sono molto vicine fra loro, al limite di risoluzione della risonanza magnetica funzionale. Per questo motivo alcuni ricercatori hanno stabilito che il giro paraippocampale anteriore corrisponde grossolanamente alla corteccia peririnale. Con questi due accorgimenti si è potuta avvalorare l’ipotesi che l’ippocampo sia coinvolto nella recollection e che la peririnale abbia invece a che fare con la familiarità.
Tuttavia, certi dubbi possono essere risolti solamente attraverso l’uso di tecniche più invasive perciò è d’obbligo passare allo studio sugli animali, almeno per chiarire la questione. Sia nelle scimmie che nei roditori si è trovata una forte convergenza dei risultati ottenuti mediante lesioni e attraverso l’elettrofisiologia a sostegno dell’idea che le diverse strutture del lobo medio temporale contribuiscono in maniere differenti alla memoria di riconoscimento. Le lesioni della corteccia peririnale hanno effetti devastanti sul riconoscimento visivo degli oggetti. Al contrario, se la peririnale è intatta e viene distrutto l’ippocampo, l’animale non ha problemi a riconoscere un oggetto che aveva già visto. Piuttosto, gli animali che hanno subito un danno solo all’ippocampo mostrano gravi problemi nel riconoscere determinati contesti spaziali. Certo, da un punto di vista logico-analitico, non ha senso parlare di familiarità e recollection in animali che non condividono il nostro stesso gioco linguistico o forma di vita; ci basta sapere, in ogni modo, che le stesse ROC che indicano la presenza di due diversi processi di riconoscimento nell’uomo sono riproducibili anche nel ratto (Fortin et al. 2004). In questo caso, si cerca di ottimizzare i risultati usando stimoli olfattivi visto che il ratto è un animale macrosmatico. In questa variante di delayed non
match-to-sample, i ratti sono addestrati con una serie d’odori che poi dovranno
riconoscere in condizioni a diverso livello di difficoltà. Come negli esseri umani, le ROC dei ratti sani sono asimmetriche e curvilinee suggerendo la presenza sia di un elemento di familiarità sia di una componente ascrivibile alla recollection. Le ROC dei ratti con lesioni all’ippocampo sono simmetriche e identiche alla componente di familiarità delle ROC degli animali sani: i ratti con l’ippocampo danneggiato hanno usato durante il riconoscimento il senso di familiarità.
1.1.5 Il riconoscimento visivo è un processo percettivo
Proviamo ora a guardare il problema sotto un’altra prospettiva. Nei primati il senso più importante per riconoscere un oggetto è la vista e potrebbe essere abbastanza sensato ritenere che la corteccia peririnale non sia altro che la stazione neurocomputazionale più complessa della via visiva ventrale. Dopo l’area V1, le proiezioni anatomiche ascendenti danno origine a due vie visive organizzate gerarchicamente. Una via si estende dorsalmente fino al lobo parietale, includendo l’area MT e le aree visive della corteccia parietale posteriore, l’altra si estende ventralmente fino al lobo temporale, includendo le aree V4 e la corteccia temporale inferiore (Felleman e Van Essen 1991). Le aree corticali della via dorsale si occupano di “dove” si trovi un oggetto nello spazio visivo, mentre le aree corticali della via ventrale si occupano di “che cosa” si sta osservando (Ungerleider e Mishkin 1982).Poniamo il caso di avere una corteccia V1 non ben sviluppata a causa di una cecità infantile che abbiamo risolto da qualche giorno con un intervento chirurgico. In questo caso, la nostra acuità visiva sarebbe molto bassa. Ci sottopongono ad un test di riconoscimento visivo. Il primo giorno ci mostrano un reticolo di bande orizzontali con frequenza spaziale A; il giorno successivo ci mostrano appaiati due reticoli di cui uno ha frequenza spaziale A e l’altro ha una frequenza spaziale B di poco diversa da A e ci chiedono di riconoscere quale dei due reticoli abbiamo visto il giorno precedente. Scegliere nella nostra sfortunata situazione corrisponderebbe al lancio di una monetina. Un filosofo del Settecento, che non sa niente di fisiologia del sistema visivo, ne concluderebbe che abbiamo
un problema di memoria. La sua osservazione ci sembrerebbe sbagliata. Ma non fino in fondo. Se avessimo avuto modo di fare più esperienza visiva con le diverse frequenze spaziali del mondo circostante, i nostri circuiti in V1 si sarebbero sviluppati imparando a tenere distinte la due frequenze e a riconoscere quella A. In una prospettiva clinica, un difetto del genere, nel riconoscere gli oggetti potrebbe essere descritto come una forma d’agnosia visiva.
1.1.6 L’agnosia visiva
Lo studio dell’agnosia ha una lunga storia di controversie con alcuni autori che hanno addirittura dubitato della sua reale esistenza. La rarità di questo disturbo ha contribuito a tenere alto lo scetticismo finché gli accurati studi degli ultimi decenni hanno stabilito che ci sono realmente pazienti agnosici per gli oggetti visivi, senza per questo avere alcun deficit ad un livello elementare delle capacità visive e senza alcun deficit intellettivo. Purtroppo, ad oggi, non si è riusciti ancora a trovare le basi anatomo-patologiche di questo disturbo. Lissauer ha proposto che il riconoscimento visivo degli oggetti negli agnosici possa essere rovinato in due modi: danneggiando la percezione visiva per cui il paziente non può riconoscere l’oggetto perché non lo vede bene, e danneggiando il processo d’associazione fra il percetto ed il suo significato perciò il paziente non riconosce gli oggetti perché non ha accesso alla loro conoscenza. Il primo tipo d’agnosia è stato denominato agnosia appercettiva e il secondo agnosia associativa (Farah e Feinberg 1997). I pazienti con agnosia appercettiva hanno buone acuità visiva, discriminazione dei contrasti, percezione dei colori e altre capacità visive elementari. La percezione delle forme è, però, deficitaria quindi, ad esempio, i pazienti non sono in grado di riconoscere disegni, lettere e perfino semplici forme geometriche (Benson e Greenberg 1969). La fig. 12 mostra cosa succede se a questi pazienti viene chiesto di ricopiare delle figure. Il riconoscimento d’oggetti reali può essere qualche volta migliore del riconoscimento delle forme geometriche, ma solo perché sono disponibili indizi come le dimensioni, il colore, la tessitura, la simmetria e anche il movimento dell’oggetto.
Figura 12 Tentativi di copiare semplici figure da parte di un paziente con agnosia apperccettiva.
Le capacità di percepire proprietà visive locali sono buone, ma i soggetti non riescono a metterle insieme per avere una struttura globale dell’oggetto. Il movimento è utile perché fornisce indizi attraverso i movimenti locali correlati. Un tipo particolare d’agnosia appercettiva è la simultagnosia ventrale (Kinsbourne e Warrington 1962). I pazienti che ne soffrono possono riconoscere l’intero oggetto, ma sono limitati nel numero d’oggetti che possono riconoscere in un determinato intervallo di tempo. Le loro descrizioni d’oggetti molto complessi sono lente e procedono un pezzo alla volta. Leggere è un’impresa titanica per questi pazienti.
Nell’agnosia associativa, la percezione visiva sembra molto migliore che in quella appercettiva. Non di meno, non riescono a riconoscere visivamente gli oggetti salvo che non glieli fate toccare o non ne gliene date una definizione. Il deficit non è un problema verbale perché questi pazienti non sono nemmeno in grado di mimare l’uso dell’oggetto o raggrupparlo con altri oggetti diversi, ma appartenenti alla stessa classe semantica (Feinberg et al. 1986). Il modo più semplice di interpretare quest’agnosia è ipotizzare una disconnessione fra le rappresentazioni visive e le aree responsabili del linguaggio o della memoria (Geschwind 1965) anche se, in questo caso, sarebbe più corretto parlare d’agnosia ottica, una forma d’anomia limitata ai nomi d’oggetti visivi. Sebbene gli agnosici associativi possano copiare dei disegni, guardando più attentamente a come svolgono il compito ci si accorge che le loro capacità percettive non sono completamente integre. I loro disegni sono fatti linea per linea e controllando ogni secondo il disegno che devono copiare. Secondo l’ottica finora adottata potremmo allora sostenere che l’agnosia associativa non è il risultato di un danneggiamento della percezione o della memoria, ma dell’elaborazione visiva ad alto livello di uno stimolo visivo complesso.
Questo è un problema analogo a quanto succede quando danneggiamo la corteccia peririnale di una scimmia o di un ratto. Siccome la corteccia peririnale serve all’integrazione delle caratteristiche di un oggetto, una scimmia con la peririnale danneggiata è in grado di distinguere - ed eventualmente riconoscere – due oggetti diversi per forma o solo per il colore, ma non due oggetti uguali in tutto tranne che per un piccolo dettaglio (feature ambiguity; Buckley et al 2001; Bussey et al 2003; Saksida et al 2006). La percezione olistica delle caratteristiche di un oggetto è l’unica funzione visiva della peririnale, infatti, una scimmia non ha difficoltà a ritenere che due rappresentazioni dello stesso oggetto (semanticamente uguali) che differiscono solo per l’orientamento, le dimensioni o i colori si riferiscono effettivamente alla stessa cosa.
Sotto questa luce il fenomeno d’apprendimento che avviene nella corteccia peririnale sembra molto simile ad una forma di priming.
1.1.7 C’è una parte di priming nel riconoscimento visivo?
Il priming è un tipo di memoria non dichiarativo e che quindi non dipende da processi consci né nella sua formazione né nel richiamo dell’informazione acquisita. I pazienti con amnesia anterograda dovuta alla lesione del lobo mediotemporale non mostrano alcun deficit nei classici test che valutano le loro capacità di priming percettivo. Stando a quest’osservazione potrà sembrarvi fuori luogo ritenere che la corteccia peririnale possa contribuire alla memoria diriconoscimento mediante un fenomeno di priming che classicamente è descritto solo nella neocorteccia. D’altro canto la corteccia peririnale è inglobata nel sistema del lobo mediotemporale solo perché storicamente essa era asportata con le altre strutture del sistema nei pazienti amnesici come H.M. Dal punto di vista istologico, la peririnale è però molto diversa dall’ippocampo essendo molto più simile all’adiacente corteccia TE, un’area neocorticale. La corteccia peririnale umana è localizzata mediante fMRI nella porzione più anteriore del giro paraippocampale (Gonsalves et al 2005; Eichenbaum et al 2007) e il priming neurale è stato descritto nella corteccia paraippocampale (Bunzeck et al 2006; Schacter et al 2007), nel giro fusiforme (Vuillemer et al 2002; Eger et al 2005) e nella corteccia entorinale (Miller e Desimone 1994). Sopra si è già affermato che la corteccia peririnale può essere compresa benissimo nella via visiva ventrale. Nel prossimo capitolo vedremo anche che la discriminazione di familiarità di uno stimolo visivo nella peririnale è segnalata da una soppressione dell’attività neurale. Questo tratto elettrofisiologico è tipico proprio del priming percettivo (Schacter e Buckner 1998; Wiggs e Martin 1998; Tsodyks e Gilbert 2004).
La memoria di riconoscimento visivo è tradizionalmente descritta come una memoria dichiarativa. Questa classificazione viene operata non in base alla consapevolezza che un soggetto ha del suo ricordo, ma solo perché la memoria di riconoscimento visivo si estingue con la lesione dei lobi temporali mediali tanto che lo sviluppo della memoria dichiarativa è stata studiata nel bambino preverbale proprio usando il test di comparazione visiva appaiata ( per un approfondimento vedi Berardi e Pizzorusso 2006). In sé, questo test non dice nulla sulla consapevolezza delle memorie di un bambino in quanto si basa semplicemente sulla loro naturale tendenza – condivisa da scimmie e roditori - a fissare un oggetto nuovo rispetto ad uno già visto. La scimmia mostra i primi sbiaditi segni di riconoscimento visivo all’età di un mese anche se il suo ippocampo, ma non la peririnale ad esempio, è stato distrutto (Bachevalier e Vargha-Khadem 2005). Senza l’ippocampo, però, le capacità di riconoscimento visivo restano deboli anche in età adulta. Il priming visivo peririnale potrebbe essere allora una terza componente più primitiva da aggiungere o sostituire alla familiarità e alla
recollection nel computo degli elementi della memoria di riconoscimento.
Ora siamo pronti per cominciare ad affrontare la domanda principale a cui questo lavoro cercherà di fornire una risposta: quali sono i meccanismi plastici che modellano i circuiti della corteccia peririnale permettendoci di riconoscere visivamente un oggetto che abbiamo già visto in precedenza? I fenomeni plastici in V1 che ci consentono di riconoscere differenti frequenze spaziali, sono abbastanza noti oggi; da una decina d’anni, il punto interrogativo è stato spostato in avanti lungo le vie visive. Sembra che sia giunta l’ora di far scorrere il cursore fino all’ultima stazione della via visiva ventrale.
1.2 ANATOMIA E FISIOLOGIA DELLA CORTECCIA PERIRINALE
1.2.1 Anatomia e citoarchitettura
In questo capitolo approfondiremo i meccanismi elettrofisiologici e molecolari che consolidano quella parte della memoria di riconoscimento visivo che compete alla corteccia peririnale (fig. 13).
Figura 13 Anatomia del sistema mediotemporale. La regione omologa con la corteccia
paraippocampaledel macaco è nota come corteccia post rinalenei roditori.Il confine tra la corteccia entorinale e quella peririnale nei roditori e nel macaco si trova vicino il fondo del solco rinale (rs). Nell’uomo non c’è il solco rinale e la maggiorparte della corteccia peririnale si trova dentro il solco collaterale (cs).
La corteccia peririnale appartiene alle aree 35 e 36 di Broadmann (Burwell et al. 1995, 2001; Suzuki e Amaral 2003) ed è una striscia di corteccia che nei primati si trova anteriormente e inferiormente nel lobo mediotemporale (fig. 14). E’ situata lateralmente rispetto all’ippocampo al quale manda numerosi inputs (Burwell e Amaral 1998; Lavenex e Amaral 2000) e da cui è separata dalla corteccia entorinale. Si trova invece medialmente e anteriormente rispetto all’area TE in cui avvengono computazioni visive di alto livello. La peririnale riceve informazioni da molte regioni della corteccia cerebrale, incluse le aree visive, uditive, olfattive e somatosensoriali e input di rientro dall’ippocampo. Questa felice organizzazione anatomo-funzionale rende la corteccia peririnale una stazione critica per la codificazione crossmodale degli oggetti (Witter et al. 2000). Nei roditori questo schema è grossolanamente simile (Burwell et al 1995; Burwell 2001; Furtak et al 2007) anche se le afferenze visive tendono a concentrarsi senza
un organizzazione retinotopica nella regione più caudale della corteccia peririnale (Naber et al 2000).
Figura 14 Diagramma del flusso d’informazioni sensoriali tra le aree sensoriali, la peririnale e l’ippocampo. Lo spessore delle frecce indica le dimensioni delle vie.
Il ruolo fondamentale svolto dalla peririnale per la memoria di riconoscimento è stato stabilito mediante studi d’ablazione principalmente nella scimmia (Zola-Morgan et al. 1989; Gaffan e Murray 1992), ma anche nel ratto (Otto e Eichenbaum 1992). In questi casi si nota un marcato deficit soprattutto nei compiti visivi di delayed matching e non-matching to sample, i quali dipendono dalla capacità di giudicare al momento del test se singoli oggetti che erano stati presentati per poche volte durante la familiarizzazione sono gli stessi che sono ora presentati (Murray e Bussey 1999; Brown e Aggleton 2001).
1.2.2 Meccanismi neurali candidati
Se la corteccia peririnale è così importante per la discriminazione di familiarità, esistono dei meccanismi sfruttati dai suoi neuroni che possono spiegare i risultati
Postrinale
Peririnale
Entorinale
Ippocampo
Subiculum
Olfattivo Auditivo Somatosensoriale
le
Visivo
comportamentali? Qualsiasi meccanismo deve essere in grado di spiegare un tipo d’apprendimento che avviene dopo una singola esposizione, dura a lungo e ha un’enorme capacità visto che ogni giorno ci ricordiamo di aver già visto molti oggetti per altro abbastanza complessi. Il meccanismo dovrebbe manifestarsi sia con addestramento sia senza addestramento visto che la nostra capacità di riconoscere se è la prima volta che vediamo un oggetto non è qualcosa che impariamo a fare. Si tenga presente che spesso ci ricordiamo d’oggetti visti in precedenza solo una o due volte e che quindi non sono molto familiari. Registrando l’attività elettrica cellulare nella peririnale di scimmie che stavano svolgendo compiti di riconoscimento, si sono fatti i primi passi per capire come tutto questo possa essere implementato nel cervello (Miller e Desimone 1994; Brown e Xiang 1998). Presentando all’animale un oggetto che è stato già visto o che non è mai stato visto si possono misurare differenze della risposta, dell’attività sostenuta fra la prima e la seconda presentazione, aumenti o diminuzioni della scarica e sincronizzazioni dell’attività di due o più cellule (fig.
15).
Figura 15 Schema dei tipi di attività neurale peririnale durante un compito di discriminazione di familiarità. Le dimensioni delle lettere rappresentano la grandezza
della risposta ad uno stimolo individuale. I) Le risposte neurali possono essere più grandi o più piccole in sessioni di match o di non match durante i test in cui la ripetizione di uno stimolo bersaglio deve essere giudicata ad ogni sessione e il numero di stimoli usati nel test è piccolo; II) L’attività sostenuta tra la prima presentazione di uno stimolo e la sua ripresentazione è rappresentata dalla freccia tratteggiata verde; III) Quando un animale è addestrato a rispondere alla ripetizione di uno specifico stimolo mediante ricompensa, le risposte alla ripetizione dello stimolo possono aumentare; IV) La risposta quando uno stimolo è gia stato incontrato prima è ridotta rispetto alla prima presentazione; V) La coincidenza approssimativa degli spikes di due neuroni potrebbe fornire delle informazioni sulla familiarità dello stimolo, per esempio se questa sincronizzazione cambia tra la prima e la seconda presentazione dello stimolo.
Tuttavia solo per uno di questi meccanismi, la riduzione d’attività durante la ripetizione dello stimolo, è stato dimostrato in maniera accurata il necessario
Prima risposta Seconda risposta
I) match/mismatch
II) attività sostenuta
III) incremento IV) decremento V) sincronizzazione
a
a
a
A
A
B
a
a
a
b
B
coinvolgimento per le risposte comportamentali osservate (Brown e Aggleton 2001).
La prima differenza di risposte dei neuroni inferotemporali durante un compito di riconoscimento è stata osservata in scimmie che svolgevano un compito di
delayed match o non-match to sample. Questo tipo di differenze si riscontra
spesso nei compiti in cui il giudizio di match o non-match va dato ad un singolo oggetto per prova e lo stimolo bersaglio è selezionato da un piccolo numero d’oggetti che sono presentati più volte. Tuttavia questo tipo di risposte non indica necessariamente se uno stimolo sia familiare o completamente nuovo, ma solo se corrisponde o no a quello in precedenza presentato; è per questo motivo che tali differenze non forniscono un substrato generale per la discriminazione della familiarità.
Il secondo meccanismo potenziale ad essere descritto è un cambiamento persistente del firing neuronale che avviene nell’intervallo successivo alla presentazione dello stimolo nella fase d’acquisizione e che dura fino alla presentazione dello stesso stimolo o di uno differente nella successiva fase comportamentale di scelta/decisione (Fuster e Jervey 1981). Questo tipo d’attività non è stato riscontrato, però in quei casi in cui è richiesta una memoria a lungo termine, in altre parole, quando più stimoli diversi devono essere ricordati; inoltre le scariche non durano per lunghi periodi e teoreticamente è stato dimostrato che possiedono una bassa capacità d’informazione. Piuttosto, si ritiene che quest’attività rappresenti un substrato dei meccanismi attentivi e a memoria breve che potrebbero contribuire alla memoria di riconoscimento a breve termine ( Desimone 1996; Brown e Xiang 1998) .
Gli incrementi di risposta dovuti alla ripetizione di uno stimolo precedentemente visto sono stati riscontrati solo quando l’animale era addestrato a riconoscere uno stimolo specifico che, quando compariva segnalava la presenza di un reward associato (Miller e Desimone 1994; Holscher et al 2003; Mogami e Tanaka 2006; ). Anche questo meccanismo è stato dimostrato solo quando l’animale doveva tenere in mente un singolo oggetto per volta e per poco tempo indicando che ci troviamo di nuovo di fronte ad una questione più d’attenzione che di memoria di riconoscimento.
Al contrario, le riduzioni della risposta in seguito alla ripetizione dello stimolo (fig. 16) sono state descritte in svariate condizioni (Brown et al. 1987; Riches et al 1991; Zhu et al. 1995).
Figura 16 Riduzione di risposta alla ripetizione di uno stimolo. Qui sono illustrati due
istogrammi cumulativi peri-stimolo e i due rasters relativi che mostrano gli spikes generati presentando 10 figure non familiari la prima volta (a) e la seconda volta (b). Notate la riduzione della risposta.
Nelle scimmie questi decrementi sono stati descritti in condizioni strettamente controllate così da escludere variazioni di allerta, attenzione, motivazione, movimenti oculari e altri cambiamenti comportamentali. La diminuzione d’attività avviene dopo una singola esposizione ad un oggetto inizialmente nuovo che può essere avvenuta anche 24 ore prima. E’ importante notare che questo fenomeno avviene anche quando l’animale doveva ricordare più di un oggetto alla volta e anche se durante gli intervalli fra una presentazione e l’altra dello stesso oggetto gli sono stati presentati altri stimoli a cui deve prestare attenzione quindi se ne può concludere che in questo caso siamo innanzi ad un vero caso di memoria di riconoscimento a lungo termine. Questo sistema ha una capacità enorme in quanto fra la prima e la seconda presentazione dello stimolo bersaglio possono essere presentati centinaia d’altri oggetti. Tenete conto che in questi esperimenti, ripetuti fra l’altro nel ratto (Zhu et al. 1995; Brown e Xiang 1998), non sono usate ricompense e addestramenti per questo si tratta di un meccanismo spontaneo.
Ad oggi si sa molto meno circa il ruolo dell’attività sincrona nelle discriminazioni di familiarità. Si è ipotizzato che il firing coincidente o quasi di più cellule fosse utile al trasferimento delle informazioni importanti ad altri sistemi (Singer e Gray 1995). Sono state trovate interazioni significative studiando i cross-correlogrammi delle attività registrate simultaneamente in coppie di neuroni nella scimmia (Erikson et al 2001). Tuttavia, l’incidenza di potenziali d’azione simultanei ( entro i 6 ms) prodotti da coppie di neuroni peririnali è molto bassa e per giunta è più concentrata nella fase tardiva della risposta neuronale allo stimolo, la qual cosa ha indotto alcuni ricercatori a ritenere che l’attività sincronizzata abbia piuttosto a che vedere con le risposte comportamentali successive al riconoscimento. Oltretutto, teniamo presente che un simile meccanismo è necessariamente più lento rispetto ad una variazione della frequenza di scarica.
Prima di passare al prossimo paragrafo completiamo quest’analisi dei meccanismi di segnalazione della familiarità di uno stimolo descrivendo una sorprendente specializzazione in tre diverse categorie (Xiang e Brown 1998) dei neuroni che abbiamo finora descritto nella scimmia e nel ratto (fig. 17). Accanto ai neuroni che rispondono intensamente solo alla prima presentazione di uno stimolo mai visto prima (novelty neuron), ci sono altri neuroni che rispondono intensamente anche se l’oggetto è visto per la seconda volta, ma per questo motivo non può ancora essere familiare (familiarity neuron) ed infine una terza classe di neuroni che risponde solo se lo stimolo non è stato presentato di recente (recency neuron).
Figura 17 I tre tipi di neuroni di riconoscimento peririnali. Ripresentando sia gli stimoli
molto familiari, sia quelli nuovi, si può dimostrare che le risposte codificano separatamente quanto è familiare uno stimolo e da quanto tempo è stato visto per l’ultima volta. I recency neurons segnalano che lo stimolo è stato visto recentemente