INDICE
1. Riassunto pag. 2
2. Introduzione pag.4
2.1 Fattori di rischio pag. 4
2.2 Storia naturale pag. 8
2.3 Diagnosi e stadiazione pag. 9
2.4 Trattamento pag. 11
3. Obiettivo della tesi pag. 22
4. Materiali e metodi pag. 23
5. Risultati pag. 25
6.Discussione pag. 27
7.Conclusioni pag. 34
8.Bibliografia pag. 35
1. Riassunto
Il carcinoma dell’ovaio rappresenta la quinta causa di morte per tumore nella donna e la prima per patologia neoplastica ginecologica nei paesi sviluppati. Secondo i dati dell’Annual Report n. 26, la sopravvivenza globale a 5 anni è dell’89,6% nello stadio Ia e decresce al 18,6% nello stadio IV. Il trattamento standard del carcinoma ovarico in stadio avanzato è rappresentato dalla chirurgica citoriduttiva seguito da una chemioterapia a base di platino e taxolo. La maggior parte delle pazienti raggiungono una risposta clinica completa dopo 6 cicli di chemioterapia ma circa il 75% di queste ed il 50% di quelle che ottengono una risposta patologica completa al second-look avranno una ricaduta dopo un intervallo mediano di 18-24 mesi. La pelvi e l’addome sono le sedi più frequenti di ricaduta.
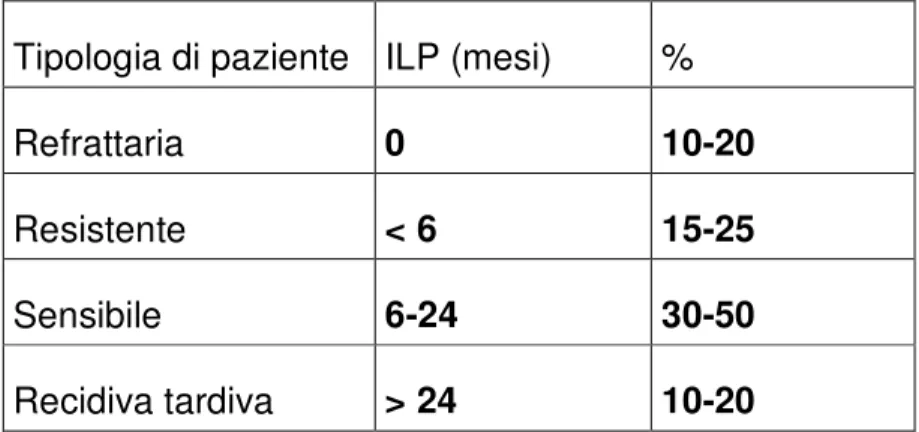
La scelta del trattamento dipende dall’intervallo di tempo libero da platino. Le pazienti si possono cosi distinguere in platino-refrattarie (progressione durante trattamento con platino), platino-resistenti (ricaduta entro sei mesi dall’ultima somministrazione di platino) e platino-sensibili (ricaduta dopo 6 mesi dall’ultima somministrazione di platino).
Lo scopo della tesi è stato quello di analizzare il pattern di recidive (sede, timing, fattori di rischio) e la sopravvivenza dopo la ricaduta in una serie di 412 pazienti con carcinoma ovarico che sono andate incontro a ripresa di malattia dopo trattamento primario.
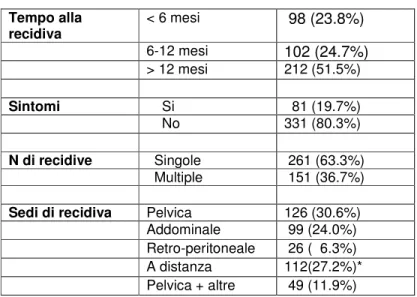
La recidiva è comparsa entro 6 mesi in 98 donne (23,8%), tra 6-12 mesi in 102 donne (24,7%) e dopo un tempo superiore a 12 mesi in 212 donne (51,5%). La recidiva ha coinvolto la pelvi nel 30,6%, l’addome nel 24,0%, i linfonodi retro-peritoneali nel 6,3% e a distanza nel 27,2%. La recidiva ha riguardato sedi multiple (pelvi e altre sedi) nell’11,9%. La ricaduta era sintomatica in 81 donne (19,7%). Fra le 331 pazienti asintomatiche, l’esame obiettivo è stata l’indagine diagnostica che ha posto sospetto di recidiva in 49 donne (14,8%), tecniche di
(23,3%), il dosaggio del CA125 e la diagnostica per immagine in 115 pazienti (34,7%). All’analisi univariata la sopravvivenza globale era correlata allo stadio (p= 0,004), alla malattia residua dopo chirurgia iniziale (p< 0,001), all’intervallo di tempo alla ricaduta (p< 0,0001), alla sede di recidiva (p= 0,04), e al trattamento alla recidiva (p<0,0001).
L’analisi multivariata ha dimostrato che la malattia residua e l’intervallo di tempo alla ricaduta sono variabili prognostiche indipendenti per la sopravvivenza globale (p<0,0001) e per la sopravvivenza dopo la recidiva (p<0,0001).
In conclusione i tassi di sopravvivenza simili delle donne asintomatiche e sintomatiche potrebbero suggerire che le procedure di follow up, sia con un approccio minimo che intensivo, non riescono a migliorare la prognosi dei pazienti. Tuttavia la sempre maggiore disponibilità di nuovi agenti citotossici e a bersaglio molecolare per il trattamento di salvataggio e i promettenti risultati ottenuti da un'ottimale citoriduzione chirurgica secondaria in pazienti accuratamente selezionate dovrebbero incoraggiare i trial clinici randomizzati specificatamente indirizzati a confrontare l’efficacia di diverse schemi di follow up.
2. Introduzione
Il carcinoma ovarico rappresenta nella popolazione femminile la quinta causa di morte per malattia neoplastica e la prima per patologia ginecologica oncologica nei paesi industrializzati (1). Ogni anno vengono diagnosticati negli Stati Uniti circa 26.000 nuovi casi di carcinoma ovarico e circa 6.000 in Gran Bretagna (2-4). Una prognosi così sfavorevole è legata alla malignità intrinseca della neoplasia stessa, all’assenza di sintomi e segni specifici tali da consentire una diagnosi precoce e alla mancanza di valide metodiche di screening di massa, cosicché circa il 70% dei casi vengono diagnosticati in stadio avanzato di malattia. Il picco di incidenza della neoplasia è intorno ai 60 anni. Secondo i dati dell’Annual Report n. 26 della Federazione Internazionale di Ginecologia e Ostetricia [FIGO], il 26,3% dei casi insorge nella fascia di età tra 50 e 59 anni, il 24,3% in quella tra 60 e 69, mentre solo il 7,2% insorge sotto i 40 anni (Tabella 1) (5).
2.1 Fattori di rischio
L’eziologia del carcinoma ovarico è poco conosciuta. a. Fattori endocrini
La probabilità di insorgenza di un carcinoma ovarico è direttamente proporzionale all’età ovulatoria della paziente. Le ipotesi eziopatogenetiche più accreditate riguardano: la teoria dell’”Incessant ovulation” di Fathalla e la stimolazione gonadotropinica. L’epitelio celomatico incorre ad ogni ovulazione in microtraumi: il substrato istogenetico alla carcinogenesi ovarica è rappresentato dalla formazione di una cisti da inclusione conseguente alla deiscenza follicolare e alla successiva invaginazione dell’epitelio di superficie nello stroma ovarico e alla
Pertanto la gravidanza, l’uso di contraccettivi orali, riducendo il numero di eventi ovulatori e di cisti inclusionali esercitano un effetto protettivo sulla carcinogenesi ovarica (6 ).
Un update di recente pubblicazione ha riportato che la protezione da parte dei contraccettivi aumenta del 5% per ogni anno di utilizzo sino ad una protezione superiore al 50% per una durata di assunzione superiore a 10 anni (7). In particolare l’uso protratto della pillola per tre o più anni riduce del 30-50% il rischio di questa neoplasia (8) e l’effetto protettivo sembra essere maggiore per le pillole che contengono progestinici ad alta potenza (9). Studi sulla scimmia hanno dimostrato che la componente progestinica della pillola ha un effetto apoptotico sull'epitelio ovarico, che è mediato da una modulazione dell' espressione delle isoforme del trasforming growth factor-. [TGF-β.] (10). Pertanto, l'effetto protettivo della pillola, così come quello della gravidanza, può essere dovuto oltre che alla inibizione dei processi ovulatori circolanti, anche all’induzione dell’apoptosi dell’epitelio ovarico mediata dai progestinici (11). Considerando che il carcinoma dell’ovaio aumenta di incidenza in donne di età superiore ai 45 anni ed ha il picco massimo 10 anni dopo la menopausa, è stato suggerito che le gonadotropine possono rappresentare un fattore di rischio (12, 13). Il ruolo eziopatogenetico delle gonadotropine è supportato da alcuni case-report in cui sono stati descritti casi di carcinoma ovarico dopo trattamento con clomifene citrato o gonadotropine (13, 14). In uno studio italiano caso-controllo, che comprendeva 1031 donne con carcinoma ovarico e 2.411 controlli, il rischio relativo [RR] per il tumore ovarico fra le donne che avevano utilizzato farmaci per la fertilità era 1.3 (intervallo di confidenza del 95% [IC 95%] 0.7-2.5) (15). Analizzando i dati di 8 studi caso-controllo su donne sottoposte a terapia con farmaci induttori dell’ovulazione, Ness e coll (16) hanno trovato che tra le donne nullipare che avevano ottenuto una gravidanza dopo più di 5 anni, il rischio di questa neoplasia
aumentava di circa 2.67 volte (95% IC: 1.91-3.74) rispetto a quelle che avevano atteso per un tempo inferiore ad un anno.
I dati presenti in letteratura circa la relazione tra assunzione di terapia ormonale sostitutiva e rischio di carcinoma ovarico sono contrastanti (17). Il documento conclusivo dell’International Menopause Society Expert Workshop del 2001 ha riportato che la maggior parte degli studi sembrano escludere una associazione tra carcinoma ovarico e terapia ormonale sostitutiva (22).
b. Fattori ambientali e chimici
Pochi dati esistono in letteratura sul ruolo eziopatogenetico di alcuni fattori alimentari e chimici. La più alta incidenza di carcinoma dell’ovaio si verifica nei paesi industrializzati, con la sola eccezione del Giappone; migliori condizioni socio-economiche, un aumentato consumo di carni rosse, una dieta ipercalorica, una ridotta assunzione di pesce, di vegetali e di frutta, l’utilizzazione di talco nella regione perineale, aumentano l’incidenza della neoplasia (23, 24). Non è stata dimostrata alcuna evidente correlazione tra il consumo di alcool, il fumo, l’attività fisica e lo sviluppo di questa neoplasia (25).
c. Fattori genetici-familiari
Il carcinoma ovarico è considerata una malattia sporadica. Solo il 5-10% dei casi hanno una componente familiare (26).Il rischio di carcinoma ovarico è superiore per le donne che presentano anamnesi familiare positiva per tale patologia: Il rischio nel corso della vita per una donna senza parenti affetti da tale patologia è pari all’1,4% (1/70), sale al 5% in presenza di un parente di primo grado affetto (madre o sorella) fino ad arrivare al 7% in
dell’ovaio. Da una analisi su 568 famiglie, in cui si erano verificati un totale di 1568 casi di carcinoma ovarico, è emerso che il grado di parentela più frequente è nel 49,5%, quello fra madre e figlia e nel 38,5%, quello tra sorelle. È stata quindi ipotizzata una trasmissione ereditaria di tipo autosomico dominante a penetranza variabile associata alla presenza di mutazioni genetiche, che impedirebbero la riparazione del DNA e favorirebbero l’insorgenza di cloni cellulari che portano allo sviluppo della neoplasia. Le forme ereditarie interessano donne di 10 anni più giovani rispetto a quelle che sviluppano un tumore sporadico.
Le sindromi genetiche riconosciute sono rappresentate dalla:
Sindrome familiare carcinoma mammella e ovaio: famiglie in cui parenti di primo e secondo grado risultano affetti da tumore ovarico e della mammella: donne con anamnesi positiva per tumore della mammella hanno una incidenza doppia di sviluppare un carcinoma ovarico e l’età alla quale sviluppano la neoplasia è minore. La sindrome è associata alla presenza di mutazioni germinali a carico dei geni oncosoppressori BRCA1 (17 q) e BRCA2 (13 q). La prevalenza di mutazioni di questo gene è 1/800-1000 donne e le donne che presentano mutazioni di BRCA1 hanno un rischio cumulativo di sviluppare un carcinoma della mammella dell’85-90% e un carcinoma ovarico del 50% (27). Se il carcinoma della mammella è legato a mutazione del gene BRCA2 (13 q), il rischio di sviluppare carcinoma dell’ovaio è del 20-30%, seguito poi dall’aumento del rischio di sviluppare altre neoplasie come vescica e pancreas (28). Nelle donne portatrici di tali mutazioni sono state proposte diverse strategie per la prevenzione del tumore ovarico, tra cui ecografia trans-vaginale con color doppler e dosaggio del CA125, l’uso dei contraccettivi orali, la legatura delle tube e la ovaro-salpingectomia.
Sindrome di Lynch 2: associazione di cancro del colon non associato a poliposi (HNPCC), cancro gastrico, cancro mammario, ovarico o dell’endometrio. Tale sindrome è legata a mutazioni germ-line dei geni del mismatch repair (MSH2, MLH1, PMS1, PMS2 e MSH6/GTBP-sindrome di Lynch 2) (29).
Sindrome del cancro ovarico sito-specifico: donne a rischio di sviluppare esclusivamente tumore ovarico (30).
2.2 Storia naturale
Il tumore dell’ovaio si distingue in tre categorie: 4-5% delle neoplasie della gonade femminile originano dallo stroma ovarico e dai cordoni sessuali (tumori a cellule della granulosa, tumori a cellule di Sertoli, Leydig, ginandroblastomi), 5% dalla cellula germinale e insorgono generalmente prima dei venti anni e i tumori epiteliali derivanti dall’epitelio celomatico o epitelio mülleriano, che rappresentano l’85-90% di tutti i tumori maligni, compaiono dopo i quarant’anni sono suddivisi in diverse varianti istopatologiche, che riflettono la potenzialità evolutiva dell’epitelio mülleriano (Tabella 2). L’istotipo maggiormente rappresentato è quello sieroso (circa il 75%), seguito da quello mucinoso, endometrioide, a cellule chiare, misto, di Brenner e indifferenziato (31). I vari istotipi sono ulteriormente suddivisi in benigni, borderline e maligni.
I tumori borderline hanno un comportamento clinico diverso rispetto alle forme maligne. Questi tumori sono spesso unilaterali al momento della diagnosi e più frequenti in età fertile. Recentemente Shih e Kurman (32) hanno proposto un modello che permette di classificare i tumori dell’ovaio sulla base di dati clinico patologici e molecolari. La patogenesi del carcinoma ovarico è al giorno d’oggi sconosciuta a causa della mancanza di un modello di
per la tumorigenesi del carcinoma ovarico che consente di suddividerli in tumori di tipo I e di tipo II.
I tumori di tipo I comprendono i carcinomi sierosi di basso grado, i mucinosi, gli endometrioidi, il tumore di Brenner e a cellule chiare. Questi si sviluppano dai tumori borderline, che a loro volta prendono origine da cistoadenomi e adenofibromi e sono confinati all’ovaio al momento della diagnosi. I tumori di tipo II comprendono i carcinomi sierosi ad alto grado, i tumori mesodermici misti e quelli indifferenziati. Questi tumori che si sviluppano de novo dalla superficie epiteliale evolvono rapidamente, metastatizzano più frequentemente e hanno generalmente un comportamento clinico molto aggressivo. Da un punto di vista molecolare questi due tipi di tumore sono caratterizzati da diversi assetti genetici che si manifestano durante il loro sviluppo. I tumori sierosi di basso grado mostrano mutazioni su geni BRAF e KRAS, i mucinosi sui geni KRAS e gli endometrioidi su ß-catenina e PTEN. I tumori sierosi di alto grado sono caratterizzati da alterazioni a carico del gene p53 (32).
2.3 Diagnosi e stadiazione
Il carcinoma ovarico è asintomatico oppure si presenta con una sintomatologia aspecifica (senso di pesantezza al basso ventre, sfumata dolenzia addomino-pelvica) nelle prime fasi di sviluppo. Può essere sospettato nel corso di una visita ginecologica di routine o eseguita per la comparsa di algie pelviche o di un aumento di volume dell’addome (31). La visita ginecologica evidenzia una massa pelvica di consistenza parenchimatosa, scarsamente mobile o fissa, a superficie irregolare, spesso bilaterale e l’esame obiettivo, oltre alla distensione addominale, può talvolta evidenziare un versamento pleurico o la presenza di tumefazioni linfonodali a sede inguinale, o più di rado, sovraclaveare.
L’ecografia pelvica e transvaginale con Color-Doppler, il dosaggio sierico dell’antigene glicoproteico CA125 consentiranno di formulare una ipotesi diagnostica. TAC e RMN consentono di valutare l’estensione della malattia a livello addomino-pelvico. Indagini endoscopiche, quali gastroscopia, colonscopia, devono essere eseguite in presenza di una sintomatologia gastroenterica sospetta per escludere una primitività del tratto digerente o un eventuale coinvolgimento da parte della neoplasia ovarica di questi organi. La PET è poco dirimente in questa fase diagnostica, mentre può essere utile nel successivo follow-up (soprattutto in presenza di diagnostica convenzionale negativa ed elevazione del CA125). La diagnosi definita si pone con l’esplorazione chirurgica che consente l’esatta definizione istopatologica e una adeguata stadiazione. In tabella 3 è riportata la classificazione per stadio secondo i criteri della FIGO.
Il carcinoma ovarico diffonde per continuità e contiguità, per via intraperitoneale, linfatica retroperitoneale, per via linfatica diaframmatica e per via ematica (31).
La via intraperitoneale è il modo di diffusione principale: le cellule tumorali sfaldatesi dalla neoplasia cadono in cavità peritoneale e si impiantano sulla sierosa peritoneale e diaframmatica. La diffusione endoperitoneale segue le vie percorse dal liquido peritoneale, la più importante delle quali è rappresentata dalla doccia parietocolica soprattutto quella destra che crea una comunicazione tra compartimento sovra e sottomesocolico sino alla superficie inferiore dell’emidiaframma. Le cellule neoplastiche, attraverso il plesso linfatico transdiaframmatico possono diffondere verso la cavità pleurica ed essere così responsabile della formazione dei versamenti pleurici maligni. L’ostruzione dei vasi linfatici diaframmatici da parte di emboli neoplastici gioca un ruolo fondamentale nella genesi dell’ascite.
precavali, a sinistra ai linfonodi pre e paraaortici. Il peduncolo iliaco esterno drena ai linfonodi della catena iliaca esterna, e ai linfonodi iliaci comuni e poi a quelli aortici. I linfonodi regionali sono quindi gli iliaci esterni iliaci comuni e para-aortici; i linfonodi inguinali possono essere interessati per via retrograda.
La disseminazione ematogena è meno frequente. Le sedi più frequenti sono polmone e fegato. Più raro è l’interessamento di encefalo ed osso. Una recente analisi della letteratura ha riportato un aumento delle metastasi cerebrali tardive in soggetti lungo-sopravviventi (33). Lo stadio FIGO rimane un importante fattore prognostico. La sopravvivenza a 5 anni diminuisce drasticamente dall’89,6% per le pazienti in stadio Ia al 32,5% per quelle in stadio IIIc (Tabella 4) (5).
2.4 Trattamento del carcinoma ovarico a.Trattamento chirurgico
Il trattamento standard delle pazienti con malattia apparentemente limitata all’ovaio è rappresentato dall’intervento chirurgico che permette da un lato di avere una conferma istologica mediante campionamento adeguato del pezzo operatorio e dall’altro di effettuare una stadiazione corretta definendo le dimensioni e l’estensione delle localizzazioni extra ovariche.
In presenza di una malattia apparentemente confinata alla gonade, l’intervento standard consiste nell’ovaro-salpingectomia bilaterale con isterectomia totale e stadiazione chirurgica intensiva, comprendente citologia peritoneale, omentectomia infracolica, appendicectomia, biopsie peritoneali ed esplorazione chirurgica del retroperitoneo (31).
Una chirurgia conservativa con asportazione dell’ovaio malato, conservazione dell’ovaio controlaterale o almeno di un’adeguata quantità di parenchima ovarico e dell’utero, associata
a stadiazione chirurgica intensiva (comprendente anche isteroscopia o esame frazionato della cavità uterina), può essere proposta in donne giovani e desiderose di prole con tumore in stadio iniziale (stadio I, grado istologico ben differenziato, e secondo alcuni autori anche stadio Ib-Ic, grado istologico moderatamente e scarsamente differenziato) (34, 35).
Nella malattia in stadio avanzato, la chirurgia deve avere un intento citoriduttivo, con l’asportazione di tutto il tumore macroscopicamente visibile o almeno delle lesioni superiori al centimetro. La maggior parte degli autori oggi considerano un debulking ottimale una malattia residua macroscopica assente o almeno inferiore ad 1 cm (36, 37). La chirurgia citoriduttiva consente di migliorare una sintomatologia spesso imponente e consente una migliore risposta del tumore alla chemioterapia con l’aumento della perfusione tumorale e della frazione di crescita delle cellule. Inoltre migliora la risposta immunologica della paziente attraverso la riduzione dell’immunodepressione neoplastica (31). L’intervento citoriduttivo spesso rende necessario il ricorso a procedure extraginecologiche.
La resezione di segmenti intestinali trova giustificazione in caso di occlusione in atto, o in situazioni immediatamente preocclusive, o se queste sono interessate dal processo neoplastico allo scopo di ottenere una citoriduzione ottimale. La resecabilità del tumore dipende anche dalle localizzazioni delle lesioni metastatiche. Una ampia diffusione all’addome superiore spesso non è suscettibile di citoriduzione ottimale (38). La pelvi è quasi sempre citoriducibile con approccio retroperitoneale (intervento di Hudson-delle Piane) che può prevedere l’asportazione di retto-sigma (39).
La malattia residua dopo prima chirurgia rappresenta quindi il fattore prognostico di risposta e di sopravvivenza più importante nel carcinoma ovarico in stadio avanzato. Anche l’età della paziente ha significato prognostico: nelle pazienti giovani, infatti, la prognosi migliore sembra
attribuibile sia alla malattia più limitata e differenziata, sia alle migliori condizioni generali che consentono un approccio terapeutico, chirurgico e farmacologico, più aggressivo.
Per quanto riguarda il ruolo della linfadenectomia uno studio randomizzato internazionale, che ha arruolato 427 pazienti con carcinoma ovarico in stadio III-IV nelle quali era stata ottenuta una citoriduzione ottimale, ha dimostrato che le donne sottoposte a linfadenectomia pelvica e lombo-aortica sistematica avevano una sopravvivenza libera da progressione al quinto anno significativamente migliore rispetto a quelle sottoposte ad exeresi dei soli linfonodi bulky (31.2% versus 21.6%, p= 0.01), mentre la sopravvivenza globale al quinto anno era sovrapponibile nei due gruppi (48.5% versus 47%) (40). Qualora una citoriduzione ottimale non sia ottenibile in prima istanza, questa può essere riproposta dopo 3-4 cicli di chemioterapia (chirurgia di intervallo) (41).
L’impiego della chemioterapia neoadiuvante seguita da chirurgia deve essere considerato sperimentale e dovrebbe essere impiegata in casi selezionati di pazienti incluse in studi clinici randomizzati. (È attualmente in corso un trial randomizzato di fase III dell’EORTC e del National Cancer Institute del Canada ) (42) .
Al di fuori di tali condizioni, una chemioterapia neoadiuvante può essere presa in considerazione in caso di pazienti con cattivo performance status e massivo interessamento da parte della malattia dell’addome superiore (43).
b. Trattamento chemioterapico
- Chemioterapia di prima linea
La rimozione macroscopica completa del tumore non è sinonimo di cura e anche una malattia in I stadio va incontro a ripresa di malattia, per questo la chemioterapia sistemica ha un ruolo di primaria importanza nel trattamento del carcinoma ovarico.
Nasce quindi l’esigenza di riuscire ad identificare tra queste pazienti quelle che sono a maggiore rischio di recidiva. Il sottostadio, il grado istologico e l’istotipo sono per la malattia in stadio iniziale le variabili più importanti per selezionare pazienti che sono a differente rischio di ricaduta e per pianificare quindi un adeguato trattamento adiuvante. Pazienti con tumore in stadio Ia-Ib e di grado istologico ben differenziato (basso rischio) accuratamente stadiate, non necessitano di alcun trattamento adiuvante. Viceversa una terapia adiuvante a base di platino è consigliabile in pazienti con malattia iniziale a basso rischio non stadiate in maniera ottimale o in quelle con malattia ad alto rischio per il sottostadio (Ic-IIa) o il grado istologico (moderatamente o scarsamente differenziato) o l’istotipo (cellule chiare) (44). La strategia terapeutica standard nel carcinoma ovarico in stadio avanzato consiste nella chirurgia citoriduttiva seguita da chemioterapia a base di platino e taxolo.
Negli ultimi venti anni, la chemioterapia si è profondamente modificata passando dall’uso di un alchilante in monochemioterapia, all’impiego del cisplatino e dei suoi analoghi in regimi di combinazione (45, 46). La meta-analisi dell’Advanced Ovarian Cancer Trialists Group sulla chemioterapia nel carcinoma ovarico in stadio avanzato (47), ha dimostrato che:
la terapia a base di platino è superiore a quella non comprendente questo agente (RR: 0.93, IC 95%: 0.83-1.05);
I regimi di combinazione comprendenti il cisplatino sono superiori al cisplatino in monochemioterapia (RR: 0.85; IC 95%: 0.72- 1.00);
.Il cisplatino e il carboplatino sono equiattivi (RR: 1.05, IC 95%: 0.94-1.18) .
All’inizio degli anni ‘90, il regime di combinazione cisplatino più ciclofosfamide [regime PC] è stato considerato come il regime di riferimento per il carcinoma ovarico avanzato. Una meta-analisi condotta su circa 1200 pazienti, incluse in 4 studi clinici randomizzati ha rilevato un
e di sopravvivenza a 6 anni (31% versus 25%, p< 0.02) per il regime di combinazione cisplatino + doxorubicina + ciclofosfamide [regime PAC] rispetto al regime PC (48). Analizzando i dati dell’Advanced Ovarian Cancer Trialists Group e Ovarian Cancer Meta-Analysis Group è stato dimostrato che l’aggiunta della doxorubicina alla chemioterapia a base di platino migliorava significativamente la sopravvivenza (RR: 0.85; IC 95%: 0.76-0.95; p: 0.003) (49).
Nell’ ultima decade sono stati condotti diversi studi sulla combinazione del taxolo con il platino per il trattamento del tumore ovarico (50-57). Due grandi studi multicentrici randomizzati hanno dimostrato che la combinazione di cisplatino e taxolo è in grado di ottenere risultati migliori sia in termini di risposta alla chemioterapia che in termini di sopravvivenza libera da progressione e sopravvivenza globale rispetto al regime PC (50, 51). Studi clinici randomizzati hanno dimostrato che l’aggiunta di ulteriori agenti quali la doxorubicina liposomiale, la gemcitabina e il topotecan al regime carbotaxolo, vuoi in combinazione tripletta di farmaci o doppietta, non aggiungono alcun vantaggio in termini di sopravvivenza libera da malattia.
Nel 2006 sono stati pubblicati i risultati di uno studio randomizzato di fase III [GOG182-ICON5] che comprendeva 4 bracci sperimentali, rappresentati da triplette (gemcitabina più taxolo più carboplatino o doxil più taxolo più carboplatino per 8 cicli) o doppiette sequenziali di farmaci (gemcitabina più carboplatino o topotecan più carboplatino per 4 cicli seguiti da taxolo più carboplatino per 4 cicli), confrontati con il regime standard taxolo più carboplatino per 8 cicli (57, 58). Attualmente la combinazione di taxolo alla dose di 175 mg/m2 (in infusione di 3 ore) e del carboplatino [CBDCA] ad una dose pari ad un’area sotto la curva [AUC] di 5-6 ogni 21 giorni per 6 cicli è considerata come il regime di prima linea standard per il carcinoma ovarico avanzato.
Questo approccio consente di raggiungere una risposta obiettiva nel 60-80% dei casi, con risposta clinica completa nel 40-50% e risposta patologica completa nel 25-30% (50-54). Tuttavia il 75% delle pazienti in risposta clinica completa e il 50% di quelle in risposta patologica svilupperanno in seguito recidiva dopo un intervallo mediano di 15.5-22 mesi (50-54, 59) di conseguenza, la maggior parte dei quadri di carcinoma ovarico in stadio avanzato necessiterà di un trattamento di seconda linea (60).
Poche linee guida formali esistono per quanto riguarda il follow-up delle pazienti con carcinoma ovarico e non c’è un accordo univoco in letteratura sul tipo e tempi di esame da mettere in atto nelle pazienti con senza evidenza clinica di malattia dopo il trattamento primario. Una minima strategia di follow up consiste nella storia, nell’esame clinico e nel dosaggio del CA125. Mentre un programma intensivo include l’utilizzo di indagini di diagnostica per immagini ad ogni visita di controllo.
Le sedi di recidiva più comuni sono la pelvi e l’addome, mentre sono meno frequenti ricadute isolate a livello retroperitoneale o a distanza (59).
c. Trattamento della recidiva
Gli scopi del trattamento possono essere - palliazione dei sintomi
-miglioramento della qualità di vita
-ritardare la progressione di malattia sintomatica -prolungare la sopravvivenza
Una paziente con recidiva deve essere trattata considerando molteplici fattori, quali, le dimensioni del tumore, il tipo istologico, la presenza di singole o multiple sedi di malattia, il
performance status, la sintomatologia e soprattutto l’intervallo libero da malattia dopo la chemioterapia di prima linea a base di platino (61).
- Chemioterapia di seconda linea
Sulla base dell’intervallo libero da malattia dopo chemioterapia di prima linea a base di platino, le pazienti possono essere distinte in pazienti platino-refrattarie (progressione durante terapia a base di platino), platino- resistenti (ricaduta entro 6 mesi) e platino-sensibili (ricaduta dopo 6 mesi) (Tabella 5). Le pazienti che presentano recidiva dopo 24 mesi (recidiva tardiva) hanno maggiore probabilità di risposta ad una chemioterapia a base di platino (62).
Alcuni studi randomizzati hanno confrontato diversi agenti nel trattamento di salvataggio in pazienti con recidiva di carcinoma ovarico. Ad esempio, Bokkel Huinink et al. (63) hanno confrontato il topotecan (1.5 mg/m2 per 5 giorni ogni 21 giorni) al taxolo (175 mg/m2 in infusione continua per 3 ore ogni 21 giorni) in 226 pazienti con carcinoma ovarico in stadio avanzato, andate incontro a progressione durante o dopo il trattamento chemioterapico a base di platino. La risposta è stata del 20.5% nelle pazienti trattate con topotecan e del 13.2% (p= ns) nelle pazienti trattate con taxolo. La durata mediana della risposta al topotecan ed al taxolo è stata, rispettivamente, di 32 e di 20 settimane (p= ns); il tempo mediano alla progressione é stato rispettivamente di 23 e 14 settimane (p= 0.002); infine la sopravvivenza mediana è stata, rispettivamente, di 61 e di 43 settimane (p= ns). La neutropenia è stata riscontrata con maggior frequenza nel trattamento con topotecan (79% contro il 23%, p< 0.01), mentre, la tossicità non-ematologica si è rivelata decisamente lieve per entrambi i farmaci. Di conseguenza, il topotecan, sembra avere una efficacia almeno
equivalente al taxolo, associato però ad un periodo significativamente più lungo prima della progressione.
Gordon et al. (64), invece, hanno randomizzato 237 pazienti con carcinoma ovarico recidivante (di cui 117 erano refrattarie al platino) a ricevere doxil (50 mg/m2 ogni 4 settimane) o topotecan (1.5 mg/m2 per 5 giorni ogni 21 giorni). La risposta obiettiva riscontrata è stata del 20.3% per il doxil e del 16.8% per il topotecan; il tempo mediano alla progressione, rispettivamente, di 22.4 e di 20.4 settimane; la mediana della sopravvivenza complessiva di 66.0 settimane per il doxil contro le 56.3 settimane del topotecan.
Piccart et al. (65) hanno condotto studi randomizzati con oxaliplatino (130 mg/m2 per 2 ore) e con il taxolo (175 mg/m2 per 3 ore) in 56 pazienti con carcinoma ovarico in stadio avanzato, precedentemente trattate con platino. La risposta obiettiva è stata del 16% per l’oxaliplatino e del 17% per il taxolo; la mediana di progressione, rispettivamente, di 12 e 14 settimane, mentre la mediana di sopravvivenza complessiva è stata, rispettivamente, di 42 e 37 settimane. Gradi 3-4 di neutropenia sono stati rilevati nel 22% delle donne trattate con taxolo, ma in nessuna delle pazienti che ha ricevuto oxaliplatino.
Approssimativamente, un terzo delle pazienti trattate con regimi a base di platino e taxani avrà ancora una persistente neuropatia al momento della ricaduta. E’ quindi importante evitare in queste pazienti farmaci potenzialmente neuropatici.
Pazienti pre-trattate con CBDCA possono sviluppare reazioni di ipersensibilità. In una serie di 205 pazienti, a cui è stato somministrato CBDCA, 24 (12%) hanno sviluppato una reazione di ipersensibilità. Di queste, solo 3 (13%) hanno evidenziato tale tossicità durante la loro chemioterapia iniziale, mentre le altre l’hanno sviluppata durante il secondo o terzo trattamento con CBDCA per malattia recidivante. Approssimativamente, in metà delle
pazienti la reazione ha fatto la sua comparsa dopo che era stata somministrata più della metà della dose totale di farmaco.
Uno studio randomizzato su 208 pazienti pre-trattate con platino ha rivelato che il taxolo settimanale (67 mg/m2) ha la stessa risposta se comparato con il taxolo (200 mg/m2) somministrato ogni 3 settimane (31% contro 32%), con un tempo mediano antecedente la progressione simile (5.5 contro 8.3 mesi, p= ns) ed una simile mediana di sopravvivenza complessiva (14.6 contro 19.2 mesi, p= ns) (66). La modalità di somministrazione settimanale si associava, però, ad una più bassa incidenza di neutropenia di grado 3-4, di neuropatia di grado 3, di alopecia, di mialgie e di artralgie.
In uno studio randomizzato condotto su 186 pazienti con carcinoma ovarico recidivato dopo 12 mesi dal completamento del trattamento primario, Torri et al. (67) hanno riscontrato, che le pazienti a cui era stata somministrata chemioterapia di combinazione (doxorubicina (80 mg/m2) + taxolo (175 mg/m2 per 3 ore) si associavano ad una percentuale di risposta (52% contro 54%, p= ns), ad un tempo mediano alla progressione (6.6 contro 7.5 mesi, p= ns) e ad una sopravvivenza mediana (12 contro 14 mesi p= ns), sovrapponibili a quelle trattate con il taxolo (175 mg/m2 per 3 ore) in monochemioterapia.
- Chirurgia di salvataggio
Il ruolo della chirurgia nel carcinoma ovarico recidivante non è stato ancora ben definito. Gli autori concordano sul fatto che più lungo è l’intervallo libero da malattia dopo la terapia primitiva, migliore sarà la sopravvivenza dopo la citoriduzione chirurgica secondaria (68-70). A questo proposito, nella serie di Eisenkop et al. (69), che include 87 pazienti sottoposte a chirurgia citoriduttiva secondaria completa, il tempo mediano di sopravvivenza è stato di 25.0
mesi, 44.4 mesi e 56.8 mesi (p= 0.005) per intervalli liberi da malattia, rispettivamente, di 6-12, 13-36 e > 36 mesi.
In una serie di 30 pazienti, che hanno recidivato dopo un periodo di remissione clinica di almeno 6 mesi e che non hanno presentato metastasi epatiche intraparenchimali né extra - addominali, Gadducci et al. (71) hanno riscontrato che la sopravvivenza mediana dopo chirurgia citoriduttiva secondaria era di 25 mesi nelle pazienti che erano recidivate dopo 17.5 mesi dal completamento del trattamento primitivo verso 15 mesi (p= 0.039) per quelle andate incontro a recidiva più precocemente.
I dati relativi ai benefici clinici della riduzione chirurgica al momento della recidiva risultano controversi in letteratura (68-73): nello studio di Morris et al. (72) l'intervento chirurgico terminato con un residuo neoplastico di calibro inferiore ai 2 cm non ha dimostrato risultati significativi nelle pazienti; al contrario Segna et al. (70) hanno rilevato una mediana di sopravvivenza, dopo la chirurgia secondaria, di 27.1 mesi per le 61 pazienti con un residuo tumorale < di 2 cm, verso i 9 mesi delle 39 pazienti con tumore residuo di maggiori dimensioni (p= 0.0001). Vaccarello et al. (73) hanno osservato che la sopravvivenza mediana per le pazienti con malattia residua maggiore di 0.5 cm era di 23 mesi contro un 75% di possibilità di sopravvivenza fino a 41 mesi, per le pazienti con un residuo più piccolo. Altri autori hanno unicamente precisato come la citoriduzione chirurgica completa con assenza di malattia macroscopica si associ ad un vantaggio in termini di sopravvivenza (68,69-71). Ed infatti, nella serie di Gadducci et al. (71), la sopravvivenza mediana dopo chirurgia di salvataggio è risultata di 37 mesi, per le pazienti sottoposte a citoriduzione completa e di 9 mesi per quelle con malattia macroscopica residua (p = 0.04). Queste ultime sono andate incontro a morte in uno spazio di 25 mesi.
Il trial tedesco “DESKTOP OVAR” (Descrittive Evaluation of Preoperative Selection Criteria for Operability in Recurrent Ovarian Cancer) che ha valutato retrospettivamente 267 pazienti sottoposte a chirurgia citoriduttiva per carcinoma ovarico recidivante, ha trovato che le variabili associate con la resezione chirurgica macroscopicamente completa erano: un ECOG performance status di 0 (p<0,001), lo stadio FIGO I e II (p=0,0036), l’assenza di malattia residua macroscopica dopo chirurgia primaria (p<0,01) e l’assenza di ascite >500 ml (p<0,001) (74). La combinazione di un buon performance status, di uno stadio FIGO iniziale o di assenza di malattia residua dopo chirurgia primaria e l’assenza di ascite significativa si associavano ad una probabilità di resezione completa del 79%. Questi criteri sono attualmente oggetto di valutazione in uno studio prospettico (AGO-DESKTOP 2) e successivamente uno studio clinico randomizzato (AGO-DESKTOP 3) confronterà la chirurgia più chemioterapia versus la chemioterapia da sola in pazienti selezionati. Due studi randomizzati stanno attualmente valutando il ruolo della citoriduzione chirurgica secondaria in pazienti con recidiva tardiva di carcinoma ovarico (EORTC 55963 e GOG 213) (75).E’ possibile che i tumori recidivati dopo un lungo intervallo libero da malattia abbiano un comportamento biologico diverso rispetto a quelli che recidivano più precocemente (68). In particolare, le recidive tardive possono spesso presentarsi come singole lesioni tumorali e non in forma di malattia disseminata e quindi trovano precisa indicazione nel trattamento di resezione chirurgica. Di contro, la chirurgia secondaria non sembra migliorare la sopravvivenza nelle pazienti dove il quadro è progredito durante o subito dopo il trattamento primitivo (76,77).
-Trattamento palliativo
Il trattamento palliativo può qualche volta rappresentare il solo possibile approccio terapeutico, soprattutto per quelle con occlusione intestinale. La chirurgia palliativa deve essere presa in considerazione quando la situazione non si risolve dopo una settimana di terapia conservativa (sondino naso-gastrico) e la paziente ha un’aspettativa di vita superiore ai 2 mesi.
3. Obiettivo della tesi
Lo scopo della tesi è stato quello di analizzare il pattern di recidive (sede, timing, fattori di rischio), e la sopravvivenza dopo la ricaduta in una serie di 412 pazienti con carcinoma ovarico che sono andate incontro a ripresa di malattia dopo trattamento primario.
4. Materiali e metodi
In questo studio retrospettivo sono stati incluse 412 pazienti con carcinoma ovarico recidivante diagnosticato dal 1987 al 2006 in sei Centri di Ginecologia Oncologica italiani: Dipartimento di Ginecologia e Ostetricia Università di Pisa, Torino, Brescia, Cattolica di Roma; Unità di Ginecologia e Ostetricia Ospedale”Umberto I “, Venezia-Mestre; Divisione di Ginecologia oncologica Istituto Europeo di Oncologia Milano.
La presenza in una paziente asintomatica di livelli aumentati di CA125 ma con esame clinico ed indagini di diagnostica per immagine negativi non è stata considerata di per sé come una malattia recidivante ma ha suggerito un programma di follow up intensivo per la paziente. Nella tabella 8 sono state riportate le caratteristiche delle pazienti al momento della diagnosi di carcinoma ovarico ( lo stadio FIGO, tipo istologico, grado del tumore, malattia residua dopo chirurgia iniziale, trattamento di prima linea, eventuale chirurgia di “second look) e al momento della recidiva (intervallo di tempo, sedi di ricaduta e numero delle sedi, presenza di sintomi, trattamento di salvataggio.) (tabella 9)
L’intervallo di tempo tra l’ultimo ciclo di chemioterapia di prima linea e la diagnosi di recidiva è stato definito come intervallo alla ricaduta. Per quanto riguarda la presenza o l’assenza di sintomi al momento della recidiva le pazienti sono stati classificati in tre categorie:
1) pazienti sintomatiche che hanno anticipato la visita di follow-up per la presenza di sintomi; 2) pazienti sintomatiche che non hanno anticipato la visita di follow-up e che hanno riferito i sintomi durante la visita programmata
3) pazienti asintomatiche la cui recidiva è stata diagnosticata al momento della visita di follow up programmata.
Le procedure di follow-up adottate da ciascun centro sono elencati nelle tabelle 6 e 7. L’esame obiettivo e il dosaggio del CA125 sono stati effettuati ogni 3-4 mesi durante i primi due anni, ogni 6 mesi dal terzo al quinto anno e ogni anno successivamente.
Al contrario le indagini di diagnostica per immagini sono state impiegate ad intervalli prestabiliti da alcuni centri mentre in altri centri solo in presenza di sintomi o segni sospetti oltre che in presenza di livelli aumentati di CA125.
Un aumento del CA125 è stato definito come un raddoppiamento del limite superiore del normale del CA 125 o del limite inferiore se i livelli di antigene erano continuamente elevati (78,79).
Il follow up mediano delle pazienti era di 35 mesi (range 6 a 224)mesi.
Analisi statistica
L’ intervallo di tempo dalla diagnosi iniziale alla morte o all’ultimo controllo è stato definito come sopravvivenza totale.
L’intervallo dalla diagnosi di recidiva alla morte o all’ ultimo controllo è stato definito come sopravvivenza dopo recidiva. Come variabili prognostiche sono state considerate lo stadio FIGO, il tipo istologico, il grado tumorale la malattia residua dopo la chirurgia iniziale, chirurgia di second look, il tempo alla ricaduta, la sede di ricaduta, il numero delle sedi di ricaduta, la presenza di sintomi e il trattamento al momento della recidiva. Le analisi di sopravvivenza sono state effettuate secondo il metodo del limite di prodotto di Kaplan-Meier. Le differenze fra i gruppi sono state valutate con il log-rank test. La regressione logistica (Modello di Cox) è stata usata per valutare quali erano le variabili prognostiche di sopravvivenza.
5. Risultati
L’età mediana delle pazienti è stata di 58 anni (range 25-86 anni). Le caratteristiche delle pazienti alla diagnosi e alla recidiva sono riportate nelle tabella 8 e 9. I sintomi alla ricaduta erano presenti in 81 donne (19,7%).
La tabella 10 riporta i sintomi presenti al momento della ricaduta in rapporto alla sede di recidiva. Solo una (3,8%) delle 26 pazienti con metastasi ai linfonodi retro-peritoneali era sintomatica. Per quanto riguarda la presenza o l’assenza di sintomi alla ricaduta, 331 (80,3%) pazienti erano asintomatiche quando la recidiva era diagnosticata al momento della visita di follow-up programmata, 8 pazienti hanno riferito i loro sintomi durante l’appuntamento fissato e 73 pazienti hanno anticipato la visita di follow-up a causa dei sintomi. Fra le 331 pazienti asintomatiche la l’indagine che ha fatto insorgere il sospetto di ricaduta di malattia è stato l’esame clinico in 49 pazienti (14,8%), la tomografia assiale computerizzata [TC] in 88 pazienti (26,6%), l’ ecografia in 2 (0,6%), il dosaggio di CA125 in 77 pazienti (23,3%), il dosaggio del CA125 combinato con le indagini radiologiche in 115 pazienti (34,7%). In dettaglio l’esame clinico ha identificato 30 (27,5%) su 109 pazienti con recidiva pelvica rispetto a 8 (10,4%) su 77 con recidiva addominale e 3 (3,5%) su 85 con recidiva a distanza. (Figura 1). Il dosaggio del CA125 da solo o in combinazione con le tecniche di diagnostica per immagini ha avuto un importante ruolo per identificare le sedi di ricaduta. Tutte le 7 pazienti con ricaduta pleurica erano sintomatiche, mentre tutte le 5 pazienti con ripresa parenchimale polmonare erano asintomatiche. Per quanto riguarda queste ultime, la TC ha posto diagnosi di ripresa in 3 pazienti mentre l’associazione del dosaggio di CA125 e della TC nelle altre 2 pazienti. Per quanto riguarda il trattamento alla recidiva, 300 pazienti hanno eseguito un trattamento chemioterapico, 12 pazienti sono state
chirurgia e chemioterapia, 3 pazienti hanno ricevuto l’ ormonoterapia , 2 pazienti sono state sottoposte a radioterapia e 2 non hanno eseguito alcun trattamento al momento della ricaduta. Non erano disponibili i dati circa il trattamento per 43 pazienti. Nella tavola 11 sono riportati i risultati dell’analisi univariata riguardo le variabili predittive di sopravvivenza globale e sopravvivenza dopo la recidiva.
La sopravvivenza globale era correlata allo stadio FIGO (I-IIa versus IIb–IV, mediana:111 mesi versus 46 mesi, p=0,004), alla malattia residua dopo chirurgia iniziale (<1 cm versus >1 cm mediana, 78 mesi versus 38 mesi, p<0,0001) (Figura 2a), all’intervallo di tempo alla ricaduta (> 12 mesi versus 6-12 versus <6 mesi, mediana, 70 versus 31 versus 23 mesi, p< 0.0001) (Figura 3a), alla sede di ricaduta (addominale versus altre sedi, mediana 66 mesi versus 44 mesi, p=0,04) (Figura 4a) e al trattamento alla recidiva (chirurgia più chemioterapia versus altri trattamenti mediana non raggiunta versus 44 mesi p<0,0001). La sopravvivenza dopo la recidiva era correlata allo stadio FIGO (I-IIa versus IIb-IV, mediana: non raggiunta versus 22 mesi, p=0,01), alla malattia residua dopo la chirurgia iniziale (<1 cm versus >1 cm, mediana: 40 versus 20 mesi p<0,0001) (Figura 2b), all’intervallo di tempo alla ricaduta(> 12 mesi versus 6-12 versus <6 mesi, mediana: 33 versus 18 versus 14 mesi, p<0,0001) (Figura 3b), al trattamento alla recidiva (chirurgia più chemioterapia versus altri trattamenti 45 mesi versus 21 mesi; p<0,0001). Il tipo istologico, il grado tumorale, il numero delle sedi di recidiva, i sintomi alla recidiva (figura 5 ) non avevano avuto rilevanza prognostica (Tabella 11)
L’analisi multivariata ha dimostrato che la malattia residua dopo chirurgia iniziale e il tempo alla ricaduta erano le sole variabili prognostiche indipendenti sia per la sopravvivenza globale (p<0,0001) che per la sopravvivenza dopo la recidiva (p<0,0001) (Tabella 12)
6. Discussione
La chirurgia stadiante seguita nei casi a rischio da chemioterapia adiuvante è il trattamento standard del carcinoma ovarico in stadio iniziale. Dal 15% al 50% dei casi iniziali vanno incontro a recidiva dopo intervallo mediano di 15-22 mesi. La pelvi e l’addome sono più frequentemente coinvolte dei linfonodi retro- peritoneali (80-85). È degno di nota che le recidive pelviche rappresentano dal 26% al 40% delle recidive complessive.(80,84-85). Il rischio è principalmente dipendente dal sottostadio FIGO, dal tipo istologico e dal grado tumorale. Nello studio retrospettivo del gruppo cooperativo italiano CTF comprendente 221 pazienti con carcinoma in stadio I, la percentuale di recidive era più bassa per i tumori mucinosi, (6/25 pari all’11%) e più alta per i carcinomi a cellule chiare (5/14 pari al 36%). Il grado istologico era il fattore prognostico più importante di recidiva. Nella serie del CTF il rischio relativo di recidiva era 2,83% (IC 95%, 1,210-6.624) per il grado 2 e 7,725 (IC 95%,3.290-18.140) per il grado 3 paragonato al grado 1.(85)
La chirurgia citoriduttiva seguita da una chemioterapia a base di platino è taxolo è attualmente considerato come il trattamento standard del carcinoma ovarico in stadio avanzato(86-89) . Non esiste alcuna dimostrazione che la chemioterapia neoadiuvante prima della chirurgia di debulking sia superiore al trattamento convenzionale della chirurgia citoriduttiva seguita dalla chemioterapia (89). La chirurgia citoriduttiva è attualmente considerata ottimale se la malattia residua è inferiore al centimetro (52,56). Diversi autori hanno riportato un beneficio di sopravvivenza quando la malattia residua macroscopica è assente(90-93).
Circa il 40-50% delle pazienti con carcinoma ovarico in stadio avanzato raggiunge una risposta clinica e il 25-30% una risposta patologica completa dopo 6 cicli di chemioterapia
risposta patologica svilupperanno in seguito una recidiva (59) dopo un intervallo mediano di 15.5-22 mesi (50-54).
L’ outcome clinico delle pazienti con malattia recidivante è infausto poiché i risultati ottenuti con i trattamenti di salvataggio si sono rivelati spesso insoddisfacenti. La mediana di sopravvivenza dopo recidiva varia fra 11 e 32 mesi. La pelvi e l’addome sono le più comuni sedi di recidiva, mentre la recidiva linfonodale isolata è un evento relativamente poco comune. Studi clinici sul trattamento di consolidamento e mantenimento con la radioterapia sull’intero addome, Fosforo 32 per via intraperitoneale, radio immunoterapia, chemioterapia intraperitoneale, la chemioterapia ad alte dosi con supporto di cellule staminali, la chemioterapia di seconda linea con epirubicina e topotecan hanno dato risultati contraddittori e la somministrazione di più di sei cicli di chemioterapia di prima linea con platino non hanno offerto benefici clinici paragonati con il numero standard di cicli di chemioterapia (94). Uno studio randomizzato di fase tre della SWOG e del GOG ha mostrato un miglioramento nella sopravvivenza libera da malattia nelle pazienti in completa risposta clinica sottoposte a 12 cicli di chemioterapia di mantenimento con paclitaxel 175mg/m2 ogni 4 settimane paragonate a quelle sottoposte a 3 cicli con lo stesso trattamento (95). In un recente studio di fase 3 che ha coinvolto 200 pazienti in risposta clinica e patologica completa dopo chemioterapia con paclitaxel e taxolo, sei cicli di mantenimento con paclitaxel 175mg/m2 ogni tre settimane non si sono rilevati miglioramenti nella sopravvivenza libera da malattia e nella sopravvivenza globale rispetto alla sola osservazione (96).
La pelvi e l’addome sono le sedi più frequenti di recidiva dopo un second-look negativo. In 15 pazienti che presentavano ricaduta , analizzate nello studio di Podratz (97), la recidiva riguardava la pelvi in 2 casi (13%), pelvi e addome in 2 (13%) ; pelvi addome e torace in 3 (20%) , pelvi o linfonodi para aortici in 3 (20%), fegato in 4 (27%), e pelvi e linfonodi para
aortici in1 caso (7%). Tutte le 15 sedi di recidiva analizzate da Bar-Am (98) erano limitate alla cavità pelvica e addominale .Rubin et al (99) riferiscono come sedi di recidiva più comuni: l’ addome in 10 pazienti (47,6%), i polmoni in 3 (14,3%), la pelvi in 2 pazienti (9,5%), il fegato in 2 (9,5%), la vagina in 2 (9,5%) e i linfonodi sovra clavicolari in 2 (9,5%). In uno studio di Gadducci et al che comprendeva 192 pazienti con carcinoma ovarico avanzato in risposta patologica completa dopo second look il 48,9% sviluppava una recidiva dopo un tempo mediano di 18 mesi dal second look. La recidiva era pelvica nel 47,9% dei casi addominale nel 44,7% coinvolgeva i linfonodi retro peritoneali nel 13,8% dei casi ed a distanza nel 21,2%. Gli autori concludevano che la malattia residua dopo chirurgia iniziale e il grado tumorale erano le più importanti variabili prognostiche (59). La malattia residua è il più importante fattore prognostico nel carcinoma ovarico in termini di sopravvivenza globale e di sopravvivenza libera da progressione. Nella serie di Gershenson (100) la sopravvivenza a 5 anni libera da progressione dopo un second look negativo era 64% e 69% per le pazienti con malattia residua >2 cm e > 2 cm e 92% per quelli senza alcun residuo macroscopico. Potraz (97) ha riportato che la malattia recidivava nel 21% delle pazienti con malattia residua inferiore a 2 cm e nel 50% di quelle con residuo superiore a 2 cm. .Nella presente tesi la malattia residua dopo chirurgia era un fattore prognostico di sopravvivenza globale (p<0,0001) e di sopravvivenza dopo la recidiva (p<0,0001) sia all’analisi univariata che a quella multivariata. .La rilevanza prognostica del tipo istologico è stata a lungo dibattuta, l’istotipo endometrioide(101-103) in genere ha prognosi migliore mentre istotipo mucinoso (101,102,104) e cellule chiare (101,102,105) sono associati a prognosi peggiore.
L’intervallo libero da platino è la più importante variabile predittiva di risposta alla seconda linea di chemioterapia. Le pazienti con malattia platino-sensibile hanno buone probabilità di
chemioterapici hanno probabilità di risposta che variano dal 5 al 30%. Alcuni autori suggeriscono di posticipare l’uso di platino dopo la recidiva utilizzando un farmaco diverso, con lo scopo di prolungare il più possibile l’intervallo libero dall’esposizione a questo agente e aumentare cosi la probabilità di risposta alla introduzione del platino per una successiva ricaduta.
In una ricerca condotta da Markman et al. (106) su 72 pazienti con carcinoma ovarico che hanno recidivato dopo un intervallo libero da platino di più di 4 mesi, è emerso che una seconda linea di terapia a base di cisplatino o carboplatino ha dato una risposta obiettiva nel 43% dei casi. In particolare, la risposta complessiva è oscillata dal 27% per le pazienti con intervallo libero da platino di 5-12 mesi, al 33% per quelle con un intervallo di 13-24 mesi, fino al 59% per quelle con un intervallo maggiore di 24 mesi..
Il follow-up delle donne trattate per carcinoma ovarico rappresenta una questione dibattuta e non c’è accordo in letteratura circa i tempi e il tipo di esami da eseguire. Anche l’utilità del follow-up è fonte di discussine poiché il carcinoma ovarico recidivante è spesso una malattia ad esito infausto. I programmi di follow up generalmente includono il dosaggio CA125, l’ esame clinico e le indagini ultrasonografiche, radiologiche o di medicina nucleare.
L’aumento dei livelli di CA125 può precedere la scoperta clinica di recidiva nel 56-94% dei casi con un mediano di 3-5 mesi.(78,107,108). Il management ottimale per le pazienti con livelli crescenti di CA125, senza evidenza clinica, ecografica e radiologica di malattia non è stato ancora ben definito. In questi casi si può, infatti, optare per uno stretto follow-up nel tempo (valutazione clinica, dosaggio dei livelli sierici di CA125, indagini diagnostiche), oppure iniziare un terapia a base di tamoxifene, o, ancora, consigliare le pazienti ad entrare a far parte di trials clinici. Il precoce ricorso alla chemioterapia al momento dell’elevazione del CA125 si associa ad un maggiore stato ansioso, dovuto ad una più precoce presa di
coscienza del quadro patologico. Inoltre, la tossicità associata al farmaco può essere sicuramente più severa quanto più è corto l’intervallo di tempo dalla prima chemioterapia. È in corso uno studio dell’European Organization for Research and Treatment of Cancer (E.O.R.T.C.), di fase III volto ad individuare un vantaggio in sopravvivenza per il trattamento precoce rispetto all’osservazione nelle pazienti asintomatiche, con livelli crescenti di CA125 e senza evidenza clinica di malattia.
L’esame fisico e l’ecografia trans addominale e trans vaginale giocano un ruolo importante nel follow up delle pazienti con carcinoma ovarico, dal momento che da circa la metà delle recidive coinvolgono la pelvi.(109-114). La sensibilità e l’accuratezza diagnostica della TC per la identificazione della recidiva di carcinoma ovarico variano dal 40%al 93% e dal 43% al 95% rispettivamente(110,115-117). In questa analisi più dell’80% delle 412 donne con recidiva di carcinoma ovarico erano asintomatiche ed era stata diagnosticata alla visita programmata di follow up. L’indagine di follow up che ha sollevato il sospetto di recidiva è stato l’esame clinico nel 14,8%dei casi, l’ imaging nel 27,2%, il CA125 nel 23,3%, sia il CA125 che una tecnica di imaging nel 34,7%. Il dosaggio del CA125 o in combinazione con le tecniche di immagine, ha avuto un ruolo importante per la individuazione delle sedi di recidiva. L’analisi multivariata ha dimostrato che la malattia residua dopo chirurgia iniziale e l’intervallo di ricaduta erano le sole variabili prognostiche indipendenti sia per la sopravvivenza globale che per la sopravvivenza dopo recidiva.
Le pazienti che presentano una recidiva dopo un lungo intervallo hanno una sopravvivenza maggiore dopo la trattamento di salvataggio, rispetto a coloro che recidivano più precocemente (118-121). Maggiore è l’intervallo libero da recidiva più alta è la probabilità che le lesioni neoplastiche contengano cloni sensibili ad una ulteriore chemioterapia.
Nella nostra serie non c’è stata differenza di sopravvivenza fra pazienti asintomatiche e sintomatiche al tempo della ricaduta perciò l’anticipazione diagnostica non sembra aver migliorato l’outcome delle pazienti, che alla fine hanno sviluppato la recidiva. Comunque nessuna conclusione sicura può essere tratta a causa delle diversità nei protocolli di follow up adottate dai diversi centri. Per quanto riguarda quest’ultimo, due bias dovrebbero essere presi in considerazione: il bias del “Lead time” cioè la diagnosi precoce semplicemente prolunga il tempo di sopravvivenza durante il quale il paziente è consapevole della malattia e il bias del “Length time” cioè i pazienti con una malattia a lenta progressione è più probabile che siano individuati con test di screening. (122). Solo eventuali studi randomizzati possono valutare la reale efficacia delle linee guida formali per il follow up di pazienti con carcinoma ovarico dopo il trattamento primario . Un altro motivo di dibattito è rappresentato dal potenziale clinico offerto dall’ introduzione di PET/TC nei protocolli di follow up. La sensibilità e l’accuratezza di questo nuovo procedimento diagnostico per la recidiva di carcinoma ovarico variano dal 73% al 100%e dal 62% al 95% rispettivamente.(123-127). La PET/TC può anche rivelare una diffusione sopradiaframmatica della malattia può essere particolarmente utile quando i livelli di CA125 sono elevati e la tecnica di immagine convenzionale è inconclusiva o negativa.(123,128-130). Un consenso nei confronti del ruolo della chirurgia citoriduttiva secondaria nella recidiva del carcinoma ovarico non è ancora stato raggiunto sebbene parecchi studi retrospettivi sembrino suggerire un beneficio di sopravvivenza per i pazienti con una resezione completa di tutte le lesioni macroscopicamente rilevabili (69,131,132). La PET/TC possono essere di valido aiuto nella programmazione della cura specialmente per la scelta dei pazienti adatti alla citoriduzione chirurgica secondaria (124,126,133) e un possibile trial randomizzato di interventi terapeutici basati sulla stratificazione dello stato di malattia ottenuto con PET/TC potrebbe chiarire
l’effettiva importanza di questo procedimento diagnostico nella gestione dei pazienti con carcinoma ovarico.(130)
7. Conclusioni
In conclusione i tassi di sopravvivenza simili delle donne asintomatiche e sintomatiche potrebbero suggerire che le procedure di follow up, sia con un approccio minimo che intensivo non riescono a migliorare la prognosi dei pazienti. Tuttavia la sempre maggiore disponibilità di nuovi agenti citotossici e a bersaglio molecolare per il trattamento di salvataggio e i promettenti risultati ottenuti da una ottimale citoriduzione chirurgica secondaria in pazienti accuratamente selezionati dovrebbero incoraggiare i trial clinici randomizzati specificatamente indirizzati a confrontare l’efficacia di diverse schemi di follow- up.
8. Bibliografia
1. La Vecchia C. Epidemiology of ovarian cancer: a summary review. Eur. J. Cancer Prev. 2001; 10: 125-9.
2. Quirk JT, Natarajan N. Ovarian cancer incidence in the United States, 1992-1999. Gynecol. Oncol. 2005; 97: 519-23.
3. Guppy AE, Nathan PD, Rustin GJ. Epithelial ovarian cancer: a review of current management. Clin. Oncol. (R. Coll. Radiol.) 2005; 17: 399-411.
4. Menon U, Skates SJ, Lewis S, et al. Prospective study using the risk of ovarian cancer algorithm to screen for ovarian cancer. J. Clin. Oncol. 2005; 23: 7919-26.
5. Heintz APM, Odicino F, Maisonneuve P, et al. Carcinoma of the ovary. Int. J. Gynecol. Obstet. 2006; 95 (Suppl.): S161-92.
6. Chiaffarino F, Pelucchi C, Parazzini F, et al. Reproductive and hormonal factors and ovarian cancer. Ann. Oncol 2001; 12: 337-41.
7. La Vecchia C. Oral contraceptives and ovarian cancer: an update, 1998- 2004. Eur J Cancer Prev. 2006; 15:117-248.
8. The Cancer and Steroid Hormone Study of the Centers for Disease Control and the National Institute of Child Health and Human Development. The reduction in risk of ovarian cancer associated with oral-contraceptive use. N. Engl. J. Med. 1987; 316: 650-5.
9. Schildkraut JM, Calingaert B, Marchbanks PA, et al. Impact of progestin and estrogen potency in oral contraceptives on ovarian cancer risk. J. Natl. Cancer Inst. 2002; 94: 32-8.
10. Rodriguez GC, Nagarsheth NP, Lee KL, et al. Progestin induced apoptosis in the Macaque ovarian epithelium: differential regulation of transforming growth factor-beta. J. Natl. Cancer Inst. 2002; 94: 50-60.
11. Gadducci A, Cosio S, Gargini A, Genazzani AR. Sex-steroid hormones, gonadotropin and ovarian carcinogenesis: a review of epidemiological and experimental data. Gynecol. Endocrinol. 2004; 19: 216-28.
12. Risch HA. Hormonal etiology of epithelial ovarian cancer, with a hypothesis concerning the role of androgens and progesterone. J. Natl. Cancer Inst. 1998; 90: 1774-86.
13. Konishi I, Kuroda H, Mandai M. Review: gonadotropins and development of ovarian cancer. Oncology 1999; 57 (Suppl. 2): 45-8.
14. Anderson SM, Dimitrievich E. Ovulation induction for infertility: is it safe or not. S. D. J. Med. 1996; 49: 419-21.
15. Parazzini F, Pelucchi C, Negri E, et al. Use of fertility drugs and risk of ovarian cancer. Hum Reprod. 2001;16:1372-5.
16. Ness RB, Cramer DW, Goodman MT, et al. Infertility, fertility drugs, and ovarian cancer: a pooled analysis of case-control studies. Am. J. Epidemiol. 2002; 155: 217-24.
17. Gadducci A, Fanucchi A, Cosio S, Genazzani AR. Hormone replacement therapy and gynaecological cancer. Anticancer Res. 1997; 17: 3793-8.
18. Persson I, Yuen J, Bergkvist L, Schairer C. Cancer incidence and mortality in women receiving estrogen and estrogen-progestin replacement therapy--long-term follow-up of a Swedish cohort. Int. J.Cancer 1996; 67: 327-32.
19. Hempling RE, Wong C, Piver MS, et al. Hormone replacement therapy as a risk factor for epithelial ovarian cancer: Results of a case-control study. Obstet. Gynecol. 1997; 89: 1012-6.
20. Negri E, Tzonou A, Beral V, et al. Hormonal therapy for menopause and ovarian cancer in a collaborative re-analysis of European studies. Int. J. Cancer 1999; 80: 848-51.
21. Riman T, Dickman PW, Nilsson S, et al. Hormone replacement therapy and the risk of invasive epithelial ovarian cancer in Swedish women. J. Natl. Cancer Inst. 2002; 94: 497-504.
22. Genazzani AR, Gadducci A, Gambacciani M. Controversial issues in climateric medicine.II. Hormone replacement therapy and cancer. Maturitas 2001; 40: 117-30. 23. Bosetti C, Negri E, Franceschi S, et al. Diet and ovarian cancer risk: a case control
study in Italy. Int. J. Cancer 2001; 93: 911-5.
24. Zhang M, Yang ZY, Binns CW, Lee AH. Diet and ovarian cancer risk: a case control study in China. Br. J. Cancer 2002; 86: 712-7.
25. Bosetti C, Altieri A, La Vecchia C. Diet and environmental carcinogenesis in breast /gynaecological cancer. Curr. Opinion. Obstet Gynecol. 2002; 14: 13-8.
26. Risch HA, McLaughin JR, Cole DEC, et al. Prevalence and penetrance of germline BRCA1 and BRCA2 mutations in a population series of 649 women with ovarian cancer. Am. J. Hum. Genet. 2001; 68: 700-10.
27. Narod SA. Hormonal prevention of hereditary breast cancer. Ann. N.Y. Sci. 2001; 952: 36-43.
28. Narod SA, Boyd J. Current understanding of the epidemiology and clinical implications of BRCA1 and BRCA2 mutations for ovarian cancer. Curr. Opin. Obstet. Gynecol. 2002; 14: 19-26
29. Sharma A, James M, Donaldson A, Fox R. Hereditary non-polyposis colorectal cancer syndrome: combined risk of gastrointestinal and gynaecological cancer. Br. J. Obstet. Gynaecol. 2001; 108: 671-7.
30. Huusko P, Castren K, Launonen V, et al. Germ-line TP53 mutations in Finnish cancer families exhibiting features of the Li-Fraumeni syndrome and negative for BRCA1 and BRCA2. Cancer Genet. Cytogenet. 1999; 112: 9-14.
31. Società Italiana di Oncologia Ginecologica. Manuale di Ginecologia Oncologica. UTET Torino, Seconda Edizione.
32. Shih Ie M, Kurman RJ. Ovarian tumorigenesis: a proposed model based on morphological and molecular genetic analysis. Am. J. Pathol. 2004; 164: 1511-8. 33. Kolomainen DF, Larkin JM, Badran M, et al. Epithelial ovarian cancer metastasizing to
the brain: a late manifestation of the disease with an increasing incidence. J. Clin. Oncol. 2002; 20: 982-6.
34. Colombo N, Chiari S, Maggioni A, et al. Controversial issues in the management of early epithelial ovarian cancer: Conservative surgery and role of adjuvant therapy. Gynecol. Oncol. 1994; 55: S47-S51.
35. Zanetta G, Rota G, Chiari S, et al. The accuracy of staging: an important prognostic determinator in stage I ovarian carcinoma. A multivariate analysis. Ann. Oncol. 1998; 9: 1097-101.
36. Hoskins WJ. Surgical staging and cytoreductive surgery of epithelial ovarian cancer. Cancer 1993; 71 (Suppl.): 1534-40.
37. Griffiths CT. Surgical cytoreduction of ovarian cancer. In: "Multimodal Treatment of Ovarian Cancer" (Conte PF, Ragni N, Rosso R, Vermorken JB eds), Raven Press, New York, 1989: 133-41.
38. Griffiths CT, Finkler NJ. Surgery for carcinoma of the ovary: Extrapelvic cytoreduction. In: "Gynecologic Oncology" (Coppleson M Ed.), Edinburgh, Scotland, Churchill, Livingstone, 1992: 313-33.
39. Benedetti-Panici P, Maneschi F, Scambia G, et al. The pelvic retroperitoneal approach in the treatment of advanced ovarian carcinoma. Obstet. Gynecol. 1996; 897: 532-8. 40. Panici PB, Maggioni A, Hacker N, et al. Systematic aortic and pelvic
lymphadenectomy versus resection of bulky nodes only in optimally debulked advanced ovarian cancer: a randomized clinical trial. J. Natl. Cancer Inst. 2005; 97: 560-6.
41. van der Burg MEL, van Lent M, Buyse M, et al. The effect of debulking surgery after induction chemotherapy on the prognosis in advanced epithelial ovarian cancer. Gynecological Cancer Cooperative Group of the European Organization for Research and Treatment of Cancer. N. Engl. J. Med. 1995;332: 629-34.
42. Schwartz PE. Neoadjuvant chemotherapy for the management of ovarian cancer. Brest Pract. Res. Clin. Obstet. Gynaecol. 2002; 16: 585-96.
43. Vergote I. Role of surgery in ovarian cancer: an update. Acta Chir. Belg. 2004; 104: 246-56.
44. Coukos G, Rubin SC. Early ovarian cancer. Curr. Treat. Options Oncol. 2000; 1: 129-37.
46. Conte PF, Cianci C, Gadducci A. Up-date in the management of advanced ovarian carcinoma. Crit. Rev. Oncol. Hematol. 1999; 32: 49-58.
47. Advanced Ovarian Cancer Trialist Group. Chemotherapy in advanced ovarian cancer: An overview of randomized clinical trials. Br. Med. J. 1991; 303: 884-93.
48. The Ovarian Cancer Meta-Analysis Group. Cyclophosphamide plus cisplatin versus cyclophosphamide,doxorubicin, and cisplatin chemotherapy of ovarian carcinoma: a meta-analysis. J. Clin. Oncol. 1991; 9: 1668-74.
49. A'Hern RP, Gore ME. Impact of doxorubicin on survival in advanced ovarian cancer. J. Clin. Oncol. 1995; 13: 726-32.
50. McGuire WP, Hoskins WJ, Brady MF, et al. Cyclophosphamide and cisplatin versus paclitaxel and cisplatin: a phase III randomized trial in patients with suboptimal stage III/IV ovarian cancer (from the Gynecologic Oncology Group). Semin. Oncol. 1996; 23: 40-7.
51. Piccart MJ, Bertelsen K, James K, et al. Randomized intergroup trial of cisplatin-paclitaxel versus cisplatin cyclophosphamide in women with advanced epithelial ovarian cancer: three- year results. J. Natl. Cancer Inst. 2000; 92: 699-708.
52. Neijt JP, Engelholm SA, Tuxen MK, et al. Exploratory phase III study of paclitaxel and cisplatin versus paclitaxel and carboplatin in advanced ovarian cancer. J. Clin. Oncol. 2000; 18: 3084-92.
53. du Bois A, Luck HJ, Meier W, et al. A randomized clinical trial of cisplatin/paclitaxel versus carboplatin/paclitaxel as first-line treatment of ovarian cancer. J. Natl. Cancer Inst. 2003; 95: 1320-30.
54. Ozols RF. Paclitaxel (Taxol)/carboplatin combination chemotherapy in the treatment of advanced ovarian cancer. Semin. Oncol. 2000; 27: 3-7.