INDICE
1. RIASSUNTO ... 3
2. INTRODUZIONE ... 4
2.1 Le Nanoparticelle ... 4
2.1.1 Definizione e Classificazione delle Nanoparticelle... 4
2.1.2 Utilizzo delle Nanoparticelle da parte dell’uomo e rischi per l’ambiente ... 6
2.1.2.1 Nanotossicità ... 8
2.1.3 Effetto delle Nanoparticelle sull’uomo, sul regno animale e sugli organismi unicellulari ... 9
2.1.4 Interazione tra Nanoparticelle e piante superiori ... 10
2.1.5 Utilizzo, caratteristiche e comportamento delle Nanoparticelle di Biossido di Titanio (TiO2) ... 14
2.1.6 Utilizzo, caratteristiche e comportamento delle Nanoparticelle di Magnetite (Fe3O4) ... 16
2.2 Elementi trasponibili: caratteristiche e classificazione ... 18
2.3 Scopo della tesi ... 20
3. MATERIALI E METODI ... 22
3.1 Materiale utilizzato e trattamenti ... 22
3.2 Analisi di microscopia elettronica ... 24
3.3 Estrazione di RNA totale ... 25
3.3.1 Purificazione dell’RNA ... 27
3.3.2 Elettroforesi di RNA totale su gel di agarosio in condizioni denaturanti ... 27
3.4 Analisi trascrittomiche: sequenziamento di RNA e valutazione dell’espressione genica... 29
4.1 Effetto delle NP di TiO2 e Fe3O4 sulla morfologia di piantine di pomodoro ... 33
4.2 Analisi al microscopio elettronico: comportamento delle NP e loro assorbimento ... 36
4.3 Analisi Molecolari: RNA sequencing ... 38
4.3.1 Analisi Molecolari: espressione di geni coinvolti nello sviluppo radicale ... 39
4.3.2 Analisi Molecolari: espressione degli elementi trasponibili ... 41
5. DISCUSSIONE ... 43
6.CONCLUSIONI ... 48
1. RIASSUNTO
In tempi recenti le nanoparticelle (NP) hanno trovato diverse applicazioni in quasi tutti i settori tecnologici, creando problemi di accumulo nell’ambiente e facendo crescere la necessità di chiarire aspetti legati alla loro tossicità. Questo lavoro di Tesi fa parte del progetto INESE (Impact of Nanoparticles in Enivornmental Sustainability and Ecotoxicity), promosso dall’Istituto Italiano di Tecnologia (IIT), in cui tra i partners figura il Dipartimento di Biologia delle Piante Agrarie dell’Università di Pisa. Il progetto si propone di ricercare possibili effetti collaterali e danni causati dalle NP oltre a valutare possibili misure di prevenzione e protocolli sperimentali per lo studio del loro impatto su organismi animali e vegetali. Il lavoro di ricerca ha riguardato in particolare l’effetto delle NP su piante di pomodoro (cv. Micro Tom) coltivate in condizioni idroponiche e i trattamenti sono stati eseguiti aggiungendo diverse concentrazioni di NP di Fe3O4 o di TiO2 alla
soluzione nutritiva. Al termine degli esperimenti, usando un microscopio elettronico a scansione dotato di spettroscopio a dispersione di energia per l'identificazione chimica dei materiali, è stato osservato che entrambe le NP testate sono in grado di ricoprire l’epidermide radicale formando aggregati nanostrutturati, e che singole NP o piccoli aggregati possono essere assorbiti dalle radici e traslocati all’ipocotile. Si tratta di un aspetto ecologico fondamentale legato alle NP: il loro assorbimento da parte di una specie orticola può implicare un potenziale rischio di contaminazione della catena alimentare. In piantine trattate con NP la morfologia dei germogli non è risultata alterata e non sono stati osservati sintomi di tossicità. Rispetto ai controlli e a piantine esposte a NP di Fe3O4, piantine cresciute con alte concentrazioni di NP di TiO2 hanno
mostrato un’anormale proliferazione di peli radicali. Questa risposta è risultata dipendere dalla concentrazione delle NP in sospensione e dalle caratteristiche chimico-fisiche delle stesse, tuttavia resta ancora da chiarire la causa di tale fenomeno. E’ possibile che la proliferazione di peli radicali sia dovuta ad una risposta adattativa data dalla ridotta capacità di assorbimento radicale di sostanze nutritive, causato dalla deposizione delle NP sulla superficie esterna, oppure all’assorbimento delle NP all’interno dei tessuti radicali. Al fine di analizzare, a livello molecolare, la risposta a trattamenti con NP, è stata condotta un’analisi trascrittomica attraverso esperimenti di sequenziamento Illumina di RNA isolato da radici, evidenziando l’espressione differenziale di alcuni elementi trasponibili e di alcuni geni chiave coinvolti nello sviluppo radicale.
2. INTRODUZIONE
2.1 Le Nanoparticelle
2.1.1 Definizione e Classificazione delle Nanoparticelle
Con il termine “Nanomateriale1” si definisce un qualsiasi materiale con almeno una dimensione inferiore ai 100 nm. All’interno di questo gruppo di materiali troviamo le “Nanoparticelle2”, identificate come aggregati atomici o molecolari con almeno due dimensioni comprese tra 1 e 100 nm (Klaine et al., 2008). Tali particelle vengono studiate approfonditamente per le particolari proprietà fisico-chimiche: posseggono infatti caratteristiche uniche, talvolta completamente discordanti da quelle di materiali della stessa specie chimica ma composta di particelle più grossolane (materiale bulk) (Nel et al., 2006). Tali proprietà sono conferite soprattutto da una maggiore superficie esposta per unità di volume, per cui una data massa di materiale in forma di NP sarà molto più reattiva della stessa massa di materiale fatta di particelle più grandi (Brar et al. 2010), inoltre l’azione delle NP dipende sia dalla loro composizione chimica che dalla loro grandezza e dalla loro forma (Brunner et al., 2006).
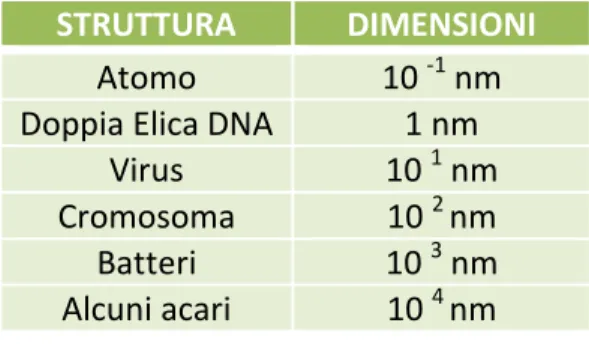
In natura esistono molte strutture di dimensioni nanometriche, fra cui troviamo anche molecole biologiche essenziali come il DNA, la cui doppia elica ha un diametro di circa 2 nm (Tabella 1 e Figura 1).
Tabella 1 – Ordine di grandezza approssimativo di alcune
strutture presenti in natura (1 nm = 1 miliardesimo di metro).
1 Abbreviato con “NM”
2 Indicate in seguito con “NP”
STRUTTURA DIMENSIONI
Atomo 10 -1 nm
Doppia Elica DNA 1 nm
Virus 10 1 nm
Cromosoma 10 2 nm Batteri 10 3 nm Alcuni acari 10 4 nm
Figura 1 – Rappresentazione di una scala di grandezza (da 1 m a 10
dimensionale occupato dalle nanoparticelle: da 10
sono riportate immagini significative (The Royal Society & The Royal Academy of Engineering, 2004).
Le NP possono assumere forma sferic
materiali e possono esistere allo stato disperso, in forma fusa, aggregata o agglomerata (Figura 2)(Nowack and Bucheli, 2007).
Figura 2 – Immagini al microscopio di alcune tipologie di
Partendo da sinistra: nanoparticelle di Oro, una nanoparticella ottopode e alcune nanoparticelle di Argento. Rappresentazione di una scala di grandezza (da 1 m a 10-10m) che mostra nel dettaglio
dimensionale occupato dalle nanoparticelle: da 10-7m(100nm) a 10-9m(1nm). Per alcuni ordini di grandezza sono riportate immagini significative (The Royal Society & The Royal Academy of Engineering, 2004).
Le NP possono assumere forma sferica, tubulare o irregolare, possono essere formate da vari materiali e possono esistere allo stato disperso, in forma fusa, aggregata o agglomerata (Figura
Immagini al microscopio di alcune tipologie di nanoparticelle caratterizzate da forme diverse. Partendo da sinistra: nanoparticelle di Oro, una nanoparticella ottopode e alcune nanoparticelle di Argento.
m) che mostra nel dettaglio l’intervallo m(1nm). Per alcuni ordini di grandezza sono riportate immagini significative (The Royal Society & The Royal Academy of Engineering, 2004).
a, tubulare o irregolare, possono essere formate da vari materiali e possono esistere allo stato disperso, in forma fusa, aggregata o agglomerata (Figura
nanoparticelle caratterizzate da forme diverse. Partendo da sinistra: nanoparticelle di Oro, una nanoparticella ottopode e alcune nanoparticelle di Argento.
In base all’origine le NP possono essere classificate in tre gruppi (Ruffini Castiglione e Cremonini, 2009):
1. Naturali, presenti fin dalla nascita della terra e con cui abbiamo sempre avuto a che fare (ceneri vulcaniche, polvere cosmica, polveri derivate dall’erosione delle rocce, ecc.);
2. Antropogeniche o accidentali, derivanti dalle attività umane (gas di scarico o polveri prodotte dal traffico veicolare, dagli inceneritori, dal riscaldamento domestico, ecc.);
3. Ingegnerizzate o intenzionali, appositamente prodotte dalle nanotecnologie3 a livello industriale per trovare uso in vari campi scientifici e industriali. I NM ingegnerizzati possono essere a loro volta raggruppati in quattro tipologie (Lin and Xing, 2007): (1) Materiali a base di carbonio, che comprendono i fullereni, i nanotubi di carbonio a parete singola (SWCNT) e i nanotubi a parete multipla (MWCNT); (2) Materiali costituiti da metalli come i quantum dots punti quantici e le NP a base di oro, zinco, TiO2, ZnO e Al2O3; (3) Dendrimeri, ovvero dei nanopolimeri,
costituiti da unità ramificate, sintetizzati per svolgere specifiche funzioni chimiche; (4) Materiali composti che combinano NP con altre NP o con materiale grossolano.
2.1.2 Utilizzo delle Nanoparticelle da parte dell’uomo e rischi per l’ambiente
Particelle di dimensioni nanometriche sono presenti sulla terra da milioni di anni e vengono sfruttate dall’uomo da millenni (Nowack and Bucheli, 2007). NP di oro sono note sin dall'antichità, 5º - 4º millenio a.C. (Cina, Egitto). Gli egiziani erano soliti preparare soluzioni di oro colloidale usate come elisir. Inoltre l’oro colloidale era usato per conferire il colore rubino a vetri e ceramiche. Con i romani si raggiunse un uso sofisticato di tali additivi, si arrivò infatti a produrre il vetro dicroico (bicolore): l’esempio più noto è la famosa Coppa di Licurgo (fig.3) conservata al British Museum. Questo manufatto di industria romana (IV-V sec. d. C.) ha la peculiarità, essendo costituito anche da NP di oro e di argento, di apparire rosso rubino se la luce viene trasmessa attraverso la sua superficie e verde se invece la luce è riflessa dalla stessa. Un altro esempio è la Porpora di Cassio, un colloide di particelle di oro e di diossido di stagno che fu usato come colorante del vetro nel secolo XVII (Gentilini, 2008).
3 Con il termine “Nanotecnologie” si intende il controllo e lo studio di materiali e sistemi con dimensioni comprese approssimativamente tra 1 e 100 nanometri (Nowack and Bucheli, 2007 ).
Figura 3 – La famosa Coppa di Licurgo conservata al British Museum ha
rosso rubino se la luce viene trasmessa attraverso la sua superficie e di colore verde se la luce è riflessa dalla stessa. Ciò è dovuto alle particolari proprietà conferite al vetro dalle NP di Oro e Argento.
L’uomo è quindi da lungo tempo esposto alle NP naturali, mentre inizia solo ora ad entrare in contatto con quelle ingegnerizzate. Si stima che l’esposizione a cui siamo sottoposti sia in continua crescita e continuerà ad aumentare anche in futuro, in quanto, in tem
hanno trovato diverse applicazioni in quasi tutti i settori tecnologici come in quello chimico, manifatturiero, biomedico, agricolo, elettronico, energetico e in una vasta gamma di aspetti della vita umana, le troviamo difatti in molti pr
catalizzatori, semiconduttori, cosmetici, detergenti, tessuti, alimentari, medicinali, ecc.. che le nanotecnologie possano mettere in moto un mercato da 1.000 miliardi di dollari 2015, dando lavoro a circa 2 milioni di
2005 erano più di 475
mercato statunitense, tra cui racchette da tennis
e Karn, 2005). Ci aspettiamo che le principali vie di contaminazione seguite dalle NP, considerando il loro largo impiego in prodotti di consumo, siano gli ambienti acquatici, terrestri e l’atmosfera, ambienti in cui purtroppo il loro comporta
(Ruffini Castiglione e Cremonini.,
(Manchikanti and Bandopadhayay, 2010) ed è perciò probabile che possano creare problemi di accumulo nell’ambiente e quindi nella catena alimentare. Da ciò quindi nasce la preoccupazione verso il considerevole aumento del rischio di contaminazione dell’ambiente da parte di queste
La famosa Coppa di Licurgo conservata al British Museum ha la peculiarità di apparire di colore rosso rubino se la luce viene trasmessa attraverso la sua superficie e di colore verde se la luce è riflessa dalla stessa. Ciò è dovuto alle particolari proprietà conferite al vetro dalle NP di Oro e Argento.
quindi da lungo tempo esposto alle NP naturali, mentre inizia solo ora ad entrare in contatto con quelle ingegnerizzate. Si stima che l’esposizione a cui siamo sottoposti sia in continua crescita e continuerà ad aumentare anche in futuro, in quanto, in tem
hanno trovato diverse applicazioni in quasi tutti i settori tecnologici come in quello chimico, manifatturiero, biomedico, agricolo, elettronico, energetico e in una vasta gamma di aspetti della vita umana, le troviamo difatti in molti prodotti commerciali come all’interno di vernici, catalizzatori, semiconduttori, cosmetici, detergenti, tessuti, alimentari, medicinali, ecc..
possano mettere in moto un mercato da 1.000 miliardi di dollari circa 2 milioni di lavoratori (Nel et al., 2006; Zhang and
le merci prodotte dalle nanotecnologie disponibili nel tra cui racchette da tennis, pantaloni, e vari strumenti
. Ci aspettiamo che le principali vie di contaminazione seguite dalle NP, considerando il loro largo impiego in prodotti di consumo, siano gli ambienti acquatici, terrestri e l’atmosfera, ambienti in cui purtroppo il loro comportamento e il loro destino rimane pressoché sc
(Ruffini Castiglione e Cremonini., 2009). Certi NM ingegnerizzati risultano non biodegradabili (Manchikanti and Bandopadhayay, 2010) ed è perciò probabile che possano creare problemi di biente e quindi nella catena alimentare. Da ciò quindi nasce la preoccupazione verso il considerevole aumento del rischio di contaminazione dell’ambiente da parte di queste
la peculiarità di apparire di colore rosso rubino se la luce viene trasmessa attraverso la sua superficie e di colore verde se la luce è riflessa dalla stessa. Ciò è dovuto alle particolari proprietà conferite al vetro dalle NP di Oro e Argento.
quindi da lungo tempo esposto alle NP naturali, mentre inizia solo ora ad entrare in contatto con quelle ingegnerizzate. Si stima che l’esposizione a cui siamo sottoposti sia in continua crescita e continuerà ad aumentare anche in futuro, in quanto, in tempi recenti, le NP hanno trovato diverse applicazioni in quasi tutti i settori tecnologici come in quello chimico, manifatturiero, biomedico, agricolo, elettronico, energetico e in una vasta gamma di aspetti della odotti commerciali come all’interno di vernici, catalizzatori, semiconduttori, cosmetici, detergenti, tessuti, alimentari, medicinali, ecc.. Si prevede possano mettere in moto un mercato da 1.000 miliardi di dollari entro il Zhang and Karn, 2005). Già nel nanotecnologie disponibili nel e vari strumenti di precisione (Zhang . Ci aspettiamo che le principali vie di contaminazione seguite dalle NP, considerando il loro largo impiego in prodotti di consumo, siano gli ambienti acquatici, terrestri e l’atmosfera, mento e il loro destino rimane pressoché sconosciuto 2009). Certi NM ingegnerizzati risultano non biodegradabili (Manchikanti and Bandopadhayay, 2010) ed è perciò probabile che possano creare problemi di biente e quindi nella catena alimentare. Da ciò quindi nasce la preoccupazione verso il considerevole aumento del rischio di contaminazione dell’ambiente da parte di queste
particelle, ormai parte della nostra vita quotidiana (Biswas and Wu, 2005; Nowack a 2007), e la necessità di chiarire gli effetti biologici arrecati agli organismi attrave nanotossicità (Fröhlich e Roblegg
Purtroppo, come spesso accade,
preceduto la valutazione del rischio ambientale e la salute dell’uomo potrebbe farne le spese.
2.1.2.1 Nanotossicità
Gli organismi presenti in ambienti contaminati da NP con il tempo sono destinati ad incorporarle, principalmente attraverso il canale alimentare, da dove in seguito possono essere traslocate verso tutti gli organi. Qui, sebbene i meccanismi di tossicità de
non siano ancora del tutto chiari (Figura 4), vari studi convergono nell’affermare che le NP esplichino la loro azione tossica attraverso meccanismi differenti (Klaine
• Danni alle membrane e ai potenziali di membrana,
• Ossidazione delle proteine,
• Genotossicità,
• Interruzione del trasporto di elettroni,
• Formazione di radicali liberi dell’ossigeno (ros),
• Rilascio di componenti tossici.
La dimensione, la natura chimica, la superficie chimicamente attiva, la carica elettrica concentrazione, il rivestimento e la persistenza biologica sono importanti parametri che concorrono a determinare la tossicità delle NP (Manchikanti and Bandopadhayay, 2010).
particelle, ormai parte della nostra vita quotidiana (Biswas and Wu, 2005; Nowack a 2007), e la necessità di chiarire gli effetti biologici arrecati agli organismi attrave
Fröhlich e Roblegg, 2012; Hansen et al., 2008; Bu Q. et al., 2010; Clift
Purtroppo, come spesso accade, l’utilizzo e il potenziale rilascio di NP nell’ecosistema ha preceduto la valutazione del rischio ambientale e la salute dell’uomo potrebbe farne le spese.
Gli organismi presenti in ambienti contaminati da NP con il tempo sono destinati ad incorporarle, principalmente attraverso il canale alimentare, da dove in seguito possono essere traslocate verso tutti gli organi. Qui, sebbene i meccanismi di tossicità della maggior parte dei NM non siano ancora del tutto chiari (Figura 4), vari studi convergono nell’affermare che le NP esplichino la loro azione tossica attraverso meccanismi differenti (Klaine et al
Danni alle membrane e ai potenziali di membrana, Ossidazione delle proteine,
Interruzione del trasporto di elettroni,
ormazione di radicali liberi dell’ossigeno (ros), Rilascio di componenti tossici.
La dimensione, la natura chimica, la superficie chimicamente attiva, la carica elettrica concentrazione, il rivestimento e la persistenza biologica sono importanti parametri che concorrono a determinare la tossicità delle NP (Manchikanti and Bandopadhayay, 2010).
particelle, ormai parte della nostra vita quotidiana (Biswas and Wu, 2005; Nowack and Bucheli, 2007), e la necessità di chiarire gli effetti biologici arrecati agli organismi attraverso studi sulla 2010; Clift et al., 2008). l’utilizzo e il potenziale rilascio di NP nell’ecosistema ha preceduto la valutazione del rischio ambientale e la salute dell’uomo potrebbe farne le spese.
Gli organismi presenti in ambienti contaminati da NP con il tempo sono destinati ad incorporarle, principalmente attraverso il canale alimentare, da dove in seguito possono essere lla maggior parte dei NM non siano ancora del tutto chiari (Figura 4), vari studi convergono nell’affermare che le NP
et al., 2008):
La dimensione, la natura chimica, la superficie chimicamente attiva, la carica elettrica, la concentrazione, il rivestimento e la persistenza biologica sono importanti parametri che concorrono a determinare la tossicità delle NP (Manchikanti and Bandopadhayay, 2010).
Figura 4 – Schema dei
possibili meccanismi di tossicità causati dai NM nei confronti dei batteri (Klaine et al., 2008).
2.1.3 Effetto delle Nanoparticelle sull’uomo, sul regno animale e sugli organismi
unicellulari
Ad oggi esistono ancora molte incertezze sul potenziale rischio arrecato dalle NP alla salute umana. Queste incertezze sorgono a causa di lacune nello studio dei fattori originanti i rischi per la salute: poco si sa sulle vie di esposizione, sulla traslocazione delle NP una volta entrate nel corpo, e sull’interazione di queste con i sistemi biologici umani. Il potenziale rischio per la salute viene generalmente associato all’entità e alla durata dell’esposizione, alla persistenza del materiale nel corpo, alla tossicità intrinseca del materiale e alla suscettibilità/stato di salute della singola persona (Martinsone and Bake, 2010). Gli studi di tossicità delle NP sull’uomo reperibili in letteratura sono in genere di due tipi: studi epidemiologici degli effetti sull’uomo del particolato atmosferico urbano e studi sperimentali in vivo su animali e in vitro su colture cellulari condotti con NP artificiali. Esistono numerosi studi che confermano la capacità di queste entità estranee di entrare nel sangue causando effetti negativi sul colon, sulla funzionalità delle cellule endoteliali, sui muscoli e sulla pelle, favorendo inoltre lo sviluppo di sarcomi (Gatti and Rivasi, 2002; Gatti, 2004, 2005; Gatti et al., 2004, 2008; Sabbioni et al., 2004; Hansen et al., 2006).
La maggiore preoccupazione dal punto di vista tossicologico in riferimento ai NM ingegnerizzati deriva quindi dal fatto che alcuni di questi sono in grado di attraversare le membrane cellulari e, una volta all’interno delle cellule, possono spostarsi finendo anche nei mitocondri (Foley et al., 2002). Una volta entrati nelle cellule i NM possono venire a contatto con gli acidi nucleici e indurre la formazione di tumori a causa di danni a carico del DNA e alla proliferazione cellulare associata all’infiammazione in corso (Klaine et al., 2008).
Esistono diversi studi di nanotossicità effettuati su organismi unicellulari e sul regno animale. Un’interessante ricerca ha dimostrato che topi sottoposti a trattamenti con dosi crescenti di nanotubi di carbonio rispondono con la formazione di granulomi epitelioidi ed, in alcuni casi, con l’instaurarsi di infiammazioni interstiziali (Lam et al.,2004). Più studi ecotossicologici hanno dimostrato che le NP risultano tossiche anche per gli organismi acquatici, sia unicellulari (batteri e protozoi, per esempio) che pluricellulari, come per esempio su Daphnia o su vari pesci (Nowack and Bucheli, 2007).
Esistono numerose informazioni sull’uso delle NP di Argento come battericidi e difatti le cellule dei batteri vengono danneggiate in loro presenza con conseguente esito infausto (Sondi e Salopek-Sondi, 2004). Oltre all’argento anche le NP di TiO2, SiO2 e ZnO hanno un effetto tossico sui
batteri e la presenza della luce è un fattore che incrementa in modo significativo l’efficacia battericida (Adams et al., 2006).
2.1.4 Interazione tra Nanoparticelle e piante superiori
Se da una parte c'è stato un notevole interesse verso la comprensione della nanotossicità nei confronti del regno animale e dei batteri, sfociato in numerose ricerche, dall’altra non si può certo affermare che ciò sia avvenuto anche nei confronti del regno vegetale; rari sono gli studi sulle piante superiori, soprattutto verso specie di fondamentale importanza nella catena alimentare in quanto anello cruciale per la diffusione delle NP nell’ambiente. Questo esiguo numero di studi poggia le proprie basi su test proposti e codificati dalle Linee Guida dell’USEPA (U.S. Environmental Protection Agency) (1996) che prendono in considerazione le analisi sulla germinazione dei semi e sull’allungamento delle radici (spesso accompagnati da misure di crescita), vari processi metabolici (quali la fotosintesi) e studi anotomo-istologici con microscopio ottico ed elettronico (utili per evidenziare in situ i sintomi di una possibile tossicità).
Studi sulla fitotossicità riportano sia effetti positivi che negativi delle NP sulle piante superiori. Sono pochi gli studi in cui vengono riportati gli effetti positivi o stimolanti delle NP somministrate a basse concentrazioni alle piante. In alcune di queste ricerche il biossido di titanio (TiO2) sotto forma di particelle nanometriche ha dimostrato di avere effetti stimolanti su piante di
spinacio (Spinacia oleracea) promuovendone la germinazione, la fotosintesi e in generale la crescita (Hong et al., 2005a,b; Zheng et al., 2005; Yang et al., 2006). NP di TiO2, a differenza del
biossido di titanio in forma grossolana,hanno manifestato effetti positivi sulla crescita delle piante dovuti all’aumento di attività di numerosi enzimi e al maggior assorbimento di nitrati, oltre ad una trasformazione più celere dell’azoto inorganico in azoto organico. Allo stesso modo, miscele di NP di SiO2 e TiO2 sono in grado di accelerare la germinazione e la crescita della soia (Glycine max L.)
(Lu et al., 2002). La presenza di NP di alluminio (Al) non ha mostrato effetti negativi sulla crescita di Phaseolus vulgaris e Lolium perenne nell'intervallo di concentrazione saggiato (Doshi et al., 2008). Questi ed altri effetti positivi delle NP sulle piante hanno promosso una serie di applicazioni dei NM nel settore dell'agricoltura come la somministrazione di prodotti chimici contenenti NP,
quali pesticidi e fertilizzanti(Qiang et al., 2008). Le nanotecnologie hanno trovato applicazioni anche nel campo della ricerca scientifica sui vegetali, per esempio in biochimica con lo studio di rivelatori in grado di determinare le interazioni di un substrato con un enzima e in biologia molecolare con l’introduzione di DNA esogeno in specifici tessuti vegetali attraverso carrier costituiti da NP. (Gonzalez-Melendi et al., 2008; Ladisch et al.,2005; Torney et al., 2007).
Oltre agli effetti positivi, in letteratura sono riportati anche casi di nanotossicità a carico delle piante. Yang and Watts (2005) hanno studiato l’effetto di NP di Allumina (Al2O3, dimensione
13 nm, con e senza rivestimento di fenantrene) sulla crescita delle radici in cinque specie di piante coltivate (cavoli, carote, mais, cetrioli e soia) e hanno scoperto che, dopo un trattamento con soluzione acquosa, si possono osservare sintomi di tossicità, ma solo a concentrazioni superiori ai
2000 mg/L; il rivestimento delle NP di Al2O3 con fenantrene ne riduce la tossicità.
Lin and Xing (2007) hanno analizzato la fitotossicità di cinque tipi di NP (nanotubi di carbonio a parete multipla, alluminio, allumina, zinco e ossido di zinco) sulla germinazione dei semi e la crescita delle radici in sei specie di piante superiori (ravanello, colza, loglio, lattuga, mais e cetriolo). La germinazione non è stata influenzata eccetto che nel caso delle NP di zinco sul Lolium
multiflorum e delle NP di ossido di zinco su Zea mays che, a concentrazioni di 2000 mg/L, hanno
mostrato azione inibitoria. Per quanto riguarda la crescita delle radici la risposta è stata molto disomogenea, variando notevolmente a seconda delle NP utilizzate e delle piante testate. È comunque interessante notare che sospensioni di 2000 mg/L di NP di Zn e ZnO hanno praticamente bloccato l’allungamento delle radici in tutte le piante testate. Successivamente casi di fitotossicità, da parte di NP di ZnO disponibili in commercio, sono stati segnalati da Lin and Xing (2008): la tossicità delle NP di ZnO da una parte e degli ioni di Zn2+ dall’altra è risultata evidente nei confronti di plantule di Lolium dimostrando di aumentare in proporzione alla concentrazione e dando maggiori sintomatologie a concentrazioni superiori a 50 mg/L. Stampoulis et al., (2009) hanno studiato l’effetto negativo di nanotubi di carbonio a parete multipla, NP di Ag, Cu, ZnO e silicio sulla germinazione dei semi, sull’allungamento della radice e sulla produzione di biomassa in
Cucurbita pepo, mettendo a confronto piante trattate in idroponica con NP e piante trattate con
materiale grossolano della stessa specie chimica. È risultato che la fitototossicità, oltre ad essere intrinseca nella specie chimica, è in buona parte dovuta alla dimensione nanometrica delle particelle. Lee et al. (2010) hanno investigato gli effetti di quattro diverse NP di ossidi di metallo (ossido di alluminio, diossido di silicio, magnetite e ossido di zinco) sullo sviluppo di
semi, l'allungamento della radice e il numero di foglie) che hanno misurato dopo i trattamenti a tre concentrazioni: 400, 2000 e 4000 mg/L. Tra le NP saggiate l’ossido di zinco è risultato il più tossico, seguito dalla magnetite e dal diossido di silicio, mentre l’ossido di alluminio non ha mostrato fenomeni di fitotossicità.
Ciò che rimane poco chiaro da questi studi, tuttavia, è un insieme di aspetti fondamentali come l’assorbimento, l’accumulo e la traslocazione delle NP nelle cellule vegetali e nei tessuti, e l'impatto di questi processi sulla genetica e sulla riproduzione delle piante (Navarro et al., 2008). Alcuni studi riportano risultati sull’assorbimento di NP da parte delle radici delle piante. Per esempio Lin e Xing (2008) hanno osservato al microscopio la presenza di singole NP di ZnO nell’apoplasto e nei protoplasti dell’endodermide e della stele radicale in seguito a esperimenti effettuati su Lolium; un'altra ricerca che riporta risultati in tal senso è quella di Yang et al. (2006), che dimostra anche la capacità delle NP di trasferirsi dalle radici al germoglio. Più recentemente Lin et al. (2009) hanno studiato l'assorbimento, il trasporto e la biodistribuzione di NP ingegnerizzate a base di carbonio in piante di riso.
Battke et al. (2008) hanno analizzato l’assorbimento del Palladio (Pd) da parte di Hordeum
vulgare e il comportamento delle NP di Pd nelle soluzioni nutritive utilizzate per coltivare le piante.
Gli autori hanno utilizzato particelle di Pd di diverse dimensioni per comparare i risultati e hanno osservato che l'assorbimento di tale elemento chimico, attraverso le radici, dipende dal suo diametro particellare. Inoltre le particelle più piccole, presenti a basse concentrazioni nella soluzione nutritiva, hanno indotto sintomi da stress nelle foglie. Zhu et al. (2008) hanno dimostrato che piante di Cucurbita maxima cresciute in un mezzo acquoso contenente NP di magnetite (Fe3O4) sono in grado di assorbire, trasportare ed accumulare le particelle nei tessuti
vegetali; al contrario Phaseolus limensis non è in grado di assorbire e traslocare le particelle.
Harris and Bali (2008) hanno analizzato l’assorbimento e la distribuzione di NP d'argento in
Brassica juncea e in Medicago sativa. A differenza di Brassica juncea, l’erba medica ha mostrato un
aumento di captazione dell’argento con un corrispondente aumento di concentrazione del substrato metallico e del tempo di esposizione. Le NP d'argento si accumulavano nei nuclei cellulari e gli autori hanno ipotizzato che entrambe le specie fossero iperaccumulatori d'argento. La capacità di alcune specie vegetali di iperaccumulare NP senza apparenti danni fisiologici, almeno in particolari condizioni sperimentali, può rappresentare un problema in quanto
rappresenta una potenziale via di trasporto di NP nell'ambiente, ma anche una valida alternativa nel campo della bonifica di aree contaminate. Oltre ai generi Medicago e Brassica, è giusto ricordare anche Cucurbita maxima e la sua capacità di assorbire una quota significativa di NP di magnetite disperse nella soluzione nutritiva e di accumularle all’interno di radici e foglie (Zhu et
al., 2008). Questi risultati suggeriscono che piante differenti presentano risposte differenti a
trattamenti con le stesse NP.
Un altro aspetto non ancora affrontato in letteratura è lo studio di risposte a livello molecolare in piante trattate con NP. Ad oggi sono rari gli studi che riportano analisi molecolari in tal senso, uno di questi, condotto da Burklew et al. (2012), ha riguardato piante di tabacco sottoposte a trattamenti con diverse concentrazioni di NP di Al2O3. Oltre ad effetti negativi sulla
crescita, gli autori hanno valutato l’espressione di 12 differenti microRNA coinvolti in risposte a stress abiotici, osservando che ben 9 di essi presentavano livelli di sovraespressione statisticamente significativi in piante trattate con NP rispetto ai controlli.
Concludendo, le piante possono incorporare NP e l'efficienza di assorbimento e traslocazione sembra dipendere da più fattori: dipende dalla specie a cui appartiene la pianta, dalla modalità di somministrazione, dalle dosi e dalle caratteristiche delle NP (composizione chimica, le dimensioni e le proprietà di superficie). Inoltre, l'esposizione a NP può alterare i processi fisiologici delle piante, sia con effetti positivi che negativi, e può influenzare la crescita e lo sviluppo mostrando, in alcuni casi, evidenti sintomi di tossicità. Per una maggiore comprensione dell’impatto delle NP sull’ecosistema e delle risposte molecolari di piante esposte a trattamenti con NP sono perciò necessari ulteriori studi.
2.1.5 Utilizzo, caratteristiche e comportamento delle Nanoparticelle di Biossido di
Titanio (TiO
2)
Come materiale bulk il biossido di titanio (TiO2) è utilizzato principalmente come pigmento
bianco a causa della sua luminosità, di un indice di rifrazione molto elevato e di un’elevata resistenza alla decolorazione. La stima della produzione globale di TiO2 parla di milioni di
tonnellate l'anno. Quasi il 70% del biossido di titanio prodotto è usato come pigmento per vernici, ma trova utilizzo anche in vetreria, smalti, materie plastiche, carta, fibre, alimenti, prodotti farmaceutici, cosmetici e nei dentifrici. Il TiO2 è anche un comune additivo (E171) in diversi
alimenti, quelli che ne contengono in maggiore quantità sono i chewing gums, le caramelle e altri dolciumi. Altri utilizzi riguardano l’azione antimicrobica, applicazioni mediche, la capacità di accumulo di energia e l’impiego di tale materiale in catalizzatori per la purificazione di aria e acqua (Weir et al., 2012). Recentemente, l’attenzione si è focalizzata sull'utilizzo del TiO2 sottoforma di
NP. Nel 2005, la produzione globale di TiO2 su scala nanometrica è stata stimata in 2000 t per un
valore di 70 milioni di dollari; di cui 1300 t sono state utilizzate in prodotti per la cura personale, come creme solari e cosmetici (Weir et al., 2012). L'utilizzo di NP di TiO2 e ZnO in alcune creme
solari è dovuto alla loro capacità di assorbire e riflettere i raggi ultravioletti (UV) e alla proprietà, molto apprezzata dai consumatori, di risultare trasparenti alla luce visibile (a differenza del TiO2
bulk). Sul loro utilizzo è in corso un acceso dibattito in quanto non è ancora stata chiarita la loro capacità o meno di penetrare nella pelle, generando in seguito radicali liberi dannosi alla salute (The Royal Society & The Royal Academy of Engineering, 2004). Le NP di TiO2 oltre ad essere
ampiamente utilizzate in prodotti cosmetici e della pelle, vengono impiegate nei dentifrici, in prodotti antibatterici, in prodotti per la pulizia e nella decomposizione di materia organica in acque reflue, grazie alle loro caratteristiche di elevata stabilità, proprietà anticorrosive e attività fotocatalizzatrici (Robichaud et al., 2009). A causa della crescente domanda e al sempre maggiore volume di produzione, si prevede che l'esposizione ambientale da NP di TiO2 risulterà superiore
rispetto all'esposizione ad altri NM di uso comune come Np di ZnO e di Ag, fullereni e nanotubi di carbonio (Gottschalk et al.,2009). Si pensi che nel 2010, la produzione si è attestata sulle 5000 t e si prevede che continuerà ad aumentare almeno fino al 2025 (Weir et al., 2012).
È quindi normale che l’attenzione dei ricercatori si vada a focalizzare sempre più anche sull’ecotossicità delle NP di TiO2. Il TiO2 nel passato è stato generalmente considerato
azione tossica. Diversi studi, per esempio, hanno dimostrato la comparsa di tumori nei polmoni di ratti esposti cronicamente all’inalazione di alte concentrazioni di particolato ultrafine di TiO2,
mentre le stesse condizioni sperimentali non hanno riportato conseguenze in topi e criceti (Bermudez et al., 2004); ciò secondo Hext et al. (2005) può essere dovuto ad un’ipersensibilità da parte dei ratti verso tali particelle, tuttavia un’azione diversificata in base alla specie saggiata nulla dice sui potenziali effetti arrecati alla salute umana. Gli stessi autori per meglio valutare l’effetto del particolato ultrafine di TiO2 sull’uomo hanno esaminato degli studi epidemiologici e hanno
concluso che non vi sembra essere un chiaro legame tra l'esposizione professionale a tali particelle e il rischio di cancro ai polmoni. In uno studio molto più recente (Wu et al., 2009) è invece risultato che NP di TiO2 possono costituire un rischio per la salute umana a seguito di esposizioni cutanee
protratte per un periodo relativamente lungo. In questo studio è stata infatti valutata la tossicità e la penetrazione di NP di TiO2 in topi glabri e in suini in seguito ad esposizioni cutanee sub-croniche
protratte per 30/60 giorni; dopo tale periodo è stato osservato che le NP testate sono in grado di penetrare attraverso la pelle, raggiungendo diversi tessuti ed inducendo lesioni patologiche in diversi organi principali. È stato inoltre dimostrato che le lesioni sono principalmente dovute allo stress ossidativo indotto dalle NP incorporate e che se applicate sullo stesso tratto di pelle per un tempo prolungato le NP di biossido di titanio possono indurre un invecchiamento cutaneo.
In letteratura esistono anche alcuni studi sull’effetto di questo tipo di NP sulle piante. Il biossido di titanio si è dimostrato tossico in varie ricerche, per esempio Asli and Neumann (2009) hanno dimostrato che sospensioni colloidali di NP di TiO2 causano un effetto negativo sulla crescita
delle foglie, sulla traspirazione e sulla conducibilità idraulica delle radici di plantule di mais; Wang
et al. (2011) hanno scoperto che NP di TiO2 sono in grado di compromettere l’architettura del
citoscheletro di cellule epidermiche causando la riorganizzazione e degradazione dei microtuboli in
Arabidopsis thaliana.
In altri casi invece le NP di TiO2, a certe concentrazioni, hanno avuto un effetto positivo sulla germinazione di semi di spinacio e sulla crescita di germogli (Zheng et al., 2005). Lu et al. (2002) hanno dimostrato che una combinazione di NP di SiO2 e di TiO2 può aumentare l’attività
della nitrato reduttasi in soia (Glycine max), migliorando inoltre la sua capacità di assorbimento ed utilizzazione di acqua e fertilizzanti, promuovendo il suo sistema antiossidante e, di fatto, accelerando la sua germinazione e la sua crescita. La presenza di NP di TiO2 sembra poter ridurre
et al. (2012) hanno dimostrato che il biossido di titanio su dimensioni nanometriche
promuoverebbe la germinazione e la crescita di plantule di frumento a dispetto del TiO2 in forma
bulk.
2.1.6 Utilizzo, caratteristiche e comportamento delle Nanoparticelle di Magnetite
(Fe
3O
4)
Le NP di magnetite (Ossido di ferro, Fe3O4) possono essere preparate con facilità per
riduzione chimica di Sali di ferro e sono molto studiate per le particolari proprietà magnetiche, che le rendono estremamente interessanti in diversi campi tecnologici, specialmente in bio-medicina (Yi et al., 2006). La proprietà più apprezzata è che possono essere “spostate” con campi magnetici esterni rendendo possibile sia il loro recupero (ad esempio per isolare determinati composti da matrici complesse a scopo diagnostico) che il loro direzionamento (per concentrare le particelle nel tessuto biologico di interesse). Trovano quindi impiego come agenti di contrasto per la risonanza magnetica nucleare, nella riparazione dei tessuti, in immunosaggi, nella rimozione di tossine da fluidi biologici, nella separazione cellulare e come guida magnetica nella somministrazione controllata di farmaci in cure antitumorali (Lin et al., 2007). Questo tipo di particelle, oggetto di grande attenzione, trova inoltre impiego per il trattamento terapeutico attraverso una tecnica particolare, quella dell’ipertermia4; anche in questo caso le proprietà magnetiche vengono sfruttate e il tessuto biologico contenente le particelle viene esposto ad un campo magnetico oscillante provocando il riscaldamento e quindi la morte delle cellule da eliminare. Un’applicazione delle NP di Fe3O4 al di fuori del campo bio-medico le vede impiegate
con risultati soddisfacenti nella pulizia delle acque contaminate da arsenico (Yavuz et al., 2006). NP di ossido di ferro sono inoltre presenti in prodotti da consumo, le troviamo infatti in alcuni cosmetici, per esempio all'interno di qualche rossetto, dove svolgono la funzione di pigmento (The Royal Society & The Royal Academy of Engineering, 2004). La magnetite in forma nanoparticellare potrebbe in futuro interessare anche il settore agricolo; recentemente Corredor et al., (2010), con l’obiettivo finale di sviluppare nanodispositivi per il rilascio controllato di fitofarmaci o di altre sostanze in piante a scopo agronomico, hanno testato diversi tipi di applicazioni di NP di magnetite su tessuti di zucca, per valutare il loro trasporto intra ed inter-cellulare e se la presenza di un'elevata concentrazione di NP nelle cellule vegetali alterava la loro organizzazione subcellulare.
In letteratura ad oggi non sono ancora stati riportati evidenti casi di tossicità da parte di NP di magnetite a spese del regno animale, ma ulteriori studi si rendono necessari considerando che si tratta di materiale dalle proprietà uniche di cui non conosciamo il destino all’interno dell’ecosistema. Alcuni studi condotti su piante hanno riportato casi di fitotossicità da parte delle NP di Fe3O4. Sono stati osservati, per esempio, sintomi di tossicità nei confronti dell'allungamento
di radici di Arabidopsis thaliana in seguito a trattamenti con NP di magnetite (Lee et al.,2010), che però non hanno influenzato negativamente la percentuale di germinazione dei semi e il numero di foglie. Wang et al. (2011) hanno condotto uno studio che si è concentrato sul rilevamento di alcuni effetti fisiologici arreccati da NP di magnetite su loglio perenne (Lolium perenne L.) e zucca (Cucurbita mixta cv. white cushaw) allevati in condizioni idroponiche, osservando che trattamenti con NP di Fe3O4 inducevano spesso stress ossidativi più elevati rispetto a trattamenti con particelle
più grossolane di Fe3O4; ciò è stato dimostrato da un significativo aumento dell'attività enzimatica
della superossido dismutasi e della catalasi oltre ad un incremento di fenomeni di perossidazione lipidica sia nelle radici che nei germogli di loglio e zucca. Un altro studio recente (Mushtaq, 2011) ha dimostrato che semi di cetriolo (Cucumis sativus), in fase di germinazione, trattati con NP di magnetite subiscono uno stress, indicato sia da un minore indice di germinazione che dalla ridotta crescita radicale.
2.2 Elementi trasponibili: caratteristiche e classificazione
Gli elementi trasponibili (TEs) costituiscono un raggruppamento fortemente eterogeneo di sequenze del DNA in grado di muoversi da un locus all’altro del genoma (trasposizione) e di amplificare il loro numero di copie all’interno dell’ospite. Sono state scoperte e caratterizzate originariamente in mais da Barbara McClintock ed in seguito sono state trovate in tutti gli organismi.
Gli elementi trasponibili vengono classificati in base al meccanismo di trasposizione in due gruppi:
• Elementi trasponibili di classe I, ovvero i retrotrasposoni (REs)
• Elementi trasponibili di classe II, indicati anche come trasposoni a DNA
I retrotrasposoni sono elementi che traspongono attraverso un meccanismo basato su un intermedio a RNA e presentano un ciclo vitale simile a quello di un retrovirus (Boeke e coerces, 1989; Doolittle et al., 1989). I retrotrasposoni codificano le proteine coinvolte nel loro meccanismo replicativo di trasposizione: gli RNA, trascritti a partire dall’elemento stesso, vengono retrotrascritti in copie di dsDNA che si vanno a integrare in una nuova posizione all’interno del Genoma ospite. Quindi quando questi elementi trasponibili si spostano in una nuova posizione del genoma ne rimane sempre una copia nella posizione originaria, si ha in pratica un meccanismo di tipo “copia ed incolla”. Tale meccanismo permette ai retrotrasposoni di incrementare notevolmente e rapidamente il loro numero di copie all'interno del genoma, contribuendo, conseguentemente, anche all’aumento della sua grandezza. Per la modalità replicativa con cui traspongono, i retrotrasposoni, sono particolarmente abbondanti negli eucarioti ed in particolare nelle piante, dove rappresentano la maggior parte degli elementi trasponibili.
Gli elementi di classe I si possono suddividere in due gruppi in base alla presenza di lunghe sequenze riprtute, dette LTR (Long Terminal Repeat), che fiancheggiano le sequenze codificanti: i retrotrasposoni con LTR ed i retrotrasposoni senza LTR. Fra i retrotrasposoni con LTR troviamo due superfamiglie: Ty1-Copia e Ty3-Gypsy; le sequenze LINEs (Long Interspersed Nuclear Elements) e SINEs (Short Interspersed Nuclear Elements) fanno invece parte dei retrotrasposoni senza LTR.
Gli elementi di classe II sono elementi che traspongono attraverso un meccanismo di escissione/reintegrazione, una specie di “taglia ed incolla”. Tale meccanismo non consente ai trasposoni a DNA di aumentare la propria consistenza numerica ed è per questo che sono meno rappresentati nel genoma rispetto ai retrotrasposoni.
La scoperta degli elementi trasponibili è legata alla loro mutagenicità ed oggi è ormai appurato che attraverso i loro meccanismi di trasposizione si possono determinare mutazioni ereditarie, riarrangiamenti genomici e variazioni epigenetiche. Per limitare queste alterazioni le piante hanno attivato dei meccanismi volti al controllo trascrizionale e post-trascrizionale di tali sequenze (Lisch, 2009). Per quanto riguarda l’attività di TEs, essa è stata documentata sia per gli elementi di classe I (Hirochika et al., 1996) che di classe II (Jiang et al., 2003; Peschke et al., 1991). Recentemente, è stata riportata l'attività di retrotrasposizione di un elemento Copia di girasole di cui è stata dimostrata l’espressione del RNA intermedio, la sua retrotrascrizione ed il successivo inserimento nel genoma (Vukich et al., 2009).
L’attività di questi elementi è in molti casi indotta anche da condizioni di stress dovute a freddo, infezioni virali, incroci interspecifici, veleni, ferite, colture di tessuti, ecc.(Hashida et al., 2003, Ungerer et al., 2006). Esempi noti sono dati da studi condotti in Solanaceae che hanno correlato l'attività di trasposizione di specifici retrotrasposoni ad una reazione indotta da stress biotici ed abiotici. Tnt1 e Tto1 in Nicotiana e Tos17 nel riso, hanno avviato processi di trascrizione e trasposizione in seguito al verificarsi di uno stress indotto in laboratorio da coltura tissutale in
vitro (Hirochika, 1993; Hirochika et al., 1996; Grandbastien, 1998), inoltre Tnt1 di tabacco risulta
attivato da differenti stress biotici e abiotici anche in Arabidopsis e pomodoro (Grandbastien et al., 1997, 2005) e Tto1 si attiva in seguito a stress da ferita ed elicitori fungini (Takeda et al., 1999). Quindi le condizioni ambientali risultano importanti per modulare l’attività di elementi trasponibili. Un esempio di come l’attività di retrotrasposoni possa, attraverso alterazioni del genoma, contribuire all’adattamento delle piante a differenti condizioni ambientali, è offerto dagli elementi BARE1 nell’orzo selvatico (Kalendar et al., 2000). In questo studio sono state campionate piante di Hordeum spontaneum in siti differenti di un Canyon sul Mount Carmel, Israele. Da analisi del genoma di tali piante è stata trovata una correlazione tra variazioni di numero di copie e polimorfismi di inserzione di BARE1 con le differenti condizioni ambientali dei siti di campionamento.
2.3 Scopo della tesi
Questo lavoro di Tesi si inserisce all’interno del progetto INESE (Impact of Nanoparticles in Enivornmental Sustainability and Ecotoxicity, ovvero impatto delle NP sulla sostenibilità ambientale e sull’ecotossicità), un progetto interdisciplinare italiano, promosso dall’Istituto Italiano di Tecnologia (IIT), in cui sono coinvolti 6 partner nazionali, fra cui anche il Dipartimento di Biologia delle Piante Agrarie dell’Università di Pisa. Gli obbiettivi del progetto INESE si possono suddividere in tre differenti categorie: Scentifici, tecnologici e sociali.
Fra gli obbiettivi scientifici il progetto si propone di: classificare e studiare i prodotti nanotecnologici presenti nel mercato italiano determinandone il grado di sicurezza, proporre modelli sulle possibili vie di dispersione delle NP nell’ambiente, simulare ecosistemi inquinati da NP all’interno di serre sperimentali per effettuare ricerche con diversi organismi viventi in ambienti acquatici e terricoli, fornire protocolli sperimentali per valutare il grado di tossicità delle diverse NP.
Per quanto riguarda gli obbiettivi politico-sociali il progetto INESE si propone di: rendere più sensibile la società e più partecipi le comunità a queste nuove tematiche informando dei possibili rischi per la salute umana e l’ambiente, fornendo report con suggerimenti e raccomandazioni sulle misure di prevenzione da adottare, per migliorare la sicurezza sul lavoro e la sicurezza pubblica fornendo linee guida per una futura regolamentazione in materia di produzione, manipolazione ed etichettatura dei prodotti nanotecnologici..
Fino ad oggi pochi studi sono stati condotti in riferimento agli effetti delle NP sulle maggiori colture agricole, e nessuno sul pomodoro, che è una delle piante coltivate più importanti al mondo. In questo lavoro abbiamo deciso di valutare gli effetti di trattamenti con diverse concentrazioni di NP di TiO2 e di Fe3O4 sulla crescita di piantine di pomodoro. Abbiamo utilizzato
un sistema di coltivazione in condizioni idroponiche impiegando piante di pomodoro della cv Micro-Tom, una cultivar di pomodoro nano, ampiamente utilizzata in studi di fisiologia vegetale sia per le ridotte dimensioni che per il ridotto tempo di generazione (Meissner et al., 1997). In particolare abbiamo concentrato la nostra attenzione sulle possibili alterazioni morfologiche causate da NP, nonché sull’assorbimento radicale e sull'eventuale traslocazione verso le parti aeree della pianta di NP di Fe3O4 e di TiO2. Infine, per meglio analizzare la risposta di piante di
tipo trascrittomico attraverso il sequenziamento del RNA isolato da radici di piante di pomodoro allevate nelle diverse condizioni sperimentali; tale approccio consente uno studio approfondito di espressione genica globale, fornendo una panoramica di tipo qualitativo e quantitativo di tutti i geni espressi nei tessuti analizzati.
In letteratura, come menzionato nell’introduzione, è stato riscontrato che particolari condizioni ambientali, o condizioni colturali stressanti possono provocare l’alterazione dell’espressione di elementi trasponibili (TEs) in tessuti vegetali. Alcuni elementi trasponibili, se espressi a livello di RNA (trascritti), possono essere retrotrascritti e trasporsi da un locus all’altro del genoma ospite causando possibili riarrangiamenti all’interno del genoma. In questo senso abbiamo voluto valutare se le particolari condizioni di coltura dettate da trattamenti con NP potessero alterare l'espressione di TEs e quindi potessero potenzialmente provocare alterazioni a livello del genoma.
Infine per cercare di fare luce, a livello molecolare, sulla risposta di piante di pomodoro a trattamenti con NP, abbiamo iniziato a valutare l’espressione genica di alcuni geni chiave coinvolti in differenti processi di sviluppo e di crescita delle radici.
3
3.1 Materiale utilizzato e trattamenti
Nei nostri esperimenti abbiamo utilizzato piante di pomodoro ( della cv Micro-Tom (Meissner et al
fatti germinare su batuffoli di cotone bagnato, inseriti in eppendorf da 0,5 ml da
asportato il fondo in modo da consentire, dopo la germinazione, il passaggio delle radici. Le eppendorf sono state inserite in supporti di polistirolo forato galleggianti al disopra della soluzione nutritiva. Ogni supporto di polistirolo prese
altrettanti semi, ed è stato inserito all’interno di una vaschetta di plastica contenente la soluzione nutritiva (Figura 5). Le vaschette sono state trasferite in cella climatizzata alla temperatura di 25°C e un fotoperiodo di 16 ore giorno/8 ore notte. La soluzione nutritiva utilizzata è una diluizione 1:3 di un mezzo costituito da: Ca 4.0 mM; K 7.0 mM; Mg 0.75 mM; N: NO
S: SO4 2.41 µM; Fe 17.8 µM; Zn 5.0
Figura 5 – Coltura idroponica di piantine di pomodoro cv Micro
Dopo 10 giorni dalla germinazione alcune plantule sono state eliminate o spostate in modo da ottenere vaschette con 20 plantule di grandezza uniforme per iniziare i trattamenti.
3. MATERIALI E METODI
3.1 Materiale utilizzato e trattamenti
esperimenti abbiamo utilizzato piante di pomodoro (Lycopersicum esculentum
et al., 1997) coltivate in condizioni idroponiche. I semi sono stati
fatti germinare su batuffoli di cotone bagnato, inseriti in eppendorf da 0,5 ml da
asportato il fondo in modo da consentire, dopo la germinazione, il passaggio delle radici. Le eppendorf sono state inserite in supporti di polistirolo forato galleggianti al disopra della soluzione nutritiva. Ogni supporto di polistirolo presentava 20 fori per alloggiare 20 eppendorf con altrettanti semi, ed è stato inserito all’interno di una vaschetta di plastica contenente la soluzione nutritiva (Figura 5). Le vaschette sono state trasferite in cella climatizzata alla temperatura di 25°C n fotoperiodo di 16 ore giorno/8 ore notte. La soluzione nutritiva utilizzata è una diluizione 1:3 di un mezzo costituito da: Ca 4.0 mM; K 7.0 mM; Mg 0.75 mM; N: NO3 11.0 mM; P: H
M; Zn 5.0 µM; Mn 10.0 µM, Cu 2.7 µM.
Coltura idroponica di piantine di pomodoro cv Micro-Tom
Dopo 10 giorni dalla germinazione alcune plantule sono state eliminate o spostate in modo da ottenere vaschette con 20 plantule di grandezza uniforme per iniziare i trattamenti.
Lycopersicum esculentum)
1997) coltivate in condizioni idroponiche. I semi sono stati fatti germinare su batuffoli di cotone bagnato, inseriti in eppendorf da 0,5 ml da cui è stato asportato il fondo in modo da consentire, dopo la germinazione, il passaggio delle radici. Le eppendorf sono state inserite in supporti di polistirolo forato galleggianti al disopra della soluzione ntava 20 fori per alloggiare 20 eppendorf con altrettanti semi, ed è stato inserito all’interno di una vaschetta di plastica contenente la soluzione nutritiva (Figura 5). Le vaschette sono state trasferite in cella climatizzata alla temperatura di 25°C n fotoperiodo di 16 ore giorno/8 ore notte. La soluzione nutritiva utilizzata è una diluizione 1:3 11.0 mM; P: H2PO4 1.2 mM;
Tom
Dopo 10 giorni dalla germinazione alcune plantule sono state eliminate o spostate in modo da ottenere vaschette con 20 plantule di grandezza uniforme per iniziare i trattamenti.
Ogni trattamento è stato condotto su due vaschette (repliche biologiche). Le plantule sono state trasferite in contenitori nuovi contenenti soluzioni nutritive arricchite con NP e sono state lasciate crescere per una settimana in cella climatica. Sono state uti
(15-20 nm, Nanoamor) o di TiO2
soluzione nutritiva, la sospensione ottenuta è stata incubata per 1 ora all’interno di un bagno sonicatore LBS2 (Labo-Scientifica)
ottenere sospensioni di singole NP, si veda come esempio la Figura 6.
Figura 6 – Sospensione di singole NP di TiO
polvere di NP e soluzione nutritiva (sinistra), a confronto con soluzione nutritiva priva di NP (destra).
Le concentrazioni di NP nelle soluzioni nutritive sono state di 50 mg/L o di 500 mg/L. Nelle sospensioni arricchite con NP, nel corso della preparazione dell
si liberino in soluzione anche ioni derivanti dalle polveri aggiunte, per cui potrebbe essere difficile discriminare se un effetto riscontrato nelle piante trattate fosse dovuto alle NP in sospensione o agli ioni Fe2+ e Fe3+ o Ti+, liberati dalle polveri. Per risolvere questo problema nei trattamenti di controllo (senza NP sospese), anzichè utilizzare soltanto soluzioni nutritive, le plantule sono state cresciute in soluzioni preparate nel modo seguente: la soluzione n
con polveri di NP di Fe3O4 o di TiO
centrifugata (3000xg, 15°C, 20 minuti) e poi filtrata attraverso un filtro Anatop da 0,02
trattamento è stato condotto su due vaschette (repliche biologiche). Le plantule sono state trasferite in contenitori nuovi contenenti soluzioni nutritive arricchite con NP e sono state lasciate crescere per una settimana in cella climatica. Sono state utilizzate polveri di NP di Fe
(20-160 nm Nanoamor). Dopo avere aggiunto la polvere di NP alla soluzione nutritiva, la sospensione ottenuta è stata incubata per 1 ora all’interno di un bagno Scientifica) regolato a 40 KHz e 100 Watt per disgregare le polveri ed ottenere sospensioni di singole NP, si veda come esempio la Figura 6.
Sospensione di singole NP di TiO2,ottenuta dopo aver incubato per 1 h in bagno sonicatore
di NP e soluzione nutritiva (sinistra), a confronto con soluzione nutritiva priva di NP (destra).
Le concentrazioni di NP nelle soluzioni nutritive sono state di 50 mg/L o di 500 mg/L. Nelle sospensioni arricchite con NP, nel corso della preparazione della sospensione, c’è la possibilità che si liberino in soluzione anche ioni derivanti dalle polveri aggiunte, per cui potrebbe essere difficile discriminare se un effetto riscontrato nelle piante trattate fosse dovuto alle NP in sospensione o liberati dalle polveri. Per risolvere questo problema nei trattamenti di controllo (senza NP sospese), anzichè utilizzare soltanto soluzioni nutritive, le plantule sono state cresciute in soluzioni preparate nel modo seguente: la soluzione nutritiva è stata prima arricchita o di TiO2, quindi trattata con bagnetto sonicatore, successivamente
centrifugata (3000xg, 15°C, 20 minuti) e poi filtrata attraverso un filtro Anatop da 0,02
trattamento è stato condotto su due vaschette (repliche biologiche). Le plantule sono state trasferite in contenitori nuovi contenenti soluzioni nutritive arricchite con NP e sono state lizzate polveri di NP di Fe3O4
160 nm Nanoamor). Dopo avere aggiunto la polvere di NP alla soluzione nutritiva, la sospensione ottenuta è stata incubata per 1 ora all’interno di un bagno regolato a 40 KHz e 100 Watt per disgregare le polveri ed
ottenuta dopo aver incubato per 1 h in bagno sonicatore di NP e soluzione nutritiva (sinistra), a confronto con soluzione nutritiva priva di NP (destra).
Le concentrazioni di NP nelle soluzioni nutritive sono state di 50 mg/L o di 500 mg/L. Nelle a sospensione, c’è la possibilità che si liberino in soluzione anche ioni derivanti dalle polveri aggiunte, per cui potrebbe essere difficile discriminare se un effetto riscontrato nelle piante trattate fosse dovuto alle NP in sospensione o liberati dalle polveri. Per risolvere questo problema nei trattamenti di controllo (senza NP sospese), anzichè utilizzare soltanto soluzioni nutritive, le plantule sono state utritiva è stata prima arricchita , quindi trattata con bagnetto sonicatore, successivamente centrifugata (3000xg, 15°C, 20 minuti) e poi filtrata attraverso un filtro Anatop da 0,02 µm per
rimuovere tutte le NP sospese. In questo modo tra campioni di controllo e campioni trattati con NP, l’unica differenza è proprio la presenza di NP sospese.
Per concludere, le diverse condizioni di crescita5 a cui abbiamo sottoposto le piantine di pomodoro sono state le seguenti:
1. Due repliche ciascuna con una vaschetta di Controllo, con la sola soluzione nutritiva arricchita di polveri e successivamente trattata per rimuovere le NP;
2. Due repliche ciascuna con una vaschetta con NP di Fe3O4 concentrate 50 mg/L;
3. Due repliche ciascuna con una vaschetta con NP di Fe3O4 concentrate 500 mg/L;
4. Due repliche ciascuna con una vaschetta con NP di TiO2 concentrate 50 mg/L;
5. Due repliche ciascuna con una vaschetta con NP di TiO2 concentrate 500 mg/L.
3.2 Analisi di microscopia elettronica
Dopo 1 o 7 giorni dal trattamento, le piantine sono state osservate e apici radicali, ipocotili e prime vere foglie sono stati raccolti e fissati in formalina tamponata in PBS. Per le analisi molecolari una parte delle radici dei vari trattamenti è stata congelata in azoto liquido. I tessuti fissati in formalina sono stati inclusi in paraffina e sezionati; le sezioni con uno spessore di circa 20
µm sono state poste su vetrini e la paraffina è stata rimossa mediante lavaggio con xilene. L’assorbimento radicale e la deposizione delle NP sulle radici sono stati studiati utilizzando un microscopio elettronico a scansione ambientale (ESEM) FEI Quanta 200 ®, dotato di spettroscopia a dispersione di energia (EDS) per l'identificazione chimica delle NP.
3.3 Estrazione di RNA totale
Per le analisi molecolari sono state raccolte radici di piantine dopo 1 giorno e dopo 7 giorni dal trattamento. L’RNA totale è stato isolato da radici di 3-4 piante per ciascuna delle due repliche dell’esperimento, utilizzando il metodo descritto da Logemann et al., (1987) seguito da trattamenti con DNAsi I (Roche), secondo le istruzioni del produttore per rimuovere completamente la contaminazione da parte del DNA genomico.
Per minimizzare possibili contaminazioni da RNAsi è stata utilizzata vetreria tenuta “overnight” a 180°C e le soluzioni impiegate sono state trattate con DEPC (Dietilpirocarbammato), come descritto da Sambrook et al., (1989). Il mortaio è stato sterilizzato con etanolo e raffreddato, quindi vi sono state aggiunte le radici raccolte e l’azoto liquido ed il tutto è stato pestato fino ad ottenere una polvere fine. Dopo aver aggiunto 2 ml di tampone di estrazione per grammo di tessuto e, successivamente, 0,5 volumi di fenolo e 0,5 volumi di cloroformio-alcool isoamilico, il preparato è stato miscelato energicamente. Il materiale così ottenuto è stato centrifugato per 5 minuti a 8.000 rpm a 4 °C in centrifuga Kontron con rotore A8.24. E’ stato recuperato il sovranatante, al quale è stato addizionato un volume di fenolo-cloroformio-alcool isoamilico e centrifugato nuovamente, come sopra descritto. L’RNA recuperato nel sovranatante è stato precipitato in 0,2 volumi di acido acetico 1 M (DEPC) e 0,7 volumi di etanolo assoluto (preraffreddato a -20°C) e tenuto per 2 ore a -20°C o per 40 minuti a –80 °C. In seguito il campione è stato centrifugato a 9.000 rpm in centrifuga Kontron con rotore A8.24 per 30 minuti a 4°C. Il
pellet è stato poi sottoposto a due lavaggi con sodio acetato 3M, pH 5,2 e a due lavaggi con
etanolo DEPC al 70 % (-20 °C). Dopo i lavaggi, il pellet è stato asciugato all’aria e solubilizzato in un minimo volume di H2O DEPC (Logeman et al., 1987).
Soluzioni utilizzate:
Tutte le soluzioni sono libere da ribonucleasi perché trattate con Dietilpirocarbammato (DEPC) nella proporzione di 1 ml per litro di soluzione: si aggiunge DEPC, si agita energicamente, si lascia agire una notte e poi si sterilizza in autoclave.
Tampone di estrazione MES 20 mM
Na2EDTA 20 mM
Guanidina-idrocloruro 8 M
Β-Mercaptoetanolo 50 mM
Fenolo saturo Si scioglie a bagnomaria il fenolo (BDH) a
65°C e si satura con Tris-HCl 100 mM, pH 8.
Cloroformio/Alcool Isoamilico (24:1 v/v)
Cloroformio ed Alcool Isoamilico miscelati in rapporto 24:1, saturati con Tris-HCl 100 mM, pH 9,5.
Fenolo/Cloroformio (1:1 v/v)
Si aggiunge un volume di Fenolo saturato con Tris-HCl 100 mM pH 8 (DEPC) ad un volume di Cloroformio/Alcool Isoamilico (24/1), si agita bene, si lasciano formare le due fasi, si conserva a 4 °C al buio.
3.3.1 Purificazione dell’RNA
I campioni di RNA totale isolati dalle radici sono stati purificati da eventuali contaminazioni di DNA genomico mediante trattamento con DNAsi. Un’unità di enzima digerisce 1 µg di DNA in 20 minuti di incubazione a 37°C.
Miscela di reazione (per un volume finale di reazione di 50 µl):
• 25 µl RNA
• 2 µl RNAsi-Inibitore (40 U/µl, Promega)
• 2 µl DNAsi (10 U/µl, Roche)
• 5 µl Buffer 10X
• 16 µl H2O DEPC
Successivamente i prodotti della purificazione sono stati purificati con un volume di Fenolo/Cloroformio/Alcool isoamilico (25:24:1). Dopo aver agitato e centrifugato a 12.000 rpm per 15 minuti a 4°C, è stato recuperato il sovranatante, al quale è stato aggiunto 1/10 di volume di Ammonio Acetato (5 M, pH 5,2) e 2,5 volumi di etanolo assoluto (-20°C). Agitando si è favorita la precipitazione e si è lasciato incubare i campioni per 1 ora a -80°C. I campioni sono stati centrifugati a 12.000 rpm per 30 minuti a 4°C e al termine si è eliminato il sovranatante. Il pellet di RNA è stato lavato con etanolo al 70% in H2O DEPC e centrifugato a 12.000 rpm per 10 minuti a
4°C. Dopo aver eliminato il sovranatante, il pellet è stato solubilizzato in un volume minimo di H2O
DEPC. L’RNA purificato è stato quantificato mediante elettroforesi su gel di agarosio 1% in condizioni denaturanti usando un marker di quantificazione standard.
3.3.2 Elettroforesi di RNA totale su gel di agarosio in condizioni denaturanti
Il campione di RNA estratto è stato fatto correre su minigel di agarosio in condizioni denaturanti per poterlo quantizzare e per verificarne la qualità e l’eventuale grado di degradazione. A questo scopo il gel è stato preparato sciogliendo l’agarosio in H2O DEPC per
ottenere una percentuale finale di agarosio pari all’1 % massa/volume; successivamente sono stati aggiunti formaldeide e MOPS 10X, riscaldati a 65 °C, rispettivamente nelle quantità di 1/6 e 1/10 del volume finale del gel; la miscela è stata versata sul supporto e lasciata polimerizzare; il gel è
stato posto nel tampone di corsa (MOPS 1X) ed è stata effettuata una pre-corsa di 10 minuti a 60 mA. I campioni di RNA sono stati preparati aggiungendo 3 volumi di soluzione denaturante e denaturandoli a 65 °C per 15 minuti. I campioni così denaturati sono stati tenuti in ghiaccio per 2 minuti e poi è stato aggiunto il tampone di caricamento contenente Bromuro di Etidio. Caricati i campioni, è stata effettuata una corsa per circa 1 ora a 60 mA.
Soluzioni utilizzate:
Gel di agarosio (1 %) (70 ml) Agarosio 0,7 g
H2O DEPC 50,5 ml
Formaldeide 37 % 12,5 ml
MOPS 10X 7 ml
Soluzione denaturante (375 µµµµl) MOPS 10X 50 µl
Formaldeide 37 % 75 µl Formammide (Flucka) 250 µl
Tampone di caricamento Saccarosio 30 % (m/v)
Na2EDTA 1 mM (pH 8)
Blu di Bromofenolo Q.B. Bromuro di Etidio 0,5 mg/ml Sciogliere in H2O e filtrare.
MOPS 10X MOPS 0,2 M (pH 7)
Sodio-acetato 50 mM
Aggiustare il pH a 7 con NaOH 2 N
Na2EDTA 10 mM (pH 8)