1
UNIVERSITÀ DI PISA
Dipartimento di Farmacia
Corso di Laurea Specialistica in Chimica e
Tecnologia Farmaceutiche
Tesi di Laurea
:
PROPRIETÀ SALUTISTICHE DELL’OLIO D’OLIVA
E VALORIZZAZIONE DEI SUOI COMPONENTI
FENOLICI E POLIFENOLICI NUTRACEUTICI
Relatori: Prof. Marco Macchia
Prof.ssa Clementina Manera
Candidata:
Giulia Cappagli
Dott. Giuseppe Saccomanni
2
INDICE
1. Introduzione………3
1.1 Descrizione………4
1.2 Tipologie di olio di oliva………8
1.3 Composizione dell’olio d’oliva………..10
1.4 Fenoli e polifenoli dell’olio d’oliva……….…13
1.5 Principali fattori che influenzano la composizione
fenolica………..…19
1.6 Proprietà salutistiche………..21
1.6.1 Proprietà sensoriali dell’oleocantale………..21
1.6.2 L’oleocantale e l’infiammazione……….23
1.6.3 L’oleocantale e le malattie
neurodegenrative...24
1.6.4 L’oleocantale e la prevenzione dei
tumori………26
1.6.5 L’oleocantale e l’osteoartite……….28
2. Introduzione alla parte sperimentale……….30
3. Parte sperimentale……….47
3.1 Analisi HPLC………48
3.2 Sintesi……….49
3.3 Analisi
1HNMR………..60
3
4 1.1 DESCRIZIONE
L’olio d’ oliva è uno dei prodotti caratteristici della tradizione e della cultura dei paesi mediterranei e rappresenta uno degli alimenti più antichi il cui ottenimento deriva dalla spremitura del frutto della pianta Olea europaea L. originaria del medio Oriente.
5
A partire dal 5000 a.C. fino al 1400 a.C. la coltivazione di questa specie si è diffusa fino a Creta, alla Siria, alla Palestina e a Israele, per arrivare infine in tutti i paesi del Mediterraneo.
Figura 2. Diffusione della pianta Olea europaea L. nel bacino del Mediterraneo.
Le proprietà terapeutiche e salutistiche dell’olio d’oliva sono conosciute da millenni e furono già descritte da Dioscoride, Galeno e Ippocrate. Quest’ultimo consigliava il succo di olive fresche per curare le malattie mentali e impacchi di olive fresche per guarire le ulcere. Nel Medioevo e durante tutto il Rinascimento l’olio d’oliva è stato usato per curare le infezioni ginecologiche ed era ritenuto
6
utile nella cura delle cardiopatie, della febbre, dell’ipertensione, come antidiabetico e diuretico. Fino a tutto l’Ottocento l’olio d’oliva è stato usato per curare l’otite e come blando purgante, per cospargere le gengive colpite da piorrea, per le nevriti, per le distorsioni e fino a pochi anni fa, prima della disponibilità della vitamina D, veniva impiegato per massaggiare i bambini rachitici.
Attualmente esiste una ampia letteratura scientifica sulle proprietà terapeutiche dell’olio d’oliva, la quale mette in evidenza molteplici meccanismi d’azione a livello tissutale, cellulare e molecolare tant’è che è opinione comune che i benefici effetti della dieta Mediterranea siano dovuti in larga misura al connesso impiego di questo olio.1
Come conseguenza di ciò, negli ultimi trenta anni vi è stato un interesse crescente nell’uso dell’olio d’oliva, tanto che il suo impiego è passato dall’essere circoscritto prevalentemente ai paesi dell’area mediterranea alla diffusione anche in altre zone come l’Australia, l’Argentina, il Sud-Africa e il Cile.
Del resto diversi studi epidemiologici hanno confermato che le persone che seguono la “dieta mediterranea” vivono più a lungo rispetto ad altre popolazioni europee ed agli americani, grazie alla minore incidenza di malattie croniche e neurodegenerative. Sebbene gli stili di vita (come una maggiore attività fisica) possano giocare un ruolo fondamentale nella longevità della popolazione mediterranea, diversi studi sottolineano che l’olio d’oliva è il principale fattore responsabile dei benefici salutistici e nutrizionali della dieta mediterranea.2
7
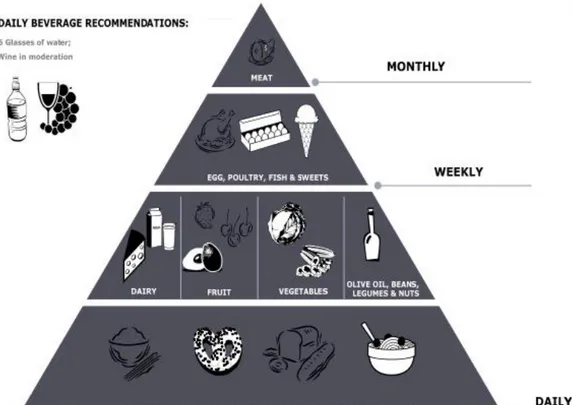
Figura 3. Piramide alimentare inquadrante i principali elementi della dieta mediterranea. Come illustrato, l’olio vergine d’oliva è un componente
integrale di questa dieta, essendo nel gruppo dei cibi quotidiani (da Cicerale S. et al., 2012).
La prima indagine sulle proprietà nutraceutiche dell’olio d’oliva fu condotta dal biologo e fisiologo statunitense Ancel Keys. Si tratta del “Seven Countries Study”,3 uno studio comparativo dei regimi alimentari in sette nazioni (Stati Uniti, Italia, Olanda, Grecia, Finlandia, Giappone ed Ex jugoslavia). Esso mise in luce che gli abitanti dell’isola di Creta possedevano il più basso indice di mortalità per malattie cardiovascolari e ciò venne messo in relazione con l’utilizzo dell’olio d’oliva nella cottura e nel condimento dei cibi a discapito di altri oli di origine vegetale e del burro. Da allora in poi i ricercatori di tutto il mondo hanno condotto numerosi studi per ampliare le loro conoscenze e per comprendere le eccezionali proprietà nutraceutiche dell’olio d’oliva.
8
1.2 TIPOLOGIE DI OLIO
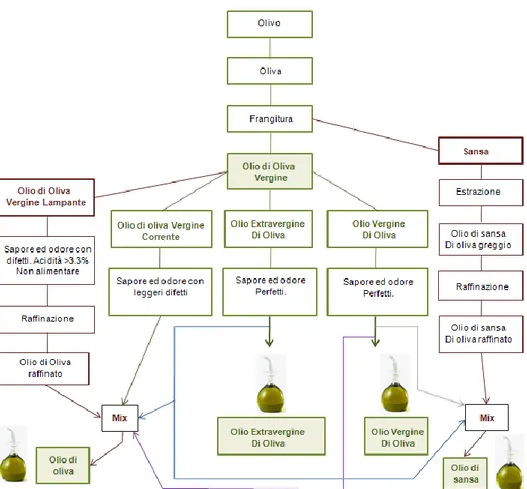
Esistono diverse tipologie di olio di oliva, che si distinguono prevalentemente in base alle tecniche di ottenimento dello stesso.
9
La tipologia vergine dell’olio di oliva si ricava dalla sola spremitura meccanica delle olive, mentre altre tipologie merceologiche di olio derivato dalle olive ma con caratteristiche dietetiche ed organolettiche differenti si ottengono per rettificazione degli oli vergini e per estrazione con solvente della sansa di olive. Le tipologie vergini sono quelle di maggiore rilevanza dal punto di vista nutraceutico, poiché vengono prodotte in modo tale da mantenere immutato il loro contenuto lipidico e soprattutto il contenuto di componenti minori, in particolare di antiossidanti. All’interno della tipologia vergine si distinguono l’olio vergine e l’olio extravergine di oliva che differiscono per il valore di acidità libera espressa come percentuale di acido oleico: l’olio extravergine di oliva, più pregiato, ha un’acidità libera inferiore allo 0,8%, mentre per l’olio vergine di oliva deve essere inferiore al 2%.
Con il fine di preservare le proprietà organolettiche e la qualità merceologica dell’olio extravergine di oliva e dato il crescente interesse che esso ha suscitato, negli ultimi anni è stato varato un decreto comunitario (Reg. CE 1513/01) che ne definisce le principali caratteristiche.
10
1.3 COMPOSIZIONE DELL’OLIO D’OLIVA
L’olio di oliva è per la quasi totalità (circa il 99%) costituito da una componente apolare o saponificabile, rappresentata da una miscela di gliceridi (esteri del glicerolo con acidi grassi), e da una frazione polare costituita da tocoferoli, steroli, polifenoli, carotenoidi, clorofilla e alcoli.
La composizione in acidi grassi dell’olio di oliva è costituita prevalentemente dall’acido oleico (oltre il 70%), monoinsaturo, e da altri acidi grassi saturi come il palmitico (5.7-18.6%) e lo stearico (0.5-4%). La frazione acidica è completata dall’acido linolenico (0,1- 0,6%) e linoleico (3,5-20,0%), che appartengono rispettivamente alla categoria degli omega-3 e degli omega-6. Sono infatti acidi grassi polinsaturi chiamati anche “acidi grassi essenziali” (AGE) perché indispensabili per l’accrescimento e la funzionalità dei tessuti dell’uomo che non è in grado di sintetizzarli.
L’alto contenuto dell’acido oleico presente nell’olio d’oliva è la principale caratteristica che lo differenzia dagli altri grassi di origine vegetale. Inoltre sembra essere rilevante per contrastare l’insorgenza dell’ischemia cardiovascolare, infatti studi recenti hanno evidenziato che un basso livello di acido oleico nelle piastrine causa questa patologia.
La frazione insaponificabile (1-2%) è costituita da un numeroso gruppo di componenti minori (circa 220 sostanze) che si dividono in tocoferoli, steroli, fenoli e polifenoli, alcoli, clorofilla e carotenoidi. Essa svolge un ruolo molto importante sia dal punto di vista nutrizionale sia dal punto di vista organolettico, oltre che rappresentare un prezioso riferimento analitico per il controllo della genuinità del prodotto.
Gli steroli svolgono un ruolo importante per accertare l’autenticità dell’olio d’oliva in quanto la composizione sterolica è tipica e non confondibile con quella di altri oli. Lo squalene è il composto maggiormente presente all’interno di
11
questa classe: esso possiede attività antiossidanti in quanto scavenger di radicali liberi e di specie reattive all’ossigeno; recenti studi hanno inoltre evidenziato un’attività chemiopreventiva per alcune forme di cancro della pelle.
Altri steroli presenti sono il colesterolo (in tracce), campesterolo, stigmasterolo, clerosterolo ed il beta-sisterolo, che non deve essere inferiore al 93% del totale. Al beta-sisterolo vengono attribuite importanti azioni come quella chemioprotettiva attraverso un aumento dell’apoptosi, la protezione nei riguardi delle malattie cardiovascolari mediante un ridotto assorbimento di colesterolo nell’intestino ed infine un’azione stimolante sul sistema immunitario.
I tocoferoli sono sostanze antiossidanti e sono costituiti principalmente dall’alfa-tocoferolo (vitamina E). Essendo facilmente ossidabili, catturano i radicali liberi che si formano durante l’esposizione all’aria dei composti insaturi ed impediscono il processo di irrancidimento ossidativo (con conseguente formazione di acidi grassi a catena corta), esplicando così la loro azione antiossidante sia nei cibi che nel tessuto cellulare.
Gli alcoli rivestono importanza per individuare le metodiche di estrazione dell’olio (pressatura meccanica oppure utilizzo di solventi).
Il gruppo più importante nell’ambito di questi composti minori è sicuramente quello dei polifenoli in quanto conferisce all’olio stabilità, qualità nutrizionali e salutistiche oltre che peculiarità sensoriali. Molti sono i fattori che influenzano la composizione di questo gruppo (circa 36 composti): varietà, ambiente di coltivazione, stadio di maturazione del frutto, processo di estrazione e conservazione del prodotto finale.
Infatti la stabilità di queste molecole e quindi la loro biodisponibilità è molto legata alla temperatura, alla presenza di luce e di ossigeno oltre che dalla durata del periodo di conservazione dell’olio, come vedremo in seguito.
Il contenuto in polifenoli svolge un ruolo fondamentale nei confronti dei processi di invecchiamento cellulare e quindi è strettamente correlato all’insorgenza di malattie croniche come quelle cardiovascolari ed il diabete oltre che a quelle tumorali. Chimicamente sono composti caratterizzati dalla presenza di uno o più
12
gruppi ossidrilici o fenolici in grado di reagire con i radicali liberi in modo da ridurne la capacità ossidante che danneggerebbe cellule e tessuti.
I carotenoidi e la clorofilla rappresentano i pigmenti dell’olio d’oliva. I primi, tra cui il beta-carotene, impediscono all’ossigeno di generare il passaggio di iniziazione nella produzione di radicali. Inoltre il beta-carotene fornisce all’organismo la vitamina A, tramite una scissione ad opera dell’enzima carotenasi del fegato.
Infine riportiamo anche la modestissima presenza di cere, aldeidi e chetoni che influenzano il profumo, il colore e quindi rientrano nella valutazione organolettica del prodotto.
13
1.4 FENOLI E POLIFENOLI DELL’OLIO D’OLIVA
I composti fenolici e polifenolici dell’olio d’oliva possono essere classificati in fenil-acidi, secoiridoidi, fenil-alcoli, flavonoidi e lignani.
I fenil-acidi presenti nell’olio d’oliva derivano dall’acido benzoico e cinnamico. A questi composti appartengono l’acido caffeico, vanillico, siringico, para-cumarico, orto-cumarico, protocatechico, sinapico e para-idrossibenzoico e sono presenti in minime quantità nell’olio di oliva.
I composti classificati come secoiridoidi sono caratterizzati da un punto di vista chimico dalla presenza nella loro struttura dell’acido elenolico e possono essere sia composti glucosidici, sia i corrispondenti agliconi privi dunque della porzione zuccherina. Sono dei composti esclusivi delle piante appartenenti alla famiglia delle olearupeace, che include Olea europea L. I maggiori esponenti glucosidici di questa classe sono l’oleuropeina, la demetiloleuropeina e il ligstroside (Figura 5).
14
15
I principali fenil-alcoli presenti nell’olio d’oliva sono l’idrossitirosolo e il tirosolo. Le loro concentrazioni sono generalmente basse nell’olio appena franto e tendono ad aumentare durante lo stoccaggio grazie all’idrolisi di derivati
esterificati che li contengono nella loro struttura. Nel particolare, questi derivati sono l’oleaceina e l’oleuropeina aglicone che derivano dall’idrossitirosolo, e l’oleocantale e il ligstroside aglicone che derivano dal tirosolo (Figura 6).
16
Il processo di idrolisi precedentemente citato risulta quindi essere critico poiché in grado di determinare variazioni nella composizione della porzione fenolica dell’olio d’oliva.
Tale processo avviene durante la frangitura dell’olio, grazie all’attivazione del patrimonio enzimatico endogeno del frutto dell’oliva ed in particolare all’attivazione della beta-glucosidasi (contenuta nel mesocarpo del frutto) che catalizza l’idrolisi dei derivati secoiridoidi glucosidici, ovvero oleuropeina, demetiloleuropeina e ligstroside a dare i corrispondenti derivati agliconici oleaceina, oleocantale, oleuropeina aglicone e ligstroside aglicone con il meccanismo riportato in figura 7:
17
Figura 7. (I) H: ligstroside, R=OH: oleuropeina; (II) R=H: ligustroside aglicone; (III) R=OH: 3,4 DHPEA-EA; (IV) R=H: forma dialdeidica del ligustroside aglicone; R=OH:formadialdeidica dell’oleuropeina agl’icone;(V) R=H:oleocantale; R=OH: oleaceina.
18
Uno studio ad opera di Servili e Montedoro,4 ha confermato la relazione tra l’idrolisi enzimatica dei secoiridoidi glucosidici e il contenuto dei derivati agliconici nell’olio d’oliva: infatti, operando una inattivazione termica delle beta-glucosidasi, si ottiene un olio d’oliva privo dei derivati agliconici ma avente intatto il contenuto dei secoiridoidi glucidici.
Infine i flavonoidi identificati nell’olio d’oliva includono flavoni, flavonoli, antociani e derivati glicosidici mentre i lignani riconosciuti sono il (+)-pinoresinolo e il (+)- 1-acetossi(+)-pinoresinolo.5
19
1.5 PRINCIPALI FATTORI CHE INFLUENZANO LA COMPOSIONE
FENOLICA
Le caratteristiche di un olio d’ oliva dipendono da molti aspetti a cominciare dalla materia prima influenzata dall’ambiente di coltivazione, dalle cultivar utilizzate, dal sistema di coltivazione, dall’epoca e dal sistema di raccolta delle olive. Altro fattore decisivo è la successiva fase di lavorazione, rappresentata dal sistema di frangitura e gramolatura, dalla conservazione e dal confezionamento del prodotto. 6
Tra i fattori agronomici la cultivar rappresenta sicuramente la variabile più importante: ogni varietà presenta un suo profilo sensoriale dato dalle sostanze aromatiche tipiche della varietà stessa, un diverso quantitativo di fenoli ed una specifica composizione sterolica. Sensibili differenze dovute al genotipo si riscontrano anche nella struttura dei trigliceridi. 7,8
L’ambiente pedologico non sembra esercitare un’azione diretta sulla qualità dell’olio contrariamente alla forte incidenza sulla produttività; i fattori climatici, quali la temperatura, il vento, la piovosità e l’umidità, hanno invece un ruolo determinante sul ciclo produttivo dell’olivo.
I fattori agronomici che maggiormente incidono sui parametri qualitativi dell’olio sono irrigazione e difesa dai parassiti. L’irrigazione influenza il contenuto di fenoli, il quale si abbassa oltre che con il progredire della maturazione anche all’aumentare del quantitativo di acqua apportato, soprattutto nella fase finale della maturazione delle drupe.9
Per quanto riguarda la difesa, tutti i parassiti che attaccano il frutto, sia di origine animale che vegetale agiscono negativamente sulla qualità dell’olio con particolare riferimento all’acidità, al numero di perossidi, alle cere e al colesterolo.
La raccolta delle olive è un’operazione particolarmente delicata che può compromettere la qualità del prodotto finale. Il momento ottimale per la raccolta è la maturazione commerciale, che coincide con la quantità massima di
20
accumulo di olio (massimo grado di inolizione) nella drupa, caratterizzato da verde intenso, bassa acidità, numero ridotto di perossidi ed elevato contenuto di fenoli. Raccogliere le olive quando sono giunte alla maturazione fisiologica, che coincide con la pigmentazione nera o nera-violacea dell’epidermide, significa ottenere un olio con fruttato maturo, tendenzialmente dolce, poco ricco di fenoli e talvolta anche di scarsa conservabilità.
Per quanto riguarda la raccolta, ai fini della qualità dell’olio è necessario che si rispetti l’integrità del frutto a partire dal distacco dalla pianta, traumi e lesioni incidono infatti negativamente sull’acidità, sull’ossidazione, sul contenuto di steroli e sulle caratteristiche organolettiche dell’olio, soprattutto se i tempi che separano la raccolta dall’estrazione dell’olio sono più lunghi di quelli raccomandati. Infatti la lesione del frutto può causare un’azione idrolitica (dovuta alle lipasi) ed una ossidativa (dovuta alle lipossidasi) ed il tempo di conservazione fa aumentare esponenzialmente tali fenomeni.
La molitura e la frangitura sono le due principali tecnologie di trasformazione che influenzano in modo diverso il contenuto di sostanze fenoliche e le caratteristiche organolettiche dell’olio. A parità di condizioni, la molitura con le macine di granito dà un olio meno ricco di sostanze fenoliche, quindi meno amaro e piccante e più armonico ed equilibrato, la frangitura invece, specie con il frangitore a martelli fissi o a dischi, dà origine ad un olio più ricco di sostanze fenoliche e quindi più amaro e piccante, più stabile nel tempo. Con questa operazione si può quindi influire sul contenuto di antiossidanti dell’olio e, di conseguenza, sul suo profilo sensoriale.
Dopo l‘estrazione, l’olio extra vergine di oliva va incontro inevitabilmente ad un processo ossidativo che comporta dapprima la perdita del fruttato e poi la comparsa del difetto di rancido. La stabilità dell’olio e la sua conservabilità sono molto influenzate dalle tecnologie di trasformazione ma in misura maggiore dalle condizioni di conservazione, che possono determinarne un più o meno rapido scadimento qualitativo. 10
21
1.6 PROPRIETA’ SALUTISTICHE
In questo lavoro di tesi ho focalizzato l’attenzione sull’oleocantale, molecola facente parte dei composti fenolici dell’olio d’oliva. Diversi studi ne accertano importanti proprietà fisiologiche, di seguito riportate.
1.6.1 Proprietà sensoriali dell’oleocantale. L’ingestione di olio extravergine di
oliva è spesso associata ad un bruciore piccante localizzato nella regione orofaringea della cavità orale. Esiste una enorme variabilità individuale nella sensibilità all’oleocantale che può variare da una leggera irritazione alla gola ad una irritazione sufficientemente forte a provocare un colpo di tosse negli individui altamente sensibili.
In realtà, come riportano Peyorot des Gachons e colleghi,11 la buona qualità dell’olio extravergine di oliva è talvolta valutata in oli da “un colpo di tosse” o “due colpi di tosse” (gli ultimi di maggior pregio) a causa di questa peculiare irritazione. L’altro unico composto che è capace di dare questa irritazione faringea localizzata è l’ibuprofene e congeneri, ovvero farmaci antiinfiammatori non steroidei arilproprionici. Come descrive Peyorot des Gachons,11 esistono molti irritanti orali, ma nessuno esercita questa inusuale localizzazione in una specifica area. Le sensazioni di irritazione, come il caratteristico bruciore faringeo dell’oleocantale, nascono da una stimolazione di terminazioni nervose aspecifiche nell’epitelio. Diversi tipi di stimoli endogeni ed ambientali sono in grado di attivare le terminazioni libere dei neuroni come la pressione, la temperatura e gli agenti nocicettivi.
La famiglia dei recettori di potenziale transiente (transient potential receptor, TRP) a canali ionici gioca un ruolo predominante in questo tipo di attivazione data dal’oleocantale. I canali TRP-termici (TRPV1-TRPV4, TRPM8, TRPA1) sono
22
espressi nei cheratinociti e nei neuroni sensitivi primari della via nocicettiva responsabile delle sensazioni di irritazione, ed è stato dimostrato che partecipano alla trasduzione del dolore indotto da stimoli termici, meccanici e chimici.
Peyrot des Gachons e colleghi11 hanno prima esaminato se l'oleocantale fosse in grado di eccitare i neuroni sensitivi primari su una coltura di neuroni trigeminali del ratto. L'applicazione dell'oleocantale determina una robusta corrente in entrata di calcio nel 30% dei neuroni trigeminali, in maniera dipendente dalla concentrazione.
Il fatto che l'oleocantale agisca sul recettore TRPA1 selettivamente è stato dimostrato usando un bloccante del canale TRPA1 e neuroni trigeminali mancanti di questo canale ionico. In entrambi i casi il flusso in entrata di calcio viene completamente abolito.
È stato poi osservato che i farmaci antinfiammatori arilpropionici, come l'ibuprofene, provocano un'irritazione faringea simile a quella data dall'oleocantale e ciò ha portato ad indagare e dimostrare (applicando le stesse tecniche viste in precedenza) che anche l'ibuprofene attiva selettivamente il canale ionico TRPA1 nei neuroni sensitivi. Si è dunque confermato che il recettore TRPA1, oltre che a mediare l'inusuale irritazione faringea anche in vivo, è attivato sia dall'ibuprofene che dall'oleocantale.
La localizzazione della sensazione di irritazione è dovuta al fatto che la mucosa orale non è sensibile in modo uniforme agli irritanti chimici. In particolare, l'espressione del canale TRPA1 è eterogenea nelle afferenze del trigemino, soprattutto in quelle della branca mandibolare. Ciò spiega il fatto che sia l’oleocantale che l'ibuprofene diano irritazione al livello della faringe e delle vie nasali superiori ma non a livello della lingua, innervata appunto dalla branca mandibolare del trigemino.
23 1.6.2 L’oleocantale e l’infiammazione
.
Come riportato da Bechaump,12 il simile effetto che ibuprofene e oleocantale esercitano sulla mucosa faringea è un indicatore di un'attività farmacologica condivisa, che vede l'oleocantale agire come composto antiinfiammatorio naturale, con una potenza e un profilo sorprendentemente simili a quelli dell'ibuprofene. Sebbene non presentino strutture molecolari simili, queste molecole inibiscono gli enzimi ciclossigenasi implicati nella via della biosintesi delle prostaglandine e dei trombossani.Le prostaglandine vengono prodotte in seguito al danno cellulare associato all'infiammazione, che agisce al livello della membrana cellulare provocando la liberazione di enzimi lisosomiali da parte dei leucociti; in seguito viene rilasciato acido arachidonico dai fosfolipidi di membrana e vengono prodotti numerosi composti, soprannominati eicosanoidi.
Dopo la sua mobilizzazione, l'acido arachidonico viene ossigenato attraverso quattro diverse vie metaboliche: la via delle ciclossigenasi, quella delle lipossigenasi, della P450 epossigenasi e quella degli isoprostani. Diversi fattori determinano il tipo di eicoesanoide sintetizzato: la specie, il tipo di cellula, il particolare fenotipo della cellula e il tipo di stimolo ricevuto dalla cellula.
La ciclossigenasi è un enzima appartenente alla classe delle ossidoreduttasi che catalizza la conversione di acido arachidonico in prostaglandine e trombossani. Le prostaglandine hanno numerosi effetti sui vasi, sulle terminazioni nervose e sulle cellule infiammatorie. Esistono due isoforme dell'enzima ciclossigenasi, che sono la COX-1 e la COX-2, la prima costitutiva e la seconda inducibile, quindi la sua espressione varia marcatamente in relazione al tipo di stimolo.
Già cinquanta anni fa fu notato che il gusto agre di determinati composti potesse essere legato ad una condivisa attività farmacologica.13
Quindi sulla base delle proprietà irritanti dell'oleocantale e dell'ibuprofene, è stato testato se effettivamente l'oleocantale avesse anche le stesse proprietà antinfiammatorie dell'ibuprofene.
L'ibuprofene è un inibitore non selettivo degli enzimi ciclossigenasi 1 e COX-2, ma non della lipossigenasi, che catalizza alcuni passaggi della via biochimica
24
dell'infiammazione a partire dall'acido arachidonico. Beachaump e colleghi13 hanno dimostrato che entrambi gli enantiomeri dell'oleocantale sono in grado di inibire in vitro le COX ma non le lipossigenasi.
Conseguentemente il consumo di oleocantale a lungo termine può aiutare a proteggere verso alcune malattie grazie a questa caratteristica di inibizione delle COX. È infatti noto che basse e regolari dosi di aspirina, un altro inibitore delle COX, conferiscano effetti positivi in merito a malattie cardiovascolari.
Inoltre secondo Harris,14 il consumo regolare di aspirina, ibuprofene o altri composti fenilpropanoici antiinfiammatori inibitori delle ciclossigenasi, presenta un significante effetto chemioprotettivo verso lo sviluppo di tumori (colon e seno).
1.6.3 L’oleocantale e le malattie neurodegenerative. L'ibuprofene è noto per
avere effetti benefici sui marcatori delle malattie neurodegenerative.
Van Dam e colleghi,15 hanno dimostrato che l'uso prolungato dei farmaci antiinfiammatori non steroidei (FANS) potrebbe ridurre il rischio di sviluppare la malattia dell'Alzheimer o ritardarne l'inizio.
Infatti i FANS riducono la produzione della proteina beta amiloide, la principale colpevole della fisiopatologia dell'Alzheimer e principale costituente delle placche amiloidi che si trovano appunto nel cervello dei pazienti affetti da questa malattia, con un'attività indipendente dagli effetti che essi hanno sulle ciclossigenasi.
La proteina β-amiloide si origina quando una più grande molecola genitrice chiamata proteina precursore della beta amiloide viene scissa da specifici enzimi. Da questo processo si possono generare diversi tipi di A-β: i più comuni sono le forme note come A-β 40 e A-β 42, che con maggiore probabilità si aggregano a formare le placche tossiche.
25
inclusi aspirina, ibuprofene e naprossene, inibiscono l'aggregazione delle proteine beta amiloidi in vitro.
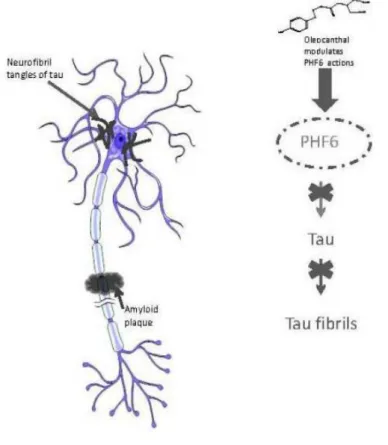
In seguito, Li e colleghi17 hanno cercato di individuare una correlazione tra gli effetti benefici dei composti contenuti nell'olio di oliva e la patogenesi dell'Alzheimer, basandosi sull'osservazione che l'oleocantale inibisce la capacità di formare fibrille sia della proteina A-β 40 che della A-β 42. Successivamente la similarità delle proteine amiloigeniche A-β e della proteina tau nel formare strutture secondarie a β-foglietto ha fatto pensare ad un comune meccanismo di formazione delle fibrille in queste due proteine e che quindi l'oleocantale potesse anche inibire la fibrillizzazione della proteina tau.
La proteina tau è una proteina associata ai microtubuli che promuove l'associazione e la stabilità dei microtubuli stessi. Nella malattia dell'Alzheimer e in altre taupatie, la proteina tau forma fibrille e si aggrega a dare dei grovigli di neurofibrille.
Li e colleghi hanno dimostrato che l'oleocantale elimina la fibrillazione della proteina tau bloccandola nel suo stato aperto; esplica questo effetto legandosi alla proteina tau nell'intorno del peptide noto come PHF6, costituito dalla sequenza VQIXXK (dove V= valina, Q=glutammina, I= isoleucina, K= lisina e X= amminoacidi variabili). Il peptide PHF6 risiede nella regione che lega i microtubuli ed è cruciale per la formazione delle neurofibrille. Tramite studi di relazione struttura-attività è stato dimostrato che entrambi i gruppi aldeidici dell'oleocantale si legano ai residui lisinici della sequenza VQIXXK del PHF6 formando delle basi Schiff, con la capacità inoltre di dare legami crociati (grazie appunto alla presenza di due gruppi aldeidici) e di modificare quindi in modo covalente il frammento peptidico PHF6.
É infine da notare che, al contrario di ciò che accade nell'inibizione della fibrillazione delle proteine β-amiloidi, i farmaci antiinfiammatori arilpropionici non sono in grado di inibire la fibrillazione delle proteine tau, quindi questo effetto rappresenta una nuova attività dell'oleocantale non condivisa con i farmaci precedentemente citati.
26
Figura 8. L’oleocantale inibisce sia la fibrillazione delle proteine tau modificando il peptide PHF6 che la formazione delle placche β amiloidi (da Cicerale S. et al., 2012).
1.6.4 L’oleocantale e la prevenzione dei tumori. Recenti studi18 dimostrano che l’oleocantale può esercitare azioni terapeutiche nei riguardi della patogenesi delle neoplasie indotte dal recettore c-Met chinasi.
C-Met è un recettore tirosin chinasico di membrana, espresso nelle cellule epiteliali di molti organi, essenziale per lo sviluppo embriologico e per la guarigione dalle lesioni. La sua attivazione avviene in seguito al legame con il ligando HGF (fattore di crescita degli epatociti) e comporta una risposta cellulare che comprende: mitogenesi, morfogenesi, migrazione, angiogenesi, crescita e
27
differenziazione cellulare.19 Il legame di HGF alla porzione extracellulare del recettore c-Met ne determina una dimerizzazione, seguita dalla fosforilazione di residui tirosinici del dominio intracellulare.20
Dal momento che la via di segnalazione HGF/Met determina un’accelerazione della proliferazione, oltre ad un’aumentata attività invasiva e che una mancata regolazione di tale via è stata riscontrata in diversi tipi di tumore, il recettore c-Met è diventato un target per lo sviluppo di inibitori che siano in grado di impedirne la stimolazione.
Elnagar e colleghi18 tramite studi di virtual screening, hanno evidenziato che l’oleocantale possiede una eccellente affinità di legame verso diversi tipi di strutture cristallizzate del recettore c-Met. In particolare hanno dimostrato che sono rilevanti per il legame al sito legante ATP del recettore l’ossidrile fenolico, che forma legami a idrogeno con opportuni residui amminoacidici quali prolina e metionina, e i due gruppi aldeidici, coinvolti anch’essi nella formazione di legami a idrogeno. Hanno inoltre avvalorato lo studio di virtual screening osservando che l’oleocantale inibisce la proliferazione, la migrazione e l’invasione di linee cellulari di tumori umani al seno e alla prostata.
Ulteriori studi in vitro ad opera di Khanal e colleghi,21 hanno evidenziato altri meccanismi d’azione con cui l’oleoantale può esplicare un’azione antitumorale. Esso infatti ha effetti antiproliferativi nelle cellule epidermiche JB6 CI41 del topo, grazie all’inibizione del segnale extracellulare mediato dalle proteina chinasi 1 e 2. Inoltre l’oleocantale induce l’apoptosi tramite l’attivazione della caspasi-3 e della poliadenosin-difosfato ribosio polimerasi, ed è in grado di indurre la frammentazione del DNA in cellule HT-29 derivanti dall’adenocarcinoma umano del colon.
28 1.6.5 L’oleocantale e l’osteoartrite. L’osteoartrite o artrosi è una malattia
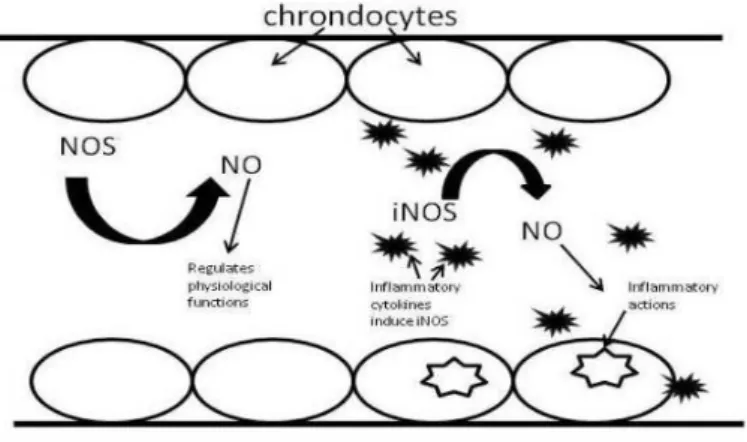
degenerativa che interessa le articolazioni e colpisce il 10% della popolazione adulta generale e il 50% delle persone che hanno superato i sessanta anni di età. La patologia consiste nella nascita di nuovo tessuto connettivo e nuovo osso intorno alle articolazioni interessate, generalmente le più sottoposte ad usura. Le citochine pro-infiammatorie spostano l’equilibrio tra produzione e degradazione di cartilagine nettamente a favore della produzione e stimolano la produzione sia di monossido di azoto (NO) che di prostaglandine di tipo 2 (PGE2), implicate nello sviluppo del dolore artritico. Dal momento che le PGE2 vengono sintetizzate grazie all’attività catalitica delle ciclossigenasi (COX), l’oleocantale potrebbe influenzare l’insorgenza del dolore artritico tramite l’effetto documentato di inibizione delle COX.12
Anche il monossido di azoto (NO) gioca un ruolo fondamentale nell’osteoartrite, dal momento che la progressione di questa malattia è caratterizzata da un aumento della produzione di NO, il quale è associato ad una degradazione della cartilagine.22 NO è un mediatore importante di diverse funzioni fisiologiche quali la vasodilatazione, la neurotrasmissione e l’infiammazione. Il NO prodotto dalla monossido d’azoto sintetasi costitutiva (NOS) funziona principalmente come vasodilatatore e come neurotrasmettitore, a seconda che sia prodotto nelle cellule endoteliali o nei neuroni, rispettivamente. La terza forma di NOS è nota come NOS inducibile (iNOS), non è generalmente presente nelle cellule ma espressa in seguito a diversi stimoli come la lipopolisaccaride batterica (LPS), il fattore alfa di necrosi tumorale, l’ipossia, l’interferone gamma e l’interleuchina 1beta.
Iacono e colleghi22 hanno dimostrato che l’oleocantale e derivati di sintesi, determinano una diminuzione dell’espressione della iNOS provocata dalla lipopolisaccaride batterica (LPS) nei condrociti del topo, in modo dose-dipendente.
29
Per tanto questo studio, evidenziando che l’oleocantale inibisce l’espressione della iNOS che a sua volta produce NO ad azione prettamente infiammatoria, mette in luce un ulteriore potenziale farmacologico di questa molecola naturale.
Figura 9. NO prodotto dalla iNOS promuove i processi infiammatori a carico dei condrociti ed è
associato malattie degenerative che interessano le cartilagini, come l’osteoartrite (da Cicerale S. et al., 2012).
30
2. INTRODUZIONE ALLA PARTE
SPERIMENTALE
31
L’olio di oliva rappresenta uno degli alimenti più antichi il cui ottenimento deriva dalla spremitura del frutto della pianta Olea europaea L. originaria del medio Oriente. A partire dal 5000 a. C. fino al 1400 a. C. la coltivazione di questa specie si è diffusa fino a Creta, alla Siria, per arrivare infine in tutti i paesi del Mediterraneo.
Attualmente esiste un’ampia letteratura scientifica sulle proprietà salutistiche dell’olio d’oliva, tant’è che è opinione comune che gli effetti benefici della Dieta Mediterranea siano attribuibili in larga misura al consumo di questo olio. È stato infatti dimostrato che l’olio d’oliva nella sua totalità contrasta l’invecchiamento cellulare, possiede una lieve azione preventiva sulla trombosi, inibisce la secrezione acida dello stomaco e favorisce la secrezione pancreatica e il drenaggio della bile.
La frazione lipidica dell’olio d’oliva, a differenza di altri oli vegetali, è ricca in acidi grassi monoinsaturi, dei quali il più abbondante è l’acido oleico (C18) che ha dimostrato di contrastare l’ischemia cardiovascolare. Sono presenti inoltre, in quantità minori, l’acido linoleico e l’acido linolenico, che fanno parte rispettivamente degli acidi di categoria omega-6 e omega-3, composti coinvolti nella produzione di energia, formazione di membrane cellulari e sintesi dell’emoglobina.
Le proprietà salutistiche dell’olio d’oliva vengono attribuite principalmente al complesso di fenoli e polifenoli antiossidanti presenti. Recentemente anche l’EFSA, secondo il Regolamento CE 1924/2006, ha approvato un “health claim” con il quale si riconoscono specifici effetti salutistici dell’olio d’oliva riferiti a composti fenolici e polifenolici quali tirosolo, idrossitirosolo e oleuropeina: “i polifenoli dell’olio d’oliva contribuiscono alla protezione dei liquidi ematici dallo stress ossidativo; questa indicazione può essere impiegata solo per l’olio d’oliva che contiene almeno 5 mg di idrossitirosolo e suoi derivati (ad esempio complesso oleuropeina e tirosolo ) per 20 g di olio d’oliva” (dose giornaliera raccomandata). Queste proprietà sono state dimostrate da diversi studi che
32
hanno evidenziato come i polifenoli dell’olio d’oliva e in particolare l’oleuropeina e l’idrossitirosolo, siano in grado di “ripulire” l’organismo dai radicali perossidici, dal radicale superossido, dall’acido ipocloroso e dallo ione perossinitrato.23
Ulteriori studi hanno dimostrato gli effetti positivi dei fenoli e polifenoli dell’olio d’oliva su certi parametri fisiologici, riducendo anche lo sviluppo di malattie croniche e degenerative come le malattie cardiovascolari, la malattia di Alzheimer e il diabete.24 Inoltre possono svolgere un’importante azione di prevenzione tumorale, ostacolando il processo di cancerogenesi attraverso un’attività antiossidante e antiinfiammatoria (mediata dalle COX 1 e COX 2) ma anche per interferenza su specifici meccanismi cellulari.25
La famiglia dei composti fenolici e polifenolici caratteristici dell’olio d’oliva comprende composti semplici come il tirosolo e l’idrossitirosolo e composti più complessi tra i quali i derivati secoiridoidi. In particolare per questa classe di composti, l’oleaceina e l’oleuropeina aglicone sono derivati dell’idrossitirosolo mentre l’oleocantale e ligstroside aglicone sono derivati del tirosolo26 (Figura 1). Le loro concentrazioni nell’olio dipendono sia dal cultivar, dal livello di maturazione del frutto, dall’irrigazione, dalle tecnologie di trasformazione delle olive in olio e dalle modalità di conservazione dello stesso.
33
Figura 1. Principali composti fenolici dell’olio vergine d’oliva ad elevato valore nutraceutico.
L’oleocantale è responsabile della caratteristica sensazione pungente e irritante associata all’ingestione di olio, poiché è in grado di legarsi e stimolare i recettori TRPA1 espressi a livello della mucosa faringea; questa stessa azione è esercitata anche dall’ibuprofene, noto farmaco antiinfiammatorio inibitore non selettivo delle ciclossigenasi (COX). Tale evidenza ha indotto lo studio sulla eventuale attività inibitoria dell’oleocantale nei confronti delle ciclossigenasi COX1 e COX2. Bechaump12 ha in seguito dimostrato che l’oleocantale esercita un effetto inibitorio sulle ciclossigenasi con un meccanismo d’azione analogo a quello dell’ibuprofene, mostrando anche una maggiore potenza inibitoria a parità di concentrazione. Tale attività giustifica anche la sua potenziale attività salutistica
34
per diverse malattie croniche come quelle cardiovascolari e per malattie infiammatorie degenerative alle articolazioni grazie ad una ridotta sintesi dei trombossani (agenti pro-aggreganti) e ad una ridotta produzione delle prostaglandine come conseguenza dell’inibizione delle COX, unita ad una ridotta espressione della iNOS.22
Infine l’oleocantale ha mostrato attività preventiva verso alcune forme di cancro gastrico poiché possiede azione antimicrobica contro i microorganismi responsabili dell’ulcera gastrica e quindi della possibile insorgenza del tumore che ne può derivare. È stato anche descritto come potenzialmente utile per contrastare lo sviluppo di malattie neurodegenerative come l’Alzheimer, per la sua capacità di prevenire la A- oligomerizzazione e la tau aggregazione.17 L’oleaceina, altro derivato secoridoide dell’olio d’oliva, ha mostrato proprietà simili a quelle dell’oleocantale e, in particolare, possiede un’ottima attività antiossidante. L’oleuropeina aglicone, è molto attiva nell’inibire l’aggregazione piastrinica e ha mostrato un effetto protettivo verso l’Alzheimer ed alcune forme di cancro.
Comunque i meccanismi d’azione, nonché i profili di biodisponibilità di questa famiglia di composti non sono stati completamente chiariti.
Il lavoro sperimentale di questa tesi si inserisce in un ampio progetto multidisciplinare che si propone di studiare le proprietà nutraceutiche dell’olio d’oliva tal quale e dei suoi componenti fenolici e polifenolici, quali tirosolo, idrossitirosolo, oleuropeina, oleocantale ed oleaceina, questi ultimi due non ancora oggetto di “health claim”. A tal proposito risulta fondamentale la disponibilità di metodiche analitiche per il dosaggio dei suddetti componenti fenolici e polifenolici, nonché di standard puri che possano essere utilizzati per gli studi analitici, per studi biochimico-farmacologici e per studi di tecnologia farmaceutica. Dai risultati di questi studi si potranno anche avere informazioni fondamentali per lo sviluppo di nuovi integratori contenenti i fenoli e polifenoli
35
oggetto di studio, che potrebbero essere utilizzati anche come “add-on therapy”. Di notevole rilevanza sarà la possibilità di veicolare tali sostanze mediante opportune forme farmaceutiche, come ad es. le nanoparticelle, al fine di incrementarne il profilo di biodisponibilità.
In particolare, tra i fenoli e polifenoli oggetto delle ricerche, questa tesi è stata focalizzata sullo sviluppo di metodiche analitiche per l’oleocantale, sia mediante HPLC che mediante risonanza magnetica nucleare. Inoltre, non essendo disponibile in commercio l’oleocantale, parte del lavoro sperimentale è stato rivolto verso la sintesi del suddetto composto, ottimizzando vie di sintesi già note.27
La prima fase del lavoro sperimentale svolto, ha riguardato lo sviluppo di una metodica analitica per l’analisi dell’olio d’oliva ed il suo contenuto in oleocantale utilizzando la cromatografia liquida ad alta prestazione (HPLC). Questo studio si è basato su una metodica riportata in letteratura28 che aveva dimostrato di avere i migliori limiti di quantificazione e determinazione. Tale metodica è stata quindi ripresa ed ottimizzata come descritto di seguito.
La porzione fenolica dell’olio d’oliva è stata estratta trattando un campione di olio con esano e acetonitrile in rapporto di 1:2.5 v/v. La totalità dell’acetonitrile ottenuta da tre estrazioni è stata evaporata e il residuo solubilizzato in una miscela MeOH/H2O 1/1 (v/v). È stata utilizzata una quantità di miscela pari ad ¼ rispetto a quella indicata nella procedura di riferimento,28 in modo da ottenere una soluzione più concentrata del campione, pronta per essere analizzata all’HPLC.
Per mettere a punto la metodica HPLC, sono state comparate quattro tipi di colonne diverse, sia per quanto riguarda le dimensioni, sia per quanto riguarda il particolato (Tabella 1), usando come fase mobile una miscela costituita da acqua e acetonitrile secondo i gradienti riportati nelle tabelle 2 e 3.
36 Tabella 1
150 x 4.6 mm Luna 5 µm
150 x 4.6 mm Luna 3 µm
250 x 4.6 mm Hypersil 5 µm
150 x 4.6 mm Zorbax 3.5 µm
Tabella 2
Tabella 3
GRADIENTE 2
Durata
(min)
ACN (%)
H2O (%)
0
25
75
35
25
75
35.01
80
20
45.00
80
20
45.01
25
75
55
25
75
GRADIENTE 1
Durata
(min)
ACN (%)
H2O (%)
0
35
65
50
35
65
50.01
60
40
60
60
40
60.02
35
65
70
35
65
37
Le condizioni migliori in termini di risoluzione sono state ottenute utilizzando come fase stazionaria la colonna Phenomenex 150 x 4.6 mm Luna 5 µm ed una fase mobile eluita secondo il gradiente di tipo 2 a flusso 1 mL/ min.
I cromatogrammi sono stati acquisiti utilizzando come rivelatore uno spettrofotometro UV impostato ad una lunghezza d’onda di 278 nm.
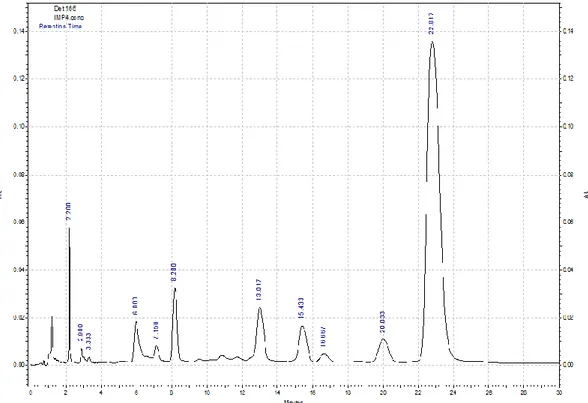
Figura 2. Cromatogramma HPLC dell’estratto fenolico dell’olio d’oliva.
In figura 2 è riportato un esempio di cromatogramma ottenuto secondo le condizioni sopradette che evidenzia una buona risoluzione e separazione dei vari componenti della matrice. In relazione alla attribuzione del picco corrispondente all’oleocantale, questo è stato definito attraverso la comparazione dei cromatogrammi e del tempo di ritenzione con quelli riportati in letteratura28; inoltre, per poter escludere la sovrapposizione di due o più analiti con lo stesso tempo di ritenzione, sono state effettuate ulteriori analisi, variando opportunamente il gradiente di eluizione. Al fine di poter attribuire il picco relativo al segnale dell’oleocantale in modo inequivocabile, risulta comunque
38
indispensabile la possibilità di disporre di uno standard puro di oleocantale, che peraltro è stato l’oggetto della seconda parte di questa tesi di laurea dal momento che, come già evidenziato, questa molecola non è disponibile in commercio.
Il lavoro sperimentale di tesi è stato pertanto rivolto verso la sintesi dell’oleocantale come miscela racemica, ottimizzando una via di sintesi già riportata in letteratura,27 al fine quindi di potere disporre di questo composto come standard puro per i successivi studi analitici, biochimico-farmacologici e di tecnologia farmaceutica.
39 Schema di sintesi
Reagenti e condizioni: (a) PhI(OAc)2 , HBF4, CH3COOH, temperatura ambiente, 2h; (b) KOH 10M,
EtOH, 60˚C, overnight; (c) MnO2, EtOH assoluto, temperatura ambiente, overnight; (d) 5, TMEDA,
DMF anh., TBAI, temperatura ambiente, overnight; (e) t-BuOOH, DBU, CH2Cl2 anh., temperatura
ambiente, overnight; (f) EtPPh3Br, KHMDS, toluene anh., -78˚C, 1h; (g) NaIO4, THF/H2O,
temperatura ambiente, 22h; (h) TBAF, HF, THF, temperatura ambiente, overnight; (i) TBDMSCl, imidazolo, THF, 15˚C per 10 minuti, temperatura ambiente overnight.
40
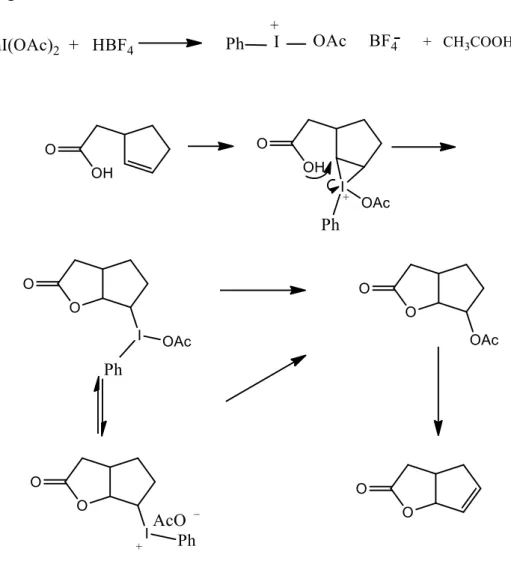
Il primo passaggio consiste nella formazione del lattone 2 a partire dall’acido 2-ciclopenten-1-acetico (1). La reazione di lattonizzazione fra l’acido insaturo 1 e la specie reattiva ottenuta facendo reagire il diacetossi iodio benzene con l’acido tetrafluoroborico, è stata effettuata seguendo due metodiche diverse. La prima prevede la formazione della specie reattiva, cioè il sale acetossi feniliodonio tetrafluoroborato, per reazione tra PhI(OAc)2 e HBF4 in acido acetico a temperatura ambiente per un’ora e la successiva aggiunta dell’acido 1. La miscela di reazione viene lasciata reagire sotto agitazione un’ora a temperatura ambiente per ottenere il lattone 2 (resa 48%), tramite il meccanismo 29 indicato in figura 3:
41
Il secondo metodo prevede l’ottenimento della specie reattiva, lo iodoso benzene tetrafluoro borato di colore giallo, per reazione fra PhI(OAc)2 e HBF4 in CHCl3. Questo sale è stato quindi isolato e fatto reagire con l’acido monoinsaturo
1 in acido acetico per un’ora a temperatura ambiente per ottenere il lattone 2 in
rese dell’80% secondo il meccanismo30 di seguito riportato (Figura 4).
42
Lo step successivo consiste nell’idrolisi del lattone con una soluzione acquosa di KOH 10 M in etanolo per ottenere il sale di potassio 3 (Schema di sintesi). Secondo quanto riportato in letteratura,27 per far sì che la reazione di idrolisi vada a completezza è necessario 1 equivalente di KOH, mentre noi abbiamo riscontrato che sono necessari 2 equivalenti di base. Tuttavia utilizzando un solo equivalente di KOH il sale può essere purificato mediante triturazione con etere dietilico che permette il recupero del lattone non reagito.
La reazione successiva consiste nell’ossidazione dell’alcol allilico del composto 3 a dare il corrispondente chetone 4. In un primo momento, abbiamo seguito esattamente la procedura presente in letteratura27 che riporta la reazione con MnO2 in etanolo assoluto per 23 ore a temperatura ambiente, senza però ottenere il prodotto desiderato, ma recuperando sempre il prodotto di partenza. Sono stati dunque utilizzati solventi diversi dall’etanolo, (THF, H2O) conducendo la reazione anche al microonde (CEM) e impiegando altri tipi di ossidanti (bromuro rameico con t-BuOOH come catalizzatore, piridinio clorocromato (PCC)), anche in questi casi senza ottenere il derivato desiderato. Infine la reazione effettuata utilizzando MnO2 attivato in etanolo assoluto ha finalmente portato al chetone atteso 4. Il MnO2 attivato infatti è riportato in letteratura30 come ossidante selettivo di alcol allilici come anche di quelli benzilici. La scelta dell’etanolo si è resa necessaria per la limitata solubilità del sale 3; il fatto che la reazione di ossidazione avvenga anche in etanolo assoluto risulta sorprendente in quanto in letteratura è riportato che i solventi polari hanno un forte effetto inibente nei confronti del MnO2 attivato.
Successivamente il composto 4 è stato fatto reagire con il bromo derivato 5 in DMF e N,N,N',N'-tetrametiletilendiammina (TMEDA) (1.1% v/v) in presenza di una quantità catalitica di tetrabutilammonio ioduro (TBAI). Il grezzo ottenuto dalla reazione è stato purificato mediante flash cromatografia utilizzando come miscela eluente etere di petrolio/acetato di etile 8:2, per ottenere l’estere desiderato 6a con una resa del 15%. A differenza di quanto riportato nella
43
procedura, durante la purificazione del grezzo di reazione non è stato isolato il corrispondente composto deprotetto 6b.
Il bromo derivato 5 è stato preparato per reazione tra il 4-(2-bromoetil)fenolo e il
t-butil dimetilsilil cloruro in THF e aggiungendo un eccesso di imidazolo a 15 ˚C
durante un periodo di dieci minuti. Successivamente la miscela di reazione è stata mantenuta sotto agitazione a temperatura ambiente per 16 ore. Il grezzo di reazione è stato purificato tramite flash-cromatografia usando come eluente etere di petrolio per ottenere il bromo derivato puro con una resa del 62%. La successiva reazione di epossidazione dell’estere 6a con t-BuOOH, in presenza di diazabiclico(5.4.0)undec-5-ene (DBU) come catalizzatore in CH2Cl2 anidro ha fornito l’epossido 7 purificato per flash cromatografia, (etere di petrolio/acetato di etile 8:2) con una resa del 40%.
L’epossido 7 è stato poi sottoposto ad una reazione di Wittig per trattamento con etil trifenilfosfonio bromuro e KHMDS in toluene a -70 ˚C.
Inizialmente la reazione è stata eseguita secondo la procedura riportata in letteratura27 che prevede la formazione dell’ilide per deprotonazione dell’etil trifenil fosfonio bromuro con KHMDS. L’avvenuta reazione è resa evidente per l’intensa colorazione rossa della soluzione che viene poi aggiunta al chetone in toluene ad una temperatura di -70 ˚C. Con questa procedura l’ilide risultava particolarmente instabile infatti rapidamente si aveva decolorazione della soluzione. Abbiamo perciò ritenuto opportuno aggiungere direttamente il chetone alla soluzione dell’ilide nel momento in cui essa si veniva a formare (colorazione rossa). La reazione è stata monitorata su TLC aggiungendo più volte alla miscela di reazione nuova ilide preparata di fresco. Il grezzo di reazione è stato purificato mediante flash cromatografia utilizzando etere di petrolio/acetato di etile 9:1 come miscela eluente, con una resa del 18%.
L’idrolisi ossidativa del composto 8 con un eccesso di NaIO4 in THF e H2O ha portato ad un grezzo di reazione che, dopo purificazione tramite cromatografia flash (etere di petrolio/acetato di etile 8:2) ha fornito il derivato dicarbonilico 9 come miscela di isomeri E/Z in rapporto di 77:23, in resa del 46 %.
44
Attualmente è in corso la procedura per effettuare la reazione di deprotezione dell’ossidrile fenolico che consiste nel trattamento del derivato 9 con un tampone costituito da una soluzione di tetrabutilammonio fluoruro (TBAF) in THF e una soluzione acquosa di HF al 40%.
Sempre con l’obiettivo di sviluppare metodiche analitiche per la determinazione dell’oleocantale nell’olio d’oliva, l’ultima parte della mia tesi è stata dedicata allo studio ed all’applicazione di una recente metodica26 che prevede l’impiego della risonanza magnetica nucleare (1H NMR).
Infatti l’oleocantale presenta un segnale caratteristico a δ = 9.22 ppm dovuto al gruppo aldeidico in posizione 5. Questo segnale è presente anche in altri derivati secoiridoidi ma cade a campi diversi (figura 5).
Figura 5. Spettro HNMR dei derivati secoiridoidi dell’olio vergine d’oliva.
Siringaldeide, standard interno
oleuropeina aglicone
oleocantale
oleacina ligstroside aglicone
45
Per poter ottenere il campione da analizzare all’1H-NMR, l’olio d’oliva è stato sottoposto a un trattamento con cicloesano e acetonitrile in rapporto 4:5 (v/v) in modo da ottenere la fase acetonitrilica in cui si solubilizzano i composti d’interesse. A tale fase è stata aggiunta una soluzione di siringaldeide in acetonitrile (0.50 mg/mL) come standard interno ed in seguito la soluzione risultante è stata evaporata. Il residuo ottenuto è stato ripreso con CDCl3 e trasferito in un tubicino per NMR. Come esempio è riportato in figura 6 uno degli spettri ottenuti, registrato con uno spettrometro Bruker Avance operante a 400 MHz ed in cui i segnali sono stati integrati manualmente (TopSpin 3.2).
46
Tale metodica è stata quindi applicata a campioni di olio di oliva al fine di determinare il loro contenuto relativo di oleocantale. Una prima valutazione dei livelli di oleocantale è stata effettuata rapportando l’integrazione del suo caratteristico segnale aldeidico (δ = 9.22 ppm) a quella del segnale aldeidico della siringaldeide (δ = 9.81 ppm), alla quale è stato attribuito un valore pari ad 1. Nella tabella 4 sono riportate le integrazioni del segnale caratteristico dell’oleocantale, ottenute secondo questa metodica, per i campioni di olio d’oliva analizzati. Questi risultati ne evidenziano quantità variabili nei diversi tipi di olio.
La possibilità di poter disporre di uno standard puro sarà utile al fine di ottenere dei valori assoluti di quantità di oleocantale nei vari campioni di olio d’oliva esaminati.
Campione Olio Integrazione Oleocantale 1 0,65 2 0,59 3 0,00 4 0,54 5 0,72 6 0,50
47
48
3.1 ANALISI HPLC
Materiali e metodi.
Reagenti: Acetonitrile, metanolo, acqua, n-esano tutti di grado analitico, sono stati acquistati dalla Sigma Adrich.
Strumentazione: per le analisi è stato utilizzato un HPLC della Beckman 125 System Gold, detector System Gold 166, software 32Karat e iniettore con loop da 20 µL. La colonna utilizzata è una Phenomenex (150 x 4.6 mm) Luna 5µ.
Preparazione dei campioni di olio per l’analisi HPLC.
A 1 g di olio di oliva in una falcon da centrifuga da 15 mL sono stati aggiunti 2 mL di esano e si è miscelato con il vortex 15 s per due volte. Successivamente sono stati aggiunti 5 mL di acetonitrile di purezza HPLC e si è miscelato al vortex 15 s per due volte.
Si procede con la centrifugazione a 4100 rpm per 5 minuti per separare il solvente dalla fase oleosa. Il solvente di estrazione è stato raccolto e la fase oleosa lavata nuovamente con acetonitrile per un totale di tre volte, ripetendo le operazioni descritte in precedenza.
Il solvente di estrazione recuperato da tutti i tre lavaggi è stato raccolto ed evaporato con il rotavapor. Al residuo di estrazione che si ottiene sono stati aggiunti 0.25 mL di MeOH/H2O (1/1 v/v) per solubilizzare l’estratto e 3 mL di esano per eliminare ogni residuo oleoso. Si centrifuga nuovamente per separare le fasi, e la fase MeOH/H2O è stata raccolta per essere analizzata all’HPLC.
Parametri HPLC.
L’ analisi è stata eseguita usando una colonna Phenomenex Luna 150 mm x 4,6
mm con diametro delle particelle 5 µm. Il volume di estratto metanolico era di 20 µL. L’eluizione è stata fatta con una miscela composta da aceto nitrile (solvente A) e acqua (solvente B) ed il flusso di tali solventi in colonna era di 1 mL / min.
49 3.2 SINTESI
Materiali e metodi.
La struttura di tutti i composti è stata verificata per mezzo della spettrometria 1H-NMR.
Gli spettri di risonanza magnetica nucleare protonica sono stati eseguiti con uno spettrometro Bruker Avance operante a 400 MHz e riferiti al segnale residuo del solvente. I chemical shift δ sono espressi in ppm e le costanti di accoppiamento J sono espresse in Hz.
Le evaporazioni sono state eseguite sotto vuoto in evaporatore rotante.
Le TLC analitiche sono state eseguite usando lastrine di gel di silice 60 F254 (MERCK) contenenti un indicatore fluorescente; le varie macchie sono state evidenziate per mezzo di lampada UV (254 nm).
Per la cromatografie su colonna è stato usato gel di silice 60 (0.040-0.063 mm) (MERCK).
50 Sintesi composto 2.
Primo metodo: ad 8 mL di CH3COOH sono stati aggiunti PhI(OAc)2 (3.32 g, 10.0 mmol) e HBF4 al 48% (1.8 mL, 28.69 mmol). La soluzione gialla che ne risulta è stata lasciata sotto agitazione per un’ora a temperatura ambiente. Successivamente è stato aggiunto l’acido 1 (0.6 mL, 5.0 mmol) e la miscela di reazione è stata lasciata sotto agitazione magnetica, sempre a temperatura ambiente, finché la totale scomparsa del prodotto di partenza è stata verificata mediante TLC (Etere di petrolio/AcOEt 8:2).
Secondo metodo: A 5 mL di CHCl3 sono stati aggiunti PhI(OAc)2 (3.22 g, 10.0 mmol) e HBF4 al 48% (2 mL, 31.89 mmol) e la miscela di reazione è stata lasciata sotto agitazione, a temperatura ambiente per mezz’ora per consentire la formazione dello iodosobenzene tetrafluoroborato.
Successivamente la soluzione ottenuta è stata evaporata sottovuoto a 50 °C e il residuo ottenuto (un olio giallo e denso) è stato tratato con CHCl3 (10 mL) e di H2O (2 mL). I cristalli gialli ottenuti sono stati filtrati, lavati con CHCl3 e H2O ed essiccati sottovuoto in un essiccatore con P2O5 per 12 ore.
In seguito, ad una soluzione (colore giallo intenso) di iodoso benzene tetrafluoroborato (1 g, 1.67 mmol) in CH3COOH (10 mL), è stato aggiunto l’acido
1 (0.4 mL, 3.34 mmol) e la miscela di reazione è stata lasciata sotto agitazione a
temperatura ambiente fino alla completa decolorazione della soluzione.
Successivamente, per entrambi i metodi la reazione è stata quenchata mediante l’aggiunta di H2O (10 mL) e la soluzione acquosa così ottenuta è stata estratta con CHCl3 (x 3). La fase organica è stata quindi essiccata su Na2SO4 anidro, filtrata ed evaporata sottovuoto.
Il grezzo ottenuto è stato purificato mediante flash cromatografia su colonna di gel di silice, usando come eluente una miscela etere di petrolio/ acetato di etile 8:2.
51
Le opportune frazioni, riunite hanno fornito 209.5 mg di composto 6 (primo metodo), e 498.3 mg di composto 6 (secondo metodo).
Resa (primo metodo): 34% Resa (secondo metodo): 83%
1HNMR: (CDCl3): 6.09-6.07 (m, 1H), 5.89-5.87 (m, 1H), 5.52 (d, J = 7.6 Hz),
52 Sintesi composto 3.
Ad una soluzione del composto 2 (837.9 mg, 6.76 mmol) in EtOH (27 mL) è stata aggiunta una soluzione acquosa di KOH 10 M (0.68 mL, 6.76 mmol) e la miscela di reazione è stata lasciata sotto agitazione, a 70˚C, overnight.
Dopo aver evaporato il solvente, il residuo ottenuto è stato triturato con Et2O, recuperando così il composto 2 che non ha reagito.
Il solido biancastro (788 mg) così ottenuto, è stato utilizzato nel passaggio successivo senza ulteriore purificazione.
1HNMR: (MeOD) δ(ppm): 5.97-5.95 (m, 1H), 5.82-5.78 (m, 1H), 4.66-4.64 (m, 1H),
53 Sintesi composto 4.
Ad una soluzione del composto 3 (788.7 mg, 4.38 mmol) in EtOH assoluto (8.7 mL) è stato aggiunto MnO2 attivato (7.61 g, 87.6 mmol). La miscela di reazione è stata lasciata sotto agitazione, a temperatura ambiente, overnight.
Successivamente la miscela di reazione è stata filtrata su Celite e il filtrato è stato evaporato sottovuoto per fornire il composto 4 (369.2 mg), utilizzato nello step successivo senza ulteriori purificazioni.
1HNMR: (MeOD) δ (ppm): 7.82-7.80 (m, 1H), 6.15-6.13 (m, 1H), 3.26-3.18 (m,
54 Sintesi composto 5.
Ad una soluzione di 4-(2-bromoetil)-fenolo (2g, 12.43 mmol) in THF anidro (52.2 mL), è stato aggiunto, a temperatura ambiente, tert-butildimetilsilil cloruro (2.04 g, 13.55 mmol). La soluzione ottenuta, mantenuta sotto agitazione magnetica, è stata portata alla temperatura di 15 ˚C ed è stato aggiunto imidazolo (2.11g, 30.99 mmol) in piccole porzioni. La miscela di reazione è stata lasciata sotto agitazione a temperatura ambiente e monitorata mediante TLC.
Dopo circa 12 ore, la miscela di reazione è stata filtrata e il filtrato evaporato fino a completa rimozione del solvente. Il residuo ottenuto è stato solubilizzato in Et2O (20 mL) e lavato con una soluzione acquosa di acido acetico (pH = 5.5, 2x20 mL), H2O (2x20 mL) e una soluzione satura di NaHCO3 (1x17 mL). La fase organica è stata essiccata su Na2SO4 anidro, filtrata ed evaporata.
Il grezzo ottenuto è stato purificato mediante flash cromatografia su colonna di gel di silice usando come eluente etere di petrolio.
Le opportune frazioni, unite ed evaporate, hanno fornito 2.41 g del composto 5 puro.
Resa: 62%
1HNMR: (CDCl3): 7.08-7.03 (m, 2H), 6.81-6,75 (m, 2H), 3.52 (t, J = 7.8 Hz, 2H),
55 Sintesi composto 6.
La reazione è stata condotta in un pallone a due colli fiammeggiato sotto N2. Ad una soluzione del composto 4 (400.9 mg, 2.25 mmol) in DMF anidra (4.2 mL) è stata aggiunta TMEDA (70 µL, 0.45 mmol) e la miscela di reazione è stata lasciata sotto agitazione magnetica per 30 minuti, a temperatura ambiente. Successivamente è stato aggiunto il composto 5 (1.42 g, 4.5 mmol) precedentemente solubilizzato in DMF anidro (4.2 mL). E’ stata infine aggiunta una quantità catalitica di TBAI e la miscela di reazione è stata lasciata sotto agitazione a temperatura ambiente overnight.
Successivamente, è stata aggiunta H2O (52 mL) e il contenuto del pallone è stato trasferito in un imbuto separatore ed estratto con Et2O (3x52 mL). La fase organica è stata essiccata su Na2SO4, filtrata ed evaporata.
Il grezzo ottenuto è stato purificato mediante flash cromatografia su colonna di gel di silice, usando come eluente una miscela etere di petrolio/ acetato di etile 8:2.
Le opportune frazioni, riunite ed evaporate, hanno fornito 202.3 mg di composto
6 puro. Resa: 24% 1HNMR: (CDCl 3) δ(ppm): 7.67-7.65 (m, 1H), 7.06 (AA’XX’, JAX = 8.4 Hz, JAA’XX’ = 2.4 Hz, 2H), 6.76 (AA’XX’, JAX = 8.4 Hz, JAA’XX’ = 2.6 Hz, 2H), 6.23-6.21 (m, 1H), 4.23 (t, J = 7.2 Hz, 2H), 2.96-2.81 (m, 4H), 2.66-2.61 (m, 1H), 2.43-2.34 (m, 2H), 0.97 (3 s sovrapposti, 3 x 3H), 0.18 (2 s sovrapposti, 2 x 2H).
56 Sintesi composto 7
Preparazione della soluzione di t-BuOOH in CH2Cl2: In un pallone fiammeggiato sotto N2 sono stati aggiunti CH2Cl2 anidro (36 mL), una soluzione di t-BuOOH (in H2O 7.76 M, 3.72 mL) e H2O (20.5 mL). La miscela è stata lasciata sotto agitazione per qualche minuto ed in seguito il contenuto del pallone è stato trasferito in un imbuto separatore. E’ stata raccolta la fase organica, essiccata su Na2SO4 anidro per 20 minuti e filtrata.
In un pallone a due colli fiammeggiato sotto N2, è stata aggiunta la soluzione di t-BuOOH in CH2Cl2 (9.92 mL, 0.68 mmol), successivamente una soluzione del composto 6a (253 mg, 0.68 mmol) in CH2Cl2 anidro (0.99 mL) e DBU (20 µL, 0.14 mmol) e la miscela di reazione così ottenuta è stata lasciata sotto agitazione a temperatura ambiente e monitorata mediante TLC. Dopo circa 12 ore, la reazione è stata quenchata aggiungendo una soluzione satura di NH4Cl (2.5 mL) e una soluzione satura di Na2S2O3 (2.5 mL) . Il contenuto del pallone è stato trasferito in un imbuto separatore ed estratto con CH2Cl2 (3x5 mL). La fase organica è stata essiccata su Na2SO4 anidro, filtrata ed evaporata.
Il grezzo ottenuto è stato purificato mediante flash cromatografia su colonna di gel di silice usando come miscela eluente etere di petrolio/ acetato di etile 8:2. Le opportune frazione, riunite ed evaporate, hanno fornito 104.5 mg di composto 7 puro. Resa: 39% 1HNMR: (CDCl3), δ (ppm): 7.04 (AA’XX’, J AX =8.4 Hz, JAA’XX’ = 2.4 Hz, 2H), 6.76 (AA’XX’, JAX =8.4 Hz, JAA’XX’ = 2.4 Hz, 2H), 4.24 (t, J = 7.1 Hz, 2H), 3.86-3.84 (m, 1H), 3.39 (d, J = 2.5 Hz, 1H), 2.84 (t, J = 7 Hz, 2H), 2.68-2.55 (m, 3H), 2.49-2.42 (m, 1H), 1.78-1.73 (m, 1H), 0.99 (3 s sovrapposti, 3 x 3H), 0.2 (2 s sovrapposti, 2 x 3 H).