1. INTRODUZIONE……….….… 2
1.1 EZIOPATOGENESI……….…...3
1.2FISIOPATOLOGIA DELLA SINOVITE REUMATOIDE...….11
1.3 QUADRO CLINICO………..……….…….………...17
1.4 DIAGNOSI………..…….….21
2. SCOPO DELLA TESI……….……...32
3. PAZIENTI E METODI……….……...33
3.1 PAZIENTI………....………...……….….33
3.2 DETERMINAZIONE DEGLI ANTICORPI ANTI-VCPs.……..37
3.3 DETERMINAZIONE DEGLI ANTICORPI ANTI-HCPs…… ...38
3.4 DETERMINAZIONE DEGLI ANTICORPI ANTI-CCP2.….…39 3.5 ANALISI STATISTICA………...…………40
4. RISULTATI………...……….………...41
5. DISCUSSIONE……….47
BIBLIOGRAFIA………...…………53
C
APITOLO1
I
NTRODUZIONE1.1 Introduzione
L’artrite reumatoide è una malattia infiammatoria cronica ad eziologia sconosciuta e andamento progressivo prevalentemente a carico delle articolazioni diartrosiche (1).
Si manifesta con una sinovite persistente a carico delle articolazioni periferiche, spesso bilateralmente e comporta la progressiva erosione dell’osso subcondrale, distruzione della cartilagine e, nel tempo, deformità dell’articolazione (2).
La malattia è ubiquitaria. La prevalenza dell’AR è compresa tra lo 0,5% e l' 1% della popolazione. Il sesso femminile è più colpito di quello maschile con un rapporto che va da 3:1 a 5:1. La sua insorgenza è caratteristica tra la IV e V decade anche se può manifestarsi anche in età giovanile e in età senile. L'esordio è estremamente variabile, ma avviene di solito in modo lento e
graduale; si ha poi un decorso con fasi di attività alternate a fasi di remissione, spontanee o indotte dalla terapia, più o meno lunghe. Sono interessate preferenzialmente le articolazioni periferiche più piccole, in maniera simmetrica e con decorso centripeto e conseguente deficit funzionale.
Nella malattia avanzata non sono inusuali manifestazioni extra-articolari come vasculite reumatoide, atrofia cutanea, linfoadenopatie, splenomegalia e impegno polmonare.
Dal punto di vista clinico la malattia è molto eterogenea: infatti alcuni pazienti possono manifestare una malattia oligoarticolare di modesta entità clinica con danno articolare minimo, mentre in altri pazienti la malattia ha esordio precoce e progressione rapida con una poliartrite inarrestabile che esita in lussazioni e anchilosi articolari.
La prognosi quoad valetudinem è severa: è infatti una malattia altamente invalidante che comporta una significativa modificazione della qualità della vita e perdita della capacità lavorativa entro dieci anni dall'esordio in oltre il 50% dei pazienti (3).
1.2 Eziopatogenesi
Nonostante l'intensa ricerca scientifica, le cause precise della patologia sono ancora ignote. È legata probabilmente a un fattore esterno scatenante (per esempio un virus) che, in soggetti
geneticamente predisposti a sviluppare la malattia, provoca un'attivazione del sistema immunitario e, attraverso una complessa serie di eventi, porta allo sviluppo di un processo infiammatorio acuto e successivamente al suo automantenimento e alla cronicizzazione (4). Esiste dunque una predisposizione genetica a contrarre l'AR; numerosi studi hanno confermato come l'AR ricorra frequentemente nella stessa famiglia e si manifesti con incidenza superiore in gemelli omozigoti rispetto agli eterozigoti.
E’ stato possibile riconoscere una peculiare associazione con l'antigene leucocitario HLA-DR4 ed in misura minore con l'HLA-DR1 (5). La molecola DR4 e' costituita da un gruppo di almeno 5 antigeni (DW4, DW10, DW13, DW14 e DW15) che differiscono dal punto di vista strutturale nella sequenza primaria e precisamente in alcuni aminoacidi della terza regione variabile della catena beta. In questa sede è presente infatti una breve sequenza amminoacidica denominata SHARED EPITOPE, che viene invariabilmente espressa dagli antigeni del DR4 predisponenti alla malattia ed è potenzialmente implicato nella patogenesi dell'AR (6).
Le molecole HLA hanno un ruolo fisiologico fondamentale nel consentire la presentazione, da parte di cellule predisposte a tale scopo, degli antigeni al linfocita T. La sequenza amminoacidica specifica dello shared epitope sembra favorire la presentazione di antigeni con carica elettrica negativa (proprio come sono le proteine
citrullinate). Il linfocita T, a sua volta, da un lato attiva i macrofagi e quindi la produzione da parte di essi di citochine pro-infiammatorie, come le IL-1 e IL-6 e il Tumor Necrosis Factor-α (TNF-α), dall’altro attiva il linfocita B e ne induce la differenziazione in plasmacellula e la conseguente produzione di anticorpi specifici (in questo caso autoanticorpi). Le citochine proinfiammatorie, a loro volta, e in primis il TNF-α, sono in grado di attivare le cellule effettrici del processo, i condrociti, i fibroblasti e gli osteoclasti che, anche attraverso fenomeni proliferativi, generano il danno delle strutture articolari e ossee (7).
Tutti gli alleli associati con l'AR condividono lo "shared epitope" ma differiscono nelle altre regioni della molecola, quindi è chiaro che lo "shared epitope" rappresenta il principale determinante della predisposizione a sviluppare la malattia.
Alcuni studi suggeriscono inoltre che lo "shared epitope" sia correlato con forme più severe e rapidità di progressione della malattia (8). Nonostante vi sia una solida evidenza che l’AR è una malattia autoimmune, non è stato ancora identificato l’autoantigene capace di innescare la reattività autoimmunitaria nei confronti delle strutture articolari, e in particolare della membrana sinoviale, organo bersaglio principale della malattia.
Tra i possibili autoantigeni vi sono il collagene di tipo II e i proteoglicani, ma anche la regione Fc delle IgG verso si formano
autoanticorpi detti fattori reumatoidi. Molti anni fa sono stati descritti anticorpi diretti verso granuli perinucleari delle cellule epiteliali della mucosa buccale (APF) (9), seguiti poi dal rilevamento di anticorpi anti cheratina (AKA) in più del 50% dei pazienti affetti da AR (10). Negli ultimi anni si è riusciti a dimostrare che il più comune antigene target riconosciuto sia da APF che AKA è la proteina filaggrina (11,12). In particolare questi anticorpi riconoscono la citrullina contenuta in queste proteine, da qui il nome di anticorpi antiproteine citrullinate (ACPA), che attualmente sono considerati un marker sierologico di malattia più specifico dello stesso fattore reumatoide (13).
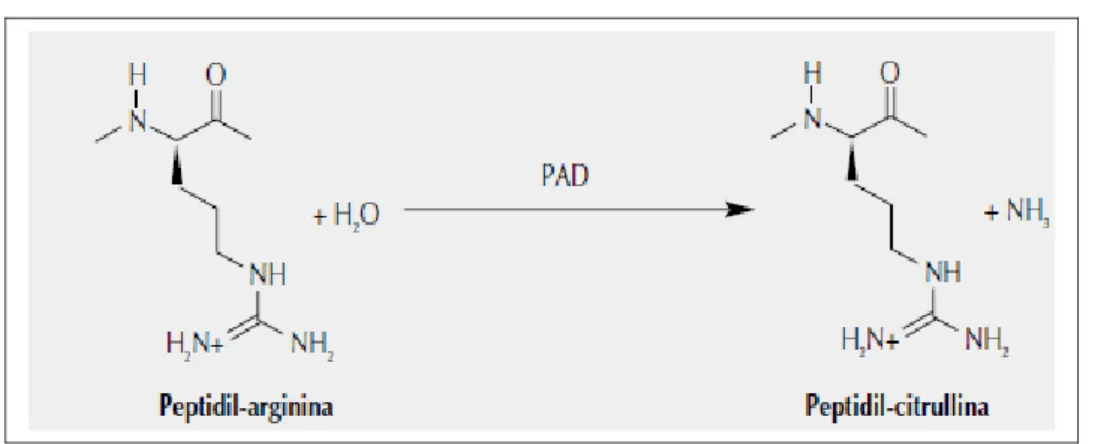
La filaggrina è una proteina ricca di residui di istidina sintetizzata ad opera delle cellule dello strato granuloso dell’epidermide sotto forma di precursore, la profilaggrina, che viene accumulato in specifici organelli citoplasmatici denominati granuli cheratoialini. La profilaggrina, formata da 10-12 molecole omologhe di filaggrina, va incontro a clivaggio con la liberazione delle unità di filaggrina funzionalmente attive (14), e circa il 20 % delle molecole di arginina delle unità di filaggrina così ottenute vengono convertite in citrullina (Vedi Fig.1) .
Figura 1 Conversione dell’arginina in citrullina ad opera di PAD
La citrullinazione delle proteine (sostituzione del residuo argininico con la citrullina attraverso un processo enzimatico di deiminazione, mediante idrolisi del gruppo guanidinico dell’arginina e formazione del gruppo uridico e ammoniaca libera) (15) è un fenomeno naturale che precede la loro denaturazione e digestione proteolitica. Consiste in una modificazione post-trascrizionale in cui un residuo di peptidil-arginina carico positivamente viene convertito in uno neutro di peptidil-citrullina dal complesso enzimatico calcio-dipendente Peptidil-Arginina-Deaminasi (PAD). Tale modificazione ha il potere di alterare la struttura, l’antigenicità e la funzione proteica.
Cinque sono gli isotipi di PAD fino ad oggi identificati nei mammiferi: PAD1, principalmente espresso a livello di epidermide e utero; PAD2 espresso pressoché ubiquitariamente, ed in particolare in macrofagi e astrociti; PAD3 soprattutto negli strati superficiali dell’epidermide e nei follicoli piliferi; PAD4 nei leucociti (granulociti e monociti) (16).
Su PAD6 non ci sono dati sull’espressione in tessuti umani ma l’mRNA di questo enzima è presente nell’ovaio, testicolo e leucociti circolanti (17).
Gli studi volti all’identificazione dell’isotipo di PAD espresso nel tessuto sinoviale infiammato dei pazienti con AR hanno rivelato una preponderanza di PAD2 e PAD4 .
La citrullinazione avviene tipicamente nelle cellule che stanno andando incontro a morte, quando la membrana cellulare permette il trasferimento di ingenti quantità di calcio extracellulare all’interno della cellula (fondamentale per la funzione dell’enzima PAD) o il calcio viene liberato dai depositi intracellulari. Tale modificazione è infatti implicata in diversi processi fisiologici, come gli ultimi stadi della differenziazione dell’epidermide e l’apoptosi. Anche l’infiammazione però è uno dei momenti in cui, sia in modelli animali, sia nella sinovia dei pazienti affetti da AR, è possibile ritrovare proteine citrullinate (18).
Normalmente il sistema immunitario non entra in contatto con tali proteine, che rimangono confinate all’interno delle cellule apoptotiche prima che le cellule stesse vengano fagocitate dai macrofagi; quando invece i meccanismi di clearance diventano inefficienti a causa, per esempio, di una massiva morte cellulare, i PAD e le proteine citrullinate possono uscire dalle cellule ed “incontrare” il sistema immunitario.
E’ stato ipotizzato e in parte verificato che un’iperproduzione di proteine citrullinate (fibrina, vimentina, filaggrina) (19) possa avvenire, nell’ambiente articolare, in certe condizioni che normalmente favoriscono l’insorgenza dell’AR (alcune infezioni virali e batteriche causate ad esempio da EBV, Retrovirus, micobatteri, Chlamydia, traumi, tabagismo) (20).
Come possibili agenti scatenanti della malattia sono stati chiamati in causa numerosi batteri tra cui streptococchi, micoplasma, bacilli difteroidi e Clostridium Perfrigens, Parvovirus B-19, EBV. Quest’ultimo in particolare risponde a tutte le caratteristiche per essere un plausibile candidato agente eziologico di AR. EBV è un herpes virus che infetta circa il 98% della popolazione mondiale. Inizialmente replica nelle cellule dell’epitelio nasofaringeo e nei linfociti B penetrando nelle cellule attraverso il legame tra la glicoproteina gp350 dell’envelope del virus e CD21. Dopo l’infezione primaria, generalmente asintomatica, il virus persiste nelle cellule B in forma latente producendo delle proteine virali come EBNA (EB nuclear antigen), LMA (latent membrane antigen) e TP (terminal protein). Occasionalmente il virus si riattiva con la produzione e l’espressione di proteine strutturali e glicoproteine costituenti l’envelope: VCA (viral capsid antigen), EA (early antigen), MA (membrane antigen). Molti sono gli effetti prodotti da EBV dal punto di vista immunomodulatorio: inibisce infatti l’apoptosi delle cellule B infette
mediante la produzione di un omologo di Bcl-2, produce una citochina virale che, come IL-10, permette al virus di limitare la risposta immune ed infine modula la produzione di citochine pro-infiammatorie come IL-6 e induce la produzione di TNF-alfa da parte delle cellule B infette (21).
Alla base della risposta autoimmune c’è un accertato mimetismo molecolare tra antigeni virali (EBNA-6, sequenze ripetute di glicina-alanina trovate in EBNA-1 e la sequenza QKRAA della glicoproteina virale gp110) e antigeni self (rispettivamente HLA DQ0302, citocheratina e la sequenza QKRAA in HLA-DRB1 04101) (22).
Nei pazienti affetti da AR si riscontra inoltre un elevato titolo anticorpale diretto contro i nuclei delle cellule B infettate da EBV. Nello specifico, l’antigene nucleare era chiamato RANA (rheumatoid arthritis nuclear antigen) e la reattività anticorpale verso i RANA fu confermata in più del 67% dei pazienti affetti da AR (23). Il RANA è stato poi identificato con l’antigene virale EBNA-1; è stato inoltre dimostrato che gli anticorpi, prodotti dalla maggior parte dei soggetti infettati dal virus ma particolarmente elevati nei soggetti con AR, sono diretti contro la parte centrale dell’EBNA 1 che contiene sequenze ripetute di glicina-alanina (24). E’ stato dimostrato che nei pazienti affetti da AR l’infezione da EBV è scarsamente controllata (25). Infatti in colture di cellule B infettate dal virus la frazione di cellule che si trasformano in linee linfoblastoidi è molto maggiore e la
quantità di IFNgamma prodotto dai linfociti T CD8+ è ridotta rispetto al normale.
Infine è stato notato che antigeni derivati da EBV, in particolare EBNA1 ed EBNA2, una volta citrullinati in vitro o in vivo, possano diventare un target per gli ACPA. Anticorpi specifici per EBNA1 o EBNA2 citrullinati reagiscono con altre proteine citrullinate come la fibrina, che è stata proposta come target importante dal punto di vista fisiopatologico nell’AR. Questi dati suggeriscono che l’infezione da EBV possa indurre una risposta immune contro le proteine virali citrullinate che è cross reattiva con proteine citrullinate umane (26,27). Tutte queste osservazioni supportano l’ipotesi di un ruolo importante degli agenti infettivi nella patogenesi della malattia, anche se mancano tuttora delle evidenze conclusive a riguardo.
Non è da sottovalutare infine il ruolo dei fattori ormonali nello sviluppo della malattia che come ricordiamo è prevalente nel sesso femminile con picco di incidenza nel periodo premenopausale.
1.3 Fisiopatologia della Sinovite Reumatoide
L'evento patogenetico più tipico dell'AR è costituito dalla flogosi della membrana sinoviale che riveste le articolazioni diartrodiali, le guaine e le borse tendinee.
In condizioni normali i sinoviociti della membrana sono disposti in un solo strato cellulare. Essi, sotto l’azione delle citochine pro-infiammatorie, cominciano a proliferare e a differenziarsi nei due sottotipi, quello A, trasformandosi poi in macrofagi che contribuiscono ad alimentare il processo flogistico, e quello B, evolvendo in fibroblasti.
Questi ultimi, proliferando, costituiscono il cosiddetto panno sinoviale, fondamentale nel provocare, nelle fasi più avanzate di malattia, la distruzione delle strutture periarticolari (capsula, ligamenti) ed erosioni ossee invadendo la cartilagine ed il tessuto osseo subcondrale.
Fondamentale è anche l’attivazione osteoclastica citochino-mediata, che si realizza a livello dell’osso subcondrale ed il conseguente riassorbimento osseo locale è prodromico alla formazione delle erosioni.
Si possono distinguere tre fasi patogenetiche dell'AR: una fase di induzione della risposta immune innata a stimoli patogeni, con alterazioni iniziali dei sinoviociti e dei capillari sinoviali, evidenziata dai segni di iperplasia sinoviale e dai depositi di fibrina; una fase infiammatoria ovvero della risposta immune antigene-specifica, con richiamo nella membrana sinoviale di leucociti polimorfonucleati; una fase "mesenchimale" o distruttiva , in cui il ruolo principale e' giocato
da fibroblasti e sinoviociti, che determinano l'automantenimento e la persistenza del processo di sinovite.
Queste tre fasi sono strettamente legate ai cinque stadi della sinovite reumatoide, a ognuno dei quali corrisponde un preciso stadio istopatologico, clinico e radiologico.
STADIO 1 : fase di riconoscimento immunitario, asintomatica e priva di manifestazioni istopatologiche e radiologiche.
STADIO 2: inizia la formazione del panno sinoviale con iperplasia dei sinoviociti e formazione dei "villi sinoviali", che sono estroflessioni digitiformi della membrana sinoviale costituiti da uno stroma di tessuto connettivo di tipo fibroblastico in cui sono immersi vasi neoformati e rivestito di sinoviociti pluristratificati.
Iniziano a comparire sintomi come astenia e rigidità mattutina, lieve tumefazione e dolorabilità alla digitopressione di alcune piccole articolazioni (mani,polsi,piedi) che sono interessate per prime dal processo morboso. Non vi sono alterazioni radiologiche.
STADIO 3: compare il dolore articolare e si fanno evidenti la tumefazione e il calore. Si ha limitazione funzionale per accumulo di liquido e proliferazione dei tessuti molli all'interno del cavo articolare. Radiologicamente si nota un lieve ispessimento delle capsule articolari.
STADIO 4 : si ha l'organizzazione del processo proliferativo sinoviale. Il panno sinoviale che è un tessuto di granulazione destruente, invade la cartilagine ialina articolare, i tendini e l'osso subcondrale.
Si ha maggiore limitazione delle articolazioni colpite. Radiologicamente si ha riduzione dello spazio articolare dovuta ai processi distruttivi a carico della cartilagine, con segni di osteoporosi periarticolare.
STADIO 5: il tessuto granulomatoso invade la cartilagine e l'osso subcondrale. Clinicamente vi è un'ulteriore perdita di funzione, una notevole limitazione dei movimenti e lo sviluppo di deformità. L'esame radiologico documenta un'ulteriore riduzione dello spazio articolare e l'iniziale comparsa di erosioni (28).
Le cellule infiammatorie che partecipano al processo flogistico dell’AR, e in particolare i linfociti T e B, si trovano ben rappresentate a livello della membrana sinoviale proliferante. Talora, quando sono particolarmente numerose, si organizzano in strutture pseudofollicolari che contraddistinguono le varianti più aggressive della malattia e rappresentano un fattore prognostico sfavorevole. Le cellule mononucleate sono prevalentemente linfociti T CD4+ in prossimità di macrofagi HLA-DR e cellule dendritiche. Lo stato funzionale di questi linfociti conferma una loro attivazione cronica
indicata dall’espressione di markers attivatori come HLA-DR e altre molecole di membrana.
Con la cronicizzazione dell’infiammazione si assiste all’iperplasia di sinoviociti con stroma sinoviale che viene pian piano occupato da cellule infiammatorie che si aggregano in sede perivascolare.
Dal punto di vista molecolare la flogosi responsabile della fibrosi sinoviale e la conseguente distruzione cartilaginea è causata dall’attivazione dei linfociti T da parte di macrofagi e cellule dendritiche stimolati da auto antigeni. Ciò comporta una risposta autoimmune che produce una grande secrezione intrarticolare da parte delle cellule T e macrofagi di citochine infiammatorie, che provocano la cronicizzazione della flogosi sinoviale, attivano la proliferazione dei sinoviociti e inducono riassorbimento condrale ed osseo.
Le stesse citochine infiammatorie inducono un’ulteriore attivazione di macrofagi, fibroblasti, neutrofili,linfociti e cellule endoteliali che amplificano il processo flogistico attraverso la secrezione di fattori chemiotattici, enzimi proteolitici e ulteriori mediatori flogistici.
Tra le citochine maggiormente rappresentate nella sinovite cronica si ritrovano IL-1 (promuove l’attivazione di leucociti, cellule endoteliali, condrociti e osteoclasti), IL-2, IL-6, IL-8, TNFα (favorisce la degradazione cartilaginea per apoptosi condrale), IL-17 (sinergizza con TNFα promuovendo l’attivazione dei fibroblasti e dei condrociti), GM-CSF, metalloproteasi (collagenasi e stromelisina), PGE2
(fondamentale per il riassorbimento di calcio osseo e l’inibizione della sintesi di proteoglicani da parte dei condrociti) (29).
TNFα gioca un ruolo fondamentale nell’induzione di altre citochine, delle chemochine e delle molecole di adesione endoteliali, nel promuovere l’angiogenesi, nel ridurre l’espansione di cellule T regolatorie e nella comparsa del dolore. Analogamente IL-6 comporta l’attivazione dei leucociti a livello locale e essendo fattore stimolante i B linfociti sostiene la produzione di autoanticorpi; media inoltre gli effetti sistemici della fase acuta come l’anemia, disfunzioni cognitive e disregolazione del metabolismo lipidico.
La produzione di fattori osteoclastogenici come RANKL rappresenta infine la causa principale delle erosioni sub condrali e della formazioni di lacune ossee.
L’attivazione dei meccanismi umorali comporta la produzione all’interno della membrana sinoviale del fattore reumatoide favorendo la formazione di immunocomplessi (IgM-IgG) e la loro successiva fagocitosi da parte di PMN e aumentando la permeabilità vasale. Gli IC si depositano in cavità articolare inducendo la liberazione di chinine, enzimi lisosomiali e ROS, capaci a loro volta di stimolare ulteriormente i sinoviociti a secernere PG e enzimi proteolitici e i fibroblasti a secernere TGFβ e depositare una matrice connettivale più spessa. Si avrà dunque una inarrestabile distruzione della cartilagine
per eccesso di proteasi e di mediatori solubili in cavità articolare e le caratteristiche erosioni condrali e subcondrali.
1.4
Quadro clinico
L'esordio della malattia è estremamente variabile, ma avviene di solito in modo lento e graduale, con sintomi aspecifici, come malessere generale, astenia, anoressia, febbre, dolori muscolari. A tali sintomi si associano i sintomi articolari, costituiti principalmente da rigidità (specie mattutina, con difficoltà a compiere movimenti anche semplici), dolore e gonfiore articolare. In genere vengono colpite più articolazioni dopo una fase più o meno lunga di impegno oligoarticolare e le prime interessate sono più spesso quelle di polsi, mani e piedi.
Le caratteristiche della poliartrite sono la distribuzione simmetrica, l’andamento centripeto (cioè sono coinvolte prima le piccole articolazioni di mani e piedi e successivamente le più prossimali degli arti), e il carattere aggiuntivo (cioè la tendenza a colpire sempre nuove articolazioni senza risoluzione del processo morboso nelle sedi precedentemente interessate).
In ordine di frequenza vengono colpite le interfalangee prossimali (IFP) delle mani, le metacarpofalangee (MCF), i polsi, le metatarsofalangee (MTF) e interfalangee prossimali dei piedi, le ginocchia, i gomiti, le caviglie.
Il sintomo principale è il dolore, spontaneo e continuo, aumentato dal movimento e dal carico; altro sintomo è la rigidità articolare, più pronunciata dopo lunga inattività e quindi in particolare al mattino, generalmente di lunga durata (2-3 ore); i pazienti lamentano inoltre debolezza e facile stancabilità nell’eseguire i movimenti articolari. Come segni si associano tumefazione (meglio apprezzabile sulla superficie estensoria dove la capsula articolare è più distendibile), rossore e calore della cute soprastante; si può avere inoltre, sin dalle prime fasi di malattia, una limitazione funzionale dovuta alla sinovite, al versamento e alla contrattura muscolare antalgica.
E’ anche vero però che nelle fasi iniziali o in caso di remissione anche parziale tali caratteri possono mancare o essere poco evidenti.
Una sindrome del tunnel carpale causata da una tenosinovite dei flessori contraddistingue non raramente l’esordio insidioso della malattia. Meno spesso l’esordio è acuto e poliarticolare ab initio.
Una AR non adeguatamente diagnosticata e trattata è destinata ad un’evoluzione in deformità delle lesioni articolari in un tempo più o meno lungo. Le alterazioni anatomopatologiche responsabili di questa evoluzione si realizzano però in un periodo relativamente breve (circa
2 anni dall’esordio). Le deformità articolari sono fortemente invalidanti e presentano aspetti esclusivi della malattia.
La mano “a colpo di vento” (deviazione ulnare delle dita.), il dito “a collo di cigno” (iperestensione delle IFP e iperflessione delle IFD), “a bottoniera” (iperflessione con rigidità delle IFP e iperestensione delle IFD), il segno del “tasto di pianoforte” all’epifisi ulnare, il pollice a “Z”, iperflessione della MCF del I dito e iperestensione della IF; la mano a “gobba di dromedario”, sublussazione volare dei metacarpi sul carpo; la mano a “gobba di cammello”, se alla precedente deformità si associa la sublussazione volare delle falangi prossimali sulle teste metacarpali; sono alcune, ma non le sole, deformità possibili.
Il versamento articolare è di solito presente, ma evidenziabile clinicamente solo nelle grandi articolazioni.
Colpiti con minore frequenza, e di solito in fasi più avanzate di malattia, sono le ginocchia, i gomiti, le spalle, le anche, le articolazioni sterno-clavicolari e temporo-mandibolari.
Lo scheletro assiale è risparmiato se si esclude un interessamento, di solito in fasi avanzate, dell’articolazione atlantoepistrofea, che può provocare sublussazione della stessa e compressione midollare.
Oltre alle strutture articolari la malattia può colpire tendini, guaine tendinee e borse sierose dando luogo a frequenti tenosinoviti (che più spesso coinvolgono le mani e i polsi) e borsiti (olecranica, sottoacromiale e trocanterica).
Un impegno iniziale dei cingoli scapolo-omerale e coxo-femorale è più tipico delle forme a inizio tardivo (oltre i 60 anni), e pone importanti problemi di diagnostica differenziale con la polimialgia reumatica.
Si possono avere inoltre manifestazioni extra-articolari piuttosto frequenti come ad esempio sierositi (pleuriti, pericarditi), manifestazioni legate all’impegno vasculitico ( fenomeno di Raynaud, ulcere e necrosi digitale, ulcere vasculitiche degli arti, neuropatie periferiche, nodulosi reumatoide), impegno renale (amiloidosi renale, nefropatia da FANS), impegno polmonare (ipertensione polmonare, noduli reumatoidi polmonari, alveoliti e fibrosi polmonare caratteristici della Sindrome di Caplan), impegno muscolare (sarcopenia) e osseo (osteoporosi), impegno esocrino (sindrome sicca). Infine, una lieve splenomegalia e linfadenopatia caratterizzano il morbo di Still (febbre elevata, rush cutaneo sincrono alle puntate febbrili, poliartrite fugace e non erosiva, linfoadenomegalia, splenomegalia e leucocitosi) e quello di Felty (noduli reumatoidi sottocutanei, splenomegalia e neutropenia).
L’AR è inoltre associata ad un’aumentata frequenza di eventi cardiovascolari come infarto, scompenso cardiaco ed eventi cerebro-vascolari. Ciò avviene perchè il quadro infiammatorio caratteristico della malattia che include citochine, immunocomplessi e reagenti di
fase acuta altera il profilo lipidico aumentando l’attivazione endoteliale e rendendo le placche ateromasiche instabili.
Nonostante la presenza di sintomi abbastanza chiari, il 25% circa dei malati arriva allo specialista quando la malattia è già in fase avanzata e il danno è già consolidato. Il ritardo può causare danni permanenti a ossa, cartilagini e altri tessuti. Se si interviene tempestivamente, invece, con i farmaci attualmente disponibili è possibile controllare la progressione della malattia e prevenire la comparsa degli effetti più gravi. Perciò è fondamentale una diagnosi precoce.
1.5 Diagnosi
Sulla base delle attuali conoscenze sulla patogenesi e l’evoluzione clinica, risulta evidente come una diagnosi precoce di malattia sia la base essenziale per poter instaurare un trattamento tempestivo in grado di contrastare l’evolutività delle lesioni articolari, cioè di poter sfruttare appieno la cosiddetta window of opportunity, la finestra temporale in cui si ha ancora l’opportunità di arrestare il processo patologico prima che il danno che esso provoca diventi irreversibile. Come strumento diagnostico sono ancora utilizzati nella clinica i Criteri Classificativi dell’American College of Rheumatology (ACR) del 1987 (30) in base ai quali si fa diagnosi di AR in presenza di
almeno 4 dei seguenti 7 punti, considerando che i criteri dall’1 al 4 devono essere presenti da almeno 6 settimane:
1 presenza di rigidità mattutina della durata di almeno 1 ora;
2 artrite di almeno 3 aree articolari (comprese tra IFP, MCF, polsi, gomiti, ginocchia, caviglie, anche, MTF);
3 artrite delle articolazioni delle mani (almeno una tra IFP, MCF, polsi);
4 artrite simmetrica (simultaneo interessamento di aree articolari da ambo i lati del corpo);
5 presenza di noduli reumatoidi;
6 presenza di fattore reumatoide sierico (FR);
7 presenza di alterazioni radiologiche (erosioni e/o decalcificazioni nelle radiografie in proiezione antero-posteriore della mano e del polso).
Questi criteri però consentono di giungere alla diagnosi troppo tardivamente per permettere di impostare una terapia realmente efficace. Negli ultimi anni si è andato sempre più affermando il concetto di early arthritis, che definisce forme di artrite molto precoce nelle quali si deve poi valutare la potenziale evoluzione verso una vera forma di AR, e in particolare verso una forma di AR aggressiva.
Sono stati dettati i criteri clinici per definire la early arthritis: si raccomanda di inviare a valutazione specialistica tutti i pazienti con
un’ artrite che interessa tre o più sedi articolari, con preferenziale interessamento delle metacarpofalagee o metatarsofalangee valutato con “la manovra della gronda” (squeeze test: esercitando una pressione latero-laterale delle metacarpofalangee o delle metatarsofalangee in caso di flogosi articolare di possibile natura reumatoide comparirà dolore); e con una rigidità mattutina di oltre 30 minuti, essendo questi i pazienti a più alto rischio di sviluppare una AR conclamata.
1.5.1.Test di laboratorio per diagnosi di AR
A tutti questi fattori vanno aggiunti gli indici di flogosi (velocità di eritrosedimentazione, C3, fibrinogeno, α-2-globuline e γ-globuline), da valutare inoltre la sideremia e l’emoglobina (ridotte proporzionalmente all’intensità della flogosi per iperattività del sistema reticoloendoteliale e per alterazione del metabolismo del ferro); l’eventuale piastrinosi (per iperconsumo periferico e conseguente iperproduzione di compenso); l’alto numero di articolazioni coinvolte, la precoce rilevazione radiologica di erosioni articolari, la presenza di un fattore reumatoide (autoanticorpo di classe IgM, IgG o IgA che reagisce contro il frammento costante Fc delle immunoglobuline di classe IgG) ad alto titolo e la presenza di anticorpi antiproteine citrullinate (ACPA).
Nel porre la diagnosi di AR come quadro clinico a sé stante è necessario poter escludere con sicurezza altre forme di artrite: in tale
percorso diagnostico il laboratorio gioca un ruolo importante con la determinazione del fattore reumatoide (FR), anticorpo di classe IgM rilevabile nel 60-80% dei pazienti con AR (31).
Il FR è un marcatore sensibile ma non molto specifico poiché esso viene riscontrato anche nel 5% dei soggetti sani. Inoltre la frequenza del FR nella popolazione generale aumenta con l’età (il 10-20% dei soggetti sopra i 65 anni presenta un test positivo), e anche numerose altre condizioni patologiche si associano alla sua presenza (Lupus eritematoso sistemico-LES, sindrome di Sjogren, Sclerosi sistemica, Connettivite mista, infezioni virali come epatiti, HIV, EBV, infezioni parassitarie o batteriche).
Data la scarsa specificità si è ritenuto necessario ricercare anticorpi dotati di una maggiore specificità oltre che un’elevata sensibilità. Sono stati così scoperti gli APF (anti-fattore perinucleare) e gli AKA (anti- cheratina) (9,10) aventi entrambi come bersaglio la profilaggrina, gli AFA (anti-filaggrina), mai utilizzati nella pratica clinica per la difficoltà nel reperimento dei substrati, infine, agli inizi degli anni ‘90 gli anti-CCP (anti-peptide ciclico citrullinato) utilizzati per testare sieri umani tramite ELISA (32).
Sono stati prodotti kit di seconda e terza generazione con caratteristiche di sensibilità e specificità sempre maggiori (del 70% e 96% rispettivamente) e nel 2007 sono stati inseriti dalla European
League against Rheumatism nelle nuove linee guida per una diagnosi precoce di AR (33).
Gli anti-CCP sono infatti risultati predittivi dello sviluppo di AR: due diversi studi, che utilizzavano entrambi campioni sierici di pazienti con AR che erano stati donatori di sangue negli anni precedenti all’analisi, hanno riportato la presenza di anticorpi anti-CCP molto prima dell’esordio clinico della malattia (circa 10 anni prima) (34,35); la positività degli anti-CCP inoltre aumentava gradualmente negli anni fino alla presentazione dei primi sintomi.
Gli anticorpi anti peptidi citrullinati (ACPA) sono caratterizzati da una specificità di oltre il 90% per AR e sono rilevabili ad uno stadio molto precoce, subclinico della malattia (36). Circa il 70% dei pazienti con AR sono positivi per ACPA a fronte di solo il 2% dei soggetti di controllo.
La loro determinazione risulta quindi utile nella diagnosi della AR e in particolare nei casi di artriti erosive ed anche nella poliartrite giovanile simil-reumatoide.
Appaiono, inoltre, utili nel differenziare le collagenopatie con artrite concomitante dalla AR (37).
Esistono poi forme overlap di AR e LES caratterizzate da un’artrite erosiva (la sindrome denominata Rhupus), in cui gli ACPA sono presenti con una certa frequenza (57% dei pazienti), non pari a quella dei pazienti con sola AR (86%), ma comunque piuttosto alta (38).
Circa il 50-70% di pazienti con AR sono ACPA+. Nonostante la presentazione clinica nella fase precoce di malattia sia molto simile tra pazienti ACPA+ e ACPA-, il decorso dell’AR appare invece molto diverso (39). Infatti la positività degli ACPA è associata con un alto rischio di infarto cardiaco e patologia polmonare,con lo sviluppo molto precoce di erosioni gravi e con un conseguente trattamento terapeutico aggressivo rispetto ai pazienti ACPA-. La sieroconversione da ACPA+ a ACPA- appare molto inusuale.
Nei pazienti ACPA + il titolo anticorpale appare incrementare nella fase preclinica, circa due anni prima dalla comparsa della sintomatologia, mantenendo però un titolo relativamente basso e una limitata “varietà” anticorpale; il titolo aumenta poi nella fase clinica stabilizzandosi su un livello abbastanza elevato. Alti titoli di ACPA sono associati con il riconoscimento di molti epitopi citrullinati e con un elevato rischio di sviluppare artriti. Secondo alcuni studi, la positività al test nei casi di artrite precoce è correlabile al successivo sviluppo di lesioni erosive ossee a livello delle articolazioni.
La produzione di autoanticorpi di elevata affinità deriva dallo switch isotipico che normalmente avviene nel centro germinativo. Gli ACPA appartengono a tutti gli isotipi di immunoglobuline (IgG, IgA, IgM, IgE) (27,40,41). Nei pazienti con AR ACPA + nel 99% dei casi si tratta di IgG (in particolare IgG1 e IgG4). Successivamente all’ ipermutazione somatica, diversi cloni di cellule B competono per
l’antigene presentato dalle cellule dendritiche e solo le cellule B che esprimono immunoglobuline con avidità sufficientemente alta per i peptidi sopravvive, quelle con bassa avidità non verranno stimolate e scompariranno dalla popolazione.
Gli ACPA presentano un importante valore prognostico sull'evoluzione di danni articolari rilevabili radiologicamente e la loro determinazione quantitativa è utile nel controllo e monitoraggio della terapia farmacologica. L'utilizzo insieme alla determinazione del FR massimizza il rapporto sensibilità/specificità. Non va dimenticato infatti che il 20% delle AR sono FR-negative e che il 15-20% delle AR sono positive al solo FR.
La contemporanea positività a FR e ACPA ha un valore predittivo positivo quasi del 100%.
La produzione anticorpale è strettamente dipendente dal background genetico del paziente, avviene cioè solo nei soggetti che possiedono alleli HLA II recanti lo “shared epitope”.
Esistono dunque due tipi di malattia: l’AR ACPA positiva e l’AR ACPA negativa; la prima che, come detto, è associata alla presenza dello “shared epitope” ed è presente in più dei due terzi dei pazienti; la seconda, senza associazione con lo “shared epitope” ma associata invece al DRB1*03.
Al momento esistono vari metodi per determinare gli ACPA (24): il primo metodo sviluppato (il CCP) utilizza un peptide ciclico derivato
dalla filaggrina. Utilizzando la prima generazione di questo test (CCP1) era possibile raggiungere una sensibilità pari al 68% con specificità del 97-98% per AR. Per aumentare la sensibilità del test è stata messa in commercio la seconda generazione (CCP2) con la quale siamo in grado si ottenere una sensibilità paragonabile a quella del fattore reumatoide (intorno all’80%) mantenendo però una specificità molto alta (98%) (32). In aggiunta sono stati resi disponibili metodi basati su substrati diversi dalla filaggrina e dai peptidi ciclici da essa derivati. Un metodo è basato sulla vimentina ricombinante deiminata (MCV) (42), un altro utilizza peptidi virali citrullinati (VCP) (26,27), un altro sfrutta peptidi
sintetici, derivati dalla proteina istonica H4
(HCP) (43).
Molti altri antigeni deiminati possono essere utilizzati per misurare ACPA: il fibrinogeno/fibrina, il collagene di tipo II e l’α-enolasi, tutte proteine espresse a livello articolare; la fibrina in particolare si trova in quantità aumentate nella sinovia dell’AR (44). In tutti i casi si tratta di antigeni self tranne che per i VCP, che derivano da proteine codificate dal virus di Epstein-Barr.Il titolo di anticorpi reattivi con questi vari substrati è simile: i vari metodi per la rilevazione di ACPA sono tutti fortemente correlati fra di loro. Esistono però sieri che reagiscono in modo differente con i vari substrati, indicando quindi che gli ACPA costituiscono una famiglia di anticorpi con specificità simili ma non identiche. La reattività di un siero con differenti antigeni citrullinati può dipendere
dalla presenza di una singola popolazione di anticorpi cross-reattivi con antigeni diversi, oppure dall’esistenza di diverse popolazioni anticorpali, ciascuna delle quali può reagire con uno specifico antigene. E’ stato dimostrato che alcuni sieri di AR contengono anticorpi crossreattivi, mentre altri contengono popolazioni indipendenti di ACPA (27,45).
L’identificazione di molti antigeni citrullinati candidati potrebbe suggerire che sia la mera presenza della citrullina a conferire l’antigenicità e che le molecole su cui tale residuo si trova siano in realtà insignificanti. D’altra parte però, e questo concetto ha maggiori evidenze a suo supporto, si è visto che la risposta anticorpale nell’AR sembra determinata dalla presenza di residui citrullinati ma che questi si debbano trovare vicini ad alcuni particolari aminoacidi nelle sequenze peptidiche degli antigeni chiamati in causa; cioè la citrullina deve trovarsi in un appropriato “ambiente aminoacidico” affinchè possa agire da innesco per la risposta anticorpale (19).
I dati più recenti sulla crossreattività degli anticorpi supportano invece la tesi che sia l’intera molecola antigenica, piuttosto che lo specifico epitopo contenente la citrullina, a guidare la risposta autoimmune. Esiste quindi un generale consenso sul fatto che l’autoimmunità specifica dell’AR sia caratterizzata dalla reattività verso una “famiglia” di antigeni strutturalmente o funzionalmente correlati.
1.5.2. Diagnosi con imaging
La diagnosi di AR, fatta in prima linea con dati clinici e di laboratorio, si affianca a tecniche di imaging.
L’esame radiografico diretto è l’indagine di prima istanza, in parallelo alla valutazione clinica e laboratoristica, per valutare il danno articolare.
Esso è particolarmente utile per il follow-up della malattia, per definire la severità e per determinare l’efficacia della terapia farmacologica.
Alcune tecniche, in particolare la risonanza magnetica nucleare con mezzo di contrasto (RMN) e l’ecografia articolare con sonde ad alta frequenza e utilizzo del segnale Power Doppler, consentono di individuare più precocemente della radiografia tradizionale la presenza di erosioni all’esordio.
La valutazione ecografica articolare sta assumendo un’importanza sempre maggiore; essa permette di riconoscere l´edema infiammatorio capsulo-sinoviale, la sinovite, la valutazione della vascolarizzazione, le alterazioni della cartilagine articolare, le erosioni ossee ed offre la possibilità di uno studio dinamico dell’articolazione, oltre che un’approfondita valutazione di tendini e guaine tendinee. L’ecografia inoltre, si è mostrata più sensibile dell’esame obiettivo nell’evidenziare la presenza di sinovite a carico delle piccole e delle grosse articolazioni.
Negli ultimi anni sta assumendo un ruolo sempre più importante l’ecografia power doppler (EPD). Essa permette, rispetto all’ecografia articolare convenzionale, di valutare e di acquisire informazioni sulla vascolarizzazione dei tessuti molli, sulla morfologia e sulle modificazioni della sinovia.
La RMN in particolare è in grado di valutare la membrana sinoviale, l’entità della vascolarizzazione e la presenza di edema dell’osso, costituendo un valido ausilio diagnostico nelle fasi precoci di malattia. Inoltre, trova applicazione nella precisa definizione di talune complicanze, quali la sublussazione atlo-occipitale o l’osteonecrosi (46).
S
COPO DELLA TESILo scopo di questo lavoro di tesi è:
- valutare la presenza di ACPA in sieri di soggetti affetti da AR, utilizzando substrati che sono probabilmente rilevanti per la patogenesi della malattia, e cioè peptidi derivati da proteine virali codificate dal virus di Epstein Barr e peptidi di origine istonica.
- correlare la presenza di ACPA determinati con 4 metodi diversi con le caratteristiche cliniche e sierologiche dell’AR.
C
APITOLO3
P
AZIENTI E METODI3.1 Pazienti
Sono stati studiati sieri ottenuti da 198 pazienti affetti da AR seguiti presso le Unità di Immunologia Clinica e Reumatologia dell’Università di Pisa, in cui la diagnosi di AR era stata posta sulla base dei criteri ACR, e da 50 soggetti sani.
I pazienti, di cui 50 uomini e 148 donne, hanno un’età media di 60,5 anni.
Tali prelievi sono stati centrifugati e conservati a -20°C fino al momento dei test.
3.2 test-Elisa
Gli anticorpi anti-proteine/peptidi citrullinati sono stati ricercati nei sieri dei pazienti AR mediante un test-ELISA INDIRETTO il quale determina se un anticorpo specifico è presente in un campione.
Un test elisa indiretto è costituito da diverse fasi:
•
Coating
Il coating consiste nel rivestimento della piastra con l’antigene. La proteina che costituisce l’antigene verso il quale sono diretti gli anticorpi di interesse, viene fatta adsorbire sul fondo dei pozzetti delle piastre per ELISA (Vedi Fig. 3.1).
Figura 3.1 Coating dell’antigene
Normalmente questo avviene per mezzo di legami aspecifici tra la proteina stessa e il materiale di cui è composta la piastra.
Questi legami sono facilitati dal pH del tampone nel quale viene fatta avvenire la reazione.
• Saturazione
La procedura di coating non permette di saturare interamente i siti reattivi della piastra. Ogni spazio della piastra non occupato dall’antigene permette l’adsorbimento di altre proteine, che possono provocare una reazione aspecifica delle varie componenti del test.
La saturazione serve quindi a ricoprire completamente il fondo del pozzetto riducendo in questo modo la possibilità che nelle fasi successive abbiano luogo legami di tipo aspecifico (Vedi Fig. 3.2). La scelta dell’agente saturante è empirica.
• Diluizione del siero
Anche la diluizione si sceglie in maniera empirica, ed è basata su prove con diluizioni variabili del siero.
Figura 3.3 Anticorpo primario
Il tampone di diluizione ha un pH neutro e contiene l’agente saturante in concentrazioni minori rispetto al tampone di blocco e un detergente non ionico tipo Tween-20 (Vedi Fig. 3.3).
• Lavaggi dei pozzetti
Sia al termine del periodo di incubazione con i sieri, che dopo il periodo di incubazione con l’anticorpo secondario coniugato, si effettuano tre lavaggi per rimuovere gli anticorpi che eventualmente non si sono legati o si sono legati in modo aspecifico.
• Incubazione dell’anticorpo secondario coniugato con l’enzima
L’anticorpo secondario rappresenta il mezzo utilizzato per svelare la presenza nel siero in esame degli anticorpi antigene-specifici.
Figura 3.4 Anticorpo secondario
Nel dosaggio ELISA indiretto gli anticorpi secondari sono marcati con un enzima e sono diluiti nello stesso tampone in cui si diluisce il siero.
• Sviluppo del test
Lo sviluppo è quel processo attraverso il quale è possibile mettere in evidenza il legame fra gli anticorpi eventualmente presenti nel siero del soggetto e l’antigene specifico utilizzato per il coating della piastra ELISA. Si usa a tale scopo un substrato specifico per l’enzima coniugato all’anticorpo secondario.
• Lettura
Il test ELISA è un saggio di tipo colorimetrico per cui è necessaria la lettura con lo spettrofotometro ad una lunghezza d’onda opportuna.
3.3 Sintesi dei peptidi
I quattro peptidi citrullinati utilizzati durante i saggi sono: HCP1 e HCP2 derivati dall’istone H4;
VCP1 e VCP2 derivati da proteine virali dell’Epstein Barr Virus.
Sono stati ottenuti presso Toscana Biomarkers s.r.l. (Siena) mediante sintesi su fase solida utilizzando aminoacidi F-moc secondo il metodo di Merrifield modificato da Atherton; tali peptidi sono stati disegnati come peptidi antigenici multipli (MAP), in cui quattro sequenze identiche sono sintetizzate su un’impalcatura di lisine e alanine (-K2KβA).
HCP1 e HCP2 sono peptidi sintetici, derivati dalla proteina istonica H4; VCP1 è un peptide sintetico, derivato da una delle proteine nucleari codificata dal virus di Epstein-Barr, l’EBNA 1; VCP2, è un eptide derivato da un’altra proteina nucleare codificata dal EBV, la proteina EBNA2. Ogni peptide è stato sintetizzato sostituendo ogni arginina della sequenza con la citrullina.
3.3.1 Determinazione degli anticorpi VCP1 e anti-VCP2
Gli anticorpi anti-VCP1 e VCP2 sono stati ricercati attraverso metodica ELISA. Peptidi sintetici lineari multipli, derivati dalle proteine EBNA 1 e 2, in cui tutti i residui di arginina sono stati sostituiti con citrulline, sono stati diluiti in PBS alla concentrazione di 10 mg/ml e caricati su piastre da 96 pozzetti NUNC Maxisorp.
Dopo aver bloccato le piastre con PBS BSA al 3%, i sieri diluiti 1:200 in PBS, BSA 1%, Tween 0.05%, sono stati incubati per 3 ore a temperatura ambiente.
Dopo lavaggi con PBS Tween 1% e PBS semplice, le piastre sono state incubate con il secondo anticorpo, anti-human IgG F(ab’)2 coniugato con fosfatasi alcalina e diluito 1:3000 in PBS BSA 1% Tween 0.05%, per 3 ore a temperatura ambiente.
Dopo nuovi lavaggi l’attività dell’enzima legato è stata misurata utilizzando come substrato il paranitrofenilfosfato. I risultati sono espressi come percentuale di un controllo positivo interno: la soglia di positività del test è risultata essere 27% per gli anti-VCP1 e 13% per gli anti-VCP2 (valore fissato al 97.5° percentile di una popolazione di controlli sani).
3.3.2 Determinazione degli anticorpi HCP1 e anti-HCP2
Gli anticorpi anti-HCP1 e anti-HCP2 sono stati ricercati attraverso metodica ELISA. Peptidi sintetici lineari multipli, derivati dalla proteina istonica H4, in cui tutti i residui di arginina sono stati sostituiti con citrulline, sono stati diluiti in PBS alla concentrazione di 10 mg/ml e caricati su piastre da 96 pozzetti NUNC Maxisorp.
Dopo aver bloccato le piastre con PBS gelatina 1%, i sieri diluiti 1:200 in PBS, gelatina 0.5%, Tween 0.05%, sono stati incubati per 3 ore a temperatura ambiente.
Dopo lavaggi con PBS Tween 1% e PBS semplice, le piastre sono state incubate con il secondo anticorpo, anti-human IgG F(ab’)2 coniugato con fosfatasi alcalina e diluito 1:3000 in PBS gelatina 0.5% Tween 0.05%, per 3 ore a temperatura ambiente.
Dopo nuovi lavaggi l’attività dell’enzima legato è stata misurata utilizzando come substrato il paranitrofenilfosfato. I risultati sono espressi come percentuale di un controllo positivo interno: la soglia di positività del test è risultata essere 12% per gli anti-HCP1 e 18% per gli anti-HCP2 (valore fissato al 97.5° percentile di una popolazione di controlli sani).
3.3.3 Determinazione degli anticorpi anti-CCP2
Abbiamo utilizzato il kit commerciale QUANTA-Lite (Germany), seguendo le istruzioni allegate; i risultati sono espressi in unità arbitrarie, calcolati sulla base di una curva di calibrazione interna al test; sono considerati negativi i valori inferiori a 20U.
3.4 Analisi statistica
I dati sono stati analizzati mediante test non parametrici (Kruskal-Wallis test, Mann- Whytney test). E’ stato considerato come significativo un valore di p<0,05.
R
ISULTATI4.1 Caratteristiche cliniche dei pazienti
Lo studio è stato condotto su 198 pazienti affetti da artrite reumatoide, seguiti presso gli ambulatori di Immunologia Clinica e di Reumatologia dell’Università di Pisa. La diagnosi è stata fatta in accordo con i criteri di classificazione ACR. I dati clinici e sierologici sono stati ottenuti al momento del prelievo, mentre per quanto riguarda gli esami radiologici sono stati considerati quelli eseguiti nel corso dell’ultimo anno. Nei pazienti sono stati valutati il coinvolgimento sistemico (xerostomia, xeroftalmia, vasculite periferica, noduli reumatoidi, impegno polmonare), l’attività di malattia (livelli di proteina C reattiva, presenza di artrite attiva) e la severità della malattia (presenza di erosioni ossee nell’esame radiografico di mani e piedi). Sono stati inoltre raccolti dati sull’abitudine al fumo, al momento del prelievo o negli anni precedenti. Le caratteristiche demografiche e i dati clinici dei pazienti sono riportati nella Tabella I.
Il gruppo dei controlli è costituito da 50 soggetti sani (NHS), donatori del Centro Trasfusionale dell’Ospedale S.Chiara.
Parametri N° %
N. pazienti 198
F:M 148:50
Età media (aa) ± DS (range) 60,5 ± 12,8
Durata malattia media (aa)±DS (range) 11 ± 10
Positività FR (>40UI) 82/132 62,0 Aumento PCR (>5g/ml) 76/ 122 62,3 Xerostomia 35/116 30,2 Xeroftalmia 36/116 30,0 Xerostomia + xeroftalmia 27/115 23,5 Vasculite periferica 6/115 5,2 Noduli reumatoidi 49/112 43,8 Artrite simmetrica 155/179 86,6 Artrite attiva 81/137 63,4 Artrite erosiva 109/153 71,1 Impegno polmonare 27/77 35,0 Fumatore attivo 26/ 128 20,3 Fumatore attivo + ex 49/129 38,0
4.2 Distribuzione degli anticorpi nella popolazione di
AR
Sono stati analizzati mediante test ELISA gli anticorpi anti-VCP1, VCP2, HCP1 e HCP2 nel siero dei 198 pazienti e dei 50 NHS.
Il limite superiore della norma (o valore soglia) è stato posto al 97.5° percentile della popolazione di controllo costituita da soggetti sani. Sempre mediante test ELISA sono stati valutati gli anticorpi anti-CCP, utilizzando un kit diagnostico (CCP2 assay) secondo le specifiche della ditta produttrice.
Il seguente grafico riporta invece le distribuzioni degli anticorpi anti-VCPs e anti-HCPs nei soggetti sani e nelle AR. L’analisi statistica di Kruskal Wallis e la comparazione secondo il metodo di Dunn dimostrano che esiste una differenza statisticamente significativa (p<0,0001) tra i soggetti sani e le AR per ogni anticorpo analizzato.
Parametri N° % Positività Anti VCP1 104/198 52,5 Positività Anti VCP2 119/198 60,1 Positività Anti VCP 125/198 63,1 Positività Anti HCP1 114/198 57,6 Positività Anti HCP2 115/ 198 58,1 Positività Anti HCP 138/198 69,7 Positività Anti CCP 135/184 73,4 Positività 0 anticorpi 48/198 24,2 Positività 1 anticorpo 19/198 9,6 Positività 2 anticorpi 27/198 13,6 Positività 3 anticorpi 33/198 16,7 Positività 4 anticorpi 72/198 36,4
Figura 4.1 Distribuzione di Ab anti VCPs e anti HCPs in soggetti sani (NHS) e in pazienti con AR
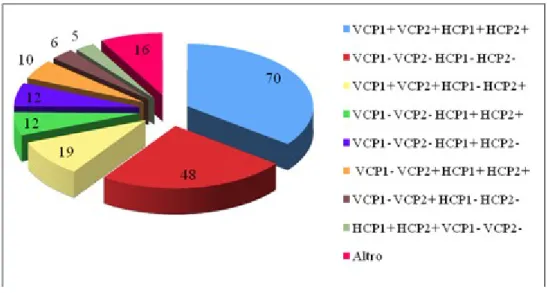
Analizzando più in dettaglio la popolazione di AR per la presenza dei 4 diversi ACPA, possiamo identificare sottogruppi di pazienti in base la numero e al tipo di anticorpi presenti. Il seguente grafico mostra i risultati ottenuti.
Figura 4.2 Analisi della positività dei sieri con i peptidi VCPs e HCPs: la frequenza di singoli o multipli positivi/negativi è indicata nella figura.
I gruppi con un numero di pazienti inferiore a 5 unità sono stati raggruppati sotto la voce “altro”.
4.3 Correlazione con anti-CCP
Al momento il test più utilizzato per la determinazione degli ACPA è il CCP2 test.
Abbiamo valutato la correlazione tra i metodi da noi sviluppati e il CCP.
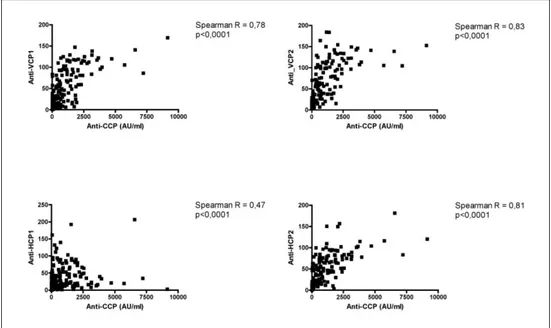
I grafici seguenti mostrano i risultati ottenuti; come si può vedere esiste un elevato livello di correlazione (p<0,0001) fra i livelli di anticorpi misurati con ciascuno dei 4 peptidi e i livelli di anti-CCP.
Figura 4.3 Analisi della correlazione tra Anti-CCP e Anti-VCPs e Anti-HCPs
Infine abbiamo valutato se esistesse correlazione tra la presenza di anticorpi anti VCPs o HCPs e la presenza di particolari parametri clinici (artrite simmetrica, artrite erosiva, artrite attiva) o parametri sierologici (fattore reumatoide, proteina C reattiva) caratteristici dell’AR. Abbiamo anche analizzato il rapporto fra fumo e produzione di ACPA.
Abbiamo rilevato una elevata correlazione tra la presenza degli anti-VCP1, VCP2, HCP1 e HCP2 e la presenza di fattore reumatoide.
Non abbiamo invece osservato alcuna correlazione tra la presenza degli anticorpi e la presenza degli altri parametri clinici e sierologici analizzati. In particolare la presenza di anti-HCP o anti-VCP non si associa ad artrite erosiva né è limitata alle artriti reumatoidi in fase di attività. Analogamente, non c’è correlazione fra l’abitudine al fumo e la presenza di anti-HCP o anti-VCP.
Risultati simili si ottengono prendendo in considerazione gli anticorpi anti-CCP.
D
ISCUSSIONELa diagnosi sierologica di AR è sempre stata difficile: i sieri di soggetti con artrite reumatoide (AR) contengono infatti diverse specificità anticorpali, ma ben pochi anticorpi hanno specificità e sensibilità sufficienti a consentirne l’uso nella diagnostica. Soltanto la determinazione del fattore reumatoide e degli anticorpi contro i peptidi citrullinati ha un’elevata utilità diagnostica ed è disponibile nella pratica clinica.
Il fattore reumatoide non è però specifico della AR; è infatti prodotto in corso di malattie infiammatorie e infettive ed è anche presente nel siero di soggetti sani, specie nell’età avanzata. Nei soggetti con AR, d’altra parte, spesso non è presente nei primi anni di malattia, quando la diagnosi differenziale con altre forme di artrite cronica è difficile su basi esclusivamente cliniche.
Gli ACPA sono invece pressochè esclusivi dell’AR. I dati della letteratura indicano in modo assolutamente concorde che meno del 5% dei sieri di soggetti affetti da altre artriti croniche o da malattie del connettivo contengono ACPA (32,36,40). Per questa loro stretta associazione con l’AR e la loro presenza nelle fasi precoci di malattia sono stati recentemente inclusi nei criteri classificativi della malattia (33).
In questo studio gli ACPA sono stati determinati utilizzando substrati che sono probabilmente rilevanti per la patogenesi della malattia. Abbiamo infatti utilizzato peptidi derivati da proteine virali codificate dal virus di Epstein Barr e peptidi di origine istonica.
Il virus di Epstein Barr è considerato uno degli agenti ambientali che contribuiscono alla patogensi dell’AR. E’ noto da tempo che i pazienti affetti da AR hanno elevati livelli di anticorpi contro le proteine replicative e latenti dell’EBV (23,24). Più di recente, è stato osservato che il contenuto di DNA virale è 10 volte più elevato nei linfomonociti periferici dei soggetti con AR rispetto ai normali o a quelli affetti da altre artriti croniche (47). La presenza del virus a livello sinoviale è un argomento controverso: alcuni studi documentano segni di infezione da EBV nella sinovia reumatoide (48) ma sono stati riportati anche risultati negativi (49,50).
Nuovi dati sono stati recentemente ottenuti dall’analisi dei centri germinativi ectopici a livello sinoviale: l’espressione di proteine della
fase di latenza e litica e di RNA virale è stata dimostrata nelle cellule B e nelle plasmacellule sinoviali. Queste plasmacellule sono produttrici di ACPA ed in particolare di anticorpi diretti contro i peptidi virali citrullinati VCP1 e VCP2 (51).
I peptidi virali utilizzati in questo studio derivano da EBNA1, espresso nelle cellule nell’infezione latente da EBV, ed EBNA2, espresso nelle cellule B nelle fasi recenti dell’infezione. I dati ottenuti dall’analisi dei sieri di AR e di controlli normali confermano la specificità dei test impiegati, con una sensibilità paragonabile a quella ottenuta in precedenza (26,27,40).
La scelta di peptidi di origine istonica deriva da recenti osservazioni sulla risposta immune ad istoni citrullinati che si osserva nell’artrite reumatoide. Gli istoni sono probabilmente le proteine deiminate più abbondanti nell’organismo. La deiminazione degli istoni è un evento biologico di importanza fondamentale, che regola la trascrizione genica e rientra nei meccanismi di difesa dell’immunità innata. Gli stimoli infiammatori, ed infettivi in particolare, inducono deiminazione degli istoni, decondensazione della cromatina e formazione delle trappole extracellulare dei neutrofili (NET), in cui gli istoni del core rappresentano la componente più abbondante. I sieri di AR reagiscono in particolare con l’istone H4 deiminato, e con 2 sequenze in esso contenute, HCP1 e HCP2 (43).
Nel gruppo di pazienti da noi studiato, gli anticorpi HCP1 e anti-HCP2 sono presenti nel 57,6% e nel 58,1% dei soggetti.
I titoli degli anticorpi anti-VCP1, VCP2, HCP1 e HCP2 sono altamente correlati fra loro e con il titolo di anticorpi anti-CCP. Questo livello di correlazione tra diversi metodi per la determinazione di ACPA è assolutamente tipico e indica come i vari metodi misurino popolazioni di anticorpi ampiamente sovrapposte. Come evidenziato dall’analisi della concordanza fra i vari test, la sovrapposizione non è però totale, suggerendo che esistano anticorpi della famiglia ACPA che sono misurabili con un determinato metodo e non con altri.
Un altro risultato della nostra analisi del tutto simile a quanto già riportato in letteratura è la forte correlazione tra la positività al FR e la presenza di ACPA. Uno stesso substrato genetico, rappresentato dallo shared epitope, predispone infatti sia alla produzione di fattore reumatoide che di ACPA e i titoli dei 2 tipi di autoanticorpi sono fortemente correlati.
La presenza di ACPA non è invece associata all’attività dell’artrite, come osservato nel presente studio e in molti lavori precedenti.
Per quanto riguarda la severità di malattia, è stato riportato che la presenza di ACPA sia associata al danno radiologico nei pazienti con AR; anche nei rari pazienti ACPA-positivi non affetti da AR la presenza di ACPA si associa all’artrite erosiva (38).
Secondo alcuni studi, la positività degli ACPA ha un valore predittivo positivo elevato per le forme di artrite di recente insorgenza ma persistenti e con andamento erosivo (52). Infatti, valutati a distanza di tempo dall’esordio dell’artrite, i pazienti positivi per ACPA presentano uno score radiologico sensibilmente più elevato rispetto ai pazienti negativi, indicando l’associazione tra gli anticorpi e una variante di malattia più aggressiva (53). Queste osservazioni sono valide per diversi componenti della famiglia ACPA: l’associazione con artrite erosiva è infatti dimostrata per gli anticorpi anti-CCP (52,53) ma anche per gli anticorpi anti-VCP2 (27).
In questo studio non abbiamo invece riscontrato nessuna associazione fra presenza di singole specificità ACPA, o fra positività ad almeno un peptide citrullinato, ed artrite erosiva: il numero di pazienti inclusi nello studio potrebbe essere troppo basso per raggiungere la significatività. Non possiamo però escludere che i criteri da noi utilizzati per la valutazione radiografica delle erosioni non siano completamente sovrapponibili a quelli impiegati in altri studi.
Nell’analisi dei nostri dati, abbiamo anche ricercato un’associazione fra abitudine al fumo e presenza di ACPA. Il fumo è infatti un fattore ambientale importante nel provocare deiminazione delle proteine: nel liquido di lavaggio bronco-alveolare dei fumatori è presente un’aumentata quantità di proteine citrullinate ed è stato dimostrato che il fumo è il più importante fattore ambientale associato ad AR (54). In
questo studio, non abbiamo dimostrato nessun rapporto fra fumo e produzione di ACPA ma anche in questo caso la numerosità del campione potrebbe essere determinante.
In conclusione, questo studio conferma che la determinazione di ACPA è importante per la diagnosi di artrite reumatoide ma non per valutarne l’andamento; suggerisce inoltre che antigeni rilevanti per la malattia (auto antigeni come gli istoni o antigeni esogeni come quelli di origine virale) possano essere utilizzati a scopo diagnostico.
1) Rheumatoid arthritis. R.N. Maini, N.J.Zvaifler, in “Rheumatology”, J.H. Clipper, P.A. Dieppe Eds, Mobsy, London 1994.
2) A.A.V.V., “Harrison-Principi di medicina interna”, 17° edizione, 2009; 2015-2023.
3) A. Picchianti Diamanti, V. Germano, B. Laganà “Il concetto di remissione nell’artrite reumatoide” Reumatologia pratica, 2010, (5) 57-62.
4) Kumar V., Abbas A.K., Fausto N. Robbins e Cotran ”Le basi patologiche delle malattie” 2006 7° edizione, 1305-1309.
5) “Kelley’s Text of Rheumathology”, 6° edizione, vol.2.
6) Gregersen P.K., Silver J., Winchester R.J., “The shared epitope hypotesis, an approach to understanding the molecular genetics of susceptibility to rheumatoid arthritis” Arthritis Rheum 1987; 30:1205-1213.
7) Iain B. Mclnnes, G. Schett “The Pathogenesis of Rheumatoid Arthritis” The New England Journal of Medicine 2011, (8) 2205-2219.
8) Gorman JD, Lum RF, Chen JJ, Suarez-Almazor ME, Thomson G, Criswell LA. “The shared epitope and severity of rheumatoid arthritis”. Rheum Dis Clin North Am. 2002 Feb;28(1):59-78.
9) Nienhuis RLF, Mandema EA. “A new serum factor in patients with rheumatoid arthritis. The antiperinuclear factor”. Ann Rheum Dis 1964; 23:302–305
10)Young BJ, Mallya RK, Leslie RD, Clark CJ, Hamblin TJ. “Antikeratin antibodies in rheumatoid arthritis” Br Med J. 1979; 2(6182):97-9.
11) Hoet, R.M., A.M.Th. Boerbooms, M. Arends, D.J. Ruiter, and W.J. Van Venrooij. 1991 "Antiperinuclear factor, a marker autoantibody for rheumatoid arthritis: colocalisation of the perinuclear factor and profilaggrin”. Ann. Rheum. Dis. 50:611– 618
12)Simon M, Girbal E, Sebbag M, Gomés-Daudrix V, Vincent C, Salema G, Serre G. “The cytokeratin filament-aggregating protein filaggrin is the target of the so called “antikeratin antibodies”, autoantibodies specific for rheumatoid arthritis”. J Clin Invest 1993; 92:1387-93
13)Vincent C., Nogueira L., Clavel C., Sebbaq M., Serre G. “Autoantibodies to citrullinated proteins : ACPA” Autoimmunity. 2005; 38(1):17-24.
14)Serre G. “Autoantibodies to filaggrin/deiminated fibrin (AFA) are useful for the diagnosis and prognosis of rheumatoid arthritis, and are probably involved in the pathophysiology of the disease”. Joint Bone Spine. 2001 Mar;68(2):103-5.
15)P. Migliorini, F. Pratesi, C. Tommasi, C. Anzilotti “The immune response to citrullinated antigens in autoimmune diseases” Autoimmunity Reviews, (4) 561-564.
16)Anzilotti C, Pratesi F, Tommasi C, Migliorini P. “Peptidylarginine deiminase 4 and citrullination in health and disease”. Autoimmun Rev. 2010 Jan;9(3):158-60.