2
LA GLICOLISI
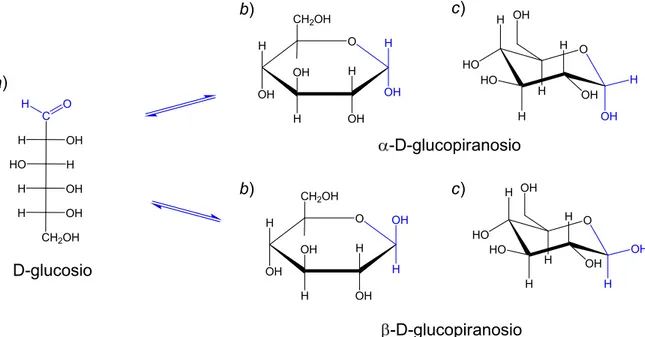
1Il D-Glucosio (Figura 1), un monosaccaride aldeidico composto da sei atomi di
carbonio poliossidrilati, è il composto organico più diffuso in natura e rappresenta la principale sostanza nutriente per la maggior parte degli organismi, intervenendo in numerosi processi metabolici. L'enantiomero destrogiro, presente allo stato libero in numerosi frutti zuccherini, è quello utilizzato e prodotto dagli organismi viventi mentre la sua immagine speculare, l’ L-Glucosio, non viene utilizzato dalle cellule.
Figura 1. a) Glucosio nella proiezione di Fischer; b) glucosio nelle proiezioni di Haworth; c)
D-glucosio nelle conformazioni a sedia. In blu il carbonio anomerico e i suoi legami.
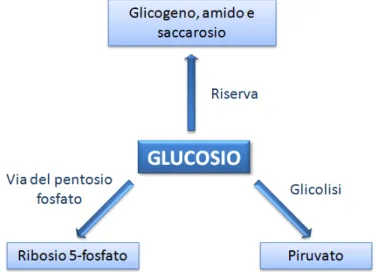
Il glucosio, una volta entrato nella cellula, può incorrere in tre diversi destini (Figura 2): 1. Può essere immagazzinato sotto forma di polisaccaridi di deposito ad elevata massa
molecolare, come l’amido e il glicogeno, mantenendo relativamente bassa l’osmolarità del citosol. Questi prodotti, quando si verifica un aumento improvviso della richiesta energetica, vengono degradati portando alla conseguente liberazione di D-Glucosio, il quale può essere nuovamente utilizzato per la produzione di ATP mediante processi aerobici o anaerobici.
2. Può essere degradato in due molecole di piruvato, composto a tre atomi di carbonio, mediante un processo ossidativo detto Glicolisi. Tale processo consta di dieci reazioni sequenziali, in cui intervengono altrettanti enzimi, durante le quali una parte dell’energia rilasciata da glucosio viene immagazzinata sotto forma di ATP e
3 NADH. La Glicolisi rappresenta praticamente in tutte le cellule la via metabolica centrale del catabolismo del glucosio e in alcune, quali eritrociti e spermatozoi, la sola percorribile per sopperire al fabbisogno energetico.
3. Può essere ossidato attraverso la via del pentosio fosfato portando alla formazione di NADPH e ribosio 5-fosfato, prodotti specializzati utili alla sopravvivenza cellulare. In particolare NADPH viene utilizzato per ridurre le insaturazioni e i gruppi carbonilici nella biosintesi degli acidi grassi e degli steroli, mentre il ribosio 5-fosfato è un elemento fondamentale nella sintesi degli acidi nucleici.
Figura 2. Le principali vie di utilizzazione del glucosio nelle cellule
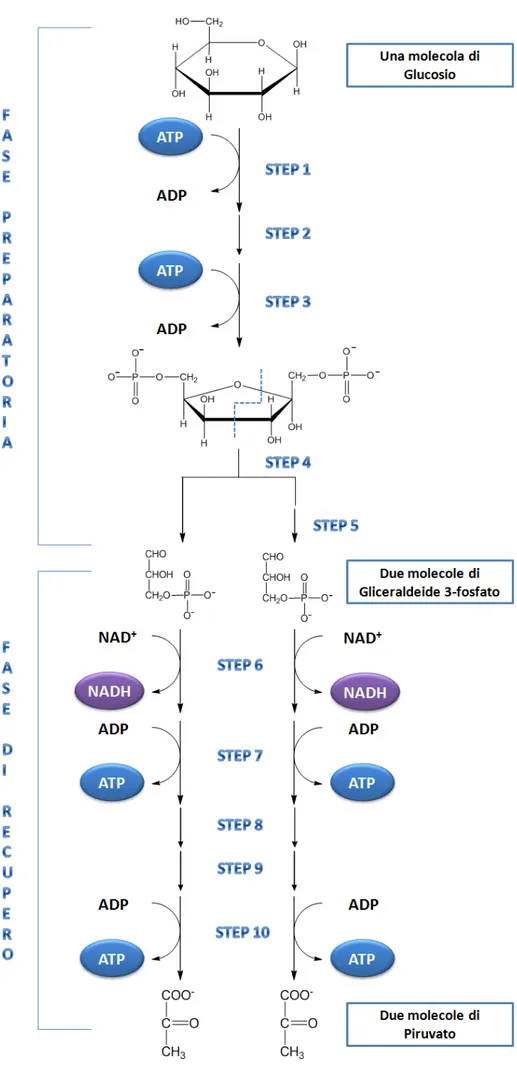
La Glicolisi (Figura 3) può essere divisa in due fasi, ognuna composta da cinque reazioni: 1. Fase Preparatoria: in questa prima fase si ha la fosforilazione del glucosio e la sua
conversione in gliceraldeide 3-fosfato mediante il consumo di due molecole di ATP atte ad aumentare l’energia libera degli intermedi della via metabolica.
2. Fase di Recupero Energetico: nella seconda fase si ha la conversione della gliceraldeide 3-fosfato a piruvato con la contemporanea formazione di ATP e NADH.
Durante la glicolisi parte dell’energia libera posseduta da glucosio viene convertita e conservata sotto forma di ATP mentre la maggior parte rimane associata alla molecola di piruvato. L’equazione complessiva della glicolisi è quindi:
glucosio + 2 ATP + 2 NAD+ = 2 piruvato + 4 ATP + 2 NADH Si ha dunque una complessiva produzione di due molecole di ATP e due di NADH.
4
5 Fase Preparatoria
Prima tappa della glicolisi (Figura 4) è l’attivazione del glucosio mediante la sua
fosforilazione a livello del carbonio in posizione 6, con formazione del glucosio 6-fosfato. Tale reazione prevede la cessione di un gruppo fosfato da parte di una molecola di ATP ed è irreversibilmente catalizzata dall’enzima esochinasi, il quale necessita ioni Mg2+ per svolgere la sua funzione.
Figura 4. Primo step: fosforilazione del glucosio
La fosforilazione del glucosio ha molteplici effetti:
1. Poiché l’ingresso di glucosio all’interno della cellula è regolato da trasportatori di membrana (GLUT) sensibili all’aumento della concentrazione intracellulare dell’esoso, la sua fosforilazione permette di mantenerne un flusso in ingresso costante.
2. La fosforilazione del glucosio ne impedisce l’uscita dalla cellula in quanto, a pH 7, il gruppo fosfato, carico negativamente, limita la permeabilità attraverso la membrana.
3. I gruppi fosforici sono componenti essenziali nei processi enzimatici di conservazione dell’energia metabolica in quanto possono essere successivamente ceduti per la trasformazione dell’ADP in ATP.
Il secondo step (Figura 5) consiste nell’isomerizzazione reversibile del glucosio 6-fosfato in
fruttosio 6-fosfato. Tale reazione che converte un aldosio in un chetosio, è catalizzata dall’enzima fosfoesoso isomerasi, il quale richiede ioni Mg2+ per la sua attività.
6 Il terzo passaggio (Figura 6), fondamentale per la regolazione della glicolisi, rappresenta la seconda reazione di innesco in cui una molecola di ATP cede, in presenza di Mg2+, un gruppo fosfato al fruttosio 6-fosfato portando all’ottenimento del fruttosio 1,6-bifosfato. Tale reazione è catalizzata dall’enzima fosfofruttochinasi-1 (PFK-1) il quale è attivato da una riduzione della [ATP]i o da una aumento della concentrazione dei suoi metaboliti,
AMP e ADP, mentre risulta inibito dall’aumento [ATP]i.
Figura 6. Terzo step: fosforilazione del F6P a fruttosio 1,6-bifosfato.
La quarta tappa (Figura 7) vede la scissione di un esoso, il fruttosio 1,6-bifosfato, in due treosi diversi: il diidrossiacetone fosfato e la gliceraldeide 3-fosfato. Tale condensazione aldolica reversibile viene catalizzata dall’enzima aldolasi ed è spinta nella direzione della scissione grazie alla rapida rimozione, attraverso le reazioni successive, dei due treosi.
Figura 7. Quarto step: scissione in diidrossiacetone fosfato e gliceraldeide 3-fosfato.
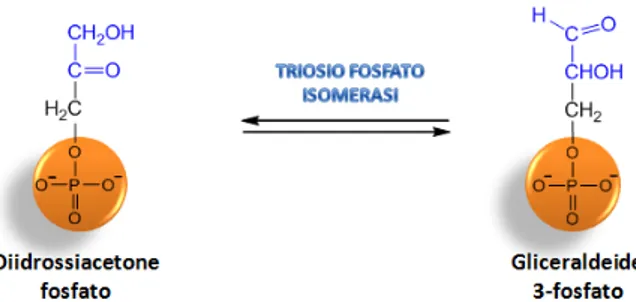
Ultima reazione della fase preparatoria (Figura 8) è l’interconversione reversibile del
diidrossiacetone fosfato nella gliceraldeide 3 fosfato, unico prodotto che può intervenire nella prima tappa della fase di recupero energetico.
7 La reazione viene catalizzata dall’enzima triosio fosfato isomerasi.
Fase di recupero energetico
Nella seconda fase della glicolisi, reazioni di fosforilazione permettono la trasformazione e conservazione di parte dell’energia contenuta nelle due molecole di gliceraldeide 3-fosfato sotto forma di ATP, generato a partire da una molecola di ADP e da Pi.
Nella sesta tappa della glicolisi (Figura 9), il gruppo aldeidico della gliceraldeide 3-fosfato
viene deidrogenato e condensato con una molecola di acido fosforico, portando alla costituzione dell’1,3-bifosfoglicerato. Tale reazione, catalizzata dall’enzima gliceraldeide
3-fosfato deidrogenasi, permette la conservazione di gran parte dell’energia associata
all’ossidazione mediante la formazione del gruppo acil fosfato. Nell’ossidazione si ha inoltre la contemporanea riduzione del cofattore NAD+ mediante il trasferimento, da parte dell’enzima, di uno ione idruro dal gruppo aldeidico della gliceraldeide 3-fosfato all’anello nicotinamidico del NAD+, con conseguente formazione del NADH e di uno ione H+ libero in soluzione.
Figura 9. Sesto step: ossidazione della gliceraldeide 3-fosfato a 1,3-bifosfoglicerato.
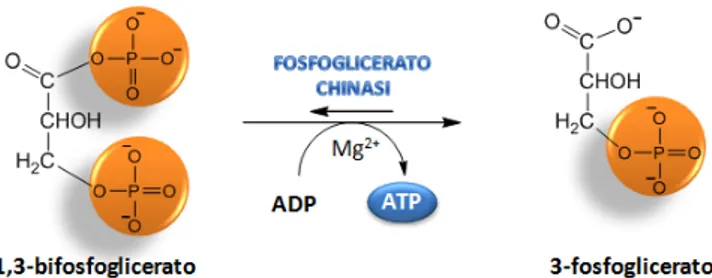
La settima reazione (Figura 10), catalizzata dall’enzima fosfoglicerato chinasi, vede il
trasferimento reversibile dell’energia libera associata al gruppo acil fosfato ad una molecola di ATP con conseguente trasformazione dell’1,bifosfoglicerato in 3-fosfoglicerato.
8 Il gruppo fosfato ancora presente nel 3-fosfoglicerato, viene spostato, nell’ottavo passaggio
(Figura 11), dal carbonio in posizione 3 a quello in 2 con formazione del 2-fosfoglicerato.
Tale conversione reversibile viene catalizzata, in presenza di ioni Mg2+, dall’enzima
fosfoglicerato mutasi, e vede la formazione, come intermedio di reazione, del
2,3-bifosfoglicerato.
Figura 11. Ottavo step: conversione del 3-fosfoglicerato in 2-fosfoglicerato.
Nella penultima reazione della glicolisi (Figura 12) la formazione di una insaturazione tra il
C2 e il C3 porta ad una ridistribuzione dell’energia interna della molecola che determina un netto aumento del ΔG di idrolisi del gruppo fosfato. La deidratazione del 2-fosfoglicerato, a generare fosfoenolpiruvato, è catalizzata dall’enzima enolasi.
Figura 12. Nono step: deidratazione del 2 fosfoglicerato a fosfoenolpiruvato.
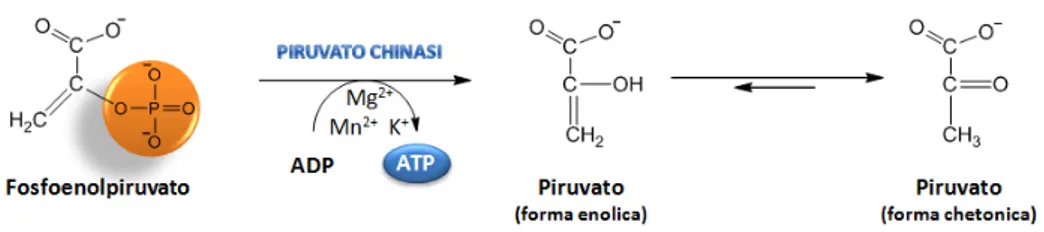
Decimo ed ultimo step della glicolisi (Figura 13) è il trasferimento del gruppo fosforico dal fosfoenolpiruvato all’ATP. Tale reazione, catalizzata irreversibilmente dall’enzima
piruvato chinasi, porta alla formazione del prodotto finale della glicolisi, il piruvato in
forma enolica, il quale tautomerizza rapidamente nella forma chetonica a Ph 7. Questo passaggio terminale viene inibito allostericamente da elevate concentrazioni di ATP, di acetil-CoA e di acidi grassi a catena lunga e attivato dalla riduzione della [ATP]i al fine di
garantire un apporto di ATP costante.
9 Effetto pasteur1,2
Louis Pasteur, nello studio della fermentazione operata dal lievito, evidenziò un aumento sia nella quantità che nella velocità di consumo del glucosio in condizioni anaerobiche rispetto a quelle osservate in condizioni aerobiche. Da studi successivi si dedusse un simile comportamento anche nelle cellule muscolari.
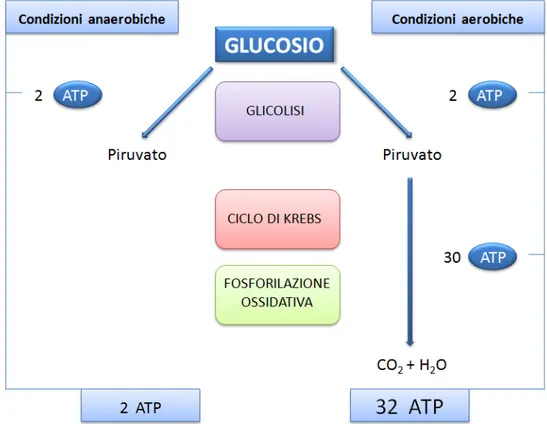
Infatti poiché la quantità di ATP prodotta nelle cellule (Figura 14) dalla completa
ossidazione del glucosio ad H2O e CO2 in presenza di ossigeno (32 ATP) è molto maggiore
rispetto a quella generata in condizioni anaerobiche (2 ATP), per generare, attraverso la glicolisi, quantità di ATP analoghe a quelle prodotte in condizioni aerobiche sono necessarie quantità di glucosio notevolmente superiori.
Figura 14. Produzione di ATP in presenza e in assenza di O2.
Con Effetto Pasteur si intende quindi l’incremento dell’attività glicolitica e l’aumento del consumo di glucosio, attuata dalla maggior parte delle cellule dei mammiferi, in assenza di ossigeno a discapito di una ridotta attività mitocondriale che permetterebbe, in presenza di ossigeno, una maggiore produzione di energia mediante la completa ossidazione del piruvato attraverso il ciclo di Krebs e la Fosforilazione Ossidativa.2
Tale effetto è comunque indispensabile per mantenere un adeguato apporto di ATP all’interno di un ampio range di pO2, permettendo di sopperire alle richieste energetiche
10
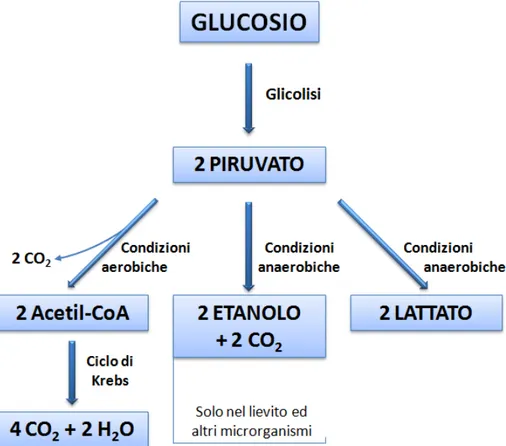
I DESTINI DEL PIRUVATO
1Il piruvato, prodotto finale della glicolisi, può incorrere in destini diversi a seconda delle condizioni aerobiche o anaerobiche in cui si trova la cellula (Figura 15):
Figura 15. I destini del piruvato in condizioni aerobiche ed anaerobiche.
Condizioni aerobiche:
1. In condizioni aerobiche la glicolisi rappresenta solo il primo passaggio ossidativo che da una molecola di glucosio genera due molecole di piruvato. Queste, in seguito al loro trasporto dal citosol al mitocondrio, vengono ulteriormente ossidate, ad opera del complesso enzimatico della piruvato deidrogenasi, ad acetile e legate al Coenzima-A, mediante la rimozione di un gruppo carbossilico sotto forma di CO2 e la conseguente riduzione del NAD+ a NADH.
L’acetil-CoA formatosi potrà quindi essere completamente degradato a CO2 e H2O
mediante il ciclo dell’acido citrico o ciclo di Krebs, nel quale l’energia ottenuta da tale processo ossidativo viene immagazzinata sotto forma di ATP e attraverso la riduzione dei cofattori NAD+ e FAD rispettivamente a NADH e FADH2.
11
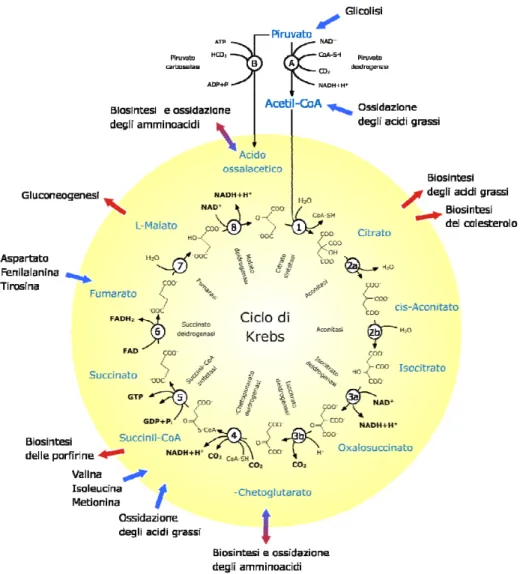
Figura 16. Il ciclo di Krebs.
Numerosi intermedi del ciclo di Krebs (Figura 16) risultano composti di partenza per la biosintesi di altre molecole oppure prodotti di ossidazione provenienti da diverse vie metaboliche:
• L’acetil-CoA viene prodotto dalla β-ossidazione di lipidi a catena pari oppure, insieme al succinil-CoA, dall’ossidazione dei lipidi a catena dispari;
• Il citrato può essere utilizzato per la biosintesi di acidi grassi e colesterolo, in seguito al suo trasporto nel citosol e alla sua trasformazione in acetil-CoA per mezzo dell’enzima liasi;
• Gli aminoacidi, attraverso vari processi metabolici, possono essere trasformati in composti, quali il fumarato, che prendono parte al ciclo di Krebs;
• Composti quali l’α-chetoglutarato e l’ossalacetato vengono sottratti al ciclo dell’acido citrico per essere utilizzati come precursori degli aminoacidi;
• Il succinil-CoA risulta il punto di partenza per la sintesi del nucleo porfirinico mentre l’L-malato interviene nella gluconeogenesi.
12 I coenzimi NADH e FADH2, le molecole trasportatrici di elettroni ridotte durante il
ciclo di Krebs, vengono infine utilizzati nella cosiddetta catena respiratoria: i due cofattori cedono i loro elettroni a dei complessi proteici, localizzati a livello della membrana interna dei mitocondri, che ne consentono il trasferimento all’accettore finale, cioè l’O2, che viene trasformato in H2O. Il trasporto di elettroni attraverso
tali complessi è associato ad una traslocazione di protoni dalla matrice mitocondriale allo spazio inter-membrana. La differenza di potenziale e di pH formatasi ai due lati della membrana viene infine sfruttata, attraverso la
fosforilazione ossidativa, per generare ATP.
Condizioni anaerobiche:
2. Il lievito ed altri microorganismi convertono il piruvato, prodotto mediante la glicolisi, in etanolo e CO2. Tale processo, definito fermentazione alcolica (Figura
17), consta di due passaggi catalizzati da altrettanti enzimi: inizialmente il piruvato
viene irreversibilmente decarbossilato, ad opera della piruvato decarbossilasi, a formare una molecola di acetaldeide la quale viene a sua volta ridotta a etanolo, grazie all’enzima alcool deidrogenasi e alla contemporanea ossidazione di una molecola di NADH.
Figura 17. La fermentazione alcolica, TPP è la tiamina pirofosfato.
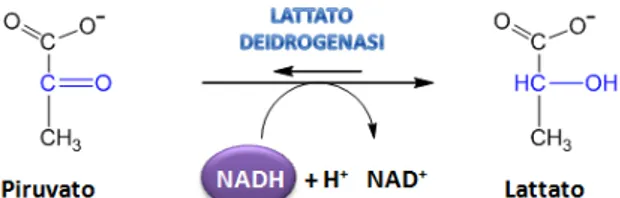
3. Alcuni microrganismi, gli eritrociti e le cellule muscolari dei vertebrati sono in grado, in assenza di ossigeno, di rigenerare la forma ossidata del cofattore NAD+ mediante la fermentazione lattica (Figura 18). In questa reazione il piruvato viene ridotto a lattato con la contemporanea ossidazione di una molecola di NADH a NAD+.
13 In condizioni anaerobiche la fosforilazione ossidativa non può avvenire in quanto viene a mancare l’accettore finale della catena di trasporto degli elettroni. Tale fenomeno non consente infatti di rigenerare NAD+ per ossidazione del NADH, e di conseguenza porta ad una notevole inibizione della glicolisi che risulta bloccata a livello della sesta reazione, la deidrogenazione di due molecole di gliceraldeide 3-fosfato con la contemporanea riduzione di due molecole di NAD+.
In tal senso la fermentazione lattica svolge un ruolo fondamentale nel garantire un continuo apporto di energia, anche in assenza di ossigeno: una molecola di glucosio viene ossidata, tramite la glicolisi, a due molecole di piruvato con conseguente riduzione di due molecole di NAD+, allo stesso tempo la riduzione, attraverso la fermentazione lattica, di due molecole di piruvato in due molecole di acido lattico, deprotonato a ph 7, porta all’ossidazione di due molecole di NADH con un bilanciamento perfetto dei due processi. Si ha quindi produzione di energia anche in assenza di O2.
La fermentazione lattica è un processo che avviene soventemente anche nel muscolo scheletrico sottoposto ad uno sforzo intenso e prolungato, in cui il fabbisogno di energia non viene del tutto bilanciato dalla produzione aerobica di ATP. In questo caso l’acido lattico prodotto, responsabile dell’acidificazione del muscolo con conseguenti dolori e crampi, durante la fase di recupero viene trasportato dal sangue al fegato e convertito in glucosio.
L’enzima che catalizza tale reazione è la lattato deidrogenasi, (Figura 19)
appartenente alla famiglia delle 2-idrossiacido-ossido-reduttasi preposta alla stereospecifica interconversione del piruvato in lattato e del NADH a NAD+. Nella struttura tetramerica di tale enzima, due monomeri, definiti H, presente principalmente nel cuore, e M, presente nel muscolo scheletrico, si combinano a formare cinque isoforme: LDH-1 (H4), LDH-2 (MH3), LDH-3 (M2H2), LDH-4
(M3H) e LDH-5 (M4). Tali isoforme pur presentando una omologia strutturale
superiore al 75%, presentano alcune differenze per quanto concerne le loro proprietà cinetiche. Inoltre è stato dimostrato che l’espressione nelle cellule di una isoforma rispetto alle altre è fortemente influenzata dalla relativa abbondanza delle due sub unitàche possono combinarsi.
Le due isoforme principali sono: LDH-1 o LDH-B, predominante a livello del muscolo cardiaco e degli eritrociti, e LDH-5 o LDH-A, principalmente presente nel muscolo scheletrico e nel fegato.
14
Figura 19. Struttura tetramerica dell’LDH-1 in cui ogni sub unità è colorata diversamente.
In nero il NADH e in magenta l’ossammato.
Il meccanismo di reazione dell’enzima vede l’iniziale legame del cofattore NADH, seguito dall’ingresso del substrato, il quale induce la chiusura del sito attivo mediante la riorganizzazione spaziale di un loop nel quale è presente l’Arg106.3 Questo aminoacido
(Figura 20) polarizza il gruppo carbonilico del piruvato, promuovendo l’attacco da parte
dell’anello nicotinamidico del NADH. L’His193 interagisce invece con il substrato svolgendo un duplice effetto: agisce come donatore/accettore di protoni durante l’ossidoriduzione e garantisce il corretto orientamento del piruvato per l’interazione con il cofattore. Altri aminoacidi fondamentali sono l’Asp166, il quale stabilizza la forma protonata dell’His193, e l’Arg169 che tramite una doppia interazione stabilizza il carbossilato del piruvato. Questi quattro residui sono conservati in tutte le isoforme dell’LDH.4
15
L’IPOSSIA TUMORALE
La presenza di zone tissutali povere di O2 è una proprietà patofisiologica,
caratteristica dei tumori solidi localmente avanzati, che risulta causata da uno scompenso tra l’apporto e il consumo di ossigeno e che non dipende dallo stadio, dalle dimensioni o dalle caratteristiche istopatologiche del tumore. Le regioni ipossigenate sono eterogeneamente distribuite all’interno della massa tumorale e posso risiedere in vicinanza di zone ossigenate come i tessuti sani in prossimità delle lesioni neoplastiche.5
I tumori sono caratterizzati da una incontrollata riproduzione di alcune cellule le quali presentano alterazioni, spesso molto estese, del loro assetto cromosomico cessando di rispondere ai meccanismi fisiologici di controllo cellulare. Questo fa si che la proliferazione delle masse tumorali, a differenza dei tessuti sani, avvenga in modo caotico portando alla generazione di nuovi tessuti anche in zone molto lontane dalla circolazione sanguigna e linfatica. La crescita tissutale, sia nei tessuti sani che in quelli neoplastici, necessita quindi un aumento dell’apporto di ossigeno e nutrienti da parte del sistema circolatorio, mediante lo sviluppo di nuovi vasi sanguigni a partire da altri già esistenti. Tale fenomeno, noto come angiogenesi, è controllato mediante il rilascio da parte dei tessuti di diversi fattori quale, ad esempio, il Vascular Endothelial Growth Factor (VEGF). Tuttavia anche la formazione di nuovi vasi sanguigni avviene, all’interno delle masse tumorali, in modo totalmente disorganizzato (Figura 21): i nuovi vasi sono profondamente
irregolari e tortuosi, presentano anastomosi artero-venose ed estremità a fondo cieco nonché una tonaca intima irregolare e una tonaca media incompleta o assente.6
Figura 21.7 Vasi sanguigni in un tessuto sano (a) e in uno tumorale (b).
16 Tale disorganizzazione porta ad una alterazione del flusso sanguigno il quale, lento e spesso irregolare, impedisce un adeguato apporto di ossigeno determinando la formazione di zone a scarso o nullo contenuto di O2. Nei tessuti tumorali si osservano infatti valori di
pressione parziale di ossigeno (Figura 22) che sono generalmente molto inferiori, non più del
30%, rispetto a quelli osservati nei tessuti sani dai quali derivano.
Figura 22.7 Ossigenazione dei tumori e dei tessuti sani circostanti.
Quattro sono i principali meccanismi patogenetici coinvolti nello sviluppo dell’ipossia dei tumori solidi (Figura 23):8
1. Importanti alterazioni funzionali e strutturali della microcircolazione tumorale portano alla formazione di zone ischemiche come risultato di una ridotta perfusione sanguigna. Tale fenomeno, detto anche ipossia acuta o ipossia perfusione-limitata, è generalmente reversibile.
2. Come risultato di una più rapida velocità di proliferazione delle cellule neoplastiche rispetto alla formazione di nuovi vasi mediante l’angiogenesi, si ha un aumento delle distanze che intercorrono tra i vasi sanguigni e le cellule tumorali. Questo genera una costante e duratura riduzione dell’apporto di O2 e di nutrienti all’aumentare della
distanza dal flusso sanguigno. Si parla allora di ipossia cronica o ipossia
diffusione-limitata che si verifica quando, in seguito all’alterazione della geometria perfusionale, la
distanza tra il vaso sanguigno e il tessuto da irrorare diviene superiore a 70 µm.
3. Una riduzione della capacità del sangue di trasportare ossigeno è generalmente causata da una alterazione della quantità di emoglobina o della sua capacità di trasportare l’ossigeno. Tale alterazione, direttamente associata al tumore o indotta da una terapia
17 antitumorale, porta ad una riduzione dell’apporto di ossigeno ai tessuti generando una
ipossia anemica.
4. Lo sviluppo di neoplasie epatiche è spesso associato a uno scarso apporto di ossigeno. In questo particolare caso, oltre ai fenomeni precedentemente illustrati, l’irrorazione sanguigna è assicurata, esclusivamente o in parte, dalla circolazione portale che, in quanto venosa, presenta una minore concentrazione di ossigeno disciolto nel sangue. Tale fenomeno è definito ipossia ipossiemica.
Figura 23. Ipossia cronica e ipossia acuta.
La formazione di zone a scarso contenuto di ossigeno all’interno dei tumori solidi fa si che questi acquisiscano una discreta resistenza nei confronti dei più comuni interventi terapeutici, quali la chemioterapia, la radioterapia e la terapia fotodinamica, progredendo verso forme maggiormente aggressive.5
La maggior parte dei chemioterapici necessitano della veicolazione ematica per poter raggiungere il tessuto bersaglio e svolgere quindi la loro azione terapeutica, inoltre la concentrazione del farmaco a livello dei tessuti tumorali diminuisce proporzionalmente all’aumentare della distanza dal vaso sanguigno. Per questi motivi nei tessuti a bassa pO2,
che come prima illustrato risultano i più distanti dal circolo ematico, avremo delle concentrazioni di farmaco insufficienti all’attività antitumorale di tali composti (Figura 24).
L’ipossia tumorale determina inoltre una riduzione della velocità di proliferazione delle cellule andando ad intaccare la selettività di molti agenti citotossici, selettivi verso cellule in rapida proliferazione. Nelle cellule tumorali, alterazioni geniche direttamente promosse dall’ipossia, portano inoltre ad una inibizione dell’apoptosi indotta da alcuni chemioterapici nonché alla sovraespressione di geni coinvolti nella resistenza ai farmaci come quello decodificante la glicoproteina-G.7
18
Figura 24.6 Chemioterapia nell’ipossia tumorale: a) concentrazione di farmaco e proliferazione cellulare
all’aumentare della distanza da vaso; b) sopravvivenza cellulare in relazione alla distanza dal circolo ematico.
Sappiamo che l’ipossia tumorale garantisce anche una elevata, o in alcuni casi totale, resistenza nei confronti della radioterapia, la quale necessita di ossigeno molecolare per rendere effettiva la sua attività citotossica.5
Nel caso in cui sia presente l’ossigeno, le cellule sfruttano l’attività della perossido
dismutasi per produrre piccole quantità di H2O2 a partire dall’acqua e dall’ossigeno
molecolare. Le radiazioni ionizzanti, quali i raggi X, determinano la rottura omolitica del legame perossidico dell’H2O2 portando alla formazione di radicali ossidrilici (HO●)
fortemente reattivi: come risulta dell’equazione in figura 25, la quantità di ossidrili radicalici prodotta è direttamente proporzionale alla quantità di ossigeno presente all’interno della cellula.
Figura 25. Formazione dei radicali ossidrilici ad opera dei raggi X.
L’elevata quantità di radicali porta alla produzione di danni a livello del corredo cromosomico della cellula in quanto determina la formazione di radicali a livello dei
19 nucleotidi del DNA i quali possono incombere in due diversi destini in condizioni aerobiche o ipossiche (Figura 26a): in presenza di ossigeno il danno viene fissato, portando
alla rottura del doppio filamento ad α-elica costitutivo del DNA, rottura che porta alla morte cellulare e al blocco della proliferazione neoplastica; in assenza di ossigeno le basi nucleotidiche danneggiate possono essere riparate attraverso l’azione di composti contenenti gruppi solfidrici, consentendone una inalterata proliferazione.
Per questo motivo le cellule con scarsa concentrazione di O2 citoplasmatica, producendo
meno OH●, sono meno suscettibili all’attività terapeutica delle radiazioni ionizzanti (Figura 26b).7 Si è anzi osservato che l’utilizzo di radioterapia in questi casi porta ad una selettiva
citotossicità nei confronti delle cellule maggiormente ossigenate determinando una parziale riossigenazione dei tessuti ipossici, con conseguente incremento della loro proliferazione.
Figura 26.7 Effetto della radioterapia: a) in presenza e assenza di O2; b) sulla sopravvivenza delle cellule
tumorali in condizioni aerobiche e ipossiche.
Per ovviare a tale riduzione di attività terapeutica, in una serie di studi clinici, è stata evidenziata la possibilità di incrementare la concentrazione di ossigeno nel sangue facendo respirare ai pazienti ossigeno alla stato puro o in condizioni di pressione aumentata, come quelle ottenute mediante l’utilizzo di camere iperbariche. Tuttavia tale tentativo ha apportato solo marginali benefici, probabilmente a causa delle presenza di zone tumorali in cui l’approvvigionamento di ossigeno è limitato non tanto da impedimenti diffusionali quanto da un blocco ischemico del flusso ematico.6
20 Terapia antitumorale
I tumori localmente definiti possono essere asportati chirurgicamente, tuttavia in seguito all’evoluzione metastatica, si rende necessario l’utilizzo sistematico di chemioterapici, spesso in associazione alla radioterapia. Un approccio atto ad aumentare l’efficacia terapeutica dei moderni chemioterapici, riducendo gli effetti collaterali dose-limitanti e la tossicità, prevede la progettazione di profarmaci antitumorali attivati mediante meccanismi sito-specifici. Nel caso dell’ipossia tumorale, sono state ottimizzate due strategie:
• L’attivazione tumore-specifica in condizioni ipossiche consiste nell’utilizzo di pro farmaci, attivati in seguito ad una riduzione catalizzata da enzimi ubiquitari, in grado di rilasciare l’agente citotossico. In presenza di ossigeno si istaura un ciclo ossidoriduttivo nel quale il farmaco ridotto viene nuovamente ossidato a profarmaco determinano la sua inattivazione. In assenza di O2 il farmaco ridotto, in quanto stabile, è invece in grado di
esplicare il suo potenziale antitumorale.
• Nell’attivazione tumore-specifica mediante l’apporto di enzimi riduttivi esogeni l’attivazione dei profarmaci antitumorali è assicurata dalla presenza di proteine espresse esclusivamente a livello del tessuto neoplastico. Tale effetto può essere ottenuto mediante tecniche quali la gene directed enzyme prodrug terapy (GDEPT) o la virus
directed enzyme prodrug terapy (VDEPT) nelle quali la sequenza genica decodificante
l’enzima esogeno, preposto all’attivazione del profarmaco, viene veicolata selettivamente a livello del tessuto tumorale. In alternativa è possibile veicolare indiscriminatamente la sequenza genica con opportuni promotori che ne consentano la trascrizione esclusivamente a basse concentrazioni di ossigeno (Figura 27).9
21 Profarmaci attivati dall’ipossia
Tali profarmaci, attivati mediante processi riduttivi radicalici con scambio di uno o due e-, devono possedere tre domini fondamentali: “trigger” o interruttore, ridotto selettivamente in tessuti ipossici, responsabile della selettiva attivazione di tali profarmaci nei confronti dell’ipossia tumorale; “effector”, dominio che, una volta rilasciato, è in grado di esplicare l’attività citotossica; “linker”, il quale funge da connessione tra l’interruttore e l’effettore, trasmettendo l’attivazione dall’uno all’altro.
Figura 28. Domini fondamentali e attivazione dei profarmaci attivati dall’ipossia.
La porzione interruttore, che svolge un ruolo fondamentale nel dirigere l’attività citotossica selettivamente nei tessuti tumorali ipossici, può essere formata da vari gruppi, quali chinoni, nitro-aromatici, N-ossidi e solfossidi, che vengono convertiti in composti reattivi elettrofili o in radicali liberi.
Un meccanismo comunemente accettato di attivazione consiste nella riduzione mono-elettronica del profarmaco: un elettrone viene trasferito, ad opera di reduttasi, quali il citocromo P450, al profarmaco convertendolo in un radicale libero. Tale composto, in assenza di O2, viene convertito nell’agente citotossico (Figura 28).
22 In presenza di ossigeno, invece, il reattivo radicalico formatosi trasferisce l’elettrone spaiato all’ossigeno generando lo ione superossido e il profarmaco di partenza. Lo ione O2-● può a sua volta essere trasformato in perossido di idrogeno ad opera dell’enzima
superossido dismutasi.
Un esempio di profarmaco attivato mediante tale reazione è la Tirapazamina (TPZ)(Figura 29): eccellente substrato per diverse reduttasi intracellulari, viene ridotta in un intermedio
radicalico TPZ● mediate il trasferimento di un e-. Il radicale TPZ● in presenza di ossigeno viene nuovamente ossidato a TPZ con formazione di uno ione superossido. In condizione ipossiche, al contrario, assistiamo ad un decadimento spontaneo che può portare alla formazione di due specie reattive: il radicale ossidrilico (OH●) ottenuto per scissione omolitica del legame N-idrossido, o il radicale benzotriazinilico (BTZ●) risultato della perdita di una molecola di acqua. I due radicali sono le vere specie citotossiche in quanto danneggiando l’enzima Topoisomerasi II (enzima che determina un aumento o una diminuzione del grado di superavvolgimento del DNA, svolgendo un ruolo fondamentale nell’impaccamento e nella replicazione degli acidi nucleici) determinano la rottura del doppio filamento di DNA e la conseguente morte cellulare.7
Figura 29.7 Attivazione della TPZ in condizioni ipossiche.
La tirapazamina tuttavia, presentando un’attività antitumorale selettiva per i tessuti ipossici, non è in grado di determinare un blocco definitivo della proliferazione tumorale. Tale impedimento risulta dall’incapacità del farmaco attivato di diffondere attraverso le membrane citoplasmatiche e di svolgere quindi la sua attività citotossica anche nei vicini tessuti ossigenati. Per ovviare a tale impedimento sono stati effettuati studi clinici in cui l’attività citotossica della TPZ viene associata all’attività chemioterapica del cisplatino, portando ad un notevole incremento dell’effetto terapeutico.6
La presenza di concentrazioni di O2 intermedie a livello di tessuti sani quali fegato,
23 profarmaci attivati da pO2 sempre più inferiori. Tale requisito, insieme alla capacità della
specie citotossica di diffondere nei tessuti vicini, nota con il termine effetto bystander, ha determinato lo sviluppo di nuovi profarmaci quali la mostarda azotata SN23862 (Figura 30).
Tale composto viene attivato attraverso una riduzione mono-elettronica del gruppo nitro in posizione 2, che determina un aumento della reattività della parte alchilante costituita dal gruppo di(2-cloroetil)amminico. Tale riduzione, determinante per l’attività citotossica del composto, avviene in modo stabile soltanto a concentrazioni molto basse di O2.7
24
L’EFFETTO WARBURG E L’EVOLUZIONE TUMORALE
La maggior parte dell’energia che le cellule necessitano per la loro sopravvivenza viene prodotta, come prima illustrato, attraverso un processo ossigeno-dipendente denominato fosforilazione ossidativa (OXPHOS). Nella maggior parte dei tessuti tumorali ipossici è quindi stata osservata una riduzione dell’attività ossidativa dei mitocondri, associata ad un incremento dell’attività glicolitica e della fermentazione lattica. Tale fenomeno, precedentemente illustrato come effetto Pasteur, assicura, anche in assenza di ossigeno, un adeguato apporto di ATP indispensabile per la proliferazione cellulare.
Nella prima metà del ‘900 Otto Warburg fu il primo ad osservare che le cellule tumorali presentano un aumentata attività glicolitica, evidenziata da un aumento della produzione di acido lattico, anche in presenza di normali pO2. Tale fenomeno, denominato poi glicolisi
aerobica o effetto Warburg (Figura 31), è ora associato alla maggioranza delle lesioni neoplastiche.
Inizialmente lo stesso Warburg aveva collegato tale alterazione ad un danno irreversibile a carico dei mitocondri, ipotesi sostenuta da una ridotta espressione della subunità β-F1 dell’enzima ATP-sintasi e dalla diminuita attività del complesso del citocromo c ossidasi, causata da una mutazione del gene p53. Studi successivi nei quali il blocco della glicolisi aerobica, ottenuta mediante una inibizione dell’attività dell’enzima LDH, portava ad una riattivazione della fosforilazione ossidativa, hanno smentito tale supposizione.10
L’alterato metabolismo del glucosio risulta quindi più di un semplice adattamento all’ipossia tumorale: spesso associato all’aggressività neoplastica e allo sviluppo metastatico, conferisce un significativo vantaggio nell’evoluzione delle cellule tumorali verso fenotipi maggiormente proliferativi e maligni. Tale affermazione risulta avvalorata da molteplici evidenze:11
1. Un flusso ematico incostante e l’aumento delle distanze dalla circolazione sanguigna sono la causa di fluttuazioni, spesso vistose, della concentrazione intracellulare di ossigeno. Tale condizione, letale per quelle cellule che basano la produzione di energia sulla fosforilazione ossidativa, non intacca la produzione di ATP nelle cellule che utilizzano la glicolisi aerobica.
2. Trasportatori di membrana, quali MCT1 e MCT2, trasportano il prodotto finale della glicolisi aerobica, il lattato, all’esterno della cellula tumorale. Da qui viene captato dalle cellule stromali che lo riconvertono in piruvato. Il piruvato così prodotto può essere utilizzato dalle stesse cellule stromali per la produzione di
25 energia, mediante il ciclo di Krebs e la fosforilazione ossidativa, oppure può essere espulso nuovamente ed andare a rifornire le cellule tumorali.
3. Le cellule tumorali a partire dal glucosio, attraverso la via del pentosio fosfato, possono produrre ribosio 5-fosfato, indispensabile per la produzione degli acidi nucleici, e NADPH. Questo composto, avente attività antiossidante, costituisce una ottima difesa nei confronti di molti chemioterapici nonché rappresenta il punto di partenza per la sintesi di acidi grassi.
4. La glicolisi aerobica rappresenta il metodo più rapido di produzione di ATP. Tale caratteristica rappresenta un punto di forza nell’apporto di energia a cellule in rapida divisione.
5. Le cellule tumorali utilizzano gli intermedi del processo glicolitico per la sintesi anabolica di composti indispensabili alla sopravvivenza cellulare. Utilizzano, ad esempio, il glucosio 6-fosfato per la sintesi di glicogeno e ribosio 5-fosfato, il diidrossiacetone fosfato per la sintesi di trigliceridi e fosfolipidi, e piruvato e fosfoenolpiruvato per la formazione di numerosi aminoacidi. Tale attività anabolica risulta inoltre favorita da un aumento dell’espressione di una particolare isoforma della piruvato chinasi (PKM2) che determina un accumulo degli intermedi della glicolisi.
Figura 31.2,12 L’effetto Warburg: a) alterazioni metaboliche; b) confronto tra la velocità di consumo del
glucosio in cellule di tumore al seno non-invasive (MCF-7) e metastatiche (MDA-MB-231).
Nel grafico in figura 31b viene messo a confronto il consumo di glucosio, in presenza e assenza di ossigeno, in cellule di tumore al seno non invasive (MCF-7) e metastatiche (MDA-MB-231). Da questo confronto si osserva come il fenotipo glicolitico sia
26 direttamente associato all’aggressività tumorale: l’effetto Warburg è evidenziato dall’incremento nel consumo di glucosio al passare da cellule tumorali non invasive a cellule metastatiche (W). L’aumento dell’impiego di glucosio al diminuire della concentrazione di ossigeno, nelle due linee cellulari, è invece indice dell’effetto Pasteur (P).2
Siamo in grado di affermare che le condizioni ostili del microambiente neoplastico selezionano quelle cellule che, essendo in grado di adattarsi meglio, consentono una proliferazione incontrollata della massa tumorale. Per questo la teoria evolutiva, che con approccio matematico analizza le dinamiche di adattamento alle alterazioni dell’ambiente circostante, è applicabile anche in questo contesto: le cellule con certe caratteristiche potranno sopravvivere a discapito delle altre che si estingueranno (Figura 32). 2
Figura 32.2 L’evoluzione tumorale in cui vi sono cellule: sane (grigio), iperplastiche (rosa), ipossiche (blu),
che utilizzano il fenotipo glicolitico (verde) e mobili (giallo).
L’evoluzione tumorale, a partire dal tessuto sano, prevede un iniziazione a stato iperplastico che evolve successivamente in neoplasia interstiziale. Da questa, attraverso il carcinoma in situ, si passa a carcinoma invasivo per giungere poi al processo metastatico. La proliferazione delle cellule sane non è subordinata all’apporto di sostanze nutritive, assicurato dalla circolazione ematica e linfatica, ma è controllata dalle interazioni con le cellule vicine, dalla matrice extracellulare e dal rilascio di fattori di crescita. Le cellule tumorali in stato iperplastico incorrono quindi in alterazioni geniche che le rendono meno sensibili a tali costrizioni permettendo loro una libera proliferazione.
27 Con l’aumentare dei volumi tissutali, e il passaggio a neoplasie interstiziali, le cellule si allontanano dalla circolazione ematica. L’aumento delle distanze e un flusso sanguigno spesso incostante generano delle fluttuazioni nell’apporto di ossigeno, fenomeno che predilige il metabolismo anaerobico come principale fonte di energia e di carbonio indispensabili alla sopravvivenza cellulare. Tale alterazione metabolica genera tuttavia alcuni effetti secondari: l’aumentata produzione di acido lattico, presente sotto forma deprotonata a pH fisiologico, genera una riduzione, spesso consistente, del pH extracellulare.2
L’esposizione prolungata delle cellule stromali all’ambiente acido circostante genera un’alterazione del gradiente transmembrana degli ioni H+ con conseguente acidosi intracellulare. Questo porta all’attivazione di fenomeni apoptotici, attivati mediante meccanismi dipendenti dall’espressione di geni quali il p53 e la caspasi-3, che conducono a morte cellulare. Le cellule tumorali, grazie ad una up-regulation di trasportatori di membrana come lo scambiatore H+/Na+ e la pompa H+-ATPasi, sono meno sensibili
all’apoptosi indotta dall’acidosi e sopravvivono anche in queste condizioni. La riduzione del pH extracellulare, portando ad una selezione delle sole cellule tumorali nonché ad una degradazione della matrice extracellulare e alla promozione dell’angiogenesi, è quindi una caratteristica indispensabile nella selezione di neoplasie maggiormente invasive.2
Le cellule che raggiungono distanze dal flusso ematico superiori a 150 µm risentono non solo di uno scarso apporto di ossigeno, ma anche di una ridotta disponibilità di glucosio. Tale deficienza richiede un aumento di motilità e invasività delle cellule tumorali che cominciano a migrare verso zone maggiormente ossigenate. Tale fenomeno, alla base dell’evoluzione metastatica, avviene in più fasi: si osserva una riduzione delle interazioni adesive con le cellule vicine e un aumento della motilità che, in seguito alla degradazione delle matrice extracellulare e della membrana basale, consenta la migrazione verso la circolazione ematica o linfatica. Attraverso queste due vie, le cellule metastatiche possono allontanarsi dal tessuto di origine e formare lesioni tumorali secondarie, le metastasi, in altri distretti dell’organismo. Molti studi hanno dimostrato che tali lesioni secondarie, nonostante presentino un sufficiente apporto di O2 e nutrienti, continuano a mantenere un
elevato consumo di glucosio rispetto alle forme tumorali iniziali. Tale è un’ulteriore dimostrazione del fatto che la glicolisi aerobica, permanendo anche in presenza di ossigeno, è un vantaggio per la sopravvivenza della cellula nell’evoluzione tumorale.13 Dato che la glicolisi aerobica è una caratteristica costitutiva di molte neoplasie, l’aumento dell’uptake di glucosio può essere utilizzato per evidenziare la presenza di lesioni primarie o secondarie. Su questa deduzione si basa la tecnica PET/CT, nella quale la tomografia ad
28 emissione di protoni viene combinata con la tomografia computerizzata. Come marcatore viene usato l’analogo del glucosio 2-(18F)-fluoro-2-desossi-D-glucosio (FdG). Tale tecnica presenta una specificità vicina al 90%, in quanto anche altri tessuti possono immagazzinare quantità elevate di glucosio, e come unica difficoltà l’incapacità di risolvere lesioni più piccole di 0,8 cm3.2
Figura 33.2 PET FdG di un paziente con linfoma: i linfonodi mediastinali (porpora) e sopraclavicolari
(verde) presentano un aumentato uptake del FdG in seguito a lesione tumorale. Medesimo comportamento presenta la vescica (giallo) preposta all’escrezione del radionucleotide.
I meccanismi molecolari e l’espressione genica
Negli ultimi 20 anni i meccanismi che conducono allo shift metabolico delle cellule tumorali sono stati altamente studiati al fine di identificare terapie alternative per la cura delle neoplasie.
Il fattore di trascrizione ipossia-inducibile (HIF-1) è l’elemento alla base di una cascata di alterazioni metaboliche che nel loro insieme portano all’espressione del fenotipo glicolitico. HIF-1 è un eterodimero costituito da due subunità: entrambe sono costituzionalmente espresse, tuttavia, mentre la subunità β è stabile in qualsiasi condizione, la subunità α lo è esclusivamente in presenza di scarse concentrazioni di ossigeno. Nei tessuti ossigenati la subunità α subisce una iniziale ossidrilazione, promossa dall’enzima
prolil idrossilasi (PHDs), a livello di due residui di prolina (402-564). Tali residui vengono
quindi riconosciuti dalla proteina von Hippel Lindau (VHL) e dalla liasi E3 che, in seguito al legame con l’ubiquitina (Ub), ne promuovono la degradazione proteosomica (Figura 34).
29
Figura 34.14 Meccanismo di attivazione e inattivazione del fattore HIF-1.
L’enzima prolil idrossilasi, che utilizza l’O2 e l’α-chetoglutarato per svolgere la sua attività
ossidativa, risulta inibito anche da piccole alterazioni della concentrazione di ossigeno. In assenza di ossigeno la subunità α risulta quindi stabile e, in seguito al legame con la subunità β, può entrare nel nucleo attivando la trascrizione di numerosi geni.
Studi successivi hanno dimostrato che altri fattori possono indurre un’attivazione del fattore HIF-1 anche in presenza di ossigeno: l’aumento di specie radicaliche (ROS), formate attraverso la fosforilazione ossidativa, e l’accumulo di succinato e fumarato, prodotti nel ciclo di Krebs, i quali presentano un’attività inibitoria nei confronti dell’enzima PHDs, condizione definita “pseudoipossia”. Altre mutazioni geniche a carico di proteine quali la fosfatidilinositolo-3-chinasi (PI3K) e la chinasi Akt rendono, con meccanismi non del tutto chiari, la subunità α stabile anche ad elevate pO2. Stesso effetto
hanno mutazioni a carico della proteina VHL, spesso evidenziate nei tumori a carico dell’apparato renale.
La trascrizione genica promossa dal fattore HIF-1 determina l’up-regulation di numerose proteine coinvolte nel metabolismo cellulare. La sovraespressione dei trasportatori di membrana GLUT (1,3,4) e delle esochinasi (HK1 e HK2) permette un aumento dell’uptake del glucosio, il quale, rapidamente fosforilato a glucosio 6-fosfato, può essere utilizzato in vari processi metabolici, sia per generare energia, sia per la sintesi di composti essenziali alla proliferazione cellulare. L’attivazione di molti enzimi che prendono parte alla glicolisi, nonché l’up-regulation dell’enzima lattato deidrogenasi A (LDH-A), portano ad una selezione del fenotipo glicolitico quale meccanismo di elezione per la produzione di energia. Tale selezione è promossa anche dagli aumentati livelli dell’enzima PDH-chinasi, (PDK1) preposto alla fosforilazione dell’enzima piruvato deidrogenasi (PDH), indispensabile alla trasformazione del piruvato in acetil-CoA, punto di partenza del ciclo di Krebs. La riduzione dell’attività mitocondriale è data inoltre dalla trascrizione del gene
30 MAX interactor 1, il quale blocca la duplicazione del DNA mitocondriale portando una sensibile riduzione della quantità di mitocondri per cellula, e dall’alterazione dell’attività della citocromo c ossidasi (COX), responsabile del trasferimento degli elettroni all’O2 nella
catena di trasporto degli elettroni.14
Figura 35.11 Alterazioni del metabolismo delle cellule tumorali.
L’alterata attività mitocondriale e l’assenza di ossigeno generano una iperpolarizzazione della membrana mitocondriale, spesso associata ad una riduzione dei canali K+ voltaggio-dipendenti (Kv), che determina un aumento della concentrazione citosolica di ioni K+. Tale incremento, portando al blocco delle caspasi e dell’apoptosis-inducing factor (AIF), è alla base dell’inibizione del processo apoptotico. Altro beneficio derivante dalla soppressione dell’OXPHOS è un decremento degli effetti tossici apportati dalla consistente produzione di ROS come prodotti della respirazione cellulare. L’utilizzo dell’acido dicloroacetico (DCA) come inibitore dell’enzima PDK1, ha evidenziato come l’inibizione di tale proteina sia in grado di ristabilire il normale processo metabolico, riattivando il ciclo di Krebs, e di indurre l’apoptosi nelle cellule tumorali, mediante una riduzione della concentrazione di ioni K+ a livello citosolico.15
L’attivazione del fattore HIF-1 produce anche alterazioni metaboliche che portano ad una aumenta proliferazione e aggressività della massa tumorale. Tra queste abbiamo la stimolazione del fattore di crescita endoteliale vascolare (VEGF), che porta ad un incremento dell’attività angiogenica, e della lisil ossidasi (LOX), enzima Cu2+-dipendente,
31 appartenete alla classe delle ossido reduttasi, che favorisce la formazione di legami crociati tra l’elastina e il collagene della matrice extracellulare favorendo la motilità cellulare. L’inattivazione dell’E-caderina indotta dal fattore HIF-1 porta ad una riduzione delle giunzioni cellula-cellula e della resistenza alla motilità indotta dalle cellule vicine, mentre l’attivazione del fattore di crescita dei tessuti connettivali (CTGF) promuove la crescita incondizionata delle cellule tumorali che non rispondono più alle limitazioni attuate dalla matrice extracellulare.16
Come precedentemente illustrato, le lesioni tumorali ipossiche presentano spesso una acidificazione dell’ambiente extracellulare circostante, in parte dovuto alla sovraespressione HIF-indotta dei trasportatori di membrana MCT1 e 2. Tali trasportatori cotrasportano nello spazio extracellulare una molecola di lattato e un protone così che non si raggiungano concentrazioni intracellulari di lattato tali da inibire il processo glicolitico. La diminuzione del pH extracellulare è legata anche all’azione dei trasportatori protonici di membrana, quali gli scambiatori Na+/H+, attivati dall’ipossia, e le pompe protoniche
V-type H+ ATPasi e F
1F0 ATPasi, che, generalmente associate alla membrana mitocondriale,
sono presenti a livello delle membrane cellulari delle cellule tumorali.
L’HIF-1 induce anche l’espressione delle isoforme 9 e 12 dell’anidrasi carbonica (CA9 e CA12) responsabili della conversione della CO2 extracellulare in HCO3- e H+. Il
bicarbonato viene poi captato dalla stessa cellula per tamponare la riduzione del pH intracellulare a discapito di una acidificazione dell’ambiente extracellulare. La riduzione del pH extracellulare, portando all’attivazione di numerose metallo proteasi pH-dipendenti, risulta quindi una ulteriore spinta alla proliferazione cellulare.11
Tutte le proteine, direttamente indotte dall’attivazione del fattore HIF-1, possono quindi essere usate come marcatori in grado di evidenziate tessuti tumorali in cui sono presenti scarse quantità di ossigeno. A tale scopo sono stati effettuati studi per determinare l’espressione genica della CA9, GLUT-1, LDH-A e della LOX al variare della concentrazione di ossigeno e del pH in diverse tipologie di lesioni neoplastiche (Figura 36).
Gli esperimenti prevedono l’esposizione di cellule provenienti dal carcinoma a cellule squamose della cervice uterina umana (SiHa) e cellule del carcinoma a cellule squamose della faringe umana (FaDuDD) a diverse concentrazioni di O2 e a vari pH. Dopo 24 ore si
misurano i livelli di mRNA relativi alle singole proteine e i risultati ottenuti da ogni misurazione vengono confrontati con i livelli di mRNA ottenuti a [O2] pari al 21%.
Dai grafici si evince che, in entrambe le linee cellulari, l’espressione genica di CA9 a pH fisiologico (7.5) è aumentata di circa 100 volte passando da condizioni di normossia (21%) a condizioni ipossiche (1% O2) e permane al medesimo livello tra 0.01 e 0% di O2.
32
Figura 36.17 Espressione dell’mRNA di CA9, GLUT-1, LDH-A e LOX nelle cellule SiHa e in quelle
33 Passando ad un ambiente lievemente acido (pH 6.7) non si notano alterazioni dell’andamento appena illustrato e le curve ricalcano quelle ottenute a pH 7.5. L’aumento dell’acidità in cellule SiHa (pH 6.5) non genera cambiamenti importanti nell’andamento dell’espressione genica ad eccezione del raggiungimento del massimo di espressione di CA9, per questa linea cellulare, all’1% di O2. Un’ulteriore diminuzione del pH a 6.3
determina invece un drastico cambiamento nell’espressione di CA9: si ha un iniziale incremento in corrispondenza dell’1% di O2, in cui si hanno valori affini a quelli osservati
a pH 7.5, seguito da una riduzione dell’espressione genica a valori di O2 inferiori allo
0.01%. In cellule FaUdDD, una iniziale riduzione del pH a 6.5 ha dato una risposta
intermedia mentre l’ulteriori acidificazione (pH 6.3) ha determinato una sensibile riduzione dei livelli di mRNA relativi a CA9.
L’andamento delle curve relative a GLUT-1 e LDH-A è molto simile: entrambe le proteine presentano, nelle cellule SiHa, un’espressione genica vistosamente influenzata da alterazioni dell’acidità: ad un pH compreso tra 7.5 e 6.7 è associato un leggero aumento dei livelli di mRNA passando dal 21% allo 0.01% di O2, con valori massimi pari a 4-5 volte
quelli raggiunti in condizioni di normossia. A pH 6.5 e 6.3 si osserva invece un picco all’1% di O2 che risulta maggiore rispetto a quello fisiologico. Nelle cellule FaDuDD,
invece, il cambiamento di pH non influenza in modo radicale l’espressione di queste proteine.
L’espressione dell’enzima LOX presenta, in entrambe le linee cellulari, un andamento crescente a pH 7.5 fino a concentrazioni di O2 pari allo 0.01%, alle quali si osserva un
valore di mRNA 10 volte maggiore rispetto alle condizioni fisiologiche. Nelle cellule SiHa si è osservato un comportamento simile a quello visto per CA9 in presenza di pH acidi: all’1% di ossigeno si ha un aumento dell’espressione genica simile a quello ottenuto a valori di pH maggiori, si ha tuttavia una rapida diminuzione dei valori di mRNA passando a concentrazioni inferiori di O2 (0.01 e 0%). Nelle cellule FaDuDD i livelli di mRNA a pH
compresi tra 6.5 e 7.0 risultano maggiori rispetto a quelli osservati in ambiente fisiologico (pH 7.5) e a pH6.3.
Possiamo quindi concludere che l’espressione dei geni indotti dall’ipossia è influenzata da variazioni del pH. Tale influenza è tuttavia fortemente dipendente dal grado di acidità, dal complesso proteico preso in considerazione e dalla concentrazione di ossigeno: si passa infatti da una forte inibizione dell’espressione di CA9 e LOX a valori di pH pari a 6.3, ad una sovraespressione di GLUT-1 e LDH-A a pH uguali o inferiori a 6.5.17
34
L’ISOFORMA 5 DELLA LATTATO DEIDROGENASI UMANA
COME NUOVO TARGET ANTITUMORALE
Nelle cellule sane, la differenza di potenziale della membrana mitocondriale (Δψm)
viene sfruttata, mediante l’attività OXPHOS, per la produzione di ATP. Nella maggio parte delle cellule tumorali si evidenzia un anomalo incremento di Δψm con conseguente
iperpolarizzazione della membrana mitocondriale. Dato l’elevato consumo di glucosio di queste cellule, tale alterazione è stata associata ad una inibizione della respirazione cellulare in favore di un aumento della fermentazione lattica. Tale teoria, alla base del fenotipo glicolitico, è inoltre sostenuta da un aumento della produzione di acido lattico a livello dei tessuti tumorali.
Uno studio, volto a comprendere il rapporto tra l’insorgenza del fenotipo glicolitico e la riduzione di attività mitocondriale, si è preposto di osservare gli effetti dell’inibizione della conversione del piruvato in lattato nella sopravvivenza delle cellule tumorali sottoposte a ridotte concentrazioni di O2. In cellule di tumore al seno appena formate è stata inibita
geneticamente espressione dell’LDH-A tramite l’utilizzo di shRNA, un frammento di RNA capace di silenziare l'espressione genica di un target (Figura 37).
Figura 37.18 a) Attivazione dell’LDH-A e b) sensibilità al 2-deossi-D-glucosio in sei linee cellulari di tumore
al seno. Proliferazione cellulare di cloni con ridotta espressione (L2-5 e L2-10) e con ripristinata espressione dell’LDH-A (L2-5.c15) rispetto a cellule di riferimento in c) normossia e d) ipossia.
Come linea cellulare di riferimento è stata presa Neu4145 in quanto, tra le linee cellulari analizzate, era quella che presentava una maggiore sensibilità ad un antimetabolita del
35 glucosio, 2-deossi-D-glucosio, indicando una maggiore espressione dell’LDH-A. Queste cellule sono state successivamente trattate con tre shRNA (L1,L2 e L3) in modo da isolare altrettanti cloni con diversi livelli di espressione dell’LDH-A. Da questi ne sono stati selezionati due, L2-5 e L2-10, che presentavano una diminuzione dell’LDH-A rispettivamente del 69% e 75%. Mentre in condizioni di normossia la proliferazione delle cellule con ridotta espressione dell’LDH-A (L2-5 e L2-10) risulta marginalmente ritardata, in ridotta concentrazione di ossigeno si osserva una riduzione, di circa 100 ordini, della loro proliferazione rispetto alle cellule di controllo. Per smentire ogni dubbio, nelle linee cellulari prese in considerazione è stata nuovamente indotta l’espressione dell’LDH-A (L2-5.c15) mediante l’utilizzo di un filamento di DNA complementare: in seguito a tale modifica si è osservato un ripristino della sopravvivenza cellulare, anche in assenza di ossigeno.18
Questo studio ha quindi evidenziato, nell’LDH-A, un elemento fondamentale per consentire la sopravvivenza cellulare in condizioni ipossiche (Figura 38). Infatti, in presenza
di ossigeno, le cellule tumorali in cui la fermentazione lattica è inibita possono riattivare la fosforilazione ossidativa per la produzione di ATP, portando ad una riduzione del potenziale di membrana nei mitocondri e ad un aumento del consumo di ossigeno. Al contrario in mancanza di ossigeno tali cellule non sono in grado di avviare la respirazione cellulare e subiscono un brusco arresto della loro capacità proliferativa.
36 Appare quindi evidente che l’inibizione dell’LDH-A possa essere utilizzata a scopo terapeutico per la cura dei tumori ipossici: la sua inattivazione in assenza di ossigeno determina un accumulo del cofattore NADH con conseguente blocco del processo glicolitico e della produzione di energia necessaria alla sopravvivenza tumorale.
Non esistono oggigiorno molecole organiche in grado di inibire l’LDH-A, ma sono state attuate esclusivamente terapie geniche volte a ridurre o silenziare l’espressione del gene decodificante tale enzima.
Gli effetti generati dalla deficienza ereditaria dell’LDH-A possono facilitare la predizione degli effetti collaterali associati all’inibizione di questo enzima: solo in seguito a sforzo fisico si verifica una rigidità muscolare accompagnata da mioglobinuria, presenza di mioglobina nelle urine, causata da un danno al tessuto muscolare cui segue il rilascio di enzimi citosolici e proteine muscolari all’interno della circolazione ematica. Altri effetti collaterali possono essere causati da una mancata selettività nei confronti dell’isoforma 5 della lattato deidrogenasi: l’inibizione dell’LDH-1 potrebbe infatti portare ad effetti collaterali a livello del muscolo cardiaco e dei globuli rossi.
Nel presente lavoro di Tesi sono state quindi sintetizzate piccole molecole organiche nel tentativo di ottenere una inibizione rilevante e possibilmente selettiva nei confronti dell’isoforma 5 della lattato deidrogenasi.