INDICE
INDICE ... 1
1.INTRODUZIONE ... 3
1.1 IL LABORATORIO DI MICROBIOLOGIA CLINICA ... 3
1.2LE FASI DELL’INDAGINE MICROBIOLOGICA ... 14
1.2.1 La fase pre-analitica ... 15
1.2.1.1 Richiesta degli esami di laboratorio ... 19
1.2.1.2 Informazione e preparazione del paziente ... 23
1.2.1.3 Raccolta del campione ... 23
1.2.1.4 Identificazione del campione ... 30
1.2.1.5 Conservazione, trasporto ed accettazione del campione ... 30
2.SCOPO DELLA TESI ... 37
3.GESTIONE DEL CAMPIONE MICROBIOLOGICO ... 39
3.1INFEZIONE DEL SANGUE E DEL SISTEMA CARDIOVASCOLARE ... 47
3.1.1 Infezione del sangue ed endocardite ... 47
3.1.2 Infezione associata a cateteri vascolari ... 52
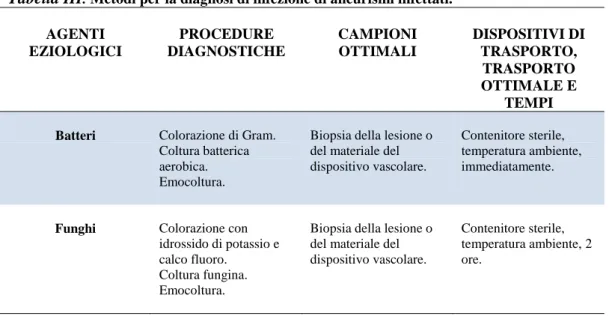
3.1.3 Aneurisma infettivo ed impianti vascolari ... 54
3.1.4 Pericardite e miocardite ... 55
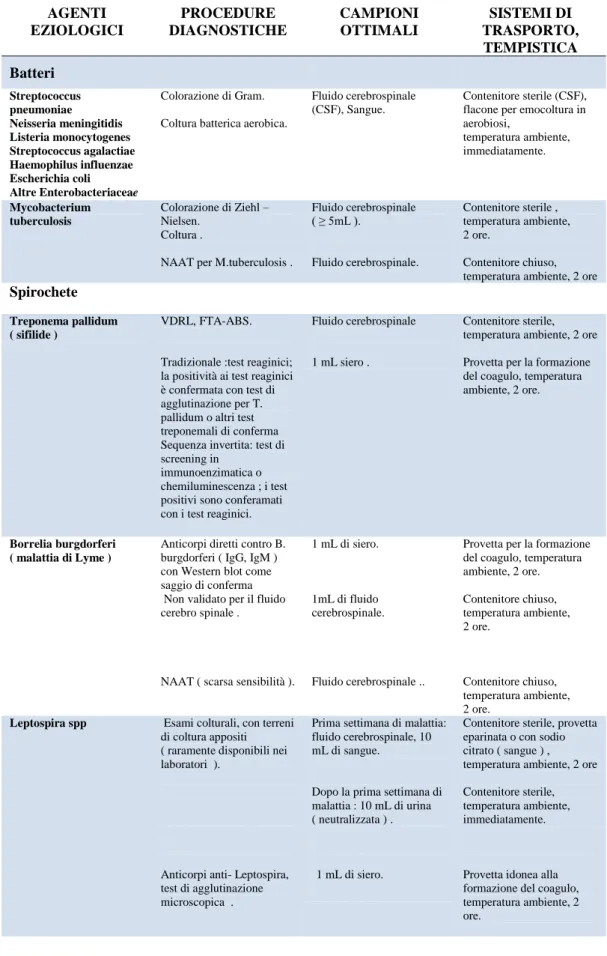
3.2INFEZIONI DEL SISTEMA NERVOSO CENTRALE ... 56
3.2.1.Meningite ... 58
3.2.2 Encefalite ... 62
3.2.3.Infezioni focali del parenchima cerebrale. ... 62
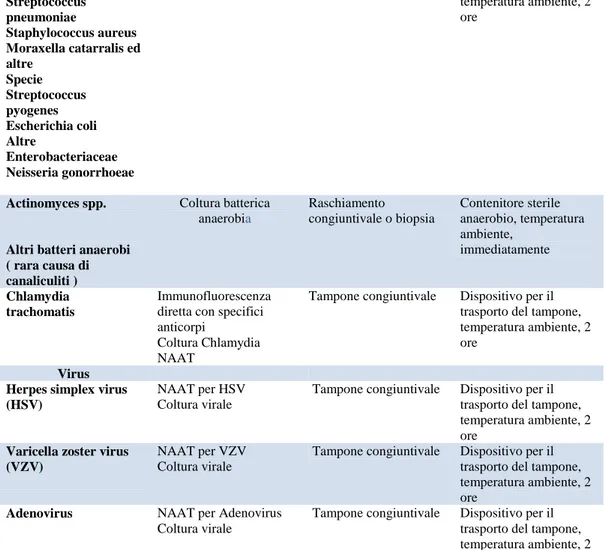
3.3INFEZIONI OCULARI ... 63
3.3.1.Cellulite orbitale e periorbitale ... 65
3.3.2 Congiuntivite ... 66
3.3.3 Cheratite ... 67
3.3.4 Endoftalmite ... 69
3.3.5 Uveite e retinite... 69
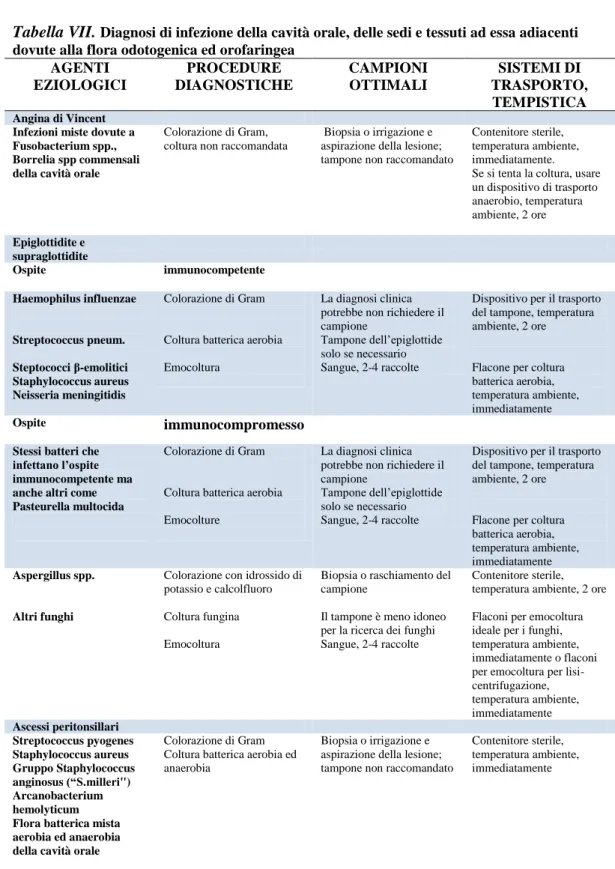
3.4INFEZIONI DEI TESSUTI MOLLI DELLA TESTA E DEL COLLO ... 72
3.5INFEZIONI BATTERICHE E FUNGINE DEL TRATTO RESPIRATORIO SUPERIORE ... 77
3.5.1 Otite media ... 78
3.5.2 Sinusite... 79
3.5.3 Faringite ... 80
3.6INFEZIONI DEL TRATTO RESPIRATORIO INFERIORE ... 82
3.6.1 Bronchite e bronchiolite ... 83
3.6.2 Polmonite comunitaria ... 83
3.6.3 Infezioni dello spazio pleurico ... 88
3.7INFEZIONI DEL TRATTO GASTROINTESTINALE ... 91
3.7.1 Esofagite ... 91
3.7.2 Gastrite ... 92
3.7.3 Gastroenterite e diarrea infettiva indotta da tossine ... 93
3.8INFEZIONI INTRAADDOMINALI ... 98
3.8.1 Peritonite batterica ed ascite ... 99
3.8.2 Peritonite secondaria ... 101
3.9INFEZIONI OSSEE ED ARTICOLARI... 105
3.9.1 Osteomielite ... 106 3.9.2 Infezioni articolari ... 107 3.10INFEZIONI URINARIE ... 109 3.11INFEZIONI GENITALI... 116 3.11.1 Vaginiti e vaginosi ... 118 3.11.2 Uretriti e Cerviciti ... 121 3.11.3 Lesioni genitali ... 121
3.11.4 Infezioni della pelvi femminile ... 127
3.12.INFEZIONI CUTANEE E DEI TESSUTI MOLLI ... 129
3.12.1. Infezioni conseguenti ad ustioni... 130
3.12.2.Infezioni associate a traumi ... 131
3.12.3. Infezioni fungine ... 132
3.13.MALATTIE VIRALI ... 134
3.14.INFEZIONI PARASSITARIE DEL SANGUE E DEI TESSUTI ... 136
4.CONCLUSIONI ... 143
5..INDICE DELLE TABELLE ... 145
6.BIBLIOGRAFIA CITATA ... 146
7.BIBLIOGRAFIA CONSULTATA ... 161
1. INTRODUZIONE
1.1 Il Laboratorio di Microbiologia Clinica
Ancora oggi la Microbiologia Clinica è la disciplina che ha meno usufruito dell’introduzione dell’automazione del processo analitico nella Medicina di Laboratorio. Tra le competenze del Laboratorio di Microbiologia si annoverano il supporto alla diagnosi, al trattamento, alla prevenzione delle patologie infettive provocate sia da patogeni primari in soggetti immunocompetenti, sia da patogeni opportunisti o condizionati in soggetti con difese immunitarie compromesse. L’avvento dell’automazione nella Microbiologia clinica si verifica nella prima metà degli anni Sessanta per poi gradualmente accelerare negli anni Settanta continuando fino ai giorni nostri seppur in maniera limitata rispetto agli altri settori della Medicina di Laboratorio [1]. Storicamente si è visto che il periodo che intercorre dal 1960 al 1975 è stato dominato dalla “miniaturizzazione e sviluppo” dei kit diagnostici, mentre dal 1975 al 1985 si è assistito alla comparsa dei test immunologici ed infine dal 1985 al 1995, si è avuta l’evoluzione delle varie applicazioni di tipo molecolare basate su reazioni a catena della polimerasi (PCR) e su sequenze specifiche
di acidi nucleici. Attualmente l’evoluzione della Proteomica e dei vari campi ad essa correlati ha condotto allo sviluppo della tecnologia Microarray.
Il Laboratorio di Microbiologia clinica si è evoluto insieme al ruolo del microbiologo. La figura del microbiologo e la diagnostica infettivologica in genere, stanno attraversando un processo di trasformazione, complesso e affascinante al tempo stesso, che, se correttamente gestito, può essere in grado di aumentarne l’impatto nella gestione clinica e terapeutica delle malattie da infezione [2].
Le prospettive di sviluppo della professione del microbiologo possono oggi essere valutate sotto tre diversi aspetti.
Il primo è rappresentato dal ruolo diagnostico, ossia l’elemento cardine dell’impegno dei professionisti del settore : in questo ambito sono oggi auspicabili e possibili dei significativi mutamenti sia sotto il profilo dell’efficienza analitico-strumentale, sia sotto il profilo dell’efficacia, concepita come capacità di interpretazione del risultato in senso clinico, al fine di conferire il valore aggiunto di vera e propria consulenza al risultato stesso [3]. Valutando l’aspetto diagnostico da una prospettiva strettamente analitica, è noto che l’accuratezza è da sempre garantita non solo dall’esperienza professionale degli operatori ma anche da una corretta gestione della fase pre-analitica, dalla
standardizzazione dei processi, dall’attenzione ai controlli di qualità e dall’adesione a linee guida e protocolli condivisi. Tuttavia pur disponendo di servizi diagnostici di elevata qualità analitica, non sempre si è in grado di interpretare e sfruttare al meglio il risultato microbiologico. Ciò che è biologicamente valido ed accurato non sempre risulta altrettanto utile e rilevante da un punto di vista clinico. Questo aspetto implica che il ruolo diagnostico del Laboratorio di Microbiologia debba orientarsi maggiormente verso l’efficacia clinica piuttosto che limitarsi alla sola scrupolosa attenzione per l’accuratezza. In senso strettamente analitico, quindi, oltre che di accuratezza, oggi c’è bisogno di efficienza e soprattutto di efficacia del risultato [4]. Dunque, il Laboratorio di Microbiologia Clinica, per migliorare l’impatto clinico del risultato microbiologico, dovrebbe fornire i risultati in tempi sempre più rapidi.
E’ unanimemente riconosciuto che disponendo di un antibiogramma in tempi il più possibile ridotti, si possa incidere sulla scelta del farmaco antimicrobico, riducendo dunque la spesa, e, contestualmente, dove possibile, sul tasso di mortalità [5].
Il microbiologo si trova di fronte ad una nuova sfida, più gestionale che analitica, un vero e proprio processo di “gestione operativa” mirato al cambiamento, che consiste principalmente nel
miglioramento dei flussi di lavoro per fornire dei risultati di elevata qualità nel minor tempo possibile rendendo in termini clinici il risultato microbiologico maggiormente fruibile. Numerosi laboratori di microbiologia per tradizione manifestano notevoli resistenze verso questi nuovi scenari diagnostico-organizzativi, non sfruttando a pieno tutti i vantaggi delle nuove tecnologie sia in termini di riduzione dei tempi di lavorazione che di refertazione. Viene così meno l’impatto innovativo di tali strumentazioni sulla scelta di una terapia antibiotica mirata [6].
GV Doern [5] ha dimostrato in un noto studio sull’impatto clinico della diagnostica rapida in microbiologia, che la disponibilità del referto analitico in tempi ridotti sia già in grado di modificare la terapia, ma ha anche constatato l’incidenza significativa sul “costo totale” del ricovero, soprattutto in termini di richieste analitiche ulteriori, spesso inappropriate o ridondanti.
Il passaggio da una “visione biologica” ad una “visione clinica” della Microbiologia, mediato dall’avvento della nuova tecnologia analitica, è perciò “epocale”: si tratta infatti di traghettare i servizi diagnostici da una concezione secondo la quale si è chiamati a produrre “un’identificazione ed un antibiogramma di eccellenza senza porsi precisi limiti di tempo per giungere al risultato” ad una gestione
secondo cui si è invece chiamati a fornire “un’identificazione ed un antibiogramma comunque di eccellenza, ma nel più breve tempo possibile”. In questo contesto la qualità analitica e il controllo di qualità interno ed esterno rappresentano degli elementi essenziali che però non possono prescindere dall’importanza del tempo analitico, sul quale si basa la vera innovazione in termini qualitativi di un moderno servizio di microbiologia.
Attualmente l’introduzione di sistemi ad “automazione spinta” per l’identificazione dei microrganismi e per l’antibiogramma sta creando al tempo stesso l’esigenza di una nuova gestione del personale e dei servizi, che permetta di fruire concretamente dei vantaggi della maggiore velocità di refertazione del risultato analitico, che a sua volta influisce direttamente sulla scelta terapeutica. Una diversa distribuzione del lavoro ed il miglioramento dei tempi di risposta conseguenti all’introduzione dell’automazione in Microbiologia, insieme ad un’estesa informatizzazione (interfaccia strumentale dei sistemi analitici e collegamento via rete con i reparti), rispecchiando così la visione del cosiddetto “ospedale senza carta”, può consentire la riorganizzazione delle diverse aree diagnostiche recuperando personale da destinare a turni di lavoro diversificati rispetto al passato, e distribuiti nell’arco della giornata e della
settimana, permettendo così anche di superare in parte le ormai diffuse ristrettezze di bilancio che impediscono di remunerare gli straordinari effettuati.
In una indagine di EJ Baron [3] condotta in collaborazione con i membri della “Società Americana di Malattie Infettive (IDSA)”, i requisiti richiesti ad un moderno servizio di Microbiologia sono rappresentati dalla celerità dei tempi di consegna dei risultati, dalla possibilità di ricevere anticipazioni telefoniche del risultato, dalla fruibilità dei risultati in rete e poi ancora dalla disponibilità del personale di prestare servizio nei week-end e possibilmente di notte.
Un altro elemento di non poca importanza consiste nella possibilità di disporre di una consulenza costante da parte del responsabile del laboratorio: l’importanza dell’interpretazione del risultato analitico è un altro elemento in grado di misurare le potenzialità “cliniche” di un moderno servizio di Microbiologia [3].
Il microbiologo, dunque, dovrebbe riappropriarsi di un ruolo clinico ed interpretativo del referto che oggi di solito non possiede [4]. A questo proposito, è bene sottolineare l’importante ruolo di consulenza dei colleghi anatomopatologi e radiologi, i quali, utilizzando per consuetudine nei propri referti degli articolati giudizi di compatibilità con il sospetto clinico del medico curante, sono in
grado di condizionare molto più dei microbiologi la prescrizione e l’esito stesso delle indagini loro richieste.
Da parte dei microbiologi vi è tuttavia una notevole riluttanza ad esprimere commenti e giudizi, anche se talora essi potrebbero meglio indirizzare il medico nella scelta terapeutica.
La Microbiologia richiede una stretta relazione tra il risultato analitico e lo stato clinico del paziente, ed inoltre qualsiasi esame microbiologico dovrebbe essere accompagnato da un preciso quesito clinico [4]. É anche vero che solo un referto che risponda in modo chiaro ed esauriente proprio a quel quesito è in grado di ridurre la prescrizione di indagini diagnostiche inutili e ridondanti, guidando così la scelta clinica e terapeutica. Se sul piano più strettamente analitico e biologico l’accuratezza è un aspetto importante in Microbiologia, pur facendosi più pressante la richiesta di una maggiore efficienza ed efficacia, sul piano epidemiologico si aprono scenari che coinvolgono in sempre maggior misura la figura del microbiologo sotto il profilo più strettamente clinico. Mentre il trattamento del singolo paziente deve rapportarsi con una diagnosi accurata, efficiente ed efficace della malattia in atto, in generale nella “gestione” delle malattie infettive c’è un crescente bisogno di conoscenza e valutazione delle situazioni epidemiologiche locali e la
necessità di riferire tutto ciò alla realtà clinica quotidiana e ad un più razionale uso dei farmaci antimicrobici [7]. In quest’ottica nasce non solo l’esigenza di produrre a cadenze regolari e rendere disponibili in rete “relazioni epidemiologiche” per meglio monitorare le nuove resistenze antibiotiche e le infezioni nosocomiali, ma soprattutto sorge la necessità di creare occasioni per un confronto quotidiano con i clinici su specifici aspetti che emergono dai dati elaborati ed in proprio possesso. A questo scopo, il migliore approccio consiste nel confrontarsi in “incontri faccia a faccia” [2] che consentono di analizzare le situazioni delle singole realtà, correlandole a determinati eventi o all’utilizzo di taluni farmaci antimicrobici piuttosto che altri, permettendo anche di chiarire meglio le dinamiche alla base dei nuovi fenomeni di resistenza e consentendo di discutere collegialmente le precauzioni da attuare per contrastarli. E’ ormai dimostrato che dove questo tipo di analisi e di confronto epidemiologico è da anni concretato [8], si è riusciti a contenere efficacemente numerosi fenomeni di diffusione delle resistenze, altrove invece molto estesi. Il ruolo del microbiologo clinico, pertanto, non deve consistere solamente nel produrre “sterili relazioni epidemiologiche”, ma piuttosto anche nel saperle interpretare e commentare perché spesso anche elementi che a prima vista sembrano intuitivi per un
professionista del settore, possono invece essere fonte di scorrette interpretazioni cliniche, con la conseguenza di indurre un uso non razionale degli antibiotici. Per questo anche i moderni sistemi “commerciali” concepiti per un controllo epidemiologico ad estesa automazione, vanno necessariamente ricondotti ad un giudizio critico ed obiettivo. Infatti se essi costituiscono un ausilio importante nella gestione del controllo delle infezioni ospedaliere, non possono e non devono prescindere dallo sviluppo di un adeguato supporto interpretativo e soprattutto dall’implementazione di un rapporto diretto con il clinico che non deve essere mediato in alcun modo dal solo mezzo informatico. Essi rappresentano in qualche modo un modello analogo ai moderni sistemi analitici automatizzati in Microbiologia ed ai sistemi “esperti” ad essi correlati, i quali, pur migliorando i flussi analitici e gestionali del laboratorio moderno, nulla devono e possono togliere all’esperienza critica, diagnostica e clinica del microbiologo. Lo sviluppo professionale partecipativo e propositivo del microbiologo e la sua “presenza clinica” sono parte integrante ed un’evoluzione naturale dei primi due processi descritti: quello analitico, che ha necessità di crescere secondo una più moderna visione di qualità globale, clinica, interpretativa e gestionale, e quello di consulenza clinico-epidemiogica. Attraverso le esperienze e le
prospettive descritte, il microbiologo si svincola da un ruolo “squisitamente biologico” per assumere e sviluppare un nuovo ruolo “clinico”, più partecipe delle realtà ospedaliera e territoriale nelle quali opera [9]. Il microbiologo, perciò, deve sapersi confrontare con i colleghi medici su specifici aspetti, quali ad esempio il rapporto tra epidemiologia locale, resistenze e consumo di antibiotici, sapersi esprimere circa la scelta razionale delle molecole da testare o da introdurre o da eliminare nei prontuari terapeutici in base a motivate ragioni epidemiologiche locali. Essere “clinicamente presenti” significa sapere indicare le scelte più razionali dei farmaci rispetto agli isolati, e il loro dosaggio più appropriato in rapporto alle MIC (Minima Concentrazione Inibente) e alla situazione del paziente. Al microbiologo clinico oggi è richiesto anche di essere parte integrante nella gestione delle infezioni nosocomiali e nella stesura di linee guida terapeutiche o di profilassi che siano espressione tangibile della realtà locale. Si può affermare che oltre al lavoro “al banco” garantito nel laboratorio moderno da altre figure professionali, assume maggiore rilevanza la capacità di consulenza, la continua disponibilità ad evolversi e rinnovarsi [7]. Tutto ciò, ovviamente, richiede non solo un’esperienza microbiologica, epidemiologica e clinica, ma anche conoscenze di fisiopatologia e di farmacologia ed una capacità
gestionale che sono il frutto di un complesso percorso di “apprendimento continuo”, dal quale può emergere una figura di professionista capace di decisioni cliniche prima ancora che diagnostiche, e in grado di gestire i processi analitici in modo da fornire risultati rilevanti sul piano clinico, comprensibili e sfruttabili dal medico curante. Un professionista caratterizzato in ultima analisi da quel tratto che consiste “nell’arte della diagnostica microbiologica
insieme alla capacità di interagire con i clinici e da quella capacità di combinare insieme la Microbiologia medica con la Medicina clinica”
1.2 Le fasi dell’indagine microbiologica
Le peculiarità della Diagnostica di Laboratorio delle malattie infettive sono rappresentate da una forte influenza della fase pre-analitica sul risultato; dall’individuazione del patogeno, e dall’interazione tra due sistemi biologici, ossia del rapporto ospite-microrganismo. In Microbiologia Clinica si è dinanzi all’unico esempio diagnostico che consente di “isolare, coltivare e conservare” l’agente responsabile della patologia, per poterlo eventualmente valutare dal punto di vista tassonomico, epidemiologico e terapeutico. L’isolamento, l’identificazione e la caratterizzazione genotipica/fenotipica di un patogeno sono il frutto di un iter diagnostico che si articola in più fasi :
Fase pre-analitica ; Fase analitica ; Fase post-analitica.
L’intervallo di tempo che intercorre tra la fase pre-analitica e quella post-analitica viene definito “Turn-Around Time” (TAT), ossia il tempo che si interpone tra il momento del prelievo e l’acquisizione
del risultato da parte del richiedente. Tale definizione “classica” del concetto di Turn Around Time si oppone a quella laboratoristica secondo la quale il TAT corrisponde all’intervallo di tempo compreso tra l’accettazione del campione e la refertazione dell’indagine. Di recente, si è parlato di Therapeutic Turn Around Time (TTAT), come lasso di tempo che separa la richiesta dell’esame da parte del clinico e il conseguimento del risultato che gli permette di assumere una decisione di valore clinico. La riduzione del valore del TAT e di conseguenza l’incremento della qualità del servizio diagnostico, è un obiettivo di non facile raggiungimento data la complessità e la numerosità di fattori che nel loro insieme lo determinano.
1.2.1 La fase pre-analitica
In ordine cronologico la fase pre-analitica ha inizio con la richiesta dell’esame da parte del clinico, prosegue con la preparazione del paziente, la raccolta del campione primario, la sua eventuale conservazione, il trasporto al laboratorio e termina all’avvio delle procedure analitiche.
In Microbiologia Clinica la fase pre-analitica è un momento diagnostico di estrema importanza poiché in essa si registra la maggior parte degli errori diagnostici tra i quali si annoverano campioni non rappresentativi dell’infezione o prelevati in maniera errata. Inoltre è un importante momento di interfaccia tra il laboratorio e le altre parti “interessate” al processo (paziente, familiari, medico, fornitore) ed infine indirizza la ricerca microbiologica, condizionandone le modalità impiegate per la lavorazione del campione quali l’iter diagnostico e le tecniche di analisi.
La fase pre-analitica si articola in varie fasi :
Richiesta degli esami di laboratorio Informazione e preparazione del paziente Raccolta del campione
Identificazione del campione
Conservazione, trasporto ed accettazione del campione in laboratorio
Per gestire al meglio la qualità nella fase pre-analitica serve una richiesta mirata al quesito diagnostico, un campione appropriato alla richiesta, un’identificazione corretta del campione e la conformità
dello stesso mediante l’impiego di protocolli per le istruzioni degli esami effettuati, sulle modalità di prelievo e trasporto e sulla conservazione del campione.
Appurato che l’appropriatezza della fase pre-analitica condiziona fortemente la qualità della risposta microbiologica, responsabilità del laboratorio di microbiologia è redigere un manuale di raccolta dei campioni primari per gli operatori addetti ai prelievi, contenente la lista degli esami eseguibili dal laboratorio, il modulo di consenso informato (ove richiesto), le informazioni da fornire al paziente per la raccolta e le istruzioni per gli utilizzatori sulle indicazioni cliniche e sull’appropriatezza nella scelta delle procedure analitiche disponibili. Pertanto, è necessario illustrare le procedure per la preparazione dei pazienti, per l’identificazione del campione primario e per la sua raccolta con relativa descrizione dei contenitori/additivi necessari. Ulteriore attenzione va posta alle modalità di compilazione della richiesta cartacea o elettronica, al tipo e alla quantità di campione da prelevare, al momento di raccolta e a tutte quelle manipolazioni che intercorrono tra il momento del prelievo e la consegna in laboratorio (refrigerazione, riscaldamento, consegna immediata).
Di notevole importanza sono le procedure di accettazione del campione quali l’etichettatura, la conservazione dei campioni esaminati, la gestione di possibili esami aggiuntivi ed i limiti di tempo per la richiesta degli stessi. Dovere del personale del laboratorio di microbiologia è la segnalazione delle non conformità relative al prelievo o al campione qualora le istruzioni o le procedure illustrate nel manuale di raccolta dei campioni primari siano state ignorate. Tale manuale, inoltre, necessita di continue verifiche e aggiornamenti che dovranno essere comunicati agli operatori. Nonostante tutte le indagini di laboratorio possano rivestire o possano assumere carattere di urgenza data la loro finalità, solo in particolari casi, essi possono essere considerati “urgenti” in senso stretto, in quanto critiche per la sopravvivenza del paziente. I campioni urgenti avranno dunque la precedenza nell’iter diagnostico e saranno quindi processati prima di quelli ordinari. Sono da considerarsi urgenze microbiologiche il liquor cefalorachidiano in caso di sospetta meningite, tamponi per sospetta difterite, infezioni di tessuti molli per sospetta mionecrosi/fascite necrotizzante, feci per sospetta infezione da colera e campioni aspirati o prelevati durante TAC o in sala operatoria. In questi casi il laboratorio deve predisporre una procedura scritta per le modalità di richiesta e di trasmissione degli esami urgenti per garantirne la
tracciabilità. Questa procedura prevede che nel modulo di richiesta siano specificati il quesito clinico e dettagli sul campione primario, sulle modalità di trasferimento dello stesso presso l’area analitica, nonchè sul processamento rapido e sui criteri particolari di refertazione da seguire.
1.2.1.1 Richiesta degli esami di laboratorio
Il ricorso alle prestazioni di laboratorio deve essere sempre ragionato: il medico deve cercare di inquadrare clinicamente ed epidemiologicamente l’infezione, nonché localizzarla individuando l’organo/i interessato. Nella preliminare formulazione del sospetto diagnostico e nella scelta del campione da prelevare, il clinico deve ricordare che non è sempre possibile ricercare tutti i microrganismi in un determinato campione .
Di notevole importanza è la limitazione della spesa sanitaria conseguibile con una riduzione della prescrizione dei numero di test di laboratorio e con una minore ospedalizzazione. Resta necessario evitare la richiesta di esami con valore diagnostico improbabile o discutibile, ossia non confermato dalla letteratura.
Gli interventi medici sono attualmente e, lo saranno di più in futuro, condizionati dalla limitazione delle risorse economiche, pertanto la valutazione del rapporto costo-beneficio dovrà essere tenuta sempre in considerazione dal clinico in ogni sua scelta, inclusa quella di ricorrere all’ausilio del laboratorio. Andrebbero evitate richieste generiche del tipo “esame colturale delle feci” o “esame del tampone faringeo” o “ricerca di germi comuni”, poiché prive del sospetto diagnostico. La prescrizione di accertamenti microbiologici viene giustificata per diagnosi di forme clinicamente atipiche od iniziali, per la determinazione della sensibilità ai farmaci, ma anche nelle sindromi polieziologiche per indicazioni terapeutiche sempre in assenza di specifiche informazioni epidemiologiche. La richiesta di accertamenti microbiologici si rende quasi sempre necessaria nella patologia infettiva del paziente immunocompromesso per ottenere indicazioni terapeutiche. Da non trascurare il ruolo degli accertamenti microbiologici per ottenere valutazioni epidemiologiche indispensabili per lo studio della circolazione dei microrganismi, per identificare i fattori di rischio, per adottare idonee misure preventive e per definire un corretto approccio diagnostico e terapeutico.
Come sancito dalla norma ISO 1518B9, nella richiesta sono da riportare le principali informazioni quali :
Nome del medico richiedente ;
Nome, Cognome, data di nascita, sesso del paziente ; Data ed ora della raccolta del campione ;
Tipologia di campione e sito anatomico di prelievo ; Sospetto diagnostico ;
Esame richiesto ;
Eventuale pericolosità del campione ;
Informazioni cliniche rilevanti per il microbiologo clinico
La norma ISO 1518B9 rivolge la sua attenzione anche alle richieste verbali di esami e alla tracciabilità del campione. In merito alle richieste verbali viene sancito che il laboratorio deve predisporre di una procedura scritta per le stesse. Occorre definire se, in casi particolari, possano però essere accettate richieste telefoniche e con quali specifiche e modalità, in modo tale da giustificare l’urgenza dell’esame o la necessità di ulteriori approfondimenti diagnostici. Questi aspetti dovrebbero comunque essere valutati ed accettati da un dirigente del laboratorio, tuttavia la richiesta deve in qualsiasi caso essere documentata appena possibile. Un aspetto importante della richiesta è anche quello di consentire la tracciabilità del campione,
ossia, di poter disporre di tutta la documentazione che permetta di verificare la bontà e l’accettabilità dell’intero processo analitico. A tal fine tutti i campioni primari (ovvero le aliquote di campione) devono essere accompagnati da una richiesta rispetto alla quale devono essere “rintracciabili”. Qualora i campioni non siano correttamente identificati, questi non devono essere accettati o processati dal laboratorio. Eccezione a quanto detto è rappresentata da campioni di difficile prelievo o facile deperimento (liquor, biopsie ecc..) : in questi casi al laboratorio è consentito di processare il campione anche in assenza di richiesta, salvo poi refertare solo dopo che il clinico richiedente o il prelevatore si sia assunto la responsabilità dell’identificazione con l’apposizione della propria firma sulla richiesta, sia essa cartacea o elettronica.
1.2.1.2 Informazione e preparazione del paziente
Il paziente deve essere informato sulle procedure da osservare per un’appropriata raccolta dei campioni.
Necessaria è la garanzia del rispetto della privacy del paziente. Solo così si otterrà il suo consenso e la sua collaborazione. Nel caso in cui il paziente è parte attiva nel processo del prelievo del campione, ossia in caso raccolta domiciliare in assenza di personale sanitario, costui deve essere adeguatamente istruito non solo in merito alle corrette modalità di prelievo, ma anche sulla conservazione e trasporto del campione. Quali esempi di raccolte domiciliari critiche annoveriamo la raccolta delle urine mediante tecniche del mitto intermedio e delle 24 ore, e la raccolta delle feci.
1.2.1.3 Raccolta del campione
Per campione clinico viene intesa quella porzione di materiale biologico da sottoporre ad indagine per verificare la presenza/assenza di specifici microrganismi a significato prognostico. Esistono diverse modalità di prelievo del campione. I siti normalmente sterili quali gli ascessi profondi, il liquor, il polmone, il fegato ed il sangue,
richiedono un prelievo diretto mediante varie tecniche come ago aspirato, biopsia chirurgica ecc.. Questa tipologia di prelievo necessita di assistenza medica. Più vantaggiosi per il clinico ed il paziente, in quanto non invasivi ma di difficile interpretazione, sono quei campioni ottenuti per prelievo indiretto. In questa categoria si ricordano gli essudati infiammatori (espettorato) o campioni (urine) che prima di essere raccolti attraversano siti contaminati da flora commensale. La terza modalità di prelievo è quella a partire da un sito primario dell’infezione, caratterizzata da flora autoctona, quale faringe o intestino crasso. In questi casi la diagnosi microbiologica è difficoltosa poiché è rivolta alla ricerca “selettiva” di patogeni, ad esempio Salmonella, Shigella, Campylobacter nelle feci e
Streptococcus pyogenes nel tampone faringeo.
La selezione di un campione per la diagnosi di infezione virale in genere è più semplificata poiché la contaminazione da altri virus è solitamente scarsa.
Ad ogni campione biologico è associato un potenziale rischio biologico per la salute degli operatori sanitari. Questo obbliga la necessità dell’impiego nel corso del prelievo di vari dispositivi per la protezione individuale (guanti, camice, occhiali, visiera, mascherine etc..) atti a contenere il rischio biologico. Affinché l’indagine
microbiologica fornisca notizie clinicamente utili è innanzitutto necessario che il materiale biologico (campione), dal quale inizia l’iter diagnostico, sia appropriato, ossia rappresentativo della patologia sulla quale si indaga. Il conseguimento dell’appropriatezza del campione si ha quando questo è di tipologia adeguata, ossia viene raccolto nel momento giusto a partire da un distretto corporeo rappresentativo della malattia ed in quantità sufficiente per l’esecuzione dell’indagine diagnostica ed infine rispetta la modalità di raccolta in asepsi, in modo da evitarne la contaminazione. Un campione “appropriato” dovrebbe essere prelevato nella fase acuta della malattia, quando l’agente eziologico è presente in maggiori quantità come nel caso dei parassiti ematici, dove il prelievo ematico andrebbe effettuato al picco febbrile, mentre nel caso degli Ortomyxovirus si predilige la raccolta nei primissimi giorni di infezione così come nella leptospiremia è preferibile una raccolta nella prima settimana di malattia. Essendo dimostrata l’interferenza degli antibiotici sulla crescita microbica e di conseguenza sull’esito dell’indagine diagnostica, in particolare sull’isolamento colturale, è preferibile che il campione clinico venga sempre raccolto prima dell’inizio di una terapia antimicrobica, qualora possibile, oppure a seguito di interruzione della stessa da almeno 48/72 ore. Esempi di interferenze antibiotiche sull’esame
microscopico e colturale sono forniti dalle frequenti false negatività nel liquor a causa di terapia in atto. Talvolta il paziente è sottoposto a trattamento antibiotico per un’altra forma morbosa concomitante o nel caso di terapia empirica che non è possibile sospendere. In questi casi è necessario avvertire il laboratorio indicando nella richiesta lo schema terapeutico impiegato (tipologia di antibiotico, posologia e modalità di somministrazione). Questo consentirà al microbiologo di limitare il più possibile l’effetto antibatterico tramite l’adozione di accorgimenti tecnici come ad esempio l’utilizzo di resine, carbone, ecc.. che permettono la separazione dell’antibiotico dal liquido colturale.
Le secrezioni mattutine sono di norma più concentrate contenendo quindi una maggiore quantità dell’agente eziologico per unità di volume: questo è da ricordarsi qualora sia necessaria la raccolta di urine o di escreato. In alcuni casi il microrganismo viene rilasciato con intermittenza da parte dell’ospite (tubercolosi renale, giardiasi) giustificando dunque la necessità di un campionamento ripetuto. L’importanza della sede del prelievo si identifica nella scelta dell’esatto punto in cui potrebbe essere presente l’infezione così da scegliere nel modo più appropriato i presidi diagnostici come la tipologia dei terreni di coltura e l’atmosfera di incubazione. In tal
modo si hanno anche delle indicazioni sulla tipologia dei microrganismi che possono avere in quella sede un ruolo eziopatologico ed in più indicazioni sulla possibilità di eseguire indagini aggiuntive. L’identificazione del distretto corporeo rappresentativo dell’area infetta deriva da un’adeguata conoscenza della biologia del microrganismo e della storia naturale della malattia infettiva in esame. La febbre tifoide, per esempio, ha un caratteristico decorso bimodale: una fase precoce compresa tra la prima e seconda settimana, con stato febbrile, emocoltura positiva nel 90-100 % dei casi e coprocoltura frequentemente negativa; una seconda fase, terza settimana, spesso diarroica, in cui Salmonella typhi viene isolata più frequentemente dalle feci che dal sangue. Dunque il sospetto clinico di febbre tifoide suggerisce la ricerca del microrganismo nel sangue tra la prima e la seconda settimana, mentre la ricerca va effettuata nelle feci, in terza e quarta settimana. Qualora un’infezione possa dare manifestazioni sistemiche come nel caso della meningite, infezioni bronco-polmonari, infezioni urinarie, si rende opportuna la richiesta di un’emocoltura. Il prelievo di una quantità sufficiente di campione è una condizione necessaria per potere effettuare un test diagnostico di qualità. Infatti la sensibilità di un test diagnostico è generalmente dipendente dalla quantità di materiale esaminato. Molte infezioni
tuttavia sono caratterizzate da una bassa carica microbica nel sito di infezione: le batteriemie per esempio sono generalmente pauciparassitemiche. Questo implica che la sensibilità dell’esame emocolturale sia quindi influenzata dalla quantità (volume) del campione prelevato. La raccolta di una scarsa quantità di campione può pertanto generare risultati falsi-negativi. La presenza di microrganismi non responsabili della patologia (contaminanti) inficia il risultato dell’indagine microbiologica. La crescita dei microrganismi contaminanti può alterare il naturale rapporto quantitativo fra le componenti microbiche del campione agendo negativamente soprattutto quando un risultato viene interpretato su base quantitativa. Le contaminazioni microbiche possono inoltre ridurre oppure inibire la crescita del patogeno come nel caso di micobatteri o enteropatogeni nelle feci. A tal riguardo per evitare contaminazioni con altri microrganismi, il prelievo del campione deve essere eseguito in asepsi, previa adozione di antisettici. Si possono individuare due principali tipologie di contaminazione: una esogena, generalmente di origine ambientale, l’altra endogena, originata dalla flora autoctona. I campioni principalmente soggetti a contaminazione endogena sono rappresentati da essudato bronchiale, urina, sangue ed essudati. Un campione biologico può essere prelevato da distretti sterili e distretti
non sterili. I distretti sterili sono quelli non a diretto contatto con l’esterno e quindi fisiologicamente sterili come il sistema cardio-vascolare, il sistema nervoso, la vescica, gli ureteri, i reni, il fegato, la milza, i tessuti profondi, le cavità chiuse, i polmoni e i bronchi terminali. In tali sedi ogni isolamento assume significato eziologico. I distretti non sterili, invece, sono in diretto contatto con l’ambiente e quindi contaminati dalla flora microbica residente. Tra questi si annoverano la cute, la congiuntiva, il nasofaringe, l’orofaringe, l’orecchio esterno, l’intestino, il retto, la vagina e l’uretra terminale. In questi casi l’interpretazione risulta dunque più difficile ed è fondamentale una conoscenza approfondita sia dell’eziologia dell’infezione sia della flora potenzialmente contaminante. D’altro canto il clinico dovrà richiedere in maniera mirata la ricerca di uno o più specifici patogeni nel contesto dell’abbondante flora contaminante. E’ da sottolineare che nel paziente immunocompromesso, taluni contaminanti possono assumere un significato eziologico, come ad esempio Staphylococcus epidermidis.
1.2.1.4 Identificazione del campione
Il campione deve essere opportunamente contrassegnato e sigillato prima del suo trasporto verso il laboratorio. Il contenitore inviato al laboratorio deve essere identificato con l’etichetta riportante il relativo codice a barre ed accompagnato da un modulo di richiesta qualora si sia in assenza di accettazione telematica. Il modulo di richiesta dovrà indicare l’identificativo del paziente (nome, cognome, età e sesso), il nominativo del prelevatore, la data e l’ora di campionamento, la diagnosi clinica presuntiva, la ricerca microbiologica mirata da eseguire soprattutto qualora si sospetti la presenza di patogeni infrequenti, ed infine le informazioni cliniche ausiliarie, come i precedenti esami microbiologici, e la terapia antibiotica pregressa o in atto.
1.2.1.5 Conservazione, trasporto ed accettazione del campione
Il campione deve essere trasportato e consegnato in laboratorio in contenitori che siano adeguati per la tipologia del campione clinico e del sospetto eziologico, rispettando l’intervallo di tempo appropriato alla natura dell’esame richiesto, l’intervallo di temperatura indicato
nel manuale di prelievo e, se necessario, utilizzando idonei additivi per garantire l’integrità del campione. Devono inoltre essere osservate le dovute istruzioni che assicurino la preservazione dei microrganismi patogeni, adottando dunque specifici sistemi di trasporto come nel caso di tamponi o per la ricerca di microrganismi anaerobi. Da non tralasciare la messa in sicurezza del campione durante il trasporto verso il laboratorio in modo da garantire l’incolumità di tutte le figure coinvolte.
Per la raccolta di campioni biologici liquidi (urine, escreato, altri fluidi biologici) oppure solidi (catetere, biopsie di tessuto) è opportuno utilizzare un contenitore le cui caratteristiche assicurino un trasporto ed una manipolazione ottimali del campione. Il contenitore deve essere sterile e monouso per evitare la contaminazione del campione; la sterilità deve essere dichiarata dal produttore con certificato allegato ove è anche stabilita la data di scadenza e il metodo utilizzato per il conseguimento della sterilità stessa (irraggiamento, ossido di etilene). Il sistema di chiusura deve essere a perfetta tenuta, come la chiusura a vite, preferibile poiché riduce la formazione di aerosol all’apertura del contenitore, o a pressione. L’integrità del contenitore dedito al trasporto del campione è necessaria per evitare sia perdite, sia contaminazioni. E’ preferibile
verificare visivamente l’integrità del contenitore prima del suo utilizzo. La tipologia del contenitore, intesa in termini di forma e di capacità dello stesso, viene scelta sulla base delle caratteristiche del campione e dell’indagine ed inoltre per facilitare la raccolta del materiale, in alcuni casi, è preferibile l’utilizzo di contenitori ad apertura larga.
Il campione biologico deve essere inviato al laboratorio il più rapidamente possibile affinché il suo processamento possa avvenire entro le due ore dal prelievo. Un trasporto protratto oltre questo periodo potrebbe ridurre la vitalità dei microrganismi determinando una falsa negatività, (Neisseria gonorrhoeae, ecc..), potrebbe favorire la crescita dei contaminanti comportando una falsa positività o favorire la crescita dei microrganismi patogeni falsando l’interpretazione dei test diagnostici quantitativi, ad esempio l’urinocoltura. Alcune sostanze usate nelle procedure di raccolta, se lasciate per lunghi periodi a contatto con microrganismi, potrebbero avere attività antibatterica, come nel caso del benoxinato (ossibuprocaina), anestetico locale.
In caso di necessità (tamponi o ricerca di anaerobi) possono essere utilizzati adeguati terreni di trasporto atti a garantire la sopravvivenza del microrganismo patogeno durante un trasporto
ritardato. Si è visto che a seguito di un trasporto di due ore a temperatura ambiente, la popolazione batterica è in grado di aumentare di circa 64 volte. Generalmente durante il trasporto il campione viene refrigerato (2-8° C). Tuttavia è opportuno conservare a temperatura ambiente il campione nel caso di sangue inoculato in sistema per emocoltura, che va incubato a 35-37° C, oppure mantenuto a temperatura ambiente; nel caso di campioni contenenti microrganismi termosensibili (liquor, feci, campioni da vie genitali, occhio e orecchio); di campioni per la ricerca di batteri anaerobi. I campioni di feci per l’esame parassitologico vanno miscelati con un conservante adeguato. Qualora non fosse possibile inviare rapidamente (entro due ore) il campione al laboratorio, la sua conservazione (per massimo 24 ore) deve avvenire secondo le indicazioni fornite dal laboratorio. La necessità di disporre di sistemi per il trasporto dei campioni è significativamente aumentata negli ultimi anni a causa del maggior ricorso alle attività ambulatoriali, della riduzione del numero dei giorni di degenza e dalla progressiva centralizzazione dei laboratori, imposta da nuovi assetti organizzativi. La sopravvivenza batterica al di fuori dell’organismo umano viene prolungata dall’utilizzo di diversi terreni di trasporto, liquidi o agarizzati. L’impiego del terreno di trasporto è finalizzato a mantenere
inalterato l’aspetto di un campione, ossia preservarne le caratteristiche chimico-fisiche e biologiche, mantenendo un adeguato ph, prevenendo sia la disidratazione delle secrezioni durante il trasporto, sia l’ossidazione e l’autodigestione enzimatica dei microrganismi presenti. Un buon terreno di trasporto deve garantire la sopravvivenza dei microrganismi senza però favorirne la crescita, in tal modo evitando di falsare l’interpretazione di indagini diagnostiche quantitative. Come già detto in precedenza, ogni campione deve essere considerato come potenziale fonte di rischio biologico per la salute degli operatori sanitari. In accordo con la normativa (legge n.21
del 20.07.94, circolare n. 3, 8 maggio 2003), le linee guida del
Ministero della Salute, OMS ed ISO, il trasporto dei campioni biologici deve avvenire in sicurezza, ossia evitando la dispersione del materiale biologico e l’eventuale contaminazione di altri materiali, di attrezzature, dei pazienti e del personale che dovrà manipolare il campione stesso. Nel caso di campione singolo come provetta, tampone o flacone, è richiesto l’impiego di un’apposita busta di plastica monouso a due scomparti: l’uno dotato di chiusura a pressione per alloggiare il campione biologico, l’altro per il modulo di richiesta debitamente compilato. Sul fronte del sacchetto sono stampati il simbolo del rischio biologico e le istruzioni. I campioni multipli
invece richiedono il trasporto in contenitori rigidi e a chiusura ermetica. Qualora l’invio dei campioni avvenga in orari “non ordinari” è richiesta una pianificazione con il laboratorio della loro raccolta ed invio. In base alla norma ISO 15189, il laboratorio ha l’obbligo di monitorare le condizioni di sicurezza del trasporto.
Il trasporto “locale” del campione è regolamentato dalla circolare n.3, 8 maggio 2003 (Ministero della Salute): “Raccomandazioni per la sicurezza del trasporto di materiali infettivi
e di campioni diagnostici”. Per trasporto “locale” si intende il
trasporto di un campione da un reparto ospedaliero (o da una struttura periferica) ad un laboratorio dell’ospedale oppure da un laboratorio ad un altro, ovvero da una struttura ospedaliera ad un centro diagnostico esterno. Se il campione è costituito da una piastra, essa deve essere opportunamente sigillata in busta; se il campione è contenuto in una provetta, essa deve essere chiusa e collocata in una rastrelliera in posizione verticale. I contenitori dei campioni e le rastrelliere devono essere posti in scatole robuste (plastica o metallo) a tenuta stagna, etichettate in relazione al contenuto ed accompagnate dalle schede con i dati del campione. In caso di trasporto a mezzo veicolo, la scatola deve essere sistemata in modo fermo e sicuro nel veicolo stesso e a bordo deve essere presente un kit fornito di materiale assorbente,
disinfettante a base di cloro, contenitore per rifiuti e guanti da lavoro resistenti.
2. SCOPO DELLA TESI
Il Laboratorio di Microbiologia Clinica, per migliorare l’impatto del risultato microbiologico, dovrebbe fornire risultati accurati in tempi sempre più rapidi, possibilmente mediante anticipazioni telefoniche e soprattutto servendosi della rete. Infatti disponendo di un antibiogramma in tempi ridotti, si incide sulla scelta del farmaco antimicrobico, riducendo la spesa sanitaria, e al tempo stesso, si può ridurre il tasso di mortalità.
Il microbiologo deve sapersi confrontare continuamente con i colleghi medici su specifici aspetti, quali ad esempio il rapporto tra epidemiologia locale, resistenze e consumo di antibiotici, permettendo così di chiarire meglio le dinamiche alla base dei nuovi fenomeni di resistenza e consentendo di discutere le precauzioni da attuare per contrastarli. E’ ormai dimostrato che dove è già in vigore questo tipo di approccio, si è riusciti a contenere efficacemente numerosi fenomeni di diffusione delle resistenze, altrove invece molto estesi.
Infatti il microbiologo clinico oggi è parte integrante nella gestione delle infezioni nosocomiali con capacità di consulenza e continua disponibilità ad evolversi e rinnovarsi, ed in più è in grado di
gestire i processi analitici in modo da fornire risultati rilevanti sul piano clinico, comprensibili e sfruttabili dai colleghi medici.
Lo scopo di questa tesi è quello di evidenziare il “nuovo ruolo” del Laboratorio di Microbiologia Clinica, e di conseguenza del microbiologo, nella corretta gestione delle malattie infettive, partendo da un idoneo trattamento del campione microbiologico indispensabile al corretto svolgimento della fase analitica nonché alla stessa interpretazione dei risultati.
3. GESTIONE DEL CAMPIONE
MICROBIOLOGICO
Diversamente da altri settori della Diagnostica di Laboratorio, la Microbiologia Clinica è una disciplina molto articolata e ancora molto legata all’esperienza e alla manualità dell’operatore.
Nel Laboratorio di Microbiologia, sebbene ci sia stata l’introduzione dell’automazione e l’avvento della genomica e della proteomica, l’interpretazione dei risultati ancora oggi dipende dalla qualità dei campioni accettati per le analisi microbiologiche. I microrganismi procarioti sono geneticamente meno complessi degli eucarioti ma si adattano più facilmente alla pressione selettiva svolta dagli antibiotici e dall’ambiente esterno così da facilitare la propria sopravvivenza. La strumentazione da laboratorio, quantunque all’avanguardia, potrebbe anche non rilevare queste mutazioni, così che lo specialista in Microbiologia risulta essere indispensabile nel facilitare l’interpretazione del risultato fornito dal Laboratorio di Microbiologia. E’ risaputo che tutti i microrganismi nascono, si moltiplicano e muoiono molto velocemente e se uno di tali eventi si verifica durante la raccolta del campione o il trasporto oppure la conservazione, i risultati delle analisi microbiologiche saranno
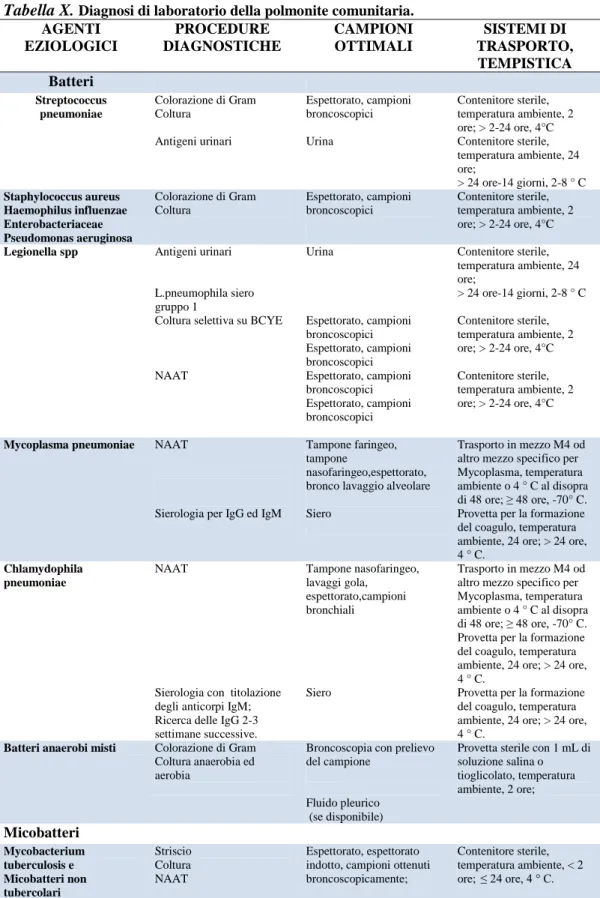
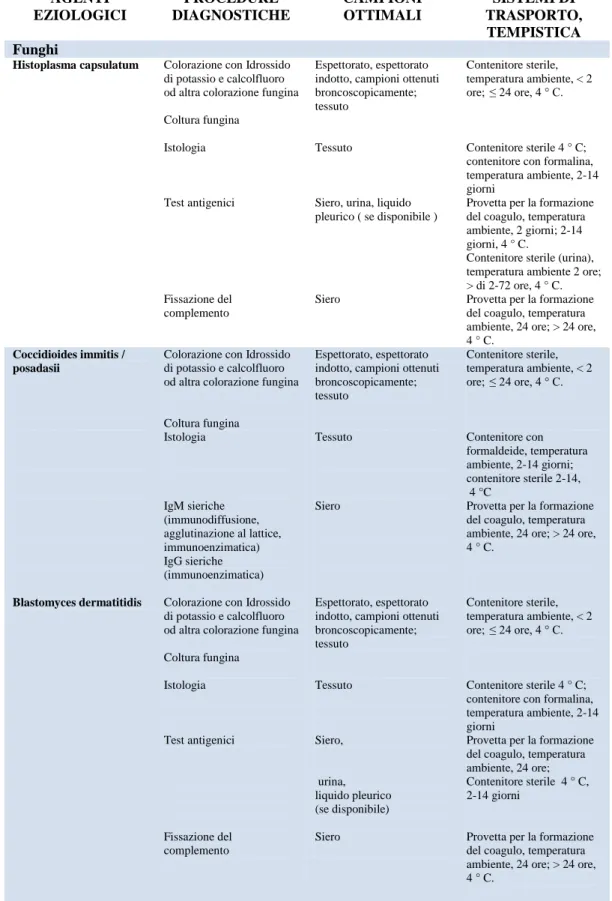
compromessi e la loro interpretazione potrebbe essere errata. Quindi l’attenzione alla gestione della fase pre-analitica è fondamentale per l’accuratezza del risultato. I medici devono aver fiducia che i risultati forniti dal Laboratorio di Microbiologia siano accurati, significativi e clinicamente rilevanti. Per ottenere un buon livello di qualità, il Laboratorio di Microbiologia necessita di campioni opportunamente raccolti, selezionati in fase di accettazione, ed infine trasportati correttamente fino al laboratorio al fine di rendere accettabili quanto più possibile sia le procedure di analisi che l’interpretazione dei risultati. Poiché l’interpretazione dei risultati in Microbiologia dipende esclusivamente dalla qualità del campione da analizzare, la gestione del campione non deve essere assolutamente lasciata al caso e coloro i quali raccolgono i campioni per le analisi microbiologiche devono essere a conoscenza di ciò di cui hanno bisogno i medici così come di ciò di cui necessita il laboratorio, oltre ad assicurare che i campioni arrivino al laboratorio di microbiologia nel più breve tempo possibile dopo essere stati raccolti (Tabella 1).
I clinici nella valutazione dei loro casi solitamente chiedono 3 semplici domande al Laboratorio di Microbiologia: la patologia del paziente in esame è dovuta ad un microrganismo? In caso affermativo, quale? Qual è il profilo di suscettibilità dell’organismo in modo che si
possa centrare la terapia? Per poter rispondere a queste domande, il Laboratorio di Microbiologia ha bisogno di diverse informazioni. In
primis, come già indicato, c’è bisogno di un campione raccolto ed
accettato correttamente, oltre che adeguatamente trasportato al laboratorio di analisi. Tra il clinico ed il laboratorio, a metà strada, si annoverano le figure degli operatori sanitari che hanno il compito di selezionare e raccogliere i campioni, e che potrebbero non essere a conoscenza di ciò di cui hanno bisogno i medici ed al contempo di cosa occorre al laboratorio per svolgere al meglio, ciascuno per la propria parte, il proprio lavoro. La priorità che emerge tra tutti gli operatori sanitari è il miglioramento continuo della qualità del campione, così che clinici, infermieri, e tutto lo staff operante in laboratorio dovrebbero essere continuamente stimolati e pronti a discutere su tale problematica.
La diagnosi di una malattia infettiva viene ben formulata se si applicano al meglio sia le conoscenze mediche sia quelle afferenti alla Diagnostica di Laboratorio seguendo i principi dell’epidemiologia e della farmacocinetica degli antibiotici, considerando inoltre anche il rapporto ospite-parassita. I migliori risultati per i pazienti si ottengono da una stretta collaborazione tra i clinici ed i laboratoristi.
Uno dei più importanti partner del laboratorio per la diagnosi delle malattie infettive è lo specialista in microbiologia. I clinici dovrebbero raccomandare, così come le istituzioni mediche dovrebbero permettere questo “ruolo centrale” del Laboratorio di Microbiologia o quantomeno consentire l’accesso a tutte le informazioni possibili ottenute dal lavoro del laboratorio tramite un’efficace consultazione.
La gestione del campione microbiologico dalla conformità fino all’accettazione dello stesso è sotto la responsabilità del personale sanitario, non sempre appartenente al laboratorio, sebbene lo specialista in microbiologia deve essere interpellato all’occorrenza o quantomeno rendersi disponibile per fornire assistenza. L’impatto della corretta gestione del campione sulla salute del paziente è enorme, rappresenta la chiave per una giusta diagnosi di laboratorio oltre che per una conferma della stessa, influisce direttamente sulla salute del paziente, influisce sulle decisioni in merito alle terapie, influisce sul controllo delle infezioni ospedaliere nonché sui tempi di degenza ospedaliera del paziente, quindi sui costi ospedalieri e del laboratorio, ed infine incide sull’efficienza stessa del laboratorio.
I clinici dovrebbero consultare il laboratorio al fine di assicurare che tutte le fasi della gestione del campione microbiologico,
che cominciano dalla verifica della conformità, quindi dalla raccolta, fino al trasporto e alla conservazione vengano correttamente eseguite. Ci sono alcuni principi fondamentali che sono alla base di una corretta gestione del campione microbiologico così come delle stesse analisi microbiologiche e che collocano la Microbiologia al di fuori degli altri settori della Medicina di Laboratorio quali la Biochimica clinica o l’Ematologia. I dieci punti cardine da rispettare per una corretta gestione del campione microbiologico sono:
I campioni di scarsa qualità devono essere rifiutati; I medici devono richiedere solo la ricerca di germi di interesse clinico al fine di formulare una corretta diagnosi;
Nei vari distretti corporei vi è una flora batterica residente che potrebbe facilmente contaminare il campione, pertanto i campioni prelevati da siti come il tratto respiratorio inferiore, ferite superficiali, fistole ed altro, necessitano di accorgimenti particolari per la loro raccolta;
Bisogna preferire campioni quali aspirati e fluidi corporei ai tamponi poiché questi ultimi riescono a trattenere piccoli volumi del campione desiderato (circa 0,05 ml), ed inoltre rendono poco accurata la ricerca di microrganismi poiché l’inoculo del campione sulle varie piastre di agar non
risulta sempre uniforme per la natura stessa del dispositivo utilizzato in quanto non sempre le fibre del tampone riescono a rilasciare totalmente i batteri o altri microrganismi che vi rimangono bloccati. I tamponi sono utilizzati per la ricerca di infezioni del tratto naso-faringeo e di infezioni del tratto respiratorio.
Le sonde floccate si sono rivelate come un valido strumento per la raccolta del campione e pertanto si sono mostrate molto più efficaci rispetto al dacron, al rayon e ai tamponi cotonati. Questo perché la natura floccata del tampone consente un più efficiente rilascio del materiali prelevato;
I protocolli di laboratorio devono essere supportati dalla letteratura;
Di norma la raccolta del campione deve avvenire prima della somministrazione degli antibiotici poiché questi ultimi tendono a provocare delle alterazioni della flora con conseguente alterazione dei risultati della ricerca;
I test di suscettibilità agli antibiotici devono essere effettuati esclusivamente su isolati clinicamente significativi e non su tutti i microrganismi identificati in coltura;
I risultati del laboratorio di microbiologia che vengono refertati, necessitano di essere accurati, significativi e soprattutto clinicamente rilevanti;
Per velocizzare i tempi di refertazione è bene avvalersi di una comunicazione efficace e soprattutto del rispetto reciproco tra le varie figure professionali, ossia medici, operatori sanitari e specialisti microbiologi;
Affinché i risultati possano essere affidabili, i campioni devono essere siglati accuratamente, con chiarezza e soprattutto con precisione al fine di fornire delle informazioni utili al sito specifico del prelievo;
Per evitare l’alterazione o la degradazione del campione, è bene osservare il rispetto delle temperature richieste. Per esempio i campioni per i quali è richiesta la ricerca dei virus devono essere trasportati in ghiaccio secco e refrigerati ad una temperatura di -80°C. Qualora il trasporto avvenga al laboratorio in meno di due ore, è possibile il trasporto a temperatura ambiente nel mezzo di trasporto idoneo per virus.
Tabella I.Guida generale al trasporto dei campioni
TIPO DI CAMPIONE CAMPIONE RICHIESTO SISTEMA DI
TRASPORTO,TEMPERATURA E TEMPO DI TRASPORTO
IDEALI
Coltura batterica aerobica Tessuto, fluido, aspirato, biopsia , etc.
Tampone (seconda scelta)- sono raccomandati i tamponi floccati.
Contenitore sterile, temperatura ambiente, immediatamente. Dispositivo per il trasporto del tampone, temperatura ambiente, 2 ore.
Coltura batterica aerobica ed anaerobica
Tessuto, fluido, aspirato, biopsia , etc.
Tampone (seconda scelta)- sono raccomandati i tamponi floccati.
Contenitore per anaerobiosi sterile, temperatura ambiente,
immediatamente.
Dispositivo per il trasporto dei tamponi in anaerobiosi, temperatura ambiente, 2 ore.
Coltura dei miceti Tessuto, fluido, aspirato, biopsia , etc.
Tampone (seconda scelta)- solo per le infezioni superficiali da lieviti e micobatteri.
Contenitore sterile, temperatura ambiente, 2 ore.
Dispositivo per il trasporto del tampone, temperatura ambiente, 2 ore.
Colture virali Tessuto, fluido, aspirato, biopsia , etc.
Tampone (seconda scelta)- sono raccomandati i tamponi floccati.
Mezzo di trasporto per virus, ghiaccio, immediatamente.
Dispositivo di trasporto per i tamponi idonei alla coltura di virus, temperatura ambiente, 2 ore .
Sierologia 5 mL di siero. Provetta idonea alla formazione del coagulo , temperatura ambiente, 2 ore
Test antigenico Come descritto nel manuale di raccolta del campione redatto dal laboratorio.
Contenitore sigillato, temperatura ambiente, 2 ore.
NAAT 5 mL di plasma. Campione di altra natura.
Provetta con EDTA, temperatura ambiente , 2 ore.
Contenitore sigillato, temperatura ambiente, 2 ore.
3.1 Infezione del sangue e del sistema cardiovascolare
3.1.1 Infezione del sangue ed endocardite
La diagnosi delle infezioni del torrente circolatorio (Blood Stream Infections, BSIs) è uno degli obiettivi più importanti per i laboratori di microbiologia clinica. Per la maggior parte degli agenti eziologici delle “BSIs”, i metodi convenzionali di coltura forniscono i risultati entro le 48 ore, ma se vengono utilizzati sistemi moderni automatizzati di monitoraggio continuo i tempi di incubazione superano i 5 giorni.
I principali agenti eziologici oggetto di ricerca sono principalmente batteri raggrupati con l’acronimo di “HACEK” [11]
(Haemophilus, Aggregatibacter, Cardiobacterium, Eikenella e Kingella) ed inoltre Brucella spp. I micobatteri ed i funghi dimorfici
richiedono tempi di incubazione più lunghi, mentre altri microrganismi potrebbero richiedere dei mezzi di coltura specifici o dei metodi non basati su coltura. Sebbene i funghi filamentosi spesso richiedano dei mezzi di coltura specifici, le specie di Candida tendono a crescere molto bene in mezzi di coltura standard qualora il paziente
non sia stato trattato con terapia antifungina. Sfortunatamente le emocolture di pazienti con sospetta candidemia non forniscono risultati positivi nel 50% dei pazienti [12,13].
Per l’identificazione di buona parte degli agenti eziologici delle endocarditi è sufficiente l’impiego di emocolture convenzionali, [13,14,15] mentre per gli agenti eziologici meno comuni e non facilmente individuabili con i normali metodi di coltura, quali
Coxiella burnetii o Bartonella spp, sono necessari metodi di
identificazione sierologica.
Inoltre per tali microrganismi come anche per altri
(Tropheryma whipplei) potrebbero essere di ottimo ausilio i metodi di
amplificazione molecolare. In casi rari si ricorre alla tecnica PCR e al sequenziamento del DNA partendo dal tessuto valvolare al fine di poter determinare l’agente eziologico. La variabile più importante nella ricerca di batteri e funghi da pazienti affetti da infezioni del circolo ematico, è rappresentato dal volume del sangue prelevato [11, 12, 15, 16]. E’ noto che “un set per emocoltura” sia costituito da tutti i flaconi derivanti da un’unica venipuntura o da un unico flusso proveniente dal catetere. Prima di procedere all’incubazione, il sangue non deve essere assolutamente refrigerato. Il volume ematico per gli adulti è di circa 20-30 ml di sangue per ogni set di emocoltura (ciò
dipende anche dalle istruzioni della casa produttrice del sistema analitico) ed il tutto potrebbe richiedere più di due flaconi. Nel caso di bambini, il volume di sangue da riporre in coltura deve essere appropriato al peso e all’età ma in media vengono richiesti circa 10 ml di sangue. E’ bene sottolineare che batteri come Streptococcus
pneumoniae o altri microrganismi Gram positivi, presentano una
crescita migliore in anaerobiosi.
Un altro aspetto importante è il numero di emocolture che vengono effettuate nel corso di un dato episodio settico. In genere, in un adulto con sospetto di BSI, nel corso di ogni episodio settico dovrebbero essere effettuate almeno 2/4 emocolture [15,17]. Solo la gravità del paziente è in grado di dettare il tempo che intercorre tra un prelievo per emocoltura ed il successivo. La contaminazione dei dispositivi per allestire un’emocoltura è molto frequente, determinando sia un incremento dei costi per la gestione sanitaria sia confusione nei risultati. Per minimizzare il rischio di contaminazione con la flora cutanea commensale, dovrebbe essere effettuata una preparazione meticolosa della pelle prima di effettuare la venipuntura. I campioni di elezione per l’emocoltura sono rappresentati dalla venipuntura periferica, in quanto tendono ad essere meno soggetti a
contaminazione rispetto al sangue ottenuto da un catetere intravascolare o da qualsiasi altro dispositivo [12].
I disinfettanti più indicati per il trattamento dell’area ove verrà effettuato il prelievo sono rappresentati dalla tintura di iodio, dal perossido di cloro e dalla clorexidina gluconata. La tintura di iodio e la clorexidina gluconata sono in grado di esercitare un effetto antisettico in soli 30 secondi, tuttavia l’impiego della clorexidina gluconata non è raccomandato in neonati con meno di due mesi.
Ogni qualvolta si ottenga un risultato positivo per emocoltura, è indispensabile che il clinico venga avvertito tempestivamente dal laboratorio di microbiologia al fine di predisporre la più opportuna decisione clinica dalla quale potrebbero dipendere le sorti del paziente. Nel caso in cui non si abbiano risposte in tempi brevi, infatti i medici devono procedere con terapie empiriche in attesa che si ottengano risultati ufficiali.
Tabella II. Diagnosi di laboratorio delle infezioni del sangue organizzata per agente eziologico. AGENTI EZIOLOGICI PROCEDURE DIAGNOSTICHE CAMPIONI OTTIMALI SISTEMI DI TRASPORTO Staphylococcus spp. Streptococcus spp. Enterococcus spp. Listeria monocytogenes Enterobacteriaceae Pseudomonas spp. Acinetobacter Batteri HACEK Brucella spp. Batteri anaerobi Lieviti Adulti : 2-4 flaconi di
emocoltura per episodio di sepsi.
Neonati e bambini :
2 o più emocolture.
20- 30 mL di sangue per ogni emocoltura, da iniettare in almeno due flaconi per emocoltura.
Volume sanguigno dipendente dal peso del paziente.
I flaconi con l’inoculo vanno trasportati in laboratorio appena possibile, a temperatura ambiente , in genere gli organismi sopravvivono nei flaconi di inoculo anche se non sono incubati
immediatamente.
Malassezia spp .richiede
un apporto
supplementare di lipidi.
Bartonella spp. Due o più flaconi per
emocoltura. NAAT 10 mL di sangue da inoculare direttamente in ogni flacone . 5 mL di plasma. I flaconi vanno trasportati appena possibile al laboratorio, a temperatura ambiente e processati entro 8 ore dall’inoculo.
Provetta con EDTA, temperatura ambiente, 2 ore .
Legionella Due o più flaconi per emocoltura.
Ricerca degli antigeni nelle urine.
10 mL di sangue da inoculare direttamente in ogni flacone.
10 mL di urina del mitto intermedio.
I flaconi vanno trasportati appena possibile al laboratorio, a temperatura ambiente e processati entro 8 ore dall’inoculo.
Contenitore tappato, temperatura ambiente, 2 ore.
Coxiella burnetii Siero .
NAAT
5 mL di siero.
5 mL di plasma.
Provetta idonea per la formazione del coagulo, temperatura ambiente, 2 ore.
Provetta con EDTA, temperatura ambiente, 2 ore.
Tropheryma whipplei NAAT 5 mL di plasma. Provetta con EDTA, temperatura ambiente, 2 ore.
Mycobateria 3 colture con appositi flaconi .
5 mL di sangue inoculati direttamente nei flaconi specifici.
I flaconi con l’inoculo vanno trasportati in laboratorio appena possibile.
3.1.2 Infezione associata a cateteri vascolari
La diagnosi di BSIs associata a catetere viene spesso formulata per esclusione poiché non esiste un metodo microbiologico ottimale per la diagnosi delle stesse. Affinché si possa effettuare la diagnosi di una BSI associata a catetere è necessario essere certi che ci sia una batteriemia [18,19]. Successivamente bisogna dimostrare che tale infezione sia causata dal catetere. Ciò comporta che vengano esclusi gli altri potenziali foci primari. Nonostante siano state descritte numerose tecniche diagnostiche per le colture di cateteri al fine di fornire prove certe di BSI catetere-correlate, l’interpretazione dei risultati risulta complicata poiché tutte presentano potenziali punti deboli. Anche se non utilizzate in tutti i laboratori di microbiologia, i seguenti criteri rappresentano il gold standard per la diagnosi di infezioni associate ai cateteri vascolari :
Tempo di positivizzazione: le emocolture ottenute
nello stesso momento una dal catetere o dal port e l’altra da vena periferica, vengono incubate contemporaneamente in un sistema automatizzato di emocolture. Se l’emocoltura prelevata da catetere si positivizza almeno due ore prima dell’emocoltura