INDICE
1. RIASSUNTO ... pag. 3
2. INTRODUZIONE ... pag. 5
3. MATERIALI E METODI ... pag. 59
4. RISULTATI ... pag. 65
5. DISCUSSIONE ... pag. 96
6. CONCLUSIONI ... pag. 104
7. BIBLIOGRAFIA ... pag. 105
8. APPENDICE ... pag. 118
1. RIASSUNTO
In Europa, l’adenocarcinoma gastrico è la sesta neoplasia con più alta incidenza (11.7 casi/100.000 abitanti) e la quinta per mortalità (8.4 decessi/100.000). Sebbene vi sia una riduzione progressiva degli adenocarcinomi dello stomaco distale, stiamo osservando un sostanziale incremento di quelli insorti a livello della giunzione esofago-gastrica. Circa 1/3 degli adenocarcinomi gastrici sono diagnosticati in stadio II o III di malattia. La resezione chirurgica è il trattamento di scelta per questi pazienti ma è curativa solo in una parte dei casi. Infatti, la sopravvivenza a 5 anni dei pazienti in stadio II e III è inferiore al 20%. Pertanto, l’aggiunta di un trattamento chemioterapico perioperatorio, con composti del platino in aggiunta ad una fluoropirimidina ed epirubicina, si è dimostrato efficace nel prolungare la sopravvivenza globale e la sopravvivenza libera da progressione. Tuttavia, è necessaria una più accurata selezione dei pazienti che possano beneficiare di un trattamento adiuvante e lo sviluppo di schemi di chemioterapia più efficaci.
I farmaci a bersaglio molecolare di recente introduzione nella ricerca clinica oncologica sembrano dare promettenti risultati. Pertanto, abbiamo valutato l’overespressione dei recettori di membrana HER2, EGFR e MET e delle molecole implicate nella trasduzione del segnale AKT1 e phospho-mTOR. Lo scopo dello studio era quello di valutare il ruolo prognostico di questi markers. Novantadue pazienti con adenocarcinoma gastrico o della giunzione gastroesofagea radicalmente operati in stadio II e III sono stati selezionati retrospettivamente. L’overespressione di questi markers è stata valutata tramite indagine immunoistochimica e l’iperespressione di HER-2, nei casi 2+ all’immunoistochimica, tramite la metodica FISH.
L’overespressione di HER-2 è stata osservata nel 13% delle neoplasie, prevalentemente in quelle di tipo intestinale (p=0.039), e si associa ad un trend per una migliore overall survival e disease free survival. L’overespressione di EGFR è presente nell’11% dei casi e rappresenta un fattore prognostico negativo indipendente. Il 32% degli adenocarcinomi overesprime MET e questo sembra associato ad un trend per una peggiore sopravvivenza. Per quanto riguarda le proteine implicate nella via di trasduzione del segnale, l’overespressione di AKT1 è stata ritrovata nell’8% dei casi, con evidenza di un trend non
statisticamente significativo per una ridotta overall survival ed di un’associazione significativa con le neoplasie insorte a livello del piloro (p=0.038) e con quelle scarsamente/non differenziate (p=0.001), mentre l’overespressione di phospho-mTOR è risultata presente nel 48% dei pazienti senza associazione significativa con una ridotta sopravvivenza ma con evidenza di un trend, non statisticamente significativo, per una ridotta disease free survival.
In 17 pazienti l’overespressione di AKT1 e quella di EGFR sono risultate mutualmente esclusive ed identificano un sottogruppo a prognosi peggiore.
2. INTRODUZIONE
Epidemiologia
Nel corso degli ultimi decenni, l’epidemiologia del carcinoma gastrico si è modificata con un calo d’incidenza e mortalità.
Nonostante ciò la diminuzione è limitata alle neoplasie al di sotto della giunzione gastroesofagea; infatti le neoplasie dello stomaco prossimale e della giunzione esofagogastrica sono in incremento dalla prima metà degli anni ’80.1, 2
L’incidenza e la mortalità sono molto differenti nelle diverse regioni del mondo. L’incidenza più elevata si manifesta in Giappone (91,4/100.000 abitanti), Sud America ed Europa dell’Est con tassi variabili da 30 a 85 casi per 100.000 abitanti. La più bassa incidenza, invece, si osserva in alcune aree degli Stati Uniti (Hawaii), in Israele, e nel Kuwait con tassi di 4-8 casi ogni 100.000 abitanti.3
Il carcinoma gastrico rappresenta una delle neoplasie più frequenti in Europa: nel complesso rappresenta il 3.4% di tutte le neoplasie in entrambi i sessi, è al sesto posto come incidenza (11.7 casi/100.000 abitanti) ed al quinto posto come mortalità (8.4 decessi/100.000). Il carcinoma gastrico rappresenta la sesta neoplasia incidente tra gli uomini (16.7 casi/100.000) e la nona tra le donne (7.8 casi/100.000).
In Europa si registrano circa 192.000 nuovi casi all’anno con un’incidenza 1,6 volte superiore nel sesso maschile. Nel contesto europeo, i tassi annuali di incidenza standardizzati per età evidenziano una maggiore incidenza nell’Europa dell’Est (34,1/100.000) e del Sud (19,5/100.000) rispetto all’Europa dell’Ovest (7/100.000) e del Nord (6,1/100.000). Attualmente, Francia e Danimarca sono le nazioni a più bassa incidenza, mentre il Portogallo ha un’incidenza circa doppia rispetto alla media europea.4
In Italia il carcinoma gastrico rappresenta il 5% di tutti i tumori in entrambi i sessi ed è al quinto posto come incidenza sia negli uomini (22.5 casi/100.000) che nelle donne (11.4 casi/100.000). Da notare che all’interno delle singole nazioni esiste una certa variabilità: ad
esempio, in Italia si registrano elevate incidenze nelle regioni settentrionali, come Toscana ed Emilia Romagna (superiori a 70 per 100.000 abitanti) e basse incidenze al Sud.
In tutti i Paesi, l’incidenza risulta maggiore nelle classi sociali meno elevate e negli Stati Uniti l’incidenza è maggiore nella popolazione afro-americana rispetto ai bianchi.5
È bene precisare inoltre che secondo la classificazione microscopica di Lauren (1965) la quale descrive due tipi istologici (intestinale e diffuso), i cambiamenti che si sono evidenziati negli ultimi anni in termini di incidenza sono maggiormente determinati da una riduzione della variante intestinale.6
La riduzione della mortalità avviene più lentamente rispetto all’incidenza. In generale, la mortalità rispecchia per distribuzione l’incidenza, anche se in Giappone si è osservata una riduzione della mortalità legata essenzialmente allo screening di massa.
Fattori di rischio
L’eziologia del carcinoma gastrico non è perfettamente conosciuta: al momento attuale infatti si preferisce considerare la cancerogenesi gastrica come un processo multifattoriale, che conduce nel tempo a progressive alterazioni responsabili poi della degenerazione maligna.
Sono stati descritti dei fattori di rischio ambientali, infettivi, genetici e condizioni precancerose che favoriscono l’insorgenza di adenocarcinomi gastrici e della giunzione gastroesofagea.
Fattori ambientali
I fattori ambientali attualmente risultano i più implicati nella patogenesi del carcinoma gastrico. È stato notato che gli immigrati gradualmente acquisiscono i tassi di incidenza del
gastrico intermedio tra quello della popolazione occidentale e quello della popolazione giapponese residente in Giappone.8 Inoltre il rischio di carcinoma gastrico risulta alto nella seconda generazione se i discendenti continuano ad avere una dieta tipica della cultura giapponese, mentre il rischio è più basso in coloro i quali hanno adottato uno stile dietetico di tipo occidentale.9
La dieta sembra essere un fattore di primaria importanza ed alcune errate abitudini alimentari sono associate ad un rischio elevato di carcinoma gastrico.
Il consumo di cibi affumicati o salati provoca la produzione di N-nitroso composti derivati dalla trasformazione dei nitrati in nitriti, i quali inducono la formazione di addotti del DNA.
Da notare che la formazione di tali addotti può essere inibita dalla vitamina C: uno studio di chemio-prevenzione ha evidenziato una riduzione del rischio di sviluppare carcinoma gastrico con l’assunzione di vitamina C e beta carotene. In quest’ottica la disponibilità dei frigoriferi è correlata con una minor incidenza di carcinoma gastrico perché permette la riduzione dell’impiego di cibi conservati sotto sale o affumicati. Una dieta ricca di sali sembra provocare un’irritazione della mucosa e indurre una gastrite cronica atrofica.10
Alcuni stili di vita errati come il consumo di alcol e il fumo sembrano rappresentare fattori di rischio per lo sviluppo della neoplasia, in particolare a livello del cardias. Per quanto riguarda il fumo, il rischio aumenta progressivamente con l’intensità e la durata.
Obesità e reflusso gastroesofageo sembrano anch’essi rappresentare fattori di rischio. Un elevato BMI e un elevato consumo calorico sono stati associati con l’adenocarcinoma dell’esofago distale e del cardias.
Nei paesi industrializzati, esiste una relativa maggiore incidenza in alcune attività lavorative come minatori, contadini, operai addetti alle raffinerie di nichel, lavoratori dell’industria del legno.5
Il consumo di frutta e verdura è stato notato avere un effetto protettivo contro la neoplasia ed esiste l’evidenza che il consumo di cibi ricchi in antiossidanti, inclusi la vitamina C, E, i carotenoidi e i flavonoidi potrebbe essere di beneficio.11
Infine è stato notato un aumentato rischio di carcinoma gastrico in soggetti che sono stati esposti a radiazioni, soprattutto in giovane età. Ciò è stato osservato sia nelle popolazioni giapponesi sopravvissute alle bombe atomiche sia negli esposti alle radiazioni derivate dall’incidente di Chernobyl.12
Fattori infettivi
L’Helicobacter Pylori ha un ruolo d’importanza primaria nella patogenesi del carcinoma
gastrico, tanto che nel 1994 la IARC lo ha classificato tra i cancerogeni di tipo I. Il rischio sembra incrementato di 5-6 volte per le neoplasie gastriche, sia adenocarcinomi sia linfomi.
L’infezione causa una gastrite cronica seguita da atrofia, metaplasia intestinale, displasia e infine carcinoma. Nonostante queste evidenze, però, il meccanismo alla base dell’aumentato rischio non risulta ancora chiaro.
Si è osservato che più del 50% della popolazione mondiale è infettato da H. pylori, ma solo il 2% va incontro alla trasformazione in carcinoma. Questa estrema variabilità nello sviluppo della neoplasia potrebbe essere correlata con la suscettibilità genetica dell’ospite, con il tipo di risposta immune dell’ospite e con la diversa specificità dei vari ceppi batterici. Alcuni ceppi di H. pylori contengono fattori di virulenza come il gene cagA che induce alterazioni sia in vivo sia in vitro; altri fattori di virulenza possibili sono l’adesina BabA2 e l’esotossina VacA, le quali però risultano meno legate all’aumento di suscettibilità alla neoplasia. Vari polimorfismi dell’ospite per quanto riguarda i geni che codificano per citochine o recettori per citochine come IL-1B, IL-1RB, TNF, IL-10 che regolano la risposta infiammatoria potrebbero contribuire a spiegare in parte la diversa suscettibilità individuale allo sviluppo del carcinoma. Ciò che rende l’infezione da H. pylori del tutto particolare è il fatto che essendo un batterio extracellulare, questo può essere visto come un cancerogeno indiretto che promuove la trasformazione neoplastica attraverso una risposta infiammatoria cronica. Infatti, come premesso, si può affermare in generale che l’aumento del rischio di sviluppo del carcinoma gastrico legato all’infezione
Condizioni precancerose
Le condizioni precancerose sono quelle situazioni che, a causa del loro elevato tasso di proliferazione, possono predisporre all’insorgenza della neoplasia.
Quelle di maggior interesse sono:
La gastrite cronica viene normalmente suddivisa in due entità con eziologia e clinica differenti: la gastrite cronica di tipo A o autoimmune e la gastrite cronica di tipo B o antrale.
La gastrite cronica di tipo A si localizza prevalentemente a livello del fondo ed è associata all’anemia perniciosa: in questa condizione gli aspetti istologici della mucosa gastrica sono quelli di un’atrofia gastrica con metaplasia intestinale di varia estensione. Gli adenomi e i carcinomi sono 3-4 volte più frequenti nei pazienti con anemia perniciosa che nella popolazione generale e tendono a localizzarsi soprattutto nel fondo/corpo dello stomaco.
La gastrite cronica di tipo B o antrale è una malattia a decorso clinico silente il cui esito finale è l’atrofia di grado più o meno elevato.
In generale la gastrite e l’atrofia alterano la secrezione acida, che rappresenta uno dei principali meccanismi di difesa, elevando il pH gastrico e determinando modificazioni della flora batterica con colonizzazione gastrica da parte di batteri anaerobi. La modificazione della flora comporta un’alterazione della produzione di N-nitroso-composti che determina un incremento del rischio di sviluppare carcinoma gastrico.
La displasia gastrica è un processo dinamico capace di evolvere da gradi lievi fino a forme molto severe, ma anche in grado di stabilizzarsi. Solitamente si distinguono tre tipi di displasia: lieve, moderata e severa. Se la displasia è lieve, questa acquisisce un potenziale precanceroso solo in caso di evoluzione verso forme più severe, mentre se la displasia è severa, la mucosa gastrica presenta una notevole probabilità di sviluppare un carcinoma, che risulta concomitante nel 60% dei casi e che si svilupperà entro 15 mesi in un rimanente 25%.
I polipi gastrici hanno caratteristiche adenomatose nel 20-30% dei casi e tendono a degenerare in carcinoma nel 6-60% delle casistiche.
La sindrome di Ménétrier consiste in una gastropatia cronica ipertrofica che è associata ad un aumento del rischio di carcinoma gastrico.
L’ulcera gastrica, soprattutto in passato, è stata considerata una lesione potenzialmente precancerosa, ma in realtà attualmente il rischio di degenerazione maligna è inferiore all’1%.
Nonostante questo, esistono comunque dati che mostrano come i soggetti con storia di ulcera peptica abbiano un rischio maggiore di neoplasia gastrica; ciò deve essere interpretato non come un’evoluzione degenerativa di un’ulcera benigna, ma come la presenza di un fattore eziologico comune (H. pylori).
I pazienti che sono stati sottoposti nel passato per una patologia benigna (es. ulcera gastrica) ad un intervento di gastroresezione, soprattutto di tipo Billroth II, hanno un maggior rischio di carcinoma gastrico in particolare dopo 15-20 anni. Questo si spiega con la presenza di reflusso duodenale di sali biliari e succhi pancreatici, che provocano la formazione di composti mutageni.5
Risulta essere differente il processo di carcinogenesi a livello della giunzione gastroesofagea e del terzo inferiore dell’esofago. Qui la mucosa squamocellulare esposta cronicamente al reflusso ed altri fattori irritanti viene sostituita da cellule di tipo colonnare intestinale. Si creerebbe così, nel 10% degli individui affetti da Malattia da Reflusso GastroEsofageo sintomatica (MRGE), la lesione preneoplastica nota come Esofago di Barrett, associata ad un rischio aumentato di 30-40 volte di sviluppare un adenocarcinoma.14
Fattori genetici
La maggior parte dei carcinomi gastrici compare in maniera sporadica. Si stima che circa l’8-10% dei casi possano essere correlati a forme ereditarie.15
E’ stato notato che in alcune famiglie esiste un’aumentata incidenza di carcinoma gastrico e nel 12-25% dei carcinomi gastrici si riscontrano clusters familiari.16 Il rischio di sviluppare carcinoma gastrico è tre volte maggiore nei familiari di primo grado.17 Il rischio aumenta ulteriormente quando più di un familiare di primo grado è affetto18 ed è curiosamente maggiore quando era affetta la madre rispetto al padre.
Sono state evidenziate mutazioni somatiche della E-caderina/CDH1 sul cromosoma 16q con caratteristiche autosomico-dominanti ad alta penetranza (67-83%)19, alterazioni della p53, amplificazione ed abnorme trascrizione del gene c-MET.
Il carcinoma gastrico inoltre è stato segnalato in pazienti con sindromi poliposiche familiari come la FAP (familial adenomatous polyposis) e la sindrome di Peutz-Jeghers20 e in pazienti affetti da sindrome di Lynch II.21 Per quanto riguarda la FAP, l’aumentato rischio di carcinoma gastrico è stato rilevato in regioni del mondo ad alto rischio come l’Asia, mentre non c’è un aumento del rischio nelle altre popolazioni.22
Il potenziale ruolo del locus HLA nella cancerogenesi gastrica ha delle implicazioni per quanto riguarda l’importanza del potenziale meccanismo di fuga dalla sorveglianza immunitaria come fattore causale la neoplasia. In realtà però la non comparsa di carcinoma gastrico in molti soggetti portatori di questo allele dimostra la complessità e la multifattorialità della carcinogenesi gastrica.
Già nel 1996, Lu et al. avevano evidenziato una maggior frequenza della variante allelica HLA DQB1*0301 tra i soggetti affetti da carcinoma gastrico (54%) rispetto alla popolazione sana (27%).23 Questo, se confermato, potrebbe far ipotizzare un ruolo di tale locus nell’influenzare il rischio di carcinoma gastrico oppure, in alternativa, tale locus potrebbe rappresentare un marker di predisposizione individuale allo sviluppo della neoplasia.
In un altro studio, la frequenza dell’allele HLA DQB1*0401 era significativamente più alto nei soggetti infettati da H. pylori che hanno sviluppato una gastrite atrofica piuttosto che in quei pazienti infettati senza gastrite atrofica o nei non infettati.24
Sebbene in passato fosse stato ipotizzato un ruolo predisponente del gruppo sanguigno di tipo A, studi recenti hanno escluso tale ipotesi.
Molti polimorfismi allelici delle citochine proinfiammatorie, quali l’interleuchina-1beta (IL-1 ), potente inibitore della secrezione acida, sono stati associati con il carcinoma gastrico. Studi più recenti hanno ipotizzato che lo sviluppo della neoplasia derivi dall’interazione tra polimorfismi e fattori ambientali, per cui in diverse situazioni lo stesso polimorfismo può risultare favorente o meno la carcinogenesi.
Patogenesi
Il processo patogenetico risulta multifattoriale e multistep con una cascata di eventi condizionante le progressive fasi evolutive. Infatti il carcinoma gastrico non deriva da un epitelio normale, ma sono necessarie diverse tappe caratterizzate dall’accumulo di molteplici alterazioni genetiche. Queste tappe sono abbastanza conosciute nella forma intestinale, mentre le lesioni predisponenti lo sviluppo della forma diffusa non sono ben conosciute.
Per quanto concerne il tipo intestinale, il suo sviluppo è caratterizzato dalla trasformazione della mucosa gastrica normale (metaplasia intestinale); in seguito la metaplasia progredisce in displasia e infine in carcinoma.
Dal punto di vista molecolare, la sequenza carcinogenetica prevede mutazioni in APC, k-RAS, DCC, p53, c-MYC nella forma intestinale. Per quanto riguarda p53, questo gene è spesso alterato nella maggior parte dei carcinomi gastrici.25 Molti studi hanno utilizzato l’analisi immunoistochimica di lesioni tumorali al fine di rintracciare un’espressione eccessiva di p53, ma questi studi non hanno mostrato un consistente valore prognostico di
Nella variante diffusa sarebbe invece responsabile una mutazione della E-caderina, a volte tramandata geneticamente. La E-caderina è un importante molecola di adesione transmembrana e dipendente dagli ioni calcio, ed è stato visto che quando si riduce la sua espressione, risulta associata ad una maggior invasività della neoplasia.27 In uno studio, la riduzione dell’espressione della E-caderina, determinata tramite analisi immunoistochimica, è stata ritrovata nel 92% di carcinomi gastrici ed è stato osservato essere significativamente associata con neoplasie indifferenziate di tipo diffuso.28 E’ stato inoltre osservato che l’ipermetilazione del promotore della E-caderina è associato con una ridotta espressione del gene.29 Un altro studio ha rilevato che l’alfa-catenina, che lega il dominio intracellulare della E-caderina e lo collega agli elementi del citoscheletro, ha una ridotta espressione immunoistochimica nel 70% dei carcinomi gastrici e che questa espressione è correlata ad una crescita infiltrativa e ad una scarsa differenziazione.30 Inoltre nelle forme diffuse sarebbe più precoce la mutazione di p53.
In generale si possono poi ritrovare molte altre alterazioni genetiche che riguardano geni coinvolti nella regolazione del ciclo cellulare, nell’attività telomerasica, nell’angiogenesi e nella struttura della matrice extracellulare. Ad esempio nel 14% dei casi si evidenziano alterazioni a carico di c-erb-B2, in particolare si osserva un’iperespressione che sembra essere associata ad una prognosi infausta.31
La perdita della p27, regolatrice del ciclo cellulare, è correlata a carcinomi gastrici in stadio avanzato.32 L’amplificazione e l’iperespressione del gene c-MET, che codifica per il recettore tirosin chinasico dell’HGF (hepatocyte growth factor), è stata osservato nei carcinomi gastrici.33 Approssimativamente in un quarto dei carcinomi gastrici si ritrova l’espressione dell’EGF (epidermal growth factor) e del suo recettore. Alterazioni dei recettori per fattori di crescita fibroblastici, incluse mutazioni di FGFR-2 sono state ritrovate in un discreto numero di carcinomi gastrici.34 In un sottoinsieme di casi si è anche osservata l’espressione di fattori angiogenetici e di fattori di crescita dell’endotelio vascolare, suggerendo un potenziale ruolo della terapia con farmaci inibitori dell’angiogenesi.
In ultimo poi, nonostante la maggior parte dei carcinomi gastrici esibisca una significativa aneuploidia, l’instabiltà dei microsatelliti si ritrova dal 13 al 44% dei carcinomi gastrici sporadici.35
Prevenzione
La prevenzione primaria dovrebbe essere effettuata attraverso modificazioni dietetiche. In particolar modo andrebbe incoraggiata nelle popolazioni ad alto rischio la riduzione del consumo di carni affumicate, insaccati ed alimenti conservati con il sale, incrementando l’utilizzo di frutta e verdura.
L’Helicobacter Pylori (HP) è classificato come agente cancerogeno di tipo I dalla International Agency for Research on Cancer (IARC) con meccanismo patogenetico da ricondurre allo sviluppo di gastrite cronica atrofica e prevalentemente associato ad adenocarcinoma di tipo intestinale della regione antrale nelle popolazioni ad alto rischio. L’eradicazione dell’infezione da HP è un passo fondamentale per la prevenzione primaria del carcinoma gastrico.
La prevenzione secondaria si concretizza con la possibilità di attuare programmi di screening.
Tali programmi sono stati applicati con successo nelle popolazioni ad alto rischio, in particolare in Giappone. Lo screening tipico include l’uso di radiografia del tubo digerente con doppio contrasto e/o l’endoscopia. Il beneficio dello screening è stato rilevante in Giappone, consentendo di incrementare la percentuale di Early Gastric Cancer dal 3.8% del 1956 a quasi il 60% negli anni ’80, con una sopravvivenza, in tali casi, di circa il 90% a 5 anni.
Per ragioni epidemiologiche ed economiche non esiste però indicazione all’attuazione d’indagini di massa nelle popolazioni a basso rischio.
Recentemente come test di screening è stato proposto il dosaggio del pepsinogeno sierico che potrebbe, per i ridotti costi, avere un ruolo anche in popolazioni a basso rischio. Tuttavia gli studi finora attivati sono ancora preliminari per poterne valutare l’efficacia e il reale rapporto costo/beneficio.
Considerazioni anatomiche
Lo stomaco origina a livello della giunzione gastroesofagea e termina in corrispondenza del piloro. Prende rapporto superiormente con il diaframma e con il lobo sinistro del fegato, mentre si trova al di sopra del colon trasverso, del mesocolon e del grande omento. Posteriormente prende rapporto con milza, pancreas, surrene sinistro, rene sinistro e flessura splenica del colon.
Il circolo sanguigno deriva dai vasi dell’asse celiaco.
Il drenaggio linfatico è diffuso e si riconoscono almeno sei gruppi di linfonodi perigastrici oltre ai linfonodi epatici, splenici e para-aortici.11
Istopatologia
Circa il 95% di tutte le neoplasie gastriche è rappresentato da adenocarcinomi, e generalmente quando si parla di cancro gastrico ci si riferisce all’adenocarcinoma dello stomaco. Esistono altre neoplasie maligne che sono però piuttosto rare come il carcinoma squamoso, il carcinoide, il GIST (Gastrointestinal Stromal Tumours), l’adenoacantoma e il leiomiosarcoma, che rappresentano l’1-3% dei tumori maligni dello stomaco. Lo stomaco inoltre rappresenta la sede più comune di linfomi dell’apparato digerente di cui circa il 50% è rappresentato dal linfoma MALT (Mucosa Associated Lymphoid Tissue).
Le neoplasie gastriche possono essere classificate in base a caratteristiche morfologiche o istopatologiche.
Macroscopicamente la classificazione più utilizzata è la classificazione di Borrmann; questa divide il carcinoma gastrico in 4 tipi:
Tipo I polipoide: tumore polipoide ben circoscritto alla base, che rappresenta il 7-8% di tutte le forme macroscopiche;
Tipo II fungoide: tumore polipoide con marcata infiltrazione centrale, la base non è ben definita e presenta un’escavazione centrale, rappresenta il 30% di tutte le forme macroscopiche;
Tipo III ulcerato: tumore ulcerato con margini infiltrati, può presentarsi sia come un’escavazione profonda a margini irregolari e sollevati sia come un’ulcera superficiale con ampia base, rappresenta il 30-40% dei casi;
Tipo IV infiltrante: si manifesta con un’estesa infiltrazione di parete che provoca ispessimento e indurimento delle pareti e che può interessare diffusamente lo stomaco (linite plastica), rappresenta il 10-20% dei casi;
Nel 1977, Ming ha proposto una classificazione istomorfologica che divide il carcinoma gastrico in:
Tipo espansivo, prognosticamente favorevole Tipo infiltrativo, a cattiva prognosi
Solitamente i tumori di tipo espansivo sono di tipo polipoide, mentre quelli di tipo infiltrativo sono quasi sempre di tipo diffuso.
Dal punto di vista microscopico è bene precisare innanzitutto che il carcinoma gastrico può assumere diverse configurazioni istologiche. Sono state elaborate, perciò, molte classificazioni, anche se le due più impiegate sono la classificazione proposta dalla WHO e quella di Lauren.
La classificazione istologica secondo WHO divide in: Adenocarcinoma intestinale diffuso
- Adenocarcinoma papillare: è caratterizzato dalla presenza di un asse fibrovascolare, rivestito da cellule epiteliali; il grado di atipia può raggiungere valori elevati; spesso presenta spiccata angioinvasività.
- Adenocarcinoma tubulare: presenta formazioni ghiandolari dai lumi più o meno dilatati dal muco di forma tubulare; le cellule di rivestimento di forma cubica o cilindrica sono tra loro coese e possono contenere mucina intracitoplasmatica.
similghiandolari si perdono nei laghi di muco, e una forma poco differenziata in cui disperse nei laghi si ritrovano soltanto cellule isolate. - Carcinoma a cellule ad anello con castone: è caratterizzato dalla presenza
di cellule non coese, in cui il citoplasma è disteso e il nucleo appare dislocato eccentricamente dai granuli di mucina; le cellule possono formare cordoni e presentano un pattern di crescita di tipo “infiltrativo” evocando spesso un’intensa reazione desmoplastica.
Carcinoma adenosquamoso Carcinoma epidermoide Carcinoma a piccole cellule
Carcinoma Indifferenziato (non contiene strutture ghiandolari né produce mucina)
La classificazione istologica secondo Lauren è molto semplice e diffusa e divide il carcinoma gastrico in forma intestinale e forma diffusa:
Forma intestinale: consiste in un carcinoma differenziato che tende a formare strutture ghiandolari, le quali infiltrano la parete gastrica secondo un pattern di crescita prevalentemente espansivo. In questo gruppo vengono compresi i carcinomi tubulari, papillari e mucinosi ben differenziati della classificazione WHO.
In genere le neoplasie di tipo intestinale derivano da lesioni precancerose, insorgono frequentemente nella regione antrale, sono più frequenti nelle aree ad elevata incidenza, interessano per lo più soggetti anziani e presentano una prognosi migliore.
Forma diffusa: è caratterizzato dalla presenza di cellule poco coese tra loro con pattern di crescita di tipo infiltrativo, di solito non insorge nella regione antrale, è più frequente nei soggetti giovani e presenta, oltre che aspetti di tipo ereditario, una prognosi peggiore. Comprende il carcinoma a cellule ad anello con castone e il carcinoma mucinoso poco differenziato della classificazione WHO.
Le neoplasie che presentano entrambe le due caratteristiche (intestinale, diffuso) vengono classificate come forma mista.
È inoltre possibile attribuire agli istotipi un diverso pattern di diffusione metastatico, prevalentemente epatico per il carcinoma di tipo intestinale e con diffusione peritoneale (incluso il tumore di Krukenberg) per il tipo diffuso.
Esiste anche la classificazione di Broder che divide i tumori in base alla loro differenziazione numerandoli da 1(ben differenziato) a 4(anaplastico).
Agli adenocarcinomi viene poi assegnato un grading in base alla differenziazione ghiandolare:
Grado X (Gx): non può essere assegnato
Grado 1 (G1): ben differenziato (oltre il 95% del tumore è composto da strutture ghiandolari)
Grado 2 (G2): moderatamente differenziato (50-95% del tumore è composto da strutture ghiandolari)
Grado 3 (G3): scarsamente differenziato (49% o meno del tumore è composto da strutture ghiandolari)
Grado 4 (G4): carcinomi a piccole cellule, carcinomi indifferenziati (senza alcuna struttura ghiandolare)
Gli adenocarcinomi tubulari corrispondono al G1, i carcinomi a cellule ad anello con castone corrispondono al G3, mentre i carcinomi a piccole cellule o gli indifferenziati sono classificati come G4.
Una condizione particolare è poi rappresentata dall’Early Gastric Cancer (EGC). Questa entità si riferisce ad un adenocarcinoma a sviluppo mucoso o sottomucoso, che non infiltra ancora la tonaca muscolare, indipendentemente dalla presenza o dall’assenza di metastasi linfonodali (presenti in percentuale variabile dal 4 al 14%). Ha a tutti gli effetti le caratteristiche tipiche della neoplasia, ma, non infiltrando la tonaca muscolare, non c’è interessamento dei vasi e verosimilmente sono assenti le metastasi a distanza.
- IIa elevato: elevazione inferiore a 0.5 cm
- IIb piatto: elevazione della mucosa minima o assente
- IIc depresso: superficiale e leggermente depresso con erosione Tipo III escavato: depressione con escavazione similulcerosa.
L’EGC è difficile da distinguere endoscopicamente dall’ulcera peptica, per cui è raccomandabile eseguire biopsie endoscopiche in presenza di un ulcera apparentemente benigna.
In conseguenza del maggior utilizzo dell’endoscopia, il numero dell’EGC è andato progressivamente aumentando e attualmente rappresenta circa il 10% delle neoplasie gastriche. Percentuali ancora più alte (tra il 35 e il 60% dei casi) si ritrovano nei Paesi ad alta incidenza, come il Giappone, dove sono attivi programmi di screening.
È quindi importante arrivare ad una diagnosi precoce ed accurata di EGC, considerando soprattutto la sua ottima risposta al trattamento chirurgico e la buona prognosi dei pazienti post-chirurgia.5, 11
Storia naturale
Il carcinoma gastrico può disseminarsi per interessamento diretto degli organi adiacenti e può sviluppare metastasi linfatiche, peritoneali e a distanza attraverso il circolo ematico. L’infiltrazione della parete è importante, sia per il rischio di infiltrare organi circostanti sia per l’interessamento dei vasi linfatici. L’interessamento degli organi circostanti può coinvolgere l’esofago e il duodeno, tramite l’infiltrazione della tonaca muscolare o del tessuto linfatico, anche in assenza d’interessamento a tutto spessore della parete.
Le lesioni che interessano tutto lo spessore di parete possono coinvolgere la sierosa gastrica, il grande omento, la milza, i surreni, il fegato, il pancreas e il colon. Il 60-90% dei pazienti presenta un interessamento della sierosa o degli organi circostanti.
La metastatizzazione per via linfatica è condizionata dalla sede del tumore primitivo. Si possono identificare, tramite due linee immaginarie trasversali, tre distretti gastrici, superiore, medio e inferiore, ciascuno dei quali ha una propria area di metastatizzazione. Per i tumori del distretto inferiore:
- Linfonodi di primo livello: linfonodi della piccola e della grande curvatura, linfonodi sovra e sottopilorici;
- Linfonodi di secondo livello: linfonodi dell’arteria epatica comune, della gastrica di sinistra, dell’asse celiaco e i paracardiali di destra;
- Linfonodi di terzo livello: linfonodi dell’ilo splenico, dell’arteria splenica, del legamento epatoduodenale, della regione retropancreatica, all’origine dei vasi mesenterici superiori, quelli paraaortici e dell’arteria colica media.
Per i tumori del distretto medio:
- Linfonodi di primo livello: linfonodi di piccola e grande curva, quelli sovra e sottopilorici e paracardiali di destra;
- Linfonodi di secondo livello: linfonodi dell’arteria epatica comune, dell’ilo splenico, dell’arteria splenica e dell’asse celiaco;
- Linfonodi di terzo livello: linfonodi della regione retropancreatica, dell’arteria colica media, quelli paraaortici, all’origine dei vasi mesenterici e del legamento epatoduodenale.
Per i tumori del distretto superiore:
- Linfonodi di primo livello: linfonodi della piccola e grande curva, paracardiali di sinistra e di destra;
- Linfonodi di secondo livello: linfonodi sopra e sottopilorici, dell’arteria gastrica di sinistra, dell’arteria epatica comune, dell’asse celiaco, dell’ilo splenico e dell’arteria splenica;
- Linfonodi di terzo livello: linfonodi del legamento epatoduodenale, della regione retropancreatica, dei vasi mesenterici superiori, dell’arteria colica media e i linfonodi paraaortici.
I linfonodi si presentano interessati tra il 50 e il 70% dei pazienti; tale rilievo può essere riscontrato anche negli stadi iniziali (14-18% nei casi T1, 60% nei T2).
Le metastasi per via ematica, che si rendono evidenti nelle fasi più avanzate di malattia, interessano solitamente il fegato, polmone, scheletro e più raramente encefalo.
Le ricadute possono avvenire a livello locale (38-69%), a livello peritoneale (23-42%) e a distanza (le metastasi epatiche metacrone rappresentano la prima sede di ricaduta nel 30% dei casi).5
Fig. 1.1: Esame TC con mdc con evidenza di metastasi epatiche multiple da carcinoma
gastrico.
Fig. 1.2: Esame TC del torace con finestra per i campi polmonari mette in evidenza
Quadro clinico
A causa dei sintomi vaghi e aspecifici che caratterizzano il carcinoma gastrico, la maggior parte dei pazienti giunge alla diagnosi in uno stadio avanzato di malattia. I pazienti possono avere spesso sintomi riferiti a patologiche aspecifiche o non neoplastiche dello stomaco: infatti spesso sono affetti da lungo tempo da patologie benigne quali gastrite cronica e ulcera peptica e sono generalmente abituati a convivere con una sintomatologia dispeptica lieve. È stato osservato che circa il 30% dei pazienti con EGC ha una lunga storia di dispepsia indistinguibile da quella dell’ulcera peptica.
Nelle fasi precoci, i pazienti possono riferire disturbi epigastrici, lieve pressione postprandiale, senso di ripienezza non giustificata dalla quantità degli alimenti ingeriti. In alcuni pazienti i sintomi possono essere suggestivi della specifica posizione della lesione: nei pazienti con neoplasia del giunto gastroesofageo può essere presente disfagia, mentre un senso di ripienezza può far ipotizzare un’infiltrazione diffusa con aumento della rigidità parietale e il vomito persistente può essere frequente nelle localizzazioni antrali con costrizione del piloro.
Può essere presente un sanguinamento occulto di lieve entità che nelle fasi tardive di malattia può arrivare a determinare un’anemia da carenza di ferro. Più rari sono i casi di sanguinamento massivo, anche se episodi di ematemesi e/o melena possono verificarsi nel 10-15% dei casi.
La presenza di una massa addominale palpabile, indice di malattia avanzata, indica solitamente l’estensione regionale della neoplasia.
In fase avanzata compaiono dolore, nausea e vomito. Ancora più tardivamente tendono a comparire calo ponderale e anemia.
La comparsa di dolore addominale, l’aumento del volume del fegato, la comparsa di ascite, l’ittero e la presenza di linfonodi palpabili (se è interessato quello della regione sovraclaveare sinistra si parla di segno di Troiser) sono generalmente manifestazioni cliniche di malattia metastatica.
Possono infine essere riscontrate sindromi paraneoplastiche come la dermatomiosite,
l’acanthosis nigricans, l’anemia emolitica microangiopatica, la coagulazione
intravascolare disseminata (CID) e trombosi venosa (sindrome di Trousseau).5
Diagnosi differenziale
La diagnosi differenziale va posta con:
Ulcera gastrica: è una condizione spesso preceduta da un lungo iter di sintomi caratteristici. La diagnosi è radiologica o endoscopica, ma spesso la diagnosi differenziale non è semplice, tanto da dover essere posta solo dopo accertamento istologico.
Gastrite cronica: l’esame dirimente per fare diagnosi differenziale è rappresentato dall’endoscopia.
Tumori benigni: i più frequenti tumori benigni di origine epiteliale sono i polipi gastrici che colpiscono soprattutto i maschi in età superiore a 50 anni; la diagnosi differenziale è radiologica e endoscopica.5
Stadiazione
La stadiazione del carcinoma gastrico è essenziale per predire la prognosi (lo stadio della malattia, infatti, è il principale fattore prognostico) e impostare un corretto programma terapeutico. Sono stati proposti molti sistemi per la stadiazione del cancro gastrico tra cui il sistema TNM AJCC/UICC (American Joint Committee on Cancer/International Union Against Cancer), il più utilizzato, e la classificazione giapponese.
Stadiazione TNM
Il sistema TNM permette di valutare l’estensione del tumore primitivo (T), l’interessamento dei linfonodi regionali (N), e la presenza di metastasi a distanza (M), e, in base a tali caratteristiche, fornisce la definizione dello stadio di malattia.
Da notare che nella VII edizione del TNM le neoplasie che insorgono a livello della giunzione gastroesofagea o che insorgono nello stomaco ad una distanza inferiore ai 5 cm dalla giunzione o che la coinvolgono vengono normalmente classificati secondo il sistema TNM proprio dell’adenocarcinoma esofageo.
Lo stadio può essere definito in diversi momenti della malattia oncologica: perciò si distinguono una stadiazione clinica pretrattamento e una patologica post-trattamento chirurgico.
Secondo le linee-guida ESMO 2010, la stadiazione per essere completa necessita di:
- Esame obiettivo, esami ematochimici (tra cui emocromo, indici di funzionalità epatica e renale), endoscopia e TC total body.
- Ecoendoscopia: è utile nel detrminare l’estensione prossimale e distale del tumore, nonostante sia meno utile nei tumori antrali.
- Laparoscopia con o senza washing peritoneale: è raccomandata in tutte quelle neoplasie considerate potenzialmente resecabili per escludere la malattia metastatica.
- PET (o meglio PET-TC): può portare ad una migliore definizione dello stadio in alcuni pazienti senza apparente diffusione metastatica alle metodiche radiologiche convenzionali, ma può risultare falsamente negativo soprattutto nei pazienti con istologia di tipo diffuso.
Lo stato linfonodale nella classificazione è basato sul numero di linfonodi interessati che sembra predire meglio la prognosi rispetto alla localizzazione degli stessi. Lo stato linfonodale rappresenta proprio un importante fattore prognostico e ciò è basato sull’osservazione che la sopravvivenza decresce all’aumentare dei linfonodi interessati. Cruciale è che venga esaminato un numero minimo di linfonodi (almeno 15).
Il parametro T indica l’estensione del tumore primitivo attraverso la parete gastrica: Tx: il tumore primitivo non può essere definito
Tis: rappresenta il carcinoma in situ, cioè una neoplasia intraepiteliale senza invasione della lamina propria
T1: tumore che invade la lamina propria, la muscolaris mucosae o la sottomucosa - T1a: tumore che invade la lamina propria o la muscolaris mucosae
- T1b: tumore che invade la sottomucosa T2: tumore che invade la muscolaris propria
T3: tumore che invade la sottosierosa senza invasione del peritoneo viscerale o di organi adiacenti. I tumori T3 inoltre includono anche quelli che si estendono al legamento gastrocolico o gastrepatico, o all’interno del grande o piccolo omento senza perforazione del peritoneo viscerale che ricopre queste strutture.
T4: tumore che perfora la sierosa o invade gli organi adiacenti - T4a: tumore che perfora la sierosa
- T4b: tumore che invade le strutture adiacenti come milza, colon trasverso, fegato, diaframma, pancreas, parete addominale, surrene, rene, intestino tenue e retroperitoneo.
Il parametro N indica l’interessamento dei linfonodi loco-regionali: Nx: i linfonodi regionali non possono essere definiti
N0: non ci sono metastasi ai linfonodi regionali N1: metastasi in 1-2 linfonodi regionali
N2: metastasi in 3-6 linfonodi regionali N3: metastasi in 7 o più linfonodi regionali
- N3a: metastasi in 7-15 linfonodi regionali - N3b: metastasi in 16 o più linfonodi regionali
Il parametro M prende in considerazione le metastasi a distanza1: M0: assenza di metastasi a distanza
M1: presenza di metastasi a distanza comprese la diffusione peritoneale, la citologia peritoneale positiva e l’infiltrazione dell’omento se non in contiguità con il tumore primitivo.37
Raggruppamento in stadi Stadio 0 Tis N0 M0 Stadio IA T1 N0 M0 Stadio IB T2 N0 M0 T1 N1 M0 Stadio IIA T3 N0 M0 T2 N1 M0 T1 N2 M0
Stadio IIB T4a N0 M0
T3 N1 M0 T2 N2 M0 T1 N3 M0
Stadio IIIA T4a N1 M0
T3 N2 M0 T2 N3 M0
Stadio IIIB T4b N0-1 M0
T4a N2 M0 T3 N3 M0
Stadio IIIC T4a N3 M0
T4b N2-3 M0
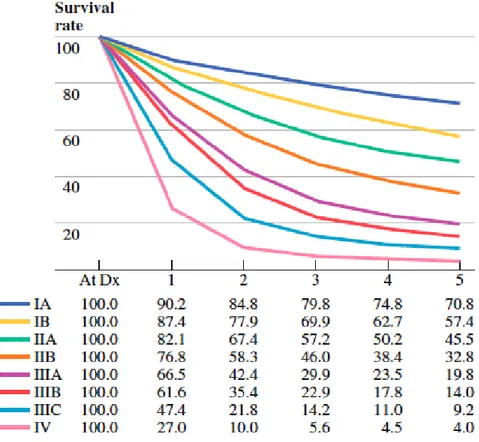
Ai diversi stadi corrisponde una diversa sopravvivenza:
Fig. 1.3: Sopravvivenza a 5 anni per stadi, da AJCC Cancer Staging Manual, 7th edition,
2009
Classificazione giapponese
La classificazione giapponese è molto più dettagliata: risulta incentrata sulla differenza tra stadio clinico, chirurgico, patologico e “finale” e include anche una classificazione per l’EGC.
La classificazione del T è basata, come per il TNM, sull’invasione della parete e l’estensione alle strutture adiacenti. La stadiazione linfonodale invece è basata sulla divisione in 18 regioni linfonodali che vengono raggruppate in 3 categorie. Vengono inoltre considerati la descrizione macroscopica del tumore, l’estensione peritoneale,
Tumore primitivo (T):
- T1: il tumore invade la mucosa e/o la muscolaris mucosae (M) e/o la sottomucosa (SM)
- T2: il tumore invade la muscolare propria (MP) o la sottomucosa (S) - T3: il tumore penetra la sierosa (SE)
- T4: il tumore invade le strutture adiacenti (SI) - Tx: sconosciuto
Stadio linfonodale (N):
- N0: non c’è evidenza di metastasi linfonodali
- N1: metastasi nei linfonodi del gruppo 1 ma assenza di metastasi nei gruppi 2 e 3 - N2: metastasi nei linfonodi del gruppo 2 ma assenza di metastasi nel gruppo 3 - N3: metastasi nei linfonodi del gruppo 3
- Nx: sconosciuto Stadio epatico (H):
- H0: assenza di metastasi epatiche - H1: presenza di metastasi epatiche - Hx: sconosciuto
Stadio peritoneale (P):
- P0: assenza di metastasi peritoneali - P1: presenza di metastasi peritoneali - Px: sconosciuto
Stadio peritoneale citologico (CY):
- CY0: citologia benigna o indeterminata - CY1: cellule tumorali nel liquido peritoneale - CYx: non determinato
Altre metastasi a distanza (M):
- M0: assenza di altre metastasi (possono esserci metastasi epatiche, peritoneali o citologia positiva)
- M1: metastasi a distanza oltre a quelle peritoneali ed epatiche - Mx: sconosciuto11
Classificazione R
Anche questa classificazione ha un’importante implicazione sulla prognosi e sul trattamento e dovrebbe essere sempre riportata.
Questa classificazione permette di quantizzare la malattia residua dopo la resezione chirurgica della neoplasia:
- R0: assenza di residuo microscopico o macroscopico - R1: presenza di residuo microscopico
- R2: presenza di residuo macroscopico.11
Classificazione del carcinoma della giunzione gastroesofagea
Questo tipo di classificazione, specifica per l’adenocarcinoma della giunzione gastroesofagea, fu introdotta da Siewert e Stein nel ’98. Questo sistema classificativo riconosce tre distinte entità che si sviluppano entro 5 cm dalla giunzione gastroesofagea sia a livello gastrico sia a livello esofageo:
- Tipo 1: adenocarcinoma dell’esofago distale che spesso origina da un’area di metaplasia intestinale (Esofago di Barrett) e può arrivare ad infiltrare la giunzione esofagogastrica dall’alto.
- Tipo 2: adenocarcinoma del cardias, che origina dall’epitelio del cardias o da brevi segmenti di metaplasia intestinale a livello della giunzione esofago gastrica.
- Tipo 3: adenocarcinoma dello stomaco sottocardiale che può infiltrare la giunzione gastroesofagea o l’esofago distale dal basso.
L’appartenenza delle singole neoplasie ad uno dei tipi si basa sulla morfologia e sulla localizzazione precisa del tumore.
La classificazione di Siewert ha importanti implicazioni terapeutiche. Le vie di drenaggio linfatico sono diverse per il tipo 1 rispetto al tipo 2 e 3: infatti il drenaggio linfatico del basso esofago si porta sia in direzione cefalica (all’interno del mediastino) sia in direzione caudale (verso l’asse celiaco); contrariamente il drenaggio linfatico della zona cardiale e
trattati con una gastrectomia estesa transaddominale (resezione di stomaco e esofago distale intraddominale).11, 38
Fattori prognostici
Il principale fattore prognostico è lo stadio TNM ed in particolare il numero di linfonodi interessati. A questi seguono il grado tumorale e il tipo istologico. L’invasione linfatica, venosa e perineurale hanno un impatto peggiorativo sulla prognosi, così come l’infiltrazione dei margini.39
Tra i principali fattori prognostici clinici studiati recentemente ritroviamo il performance status (PS), la perdita di peso, la presenza di malattia misurabile e di masse addominali, il vomito, l’anoressia, la ripresa locale di malattia, la presenza di metastasi epatiche, la presenza di sedi metastatiche multiple, la leucocitosi, la leucopenia, la linfopenia, l’ipoprotidemia e i livelli elevati di marcatore tumorale CEA.
Una metanalisi effettuata per analizzare i principali fattori prognostici ha permesso di identificarne quattro negativi: PS> o =2, metastasi epatiche, peritoneali e fosfatasi alcalina > o =100 U/l.
Sulla base di tali fattori è stato costruito l’indice prognostico della Royal Marsden Hospital Prognostic Index, che consente di distinguere tre gradi di rischio:
Pazienti a basso rischio (senza fattori di rischio) con mOS di 11.8 mesi Pazienti a rischio moderato (con 1 o 2 fattori di rischio) con mOS di 7.4 mesi Pazienti ad alto rischio (con 3 o 4 fattori di rischio) con mOS di 4.1 mesi 4041 All’interno del progetto GASTRIC, Pozzo et al. hanno condotto una metanalisi su 3.619 pazienti affetti da adenocarcinoma gastrico metastatico per identificare fattori prognostici, osservando che la sopravvivenza è particolarmente influenzata dal PS, dall’estensione di malattia al momento della presentazione, dal numero e tipo di localizzazioni metastatiche.42
Un fattore ancora controverso, ma presente in circa il 4.4-53.4% dei carcinomi gastrici, è rappresentato della iperespressione di HER-243, che sembrerebbe essere associata più frequentemente al tipo istologico della variante intestinale secondo Lauren, alla
localizzazione gastroesofagea (24-32%) piuttosto che gastrica (9.5-18%) e alla presenza di metastasi epatiche.44,45
Negli ultimi anni molti studi hanno suggerito un ruolo delle alterazioni genetiche e di caratteristiche biomolecolari tra cui l’iperespressione di p53, di VEGF, di EGFR, di c-MET.
HER-2 nel carcinoma gastrico
Il recettore HER-2, anche detto ERBB2 o HER-2/neu, è un membro della famiglia dell’ErbB che comprende anche l’EGFR o ERBB1, l’HER-3 o ERBB3 e l’HER-4 o ERBB4. Questi recettori sono strettamente correlati e cooperano nella regolazione di differenti processi cellulari quali la proliferazione, la differenziazione e la sopravvivenza.46 Strutturalmente presentano un dominio extracellulare per il legame con il fattore di crescita, una porzione trans-membrana e un dominio intracellulare ad attività tirosin-kinasica.47
L’interazione tra ligando e recettore determina la formazione di complessi di omo- ed etero-dimeri con conseguente fosforilazione della tirosin-kinasi, attivazione della cascata intracellulare ed espressione di diversi geni implicati in diversi processi cellulari.
L’espressione di HER-2 nel carcinoma gastrico e della giunzione gastroesofagea è di circa il 20% e non risulta essere omogenea, con maggiore espressione nelle localizzazioni prossimali del tumore, fondo e cardias, rispetto alle localizzazioni distali, corpo e antro, e nell’istotipo intestinale rispetto alle forme diffuse.
Differenze significative correlano anche con il grado di differenziazione del tumore: tumori ben o moderatamente differenziati presentano un’espressione proteica maggiore rispetto alle neoplasie scarsamente differenziate. Questo in accordo con l’evidenza che anche nelle lesioni displastiche è possibile documentare, seppur con minor frequenza, una positività di HER-2.
Infine la concordanza tra lo stato di HER-2 e quello metastatico fornisce la base biologica per il razionale di una terapia nei pazienti con carcinoma gastrico metastatico.48
EGFR nel carcinoma gastrico
EGFR (Epidermal Growth Factor Receptor) è un recettore transmembrana tirosin-kinasico con un dominio extracellulare e uno intracellulare, che appartiene alla famiglia HER. EGFR è attivato dal legame con il ligando a cui segue o un omodimerizzazione o eterodimerizzazione con un altro membro di questa famiglia, come ERBB2 (Her-2/neu), ERBB3 e ERBB4.49
I ligandi per EGFR includono EGF, TGF-beta, amfiregulina, epiregulina, betacellulina e HB-EGF.50
Il legame tra EGFR-ligando si risolve in un’attivazione della cascata di fosforilazione e conseguente attivazione di protein kinasi Ras-Raf_mitogen-activated, del pathway fosfatidilinositolo 3-kinasi (MEK)/ERK, che sono importanti nella proliferazione e sopravvivenza della cellula tumorale.51, 52
L’iperespressione dell’EGFR si osserva nel 27-44% dei carcinomi gastrici e sembra essere associata con una cattiva prognosi53,54, nonostante evidenze contraddittorie.55
Una recente analisi retrospettiva condotta su 829 pazienti asiatici con carcinoma gastrico resecati in stadio II/III arruolati nel ACTS-GC (the Adjuvant Chemotherapy Trial of TS-1 for Gastric-Cancer) ha rilevato un’incidenza dell’EGFR, tramite immunoistochimica, del 7%.56
MET nel carcinoma gastrico
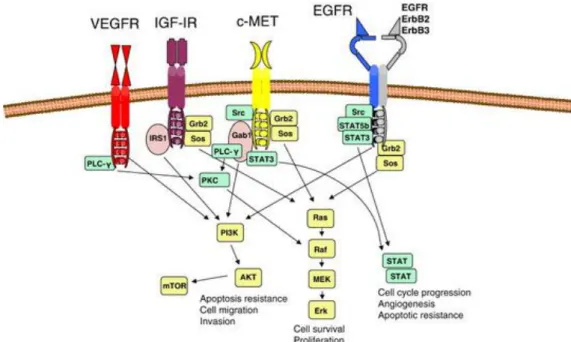
MET (N-methyl-N-nitroso-guanidine human osteosarcoma tranforming gene) è un oncogene che codifica per un recettore ad attività tirosin-kinasica che viene attivata quando il suo dominio extracellulare si lega all’HGF (Hepatocyte Growth Factor). L’attivazione di MET esita poi in segnali di proliferazione, sopravvivenza e stimolo dell’angiogenesi della cellula tumorale attraverso l’attivazione di diverse cascate del segnale come RAS/RAF/MAPK e PI3K-AKT, target comuni alla famiglia EGFR.57,58
In realtà, recentemente è stato osservato che l’up-regolazione di queste kinasi può conferire resistenza agli inibitori di MET.59,60,61
Di contro, l’amplificazione di MET sembra essere associata con la resistenza agli inibitori di EGFR. 62,63,64,65
La proteina MET, valutata attraverso immunoistochimica (IHC), è iperespressa in circa il 50-73.7% dei carcinomi gastrici avanzati.66,67,68,69
La sua iperespressione correla con una maggiore profondità d’invasione, un aumento del potenziale metastatico e un peggior outcome clinico.70,33, 66,67,68
m-TOR nel carcinoma gastrico
m-TOR (mammalian target of rapamycin) è una kinasi regolatrice che ha la funzione di aumentare la produzione di proteine che stimolano i processi cellulari chiave tra cui la crescita e la proliferazione cellulare, il metabolismo cellulare e l’angiogenesi.71
Diversi studi preclinici hanno mostrato una disregolazione dell’attività di m-TOR nei carcinomi gastrici, suggerendo un suo potenziale ruolo come target molecolare. Alcuni studi hanno evidenziato come diversi campioni di carcinoma gastrico esprimessero m-TOR fosforilato72-74, il quale risulta positivamente correlato con la progressione tumorale e con una scarsa sopravvivenza.73-75
AKT nel carcinoma gastrico
Il pathway fosfoinositide 3-kinasi (PI3K)/proteina kinasi B (AKT) gioca un ruolo centrale nella progressione di molte neoplasie maligne e ha mostrato essere un possibile target terapeutico.76 La proteina kinasi B (AKT) è essenziale per la crescita cellulare, per la proliferazione e per la sopravvivenza. Un’attivazione aberrante di AKT è uno delle più comuni caratteristiche molecolari nei tumori maligni umani compreso il carcinoma gastrico e si pensa giochi un ruolo importante nella sopravvivenza della cellula tumorale e nella resistenza alla chemioterapia.77
Il pathway PI3K/AKT risulta fortemente espresso nell’adenocarcinoma gastrico (PI3K espresso nell’80% dei tumori gastrici, p-AKT nell’82.2%).76
Fig. 1.4: Cascata di trasduzione del segnale di MET ed EGFR.
Trattamento del carcinoma gastrico e della giunzione gastroesofagea
1.Trattamento della malattia iniziale
Chirurgia
La chirurgia rimane tuttora l’unica arma potenzialmente curativa, anche se meno del 40% dei pazienti affetti da carcinoma gastrico è suscettibile di un intervento radicale.
Le indicazioni e il tipo di trattamento chirurgico dipendono dalle caratteristiche della neoplasia al momento della diagnosi e variano a secondo che si tratti di un Early Gastric Cancer (EGC) [A], di un cancro avanzato (AGC) [B], di un cancro avanzato con diffusione agli organi circostanti (T4b) [C] o con carcinosi peritoneale [D].
[A]Per quanto riguarda l’Early Gastric Cancer, sono state proposte nuove tecniche di resezione endoscopica alternative alla resezione gastrica. Può essere utilizzata una resezione endoscopica limitata alla mucosa (EMR o Endoscopic Mucosal Resection) oppure una resezione endoscopica comprendente la sottomucosa (ESD o Endoscopic
Submucosal Dissection). Questa resezione endoscopica è indicata quando la neoplasia è limitata alla mucosa, di diametro inferiore ai 2 cm, istologicamente ben differenziata e in assenza di invasione linfatica o vascolare. Alcuni autori giapponesi hanno proposto di estendere la resezione endoscopica anche ad alcuni casi di neoplasia estesa alla sottomucosa, ma nei paesi occidentali si ritiene che se non esistono le caratteristiche sopra elencate, sia necessario un intervento chirurgico resettivo.78 79
La gastroresezione totale o subtotale distale con un margine libero di almeno 2 cm e una linfoadenectomia D1-D2 è considerato il trattamento di scelta. In particolare una linfoadenectomia D1 (che comprende i linfonodi 1-7) viene utilizzata nei tumori T1a non suscettibili di trattamento endoscopico e nei cT1bN0 di tipo differenziato e di diametro inferiore ai 15 mm. Una linfoadenectomia D1+ (che comprende i linfonodi 1-9) è indicata per gli altri tumori cT1N0. Una linfoadenectomia D2 è riservata a quei EGC che presentino metastasi linfonodali (T1N+).
Per ridurre l’estensione delle linfoadenectomie è stata proposta nell’EGC la tecnica del linfonodo sentinella, che però non risulta attualmente sufficientemente affidabile a causa del numero elevato di linfonodi sentinella che vengono identificati e a causa dei numerosi falsi negativi.
[B]Per quanto riguarda il carcinoma gastrico localmente avanzato (T2, T3, T4a), la chirurgia rappresenta il momento principale nel trattamento della neoplasia, laddove non sia possibile sottoporre il paziente ad una chemioterapia neoadiuvante. Un intervento chirurgico per essere oncologicamente valido deve essere, laddove possibile, un intervento radicale (R0). Un intervento radicale è quello che garantisce una completa asportazione del tumore primitivo e l’assenza di malattia diagnosticabile con i comuni esami di stadiazione. La classificazione della radicalità chirurgica secondo la UICC è la seguente:
- Rx: la presenza di tumore residuo non può essere valutata - R0: assenza di tumore residuo
- R1: residuo tumorale microscopico a livello della trancia di resezione o pazienti in cui la citologia del liquido peritoneale libero o del liquido di lavaggio risulta essere
Si ritiene adeguata una resezione che cada ad almeno 5 cm dal margine del tumore con margine microscopico negativo; a livello del duodeno possono essere sufficienti 2 cm poiché il piloro sembra essere una barriera all’estensione del carcinoma.5
I principi di una chirurgia radicale per il carcinoma gastrico sono:
Gastrectomia totale o subtotale con margini di resezione liberi da malattia Asportazione “in blocco” del grande e piccolo omento
Asportazione “in blocco” dei linfonodi loco-regionali Resezioni “in blocco” degli organi adesi alla neoplasia.
La tipologia dell’intervento chirurgico viene scelta sulla base della sede della neoplasia. Per le neoplasie dell’antro gastrico e del piloro la gastroresezione subtotale distale rappresenta l’intervento di scelta ed è indicata anche per le lesioni del terzo medio a condizione che i margini di resezione macroscopicamente liberi da malattia siano di almeno 5 cm. Quando ci siano dei dubbi sul margine di resezione sia prossimale (gastrico) sia distale (pilorico) è indicato un esame istologico estemporaneo della trancia.
È stato infatti dimostrato da numerosi studi clinici randomizzati che la gastrectomia totale in pazienti con localizzazione della malattia distale non offre vantaggi in termini di ricadute e sopravvivenza rispetto alla gastrectomia subtotale. Inoltre questo tipo d’intervento sembra essere gravato da una maggiore morbilità e mortalità, mentre la gastrectomia subtotale sembra in grado di mantenere un migliore stato nutrizionale e una migliore qualità di vita. Uno studio italiano di ampie dimensioni conferma questi risultati.80
La gastrectomia totale va riservata alle lesioni del terzo superiore e del terzo medio con margini di resezione non adeguati. Nelle gastrectomie totali eseguite per neoplasie sotto-cardiali va sempre eseguito l’esame istologico del margine di resezione esofageo.
Per le neoplasie della giunzione gastroesofagea è possibile utilizzare un approccio esclusivamente laparotomico oppure una approccio combinato toraco-addominale, con una gastrectomia totale estesa ad un tratto di esofago di almeno 5 cm al di sopra dell’estensione macroscopica della neoplasia. In alternativa può essere realizzata una resezione gastroesofagea (resezione polare superiore) con conservazione dei 2/3 inferiori dello stomaco e anastomosi esofago-gastrica, intervento comunque gravato da importanti sequele postoperatorie legate alla denervazione dello stomaco residuo.
Dopo gastrectomia totale, la ricostruzione della continuità digestiva utilizzando la prima ansa digiunale “esclusa” secondo Roux con il confezionamento di una anastomosi esofago-digiunale rappresenta la modalità più accettata. Dopo gastroresezioni, le ricostruzioni gastro-digiunali secondo Billroth II sono gravate da una maggiore incidenza di complicanze postoperatorie e a distanza rispetto alla ricostruzione su ansa esclusa alla Roux.
Splenectomia
In generale si può affermare che la splenectomia, ad eccezione di alcuni casi, va evitata, essendo soggetta ad un maggior numero di complicanze postoperatorie ed essendo le percentuali di sopravvivenza dei pazienti splenectomizzati inferiori rispetto a quelle dei pazienti non sottoposti a splenectomia. La splenectomia di principio va riservata solo ai casi in cui ci sia un interessamento macroscopico dei linfonodi dell’ilo splenico o dell’arteria splenica distale. L’incidenza di questo tipo di metastasi è praticamente trascurabile per le neoplasie del terzo inferiore dello stomaco ed è comunque bassa per le neoplasie del terzo medio e superiore. Un caso particolare è rappresentato dalle neoplasie T4 della grande curva in cui l’incidenza di metastasi ai linfonodi dell’ilo splenico raggiunge il 25-30%: in questo caso può essere indicata una splenectomia di principio, anche se non esistono studi che dimostrino un chiaro vantaggio in termini di sopravvivenza e di intervallo libero da malattia dei pazienti sottoposti a splenectomia.81
Linfoadenectomia
Il numero di linfonodi metastatici ed il rapporto tra numero di linfonodi metastatici e numero di linfonodi esaminati sono tra i fattori prognostici più importanti per i pazienti con cancro gastrico sottoposti ad intervento radicale.
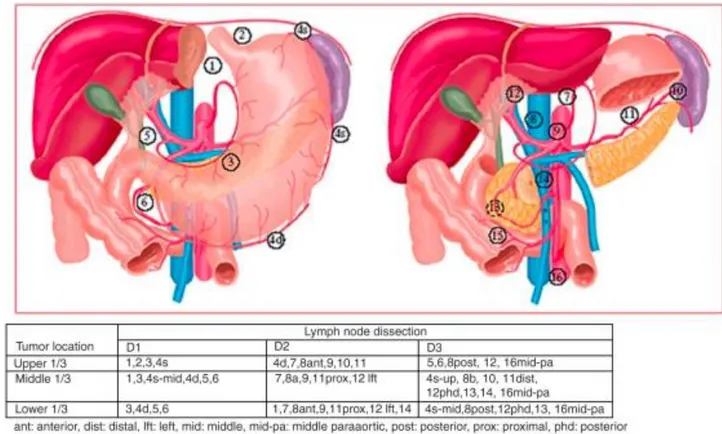
La rimozione dei linfonodi perigastrici della piccola e grande curva (linfoadenectomia D1) viene realizzata “en bloc”, insieme all’asportazione dello stomaco.
linfoadenectomia estesa (D2), questo tipo di linfoadenectomia consente una corretta stadiazione della neoplasia e può essere curativo nei tumori ad estensione loco-regionale. Infatti nella classificazione UICC viene raccomandata l’asportazione di almeno 15 linfonodi per poterclassificare un paziente N3: una linfoadenectomia di tipo D1, limitata ai soli linfonodi perigastrici, potrebbe portare ad una sottostadiazione dei pazienti.
Una linfoadenectomia più estesa della D2 (D2+ secondo la classificazione giapponese) non viene considerata una linfoadenectomia standard. In particolare in un recente studio clinico controllato condotto in Giappone non sono stati dimostrati vantaggi terapeutici della linfoadenectomia profilattica dei linfonodi para-aortici; in più questa procedura risulta gravata da un più elevato numero di complicanze. È inoltre bene ricordare che in presenza di metastasi ai linfonodi para-aortici la malattia è classificata come M1.11
Fig. 1.5: Stazioni e dissezione linfonodali. Da Japanese Research Society for Gastric Cancer
Chirurgia mini-invasiva
La chirurgia dello stomaco può essere realizzata in corso di laparoscopia e tale metodica, che necessita di un buona esperienza chirurgica, non è gravata da maggiori mortalità e morbilità postoperatorie e può rispettare i principi di chirurgia oncologica che vengono applicati alla laparotomia. Nei paesi orientali, soprattutto in Giappone, la gastroresezione subtotale laparoscopica è diventata la procedura di scelta e recenti meta-analisi hanno confermato che per l’Early Gastric Cancer tale metodica consente di ottenere risultati simili alle procedure open in termini di sopravvivenza e di intervallo libero da malattia. Rimane attualmente da definire se questo approccio offra gli stessi vantaggi nelle localizzazioni del terzo superiore e nei tumori più avanzati.
Citologia e lavaggio peritoneale
Nei pazienti con carcinoma gastrico la presenza di cellule neoplastiche nella cavità peritoneale rappresenta un importante fattore prognostico negativo: l’incidenza di recidiva peritoneale nei pazienti con citologia positiva è molto elevata e la sopravvivenza dei casi trattati con la sola chirurgia è paragonabile a quella dei pazienti con metastasi a distanza. L’esame citologico del liquido di lavaggio peritoneale è un’indagine intraoperatoria di facile esecuzione e la positività o negatività della citologia condiziona fortemente l’estensione della resezione: ad esempio, in presenza di citologia positiva si preferiranno interventi meno demolitivi e linfoadenectomia di tipo D1.
[C] Per quanto riguarda il carcinoma gastrico T4b, è stato notato che circa il 15-20% dei carcinomi gastrici avanzati, al momento della diagnosi si presenta come una neoplasia che supera la sierosa ed infiltra gli organi contigui (T4b). Un intervento curativo per le neoplasie localmente avanzate è realizzabile nel 30-50% dei casi anche per l’elevata incidenza di metastasi linfonodali extraregionali riscontrabili nel 10-20% dei casi. In
forme localmente avanzate, l’estensione della resezione gastrica è condizionata dalla sede della neoplasia, anche se nella maggior parte dei casi le dimensioni della lesione rendono necessario un intervento di gastrectomia totale.
Queste forme necessitano quindi spesso di una chirurgia allargata, che si basa sul principio di resecare, se tecnicamente possibile, le strutture e gli organi adiacenti alla neoplasia, previa accertamento dell’assenza di metastasi epatiche e peritoneali.
- I tumori T4 localizzati al terzo medio e superiore richiedono più frequentemente l’asportazione della milza per la presenza di infiltrazione diretta, per una elevata incidenza di metastasi ai linfonodi dell’ilo splenico e per il frequente interessamento pancreatico che richiederà una spleno-pancreasectomia distale. - Per i tumori T4, la pancreasectomia distale si rende necessaria quando c’è
infiltrazione per contiguità del pancreas; in questi casi inoltre è necessaria una accurata esplorazione della regione paraortica laterale sinistra e, in caso di dubbie linfoadenopatie, da alcuni autori viene suggerita la surrenalectomia sinistra.
- Le resezioni del mesocolon, del colon trasverso, dei segmenti sinistri del fegato, e del diaframma sono indicate in presenza di un’infiltrazione per contiguità di questi organi.82
[D] La carcinosi peritoneale rappresenta un evento molto frequente nel carcinoma gastrico avanzato (T3 e T4), soprattutto nell’istotipo diffuso. Ovviamente la chirurgia resettiva tradizionale non consente di trattare adeguatamente questa condizione, per cui a partire dagli anni ’90 sono state sviluppate alcune metodiche per il trattamento della carcinosi peritoneale, tra cui la chirurgia citoriduttiva e la chemioterapia ipertermica intraperitoneale (HIPEC).
In pazienti con carcinoma gastrico la HIPEC viene utilizzata:
- in presenza di carcinosi come intervento curativo per ridurre al minimo la malattia residua dopo citoriduzione
- in assenza di carcinosi come terapia adiuvante nei carcinomi gastrici infiltranti la sierosa(T4a eT4b)
- come trattamento palliativo delle asciti che non rispondono alla chemioterapia sistemica.
È bene precisare che se per alcune carcinomatosi (come quelle da pseudomixoma peritonei, mesotelioma peritoneale e carcinoma del colon-retto) l’efficacia della HIPEC in