1
La cardiomiopatia settica
Il presente concetto sulla patogenesi della sepsi batterica è centrato sull’idea che stimoli eterogenei che includono batteri stessi, esotossine, endotossine o superantigeni evocano l’attivazione di mediator cells con il conseguente rilascio secondario di citochine e mediatori pro-infiammatori. (1) L’esagerata attivazione di questa risposta protettiva è alla base delle manifestazioni cliniche della sepsi. Oltre all’effetto negativo indotto dalla produzione di fattori endogeni come TNF alfa , esiste anche una tossicità diretta determinata dalle tossine batteriche come l’endotossina, esotossina A , l’acido lipoteicoico e che coinvolge anche il cuore.(2) Recentemente è emerso che anche stimoli non infettivi come il bypass cardiopolmonare, pancreatite, traumi severi, possono innescare l’attivazione di questi meccanismi difensivi e determinare un quadro clinico simile allo stato settico e descritto come SIRS (risposta infiammatoria sistemica).
Per lungo tempo è stato negato un coinvolgimento del cuore come organo bersaglio della disfunzione d’organo sistemica (MODS) indotta dalla sepsi; tale ipotesi si basava sull’ evidenza che i pazienti settici mantengono una portata cardiaca normale o aumentata rispetto ai valori fisiologici.
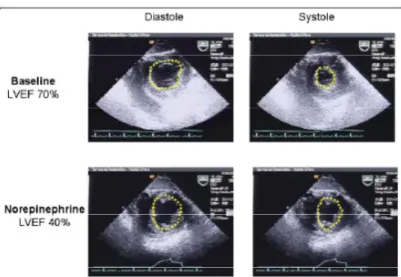
Tuttavia la disfunzione cardiaca diventa evidenete quando l’output cardiaco si correla alle resistenze vascolari sistemiche che sono intensamente ridotte dalla vasodilatazione sepsi-indotta.( Figura1)
Figura 1 Riduzione della Frazione di eiezione dopo infusione di noradreanalina in un paziente con shock settico. L’aumento del post-carico rivela la sottostante riduzione della contrattilità prima mascherata dalle basse resistenze periferiche
2
Un cuore sano è in grado di mantenere una pressione arteriosa normale dopo riduzione del post-carico indotto da vasodilatazione attraverso un proporzionale aumento della portata cardiaca; al contrario spesso i valori osservati nei pazienti settici di cardiac output sono inferiori a quelli attesi secondariamente alla vasoplegia. (7)
La cardiomiopatia settica è presente nei pazienti settici molto più frequentemente di quanto venga diagnosticata. In senso stretto il 30-80% di pazienti con sepsi severa presenta un non-STEMI, con livelli di troponina al di sopra dei range di normalità. I pazienti con elevati livelli di troponina necessitano di più alte dosi di noradrenalina e hanno una prognosi peggiore. Inoltre gli elevati livelli di peptidi natriuretici atriali incorso di sepsi indicano un impairment della funzione. Cambiamenti del tracciato elettrocardiografico nei pazienti settici possono documentare segni di ischemia ma nella maggior parte dei casi sono non specifici.
La prima evidenza della soppressione della funzione miocardica nei pazienti con shock settico fu dimostrata inequivocabilmente da Parrillo nel 1983 il quale evidenziò in vitro una riduzione della capacità di accorciamento di fibre miocardiche dopo esposizione a siero di pazienti settici. (3) Lo stesso team scoprì come il fattore scatenante la depressione miocardica fosse il TNF alfa. In seguito altre sostanze come l’il1 beta, e il C5a sono state evidenziate come in grado di deprimere in vitro la funzione cardiaca. Recentemente è stato scoperto che il fattore C5a potrebbe avere un ruolo chiave nella cardiomiopatia settica, poichè sarebbe il fattore che innesca la produzione di citochine cardioplegiche come TNF 1 alfa , il-6 , il1Beta direttamente da parte dei cardiomiociti stessi. (4-5)
Accanto all’effetto negativo indotto dalle citochine esistono altre evidenti cause cellulari che possono spiegare la cardiopmiopatia settica come le
3
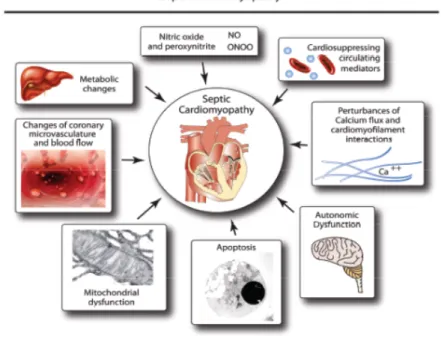
alterazione dell’omeostasi del calcio intracellulare, della sensibilità dei miofilamenti al calcio, la disfunzione del sistema nervoso autonomo, la disfunzione mitocondriale , l’apoptosi, la produzione di ossido nitrico e perossinitriti e di metalloproteinasi, la riduzione dei recettori beta- adrenergici. (7)(18)(Figura2)
E’ opinione recente che la cardiomiopatia settica rappresenti non soltanto un’ alterazione patologica d’organo da curare ma uno stato funzionale e metabolico di ibernazione cellulare da non alterare profondamente poichè permette ai miocardiociti di sopravvivere in una condizione come la sepsi in cui il rapporto fra apporto e dispendio energetico è sfavorevole. (6)
La prima caratteristica della cardiomiopatia settica è che è acuta e reversibile. La seconda è che la disfunzione sistolica è associata a pressioni
Figura 2 Meccanismi fisiopatologici coinvolti nella genesi della cardiomiopatia settica
4
di riempimento del ventricolo sinistro normali o ridotte, anche con frazione di eiezione ventricolare <45%.
Questo stato emodinamico trova la sua spiegazione in due meccanismi. Il primo è correlato alla disfunzione del ventricolo destro in corso di sepsi, determinato o dall’ipertensione polmonare acuta indotta da acute lung injury o dalla depressione della contrattilità destra intrinseca prodotta dalle citochine della sepsi. Ciò è dimostrato dal fatto che quasi il 30% dei pazienti con presentano una dilatazione del ventricolo destro che è suggestiva di un impairment della sua funzione.
Il secondo è determinato da un’alterazione della compliance del ventricolo sinistro; in particolare l’iniezione di endotossina determina una depressione della funzione ventricolare sinistra associatà però ad una riduzione del rapporto fra pressione di PCWP/LVEDV.
Considerato lo strano pattern emodinamico funzionale cardiaco in corso di sepsi, l’incidenza di cardiomiopatia e della disfunzione ventricolare in corso di sepsi varia significativamente. Infatti lo stesso valore di frazione di eiezione può corrispondere a vari livelli di contrattilità intrinseca del ventricolo sinistro in funzione di post-carichi e precarichi differenti.(19) E’ difficile inoltre sabilire come la cardiomiopatia settica influisca sulla prognosi dei malati di shock settico, poichè molte altre variabili sono coinvolte come l’età, la storia del paziente, il tipo di microganismo. Inizialmente Parker et al.(6) Hanno suggerito che la cardiomiopatia settica fosse uno stato protettivo poichè la presenza di un profilo ipocinetico è stato associato ad una mortalità più bassa nei pazienti settici rispetto a quelli che mantenevano un profilo normocinetico. Attualmente invece di considerare protettivo l’effetto della disfunzione del ventricolo sinistro in corso di sepsi, si è concluso che la prognosi della cardiomiopatia settica è peggiore se associata ad uno stato ipercinetico che riflette una persistenza dello stato di vasoplegia.
5
Le Linee Guida recenti sul trattamento della sepsi danno delle raccomandazioni dettagliate sul riempimento fluidico e il trattamento vasopressorio in corso di sepsi, poichè la stabilizzazione cardiovascolare precoce è associata adun aumento della sopravvivenza.
L’utilizzo massivo di infusioni suggerito da Parker mantiene un CI normale anche in presenza di un impairment della funzione del LV attraverso un adattamento del riempimento ventricolare Tuttavia come dimostrato da Ognibene l’utilizzo eccessivo di fluidi spesso smaschera soltanto un appiattimento della curva di Frank-Starling ed è associato ad una prognosi infausta.
La seconda opzione è l’utilizzo di vasopressori come la dobutamina che aumentano la frazione di eiezione del ventricolo sinistro e il cardiac index. Non è ancora chiaro se l’aumento relativo della performance ventricolare sia associato ad un miglioramento della prognosi dei pazienti shock settico, tuttavia è noto che una risposta emodinamica all’infusione di dobutamina con aumento degli indici di performace e contrattilità cardiaca è associata ad una prognosi migliore nei pazienti settici.
Tuttavia l’infusione di dobutamina potrebbe essere considerato solo uno strumento diagnostico e non terapeutico, volto a stabilire quanto reversibile e di ibernazione sia la condizione di un cuore di un paziente in shock settico. E’ comunque opinione comune che la quantificazione della cardiomiopatia settica sia importante nella gestione del paziente con shock settico. Infatti il 70% dei pazienti che sopravvive ad uno shock settico ha una funzione di pompa normale ( cardiac output in relazione alle rispettive SVR maggiore dell’80% del valore previsto)inoltre l’aumento dei livelli di peptidi natriuretici atriali correla con la mortalità.(7)
Dal punto di vista clinico quindi è necessario utilizzare metodi che valutino la funzione miocardica in corso di sepsi e shock settico che tengano in
6
considerazione non solo la contrattilità intrinseca del mioccardio e la sua funzione di pompa, ma l’intero sistema cardiocircolatorio ed in particolare l’accoppiamento ventricolo-arterioso.
7
L’accoppiamento ventricolo arterioso
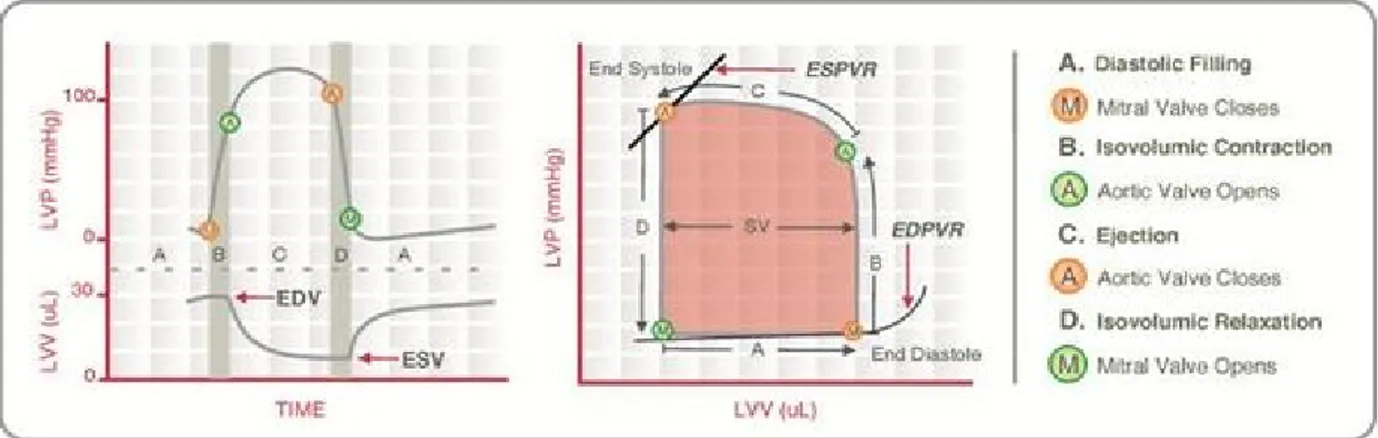
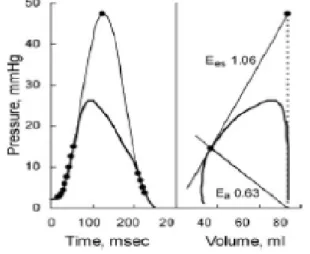
La performance del sistema cardiovascolare dipende dall’interazione delle sue componenti. Il ventricolo sinistro pompa uno stroke volume (SV) nel sistema arterioso chegarantisce un flusso ai tessuti. Di conseguenza una funzione cardiovascolare ottimale è il frutto di un accoppiamento appropriato dell’attività del ventricolo sinistro e del sistema arterioso. L’analisi funzionale di questi due sistemi richiede che il ventricolo sinistro e il sistema arterioso vengano descritti e studiati utilizzando termini simili. Per analizzare la funzione di pompa del Ventricolo sinistro i segnali in real time di pressione volume di ogni ciclo cardiaco possono essere combinati per generare dei loop che delimitano lo stroke volume del ventricolo sinistro per ogni battito.(Figura3)
La forma e la posizione del loop pressione volume riflette l’interazione tra le proprietà meccaniche del ventricolo sinistro e le condizioni di pre e post-carico.
E’ possibile derivare dai loop pressione volume degli indici che caratterizzano la funzione meccanica del ventricolo sinistro. In particolare
8
l’angolo in alto a sinistro del loop rappresenta il punto del ciclo cardiaco in cui il ventricolo sinistro raggiunge la massima stifness (elastanza) in un ciclo cardiaco. Per derivare un indice load-independent e di conseguenza icona dello stato di contrattilità intrinseca del ventricolo sinistroè necessario ottenere la relazione fra end systolic pressure e volume in differenti stati di pre-carico.
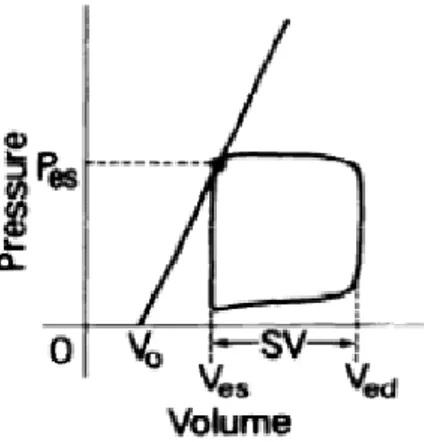
Sunagawa e altri hanno evidenziato come in range fisiologici la relazione fra la pressione di fine sistole e volume (end systolic pressure volume relationship) sia lineare quando misurata in differenti stati di pre-carico. Unendo i punti determinati dalla ESPVR in diversi stati di carico si crea una retta la cui pendenza descrive l’Ees ovvero l’elastanza ventricolare. Numerosi studi hanno evidenziato come la pendenza dell’elastanza ventricolare varia in funzione della contrattilità del ventricolo sinistro e che la ESPVR sia un parametro di funzionalità miocardica indipendente dal precarico. In particolare Suga e altri hanno evidenziato la relazione fra elastanza ventricolare, Pes (Pressione di fine sistole )e SV (Stroke volume) secondo l’equazione
Pes= Ees(Ved-SV-V0) dove Ved è il volume di fine diastole e V0 è il volume in cui si intercetta la retta dell’ESPVR (Figura4)
Figura 4 Retta dell ESPVR (end systolic pressure volume relationship) che intercetta nel punto V0 l’asse dle volume e che descrive l’elastanza di fine eiezione del ventricolo sinistro indice di contrattilità.
9
Lo stesso Sunagawa ha elaborato un modello per descrivere le proprietà dell’albero arterioso usando la relazione Pes- SV (stroke volume). Se le proprietà dell’albero arterioso vengono approssimate ad un modello a tre elementi secondo Windkessel con una caratteristica impedenza, resistenza periferica e compliance arteriosa è possibile ricavare dal Piano pressione volume una Elastanza dell’albero arterioso secondo l’equazione
Ea= SV/Pes(end esysolic pression)
Risolvendo le due equazioni per SV e approssimando la pressione di fne eiezione alla Pes si ha
SV=Ved-V0/ 1+Ea/Ees
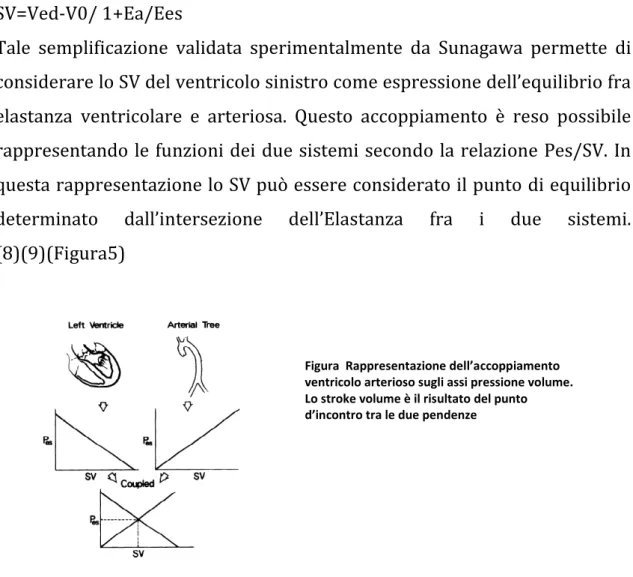
Tale semplificazione validata sperimentalmente da Sunagawa permette di considerare lo SV del ventricolo sinistro come espressione dell’equilibrio fra elastanza ventricolare e arteriosa. Questo accoppiamento è reso possibile rappresentando le funzioni dei due sistemi secondo la relazione Pes/SV. In questa rappresentazione lo SV può essere considerato il punto di equilibrio
determinato dall’intersezione dell’Elastanza fra i due sistemi.
(8)(9)(Figura5)
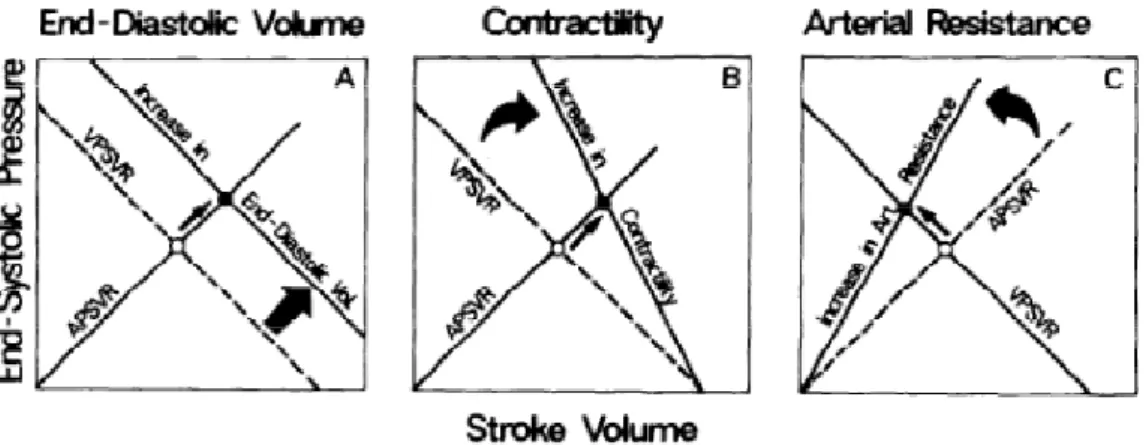
La modificazione dell’Ees o dell’Ea ossia della pendenza delle due rette porterà ad uno spostamento del punto di equilibrio e di conseguenza alla variazione dello SV. In ragione di ciò un aumento dell’End Diastolic Volume
Figura Rappresentazione dell’accoppiamento ventricolo arterioso sugli assi pressione volume. Lo stroke volume è il risultato del punto d’incontro tra le due pendenze
10
risulterà in un aumento dello SV senza variazione dell’ Ees o dell’Ea; un aumento puro della contrattilità aumenterà lo SV attraverso un aumento della pendenza dell’Ees, viceversa l’aumento dell’afterload ventricolare determinerà un aumento della pendenza dell’Ea con un decremento netto dello stroke volume. (fig.6)
L’analisi delle curve pressione volume e il concetto di elastanza ventricolare e arteriosa assumono un particolare interesse nella descrizione della funzione miocardica poichè tali metodi possono essere utilizzati come indice del consumo energetico e del lavoro miocardico nell’espletamento della sua funzione. Infatti il prodotto di Pressione e Volume descrive un’unità di energia. L’area delimitata dal loop PV è di conseguenza equivalente a unità di energia. Più precisamente quest’area descrive la quantità di lavoro meccanico esterno sviluppato dal ventricolo sinistro durante l’eiezione di uno Stroke Volume. Nella sua funzione il ventricolo si comporta come un generatore di energia idraulica; questa energia meccanica generata ad ogni contrazione è trasferita al sangue nella camera ventricolare, ma solo la quota di volume di eiezione di sangue transferisce questa energia al sistema arterioso. Questa importante quota di energia è definita Lavoro Esterno ( o
Figura A eEffetto della modificazione del precarico sullo stroke volume. L’aumento dello stroke determinato dall’aumento dell’End Diastolic volume non modifica la slope dell’Elastanza Ventricolare (Es)che risulta quindi indipendente dal precarico. B L’aumento della Contrattilità del ventricolo sinistro aumenta la pendenza della Es mentre l’aumento del post-carico (C) aumenta l’ Elastanza arteriosa. L’effetto netto è in B un aumento dello stroke volume per uno spostamento verso destra dell’equilibrio fra le elastanze e in C una riduzione dello stroke volume per uno shift verso sinistra del rapporto Es/Ea.
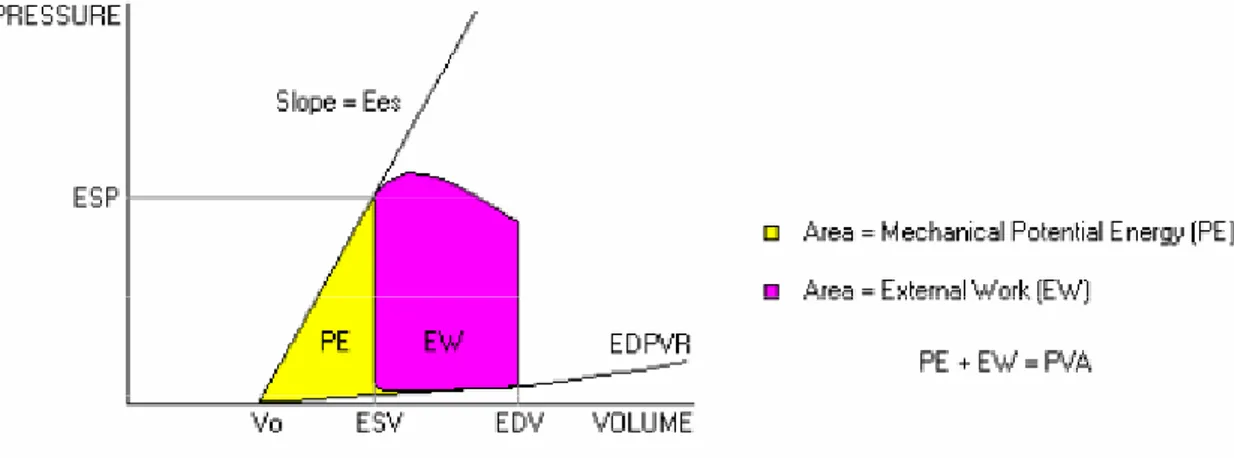
11
Stroke Work). Il resto dell’energia è Una Energia Potenzialne che viene dissipato come calore prima della successiva contrazione. E’ importante notare che è quindi possibile aumentare la quota di Lavoro Esterno se si permette al ventricolo di aumentare la sua eiezione su un post-carico ridotto. Se analizziamo il lavoro cardiaco nell’ambito delle curve pressione-volume, Il lavoro esterno (EW) è ovviamente rappresentato dall’area del PV loop. Alla fine della sistole il ventricolo possiede ancora un’energia potenziale ma che non viene convertita in lavoro esterno perchè l’interazione fra afterload (Ea) e contrattilità(Es) determina la fine dell’eiezione e la chiusura della valvola aortica. Di conseguenza questa energia potenziale può essere descritta nel grafico pressione volume come Il triagolo descritto delimitato dalla retta di elastanza ventricolare (Es-V0), le coordinate fra ESP-ESV e il tratto V0 –ESV.(fig)Concludendo L’energia Meccanica miocardica ventricolare per singolo battito può essere descritta come la Somma fra Il Lavoro Esterno e L’energia Poternziale che delimitano un’area totale denominata Pressure volume Area (PVA).(Figura7)
Figura 7 Rappresentazione del lavoro cardiaco evidenziato sulle curve pressione volume. La PVA rappresenta la somma del lavoro esterno ( stroke work) prodotto nell’eiezione e il lavoro potenziale (energia potenziale ) non convertita in calore.
Dal momento che la PVA rappresenta l’energia miocardica prodotta per ogni contrazione, la sua conoscenza assume una particolare importanza dal
12
punto di vista clinico. Infatti La PVA correla linearmente con il consumo miocardico d’ossigeno V02.
In un sistema idraulico come può essere definito quello ventricolo-arterioso, un concetto importante da definire è la sua efficienza. Possiamo definire l’efficienza come l’abilità del ventricolo di convertire l’nergia metabolica (VO2) in energia meccanica (PVA) da trasferire alla fine all’albero arterioso(EW). Di conseguenza il rapporto fra EW/PVA e EW/VO2 sono indici dell’ efficienza ventricolare ossia della sua capacità di convertire la quota di energia metaabolica in energia di eiezione.
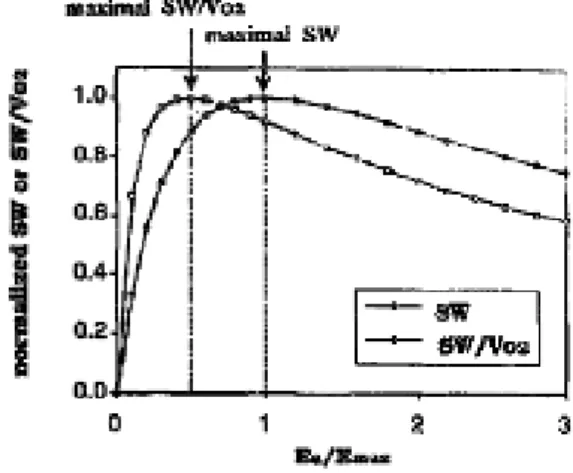
Sunagawa e altri hanno elaborato una equazione che descrive lo SW come funzione del rapporto fra Elastanza Ventricolare ed arteriosa.
SW= ESP*SV= Ea*(EDV-V0)2/(1+Es/Ea)2. Questa equazione predice che il lavoro cardiaco esterno è massimo quando il rapporto fra elastanza ventricolare e arteriosa è uguale a 1. Studi successivi hanno inoltre dimostrato invece che l’efficienza miocardica massima (SW/VO2) si ottiene quando il rapporto fra l’elastanza arteriosa e ventricolare è 0.5 (Figura8) Lo studio dell’accoppiamento ventricolo arterioso nelle sue componenti è quindi un’analisi fisiologica che ha dei risvolti clinici importanti. Lo studio dell’Elastanza arteriosa e Ventricolare e la loro interazione permettono infatti di individuare non solo lo stato di funzionalità miocardica ma anche l’efficienza del sistema ventricolare nell’ effettuare il proprio lavoro sia in condizioni fisiologiche o patologiche , sia dopo somministrazione di farmaci che alterano la contrattilità o l’afterload. (9)(11)(12)(14)
Figura 8 Relazione fra SW, SW/VO2 e accoppiamento ventricolo arterioso ricavato dall’equazione di Sunagawa e applicato in modello di cardiomioopatia dilatativa . Si noti come il massimo SW si ha per accoppiamento =1 e la massima efficienza per Ea/Es <0,5
13
Queste assunzioni trovano la loro traduzione in ambito clinico qunado analizziamo i numerosi studi effettuati sull’analisi dell’accoppiamento ventricolo arterioso in varie patologie cardiovascolari. Ad esempio lo scompenso cardiaco a frazione di eiezione conservata è oggi considerato come il frutto di un’alterazione diastolica accompagnato da un’importante uncoupling ventricolo arterioso; l’ipertrofia miocardica secondaria all’ipertensione e all’obesità è il tentativo di compensazione di un’aumento dell’Es per mantenere un coupling con l’elevata Elastanza arteriosa. In ambito intensivo poi Martin e alt. Hanno dimostrato come la rianimazione basata su target di miglioramento dello SW e dell’accoppiamento ventricolo arterioso migliora la prognosi di pazienti con politrauma. Nello stesso tempo i farmaci utilizzati come inotropi possono avere un’azione simile in termini di aumento della contrattilità cardiaca ma diverso impatto sulla performance ed efficienza miocardica; ad esempio gli inibitori delle
fosfodiesterasi migliorano l’accoppiamento ventricolare più della
dobutamina in pazienti cardiopatici con un effetto positivo sull’incremento dell’efficienza miocardica.
14
Analisi dell’Elastanza Ventricolare di fine eiezione con metodo Single Beat non invasivo
Studi su modelli animali e umani hanno dimostrato che l’ESPVR (end systolic pressure-volume relationship) è un parametro pressocchè lineare che descrive uno stato intrinseco di contrattilità miocardica in modo quasi indipendente dal pre-carico, post-carico e frequenza cardiaca. Queste analisi hanno dimostrato come che la pendenza dell’ESPVR (Es) è più ripida in pazienti con contrattilità normalee rispetto a quelli con contrattilità diminuita. Di conseguenza L’ESPVR e L’Es sono utili per la comprensione clinica della meccanica ventricolare in condizioni fisiologiche, patologiche e di modificazione iatrogena dell’inotropismo. Inoltre l’analisi simultanea dell’Ea permette di tracciare lo stato di accoppiamento ventricolare e l’efficienza del sistama circolatorio nelle diverse condizioni patologiche e dopo eventuali aggiustamenti terapeutici. L’ Elastanza arteriosa è definita come il rapporto fra Pes e SV (Pressione di fine sistole e Stroke volume) Tuttavia per l’analisi dell’Es è necessario conoscere almeno due curve pressione volume con differente end systolic pressure in uno stato di inotropismo costante. La costruzione di curve pressione volume con diversa end-systolic pressure può essere effettuata con una modificazione del pre-carico ventricolare e una occlusione delle vene cave. Tuttavia questo metodo risulta poco applicabile in clinica dove è difficile effettuare una modificazione controllata del precarico ventricolare.
Sono stati proposti numerosi approcci per stimare Ees senza modificazione del pre-carico; tali metodi vengono definiti come analisi sigle beat dell’Ees (Ees(SB)).
Ad esempio assumendo la linearità della ESPVR Sunagawa e altri hanno stimato la pendenza dell’ESPVR effettuando matecamaticamente una stima della Pmax alla fine della diastole attraverso un’analisi matematica curve
15
fitting della pressione ventricolare. La Pmax è la pressione massima raggiungibile dal ventricolo in contrazione isovolumetrica e risulta essere il punto più alto della retta passsante per la tangente alla curva di contrazione isovolumetrica(15)(Figura9)
Figura 9 Metodo curve fitting per la determinazione matematica della PMAX necessaria per la determianzione del punto di intersezione della retta di Es
Recentemente Chen e altri hanno elaborato un metodo interessante per la misura dell’Es single beat basandosi sullo studio delle curve di elastanza “normalizzate”; tali teorie si basano sull’assunzione che il ventricolo si comporti come una camera elastica che si contrae e rilassa in modo “prevedibile” nella scala temporale descrivendo una curva definita come time varyng elastance.
Utilizzando Pressioni e volumi determinate al tempo di midisovolumic contraction(td) ea fine sistole (tes), si derivano due valori di Elastanza ventricolare; Ed= (Pd/Vd-V0) e Es=(Pes/Ves-V0). Si è scoperto come il rapporto fra queste due elastanze ENd (Ed/Es) misurato in diversi tempi di contrazione isovolumetrica risulta conservato nella specie umana indipendentemente dalla presenza di di malattia cardiaca, pre e post carico. Di conseguenza la conoscenza di ENd e di td permette di derivare ES e Vo in un singolo battito.
16
Studi precedenti di Senzaki avevano raccolto pressioni e volumi in diversi tempi di contrazione isovolumetrica per la costruzione di ENd attraverso un catetere a conduttanza intraventricolare che registra le variazioni pressione e volume in modo continuo. Per un’analisi non invasiva invece Chen ha proposto l’utilizzo di un singolo punto pressione volume misurato all’inizio dell’eiezione ( Fine del periodo di contrazione isovolumetrica). Sostituendo la pressione diastolica come indice di end.isovolumic pressure del ventricolo sinistroe la pressione sistolica come indice della pressione sistolica del ventricolo sinistro a fine sistole è possibile derivare un’ elastanza ventricolare single beat dall’equazione
Es(sb)= [ Pd-(End*Ps*0,9) ]/ [ Ved-Ves)*ENd]= [ Pd-(End*Ps*0,9) ]/ [ SV*ENd]
dove Pd e Ps sono rispettivamente la pressione diastolica e sistolica, Ved eVes i volumi di fine diastole e fine sistole, SV lo Stroke volume.
L’accuratezza di questa equazione nel predire L’elastanza ventricolare di fine eiezione in modo single beat dipende dall’accuratezza del valore scelto per ENd.
Chen è riuscito a elaborare un modello matematico per la misurazione stimata non invasiva dell’ENd dalla stima di curve di elastanza ventricolare registrate precedentemente in 23 soggetti e ricavando un valore di ENd (Avg) nello stesso tempo di fine contrazione isovolumetrica td . NE risulta l’equazione
ENd (est) =0,0275-0,165*EF( frazione di eiezione)+0,3656*(Pd/Ps)+ 0,515*ENd(Avg)
ENd(avg) è il frutto di un’equazione polinomiale il cui valore dipende dal rapporto fra i tempi di preeiezione ventricolare e il tempo totale di sistole. Infine
17
Tale equazione finale ci permette di misurare l’elastanza ventricolare di fine eiezione attraverso parametri rilevati non invasivamente e che sono la pressione sistolica, la pressione diastolica, la frazione di eiezione, lo stroke volume e i tempi di preeiezione e sistole per la valutazione dell End (avg ) matematica.(16)
18
STUDIO
Studio retrospettivo di monitoraggio emodinamico e accoppiamento ventricolo arterioso di pazienti in shock settico di diversa eziologia ricoverati nell’anno 2011 presso la Rianimazione del Dipartimento Cardiotoracico AOUP Pisa.
Pazienti e Metodi
Sono Stati individuati nell’anno 2011 -2012 i pazienti con diagnosi di shock settico ricoverati presso la Rianimazione del Dipartimento cardio Toracico. Tutti i pazienti sono stati trattati omogeneamente secondo la Surviving Sepsis Campaign. E’stato effettuato un monitoraggio emodinamico arterioso invasivo e ecocardiografico transesofageo per analizzare i parametri necessari alla misurazione dell’accoppiamento ventricolo-arterioso single-beat non invasivo (16) al momento della diagnosi.
Sono stati rilevati quindi Cardiac Output e Frazione di Eiezione, Pressione arteriosa Sistolica, Diastolica, Media, Frequenza cardiaca, Elastanza ventricolre di Fine sistole (Es), Elastanza Arteriosa (Ea) e rapporto fra le elastanze ventricolare e arteriosa(Es/Ea), Saturazione Venosa di O2 (SvO2).
Analisi statistica
I dati sono espressi come media e deviazione standard. Il confronto fra gruppi è stato effettuato utilizzando Il test non parametrico Mann-Whytney per campioni non appaiati, mentre è stata costruita una regressione lineare e calcolato il coegfficiente di correlazione per analizzare il rapporto fra Elastanza Ventricolare di Fine eiezione e CI, Es e Frazione di eiezione
19
Risultati
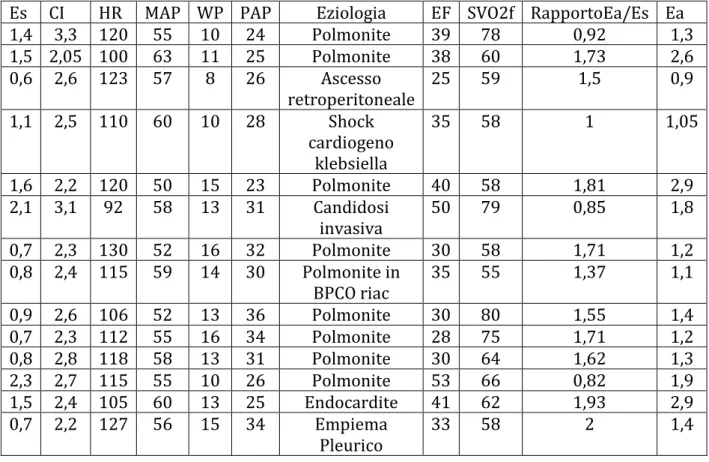
Sono stati reclutati 14 pazienti con shock settico con età media di 67± 13. L’eziologia della sepsi è indicata nella tabella . I pazienti presentavano globalmente una riduzione della Frazione di eiezione al momento della diagnosi di shock settico con una media di 36±8,04 ma un Cardiac Index sempre maggiore di 2 ( media 2,5±0,3) e una frequenza media di 113±10
Tabella 1 Dati ricavati per dallo studio emodinamico dei pazienti in shock settico
Es CI HR MAP WP PAP Eziologia EF SVO2f RapportoEa/Es Ea
1,4 3,3 120 55 10 24 Polmonite 39 78 0,92 1,3 1,5 2,05 100 63 11 25 Polmonite 38 60 1,73 2,6 0,6 2,6 123 57 8 26 Ascesso retroperitoneale 25 59 1,5 0,9 1,1 2,5 110 60 10 28 Shock cardiogeno klebsiella 35 58 1 1,05 1,6 2,2 120 50 15 23 Polmonite 40 58 1,81 2,9 2,1 3,1 92 58 13 31 Candidosi invasiva 50 79 0,85 1,8 0,7 2,3 130 52 16 32 Polmonite 30 58 1,71 1,2 0,8 2,4 115 59 14 30 Polmonite in BPCO riac 35 55 1,37 1,1 0,9 2,6 106 52 13 36 Polmonite 30 80 1,55 1,4 0,7 2,3 112 55 16 34 Polmonite 28 75 1,71 1,2 0,8 2,8 118 58 13 31 Polmonite 30 64 1,62 1,3 2,3 2,7 115 55 10 26 Polmonite 53 66 0,82 1,9 1,5 2,4 105 60 13 25 Endocardite 41 62 1,93 2,9 0,7 2,2 127 56 15 34 Empiema Pleurico 33 58 2 1,4
20
Soltanto 4 pazienti su 14 hanno mostrato un accoppiamento ventricolo-arterioso conservato (Ea/Es<=1). Al contrario 10/14 presentavano un rapporto di Ea/Es >1,4 . (Fig10)
0,5 0,6 0,8 0,9 1,1 1,2 1,4 1,5 1,6 1,8 1,9 2,1 2,2 2,4 2,5 0 1 2 3 Rapporto_Elastanze Ea/Es F re q u e n c
y Figura 10 Distribuzione dell’accoppiamento
21
Dividendo i pazienti in due gruppi : Ea/Es<=1 e >1 sono emersi i seguenti risultati:
1-Non si è rilevata differenza fra l’elastanza arteriosa (p=0,55), frequenza cardiaca (p=0,49) fra pazienti con accoppiamento ventricolo-arterioso conservato e pazienti “disaccoppiati”
2- I pazienti con accoppiamento ventricolo arterioso conservato avevano una Es (P=0,04), Cardiac index (p=0,02) e frazione d’eiezione più alta rispetto ai pazienti con Ea/Es>1 (p=0,01) (Fig 11)
3- I pazienti con Ea/Es<1 presentavano una SV02 periferica più bassa rispetto a quelli con accoppiamento conservato (p=0,06) (Fig 12)
30 35 40 45 50 55 EF Rapporto_Ea_Es<1 EF Rapporto_Ea_Es>1 2,2 2,4 2,6 2,8 3,0 3,2 3,4 CI Rapporto_Ea_Es<1 CI Rapporto_Ea_Es>1 55 60 65 70 75 80 SVO2f Rapporto_Ea_Es<1 SVO2f Rapporto_Ea_Es>1
Figura 11 Differenza dellla Frazione d’eiezione nei pazienti con accoppiamento ventricolo-arterioso conservato e disaccoppiati
Figura12 Differenza dell’ SVO2 centrale tra pazienti con accoppiamento conservato e non
22
Si è evidenziata inoltre una correlazione lineare fra Elastanza ventricolare e frazione di eiezione (P=0,001 R=0,89) , non presente invece per il cardiac index. (P=0,25) 0,5 1,0 1,5 2,0 2,5 25 30 35 40 45 50 55 Es E F 0,5 1,0 1,5 2,0 2,5 2,0 2,2 2,4 2,6 2,8 3,0 3,2 3,4 Es C I
Figura 13 Correlazione lineare fra Elastanza ventricolare di fine eiezione (Es) e Frazione d’eiezione (EF) e Cardiac Index(CI)
23
Conclusioni
Lo studio effettuato evidenzia come la maggior parte dei pazienti analizzati presenta un importante disaccoppiamento ventricolo arterioso alla diagnosi di shock settico. Nei nostri pazienti tale disaccoppiamento ventricolo-arterioso è determinato dalla riduzione della performance miocardica (riduzione della contrattilità) e non dall’aumento dall’elastanza arteriosa . I pazienti disaccoppiati presentano inoltre una riduzione della SVO2 rispetto ai pazienti con accoppiamento ventricolo arterioso conservato. L’alterazione della SVO2 è il risultato della alterazione della performance cardiaca che presentano i pazienti disaccoppiati, generato da un impairment della Frazione d’eiezione e Cardiac Output. La riduzione della portata determina una riduzione della DO2 perferica e un aumento secondario dell’estrazione d’ossigeno
L’insieme dei dati suggerisce che lo studio emodinamico ed in particolare dell’accoppiamento ventricolo-arterioso e della performance miocardica dei pazienti con shock settico può essere uno strumento terapeutico
importante. Nel disaccoppiamento ventricolo-arterioso il sistema
cardiocircolatorio risulta inefficente e le terapie utilizzate devono avere come obiettivo non solo quello di garantire una perfusione periferica adeguata ma il tentativo di riportare l’apparato cardiovascolare verso l’efficienza e il lavoro cardiaco verso condizioni più fisiologiche. In particolare il monitoraggio dell’accoppiamento ventricolo-arterioso può modificare l’utilizzo di farmaci vasoattivi nello shock settico. Ad esempio l’utilizzo singolo della noradrenalina ad alti dosaggi permette di mantenere una pressione media adeguata ma porta ad un aumento dell’elastanza arteriosa a scapito dell’accoppiamento ventricolo-arterioso e della performance ventricolare . In questo senso un utilizzo precoce di farmaci inodilatatori come levosimendan e inibitori delle fosfodiesterasi in
24
condizioni di ridotta elastanza ventricolare (Es) e alta elastanza arteriosa indotta(Ea) possono garantire sia l’accoppiamento ventricolo arterioso chee una buona perfusione periferica con un dispendio minore energetico globale del sistema cardio-vascolare.
Infine L’evidenza che esiste una correlazione lineare fra la Frazione di Eiezione e L’elastanza ventricolare di fine eiezione suggerisce che nelle condizioni patologiche di Bassa Elastanza arteriosa la frazione di eiezione assume un ruolo importante come indice puro di contrattilità.
25
Bibliografia
1-Mueller-Werdan U, Reithmann C, Werdan K. Cytokines and theHeart: Molecular Mechanisms of Septic Cardiomyopathy. Berlin: Springer-Verlag, 1996.
2-Müller-Werdan U, Schumann H, Loppnow H, et al. Endotoxin and tumor necrosis factor alpha exert a similar proinflammatory effect in neonatal rat cardiomyocytes, but have different cardiodepressant
profiles. J Mol Cell Cardiol 1998;30:1027-36.
3Parrillo JE, Burch C, Shelhamer JH, Parker MM, Natanson C, Schuette W: A circulating myocardial depressant substance in humans with septic shock. Septic shock patients with a reduced ejection fraction have a circulating factor that depresses in vitro myocardial cell performance. J Clin Invest 1985, 76: 1539-1553.
4Kumar A, et al. (1996) Tumor necrosis factor alpha and interleukin 1beta are responsible for in vitro
myocardial cell depression induced by human septic shock serum. J. Exp. Med. 183:949–58. 5Finkel MS, et al. (1992) Negative inotropic effects of cytokines on the heart mediated by nitric oxide. Science 257:387–9.
Niederbichler AD, et al. (2006) An essential role for complement C5a in the pathogenesis of septic cardiac dysfunction. J. Exp. Med. 203:53–61.
6 Parker MM, McCarthy KE, Ognibene FP, Parrillo JE: Right ventricular dysfunction and dilatation, similar to left ventricular changes, characterize the cardiac depression of septic shock in humans. Chest 1990, 97: 126-131
7 Suffredini A, Fromm RE, Parker MM, Brenner M, Kovacs JA, Wesley RA, Parrillo JE: The cardiovascular response of normal humans to the administration of endotoxin. N Engl J Med 1989, 321: 280-287.
8Sunagawa K, Maughan WL, Burkhoff D, Sagawa K. Left ventricular interaction with arterial
load studied in isolated canine ventricle.Am J Physiol. 1983 Nov;245(5 Pt 1):H773-80.
Sunagawa K, Maughan WL, Sagawa K. Optimal arterial resistance for the maximal stroke work studied in isolated canine left ventricle. Circ Res. 1985 Apr;56(4):586-95.
9Beanlands RS, Bach DS, Raylman R, Armstrong WF, Wilson V, Montieth M, Moore CK, Bates
E, Schwaiger M.Acute effects of dobutamine on myocardial oxygen consumption and cardiac efficiency measured using carbon-11 acetate kinetics in patients with dilated
cardiomyopathy. J Am Coll Cardiol. 1993 Nov 1;22(5):1389-98.
10Martin RS, Norris PR, Kilgo PD, Miller PR, Hoth JJ, Meredith JW, Chang MC, Morris JA
Jr.Validation of stroke work and ventricular arterial coupling as markers of cardiovascular performance during resuscitation. J Trauma. 2006 May;60(5):930-4; discussion 934-5.
26
11Goto Y, Futaki S, Kawaguchi O, Hata K, Takasago T, Saeki A, Nishioka T, Suga H. Left ventricular contractility and energetic cost in disease models--an approach from the pressure-volume diagram. Jpn Circ J. 1992 Jul;56(7):716-21.
12 Prabhu SD. Altered left
ventricular-arterial coupling precedes pump dysfunction in early heart failure. Heart Vessels. 2007 May;22(3):170-7. Epub 2007 May 21.
13Ishihara H, Yokota M, Sobue T, Saito H.
Relation between ventriculoarterial coupling and myocardial energetics in patients with idiopathic dilated cardiomyopathy. J Am Coll Cardiol. 1994 Feb;23(2):406-16.
14Kameyama T, Asanoi H, Ishizaka S, Yamanishi K, Fujita M, Sasayama S. Energy conversion
efficiency in human left ventricle. Circulation. 1992 Mar;85(3):988-96.
15Takeuchi M, Igarashi Y, Tomimoto S, Odake M, Hayashi T, Tsukamoto T, Hata K, Takaoka
H, Fukuzaki H. Single-beat estimation of the slope of the end-systolic pressure-volume relation in the human left ventricle.Circulation. 1991 Jan;83(1):202-12.
16Chen CH, Fetics B, Nevo E, Rochitte CE, Chiou KR, Ding PA, Kawaguchi M, Kass
DANoninvasive single-beat determination of left ventricular end-systolic elastance in humans. J Am Coll Cardiol. 2001 Dec;38(7):2028-34.
17Kass DA, Yamazaki T, Burkhoff D, Maughan WL, Sagawa
K.Determination of left ventricular end-systolic pressure-volume relationships by the conductance(volume) catheter technique. Circulation. 1986 Mar;73(3):586-95. 18 Flierl MA, Rittirsch D, Huber-Lang MS, Sarma JV, Ward PA.Molecular events in the
cardiomyopathy of sepsis. Mol Med. 2008 May-Jun;14(5-6):327-36.