Comunicazione presentata all’adunanza del 20 aprile 2012
Assistenza respiratoria artificiale per il trattamento dell’insufficienza
respiratoria acuta nei pazienti oncoematologici pediatrici –
Esperienza di quattro anni
Roberta Puce, Livio Carnevale, Giorgio Iotti
Clinica di Anestesia e Rianimazione II, Università degli Studi di Pavia, Fondazione IRCCS Policlinico San Matteo, Pavia, Italia
Assistenza respiratoria artificiale per il trattamento dell’insufficienza respiratoria acuta nei pazienti oncoe-matologici pdiatrici – Esperienza di quattro anni
Questo studio analizza l’outcome dei bambini e degli adolescenti con malattie oncoematologiche, che sono stati ricoverati nei reparti di Oncoematologia Pediatrica e/o di Anestesia e Rianimazione e che hanno presentato uno o più episodi di insufficienza respiratoria acuta (IRA) con necessità di assistenza respiratoria artificiale. Inoltre, esso valuta la presenza di eventuali variabili che possano influenzare la mortalità di questi pazienti con particola-re riferimento alla tipologia del trattamento particola-respiratorio utilizzato. È stata condotta un’analisi particola-retrospettiva dei dati relativi ai pazienti ricoverati dal 2007 al 2010 nei reparti di Anestesia e Rianimazione ed Oncoematologia Pediatrica della Fondazione IRCCS Policlinico San Matteo di Pavia. Nello studio sono stati inclusi 43 bambini, che successivamente sono stati suddivisi in tre gruppi, a seconda del reparto in cui è stata trattata la loro patolo-gia respiratoria. Dei pazienti di ciascun gruppo sono state analizzate le variabili demografiche, alcune caratteri-stiche della malattia di base e del suo trattamento, dell’insufficienza respiratoria e dell’assistenza respiratoria artificiale fornita. La mortalità generale è risultata del 69.77%. Il tasso di mortalità nei singoli gruppi, invece, è risultato del 55.5% nel primo, del 70.4% nel secondo e dell’ 85.7% nel terzo gruppo. L’associazione tra mortali-tà ed emortali-tà (p=0.0037) e tra mortalimortali-tà e complicanze ematologiche (p=0.045) è risultata statisticamente significati-va. Inoltre, sono emersi altri fattori in grado di influenzare la prognosi, tra cui la diagnosi di leucemia non linfo-blastica acuta (LnLA), la comparsa di più di una recidiva della malattia di base, la necessità di più trapianti, il BMT (Bone Marrow Transplant) da un donatore non consanguineo, l’infusione di cellule staminali emopoietiche provenienti dal sangue cordonale, l’insorgenza di altre complicanze diverse dall’IRA, l’esordio dell’IRA durante il mid recovery del periodo post-trapianto, l’emorragia alveolare e l’Acute Respiratory Distress Syndrome (ARDS) come cause dell’IRA, la necessità di ricorrere a trattamenti invasivi come Ventilazione Meccanica (VM) ed Extra Corporeal Membrane Oxygenation (ECMO). I risultati ottenuti ci hanno permesso di concludere che l’outcome dei bambini con malattie oncoematologiche che sviluppano insufficienza respiratoria risulta in-fluenzato da diverse variabili ed è poco favorevole. Tuttavia, un’assistenza respiratoria iniziata precocemente e in modalità non invasiva può essere associate ad una prognosi migliore.
Artificial and respiratory assistance for the treatment of acute respiratory insufficiency in oncohaematological pediatric patients – Four years experience
This study analyzes the outcome of children and adolescents affected by oncohaematological diseases, who were admitted in pediatric oncohaematological and/or intensive therapy wards and presented one or more episodes of acute respiratory failure (ARF) needing artificial respiratory assistance. It, moreover, investigates the presence of any variables that can influence mortality in these patients with particular attention to the kind of respiratory therapy used. We made a retrospective analysis of data on patients admitted from 2007 to 2010 and admitted to intensive therapy and oncohaematological pediatric wards of IRCCS Policlinico San Matteo Foundation in Pa-via. 43 children were included in this study and they were divided in three groups, related to the place where ARF was treated. Demographic variables, characteristics of oncohaematological disease and of its treatment, of ARF and of the given respiratory assistance were analyzed for each group. The overall mortality rate was 69.77%. Instead, it was 55.5% in the first group of patients, 70.4% in the second and 85.7% in the third one. The relations between younger age (p= 0.0037) and mortality, haematological complications (p=0.045) and mortality were statistically significant. Other factors influencing negatively the prognosis were diagnosis of acute non linfoblastic leucemia (LnLA), the onset of more than one recurrence of the disease, more than a transplant, re-ceiving a cordon stem cell infusion, a bone marrow transplant from an unrelated donor, the onset of non-respiratory complications, the onset of IRA during the mid recovery, an alveolar hemorrhage and the Acute Res-piratory Distress Syndrome (ARDS) as causes of IRA, the need of an invasive treatment like Mechanical Venti-lation (VM) end Extra Corporeal Membrane Oxygenation (ECMO). These results allow us to deduce that out-come on paediatric oncohaematological patients is influenced by many factors and is unsatisfactory. However, a non-invasive and early applied respiratory therapy can be associated with a better outcome.
Introduzione
Le patologie oncoematologiche spesso comportano l’insorgenza di complicanze (Tabelle 1 e 2) che possono rendere le persone da esse affette dei malati estremamente critici. Infatti, quasi il 40% dei bambini con tumore e in trattamento con farmaci citostatici o con trapianto necessita di cure intensive, rendendo conto di circa il 3% di tutti i ricoveri in una rianimazione [1-2]. Storicamente in questi bam-bini i margini di successo degli interventi intensivi, in particolare dell’assistenza respiratoria artificia-le, sono sempre stati considerati scarsi. Studi recenti, tuttavia, dimostrano che la diagnosi di malattia oncoematolgica non esclude i potenziali benefici che possono derivare da un trattamento intensivo, quando questo viene adeguatamente intrapreso. Ancora oggi, però, le casistiche relative all’outcome e ai suoi determinanti riportano dati non sempre in completo accordo fra loro.
Scopo del lavoro
Il nostro studio si propone primariamente di analizzare, in modo retrospettivo, l’outcome dei bambini e degli adolescenti con malattie oncoematologiche, che sono stati ricoverati nei reparti di Oncoemato-logia Pediatrica e/o di Anestesia e Rianimazione e che hanno presentato uno o più episodi di insuffi-cienza respiratoria acuta con necessità di assistenza respiratoria artificiale. L’obiettivo secondario è quello di indagare la presenza di eventuali variabili che possano influenzare la mortalità di questi pa-zienti con particolare riferimento alla tipologia del trattamento respiratorio utilizzato.
Materiali e metodi
Nel reparto di Oncoematologia Pediatrica della Fondazione IRCCS Policlinico San Matteo di Pavia, nel periodo di tempo compreso tra il 2007 e il 2010, sono stati effettuati 1427 ricoveri, duranti i quali 250 bambini hanno ricevuto un trapianto di midollo e una minoranza, purtroppo non numericamente definibile, è stata trattata esclusivamente con chemioterapia. Fra tutti questi pazienti, 46 hanno svilup-pato uno o più episodi di insufficienza respiratoria acuta che ha richiesto un supporto artificiale. In questo studio sono stati analizzati in modo retrospettivo i dati relativi a 43 di questi pazienti. Tre pa-zienti sono stati esclusi perché non è stato possibile consultare le cartelle cliniche.
I bambini inclusi nello studio sono stati suddivisi in tre gruppi, a seconda del luogo in cui è stata tratta-ta la loro patologia respiratoria. Al primo gruppo sono stratta-tati assegnati i pazienti che sono stratta-tati curati in Pediatria e che quindi hanno avuto bisogno soltanto di ossigenoterapia o di Continuous Positive Air-way Pressure (CPAP), al secondo i bambini con IRA trattata sia in Pediatria che in Rianimazione e al terzo gruppo i pazienti trattati soltanto in Rianimazione.
Per poter raggiungere gli obiettivi di questo studio sono state consultate le cartelle cliniche del reparto di Oncoematologia Pediatrica e delle Rianimazioni I e II, dalle quali sono stati estrapolati numerosi dati. Prima di tutto si è valutato se il bambino è deceduto o no, al fine di definire l’outcome dei singoli gruppi. Allo scopo di capire se per quest’ultimo esistono dei fattori prognostici, sono stati, invece, pre-si in conpre-siderazione elementi anagrafici, relativi alla malattia di base e alla complicanza respiratoria sviluppata. Per ogni bambino, quindi, sono stati ricercati e annotati i parametri di seguito riportati:
• età e sesso;
• diagnosi oncoematologica;
• numero di recidive che la malattia di base ha presentato;
• eventuale trattamento per la malattia di base e se quest’ultimo è consistito in una chemioterapia o in un trapianto;
• familiarità e il grado di compatibilità degli human leukocyte antigen (HLA) tra donatore e ricevente; • sorgente delle cellule staminali emopoieitiche;
• eventuale infusione del fattore stimolante la crescita dei granulociti neutrofili (G-CSF) nei pazienti trattati;
• presenza di neutropenia al momento dell’insorgenza dell’insufficienza respiratoria; • complicanze non polmonari associate alla malattia di base e al suo trattamento;
• momento d’insorgenza dell’IRA. Si è fatta una distinzione tra il periodo di preparazione al trapianto (fase di condizionamento prtrapianto), il post trapianto (a sua volta suddiviso in e-arly-recovery, mid-recovery e late-recovery), le diverse fasi di un ciclo di chemioterapia (fase di induzione, di remissione, di consolidamento e di mantenimento) ed assenza di trattamento per coloro che non ricevono una cura specifica per la malattia di base;
• cause diverse d’insufficienza respiratoria;
• tipo di assistenza respiratoria di cui il bambino ha avuto bisogno (ossigenoterapia, CPAP, Non Invasive Ventilation (NIV), VM ed ECMO);
• durata di ciascuno dei suddetti trattamenti (espressa in ore);
• valori di pH, pressione parziale di ossigeno (paO2), pressione parziale di anidride carbonica (paCO2) del sangue arterioso, la frequenza respiratoria (FR), e la saturazione al dito (SpO2); • durata dei ricoveri nei singoli reparti (espressa in giorni);
• valore del PRISM (Pediatric Risk Score for Mortality) e dell’ O-PRISM (Oncology Risk Score for Mortality);
• cause del decesso, distinguendole tra non respiratorie, soltanto respiratorie, respiratorie insie-me ad altre, ed insufficienza multiorgano (MOF).
Una volta ottenuti tutti i dati desiderati, si è valutata la distribuzione delle variabili in funzione del luogo, si è potuta stabilire la mortalità intraospedaliera di questa popolazione e dei suoi diversi gruppi e sottogruppi, e si è cercato di definire l’esistenza di una relazione statisticamente significativa tra le variabili precedentemente esposte e gli outcome osservati.
Risultati
Suddividendo la popolazione in esame in funzione della sopravvivenza e analizzando separatamente il gruppo dei bambini deceduti e quello dei pazienti ancora in vita si ottengono i seguenti risultati:
• Dati relativi ai pazienti deceduti
I bambini deceduti sono più piccoli dei non deceduti (Figura 1). La malattia più frequente nei pazienti trattati solo in Rianimazione e in Pediatria e Rianimazione è la leucemia linfatica acu-ta (LLA), che interessa rispettivamente il 47.36% e il 100% dei pazienti. Nel primo gruppo, invece, sono le leucemie non linfoblastiche a prevalere, essendo diagnosticate in tre casi su cinque (Figura 2). Il numero dei deceduti che presenta una ripresa di malattia è superiore a quello dei casi che non recidivano nei pazienti trattati in Rianimazione e nel secondo gruppo. Al contrario, senza recidiva è il 60% delle malattie dei pazienti deceduti del primo gruppo (3 su 5). Otto dei 19 casi recidivati hanno ripresentato la malattia per più di una volta. Questa complicanza è risultata rara nel primo e nel terzo gruppo, nei quali ha interessato un unico pa-ziente, e più frequente nel secondo, in cui ha coinvolto sei bambini. Per quanto riguarda le te-rapie della malattia di base, il trapianto è il tipo di trattamento più utilizzato: si parla di venti-due casi su trenta, di cui in 3 (1 del primo e 2 del secondo gruppo) vengono eseguite venti-due o più infusioni di cellule staminali emopoietiche (CSE). I restanti pazienti, tutti del secondo e terzo gruppo, eseguono il ciclo chemioterapico previsto per la loro malattia di base. Il trapianto fa-miliare aploidentico è quello eseguito più frequentemente (8 casi, di cui 7 nel secondo e 1 nel primo, con nessun caso nell’ultimo gruppo). La seconda tipologia di trapianto più utilizzata è l’infusione di CSE provenienti da donatore non relato, interessando tutti e tre i bambini del terzo gruppo (ossia il 100% dei casi), il 60% (4 bambini) e 28.57% (3 bambini) degli altri due (Figura 3). In nove casi (1 del primo e 8 del secondo gruppo) sono state infuse cellule prove-nienti dal sangue periferico. Sette, invece, sono stati i trapianti di cellule midollari, di cui 5 ef-fettuati nel secondo gruppo. Il sangue cordonale è stato utilizzato come fonte di CSE per 2, 1 e 3 dei bambini rispettivamente dell’ultimo, secondo e primo gruppo. Per quanto riguarda le conseguenze della malattia e del suo trattamento si può osservare che la neutropenia interessa 3 casi su 5 nel primo gruppo, 16 nel secondo e tutti i pazienti del terzo gruppo. Tra le altera-zioni di organi ed apparati quelle più frequenti sono le renali ed urologiche nel primo gruppo, le ematologiche nel secondo e la sepsi e lo shock settico ed ipovolemico nel terzo. Seconde per importanza sono le alterazioni ematologiche nel primo, nel secondo le cardiovascolari, e nell’ultimo gruppo rash cutanei, alterazioni metaboliche e degli elettroliti, che fanno parte del gruppo altro. Nessun caso di sepsi o shock si è verificato nei deceduti che erano curati in On-coematologia Pediatrica; al contrario, tutti i pazienti del terzo gruppo e il 50% del secondo con questa complicazione muoiono. La Graft versus Host Disease (GvHD) interessa il 23% dei deceduti, suddiviso in due casi nel primo gruppo, quattro nel secondo e uno nel terzo (Figura
4). Le complicanze polmonari esordiscono più frequentemente nel periodo del post-trapianto nei primi due gruppi, nell’ultimo invece sono più frequenti nel corso della fase di induzione del trattamento chemioterapico. In particolare, nel primo gruppo l’IRA si presenta nel 40% dei casi durante la fase iniziale di ripresa post trapianto (early recovery), in un altro 40% durante la fase di mezzo (mid recovery) e il restante 20% nella fase più tardiva (late recovery). Dei bambini trattati in Pediatria e Rianimazione 7 su 11 presentano complicanze nell’early reco-very e 4 nel mid. Nel terzo gruppo un solo paziente presenta complicanze nel late recoreco-very (Figura 5). Le cause d’insufficienza respiratoria meno frequenti sono le alterazioni neurologi-che e le patologie emorragineurologi-che polmonari, con soli 1 e 3 casi rispettivamente e tutti nel secon-do gruppo di pazienti. Per prime invece si collocano l’edema polmonare e l’ARDS nei bambi-ni dell’Oncoematologia Pediatrica, le polmobambi-niti e le patologie che rientrano nel gruppo altro nel secondo, le complicanze cardiache nel terzo gruppo (Figura 6). L’IRA è stata trattata in 28 bambini con l’ossigenoterapia. Infatti soltanto due pazienti del terzo gruppo vengono subito curati con CPAP o intubati. La CPAP è il secondo trattamento più utilizzato con una frequen-za di 4 casi nel primo gruppo, 15 nel secondo e 2 nel terzo. La ventilazione meccanica control-lata è terza per frequenza (11 casi nel secondo e 4 nel terzo), mentre la non invasiva è stata uti-lizzata soltanto in 5 bambini del secondo e 1 del terzo (Figura 7). Le variabili quantitative ri-cercate hanno mostrato un trend sovrapponibile a quello della popolazione generale: anche in questo sottoinsieme di pazienti e per tutti i tre gruppi presi in esame, i valori di saturazione al dito, pH, paO2 e frequenza respiratoria medi sono diminuiti al termine del trattamento e la
pa-CO2 finale media è superiore all’iniziale. La durata dei trattamenti è di 42, 75 e 65.5 ore per
l’ossigenoterapia, 46, 63 e 4 ore per la CPAP rispettivamente nel primo, secondo e terzo grup-po. La NIV è utilizzata per 6 e 136 ore negli ultimi due gruppi, in cui la VMC è impiegata per 120 e 23 ore. I valori medi di O-PRISM dei pazienti del secondo e terzo gruppo sono risultati rispettivamente pari a 11, 167 e 21, mentre quelli di PRISM uguali a 8.8 e 13.
• Dati relativi alla popolazione in vita
Hanno presentato un buon outcome soltanto 13 bambini, di cui 8 all’interno del secondo grup-po (29.63%), 4 nel primo (44.44%) e uno solo nel terzo (14.29%). Durante i loro ricoveri sette pazienti, 3 dei quali del primo gruppo, 3 del secondo, uno dell’ultimo hanno effettuato un tra-pianto, ed un solo bambino ha ricevuto tre trapianti. Tre, invece, sono stati curati con la che-mioterapia, di cui soltanto uno nel primo gruppo, e due non hanno ricevuto alcun tipo di trat-tamento prima di sviluppare un’insufficienza respiratoria. La tipologia di trapianto più utiliz-zata ha previsto l’utilizzo di cellule staminali del sangue periferico da donatore familiare a-ploidentico, mentre quelle donate da una persona non relata sono state impiegate nell’unico paziente del terzo gruppo e in uno solo del secondo. Il G-CSF è stato aggiunto al trattamento di nove bambini, nessuno dei quali facente parte del terzo gruppo. Prevalentemente durante il late (4 casi, di cui 3 nel secondo e uno nel terzo) e il mid recovery di tali trapianti, tutti questi bambini hanno sviluppato uno o più episodi di insufficienza respiratoria. Invece, i tre riceventi farmaci antineoplastici hanno presentato tale complicanza durante la fase di induzione. Le polmoniti sono la causa più frequente di IRA (8 bambini) e si presentano equamente divise tra il primo e il secondo gruppo. Ad esse seguono due casi di edema polmonare, due di stato di male epilettico e due di shock settico da E. Coli. Per tali complicanze tutti i bambini del primo gruppo e dell’ultimo sono stati trattati con ossigenoterapia e CPAP. La ventilazione meccanica invasiva è stata utilizzata soltanto nel secondo gruppo (5 casi),mentre la non invasiva viene eseguita da due pazienti del secondo gruppo e da uno del primo. Ossigenoterapia e CPAP sono state più a lungo utilizzate in Pediatria, dove la durata media di entrambi i trattamenti è stata di
256 e 92.5 ore rispettivamente. la NIV, al contrario, è stata impiegata per poco più di un gior-no. Come dimostrato dai valori delle emogasanalisi, delle saturazioni e della frequenza respirato-ria, tutte queste tecniche di supporto respiratorio hanno consentito il trattamento dell’IRA in questo gruppo di bambini, in cui la leucemia linfatica acuta è la malattia più frequente, interes-sando 6 pazienti divisi tra il primo e il secondo gruppo, seguita da: linfomi (due casi nel secondo e uno nel terzo gruppo), tumori solidi (due casi), patologie non neoplastiche e leucemie non lin-foblastiche (un caso ciascuno). Tutte queste malattie hanno dato una recidiva in sette casi, più frequentemente nel primo e nel secondo gruppo (tre casi per gruppo), mentre un solo caso di LLA, appartenente al primo gruppo, si è ripresentato per due volte. Inoltre, il loro decorso è stato complicato da disturbi gastroenterici, i più frequenti (otto casi in totale), cardiovascolari (7 casi), nefro-urologici (6 casi), neurologici, mucositi, faringiti, micosi rinosinusali, patologie della cute, e meno spesso da alterazioni ematologiche (2 casi) e shock settico (solo tre casi) nei primi due gruppi, mentre nel paziente trattato in terapia intensiva le uniche complicanze presentate sono neurologiche e cardiovascolari. La GvHD ha interessato 3 pazienti, uno per gruppo, e si è mani-festata in forma cronica ed estesa negli ultimi due gruppi. Infine, l’ultimo dato da sottolineare su questo gruppo di pazienti è che le complicanze delle malattia e del trattamento, associate alle al-terazioni emogasanalitiche ed emodinamiche iniziali hanno determinato valori di O-PRISM pari a 14.67e 9 per i bambini trattati in Rianimazione e per quelli curati sia in terapia intensiva che in Pediatria e valori di PRISM pari a 9.5 per i pazienti del secondo gruppo.
Discussione
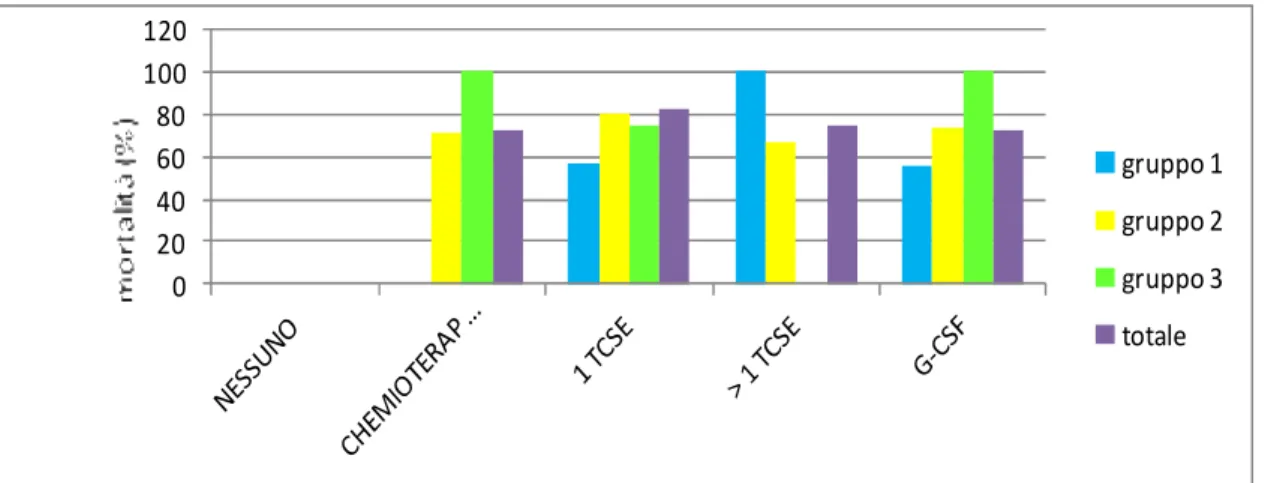
La comparsa di insufficienza respiratoria acuta nei pazienti con patologia oncoematologica sottoposti a trattamento farmacologico e/o a TCSE è un evento non particolarmente frequente ma nemmeno nu-mericamente trascurabile. Nella nostra piccola realtà, ad esempio, 30 dei 172 (17.44%) bambini tra-piantati hanno sviluppato un’IRA. Tale complicanza, qualora sia di livello tale da condizionare la necessità di impiego di un supporto respiratorio artificiale, è gravata da un outcome scadente. Infat-ti, nel nostro studio, la mortalità generale è risultata pari al 69.77% (30 bambini su 43). La mortalità riscontrata nei singoli gruppi è invece del 55.5% nei pazienti trattati solo in Pediatria (in cui sono deceduti 5 bambini), del 70.4% in quelli trattati sia in Rianimazione che in Pediatria (in cui si sono verificati 19 decessi) e dell’85.7% nel gruppo dei bambini curati soltanto in Rianimazione (dove sono deceduti 6 pazienti) (Figura 8). Sempre nel nostro studio il 73.53% (25 bambini) dei pazienti che necessitano del ricovero in un ambiente intensivo (34 bambini) muore. Tale percentuale è di poco superiore a quella (70.4%) riportata da Lamas e collaboratori in uno studio pubblicato nel 2002, ma è inferiore ai valori ritrovati in articoli non molto recenti, in cui sono stati indicati tassi di mortalità pari a 75-76%[1-2]. L’analisi della mortalità in funzione di diverse variabili, che è stata condotta nel nostro studio, ha permesso di stabilire che l’outcome di questi bambini può essere in-fluenzato negativamente da alcuni fattori. Uno di questi è l’età: muoiono più frequentemente i bam-bini più piccoli. Infatti, il gruppo dei deceduti e quello dei sopravvissuti presentano, rispettivamente, un’età media di 8.86 e 14.6 anni. La medesima correlazione è stata riscontrata da Tomaske [3], La-mas [4] e altri Autori [5-7], invece, hanno dimostrato l’esistenza di una significatività per i pazienti più grandi, mentre in altri articoli [2, 8-9] l’età non è un fattore prognostico significativo.
Per quanto riguarda il sesso si può osservare che esso non correla con la mortalità nella nostra ed in altre casistiche, nonostante i maschi di solito superino in numero le femmine in questo genere di studi [2, 8-9].
Soltanto Lamas [4] invece, ha dimostrato che nei maschi si verifica un maggior numero di decessi, mentre Gonzales-Vincent [10] ha riscontrato per gli uomini una maggiore probabilità di ricovero in Rianimazione. Le malattie oncoematologiche con la maggiore mortalità, tra quelle indagate in questo studio, sono le leucemie non linfoblastiche (8 casi su 9), seguite dalla leucemia linfatica acuta (16 su 22), dai linfomi (3 su 6) e dalle patologie del gruppo miscellanea (3 casi su 4), mentre tutti i pazienti affetti da tumore solido sono stati dimessi dalla Rianimazione o dall’Oncoematologia Pediatrica in buone condizioni di salute. I nostri dati sono sovrapponibili a quelli presenti in un articolo di Tamburro [11], che riporta una minore sopravvivenza per leucemie e linfomi rispetto a tumori solidi e malattie oncoematoligiche non maligne. Tassi di sopravvivenza superiori, invece, sono stati ritrovati in un recente studio, in cui la leucemia mieloide acuta e la linfoblastica sono state associate ad una morta-lità rispettivamente del 67% e del 30% [12]; mentre un maggior rischio di intubazione, e quindi di peggiore prognosi, è stato descritto da Warwick [13] nei bambini con disordini del metabolismo, neuroblastomi, immunodeficienze, e da Pancera [14] nei pazienti con tumori solidi.
I pazienti arruolati in questo studio mostrano una mortalità in presenza di recidiva (70.4%) sovrapponibile a quella complessiva, e solo un po’ più alta di quella dei bambini la cui malattia non si è ripresentata dopo il raggiungimento della remissione completa (68.7%). Tuttavia, a ben vedere, i pazienti con più di una recidi-va hanno una mortalità superiore a quella dei gruppi suddetti (88.8%). Inoltre non sopravvive nessun bam-bino con recidiva localizzata a livello del sistema nervoso centrale (SNC), combinata o extramidollare. Nel 1998 Ewig [15], dopo aver condotto analisi uni- e multi-variate in bambini con malignità oncoe-matologiche ed insufficienza respiratoria, ha affermato che in questi pazienti il trapianto è un fattore prognostico sfavorevole, statisticamente significativo, associato ad una mortalità del 90%. Nei pazienti trattati soltanto con cicli di chemioterapia, invece, lo stesso autore riporta una sopravvivenza del 38%. Anche i risultati del nostro studio permettono di osservare che l’outcome dei bambini oncoematologici è diverso in funzione del trattamento della malattia di base. Tuttavia, i nostri dati, pur statisticamente non significativi, sono in disaccordo con quelli di Ewig. Infatti abbiamo riscontrato che i due pazienti che non ricevono né il trapianto né la chemioterapia sopravvivono, mentre quando vengono utilizzati soltanto farmaci antineoplastici la mortalità è del 72.73%. Invece, nei bambini che vengono curati con infusione di cellule staminali emopoietiche, sono stati registrati 18 decessi e, quindi, una mortalità del 69.23%. Tale valore percentuale è ottenuto considerando tutti i pazienti trapiantati, indipendentemente dal numero dei trapianti effettuati. Va precisato, infatti, che è stata riscontrata una piccola differenza tra coloro che ricevono un’ infusione singola di CSE e coloro che ne ricevono due o più. Nel primo caso, infatti, la mortalità è di poco superiore al 69% (16 bambini su 23), mentre nel secondo si rag-giunge il 75% (3 decessi su 4). Per quanto riguarda la tipologia del rapporto donatore-ricevente, il tra-pianto da donatore non familiare presenta la minore percentuale di sopravvissuti ed una mortalità dell’83%. Ad esso seguono il trapianto aploidentico (8 decessi in 11 bambini, 72.73% di mortalità) ed il familiare identico (4 casi su 6). L’unico paziente che effettua un trapianto autologo, invece, soprav-vive. Anche la sorgente delle cellule staminali influenza la prognosi. Nel nostro studio, infatti, quest’ultima è peggiore per i bambini che sono stati trattati con infusione di cellule derivanti da san-gue cordonale (6 bambini su 7 muoiono). Nei pazienti sottoposti a trapianto di cellule midollari, inve-ce, la sopravvivenza è stata del 25% (6 decessi su 8 pazienti), mentre quando il trattamento prevede l’infusione di CSE del sangue periferico la mortalità è del 56.25% (9 decessi su 16 pazienti). Si può osservare, inoltre, come quest’ultima modalità di trapianto sia stata l’unica ad essere utilizzata in tutti i bambini trapiantati (7 casi) sopravvissuti. Tutti questi dati ci spingono, quindi, ad associare un miglior outcome al trapianto di cellule staminali derivanti da sangue periferico, sebbene tale relazione non ri-sulti confermata dalla nostra analisi statistica. Invece in letteratura è spesso riportato che il trapianto autologo determina una prognosi migliore rispetto a quello allogenico [16,17,18], dal momento che quest’ultimo prevede un regime mieloablativo più aggressivo e sembra contribuire ad un danno
pol-monare che si caratterizza per una patogenesi diversa rispetto a quella osservata in altri tipi di trapian-to [19]. Tomaske [3] in un suo studio ha riportatrapian-to una sopravvivenza del 100% nei pazienti autrapian-totra- autopiantati, sei decessi in 10 bambini riceventi un trapianto allogenico, 7 in 11 bambini riceventi un tra-pianto aploidentico ed una mortalità del 100% (2 casi su 2) per coloro che ricevono una donazione da un fratello o da una sorella. Inoltre, Hagen [20] ha dimostrato che l’utilizzo di cellule staminali deri-vanti da sangue cordonale determina, rispetto a quelle midollari, una sopravvivenza peggiore a breve termine ma sovrapponibile a distanza di due anni dal trapianto. Infine, Gruson [21] ha riportato che sopravvivono tutti i bambini con neoplasie ematologiche che vengono trattati con l’infusione di cellule staminali derivanti da sangue periferico e che presentano polmonite nel post-trapianto.
L’infusione del fattore stimolante la crescita dei granulociti neutrofili è associata, nella nostra casisti-ca, ad una mortalità del 72.22%, superiore a quella dei pazienti che non la ricevono (37%).
La contemporanea presenza di altre complicanze, oltre all’insufficienza respiratoria, peggiora la pro-gnosi dei nostri pazienti. Quest’ultima, inoltre, sembra variare in funzione del tipo di alterazione d’organo presente. Si può osservare che i bambini con il peggior outcome sono quelli che presentano disturbi ematologici: ne muoiono, infatti, 15 su 17 (88% di mortalità). Ad essi seguono i pazienti con malattie cardio-vascolari (18 decessi su 25 con mortalità del 72%), complicanze nefro-urologiche (mortalità pari a 71.4%), sepsi e shock (70% mortalità), disturbi gastroenterici (12 casi su 20 con il 60% di mortalità) ed alterazioni neurologiche (circa il 54% di mortalità con 7 morti su 13). Questi dati provano la nostra considerazione iniziale, che è inoltre confermata dalla diversa distribuzione che que-ste alterazioni presentano tra i pazienti deceduti ed i sopravvissuti. Si può osservare, infatti, che il maggior numero delle complicanze nel gruppo dei pazienti in vita è di tipo gastroenterico, a cui se-guono quelle neurologiche, nefrologiche e cardiovascolari. Rare, invece, (soltanto 2 casi) sono le complicanze ematologiche. Quest’ ultimo dato spiega il risultato fornito dall’analisi univariata, con-dotta in questo studio, che associa significativamente ad una maggiore mortalità soltanto le compli-canze ematologiche. In alcuni articoli relativi a bambini oncoematologici, ricoverati in Rianimazione, tali alterazioni si trovano, invece, associate spesso ad un’insufficienza epatica, cardiaca, renale, alla necessità di un trattamento dialitico, al bisogno di supporto inotropo, alla contemporanea presenza di più insufficienze d’organo (MOF) ed alla neutropenia[4, 9, 20, 22]. Quest’ultima, nei nostri bambini, comporta una mortalità del 73.53% che supera del 18% quella dei bambini con normale conta leucoci-taria. Nello studio retrospettivo di A. van Veen 7 dei 15 bambini (47%) con neutropenia muoiono [23]. Sivan e altri Autori invece dimostrano che la prognosi nei pazienti oncoematologici è tanto più severa quanto più bassa è la conta leucocitaria [24-25]. Questa proporzionalità inversa può essere in parte legata all’aumentato rischio infettivo, a cui questo tipo di immunodeficienza acquisita espone.
Un’altra importante complicanza è la GvHD. Infatti, quest’ultima è spesso presente nell’elenco dei fattori prognostici per lo sviluppo di patologie polmonari ed insufficienze d’organo, per l’ingresso in terapia intensiva e per un outcome non favorevole, soprattutto quando è acuta e di grado elevato (≥III) o cronica e disseminata [26]. In questo studio la mortalità dei bambini con GvHD è alta (70%, muoio-no 7 bambini su 10), ma sovrapponibile a quella dei pazienti in cui muoio-non si manifesta (69.7%). Imuoio-noltre, gli unici tre sopravvissuti da essa interessati, presentano una forma cronica estesa o una acuta di grado superiore al II. Quindi, al contrario di quanto atteso sulla base della letteratura, nella nostra casistica, la GvHD non correla in modo significativo con la prognosi. Tale differenza potrebbe essere attribuita al fatto che abbiamo ristretto il nostro studio ai pazienti che hanno almeno un’insufficienza d’organo (respiratoria). Quindi, i nostri risultati sembrerebbero escludere un’ influenza diretta della GvHD sull’outcome, mentre è possibile che i pazienti che presentano GvHD sviluppino più frequentemente insufficienze d’organo ed abbiano, per questo motivo, un outcome peggiore.
Per quanto riguarda le alterazioni respiratorie, il confronto tra i nostri dati e quelli forniti da un’analisi condotta su tutti i bambini trapiantati dal 2007 al 2010 a Pavia (Tabelle 3 e 4) permette di evidenziare
l’impatto negativo che l’insufficienza respiratoria acuta ha sull’outcome. Infatti, contrariamente a quanto da noi riportato, dall’indagine generale si evince che soltanto l’11% (27 dei 250) dei bambini trapiantati muore e che la loro mortalità in funzione dei diversi gruppi di malattia oncoematologica e delle diverse tipologie di trapianto è inferiore a quella da noi riscontrata.
I nostri dati, inoltre, hanno fatto emergere che la mortalità in presenza di insufficienza respiratoria è diversa in funzione dell’eziologia e del momento di insorgenza di quest’ultima. In particolare, si può notare che le patologie che correlano con la più alta mortalità sono le emorragie polmonari e l’ARDS (mortalità del 100% per entrambe le patologie), che infatti non si manifestano in nessuno dei bambini sopravvissuti. Ad esse seguono le complicanze polmonari legate ad una malattia cardiaca (sette morti su otto casi), l’edema polmonare non cardiogeno (con mortalità del 75%), la sepsi e i diversi tipi di shock (4 decessi su 6, con mortalità del 66.67%), le polmoniti (per cui muoiono 13 bambini su 21), ed infine le alterazioni neurologiche (per cui perde la vita un solo paziente su tre). In letteratura la morta-lità più alta è stata osservata in bambini con insufficienza respiratoria determinata da una patologia polmonare[4, 27]. In particolare la polmonite di eziologia infettiva si è dimostrata responsabile di un maggior numero di decessi rispetto a quella non infettiva [15]. Le malattie delle alte vie aeree [11], quelle cardiache [28], neurologiche [29] e le alterazioni emodinamiche, sono associate, invece, ad una maggiore sopravvivenza. Nel nostro studio l’insufficienza respiratoria esordisce nella maggior parte dei casi durante l’early recovery, come del resto già osservato da altri Autori [30-31]. Tuttavia le fasi durante le quali si osserva un peggiore outcome sono il mid recovery, con un paziente che sopravvive su 8 (87.5% di mortalità), l’early recovery, in cui vivono 3 bambini su 12 (mortalità 75%), la fase di induzione dei trattamenti chemioterapici, in cui muoiono 6 bambini su 9 (66.67%). L’unico paziente che sviluppa l’IRA durante la fase di consolidamento della chemioterapia ed i due che la manifestano nella fase di condizionamento pre-trapianto muoiono. La maggior parte dei so-pravvissuti, invece, presenta un’insufficienza respiratoria nel late recovery.
Se si considera l’associazione fra le diverse tecniche di trattamento dell’insufficienza respiratoria, uti-lizzate nei pazienti di questo studio, e la mortalità, si può osservare che muoiono tutti i bambini posti in ECMO, 15 dei 20 (75%) di coloro che eseguono VM, 6 dei 9 (66.67%) che vengono trattati con NIV, 21 dei 30 (70%) trattati con CPAP, 28 dei 41 (68.3%) che eseguono ossigenoterapia. Precedenti studi non presentano dati del tutto sovrapponibili a quest’ultimi. Innanzitutto in letteratura è già stato evidenziato come l’ECMO sia un importante strumento di supporto respiratorio in bambini con o sen-za neoplasie. Ad esempio sono stati descritti tre casi di bambini con massa mediastinica, legata a leu-cemie (in un solo paziente) [32] e linfomi (negli altri due) [33-34], che ha determinato un’insufficienza respiratoria trattata con successo grazie all’ECMO. Anche l’IRA insorta nel post-trapianto [19, 34] o nel corso del trattamento chemioterapico [35] sembra trarre beneficio dall’utilizzo di questa tecnica di assistenza respiratoria. Altrettanto efficaci sembrano i supporti ventilatori non in-vasivi. Squadrone dimostra che l’utilizzo precoce del sistema CPAP in un reparto oncoematologico non pediatrico migliora l’outcome dei pazienti [36]. Hilbert e collaboratori hanno trovato che la CPAP è efficace nel prevenire l’intubazione nel 25% dei pazienti con malattie oncoematologiche e neutrope-nia [37]. Il contrario, tuttavia, è stato osservato da Delclaux[38]. Anche per quanto riguarda la ventila-zione meccanica non invasiva non si riscontrano pareri univoci. Infatti l’efficacia di tale tecnica nel risolvere l’IRA e, contemporaneamente, ridurre il numero delle intubazioni e migliorare l’outcome, non è sempre dimostrata. Depuydt e altri, in due diversi studi [39-40], non riescono a verificare questi benefici. Antonelli [41] e Martin [42] al contrario, riportano la maggiore efficacia della NPPV rispetto all’ossigenoterapia. Invece, Piastra [43], Cogliati [44] ed Essouri [45] hanno dimostrato che la NIV è in grado di migliorare l’ossigenazione entro 2-3 ore dal suo inizio. Una simile conclusione è stata ri-portata anche negli adulti da Conti [46]. Un’analisi di Fortenberry dimostra un miglioramento di pa-O2, paCpa-O2, pH e frequenza respiratoria al termine del trattamento dell’IRA [47], mentre un altro
stu-dio condotto da Padman ha evidenziato la capacità della NIV di ridurre la frequenza cardiaca e la dis-pnea [48]. In questi ultimi due studi l’insuccesso della non invasiva, inteso come necessità di intuba-zione, si è verificato, rispettivamente, soltanto nel 10.7% e nell’8.8% dei pazienti. In altri articoli, in-vece, sono riportati valori di mortalità, associata alla NIV, variabili dal 22.5% al 56% [49]. Compresi tra il 40% e il 94% sono invece i tassi di mortalità ritrovati nei pazienti che vanno incontro ad intuba-zione [2, 4, 9, 13, 15-16, 20, 25, 50-53]. Numerose analisi hanno suggerito che nei pazienti sottoposti a VM la mortalità è più elevata per quelli che effettuano un trattamento di maggiore durata [8, 22, 54-55]. Tale associazione non è stata confermata da Jacobe e colleghi [53] e dal nostro studio in cui, ad esempio, la durata media della ventilazione controllata in tutti i bambini del secondo gruppo trattati con VM, ma poi deceduti, è inferiore a quella dei bambini sopravvissuti. Per quanto riguarda gli altri trattamenti, ossigenoterapia, CPAP e NIV vengono effettuati più a lungo nei pazienti sopravvissuti. Inoltre l’ossigenoterapia è utilizzata più frequentemente nei bambini del secondo gruppo, mentre la CPAP è meno impiegata nei pazienti del terzo gruppo, che, ricordiamo, sono quelli che presentano la prognosi peggiore. I valori emogasanalitici, di saturazione e frequenza respiratoria non mostrano so-stanziali differenze tra il gruppo dei deceduti e quello dei sopravvissuti, se non per i valori finali di saturazione arteriosa d’ossigeno e pH, che si dimostrano significativamente superiori nei bambini che terminano con successo il trattamento. Randle e collaboratori, invece, hanno dimostrato che nei bam-bini con leucemia acuta e polmonite l’incapacità di mantenere una saturazione pari o superiore al 95% rappresenta un criterio per identificare precocemente i pazienti a maggior rischio di sviluppare un’IRA severa, che necessita di supporto ventilatorio meccanico invasivo [56]. Oltre a questi parametri, altre misure di morbidità e mortalità, spesso utilizzate, sono gli indici di severità delle malattie (SDI, cioè Severity Disease Index). Gli SDI dal 1973, anno in cui è comparso il primo punteggio sistematico (il TISS, cioè il Therapeutic Intervention System Score), ad oggi hanno subito continue modifiche al fine di creare sistemi in grado di rispecchiare le caratteristiche dei diversi pazienti. Per questo, in seguito all’applicazione di score come l’APACHE I (Acute Physiology And Chronic Health Evaluation), II (Acute Physiology Age Chronic Health Evaluation) e III, il SAPS (Simplified Acute Physiology Score) I e II ai pazienti oncoematologici delle terapie intensive pediatriche, sono stati introdotti il PRISM (Pediatric Risk Score for Mortality) e, nel 2000, l’O-PRISM (Oncological Pediatric Risk Score for Mortality). Tra questi ultimi due score, il primo può essere applicato a tutti i bambini onco-logici, mentre il secondo è specifico per i bambini che ricevono un trapianto. Essi, infatti, sono stati appositamente ideati per poter identificare con la maggior certezza e la maggior precocità possibili quei pazienti ad alto rischio, che potrebbero beneficiare di forme di trattamento alternative. Il ruolo prognostico di questi sistemi di punteggio, che è stato osservato in diversi studi, non è dimostrato dalla nostra casistica, in cui l’associazione tra valori di O-PRISM o PRISM ed outcome non è risultata stati-sticamente significativa. Tuttavia, a ben vedere, un certo valore predittivo di tale score emerge anche dalla nostra analisi. Si può osservare, infatti, che il PRISM presenta un valore medio più alto nei bam-bini deceduti del terzo gruppo rispetto ai deceduti del secondo gruppo (13 contro 8.8), il quale, in ef-fetti, presenta una mortalità inferiore. Inoltre, il calcolo dell’O-PRISM ha dato risultati differenti tra i bambini deceduti e quelli sopravvissuti del terzo gruppo, presentando in questi ultimi valori minori.
Tabelle e figure
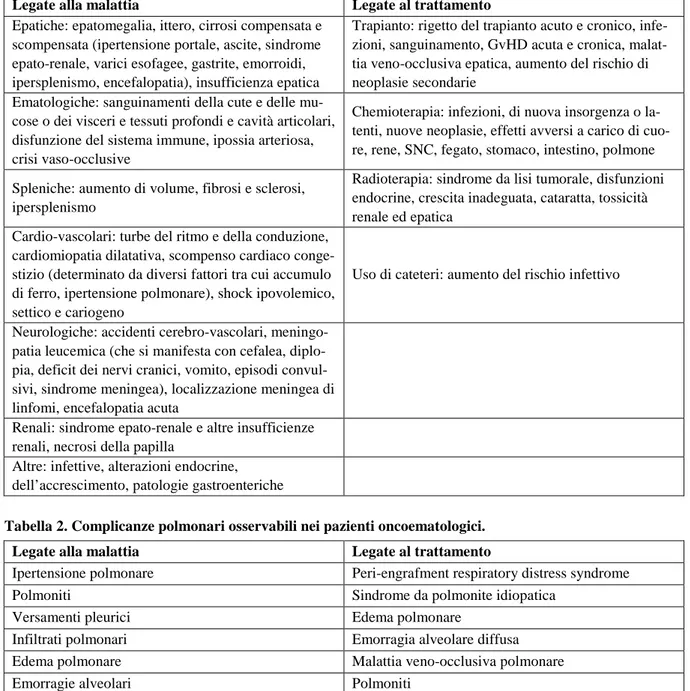
Tabella 1. Complicanze non polmonari osservabili nei pazienti oncoematologici.
Legate alla malattia Legate al trattamento
Epatiche: epatomegalia, ittero, cirrosi compensata e scompensata (ipertensione portale, ascite, sindrome epato-renale, varici esofagee, gastrite, emorroidi, ipersplenismo, encefalopatia), insufficienza epatica
Trapianto: rigetto del trapianto acuto e cronico, infe-zioni, sanguinamento, GvHD acuta e cronica, malat-tia veno-occlusiva epatica, aumento del rischio di neoplasie secondarie
Ematologiche: sanguinamenti della cute e delle mu-cose o dei visceri e tessuti profondi e cavità articolari, disfunzione del sistema immune, ipossia arteriosa, crisi vaso-occlusive
Chemioterapia: infezioni, di nuova insorgenza o la-tenti, nuove neoplasie, effetti avversi a carico di cuo-re, rene, SNC, fegato, stomaco, intestino, polmone Spleniche: aumento di volume, fibrosi e sclerosi,
ipersplenismo
Radioterapia: sindrome da lisi tumorale, disfunzioni endocrine, crescita inadeguata, cataratta, tossicità renale ed epatica
Cardio-vascolari: turbe del ritmo e della conduzione, cardiomiopatia dilatativa, scompenso cardiaco conge-stizio (determinato da diversi fattori tra cui accumulo di ferro, ipertensione polmonare), shock ipovolemico, settico e cariogeno
Uso di cateteri: aumento del rischio infettivo
Neurologiche: accidenti cerebro-vascolari, meningo-patia leucemica (che si manifesta con cefalea, diplo-pia, deficit dei nervi cranici, vomito, episodi convul-sivi, sindrome meningea), localizzazione meningea di linfomi, encefalopatia acuta
Renali: sindrome epato-renale e altre insufficienze renali, necrosi della papilla
Altre: infettive, alterazioni endocrine, dell’accrescimento, patologie gastroenteriche
Tabella 2. Complicanze polmonari osservabili nei pazienti oncoematologici.
Legate alla malattia Legate al trattamento
Ipertensione polmonare Peri-engrafment respiratory distress syndrome
Polmoniti Sindrome da polmonite idiopatica
Versamenti pleurici Edema polmonare
Infiltrati polmonari Emorragia alveolare diffusa
Edema polmonare Malattia veno-occlusiva polmonare
Emorragie alveolari Polmoniti
Sindrome toracica acuta Patologie restrittive (BO: bronchiolite obliterante ) Patologie ostruttive ( COP:polmonite organizzantesi criptogenetica)
Proteinosi alveolare secondaria Malattia linfoproliferativa cronica
Tabella 3. Mortalità in funzione della tipologia di trapianto relativa a tutti i 250 trapianti.
TIPOLOGIA DI TRAPIANTO N° DEI PAZIENTI DECEDUTI % DEI PAZIENTI DECEDUTI
Auologo 4 11
Fmiliare HLA compatibile 3 5
Non familiare HLA compatibile 14 7
HLA parzialmente compatibile 6 13
Tabella 4. Numero di trapianti effettuati per gruppi di malattie e rispettiva mortalità. N° DEI PAZIENTI TRAPIANTATI N° DEI PAZIENTI DECDUTI IN SEGUITO A TCSE % DEI PAZIENTI DECEDUTI IN SEGUITO A TCSE LLA 82 12 15 LnL 65 5 8 LINFOMI 14 2 14 TUMORI SOLIDI 11 1 9 ALTRO 78 7 9 TOTALE 250 27 11
Figura 1. Età media dei pazienti in funzione dell’outcome.
0 20 40 60 80 100 120
LLA LnL LINFOMI TUMORI
SOLIDI ALTRO gruppo 1 gruppo 2 gruppo 3 tot
0 20 40 60 80 100 120 gruppo 1 gruppo 2 gruppo 3 totale
Figura 3. Mortalità in funzione del trattamento della malattia oncoematologica.
0 20 40 60 80 100 120 gruppo 1 gruppo 2 gruppo 3 totale
Figura 4. Mortalità in funzione delle complicanze legate alla malattia oncoematologica.
0 20 40 60 80 100 120 gruppo 1 gruppo 2 gruppo 3 totale
0 20 40 60 80 100 120 gruppo 1 gruppo 2 gruppo 3 totale
Figura 6. Mortalità in funzione dell’eziologia dell’IRA.
Figura 7. Mortalità in funzione del trattamento dell’IRA.
55,50% 70,40% 85,70%
Mortalità
gruppo 1 gruppo 2 gruppo 3Bibliografia
1. Dalton HJ, Slonim AD, Pollack MM. Multicenter outcome of pediatric oncology patients requiring intensive care. Pediatric hematology oncology 2003;20:643-649.
2. Jackson SR, Tweeddale MG, Barnett MJ et al. Admission of bone marrow transplant recipients to the intensive care unit: outcome, survival and prognostic factors. Bone marrow transplantation 1998;21:697-704.
3. Tomaske M, Bosk Axel, Eyrich M et al. Risks of mortality in children admitted to the pediatric intensive care unit after haematopoietic stem cell transplantation. British Journal of hematology 2003;121:886-891.
4. Lamas A, Otheo E, Vazquez JL et al. Prognosis of child recipients of hematopoietic stem cell transplantation requiring intensive care. Neonatal and pediatric intensive care 2003;29:91-96.
5. Rubenfeld GD, Crawford SW. Withdrawing life support from mechanically ventilated recipients of bone marrow transplantats: a case for evidence based guidelines. Annals of internal medicine 1996;125:625-633.
6. Crawford SW, Petersen FB. Long-term survival from respiratory failure after bone marrow transplantation for malignancy. American review of respiratory disease 1992;145:510-514.
7. Crawford SW, Schwartz DA, Petersen FB et al. Mechanical ventilation after bone marrow transplantation. Risk and clinical outcome. American review of respiratory disease 1988;137:682-687.
8. Abraham RB, Toren A, Ono N et al. Predictors of outcome in the pediatric intensive care units of children with malignancies. Journal of pediatric hematology/oncology 2002;1:23-26.
9. Kache S, Weiss IK, Moore TB. Changing outcome for children requiring intensive care following hematopoi-etic stem cell transplantation. Pediatric transplantation 2006;10:299-303.
10. Gonzalez-Vincent M, Marin C, Madero L et al. Risk score for pediatric intensive care unit admission in chil-dren undregoing hematopoietic stem cell transplantation and analysis of predictive factors for survival. Jour-nal of pediatric hematology-oncology 2005;27(10):526-531.
11. Tamburro RF, Raymond CB. Changes in outcome (1996-2004) for pediatric oncology and hematopoietic stem cell transplantat patients requiring inavsive mechanical ventilation. Pediatric Critical Care Medicine 2008;9,3:270-277. 12. Owens C, Mannion D, O’Marcaigh A et al. Indications for admission, treatment and improved outcome of pediatric
haematology/oncology patients admitted to a tertiary paediatric ICU. Irish Journal of medical science 2011;180: 85-89. 13. Warwick AB, Mertens AC, Ou Shu X et al. Outcome following mechanical ventilation in children undergoing bone
marrow transplantation. Bone Marrow Transplantation 1998;22:787-794.
14. Pancera CF, Hayashi M, Fregnani JH et al. Noninvasive ventilation in Immunocompromised pediatric patients: eight years of experience in a pediatric oncology intensive care unit. Journal of pediatric hematlogy-oncology 2008;30,7:533-537.
15. Ewig S, Torres A, Riquelme R et al. Pulmonary complications in patients with haematological malignancies treated at a respiratory ICU. European respiratory journal 1998;12:116-122.
16. Diaz M A, Vicent M G, Prudencio M et al. Predicting factors for admission to an intensive care unit and clinical out-come in pediatric patients receiving hematopoietic stem cell transplantation. Haematologica 2002;87:292-298. 17. Diaz de Heredia C, Moreno A, Olive T et al. Role of the intensive care unit in children undergoing bone marrow
trans-plantation with life-threatening complications. Bone marrow transtrans-plantation 1999;24:163-168.
18. Burdach S, van Kaick B, Laws HJ et al. Allogenic and autologous stem-cell transplantation in advanced Ewing tumors. Annals of oncology 2000;11:1451-1462.
19. Di Carlo JV, Alexander SR, Agarwal R et al. Continuous veno-venous hemofiltration may improve survival from acute respiratory distress syndrome after bone marrow transplantation or chemiotherapy. Journal pediat-ric hematology oncology 2003;25(10):801-805.
20. Hagen SA, Craig DM, Martin PL et al. Mechanically ventilated pediatric stem cell transplant recipients: effect of cord blood transplant and organ dysfunction on outcome. Pediatric critic care medicine 2003;4(2):206-213.
21. Gruson D, Vargas F, Hilbert G et al. Predictive factors of intensive care unit admission in patients with haematologcal malignancies and pneumonia. Intensive care medicine 2004;30:965-971.
22. Hallahan AR, Shaw PJ, Rowell G et al. Improved outcomes of children with malignancy admitted to a pediat-ric intensive care unit. Pediatpediat-ric critical care 2000;28(11):3718-3721.
23. van Veen A, Karstens A, van der Hoek ACJ et al. The prognosis of oncologic patients in the pediatric inten-sive care unit. Inteninten-sive care Medicine 1996;22:237-241.
24. Sivan Y, Scwartz PH, Schonfeld T et al. Outcome og oncology patients in the pediatric intensive care unit. Intensive care medicine 1991;17:11-15.
25. Goodman DM, Wilde RA, Green TP. Oncology patients in the pediatric intensive care unit: room for opti-mism? Critical care medicine 2000;28(11):3768-3769.
26. Bonig H, Schneider DT, Sprock I et al. Sepsis and multi-organ failure: predictors of poor outcome after hematopoietic stem cell transplantation in children. Bone marrow transplantation 2000;25(2):S32-S34.
27. Hayes C, Lush RJ, Cornish JM et al. The outcome of children requiring admission to an intensive care unti following bone marrow transplantation. British Journal of haematology 1998;102:666-670.
28. Villa F, Coppadoro A, Bellani G et al. Etiology of respiratory failure is related to mortality in crtically ill patients af-fected by a hematological malignancy: a retrospective study. Minerva anestesiologica 2010;76:7-12.
29. Keenan HT, Bratton SL, Martin LD et al. Outcome of children who require mechanical ventilatory support after bone marrow transplantation. Pediatric critical care 2000;28(3):830-835.
30. Bojko T, Notterman DA, Greenwald BM et al. Acute hypoxemic respiratory failure in children following bone marrow transplantation: an outcome and pathologic study. Peditric critical care 1995;23(4):755-759.
31. Ho VT, Weller E, Lee SF et al. Prognostic facotrs for early severe pulmonary complications after hematopoietic stem cell transplantation. Biology of blood and marrow transplantation 2001;7:223-229.
32. Wickiser JE, Thompson M, Leavey PJ et al. Extracorporeal membrane oxygenation(ECMO) initiation without intuba-tion in two children with mediastinal malignancy. Pediatric blood cancer 2007;49:751-754.
33. Frey TKE, Chopra A, Lin RJ et al. A child with anterior mediastinal mass supported with veno-arterial extracorpeal membrane oxygenation. Pediatric critical care medicine 2006;7(5):479-481.
34. Gow KW, Wulkan ML, Heiss KF et al. Extracorporeal membrane oxygenation for support of children after hematopoietic stem cell transplantation: the extracorporeal life support organization experience. Journal of pediatric surgery 2006;41:662-667. 35. Lindén V, Karlén J, Olsson M et al. Successful extracorporeal membrane oxygenation in four children with malignant
disease and severe Pneumocystis carinii pneumonia. Medical and pediatric oncology 1999;32:25-31.
36. Squadrone V, Massaia M, Bruno B et al. Early CPAP prevents evolution of acute lung injury in patients with hemato-logic malignancy. Intensive care medicine 2010;36:1666-1674.
37. Hilbert G, Gruson D, Vargas F et al. Noninvasive continuous positive airway pressure in neutropenic patients with acute respiratory failure requiring intensive care unit admission. Criticak care medicine 2000;28:3185-3190.
38. Delclaux C, L’Her E, Albert C et al. Treatment of acute hypoxemic non hypercapnic respiratory insufficiency with continuous positive airway pressure delivered by a face mask: a randomized controlled trial. JAMA 2000;284:2352-2360.
39. Depuydt PO, Benoit DD, Vandewoude KH et al. Outcome in noninvasively ventilated hematologic patients with acute respiratory failure. Chest 2004;126(4):1299-1306.
40. Depuydt PO, Benoit DD, Roosens CD et al. The impact of initial ventilatory strategy on survival in hematological pa-tients with acute hypoxemic respiratory failure. Journal of critical care 2010;25:30-36.
41. Antonelli M, Conti G, Bufi M et al. Noninvasive ventilation for treatment of acute respiratory failure in pa-tients undergoing solid organ transplantation. JAMA 2000;283:235-241.
42. Martin TJ, Hovis JD, Costantino JP et al. A randomized, prospective evaluation of noninvasive ventilation for acute respiratory failure. American journal of respiratory and critical care medicine 2000;161:807-813.
43. Piastra M, De Luca D, Pietrini D et al. Noninvasive pressure-support ventilation in immunocompromised children with ARDS: a feasibility study. Intensive Care Medicine 2009;35:1420-1427.
44. Cogliati AA, Conti G, Tritapepe L et al. Noninvasive ventilation in the treatment of acute respiratory failure induced by all-trans retinoic acid (retinoic acid syndrome) in children with acute promyelocytic leukemia. Pediatric critical care medicine 2002;1:3. 45. Essouri S, Chevret L, Durand P et al. Noninvasive positive pressure ventilation: five years of experience in a
pediatric intensive care unit. Pediatric critical care 2006;7(4):329-334.
46. Conti G, Marino P, Cogliati A et al. Noninvasive ventilation for the treatment of acute respiratory failure in patients with hematological malignancies: a pilot study. Intensive care medicine 1998;24:1283-1288.
47. Fortenberry JD, Del Toro J, Jefferson LS et al. Management of pediatric acute hypoxemic respiratory insufficiency with bilevel positive pressure (BiPAP) nasal mask ventilation. Chest 1995;108:1059-1064.
48. Padman R, Lawless ST, Kettrick RG. Noninvasive ventilation via bilevel positive airway pressure support in pediatric practice. Critical care medicine 1998;26:169-173.
49. Piastra M, De Luca D, Pietrini et al. Noninvasive pressure-support ventilation in immunocompromsied children with ARDS : a feasibility study. Intensive care medicine 2009;35:1420-1427.
50. Bach PB, Schrag D, Nierman DM et al. Identification of poor prognostic features among patients requiring mechanical ventilation after hematopoietic stem cell transplantation. Blood 2001;98,12:3234-3240.
51. Todd K, Wiley F, Landaw E et al. Survival outcome among 54 intubated pediatric bone marrow transplant patients. Critical care medicine 1994;22,1:171-176.
52. Rossi R, Shermie SD, Calderwood S. Prognosis of pediatric bone marrow transplant recipients requiring me-chanical ventilation. Critical care medicine 1999;27:1181-1186.
53. Jacobe SJ, Hassan A, Veys P et al. Outcome of children requiring admission to an intensive care unit after bone marrow transplantation. Critical care medicine 2003;31:1299-1305.
54. Denardo SJ, Oye RK, Bellamy PE. Efficacy of intensive care for bone marrow transplant patients with respira-tory failure. Critical care medicine 1989;17:4-6.
55. Nichols DG, Walker LK, Wingard JR et al. Predictors of acute respiratory failure after bone marrow trans-plantation in children. Critical care medicine 1994;22:1485-1491.
56. Randle CJ, Frankel LR, Amylon MD. Identifying early predictors of mortality in pediatric patients with acute leukemia and pneumonia. Chest 1996;109:457-461.